Genetska serija primerov nekovin. Genetski odnos med razredi snovi - hipermarket znanja
Obstaja genetska povezava med enostavnimi snovmi, oksidi, bazami, kislinami in solmi, in sicer možnostjo njihovega medsebojnega prehoda (transformacije).
Na primer, preprosta snov - kalcij kot posledica interakcije s kisikom se spremeni v oksid: 2Ca + O2 = 2CaO.
Kalcijev oksid pri medsebojnem delovanju z vodo tvori kalcijev hidroksid CaO + H 2 O = Ca (OH) 2, slednji pa pri medsebojnem delovanju s kislino postane sol: Ca (OH) 2 + H2SO4 = CaSO4 + 2H2O.
Te transformacije lahko predstavimo s shemo:
Ca → CaO → Ca (OH) 2 → CaSO 4
Podobna shema je lahko napisana za nekovinske, na primer žveplo:
S → SO 3 → H 2 SO 4 → CaSO 4
Torej se ista sol dobi na različne načine.
Možen je tudi obratni prehod iz soli v druge razrede anorganskih spojin in enostavnih snovi:
CuSO 4 → Cu (OH) 2 → CuO → Cu
CuS04 + 2NaOH = Cu (OH) 2 + Na2S04
Cu (OH) 2 = CuO + H20
CuO + H 2 = Cu + H 2 O (redukcija bakra)
Podoben odnos med razredi anorganskih spojin, ki temelji na proizvodnji snovi enega razreda iz snovi drugega, se imenuje genetski.
Lastnosti kompleksnih spojin se odražajo v genetski shemi glavnih razredov anorganskih spojin (glej sliko). Odraža faze razvoja anorganske snovi na dveh glavnih linijah, od značilnih kovin do značilnih nekovin z nasprotnimi lastnostmi.
Kovine, katerih kemična lastnost atoma je sposobnost darovati elektrone in ne-kovine, katerih glavno kemijsko lastnost je sposobnost njihovih atomov, da vežejo elektrone nasproti drugam v lastnostih. Z zapletom sestave snovi se te nasprotne tendence še vedno pojavljajo.
Značilne kovine in prehodni elementi v najnižjem oksidacijskem stanju tvorijo osnovne okside, medtem ko tipični nekovine in prehodni elementi v visokem oksidacijskem stanju tvorijo nasprotne kislinske okside.
Enostavne snovi
Amphoteric
Nekovine
Osnovni oksidi
Amphoteric
Kisla
Razlogi
Amphoteric
hidroksidov
Genetska shema glavnih razredov anorganskih spojin
Z nadaljnjim zapletom sestave snovi nastanejo hidroksidi, bazični oksidi, ki ustrezajo bazo, in kislinske okside, ki ustrezajo kislini. Podlage, ki so nasproti lastnosti in kislina, aktivno reagirajo med seboj in tvorijo soli. Interakcija nasprotij je gonilna sila reakcije. Zato osnovni in kisli oksidi, baze in kisline aktivno medsebojno delujejo in dva kisla oksida ali dva bazična oksida nista v medsebojnem vplivu, ker so njihove lastnosti blizu.
Tako se lastnosti kompleksne spojine določijo na podlagi lastnosti sestavnih elementov. Glavni zakoni sprememb teh lastnosti so povzeti v naslednjih aplikacijah (tabela 6).
1. V obdobjih s povečanjem zaporedne številke se lastnosti elementov spremenijo iz kovinske v nemetalne. Število elektronov na zunanji ravni se povečuje, stopnja oksidacije elementa se povečuje, polmer atoma in iona se zmanjšuje, ionizacijska energija in afiniteta za elektron naraščata. V skladu s tem se osnovna znižanja in kisle lastnosti oksidov in hidroksidov povečajo.
2. V glavnih podskupinah se osnovne lastnosti oksidov in hidroksidov povečajo z naraščajočim atomskim številom. Za elemente stranskih skupin s povečanjem zaporedne številke je značilna bolj kompleksna sprememba lastnosti. Prvič, kovinske lastnosti se povečajo in nato zmanjšajo.
3. Aktivne kovine ustrezajo oksidom in hidroksidom z močno izraženimi osnovnimi lastnostmi. Najbolj aktivne kovine so alkalijske in zemeljsko alkalne. Oblikujejo vodotopne okside in močne topne baze - alkalije.
4. Nizkoaktivne kovine (vse razen alkalne in zemeljsko alkalne) tvorijo šibke baze, ki jih je težko raztopiti v vodi: \\ t
Cu (OH) 2, Fe (OH) 3.
5. Oksidi in hidroksidi z močno izraženimi kislinskimi lastnostmi ustrezajo aktivnim nekovinam.
6. Amfoterne kovine tvorijo amfoterne okside in hidrokside.
7. Če ima element različne stopnje oksidacije, potem mu ustrezajo oksidi in hidroksidi z različnimi lastnostmi.
Tema: GENETSKA POVEZAVA MED kovinami in nekovinami in njihovimi spojinami. 9. razred
Cilji: izobraževalni: utrditi koncept "genetske serije", "genetske povezave"; naučiti, kako izdelati genetske serije elementov (kovine in nekovine), sestaviti reakcijske enačbe, ki ustrezajo genetski seriji; preverite, kako se znanje uči kemijske lastnosti oksidi, kisline, soli, baze, razvoj: razviti sposobnost analiziranja, primerjanja, povzemanja in sklepanja, sestaviti enačbe kemijskih reakcij; izobraževalni: spodbujati oblikovanje znanstvenega pogleda na svet.
Zagotavljanje razredov: tabele "Periodni sistem", "Tabela topnosti", "Serija aktivnosti kovin", navodila za študente, naloge za testiranje znanja.
Napredek: 1) Org. trenutek
2) Preverite d / s
3) Študija novega materiala
4) Pritrditev
5) D / C
1) Org. trenutek. Lep pozdrav
2) Preverite d / s.
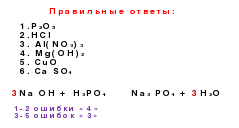
Genetske povezave so povezave med različnimi razredi na podlagi njihovih konverzij.
Ker poznamo razrede anorganskih snovi, je možno sestaviti genetske serije kovin in nekovin. Osnova teh serij je isti element.
Med kovinami obstajata dve vrsti vrstic:
1
. Genetska serija, v kateri alkalija deluje kot osnova. Ta serija je lahko predstavljena z naslednjimi transformacijami:kovinski → bazični oksid → alkalijski → sol
Na primer, K → K
2 O → KOH → KCl2
. Genetska serija, kjer je baza netopna baza, lahko nato predstavimo kot verigo transformacij:kovina → osnovni oksid → sol → netopna baza →
→osnovni oksid → kovina
Na primer Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu
1
. Genetska serija nekovin, kjer topna kislina deluje kot vez v seriji. Verigo transformacij lahko predstavimo na naslednji način:nekovinski → kislinski oksid → topna kislina → sol
Na primer, P → P
2 O 5 → H 3 PO 4 → Na 3 PO 42
. Genetska serija nekovin, kjer netopna kislina deluje kot povezava v seriji:nekovinski → kislinski oksid → sol → kislina →
→kislinski oksid → nekovinski
Na primer
Si→ Sio 2 → Na 2 Sio 3 → H 2 Sio 3 → Sio 2 → Si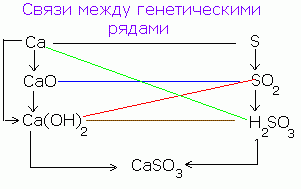
Frontalni pogovor o:
Kaj je genetska povezava? Genetske povezave so povezave med različnimi razredi, ki temeljijo na njihovih interkonverzijah.
Genetska serija - vrsta snovi - predstavniki različnih razredov, ki so spojine enega kemičnega elementa, povezane z medsebojnimi konverzijami in ki odražajo transformacije teh snovi. Osnova teh serij je isti element.
Katere vrste genetskih serij je mogoče razlikovati Med kovinami lahko ločimo dve vrsti serij:
a) Genetska serija, v kateri alkalija deluje kot osnova. Ta serija je lahko predstavljena z naslednjimi transformacijami:
kovinski → bazični oksid → alkalijski → sol
na primer genetska serija kalija K → K
2 O → KOH → KClb) Genetska serija, kjer je baza netopna baza, lahko serijo predstavimo kot verigo transformacij:
kovina → osnovni oksid → sol → netopna baza → osnovni oksid → kovina
na primer: Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → CuMed nekovinami je mogoče ločiti tudi dve vrsti vrstic:
a) Genetska serija nekovin, kjer topna kislina deluje kot vez v seriji. Verigo transformacij lahko predstavimo na naslednji način: nekovinska → kislina oksid → topna kislina → sol.
Na primer: P → P
2 O 5 → H 3 PO 4 → Na 3 PO 4b) Genetska vrsta nekovin, kjer je netopna kislina: nekovinski → kislinski oksid → sol → kislina → kislinski oksid → nekovinski del.
Na primer: Si → SiO
2 → Na 2 Sio 3 → H 2 Sio 3 → SiO 2 → SiIzvajanje nalog za možnosti:
1. V svoji različici izberite oksidne formule, pojasnite svojo izbiro na podlagi poznavanja lastnosti sestave tega razreda spojin. Pokličite jih.
2. V stolpcu s formulami v različici poiščite formule za kislino in razložite svojo izbiro na podlagi analize sestave teh spojin.
3. Določite valence kislih ostankov v kislinski sestavi.
4. Izberite soli in jih poimenujte.
5. Pripravite formule soli, ki se lahko tvorijo z magnezijem in kislinami v vaši varianti. Zapišite jih, ime.
6. V stolpcu s formulami svoje različice poiščite osnovne formule in razložite svojo izbiro na podlagi analize sestave teh spojin.
7. V svoji različici izberite formule snovi, s katerimi lahko reagira raztopina ortofosforne kisline (klorovodikova, žveplova). Naredite ustrezne reakcijske enačbe.
9. Med formulami vaše možnosti izberite formule snovi, ki lahko medsebojno delujejo. Naredite ustrezne reakcijske enačbe.
10. Naredite verigo genetskih vezi anorganskih spojin, ki bodo vsebovale snov, katere formula je navedena v vaši različici pod številko ena.
Možnost 1
Možnost 2. \\ T
Cao
Hno
3Fe (OH)
3N
2 OZn (NO
3 ) 2Cr (OH)
3H
2 SO 3H
2 SPbo
LiOH
Ag
3 PO 4P
2 O 5NaOH
Zno
CO
2BaCl
2HCl
H
2 CO 3H
2 SO 4Cuso
4Iz teh snovi naredimo genetsko linijo z uporabo vseh formul. Napišite reakcijske enačbe, s katerimi lahko dosežemo to verigo transformacij:
I možnost: ZnSO
4, Zn, ZnO, Zn, Zn (OH) 2 : II možnost:Na 2 SO 4, NaOH, Na, Na 2 O 2 , Na 2 O4) Pritrditev1.
Al→ Al 2 O 3 → AlCl 3 → Al( OH) 3 → Al 2 O 32.
P→ P 2 O 5 → H 3 PO 4 → Na 3 PO 4 → Ca 3 ( PO 4 ) 23. Zn → ZnCl
2 → Zn (OH) 2 → ZnO → Zn (NO 3 ) 24. Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu5.N
2 O 5 → HNO 3 → Fe (NO 3 ) 2 → Fe (OH) 2 → FeS → FeSO 45) Domača naloga:
načrtovati postopen prehod iz kalcija v kalcijev karbonat in pripraviti poročilo o uporabi kakršne koli soli v medicini (z uporabo dodatne literature).

Med kovinami je mogoče razlikovati med dvema vrstama vrst: 1. Genetske serije, v katerih alkalija deluje kot osnova. Ta serija je lahko predstavljena z naslednjimi transformacijami: metal - osnovni oksid - alkalijska sol, na primer genetska serija kalija K - K 2 O - KOH - KCl.

2. Genetska serija, kjer netopna baza deluje kot osnova, lahko serijo predstavimo kot verigo transformacij: kovina - bazični oksid - sol netopna baza - bazični oksid - kovina. Cu-- CuO - CuCl 2 - Cu (OH) 2 - CuO -\u003e Cu genetske serije bakra "\u003e Cu je genetska serija bakra"\u003e "title =" (! LANG: 2. Genetska serija, kjer je baza netopna baza, nato pa lahko serijo predstavimo kot verigo transformacij: kovinsko - bazični oksid - sol netopna baza. glavni oksid je kovina Cu - CuO - CuCl 2 - Cu (OH) 2 - CuO -\u003e"> title="2. Genetska serija, kjer netopna baza deluje kot osnova, lahko serijo predstavimo kot verigo transformacij: kovina - bazični oksid - sol netopna baza - bazični oksid - kovina. Cu - CuO - CuCl 2 - Cu (OH) 2 - CuO -\u003e"> !}
Med nekovinami je mogoče razlikovati tudi dve vrsti vrstic: 1. Genetska serija nekovin, kjer topna kislina deluje kot vez v seriji. Verigo transformacij lahko predstavimo na naslednji način: kislo-kislinsko-kislinsko topna kislina -sol. P - P 2 O 5 - H 3 PO 4 - Na 3 PO 4. Fosforjev genetski razpon

Med skupinami anorganskih spojin obstaja genetska povezava. Od preprostih snovi lahko dobite kompleksno in obratno. Od spojin enega razreda lahko dobite spojine drugega razreda.
Poenostavljeno genetsko razmerje med razredi anorganskih spojin lahko predstavimo z naslednjo shemo:
Zaporedje takšnih transformacij za nekovine lahko predstavimo z naslednjo shemo: CANPO 4
Р → Р 2 О 5 → Н 3 РО 4 → Са 3 (РО 4) 2
(Saon) 3 PO 4
Za značilne kovine lahko naredite naslednjo verigo transformacij:
Ba → BaO → Ba (OH) 2 → BaSO 4
Za kovine, katerih oksidi in hidroksidi so amfoterni (polimetali), se lahko izvedejo naslednje transformacije:
Al → Al 2 O 3 → Al (OH) 3 → Na → AlCl 3 → AlOHCl 2 → Al (OH) 3 → Al 2 O 3.
Povezave med razredi:
1. Kovine, nekovine→ sol.
Z neposredno interakcijo kovin in nekovin se tvorijo soli kisikovih kislin (halogenidi, sulfidi):
2Na + C1 2 = 2NaCl
Te spojine so stabilne in se pri segrevanju ne razpadejo.
2. Osnovni oksidi, kisli oksidi→ sol.
CaO + CO 2 = CaCO 3;
Na2O + SO3 = Na2S04.
3. Baze, kisline→ sol.
Izvaja se z reakcijo nevtralizacije:
2NaOH + H2SO4 = Na2S04 + 2H2O,
HE - + H + - H20;
Mg (OH) 2 + 2HC1 = MgCl2 + 2H2O,
Mg (OH) 2 + 2H + → Mg2 + + 2H2O.
4. Kovine→ osnovne okside.
Večina kovin sodeluje s kisikom in tvori okside:
2Ca + O2 = 2CaO;
4A1 + 3O 2 = 2A1 2 O 3.
Zlato, srebro, platina in druge plemenite kovine ne vplivajo na kisik, oksidi takih kovin se pridobijo posredno.
5. Nekovine→ kislinskih oksidov.
Nekovine (razen halogenov in žlahtnih plinov) medsebojno delujejo s kisikom in tvorijo okside:
4P + 5O2 = 2P205;
S + O2 = SO2.
6. Osnovni oksidi→ razlogov.
Neposredna interakcija z vodo se lahko doseže le s hidroksidi alkalijskih in zemeljskoalkalijskih kovin (alkalijami):
Na20 + H20 = 2NaOH;
CaO + H 2 O = Ca (OH) 2.
Preostali razlogi so pridobljeni posredno.
7. Kislinski oksidi→ kisline.
Kislinski oksidi reagirajo z vodo, da nastanejo ustrezne kisline:
SO3 + H20 = H2SO4;
R 2 O 5 + 3H 2 O = 2H 3 PO 4.
Izjema je SiO 2, ki ne reagira z vodo.
8. Baze, kisli oksidi→ sol.
Alkalije medsebojno delujejo s kislimi oksidi, da tvorijo soli:
2NaOH + SO3 = Na2S04 + H20,
2OH - + SO3 = SO4 2- + H20;
Ca (OH) 2 + SO 2 = CaCO 3 Н + N 2 O,
Ca 2+ + 2OH - + CO 2 → CaCO 3 + H 2 O.
9. Kisline, bazični oksidi→ sol.
Kovinski oksidi se raztopijo v kislinah in tvorijo soli:
CuO + H2SO4 = CuS04 + H20,
CuO + 2H + = Cu2 + + H20;
Na2O + 2HS1 = 2NaCl + H20,
Na2O + 2H + = 2Na + + H20.
10. Razlogi→ osnovne okside.
Netopne baze in LiOH pri segrevanju razpadejo: \\ t
2LiOH = Li20 + H20;
Cu (OH) 2 = CuO + H20.
11. Kisline→ kislinskih oksidov.
Nestabilne kisline, ki vsebujejo kisik, razpadejo pri segrevanju (H 2 SiO 3) in celo brez segrevanja (H 2 CO 3, HClO). Hkrati so številne kisline odporne na segrevanje (H 2 SO 4, H 3 PO 4).
H2S03 = H20 + Si02;
H 2 CO 3 = H 2 O + CO 2.
12. Kovinski oksidi→ kovin.
Nekateri težki kovinski oksidi se lahko razgradijo na kovino in kisik:
2HgO = 2Hg + O2.
Tudi kovine se pridobivajo iz ustreznih oksidov s pomočjo redukcijskih sredstev:
3MnO2 + 4Al = 3Mn + 2Al203;
Fe2O3 + 3H2 = 2Fe + 3H2O.
13. Kislinski oksidi→ nekovine
Večina nekovinskih oksidov se pri segrevanju ne razgradi. Nekovinski in kisik razgradi le nekaj nestabilnih oksidov (halogen oksidi).
Nekatere nekovine dobimo z redukcijo iz ustreznih oksidov:
SiO2 + 2Mg = 2MgO + Si.
14. Soli, baze → baze.
Netopne baze dobimo z delovanjem alkalij na raztopine ustreznih kislin:
CuSO 4 + 2NaOH = Cu (OH) 2 + Na2S04,
Cu 2+ + 2OH - → Cu (OH) 2 ↓;
FeCl2 + 2KOH = Fe (OH) 2 2 + 2KCl,
Fe2 + + 2OH - = Fe (OH) 2 '.
15. Soli, kisline → kisline.
Topne soli reagirajo s kislinami (v skladu s serijo pritiskov), če je rezultat šibkejša ali hlapna kislina:
Na2Si03 + 2HCl = 2NaCl + H2SiO3,
Si02, 2 + 2H + → H 2 SiO 3;
NaCl (s) + H2SO4 (k) = NaHS04 + HCl.
16. Soli→ bazični oksidi, kisli oksidi.
Soli nekaterih kislin, ki vsebujejo kisik (nitrati, karbonati), se pri segrevanju razgradijo: \\ t
CaCO3 = CaO + CO 2;
2Cu (NO3) 2 = 2CuO + 4NO2 + O2.
VAJE ZA NEODVISNO DELO NA TEMO »GENETIČNA POVEZAVA MED RAZREDI ANORGANSKIH SPOJIN«
1. Navedite spodaj navedene snovi, razporedite jih v razrede anorganskih spojin: Na 3 PO 4, H 2 SiO 3, NO, B 2 O 3, MgS, BaI 2, Ca (OH) 2, KNO 3, HNO 2, Cl 2 O7, Fe (OH) 2, P205, HF, Mn02.
2. Od spodaj navedenih snovi je mogoče dobiti hidroksid (kislino ali bazo) v eni fazi: baker, železov oksid (P), barijev oksid, dušikov oksid (P), dušikov oksid (V), silicijev oksid, bakrov sulfat, kalijev klorid. kalija, magnezijevega karbonata.
3. Na zgornjem seznamu navedite formule za snovi, povezane z: 1) oksidi; 2) razlogi; 3) kisline; 4) soli:
C02, NaOH, HCl, SO3, CuS04, NaN03, KCl, H2S04, Ca (OH) 2, P205, HNO3, Al (OH) 3.
4. Navedite snovi: Zn (OH) 2, MgO, P 2 O 3, NaHCO 3, H 3 PO 3, Fe 2 (SO 4) 3, KOH, (AlOH) 3 (PO 4) 2, Ba (MnO 4). ) 2, CO, HI. Navedite, v kateri razred spada posamezna snov.
5. Napišite molekulske formule naslednjih snovi in navedite, v kateri razred spada posamezna snov:
1) bakrov (II) hidroksokarbonat;
2) dušikov oksid (V);
3) nikelj (II) hidroksid;
4) barijev hidrogenfosfat;
5) perklorna kislina;
6) krom (III) hidroksid;
7) kalijev klorat;
8) vodikovega sulfidne kisline;
9) natrijev cinkat.
6. Navedite primere reakcij povezave med:
1) preproste snovi - nekovine;
2) preprosta snov in oksid;
3) oksidi;
4) kompleksne snovi, ki niso oksidi;
5) kovine in nekovine;
6) tri snovi.
7. Katera od naslednjih snovi lahko reagira: \\ t
1) ogljikov monoksid (IV): HCl, O2, N02, KOH, H20;
2) magnezijev oksid: Ba (OH) 2, HCl, C02, 02, HNO3;
3) železov (II) hidroksid: KCl, HCl, KOH, 02, H20, HNO3;
4) klorovodik: Zn, MgO, ZnCl2, HN03, Ca (OH) 2, Cu, (ZnOH) Cl.
8. Ali je možna interakcija med naslednjimi snovmi?
1) ogljikov monoksid (IV) in kalijev hidroksid;
2) kalijev hidrosulfat in kalcijev hidroksid;
3) kalcijev fosfat in žveplova kislina;
4) kalcijev hidroksid in žveplov oksid (IV);
5) žveplova kislina in kalijev hidroksid;
6) kalcijev bikarbonat in fosforjeva kislina;
7) silicijev dioksid in žveplova kislina;
8) cinkov oksid in fosforjev oksid (V).
Napišite enačbe možnih reakcij, določite pogoje, v katerih se pojavijo. Če lahko reakcije privedejo do različnih snovi, navedite, kakšna je razlika v pogojih za njihovo izvajanje.
9. Podajte enačbe reakcij za pridobitev naslednjih snovi: natrijev ortofosfat (4 načine), kalijev sulfat (7 načinov), cinkov hidroksid.
10. Ena od metod za proizvodnjo sode (natrijevega karbonata) je delovanje vode in ogljikovega monoksida (IV) na natrijev aluminat. Dopolnite enačbe reakcij.
11. Ko spreminja koeficiente, napišite reakcijske produkte:
1) MgO + 2H2SO4 →
2) 2SO 2 + Ba (OH) 2 →
3) 3N2O5 + 2Al (OH) 3 →
4) P 2 O 5 + 4 NaOH →
5) P 2 O 5 + 6 NaOH →
6) P 2 O 5 + 2 NaOH →
12. Naredite enačbe reakcij za sprejemanje različnih vrst soli:
1) SO 2 + Ba (OH) 2 → (srednje in kisle soli),
2) A1 2 O 3 + H 2 O + HNO 3 → (srednja sol, bazične soli),
3) Na 2 O + H 2 S → (srednje in kisle soli),
4) SO 3 + Sa (OH) 2 → (srednje in bazične soli),
5) CaO + H 2 O + P 2 O 5 → (bazična sol, kisle soli).
13. Izpolnite reakcijske enačbe:
CaO + A1 2 O 3 → CaHPO 4 + Ca (OH) 2 →
Cr 2 O 3 + H 2 SO 4 → AlOHSO 4 + NaOH →
Cr 2 O 3 + NaOH → CaCO 3 + CO 2 + H 2 O →
A1203 + HClO4 → Ca (HCO3) 2 + HCl →
Mn 2 O 7 + KOH → ZnS + H2S →
NO 2 + Ca (OH) 2 → CaSO 4 + H 2 SO 4 →
Zn (OH) 2 + NaOH → (ZnOH) Cl + HCl →
Zn (OH) 2 + HNO 3 → Bi (OH) 3 + H 2 SO 4 (nezadosten) →
AlCl3 + NaOH (pomanjkljivo) → (FeOH) Cl + NaHS →
AlCl 3 + NaOH → Na 2 ZnO 2 + H 2 SO 4 (presežek) →
AlC1 3 + NaOH (presežek.) → Ca (AlO2) 2 + HCl (presežek) →
14. Zapišite enačbe reakcij, s katerimi lahko izvedete naslednje transformacije:
1) Cu → CuO → CuSO 4 → Cu (OH) 2 → CuC1 2 → Cu (NO 3) 2
2) Zn → ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → ZnCl 2
3) Р → Р 2 O 5 → Н 3 РО 4 → К 3 РО 4 → Са 3 (РО 4) 2 → N 3 РО 4
4) Mg → MgO → MgCl2 → Mg (OH) 2 → Mg (HSO 4) 2 → MgS04
5) Ca → CaO → Ca (OH) 2 → CaCO 3 → Ca (HCO 3) 2 → CO 2
6) Cr → Cr 2 (SO 4) 3 → Cr (OH) 3 → NaSrO 2 → Cr 2 O 3 → K
7) P → P 2 O 5 → HPO 3 → H 3 PO 4 → NaH 2 PO 4 → Na 3 PO 4
8) CuS → CuO → CuSO4 → Cu (OH) 2 → CuO → Cu
9) Al → Al 2 O 3 → Al 2 (SO 4) 3 → Al (HSO 4) 3 → Al (OH) 3 → K
10) S → SO2 → SO3 → NaHS04 → Na2S04 → BaSO4
11) Zn → ZnO → ZnCl2 → Zn → Na2
12) Zn → ZnSO 4 → ZnCl 2 → Zn (OH) 2 → Na 2 → Zn (NO 3) 2
13) Ca → CaCl 2 → CaCO 3 → Ca (HCO 3) 2 → Ca (NO 3) 2
14) Ca → Ca (OH) 2 → CaCO 3 → CaCl 2 → CaCO 3 → Ca (NO 3) 2
15) CuO → CuCl 2 → Cu (NO 3) 2 → CuO → CuSO 4 → Cu
16) CaO → Ca (OH) 2 → Ca (NO 3) 2 → Ca (NO 2) 2 → HNO 2 → NaNO 2
17) MgO → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
18) SO2 → H2SO3 → KHS03 → K2SO3 → KHS03 → SO2
19) P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2 → Ca (H 2 PO 4) 2 → CaHPO 4
20) CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
21) PbO → Pb (NO 3) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbCl 2
22) ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2 → K 2
23) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → Al (OH) 3 → K
24) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → Zn → ZnO → Zn (NO 3) 2
25) AlCl 3 → Al (NO 3) 3 → Al (OH) 3 → NaAlO 2 → A1C1 3 → Al
26) Pb (NO 3) 2 → Pb (OH) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbSO 4
27) Fe 2 (SO 4) 3 → FeCl 3 → Fe (OH) 3 → FeOH (NO 3) 2 → Fe (NO 3) 3 → Fe 2 O 3
28) K → KOH → KHSO 4 → K 2 SO 4 → KCl → KNO 3
29) Cu (OH) 2 → CuOHNO 3 → Cu (NO 3) 2 → CuSO 4 → CuCl 2 → Cu (NO 3) 2
30) CaCl 2 → Ca → Ca (OH) 2 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
31) Cu → Cu (NO 3) 2 → Cu (OH) 2 → CuSO 4 → Al 2 (SO 4) 3 → A1C1 3
32) Mg → MgS04 → MgCl2 → MgOHCl → Mg (OH) 2 → MgOHNO3
33) CuSO 4 → CuCl 2 → ZnCl 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2
34) Hg (NO 3) 2 → Al (NO 3) 3 → Al 2 O 3 → NaAlO 2 → Al (OH) 3 → AlOHCl 2
35) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → AlCl 3 → Al (OH) 3 → A1 2 O 3
36) CuCl 2 → Cu (OH) 2 → CuSO 4 → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2
37) Fe (NO 3) 3 → FeOH (NO 3) 2 → Fe (OH) 3 → FeCl 3 → Fe (NO 3) 3 → Fe
38) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → NaNO 3 → HNO 3
39) Mg (OH) 2 → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
40) aluminijev sulfat → aluminijev klorid → aluminijev nitrat → aluminijev oksid → kalijev aluminat → aluminijev hidroksid → aluminijev hidroksid → aluminijev klorid.
41) Na → NaOH → Na 3 PO 4 → NaNO 3 → HNO 3 → N 2 O 5
42) BaCO 3 → Ba (HCO 3) 2 → BaCO 3 → (BaOH) 2 CO 3 → BaO → BaSO 4
43) Cu → CuSO 4 → (CuOH) 2 SO 4 → Cu (OH) 2 → Cu (HSO 4) 2 → CuSO 4
44) barijev → barijev hidroksid → barijev bikarbonat → barijev klorid → barijev karbonat → barijev klorid → barijev hidroksid
45) P → P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → CaHPO 4 → Ca 3 (PO 4) 2
46) Cr → CrO → Cr 2 O 3 → NaCrO 2 → CrCl 3 → Cr (OH) 3 → Cr 2 O 3 → Cr
47) Cr 2 O 3 → CrCl 3 → Cr (OH) 3 → Na 3 → Cr 2 (SO 4) 3 → CrCl 3
48) K → KOH → KCl → KOH → K 2 SO 4 → KNO 3 → KNO 2
49) S → FeS → H 2 S → SO 2 → S → ZnS → ZnO → ZnCl 2 → Zn (OH) 2 → K 2
50) C → CO 2 → CO → CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2
51) С → CO 2 → NaHCO 3 → Na 2 CO 3 → CO 2
52) S → SO 2 → K 2 SO 3 → KHSO 3 → K 2 SO 3
53) Cu → Cu (OH) 2 → Cu (NO 3) 2 → CuO → Cu
54) Р 2 O 5 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2
55) Fe → FeCl 2 → Fe (OH) 2 → FeSO 4 → Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (NO 3) 2 → ZnO
57) CuS → SO2 → KHSO 3 → CaSO 3 → SO 2
58) SO 2 → H 2 SO 4 → CuSO 4 → CuO → Cu (NO 3) 2
59) KHSO 3 → CaSO 3 → Ca (HSO 3) 2 → SO 2 → K 2 SO 4
60) SO2 → CaSO3 → SO2 → NaHS03 → SO2
61) NaHC03 → Na2C03 → NaCl → NaHS04 → Na2S04
62) K → KOH → KCl → KNO 3 → K 2 SO 4 → KCl
63) NaCl → Na → NaOH → Na2S04 → NaCl
64) Al → AlCl3 → Al (OH) 3 → A1203 → Al (OH) 3
65) CuO → Cu → CuCl2 → CuSO4 → CuS
66) Fe → FeSO 4 → Fe (OH) 2 → Fe → Fe (OH) 3
67) Fe → Fe (OH) 2 → FeCl 2 → Fe (NO 3) 2 → Fe
68) Fe (NO 3) 3 → Fe 2 O 3 → FeCl 3 → Fe (NO 3) 3 → Fe
69) CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
70) MgCO 3 → MgO → MgCl 2 → Mg (OH) 2 → Mg (NO 3) 2
71) Mg → Mg (OH) 2 → MgSO 4 → MgCO 3 → Mg (HCO 3) 2
72) CaO → Ca (OH) 2 → CaCl 2 → CaCO 3 → CO 2
73) CaCO 3 → Ca (HCO 3) 2 → CaCl 2 → Ca (NO 3) 2 → O 2
74) FeS → Fe 2 O 3 → Fe (OH) 3 → Fe 2 (SO 4) 3 → FeCl 3
75) KS1 → K 2 SO 4 → KOH → K 2 CO 3 → KOH
76) CuS → CuO → Cu (OH) 2 → CuSO 4 → Cu
77) Fe → Fe (OH) 3 → Fe (NO 3) 3 → FeCl 3 → Fe 2 (SO 4) 3
78) CuSO 4 → CuO → Cu (NO 3) 2 → CuO → CuS
79) ZnS → H 2 S → SO 2 → Na 2 SO 4 → NaOH
80) Al → Al (OH) 3 → A1 2 (SO 4) 3 → A1 2 O 3 → Al (OH) 3
81) CaCl 2 → CaCO 3 → Ca (HCO 3) 2 → CaCO 3 → CaSiO 3
82) S → ZnS → H 2 S → Ca (HSO 3) 2 → SO 2
83) Na2S04 → NaCl → HCl → CaCl2 → Ca (NO3) 2
84) Na2SO3 → SO2 → H2SO4 → HCl → FeCl2
85) С → Na 2 CO 3 → CaCO 3 → CaSiO 3 → H 2 SiO 3
86) P → P 2 O 5 → Ca (H 2 PO 4) 2 → CaHPO 4 → H 3 PO 4
87) Al → A1 2 O 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
88) HCl → CuCl2 → Cl2 → HCl → H2
89) P 2 O 5 → Na 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4
90) NH3 → NH4C1 → NH3H2O → NH4HC03 → NH3
91) NH4C1 → KC1 → HCl → CuCl2 → Cu (OH) 2
92) NH3 → NH4H2P04 → (NH4) 2HPO4 → NH3 → NH4NO3
93) KOH → KHCO 3 → K 2 CO 3 → CO 2 → Ca (HCO 3) 2
94) Na → NaOH → NaHC03 → Na2S04 → NaOH
95) KNO 3 → K 2 SO 4 → KC1 → KNO 3 → KNO 2
96) Cl 2 → KC1 → K 2 SO 4 → KNO 3 → KHSO 4
97) FeSO 4 → FeS → SO 2 → KHSO 3 → K 2 SO 4
98) KOH → Cu (OH) 2 → CuSO 4 → Cu (OH) 2 → Cu
99) Fe 2 O 3 → FeCl 3 → Fe (OH) 3 → Fe (NO 3) 3 → Fe 2 O 3
100) Al → A1 2 O 3 → A1 (NO 3) 3 → A1 2 O 3 → Al (OH) 3
101) CaO → CaCO 3 → CaSiO 3 → Ca (NO 3) 2 → O 2
102) Cu → Cu (OH) 2 → Cu → CuSO4 → CuCl2
103) H 2 S → SO 2 → ZnSO 4 → ZnS → ZnO
104) Cl 2 → NaCl → HCl → CuCl2 → CuO
105) Cl 2 → FeCl 3 → Fe 2 O 3 → Fe (OH) 3 → Fe (NO 3) 3
106) P 2 O 5 → Ca 3 (PO 4) 2 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2
107) ZnS → ZnO → Zn → ZnCl2 → Zn (NO3) 2
108) ZnO → ZnSO 4 → Zn (NO 3) 2 → ZnO → Zn (OH) 2
109) H 3 PO 4 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2
110) CaCO 3 → Na 2 CO 3 → Na 3 PO 4 → NaH 2 PO 4 → Ca 3 (PO 4) 2
111) CaCl2 → CaSO3 → Ca (OH) 2 → CaCl2 → Ca (NO3) 2
112) NaOH → Na2C03 → NaHS04 → NaNO3 → NaHS04
113) Na2SiO3 → Na2C03 → Na2S04 → NaCl → Na2S04
114) KNO 3 → KHSO 4 → K2SO4 → KCl → Na2S04
115) SiO 2 → K 2 SiO 3 → H 2 SiO 3 → SiO 2 → CaSiO 3
116) Cu → CuCl 2 → Cu (NO 3) 2 → NO 2 → HNO 3
117) Ca (NO 3) 2 → O 2 → SiO 2 → H 2 SiO 3 → SiO 2
118) P → H 3 PO 4 → Ca 3 (PO 4) 2 → CaHPO 4 → Ca (H 2 PO 4) 2
119) CuSO4 → Cu → CuS → CuO → CuCl2
120) Al → A1 2 (SO 4) 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
121) S → SO 3 → H 2 SO 4 → KHSO 4 → BaSO 4
122) N 2 O 5 → HNO 3 → Cu (NO 3) 2 → CuO → Cu (OH) 2
123) Al → A1 2 O 3 → Al (OH) 3 → A1 2 (SO 4) 3 → A1 (NO 3) 3
124) Ca → Ca (OH) 2 → Ca (HCO 3) 2 → CaO → CaCl 2
125) NH3H2O → NH4C1 → NH3 → NH4HC03 3 (NH4) 2C03
126) Cu (OH) 2 → H 2 O → HNO 3 → Fe (NO 3) 3 → Fe
127) S02 → Ca (HSO3) 2 → CaCl2 → Ca (OH) 2 → Ca (HCO 3) 2
128) NH 3 H 2 O → NH 4 HCO 3 → CaCO 3 → CaSiO 3 → CaCl 2
129) CuSO4 → Cu → CuO → Cu (OH) 2 → Cu
130) Fe (OH) 3 → Fe → FeCl 3 → Fe (NO 3) 3 → Fe
131) Zn → Zn (OH) 2 → Na2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn
132) Zn → ZnO → Na 2 ZnO 2 → Zn (OH) 2 → Na2 → ZnCl2
133) Zn → K 2 ZnO 2 → ZnSO 4 → K 2 → Zn (NO 3) 2 → ZnO
134) ZnO → Zn (OH) 2 → K 2 ZnO 2 → ZnSO 4 → ZnCl 2 → ZnO
135) Zn → Na 2 → Na 2 ZnO 2 → Zn (NO 3) 2 → ZnO → Zn
136) Al → K 3 → Al (OH) 3 → Na 3 → A1C1 3 → Al (OH) 3
137) Al 2 O 3 → KAlO 2 → Al (OH) 3 → Al 2 O 3 → Na 3 → Al 2 O 3
138) Al (OH) 3 → A1 2 O 3 → K 3 → Al 2 (SO 4) 3 → A1 (NO 3) 3
139) A1C1 3 → K 3 → Al (NO 3) 3 → NaAlO 2 → Al 2 O 3
140) Be → Na 2 → Be (OH) 2 → Na 2 BeO 2 → BaBeO 2
EKSPERIMENTALNA IZKUŠNJA NA TEMI »OSNOVNI RAZREDI ANORGANSKIH SPOJIN«
IZKUŠNJE 1.Nevtralizacijske reakcije.
a) Interakcija močne kisline in močne osnove.
V posodo iz porcelana nalijemo 5 ml 2N raztopine klorovodikove kisline in nanj po kapljicah dodamo 2 n raztopino natrijevega hidroksida. Raztopino premešamo s stekleno paličico in preizkusimo njen učinek na lakmusu, pri čemer kapljico raztopine prenesemo na lakmusov test. Treba je doseči nevtralno reakcijo (modri in rdeči lakmusov papir ne spremeni barve). Nastalo raztopino uparimo do suhega. Kaj je nastalo? Napišite molekularne in ionske reakcijske enačbe.
b) medsebojno delovanje šibke kisline in močne baze.
V epruveto vlijemo 2 ml 2N alkalne raztopine in dodamo raztopino ocetne kisline, dokler raztopina ni nevtralna. Napišite molekularne in ionske reakcijske enačbe. Pojasnite, zakaj se ravnotežna ionska reakcija, v kateri sodeluje šibki elektrolit (ocetna kislina), premakne v smeri tvorbe vodnih molekul.
IZKUŠNJE 2. Amfoterni hidroksidi.
Iz reagentov, ki so na voljo v laboratoriju, dobite oborino cinkovega hidroksida. Dobljeno oborino stresemo in jo vlijemo v 2 epruveti. V eno od cevi dodamo raztopino klorovodikove kisline, v drugi - raztopino natrijevega hidroksida (presežek). Kaj opazimo? Zapišite enačbe ustreznih reakcij v molekularni in ionski obliki.
IZKUŠNJE 3.Kemijske lastnosti soli.
a) Interakcija raztopin soli z nastankom težko topne snovi.
V epruveto nalijemo 2 ml raztopine natrijevega karbonata in dodamo raztopino barijevega klorida, dokler se ne pojavi bela oborina. Napiši enačbo kemijske reakcije v ionski in molekularni obliki. Oborina je razdeljena na dva dela. V eno od cevi vlijemo raztopino žveplove kisline, v drugo pa natrijev hidroksid. Naredite sklep o topnosti oborine v kislinah in alkalijah.
b) Interakcija raztopine soli s kislinami, da nastane hlapna spojina.
V epruveto nalijemo 2 ml raztopine natrijevega karbonata in dodamo majhno količino raztopine klorovodikove kisline. Kaj opazimo? Zapišite enačbe kemijskih reakcij v ionski in molekularni obliki.
c) Interakcija raztopin soli z alkalijami z nastankom hlapne spojine.
V epruveto nalijte malo raztopine amonijeve soli, dodajte 1-2 ml raztopine natrijevega hidroksida in segrejte do vrelišča. V epruveto z reakcijsko zmesjo izvedemo moker lakmusov preskus. Kaj opazimo? Pojasnite. Napišite reakcijske enačbe.
g ) Interakcije soli z bolj aktivnimi kovinami kot kovina, ki je del soli.
Železo (jeklo) očistite s finim brusnim papirjem. Nato jo potopimo v raztopino bakrovega sulfata. Po določenem času opazujte sproščanje bakra na površino nohta. Napišite ustrezno reakcijsko enačbo v ionski in molekularni obliki.
IZKUŠNJE 4.Pridobivanje osnovnih in kislih soli.
a) Priprava svinčevega hidroksoksarbonata.
Dodamo malo svinčevega (II) oksida v raztopino svinčevega (II) acetata in mešanico kuhamo nekaj minut. Ohlajeno raztopino izperemo iz oborine in skozi nje prehaja tok ogljikovega dioksida. Kaj opazimo? Oborino filtriramo in posušimo med listi filtrirnega papirja. Označimo barvo in naravo nastale oborine svinčevega hidroksoksarbonata. Napišite reakcijske enačbe. Naredite grafično formulo dobljene soli.
b) Priprava magnezijevega bikarbonata.
Zelo močno razredčeno raztopino neke magnezijeve soli dodamo malo raztopine natrijevega karbonata. Katera snov se obori? Nasičena raztopina z oborino z ogljikovim dioksidom. Opazujte postopno raztapljanje oborine. Zakaj se to dogaja? Napišite reakcijske enačbe.
IZKUŠNJE 5.Pridobivanje kompleksnih soli.
a) Nastajanje spojin s kompleksnim kationom.
V epruveto z 2-3 ml raztopine bakrovega (II) klorida dodamo po kapljicah raztopino amoniaka, dokler se ne pojavi oborina bakrovega (II) hidroksida, in nato dodamo odvečno raztopino amoniaka, da raztopimo oborino. Primerjajte barvo ionov Cu 2+ z barvo nastale raztopine. Kateri ioni so prisotni v raztopini? Napišite reakcijsko enačbo za pridobitev kompleksne spojine.
b) Nastajanje spojin s kompleksnim anionom.
V 1-2 ml raztopine živosrebrovega (II) nitrata po kapljicah dodamo razredčeno raztopino kalijevega jodida, da se tvori oborina HgI 2. Nato prelijemo raztopino kalijevega jodida, dokler se oborina ne raztopi. Napišite reakcije pridobivanja kompleksne soli.
IZKUŠNJE 6.Priprava dvojnih soli (kalijev alum).
Natehtamo 7,5 g Al 2 (SO 4) 3 - 18 H 2 O in raztopimo v 50 ml vode, pri čemer za to potrebujemo dovolj veliko porcelanasto posodo. Izračunajte reakcijsko enačbo in stehtajte maso kalijevega sulfata, potrebno za reakcijo. Pripravite vročo nasičeno raztopino kalijevega sulfata in jo premešajte v porcelansko posodo z raztopino aluminijevega sulfata. Po nekaj urah opazujemo obarjanje kristalov aluminijevega kalija. Po ohladitvi in kristalizaciji izlijemo matično lužnico, sušimo alum kristale med listi filtrirnega papirja in stehtamo nastale kristale. Izračunajte odstotek pridelka.
PORAVNALNE NALOGE
1. S prehodom presežka vodikovega sulfida skozi 16 g raztopine bakrovega (II) sulfata dobimo 1,92 g oborine. Poiščite masni delež bakrovega sulfata v uporabljeni raztopini in količino porabljenega vodikovega sulfida.
2. Za popolno obarjanje bakra v obliki sulfida iz 291 cm3 raztopine bakrovega (II) sulfata z masnim deležem 10% uporabimo plin, pridobljen z reakcijo 17,6 g železovega (II) sulfida s presežkom klorovodikove kisline. Poišči gostoto prvotne raztopine bakrovega sulfata.
3. Plin, ki se sprošča med medsebojnim delovanjem raztopine K 2 S z razredčeno žveplovo kislino, prehaja skozi presežek raztopine svinca (II) nitrata. Nastala oborina ima maso 71,7 g. Poišči volumen reagirane raztopine žveplove kisline, če je njena gostota 1,176 g / cm 3, masni delež pa 25%.
4. K raztopini, ki vsebuje 8 g bakrovega (II) sulfata, dodamo raztopino, ki vsebuje 4,68 g natrijevega sulfida. Oborino filtriramo, filtrat uparimo. Po uparjenju določimo maso snovi v filtratu in maso oborine bakrovega sulfida.
5. Nekaj železovega (II) sulfida smo obdelali s prebitkom klorovodikove kisline. Nastali plin v reakciji z 12,5 cm3 raztopine NaOH z masnim deležem 25% in gostoto 1,28 g / cm3 je tvoril kislinsko sol. Poišči maso prvotnega železovega sulfida.
6. Železov (II) sulfid, ki tehta 176 g, je bil obdelan s presežkom klorovodikove kisline in nastali plin je bil zažgan v presežnem zraku. Kolikšen volumen raztopine KOH z masnim deležem 40% in gostoto 1,4 g / cm 3 je potreben za popolno nevtralizacijo plina, proizvedenega med zgorevanjem?
7. Pri praženju 100 g tehničnega pirita so dobili plin, ki je bil popolnoma nevtraliziran s 400 cm3 raztopine NaOH z masnim deležem 25% in gostoto 1,28 g / cm3. Določite masni delež nečistoč v piritu.
8. V 2 g zmesi železa, železovega oksida (II) in železovega oksida (III) dodamo 16 cm3 raztopine HC1 z masnim deležem 20% in gostoto 1,09 g / cm3. Za nevtralizacijo odvečne kisline se je porabilo 10,8 cm3 raztopine NaOH z masnim deležem 10% gostote 1,05 g / cm3. Poiščite mase snovi v mešanici, če je volumen sproščenega vodika 224 cm 3 (NU).
9. Zmes je Ca (OH) 2, CaCO 3 in BaSO 4 z maso 10,5 g. Ko je bila zmes obdelana s presežkom klorovodikove kisline, je bilo sproščenih 672 cm 3 (IU) plina in 71,2 g kisline reagiralo z maso. 10% delež. Določite maso snovi v mešanici.
10. Obstaja mešanica barijevega klorida, kalcijevega karbonata in natrijevega bikarbonata. Ko se 10 g te zmesi raztopi v vodi, je netopni ostanek enak 3,5 g. Pri žganju 20 g začetne zmesi se masa zmanjša za 5,2 g. Poiščite masne deleže snovi v začetni zmesi.
11. Obstaja raztopina, ki vsebuje tako žveplove kot dušikove kisline. Za popolno nevtralizacijo 10 g te raztopine porabimo 12,5 cm3 raztopine KOH z masnim deležem 19% in gostoto 1,18 g / cm 3. Ko se 20 g iste mešanice kislinske raztopine doda presežku barijevega klorida, pade 4,66 g oborine. Poiščite masne deleže kislin v zmesi.
12. Ves vodikov klorid, dobljen iz 100 g zmesi KC1 in KNO3, je bil raztopljen v 71,8 cm3 vode. Pri žganju 100 g iste zmesi soli ostane 93,6 g trdnega ostanka. Poišči masni delež vodikovega klorida v vodi.
13. S prehodom 2 m 3 zraka (NU) skozi raztopino Ca (OH) 2 dobimo 3 g oborine soli ogljikove kisline. Poišči volumen in masni delež CO 2 v zraku.
14. Ogljikov dioksid se spusti skozi suspenzijo, ki vsebuje 50 g CaCO3. Reakcija je dosegla 8,96 dm3 plina (NU). Kakšna je masa CaCO 3 v trdni fazi?
15. Pri dodajanju vode v CaO se je njegova masa povečala za 30%. Kateri del CaO (v masnih%) je ugasnil?
16. Svinec (II) oksid, ki tehta 18,47 g, segrevamo v toku vodika. Po reakciji je masa nastalega svinca in nereagiranega oksida znašala 18,07 g. Kakšna je masa svinčevega oksida, ki ni reagiral?
17. Ogljikov monoksid pri segrevanju prehaja skozi železov (III) oksid. Masa trdnega ostanka po reakciji je 2 g manjša od začetne mase železovega oksida. Kakšen volumen CO je povzročila reakcija (ali je oksid popolnoma zmanjšan)?
18. Obstaja 8,96 dm3 (NU) zmesi N2, CO 2 in SO 2 z relativno gostoto vodika 25. Po prehodu skozi presežek raztopine KOH se je volumen zmesi zmanjšal za 4-krat. Poiščite količine plinov v originalni zmesi.
19. V dveh kozarcih je 100 g raztopine HC1 z masnim deležem 2,5%. V enem kozarcu smo dodali 10 g CaCO 3, v drugi - 8,4 g MgCO 3. Kako se bo masa očal razlikovala po reakciji?
20. Kolikšen volumen (NU) žveplovega dioksida je treba prenesti skozi 200 cm3 raztopine z 0,1% masnim deležem NaOH in gostoto 1 g / cm3, da dobimo kislo sol?
21. Kolikšna je največja količina (ogljikov dioksid) ogljikovega dioksida, ki lahko absorbira 25 cm3 raztopine z 25% masnim deležem NaOH in gostoto 1,1 g / cm3?
22. Kolikšna je najmanjša prostornina raztopine z masnim deležem 20% KOH in gostoto 1,19 g / cm 3, ki lahko absorbira ves proizvedeni ogljikov dioksid s popolnim zmanjšanjem 23,2 g magnetita z ogljikovim monoksidom?
23. Kakšna je najmanjša masa KOH, ki jo je treba presnoviti s 24,5 g ortofosforne kisline, tako da je proizvod le kalijev dihidrogenfosfat?
24. Kolikšna je najmanjša masa Ca (OH) 2, da se doda 16 g raztopine kalcijevega bikarbonata z masnim deležem 5% soli, da dobimo medijsko sol?
25. Katero maso kalijevega hidrogenfosfata je treba dodati raztopini, ki vsebuje 12,25 g H 3 PO 4, tako da po tem raztopina vsebuje samo kalijev dihidrogenfosfat?
26. Raztopina je vsebovala 56,1 g zmesi kalcijevih in magnezijevih karbonatov v suspenziji. Da bi jih pretvorili v hidrokarbonate, so porabili ves ogljikov dioksid, ki je nastal s sežiganjem 7 dm 3 (NU) etana. Poiščite maso kalcijevega karbonata v začetni zmesi.
27. Za pretvorbo 9,5 g zmesi natrijevega hidroksida in dihidrogenfosfata v medijsko sol, je potrebno 10 cm3 raztopine z masnim deležem NaOH 27,7% in gostoto 1,3 g / cm3. Poiščite maso vodikovega fosfata v mešanici.
28. S prehodom ogljikovega dioksida skozi raztopino, ki vsebuje 6 g NaOH, dobimo 9,5 g zmesi kislinskih in srednje soli. Poišči količino porabljenega ogljikovega dioksida.
29. Po prehodu 11,2 dm3 (NU) C02 skozi raztopino KOH dobimo 57,6 g zmesi kislinskih in srednjih soli. Poišči maso srednje soli.
30. Kakšno maso ortofosforne kisline moramo nevtralizirati, da dobimo 1,2 g dihidro- in 4,26 g natrijevega hidrogen fosfata?
31. Raztopini žveplove kisline dodamo NaOH, da dobimo 3,6 g hidrosulfata in 2,84 g natrijevega sulfata. Določite kemične količine kisline in alkalij, ki so reagirali.
32. Po prehodu vodikovega klorida skozi 200 cm3 raztopine NaOH z masnim deležem 10% in gostoto 1,1 g / cm3 se je masni delež NaOH v nastali raztopini zmanjšal za polovico. V nastali raztopini določite masni delež NaCl.
33. Raztapljanje 14,4 g zmesi bakra in njegovega oksida (II) je porabilo 48,5 g raztopine z masnim deležem HNO 3 80%. Poiščite masne deleže bakra in oksida v začetni zmesi.
34. Maso natrijevega oksida 6,2 g raztopimo v 100 cm3 vode in dobimo raztopino št. 1. Nato k raztopini dodamo klorovodikovo kislino z masnim deležem 10%, dokler medij ne postane nevtralen in dobimo raztopino št. :
1) masni deleži snovi v raztopinah št. 1, 2;
2) masa raztopine HC1, ki je nevtralizirala število raztopine 1.
35. 3 g cinka sodelujejo z 18,69 cm3 raztopine HC1 z masnim deležem 14,6% in gostoto 1,07 g / cm3. Pri segrevanju nastali plin prehaja preko vročega CuO, ki tehta 4 g. Kakšna je masa pridobljenega bakra?
36. Plin, sproščen po obdelavi kalcijevega hidrida s presežkom vode, je zamudil FeO. Posledično se je masa oksida zmanjšala za 8 g. Poišči maso CaH 2, obdelano z vodo.
37. Med žganjem vzorca CaCO 3 se je njegova masa zmanjšala za 35,2%. Trdne reakcijske produkte smo raztopili v presežku klorovodikove kisline, da smo dobili 0,112 dm3 (NU) plina. Določimo maso prvotnega vzorca kalcijevega karbonata.
38. Bakrov nitrat je razpadel in nastali bakrov (II) oksid je bil popolnoma reduciran z vodikom. Nastali produkti so šli skozi cev s P 2 O 5, masa cevi pa se je povečala za 3,6 g. Kolikšna je najmanjša količina žveplove kisline z masnim deležem 88% in gostoto 1,87 g / cm 3, potrebno za raztapljanje, pridobljeno v poskusu. bakra in kakšna je masa razpadle soli?
39. Po absorpciji dušikovega oksida (IV) s presežkom raztopine KOH v mrazu v odsotnosti kisika dobimo 40,4 g KNO3. Katera snov je še oblikovana in kakšna je njena masa?
40. Nevtralizirati 400 g raztopine, ki vsebuje klorovodik in. \\ T žveplove kislineporabili 287 cm3 raztopine natrijevega hidroksida z masnim deležem 10% in gostoto 1,115 g / cm3. Če se 100 g prvotne raztopine doda odvečni raztopini barijevega klorida, bo padlo 5,825 g oborine. Določite masne deleže kislin v začetni raztopini.
41. Po prehodu ogljikovega dioksida skozi raztopino natrijevega hidroksida dobimo 13,7 g mešanice medijskih in kislih soli. Za pretvorbo v natrijev klorid je potrebno 75 g klorovodikove kisline z masnim deležem HCl 10%. Poišči količino absorbiranega ogljikovega dioksida.
42. Zmes klorovodikove in žveplove kisline s skupno maso 600 g raztopine z enakimi masnimi frakcijami kislin smo obdelali s presežkom natrijevega bikarbonata in pridobili 32,1 dm3 plina (NO). Poišči masni delež kislin v začetni zmesi.
43. Za nevtralizacijo 1 dm3 raztopine NaOH se porabi 66,66 cm3 raztopine HNO3 z masnim deležem 63% in gostoto 1,5 g / cm3. Kakšna količina raztopine žveplove kisline z masnim deležem 24,5% in gostoto 1,2 g / cm3 bi bila potrebna za nevtralizacijo enake količine alkalij?
44. V kakšnem volumskem razmerju je treba vzeti raztopino žveplove kisline z masnim deležem 5% in gostoto 1,03 g / cm 3 in raztopino barijevega hidroksida z masnim deležem 5% in gostoto 1,1 g / cm3 za popolno nevtralizacijo? Predstavljajte si odgovor kot količnik prostornine alkalne raztopine na kisli raztopini
45. Izračunajte najmanjšo prostornino raztopine amonijaka z gostoto 0,9 g / cm 3 in masnim deležem 25%, ki je potrebna za popolno absorpcijo ogljikovega dioksida, pridobljenega z razgradnjo 0,5 kg naravnega apnenca z masnim deležem kalcijevega karbonata, ki je enak 92%.
46. Za popolno pretvorbo 2,92 g zmesi natrijevega hidroksida in natrijevega karbonata v klorid se zahteva 1,334 dm3 vodikovega klorida (NU). Poiščite maso natrijevega karbonata v mešanici.
47. K 25 g raztopine bakrovega (II) sulfata z masnim deležem 16% smo dodali količino raztopine natrijevega hidroksida z masnim deležem 16%. Nastalo oborino filtriramo, nakar filtrat naalkalimo. Za popolno nevtralizacijo filtrata je vzel 25 cm3 raztopine žveplove kisline z molsko koncentracijo 0,1 mol / dm 3 raztopine. Izračunamo maso dodane raztopine natrijevega hidroksida.
48. Snov, pridobljeno s popolno redukcijo CuO z maso 15,8 g vodika s prostornino 11,2 dm3 (NU), raztopimo s segrevanjem v koncentrirani žveplovi kislini. Kolikšna je količina plina, ki se sprosti kot rezultat reakcije?
49. Za popolno nevtralizacijo 50 cm3 klorovodikove kisline z masnim deležem HCl 20% in gostoto 1,10 g / cm 3 je bila uporabljena raztopina kalijevega hidroksida z masnim deležem KOH 20%. Kakšna je kemična količina vode v nastali raztopini?
50. Plin, ki ga dobimo s prehodom presežka CO 2 nad 0,84 g vročega premoga, pošljemo v reakcijo z 14,0 g segretega bakrovega (II) oksida. Kolikšna količina raztopine dušikove kisline z masnim deležem 63% in gostoto 1,4 g / cm3 je potrebna, da se snov popolnoma raztopi, pridobljeno v zadnji reakciji?
51. Pri žganju do konstantne mase bakrovega (II) nitrata se je masa soli zmanjšala za 6,5 g. Kakšna teža soli je bila razpadla?
52. Ko je bil uporabljen presežek klorovodikove kisline, se je na mešanici aluminija z neznano monovalentno kovino sproščalo 6,72 dm 3 (NW) plina, masa mešanice pa se je prepolovila. Pri obdelavi ostanka z razredčeno dušikovo kislino se sprosti 0,373 dm3 (NU) NO. Identificirajte neznano kovino.
53. Masa vzorca krede je 105 g, kemijska količina kisikovega elementa v njegovi sestavi pa je 1 mol. Določite masni delež CaCO 3 v vzorcu krede (kisik je vključen samo v sestavo kalcijevega karbonata).
54. Pri medsebojnem delovanju žveplovega oksida (VI) z vodo je bila dobljena raztopina z masnim deležem 25% žveplove kisline. Ko smo k tej raztopini dodali presežek Ba (OH) 2, smo odložili oborino, ki je tehtala 29,13 g., Katere mase SO3 in H20 smo porabili za tvorbo kisle raztopine?
55. Pri prehodu SO2 skozi 200 g raztopine z masnim deležem NaOH 16% je nastala zmes soli, ki vključuje 41,6 g kislinske soli. Kolikšna je bila masa žvepla, ki vsebuje 4,5 mas.% Nečistoč, za pridobitev SO2? Kakšna je teža srednje soli?
56. Medsebojno delovanje z 80 g Ca (NO3) 2 raztopine je vzelo 50 g raztopine Na2C03. Precipitacijo smo ločili, medtem ko smo jo predelali s presežkom klorovodikove kisline, sprostili pa smo 2,24 dm3 (NU) plina. Kakšni so masni deleži soli v začetnih raztopinah? Kolikšen je masni delež natrijevega nitrata v raztopini po ločitvi oborine?
57. Kadar cink medsebojno deluje z žveplovo kislino, nastane 10 dm 3 (NU) zmesi SO2 in H2S z relativno gostoto argona 1,51. Kolikšna je količina raztopljenega cinka? Kolikšen je masni delež SO 2 v mešanici plinov?
58. Vzorec zmesi cinkove in aluminijeve žagovine s skupno maso 11 g je bil raztopljen v presežku alkalne raztopine. Določite prostornino (NU) sproščenega plina, če je masni delež cinka v mešanici 30%.
59. Natrijev hidroksid, ki tehta 4,0 g, je legiran z aluminijevim hidroksidom, ki tehta 9,8 g. Izračunajte maso pridobljenega natrijevega metaluminata.
60. Pri predelavi 10 g mešanice bakra in aluminija s koncentrirano dušikovo kislino pri sobni temperaturi sproščen 2,24 dm 3 plina (NU). Kolikšen volumen (NU) plina se bo sprostil pri obdelavi iste mase zmesi s presežkom raztopine KOH?
61. Zlitina bakra in aluminija, ki tehta 20 g, je bila obdelana s presežkom alkalij, netopni ostanek je bil raztopljen v koncentrirani dušikovi kislini. Dobljeno sol izoliramo, žarimo do konstantne teže in dobimo 8 g trdnega ostanka. Določimo prostornino izrabljene raztopine NaOH z masnim deležem 40% in gostoto 1,4 g / cm 3).
62. Zmes aluminija in kovinskega oksida (II) (ne-amfoterni oksid), ki tehta 39 g, smo obdelali s presežkom raztopine KOH, izpuščeni plin smo sežgali, da smo dobili 27 g vode. Neotopljeni ostanek smo popolnoma raztopili v 25,2 cm3 raztopine z masnim deležem HCl 36,5% in gostoto 1,19 g / cm3). Določite oksid.
63. Zmes cinkovega in bakrovega ostružka je bila obdelana s presežkom raztopine KOH, medtem ko je bil sproščen plin 2,24 dm 3 (NU). Za popolno kloriranje istega kovinskega vzorca je bil potreben klor z volumnom 8,96 dm 3 (NU). Izračunajte masni delež cinka v vzorcu.
64. Mešanica žagovine železa, aluminija in magnezija z maso 49 g je bila obdelana s prebitkom razredčene H 2 SO 4 in tako dobila 1,95 mol plina. Drugi del iste zmesi, ki tehta 4,9 g, obdelamo s presežkom alkalne raztopine, dobimo 1,68 dm (NU) plina. Poišči maso kovin v mešanici.
65. Kolikšna je masa sedimenta, ki nastane pri združitvi raztopin, ki vsebujejo 10 g NaOH in 13,6 g ZnCl2?
66. Obstajata dva dela zmesi Al, Mg, Fe, Zn, enako v molarni sestavi, od katerih vsaka tehta 7,4 g. En obrok je bil raztopljen v klorovodikovi kislini in dobil 3,558 dm 3 plina (NU), drugi v alkalni raztopini in Prejel je 2.016 dm3 plina (NU). Znano je, da v obeh mešanicah obstajajo 3 atomi Zn na atom A1. Poišči maso kovin v mešanici.
67. Zmes bakra, magnezija in aluminija, ki tehta 1 g, smo obdelali s prebitkom klorovodikove kisline. Raztopino filtriramo, filtratu dodamo presežek raztopine NaOH. Oborino smo ločili in kalcinirali do konstantne mase 0,2 g. Ostanek, ki smo ga po obdelavi s klorovodikovo kislino raztopili, smo prežarili na zraku in dobili 0,8 g črne snovi. Poiščite masni delež aluminija v mešanici.
68. Pri segrevanju v toku kisikove zlitine cinka, magnezija in bakra se masa zmesi poveča za 9,6 g. Proizvod je delno raztopljen v alkalijah, za raztapljanje pa je potrebna 40 cm3 raztopine z masnim deležem 40% KOH in gostoto 1,4 g / cm. 3 Za reakcijo z istim delom zlitine je potrebna 0,7 mol HCl. Poiščite kemične količine kovin v zlitini.
69. Zlitino bakra in cinka, ki tehta 5 g, obdelamo s prebitkom raztopine NaOH. Nato ločimo trdni ostanek in obdelamo s koncentriranim HN03, tako dobljeno sol izoliramo, kalciniramo do konstantne mase in dobimo 2,5 g trdnega ostanka. Določite maso kovin v zlitini.
70. Zlitina bakra in aluminija, ki tehta 12,8 g, je bila obdelana s prebitkom klorovodikove kisline. Neotopljeni ostanek raztopimo v koncentrirani dušikovi kislini, dobljeno raztopino uparimo, suhi ostanek preperemo do konstantne mase in dobimo 4 g trdne snovi. Določite masni delež bakra v zlitini.
71. V kakšnem masnem razmerju naj vzamemo dva dela A1, tako da se, kadar je ena dodana raztopini alkalij in druga enaka količini vodika, sprosti v klorovodikovo kislino?
72. Pri obdelavi zmesi aluminija in bakrovega (II) oksida s presežkom raztopine KOH se je sprostilo 6,72 dm3 (NU) plina in z raztapljanjem istega dela zmesi v koncentrirani HNO 3 pri sobni temperaturi dobimo 75,2 g soli. Poišči maso začetne mešanice snovi.
73. Kakšno maso bakrovega (II) oksida lahko obnovimo z vodikom, dobljenim z reakcijo presežka aluminija s 139,87 cm3 raztopine s 40% NaOH in gostoto 1,43 g / cm3?
74. S popolno oksidacijo 7,83 g zlitine dveh kovin je nastalo 14,23 g oksidov, med obdelavo katerih je presežek alkalij ostal neraztopljen 4,03 g usedline. Določite kvalitativno sestavo kovin, ki tvorijo zlitino, če imajo njihovi kationi oksidacijsko stanje +2 in +3, molsko razmerje oksidov pa je 1: 1 (predpostavimo, da ima kovinski oksid z oksidacijskim stanjem +3 amfoterne lastnosti).
75. Raztopimo dva dela aluminija z enako maso: enega v raztopini kalijevega hidroksida, drugega v klorovodikovi kislini. Kako se količine nastalih plinov (nos) med seboj nanašajo?
76. Zlitina bakra z aluminijem, ki tehta 1.000 g, je bila obdelana s presežkom alkalne raztopine, neraztopljena oborina je bila raztopljena v dušikovi kislini, nato je bila raztopina uparena, ostanek kalciniran do konstantne teže. Masa novega ostanka je 0,398 g. Kakšna je masa kovin v zlitini?
77. Zlitina cinka in bakra, ki tehta 20 g, je bila obdelana s presežkom raztopine NaOH z masnim deležem 30% in gostoto 1,33 g / cm3. Trdni ostanek smo izolirali in obdelali s presežkom koncentrirane raztopine HNO3. Sol, ki je nastala med tem postopkom, smo izolirali in kalcinirali do konstantne teže. Masa trdnega ostanka je bila 10.016 g. Izračunajte masne deleže kovin v zlitini in porabljeni volumen alkalijske raztopine.
78. Zlitina bakra in aluminija, ki tehta 2 g, je bila obdelana s presežkom alkalne raztopine. Ostanek filtriramo, speremo, raztopimo v HN03, raztopino uparimo in kalciniramo do konstantne teže. Masa ostanka po žganju je bila 0,736 g. Izračunajte masne deleže kovin v zlitini.
79. Kloriranje zmesi železa, bakra in aluminija zahteva 8,96 dm 3 klora (NU), za interakcijo istega vzorca s klorovodikom pa 5,6 dm 3 (NU). Pri medsebojnem delovanju z isto maso mešanice kovin z alkalijami se sprosti 1,68 dm 3 (NU) plina. Poiščite kemične količine kovin v mešanici.
80. Kalijev hidrid, ki tehta 5,0 g, raztopimo v vodi s prostornino 80 cm3 in dodani raztopini dodamo aluminij, ki tehta 0,81 g., Najdemo masne deleže snovi v dobljeni raztopini s točnostjo do tisočinke odstotka.
SEZNAM LITERATURE. \\ T
1. Barannik, V.P. Sodobna ruska nomenklatura anorganskih spojin / V.P. Barannik // Zbornik All-Union Chemical Society. D.I. Mendeleev. - 1983. - zvezek XXVIII. - str.
2. Wroblewski, A.I. Simulator kemije / A.I. Wroblewski. - 2. izd., Pererab. in dodajte. - Minsk: Krasiko-Print, 2007. - 624 str.
3. Glinka, N.L. Naloge in vaje splošne kemije: študije. priročnik za univerze / ed. V.A. Rabinovich in H.M. Rubina. - M .: Integral-Press, 2004. - 240 str.
4. Lidin, R.A. Naloge v splošni in anorganski kemiji: študije. priročnik za študente višjih. študij. institucije / R.A. Lidin, V.A. Milk, L.L. Andreeva; z ed. R.A. Lidina. - M .: VLADOS, 2004. - 383 str.
5. Lidin, R.A. Osnove nomenklature anorganskih snovi / R.A. Lidin [et al.]; z ed. B.D. Stepina. - M: Chemistry, 1983. - 112 str.
6. Stepin, B.D. Uporaba pravil IUPAC o nomenklaturi anorganskih spojin v ruskem jeziku / B.D. Stepin, R.A. Lidin // Zbornik All-Union Chemical Society. D.I. Mendeleev. - 1983. - zvezek XXVIII. - str.
| Uvod …………………………………………………………………… Splošna pravila za vrsto anorganskih snovi ………… .. Oksidi ………………………………… ……………………………… Osnovni oksidi ………………………………………………………… ... kislinski oksidi ………………………………… ………………………. Amfoterni oksidi ……………………………………………………… .. Pridobivanje oksidov ………………………………………………………… Vaje za samostojno delo na Tema »Oksidi« …………………………………………………………. Kisline ……………………………………………………………………. Vaje za samostojno delo na temo “Kisline” ………………………………………………………… Razlogi …………………………………………………… ……… .. Vaje za samostojno delo na temo »Temelji« ………………………………………………………. Soli …………………………………………………………………………. Vaje za samostojno delo na temo "Soli" .......................................................... Genetski odnos med razredi anorganskih spojin ......................................... …………… .. Vaje za samostojno delo na temo »Genetska povezava med razredi anorganskih spojin« ……………………………………………… Eksperimentalni poskusi na temo »Glavni razredi anorganskih spojin …………… ……… .. Naloge poravnave …………………………………………………………… Reference …………………………………………………… |
izobraževalni: določiti koncept "genetske serije", "genetske povezave"; naučiti, kako izdelati genetske serije elementov (kovine in nekovine), sestaviti reakcijske enačbe, ki ustrezajo genetski seriji; preveriti, kako se izenačijo znanja o kemijskih lastnostih oksidov, kislin, soli, baz;
razvoj: razviti sposobnost analiziranja, primerjanja, povzemanja in oblikovanja zaključkov, sestaviti enačbe kemijskih reakcij;
izobraževalne : spodbujanje oblikovanja znanstvenega pogleda na svet.
2. Zagotavljanje razredov: tabele »Periodični sistem«, »Tabela topnosti«, »Serija aktivnosti kovin«, navodila za študente, naloge za testiranje znanja.
3. Vrstni red izvedbe:
3.1. Frontalni pregled.
3.2. Rešitev nalog.
3.3. Opravite preverjanje možnosti.
4. Postavitev poročila:
4.1. Napišite temo in cilje praktične lekcije.
4.2. Zabeležite reševanje problemov.
4.3. Rešite svojo različico neodvisnega dela, odločitev, da pišete v zvezek in ga posredujete učitelju v pregled.
Napredek pri delu
1. Frontalni pogovor o:
Kaj je genska povezava?
Genetske povezave - to so povezave med različnimi razredi glede na njihove medsebojne konverzije.
Kaj je genetska serija?
Genetska vrstica - serija snovi - predstavniki različnih razredov, ki so spojine enega kemičnega elementa, povezane z medsebojnimi pretvorbami in ki odražajo transformacije teh snovi. Osnova teh serij je isti element.
Katere vrste genetskih serij so običajno dodeljene?
Med kovinami obstajata dve vrsti vrstic:
a) Genetska serija, v kateri alkalija deluje kot osnova. Ta serija je lahko predstavljena z naslednjimi transformacijami:
kovinski → bazični oksid → alkalijski → sol
na primer genetska serija kalija K → K 2 O → KOH → KCl
b) Genetska serija, kjer je baza netopna baza, lahko serijo predstavimo kot verigo transformacij:
kovina → osnovni oksid → sol → netopna baza → osnovni oksid → kovina
na primer: Cu → CuO → CuCl2 → Cu (OH) 2 → CuO → Cu
Med nekovinami je mogoče ločiti tudi dve vrsti vrstic:
a) Genetska serija nekovin, kjer topna kislina deluje kot vez v seriji. Verigo transformacij lahko predstavimo na naslednji način: nekovinska → kislina oksid → topna kislina → sol.
Na primer: P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
b) Genetska vrsta nekovin, kjer je netopna kislina: nekovinski → kislinski oksid → sol → kislina → kislinski oksid → nekovinski del.
Na primer: Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Izvajanje nalog za možnosti:
| Možnost 1 | Možnost 2. \\ T |
|
I možnost: ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2
Možnost II: Na2S04, NaOH, Na, Na2O2, Na2O
Domača naloga: načrtovati postopen prehod iz kalcija v kalcijev karbonat in pripraviti poročilo o uporabi kakršne koli soli v medicini (z uporabo dodatne literature).
Navodila za praktično lekcijo
Genetski odnos med glavnimi razredi anorganskih snovi.
Cilji: določiti koncept "genetske serije", "genetske povezave"; naučiti se genetske serije elementov (kovine in nekovine), sestaviti enačbe reakcij, ki ustrezajo genetski seriji; ponovite lastnosti oksidov, kislin, soli, baz.
Napredek pri delu
Zapišite definicije pojmov:
Genetski odnos - __________________________________________
Genetska vrstica - ___________________________________________
Genetska serija kovin, v katerih alkalija deluje kot osnova. lahko na splošno predstavimo: kovinski → bazični oksid → alkalijski → sol. To serijo naredite z uporabo kalija. Napišite enačbe reakcij, s pomočjo katerih lahko dosežete to verigo transformacij.
Genetska serija nekovin, kjer topna kislina deluje kot vez v seriji lahko predstavimo kot sledi: nekovinski → kislinski oksid → topna kislina → sol. To serijo naredite s fosforjem. Napišite enačbe reakcij, s pomočjo katerih lahko dosežete to verigo transformacij.
Genetska vrstica, kjer je baza netopna baza lahko predstavimo z verigo transformacij: kovinski → bazični oksid → sol → netopna baza → bazični oksid → kovina. Zgradite to serijo z bakrom. Napišite enačbe reakcij, s pomočjo katerih lahko dosežete to verigo transformacij.
Genetska serija nekovin, kjer netopna kislina deluje kot vez v seriji lahko predstavimo z verigo transformacij: nekovinski → kislinski oksid → sol → kislina → kislinski oksid → nekovinski. Zgradite to serijo z uporabo silicija. Napišite enačbe reakcij, s pomočjo katerih lahko dosežete to verigo transformacij.
Opravite naloge za možnosti:
| Možnost 1 | Možnost 2. \\ T |
|
1. V svoji različici izberite oksidne formule, pojasnite svojo izbiro na podlagi poznavanja lastnosti sestave tega razreda spojin. Pokličite jih.
2. V stolpcu s formulami v različici poiščite formule za kislino in razložite svojo izbiro na podlagi analize sestave teh spojin.
3. Določite valence kislih ostankov v kislinski sestavi.
4. Izberite soli in jih poimenujte.
5. Pripravite formule soli, ki se lahko tvorijo z magnezijem in kislinami v vaši varianti. Zapišite jih, ime.
6. V stolpcu s formulami svoje različice poiščite osnovne formule in razložite svojo izbiro na podlagi analize sestave teh spojin.
7. V svoji različici izberite formule snovi, s katerimi lahko reagira raztopina ortofosforne kisline (klorovodikova, žveplova). Naredite ustrezne reakcijske enačbe.
9. Med formulami vaše možnosti izberite formule snovi, ki lahko medsebojno delujejo. Naredite ustrezne reakcijske enačbe.
10. Naredite verigo genetskih vezi anorganskih spojin, ki bodo vsebovale snov, katere formula je navedena v vaši različici pod številko ena.
Iz teh snovi naredimo genetsko linijo z uporabo vseh formul. Napišite reakcijske enačbe, s katerimi lahko dosežemo to verigo transformacij:
I možnost: ZnS04, Zn, ZnO, Zn, Zn (OH) 2
IImožnost: Na2S04, NaOH, Na, Na2O2, Na2O
Domača naloga: načrtovati postopen prehod iz kalcija v kalcijev karbonat in pripraviti poročilo o uporabi kakršne koli soli v medicini (z uporabo dodatne literature).
