Kemična formula žveplove kisline. Žveplova kislina: kemijske lastnosti, pripravek
H2SO3, šibka dvobazna kislina. V prosti obliki ni dodeljena, obstaja v vodnih raztopinah. Žveplovi kislinski sulfiti ... Veliki enciklopedični slovar
Žveplova kislina - (H2SO3) šibka dvobazna kislina. Obstaja samo v vodnih raztopinah. Soli S. do. Sulfiti. Uporablja se v papirni in prehrambeni industriji. Glej tudi Kisline in anhidridi ... Ruska enciklopedija o zaščiti dela
žveplove kisline - - [A.S. Goldberg. Angleški ruski energetski slovar. 2006] Teme o energiji na splošno EN Žveplova kislina ... Vodnik za tehnične prevajalce
H2SO3, šibka dvobazna kislina. V prosti obliki ni dodeljena, obstaja v vodnih raztopinah. Sulfitov žveplova kislina. * * * Žveplova kislina, žveplova kislina, H2SO3, šibka dvobazna kislina. Brezplačno ni izbrano, ... ... Enciklopedični slovar
žveplove kisline - sulfito rūgštis statusa T sritis chemija formulė H₂SO₃ atitikmenys: angl. žveplova kislina rus. žveplova kislina ryšiai: sinonimas - vandenilio trioksosulfatas (2–) Chemijos terminų aiškinamasis žodynas
H2SO3, šibka dvobazna kislina, ki ustreza stopnji oksidacije žvepla +4. Znano samo v razredčenih vodnih raztopinah. Disociacijske konstante: K1 = 1,6 · 10 2, K2 = 1,0 · 10 7 (18 ° C). Daje dve vrsti soli: normalni sulfiti in kislo ... Velika sovjetska enciklopedija
H2SO3, šibka dvobazna kislina. V prosti obliki ni poudarjeno, obstaja v vodah. p rah. Soli S. k. Naravoslovje. Enciklopedični slovar
Oglejte si žveplo ... Enciklopedični slovar FA Brockhaus in I.A. Efrona
Žveplov dioksid (dioksid) nastane s sežiganjem žvepla v zraku ali kisiku. Prav tako se pridobiva s kalciniranjem v zraku ("kurjenje") sulfidov kovin, na primer železnih piritov:
Glede na to reakcijo se žveplov dioksid običajno pridobi v industriji (za druge industrijske metode pridobivanja cm, 9 § 131).
Žveplov dioksid je brezbarven plin ("žveplov dioksid") z ostrim vročim žveplom. Zelo se kondenzira v brezbarvno tekočino, ki vre. Ko tekočina izhlapi, se temperatura (pred) močno zmanjša.
Žveplov dioksid je zelo topen v vodi (približno 40 volumnov v 1 volumskem delu vode); hkrati delno poteka reakcija z vodo in nastane žveplena kislina:
Tako je žveplov dioksid anhidrid žveplove kisline. Ko se segreje, se topnost zmanjša in ravnotežje premakne v levo; postopoma se ves žveplov dioksid spet sprosti iz raztopine.
Molekula je zgrajena podobno kot molekula ozona. Jedra sestavnih atomov tvorijo enakokraki trikotnik:
Tu je atom žvepla, kot je osrednji atom kisika v molekuli ozona, v stanju a-hibridizacije in kot je blizu. Usmerjena pravokotno na ravnino molekule, orbitalni atom žvepla ne sodeluje pri hibridizaciji. Zaradi teh orbital in podobnih usmerjenosti orbitale kisikovih atomov se tvori tritočkovna vez; elektronski par, ki ga nosi, pripada vsem trem atomom molekule.
Žveplov dioksid se uporablja za proizvodnjo žveplove kisline, prav tako (v veliko manjših količinah) za beljenje slame, volne, svile in kot razkužilo (za uničevanje plesni v kleti, kleti, vinski sodi, posodi za fermentacijo).
Žveplova kislina je zelo krhka spojina. Znano je samo v vodnih raztopinah. Ko poskušamo izolirati žveplovo kislino, se razgradi v vodo. Na primer, kadar koncentrirana žveplova kislina deluje na natrijev sulfit, se namesto žveplove kisline sprosti žveplov dioksid:
Raztopino žveplove kisline je treba zaščititi pred zrakom, drugače pa, absorbira kisik iz zraka, počasi oksidira v žveplovo kislino:
Žveplova kislina je dobro redukcijsko sredstvo. Na primer, prosti halogeni se obnovijo z vodikovimi halidi:
![]()
Vendar lahko pri medsebojnem delovanju z močnimi reducenti vloga oksidacijskega sredstva igra žveplova kislina. Torej njegova reakcija z vodikovim sulfidom poteka predvsem po enačbi:
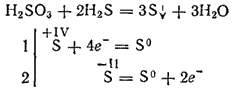
Žveplova kislina, ki je dibazična, tvori dve vrsti soli. Njegove srednje soli se imenujejo sulfiti, kisle soli - hidrosulfiti.
Kot kislina so reducirna sredstva tudi sulfiti in hidrosulfiti. Ko se oksidirajo, dobimo soli žveplove kisline.
Sulfiti najbolj aktivnih kovin med kalcinacijo se razgradijo z nastajanjem sulfidov in sulfatov (samo-oksidacijska reakcija - samo-redukcija):
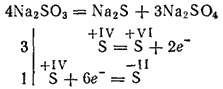
Kalijev in natrijev sulfit se uporablja za beljenje nekaterih materialov v tekstilni industriji za barvanje tkanin, v fotografiji. Raztopina (ta sol obstaja samo v raztopini) se uporablja za obdelavo lesa v tako imenovano sulfitno celulozo, iz katere nato dobimo papir.
Sulfurousna kislina lahko reagira s kisikom. To tvori žveplovo kislino. Ta reakcija traja zelo dolgo in je možna le, če so kršena pravila shranjevanja. Žveplova kislina ima tako oksidativne kot reduktivne lastnosti. S svojo pomočjo lahko dobite halogenske kisline. Vodna raztopina pri reagiranju s klorom tvori klorovodikovo in žveplovo kislino.
Ko reagira z močnimi reducenti, ima sulfurna kislina vlogo oksidacijskega sredstva. Ena od teh snovi je vodikov sulfid, plin z zelo neprijetnim vonjem. V interakciji z vodno raztopino žveplove kisline tvori žveplo in vodo. Soli žveplove kisline imajo tudi redukcijske lastnosti. Razdelijo se na sulfite in hidrosulfite. Oksidacijske reakcije teh soli proizvajajo žveplovo kislino.
Proizvodnja žveplove kisline
Žveplovo kislino tvori le interakcija žveplovega dioksida in vode. Potrebuješ kisli plin. To lahko naredimo z bakrom in žveplovo kislino. Nežno vlijte koncentrirano žveplovo kislino v epruveto in vstavite kos bakra. Cev segrejemo z žarnico.
Kot posledica segrevanja nastane bakrov sulfat (bakrov sulfat), voda in žveplov dioksid, ki ga je treba s pomočjo posebne cevi pripeljati do stožca. čisto vodo. Na ta način lahko dobimo žveplovo kislino.
Ne pozabite, da je žveplov dioksid škodljiv za ljudi. Povzroča poškodbe dihalnih poti, izgubo apetita in glavobol. Daljše vdihavanje lahko povzroči omedlevico. Pri delu z njim je potrebna previdnost.
Uporaba žveplove kisline
Žveplova kislina ima antiseptične lastnosti. Uporablja se pri razkuževanju površin, fermentaciji zrn. Uporablja se lahko za beljenje nekaterih snovi, ki se razpadejo, ko reagirajo z močnimi oksidanti (npr. Klor). Takšne snovi vključujejo volno, svilo, papir in nekatere druge. Njegove antibakterijske lastnosti se uporabljajo za preprečevanje fermentacije vina v sodih. Tako lahko plemenito pijačo hranimo zelo dolgo časa in pridobimo plemenit okus in edinstveno aromo.
Žveplova kislina se uporablja pri proizvodnji papirja. Dodatek te kisline je vključen v tehnologijo proizvodnje sulfitne celuloze. Nato ga obdelamo z raztopino kalcijevega hidrosulfita, da se vlakna vežejo skupaj.
