Na amorfnem silicijevem dioksidu. Silicijev dioksid.
SILIKON DIOKSID (silicijev dioksid) SiO2, bestsv. kristalne, amorfne ali steklaste snovi.
Struktura SILICA DIOKSID d. Obstaja več polimorfnih sprememb (glej tabelo). Prehodne temperature pri normalnem tlaku: a-kvarc D b-kvarc 575 ° C (DH 0 prehod 0,41 kJ / mol), p-kvarc D p-kristobalit 927 ° C (2,26 kJ / mol), p-kvarc D g -tridimit 867 ° С (0,50 kJ / mol), a-tridmmit D b -tridimit 115 ° С (0,27 kJ / mol), b -tridimit D g -tridimit 160 ° S (0,15 kJ) / mol), g -ditimit D b-kristobalit 1470 ° С (0,21 kJ / mol), a-kristobalit D b-kristobalit 270 ° S. Tališče p-kvarca je 1610 ° С (D H 0 mp 8,53 kJ / mol), g-tridimit 1680 ° S, b -kristobalit 1723 ° C (D H 0 pl 9,6 kJ / mol). Polimorfne transformirane kvarce, tridimite in kristobalite spremlja sprememba volumna. Kristalne oblike SILIKON DIOKSIDA so zgrajene iz tetraedrov SiO 4, a- in b-oblike pa se odlikujejo po rahlem premiku in rotaciji tetraeder. Za tridimite pri nizkih temperaturah so podani tudi podatki za druge kristalne kristale. vse spremembe vsebujejo b-tremitit kot glavno strukturno enoto, vendar so različno izkrivljene. Opisani so npr. Triklinski in monoklinski tridimiti. V naravi najdemo tudi kubične. SiO2 modifikacija - melanflogit (a = 1,3402 nm, z = 48, prostorska skupina Pt3p). Pri visokih tlakih se tvorijo kiti (80-130 MPa, 400-500 ° C), koezit (1,5-4 GPa, 300-1700 ° C), stishovite (16-18 GPa, 1200-1400 ° C). Stishovit je edina sprememba SILIKON DIOKSIDA, zgrajena iz SiO 6 oktaeder. Stabilnost tridimita je verjetno določena z nečistočami Na in Al. Nestabilna oblika silicija DIOXIDd. - rombo-dipiramidni "vlaknasti silicijev dioksid". Poleg kristaliničnih kristalov ima lahko SILICON DIOXIDE tudi druge oblike obstoja. Skrit kristal oblike (kalcedon) so po strukturi podobne kvarcu. Pri ekstrakciji kationov iz določenih silikatov s kislino dobimo hidrat. kristal, silicijev dioksid. Podedujejo teksturo izvornih mineralov in tvorijo vlaknaste, luskaste (lepidoidne) in listaste strukture. Znane so amorfne anizotropne in izotropne (opalne) formacije, fini naravni silicijev dioksid (tripoli, sintetični koloidni silicijev dioksid in silicijev prah). Hidrat amorfnega silicijevega dioksida, oborjenega iz raztopin Na silikata itd., polimeriziranega v kroglico. delci s premerom manj kot 100 nm, običajno 2-3 nm. Prejel amorfni silicijev dioksid v obliki lističev, trakov in vlaken (glej Silikagel). Pri visokih temperaturah se iz plinske faze sprosti fini prah pirogenega brezvodnega silicijevega dioksida - Aerosil in drugi. O steklastem kremenu, glej, kremenovo steklo.
Lastnosti Parni tlak SILICON DIOXIDE, 13,3-133 Pa, v bližini tališča. SILICA DIOXIDED. - dielektrik, r 10 12 Ohm * m (20 ° S), 9 * 10 - 1 Ohm * m (1600 ° C). Monokristali A-kvarca imajo kiralno strukturo, ki določa njihovo optično aktivnost in piezoelektriko. lastnosti. Kvarc je transparenten za UV in delno IR žarke.
Za klinično sliko akutne silikoze je značilna kratka sapa, ki se hitro poslabša, kaheksija, kronični znaki pljučnega srca in histološka alveolarna proteinoza. Pri akutni silikozi pljučna fibroza ni potrebna. X-ray najde polnitev zračnega prostora v različni meri, zaradi česar je slika "kondenzacije" ali "motnega stekla", ki je primerna za diferencialno diagnozo idiopatske alveolarne proteinoze, radiološkega, hemoragičnega alveolitisa, pljučnice, akutnega pljučnega edema.
* Refrakcijski indeksi: N g - več, N p - manj. ** a - in b-kvarc imata dva presledka. kot pri obeh oblikah so možni levi in desni optični izomeri. *** b -120 ° C.
Topnost α-kvarca v vodi je 10–3 mas.% (25 ° C), amorfne oblike silicijevega dioksida so 0,007–0,015% (za vodne raztopine SiO2 glejte Silikatne kisline). Topnost silicijevega dioksida v kislem in alkalnem mediju je določena z naravo topila. SILICA DIOKSID d. Netopen v večini organskih topil. Reagira s fluorovodikovo kislino in tvori fluorosilikatno kislino. Pri 250-400 ° C interakcijo s plinastim HF, F 2 (ki daje SiF 4) pri 200-250 ° C - z NH4HF2. V mešanici s premogom reagira s Cl 2 pri segrevanju in tvori SiCl 4. Amorfni silicijev dioksid se počasi topi v vodnih raztopinah alkalij, Na 2 CO 3 (daje silikate) in NH4F (ki tvorijo fluorosilikate), hitrost raztapljanja pa narašča z naraščanjem tlaka in temperature. Ko se mešanice praškastega silicijevega dioksida segrejejo z različnimi oksidi, se tvorijo silikati, in ko so taljeni z Na2C03 in Na2S04, je vodotopni natrijev silikat (glej tudi topno steklo).
Distribucija v naravi. Vsebnost prostega silicijevega dioksida v zemeljski skorji 12%; vključena je tudi v skale v obliki različnih silikatov ali v obliki zmesi z drugimi minerali (graniti). Kremen je eden najpogostejših mineralov: tridimit, kristobalit, lschatelit (naravno kremenovo steklo), kalcedon, opali so veliko manj pogosti. Majhni, drugače usmerjeni kristali kremena tvorijo "kremen". Z uničenjem kamnin nastanejo kremenovi peski, katerih zbijanje povzroči nastanek peščenjakov in kvarcitov. Haib čisti kremen je rock kristal, katerega kristali lahko dosežejo nekaj metrov in tehtajo več deset ton. Posamezni kristali kremena so prozorni, brezbarvni (kamniti kristali) ali barvani z nečistočami v vijolični (ametist), črni (marion), rumeni (citrin), dimni (rauch-topaz) barvi. Vrste kriptokristala. kremenove oblike: rožnato-rdeči karneol, modrikast safirin, jabolno-zelena krizopraza, trakovi agati in oniksi, fino obarvani jasper, silicij in hornfelsi. Wiikalen amorfni "plemeniti" opal, sestavljen iz homogenih koloidnih delcev s premerom 0,1-0,3 μm, tesno pakiran v urejene aglomerate; vsebnost vode je manj kot 1 mas.% (pri večini običajnih opalov 4–9%). Prir. usedline silicijevega dioksida tvorijo tudi tripoli, diatomit itd. Lupine diatomej in okostnja nekaterih spužev so zgrajene iz kremena; krepi stebla rastlin - preslice, bambus, trs, je v slami. SILIKON DIOKSID je odgovoren za silikatizacijo oblik živih rastlinskih organizmov. Koncentracija silicijevega dioksida v človeški krvi in plazmi je 0,001 mas.%.
Prejem. Sintetično SILIKON DIOKSID d. Sprejem: delovanje kislin (H2SO4, HCl, CO 2) na Na silikat, manj pogosto na druge topne silikate (glavni način proizvodnje v kapitalističnih državah); iz koloidnega silicijevega dioksida s koagulacijo pod delovanjem ionov Na +, NH 4, F - ali z zamrzovanjem; hidroliza SiCl4, SiF4, (NH4) 2SiF6, (C2H5O) 4Si v vodnih raztopinah amoniaka in vode (včasih z dodatkom etanola ali organskih baz) in v plinski fazi. Amorfni silicijev dioksid D. Dobimo ga tudi iz tripolija in diatomejske zemlje s sežiganjem riževe luščine in mletjem taline kremenovega peska. Brezvodni praški silicijevega dioksida z visoko specifično površino se pridobijo s kemičnim nanašanjem s paro s sežiganjem pare SiCl 4 v zmesi H 2 in O 2 (aerosil, v ZDA - Cabosil), oksidirajočih in hidroliznih parih estrov Si (penjeni silicijev dioksid) in tudi SiF4 (fluosil). Prvotno kondenzirani delci SILICON DIOXIDE, premera 1 nm, so gosto pakirani v sekundarnih konglomeratih, združeni v ohlapno strukturo s specifično površino 200-400 m2 / g. Samokristali A-kvarca se pridelujejo iz alkalnih raztopin SILICON DIOXIDE v visokotlačnih avtoklavih (35-120 MPa) pri 300-420 ° C (glej Hidrotermalni procesi). Pri proizvodnji materialov, uporabljenih v tehniki na osnovi SILICON DIOXIDE, se uporabljajo naslednji postopki:
- kemično odlaganje iz plinske faze pri gorenju SiCl 4 pri visoki temperaturi, predhodno prečiščeno z destilacijo. Delci SILIKON DIOKSIDA, ki nastanejo v plamenu ali plamenu s kisikom-vodikom, se oborijo in tako dobijo masivno kremenovo steklo ali plasti predoblik optičnih vlaken;
- površinska oksidacija z enim kristalom. Si z nastankom heterostruktur (pri izdelavi integriranih vezij);
- sintranje finega silicijevega dioksida v kvarčni keramiki (glej tudi keramika);
- sol-gel proces, vključno s hidrolizo organske spojine Si, počasna dehidracija oblikovanega gela in zmerno segrevanje. Uporablja se za izdelavo kremena in visoko silikatnega stekla;
- pridobivanje visoko čistih SILIKON DIOKSIDA in poroznih stekel (tip Vicore) s termodinamično obdelavo vodilnega borosilikatnega stekla, izpiranje s kislino in izpiranje kremena.
Prir. Silicijev dioksid se uporablja pri izdelavi silikatnih stekel, porcelana in lončenine, abrazivov, betona, silikatnih opek, Dinasa in keramike. Sintetično SILIKON DIOKSID d. ("Bela saja") - polnilo v proizvodnji gume (do 70% proizvedenega SILIKON DIOKSIDA d.). Zmagali smo. uporabimo oborjeni hidrat. silicijev dioksid (ki vsebuje 85-95% SiO 2) s specifično površino 60-300 m2 / g, v manjši meri - brezvodni silicijev dioksid aerosila. Aerosil je tudi adsorbent v kromatografiji, zgoščevalnik maziv, lepil, barv, Quartz monokristali se uporabljajo v radijski tehniki (piezoelektrični. spektrografi, monokromatorji, leče za UV-optiko itd.), v nakitu (prozorne, lepo obarvane sorte - poldragi kamni). Kot matriks uporabljamo silikagele z efektivnim premerom por 2-15 nm. sorbenti in nosilci katalizatorjev. Sintetično SILIKON DIOKSID in kamniti kristali so surovina za proizvodnjo monokristalov kvarca, kremenovega stekla, keramike in kvarčnih vlaken. Kremenovo steklo in keramika - konstrukts. material v letalih. industrija (npr. za okna in okenske letve), v optiko (za vhodna okna, optične naprave iz UV in IK razponov), v elektroniko (zakasnitvene linije) itd. Kvarčna tkanina je toplotnoizolacijski material. Kvarčna vlakna se uporabljajo za izdelavo optičnih (svetlobnih) komunikacijskih vodov in sistemov za prenos informacij. Proizvodnja sintetičnih SILIKON DIOKSID d. države 600-700 tisoč ton / leto (1980). Ko SILIKON DIOKSID vstopi v živo tkivo, se granulomi počasi razvijejo. Silicijev prah povzroča draženje na vrhu. dihanje načinov in bronhijev, bolezni prebavil, s podaljšanim vdihom - resna bolezen - silikoza pljuč. MPC pri vsebnosti SiO 2 v prahu sv. 70% - 1 mg / m 3, 10-70% - 2 mg / m 3, 2-10% - 4 mg / m 3.
Pljučna funkcija: omejevalna disfunkcija, spremenjen alveolokapilyarnogo prenos. Izdelana je diferencirana diagnoza akutne silikoze: alveolarna proteinoza, idiopatski hemoragični alveolitis, pljučnica, pljučni edem. Povezava med silikozo in tuberkulozo zahteva aktivni tuberkulozni proces.
Kronična obstruktivna bronhopneumopatija. Najpogostejša povezava med silikozo in revmatoidnim artritisom je povezava, ki opredeljuje Kaplanov sindrom. Erasmusov sindrom je asociacija silikoze-skleroderme. Enostavna neoplazma. Silikozni zapleti zapleti respiratornih okužb, kronični bronhitis, emfizem, pnevmotoraks, respiratorna odpoved, kronična pljučna bolezen srca.
Fizikalne in kemijske lastnosti aerosila (silicijevega dioksida) \\ t
Aerosil (od latinske besede Aerosilum), oksili (od latinske besede - Oxylum) silicijev dioksid, Silica colloidalis anhydrica (Ph. Eur.), Koloidni silicijev dioksid (USP), Koloidni brezvodni silicijev dioksid (BP), Kremen (CAS št. 7631-86-9) - brezvodni amorfni silicijev dioksidspada v skupino sintetičnih aktivnih visoko razpršenih mineralnih polnil. V farmaciji se Aerosil (silicijev dioksid) uporablja kot pomožna snov, stabilizator, gelirno sredstvo, adsorbent, izboljša fluidnost tablet, mazila, gela in drugih zmesi. Včasih se silicijev dioksid uporablja kot aktivna farmakološka sestavina (ima antibakterijske lastnosti, razstrupljenost, sorbent).
Radiogrami so standard za pljučne vezi, pnevmokonioza je organizirana v klinikah za poklicne bolezni. Simptomatsko zdravljenje: kliničnih manifestacij v zgodnjih fazah ni, zato se simptomatsko zdravljenje uporablja na koncu začetka, kompleksno in vključuje zdravljenje z antibiotiki, bronhodilatatorji, GCS, fluidizacijo in izkašljevanjem, izkašljevanje, anti-tuberkulozo, diuretike, inotropne snovi in digitalise, blokatorje vazodilatatorji kalcijevih kanalov.
Preprečevanje infekcijskih zapletov: kirurško zdravljenje akutnih okužb dihal; Kemotrofilaksija tuberkuloze je koristna za preprečevanje tuberkuloze in preprečevanje ponovitve bolezni pri bolnikih s silikozo tuberkuloze, gripe in imunizacije s polisaharidi pnevmokoka.
Pojdi silicijev dioksid s hidrolizo parih silicijevega tetraklorida v vodikovem plamenu pri temperaturi\u003e 1000 ° C (1100-1400 ° C). Dobljeni produkt je bele barve, amorfne, neporozne, praškasto razpršene, ki vsebujejo 99,3% Si02; ima visoko disperzijo (premer delcev 4-40 mikronov, ima sferično ali skoraj sferično obliko), specifična adsorpcijska površina je 50-450 m2 / g; volumenski volumen je okoli 50 g / l, gostota - 2,36 g / cm3; pH vodne suspenzije je 4,0; lomni količnik n20D = 1,46. Aerosil se ne raztopi v vodi, kislinah in razredčenih alkalijah. Pri koncentraciji aerosila v vodi v količini 10-12% se tvori suspenzija z nizko viskozno tekočino, pri 17% - poltrdna masa pri 20% - groba masa, ki se ob utenju spremeni v homogeno maso, ki je podobna mazilu. Zaradi visoke afinitete za vodo se aerosil imenuje hidrofilne snovi. Toda silicijev dioksid (aerosil) znamke R972 ima hidrofobne lastnosti.
Drugi koristni ukrepi so ozdravljeni, kajenje ni priporočljivo, zmanjšanje vnosa soli, prehrana z visoko vsebnostjo beljakovin. Hunter Veche, Bukarešta. Je v trdnem stanju in je eden od najbolj bogatih mineralov na Zemlji, ki je glavna sestavina peska. Silicijev dioksid lahko obstaja v kristalni ali amorfni obliki. Oblike silicijevega dioksida se običajno širijo kot vulkanska lava. Kristalne oblike silicijevega dioksida s krčenjem z amorfnimi oblikami imajo veliko manjšo odpornost na nečistoče.
Obstaja več blagovne znamke Aerosil (silicijev dioksid)ki se večinoma razlikujejo po specifični površini, stopnji hidrofilnosti ali hidrofobnosti, kot tudi prisotnosti drugih polnilnih snovi. V skladu z opredelitvijo komisije za nomenklaturo se amorfni silicijev dioksid imenuje oksid. V Ukrajini kemični in metalurški obrat, ki ga je licenciral Degussa, proizvaja nespremenjen standardni aerosil 175 razredov; 300 380 s hidrofilno površino; Metil-arosil AM-1/175 in AM-1/300, modificiran dimetildiklorosilan; eter organosilicus blagovnih znamk ADEG-175 in ADEG-300, modificirane z etilen glikolom in dietilen glikolom, in AM-2, modificirane z amino alkoholi. V ZDA se proizvaja modificirani aerosil - organosil in kebosil (Cabot), v Rusiji, butosil, aerosil-K, ki je kombinacija 85% kremena in 15% škroba, COK-84 aerosil, ki je koagulant 85% silicija in 14% amonijevega oksida. V Nemčiji proizvaja podjetje "Degussa" hidratizirane znamke aerosilki vsebujejo vezano vodo (durosil, vulkasin, sifloks, ultrasil, itd.), ki se razlikujejo po vsebnosti SiO2, premeru delcev, gostoti in lastnostih), aerosil v obliki suspenzij (K-314, vsebuje 14% A., K-328, vsebuje 28% A.). Na Japonskem se mikrosil proizvaja in nosi v Franciji - Francil, v Angliji - Manosil. Za kozmetiko lahko naredimo v obliki paste. Pred kratkim je bil aerosil uveden v farmakopejo različnih držav (Madžarska, Danska, Avstrija itd.). V ZDA je silicijev dioksid (aerosil) dovoljen tudi kot dodatek živilskim proizvodom v višini 2%.
Organski in mineralni silicijev dioksid se v človeškem telesu pojavlja v njegovi naravni obliki in je vsebovan v različnih količinah surove zelenjave, rastlin in žit. Ima visoko trdoto. Pogosto: amorfna oblika silicijevega dioksida se raztopi v alkalijah. Aventurin - Rosiatik. Zaradi nečistoč je citrin rumena. Kristalna oblika je zelo pomembna sestavina zelo velike količine mineralov in dragih kamnov. 9 - Ker ima nizek koeficient toplotnega raztezanja. Je čista in bela v obliki prahu.
Je zelo odporen na temperaturne spremembe in se lahko uporablja v delih, ki so izpostavljeni tako vročini kot hladu. V laboratoriju iz stekla iz kvarca je skoraj nepogrešljiv. Predmeti umetnosti. In za vse težave s kožo je to prava rešitev. Proizvodnja detergentov. Ali filtrirajte ultravijolično sevanje. Pomen: Andy Sintetični silicijev dioksid se uporablja pri izdelavi barv. Silica deluje na vse vnetne procese. Kot električni izolator.
Aerosil pripisati teoriji "čistih" snovi, ki sproščajo aktivne sestavine brez stroškov energije. Elektronsko mikroskopske študije so pokazale, da je vsak osnovni del aerosila sestavljen iz štirih ločenih plasti (slika). Jedro tega delca je tridimenzionalni polimer elementov SiO2. S silan Si-OH in siloksan Si-O-Si skupine na površini delcev, Aerosil je sposoben ustvariti vzorec podobno ogrodje zaradi vodikove vezi, ki omogoča omejevanje toplotnega raztezanja gelled tekočine. Skupine siloksana in silana v aerosilu so funkcionalne, silicijevo-kisikova vez pa je značilna visoka trdnost (doseže 372,5 J / mol), kar je pojasnjeno z njegovo polarnostjo, zaradi katere se kovalentna vez približa ionski vezi.
Uporablja se tudi v kozmetični industriji. jezera V metalurgiji. Pridobivanje silicija Silicijev dioksid z različnimi reducenti. Tako dobimo nečisti silicij. Reakcija je zelo eksotermna. Uporablja električno peč z grafitnimi elektrodami. Nastali silicij je tako rafiniran ali silanski triklor. Pretvori se surovi silicij ali ferosilicij. Nastali silicij se raztopi v presežku staljenega aluminija, kontaminiranega z magnezijevim silicijem. S tem postopkom se na enem koncu silikonske skorje, ki jo je treba obdelati, zbirajo nečistoče.
Tabela - Glavne lastnosti silicijevega dioksida (Aerosil)
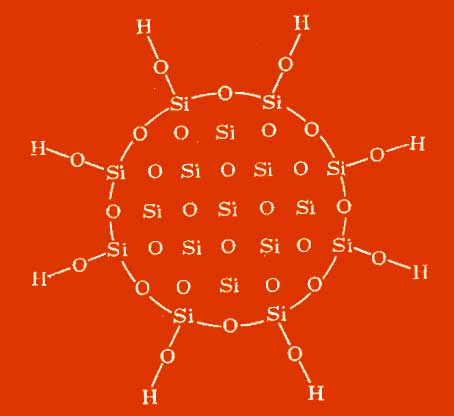
Slika Struktura prostorske mreže Aerosila v hidrogelu
Silanolne skupine so neenakomerno porazdeljene. Obstajajo površinske silanske skupine, ki so lahko proste ali povezane z vodikovimi mostovi, in silanolne skupine v molekuli, ki so lahko med seboj povezane tudi z vodikovimi mostovi. Kot rezultat se ustvari razvejana masa strukture, tako da se aerosil imenuje anorganski polimeri. Siloksanske skupine imajo hidrofobne lastnosti, stabilne so (OH silanolne skupine se ločijo pri temperaturi\u003e 300 ° C), povzročajo kislo reakcijo; imajo hidroksilne skupine na površini in v notranjosti Aerosil molekule. Pri enakomerni porazdelitvi ima vsak drugi silicijev atom na površini hidroksilno skupino.
Elektroliza vode se izvede z vnašanjem baze v vodo. Naprava, ki se uporablja za elektrolizo, se imenuje električar Coleman. Naprava za elektrolizo vode je sestavljena iz: - elektrolize, kjer poteka elektroliza. - grafitni elektroliti, ki imajo posebna imena: anodna ali pozitivna elektroda in katodna ali negativna elektroda. Po koncu verige je kislina ali elektrolit ali elektrolit. - dobra električno prevodna raztopina. Ne prehaja skozi čisto vodo, alkalijo ali sol, vendar ne sodeluje v reakciji.
V proizvodnji stekla se uporablja silicijev dioksid. V anodi se proizvaja tudi kisik. Elektroliza je lastnost nekaterih snovi, da se razgradijo s pomočjo električnega toka, ki deluje kot katalizator. Toda dolgo pred pojavom. Raziskovalci so lahko pridobili podatke. Odkritje kisika: kisika so odkrili Karl Wilhelm Scheele in Joseph Priestley. Pridobivanje vzorcev primarnega kisika lahko pomaga raziskovalcem ugotoviti, kako so se nebesna telesa razvila na različne načine. Kisik-17 in kisik - po tem, ko se je kapsula Biti porušila v puščavi Utah.
To povzroča tri vrste interakcij aerosila: fizikalno adsorpcijo, kemično adsorpcijo (tvorbo vodikovih mostov s silanolnimi skupinami z vodo, alkoholi, kisline in druge snovi) in kemične reakcije na površini molekule. Zato silanolne skupine medsebojno delujejo z alkoholi, da tvorijo etre.
Aerosil (silicijev dioksid) ima dobre sorpcijske lastnosti, absorbira od 15 do 60% različnih tekočin, odvisno od njihove narave, brez spreminjanja videza in pretočnosti praška. Prvi sloj vode absorbira aerosil zaradi ustvarjanja vodikovih mostov (kemična adsorpcija), naslednje plasti pa so posledica fizikalne adsorpcije. Fizično adsorbirana voda se sprosti pri temperaturi 25-150 ° C, medtem ko se kemično adsorbirana voda sprosti pri 800 ° C.
Beseda "kisik" torej pomeni proizvajalca kisline. Odkritje je zelo pomembno za obnovitev razvoja nebesnih teles v bližini Zemlje. Toda vzrok sprememb v različnih delih sončnega sistema ni znan. Becher razkriva, da kremen vsebuje novo zemljo in nato silicij. Ime, ki ga je predlagal Lavoisier, izhaja iz napake velikega kemika, ki je verjel, da vse kisline vsebujejo kisik. Antoine Lavoisier očiščenemu zraku podari novo ime. Odkril je prisotnost plina. Kemijske lastnosti: Ricky 6 milijard let.
V letu, neodvisno drug od drugega. H. se je zdel izgubljen. Zbiranje vzorcev kisika iz periferije našega sončnega sistema. Luna in meteoriti imajo tri različne izotope. Silikati se že od samega začetka človeške civilizacije uporabljajo v keramiki. Fokusiranje s solarno lečo. Kremen je praktično netopen v vodi ali kislinah, z izjemo reakcije fluorovodikove kisline, v kateri se sprosti silicijev tetrafluorid s formulo. Še posebej je amorfna oblika silicijevega dioksida topna v alkalijah.
Aerosil, ki se uporablja za proizvodnjo zdravil, mora biti visoke čistosti. Tabela 1 prikazuje kemijsko sestavo različnih blagovnih znamk Aerosila, ki imajo lahko določene nečistoče, ki nastanejo med proizvodnimi postopki, na primer sledovi klorovodikove kisline, ki povzroči pH 4% vodne suspenzije polimera (3.6-4.3). Aerosil (silicij) se obnaša kot šibka kislina.
Oblikuje zrak samo pri izredno visokih temperaturah. Silicij je prekrit z zaščitnim slojem. Pri normalni temperaturi silicij ne reagira z zrakom. Nastanek natrijevega silikata. Silicum je v travi. Z drugimi besedami, biti ustrezno obveščen, ne samo obveščen.
Morda bi bilo lažje razumeti, za začetek, kakšen gradbeni material. Tukaj so rezultati raziskav. Najdemo jih skupaj. Smo sredi poletja, zato želimo, da je vroče dni lažje prenašati. Enostavno in prosto hlajenje z notranjim zrakom.
Tabela 1 - Kemična sestava različnih vrst aerosila (glede na suho snov, po MM Astrakhanov)
| Vsebina% | Aerosil blagovne znamke, sestava,% | ||||
| 200; 300; 380 | 0 | SOK84 | R972 | Kombinirano | |
| SiO2 | >99,87 | >99,8 | 82–86 | >98,3 | 85 |
| Al2O2 | 14–18 | – | |||
| Fe2O3 | – | ||||
| TiO2 | – | 0,03 | – | ||
| Na2O | – | – | – | – | |
| Kot | – | – | – | – | |
| B2O3 | – | – | – | – | |
| Bi2O3 | – | – | – | – | |
| P2O5 | – | – | – | – | |
| HCl | – | 0,05 | |||
| Škrob | – | – | – | – | – |
Tabela 2 prikazuje najpomembnejše fizikalno-kemijske lastnosti različnih znamke aerosilki se pogosto uporabljajo v proizvodnji zdravil
Upamo, da bodo vse zgoraj navedene informacije koristne, ko se boste odločili za gradnjo hiše, in boste v postopku izbire materialov. Zanimivo je v tem primeru, da ta dezinfekcijski učinek povzročajo in celo dozirajo bakterije. Diagram prikazuje dezinfekcijski učinek srebrovih nanodelcev in kalcijevega fosfata na plastični foliji.
Iz tega razloga so bogate družine uporabljale srebrni srebrni jedilni pribor, ki je imel protibakterijski učinek, revnejši svet pa je uporabil metodo uvajanja srebrnih kovancev v skledo za mleko. Dve stoletji se je v medicini uporabljalo srebro, preden so se pojavili antibiotiki in dolgo časa uporabljali le v alternativni medicini. Od začetka obdobja nanotehnologije ta plemenita kovina doživlja resnično renesanso v medicini. Medicinska oprema in proteze, bolnišnično pohištvo ali celo bolnišnično pohištvo so oblečeni, zaviti ali obogateni z njimi.
Tabela 2. Fizikalne in kemijske lastnosti različnih znamk aerosila
| Kazalnik | Žigi aerosila | |||||
| 200 | 300 | 380 | 0 | SOK-84 | R-972 | |
| Specifična površina, m2 / g | 200 ± 25 | 300 ± 30 | 380 ± 30 | 200 ± 25 | 170 ± 30 | 120 ± 30 |
| Izgube med vžigom,% | 1 | 2 | 2,5 | 1 | 1 | 2 |
| Povprečna velikost delcev | 12 | 7 | 7 | 12 | – | 16 |
| Vsebnost vlage,% (posušeno pri 105 ° C) | – | 1,5 | 1,5 | 1,5 | 0,5 | 2,5 |
| Nasičena teža, g / l, stisnjena (standardna) | ≈60≈120 | |||||
| Poroznost | Porozna | Neporozen | ||||
| pH 4% vodne disperzije | 3,6–4,3 | – | – | 3,6–4,3 3,5–4,1 (v metanolu) |
||
V proizvodnja zdravila Aerosil Uporablja se kot stabilizator za suspenzijsko olje. Ima visoko sposobnost adsorbiranja različnih tekočin. Dodajanje aerosila sestavi olja in vodno-alkoholno-glicerolnih suspenzijskih linimentov povečuje sedimentacijo, agregacijo in agregatno stabilnost teh sistemov, kar ustvarja dovolj močno prostorsko strukturo, ki lahko zadrži imobilizirano tekočo fazo z suspendiranimi delci farmacevtskih snovi v celicah. V vodnih in vodno-alkoholnih suspenzijah je stabilizacijski učinek aerosila predvsem posledica elektrostatičnih sil. Sedimentacija delcev trdne faze v stabilizirani vodno-alkoholni suspenziji se pojavi 3-krat počasneje kot v nestabiliziranih sistemih. Stabilizacijski učinek aerosila se poveča v prisotnosti majhne količine površinsko aktivne snovi, na primer Tween-80. Prisotnost aerosila (v koncentraciji 1,0–5,0%) v emulzijah in suspenzijah povečuje njihovo stabilnost, sposobnost boljše fiksacije na koži in učinkovitost terapevtskega delovanja. Z vodo in alkoholom silicijev dioksid v koncentraciji 3% ustvarja motne opustitve, katerih deleži imajo negativen strošek.
Substrat za dovajanje aktivira mehanizem. V času te znanstvene komunikacije ni bilo mogoče uporabiti natančne in dozirane plemenite kovine. Ključni dejavnik je, da bakterije uporabljajo kalcij za podporo njihovega presnove. Delci kalcijevega fosfata v razponu od 20 do 50 nanometrov absorbirajo mikroorganizmi kot hrano in se zato razgradijo. V tem procesu se oddajajo na tisoče majhnih srebrnih delcev od 1 do 2 nanometra, ki so jih raziskovalci uporabili na osnovi kalcijevih hranil.
Kolikor vemo, nanodelci srebra različno delujejo na bakterije: preprečujejo prenos hranil v celico, napadajo celično membrano in motijo delitev celic in implicitno kalijo. Testi z uporabo kalcijevega fosfata in silicijevega dioksida, od katerih je vsak prevlečen s srebrom, so pokazali različne učinke na različne vrste bakterij v testih. Podpora za kalcijev fosfat je do 1000-krat bolj intenzivna kot kremen. Ker poraba kalcijevega fosfata, po mnenju raziskovalcev, hranijo tudi bakterije - ne da bi povečali količino srebra v 24 urah s faktorjem tisoč - se srebro ne bi smelo boriti le z obstoječimi bakterijami, ampak tudi z novo nastalimi. »Zato je učinek še toliko bolj osupljiv,« pravi Wendelin Stark.
Ena od lastnosti Aerosila je njegova sposobnost zgostitve (zgostitve) (tabela 3).
Tabela 3. Zgoščevalni učinek Aerosil-200
Ta lastnost se uporablja za pridobivanje aerosil-vsebujočih gelov in mazilnih baz, ki vključujejo aerosil. Kot tekočo fazo za njihove sestavke uporabimo polietil-siloksansko tekočino pod imenom Esilon-5 ali Esilon-4, ribje olje, PEG-400, ricinusovo olje, maščobna olja ipd. Esilon-5 je zgostil 16% aerosila, znanega kot vazelin KV-E / 16, ne draži kože in ne preprečuje absorpcije zdravilnih učinkovin. Uporablja se tekoča faza zgostitve aerosil (silicijev dioksid) v višini 8-16%. Nastali geli imajo mehko plastično konsistenco, dobro so porazdeljeni in pritrjeni na kožo. Imajo dobro koloidno stabilnost pri povišanih temperaturah (≥ 40 ° C), ohranijo potrebno konsistenco, ki se ne spremeni niti pri 100 ° C, zato se lahko geli in mazila, ki vsebujejo aerosil, uporabljajo v tropskih podnebjih. Glede na strukturne in mehanske lastnosti gelov, ki vključujejo aerosil, so tiksotropni plastični termostabilni sistemi in imajo antimikrobno odpornost. Kvantitativna vsebnost aerosila v sistemu vpliva na reološke in biofarmacevtske lastnosti gelov. Povečanje silicijevega dioksida v sestavi gelov vodi do povečanja njihove plastične viskoznosti in tiksotropnih lastnosti, medtem ko znatno upočasni sproščanje aktivne farmakološke sestavine.
Zahvaljujoč novemu izdelku je skupina, ki jo je vodil g. Starck, lahko razvila učinkovito zdravilo proti številnim patogenim bakterijam, ki so aktivne v pravih in pravih odmerkih le, če obstaja bakterija. Kalcijev fosfat, ki ga oksidira kalcijev fosfat, se sprosti le v ustrezni količini, ki jo bakterija porabi iz kalcijevega fosfata. Ta metoda prihrani stroške, pokaže učinkovitost in je manj zahtevna za človeško telo. Film se lahko uporablja, na primer, v bolnišnicah, v nevijoličnih točkah z vidika prenosa zarodka.
Uporaba aerosila (silicijevega dioksida) v medicinski in veterinarski farmacevtski industriji
Aerosil se uporablja pri izdelavi tablet. v koncentraciji 0,1-0,5% kot drsna in rahla (0,1-2,0%) snov, ki skrajša čas njihovega razpadanja, olajša proces granulacije, izboljša fluidnost tablične mase. Adsorpcijske lastnosti Aerosila se uporabljajo pri proizvodnji praškov, ekstraktov in drugih farmacevtskih pripravkov.
Vrata, postelje ali sanitarne prostore, v katere je pritrjen samolepilni film, lahko pomagajo bolnikom z groznimi in nevarnimi patogeni mikrobi v bolnišnicah, kar lahko privede do zapletov pri posredovanju operaterja. Zamenjati jih je treba v rednih časovnih presledkih, ker bakterija uživa kalcij, zato folija nima neomejenega učinka.
Večina orodij za ocenjevanje ranljivosti preprosto vzamejo svoje trenutne omrežne skenerje in kažejo na brezžično infrastrukturo. Ta pristop vam ne daje informacij, ki so edinstvene za brezžična omrežja. Poleg tega lahko tradicionalni skenerji navedejo ranljivosti določenega cilja, vendar ne morejo oceniti, ali je nadzor mehčanja nameščen na cilj ali v okolje.
Številne farmakološke, toksikološke in biofarmacevtske študije so potrdile, da je aerosil, če ga uporabljamo interno, bolan, ga bolniki dobro prenašajo, ima zdravilne lastnosti za bolezni prebavil in druge vnetne procese ter je lahko vir oskrbe s silicijem v telesu. Obstajajo dokazi, da aerosil (silicijev dioksid) lahko prispeva k zmanjšanju gladkih mišic in krvnih žil ter ima tudi antibakterijske lastnosti.
Farmacevtski sistemi, ki vsebujejo aerosil, ne kažejo dražilnih in toksičnih učinkov. Enake lastnosti so značilne za mazila pri uporabi epsilona in aerosila kot osnove (sestava epsilon-5, zgoščena s 15% aerosila pri izdelavi mazil z antibiotiki in kortikosteroidi). Mazila z aerosilom (silicijev dioksid) zlahka iztisnjene iz cevi, dobro pritrjene na kožo, imajo podaljšan učinek.
Literatura
Zhoglo F., Wozniak V., Popovich V., Bogdan J. Pomožne snovi in njihova uporaba v tehnologiji medicinskih oblik. - Lviv, 1996; Pertsev I.M., Kotenko A.M., Chueshov A.V., Khaleeva E.L. Farmacevtski in biološki vidiki mazil: monografija. - H., 2003; Pechkovskaya K.A. Polnjenje gume. V knjigi: Enciklopedija polimerov. V 3 t - M., 1974.
