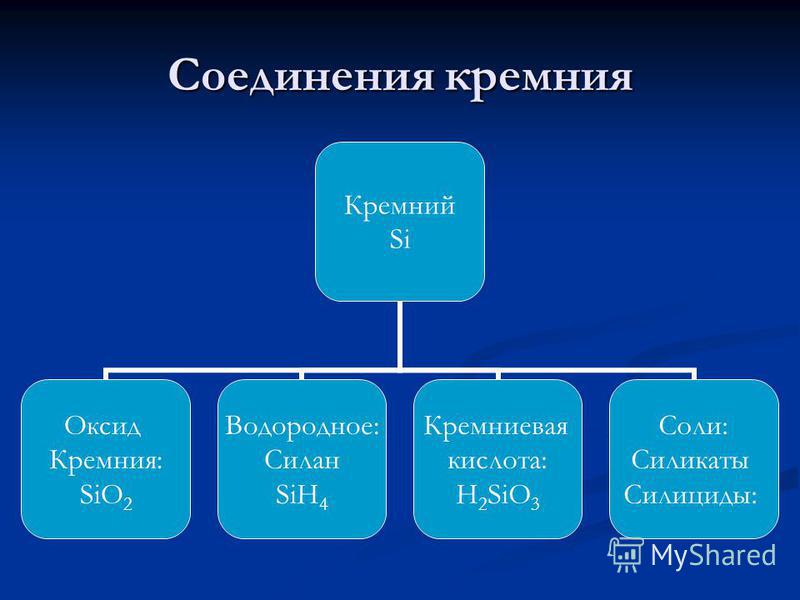
Shema strukture silicija. Struktura elektronov
Atomska struktura Položaj v PS: III. skupina IV, vodilna; Naboj jedra: +14 Si; Relativna atomska masa: Ar (Si) = 28 Atomska struktura: p = 14, e = 14, n = = 14 Elektronska formula: +14 Si 2e; 8e; 4e; +14 Si 1s 2 2s 2 2p 6 3s 2 3p Si 1s 2 2s 2 2p 6 3s 2 3p 2 Nemetall;
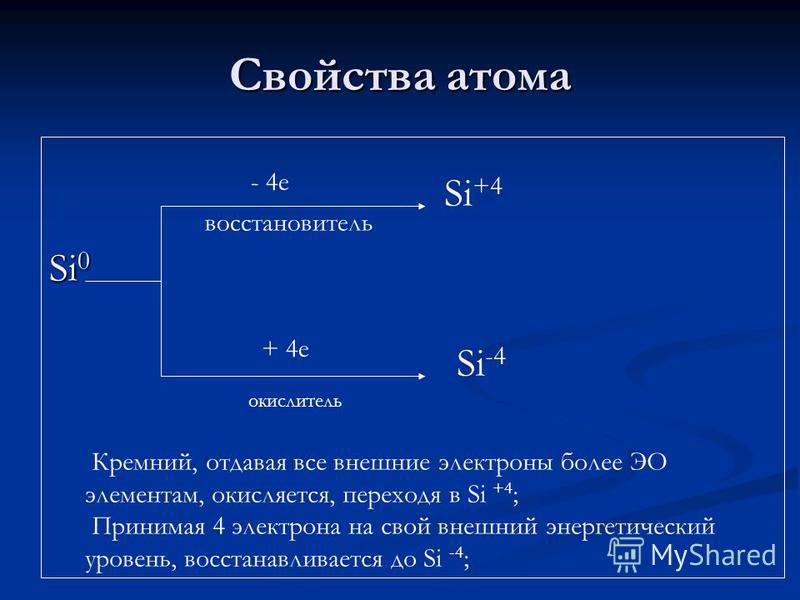
Atomske lastnosti Si e redukcijsko sredstvo + 4 e oksidant Si + 4 Si -4 Silicij, ki daje vsem zunanjim elektronima več elementov EO, oksidira, prehaja v Si + 4; Če vzamemo 4 elektrona na svojo zunanjo energetsko raven, se zmanjša na Si-4;

Fizikalne lastnosti silicija Silicij je nekovinski, obstaja v kristalnem in amorfnem stanju. Kristalni silicij je sivkasto-jeklena snov s kovinskim sijajem, zelo trda, vendar krhka. Amorfni silicij - rjav prah. p = 2,33 g / cm3; t pl. = C; t kip. = C;

Kristalna struktura silicija Kristalna rešetka silicija je kubični obrazni diamant. Zaradi daljše vezne dolžine med Si - Si je trdota silicija bistveno manjša kot pri diamantu. Silicij je krhek, samo pri segrevanju nad C.

Elektro fizikalne lastnosti Elementarni silicij Elementarni silicij je tipičen polprevodnik. tipični polprevodnik. Na elektrofizične lastnosti kristalnega silicija močno vplivajo sledi, ki jih vsebujejo. Za pridobitev silicijevih monokristalov s p-tipno prevodnostjo se v silicij vnesejo dodatki elementov 3. skupine bora, aluminija, galija in indija z elektronsko prevodnostjo dodatka. elementi V skupine fosforja, arzena ali antimona.


Flint Flint, ta Flint, ta grda in zelo grda in zelo trpežna kamen, trpežni kamen, je postavil temelje kamnitemu začetku kamene dobe - stoletja - stoletja kremenih delovnih orodij. kremena orodja. Obstajata dva razloga: - razširjenost in razpoložljivost silicija; - razširjenost in razpoložljivost silicija; - zmožnost oblikovanja ostrih rezalnih robov pri rezanju; - zmožnost oblikovanja ostrih rezalnih robov pri rezanju;




Ali veste, da je .. Metodo za pridobivanje silicija v njegovi čisti obliki je razvil Nikolaj Nikolajič Beketov. Silicon v Rusiji se proizvaja v tovarnah: Kamensk - Uralsky (Regija Sverdlovsk) Kamensk - Uralsky (Regija Sverdlovsk) Shelekh (Regija Irkutsk). Shelekh (regija Irkutsk).

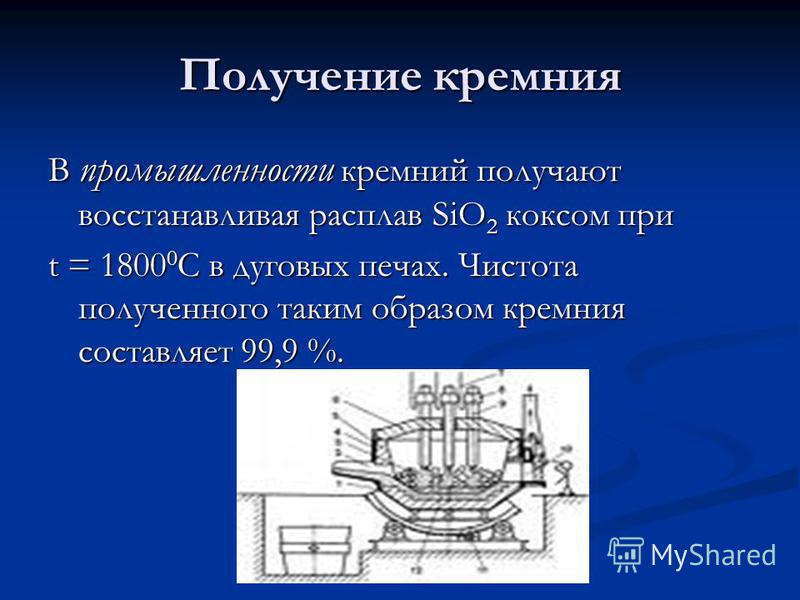
Proizvodnja silicija V industriji se silicij doseže z zmanjšanjem taline SiO2 s koksom pri t = C v obločnih pečeh. Čistota tako dobljenega silicija je 99,9%.
Pridobivanje silicija Laboratorijski postopek izdelave: SiO Mg 2MgO + Si SiO Mg 2MgO + Si


Kemične lastnosti silicija Pri segrevanju na 400 ° C silicij reagira s kisikom in tvori silicijev dioksid: Si + O 2 SiO 2 Si + O 2 SiO 2



![]()
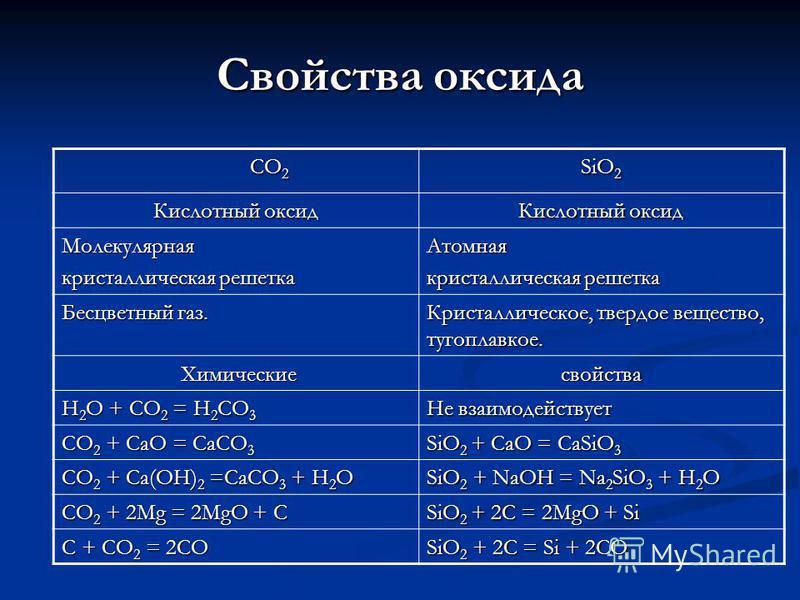
Lastnosti CO 2 CO 2 SiO 2 oksid Kislinski oksid Molekularna kristalna mreža Atomska Brezbarvni plin. Kristalinična, trdna, neodzivna. Kemijska kemijska lastnost H 2 O + CO 2 = H 2 CO 3 Ne reagira CO 2 + CaO = CaCO 3 SiO 2 + CaO = CaSiO 3 CO 2 + Ca (OH) 2 = CaCO 3 + H 2 O SiO 2 + NaOH = Na 2 SiO 3 + H 2 O CO 2 + 2Mg = 2MgO + C SiO 2 + 2C = 2MgO + Si C + CO 2 = 2CO SiO 2 + 2C = Si + 2CO
Lastnosti kislin H 2 CO 3 H 2 SiO 3 Dibazično, kisik vsebujoče, šibko, krhko, ker letenje. Dibazično, šibko, kisik vsebujoče, netopno v vodi. Sprejem: CO 2 + H 2 O = H 2 CO 3 Sprejem: SiO 2 + H 2 O = ne more biti nestabilen, krhek, razpade pri stajanju ali segrevanju: H 2 CO 3 = CO 2 + H 2 O Ni ga mogoče izbrati v čisti obliki, ker razgradi se pri segrevanju: H 2 SiO 3 = SiO 2 + H 2 O Zn + H 2 CO 3 = ZnCO 3 + H 2 Manjši nastanek plina __________

Ogljikove kisline s silikatno kislino - karbonati; - ogljikovodiki; - silikati; - silikati; Karbonati imajo vse lastnosti soli, so močni elektroliti, popolnoma disociirajo v ione (topne v vodi). Samo soli alkalijskih kovin so topne, druge tvorijo netopne ali sploh ne tvorijo soli (Al + 3, Cr +3, Ag +).
![]()



Biološka vloga Najpomembnejša silicijeva spojina, SiO 2, je bistvena za rastlinsko in živalsko življenje. Zahvaljujoč njemu, trstičju, trsju Zahvaljujoč njemu, trstičje, trsje in horsetails trdno kot bajoneti. in horsetails stati tesen, kot bajonet. Ostri listi listov, kot so ostri listi listov, rezani kot noži, strnišča na košenih poljskih nožih, strnišča na košenih poljskih kockah, kot so igle, in stebla žit pa so kot igle, stebla žit pa so tako močna, da ne dovolijo tako močnega ne dovolite, da polje na poljih pade z dežja in da polje vetra na poljih pade od dežja in vetra


Silicij je element v sledovih, ki je stalno v človeškem telesu. Njegova največja količina je v bezgavkah, vezivnem tkivu aorte, sapnika, las in kože. Silicij je potreben za izgradnjo epitelijskih celic. Silicij je element v sledovih, ki je stalno v človeškem telesu. Njegova največja količina je v bezgavkah, vezivnem tkivu aorte, sapnika, las in kože. Silicij je potreben za izgradnjo epitelijskih celic. Silicij ima pomembno vlogo pri procesu mineralizacije kosti; potrebno za vzdrževanje elastičnosti arterijske stene, ima pozitiven učinek na imunski sistem in upočasni proces staranja v tkivih človeškega telesa. Povprečna vsebnost silicija v krvi je 8,25 mg / dan. S starostjo se njegova raven v telesu zmanjšuje, zato se pri starejših potrebuje povečevanje silicija. Izboljša absorpcijo silicija s strani telesa s prisotnostjo kalcija, magnezija, mangana in kalija. Silicij ima pomembno vlogo pri procesu mineralizacije kosti; potrebno za vzdrževanje elastičnosti arterijske stene, ima pozitiven učinek na imunski sistem in upočasni proces staranja v tkivih človeškega telesa. Povprečna vsebnost silicija v krvi je 8,25 mg / dan. S starostjo se njegova raven v telesu zmanjšuje, zato se pri starejših potrebuje povečevanje silicija. Izboljša absorpcijo silicija s strani telesa s prisotnostjo kalcija, magnezija, mangana in kalija.

Biološka vloga silicija je vključena tudi v sestavo nižjih živih organizmov - diatomej in radiolarij - najbolj občutljivih kosti žive snovi, ki ustvarjajo svoje neprekosljive lepotne okostnje iz silike. Silicij je tudi del nižjih živih organizmov - diatomej in radiolarij - najbolj občutljivih kosti žive snovi, ki ustvarjajo svojo neprekosljivo lepoto kremenovih ogrodij. Diatome Radiolaria Samokontrola 1. Kaj je mesto silicija v periodičnem sistemu: a) 2 obdobje, 4 og. b) 3 obdobje, 3 gr. poglavju. c) 3 obdobje, 4 gr. poglavje) 2 obdobje, 4 gr. b) 3 obdobje, 3 gr. poglavju. c) 3 obdobje, 4 gr. poglavju. 2. Silicijeva mreža: a) ionska; b) atomska; c) molekularna; a) ionski; b) atomska; c) molekularna; 3. Glede na razširjenost v naravi silicija ... element: a) prvi; b) drugi; c) tretji; a) prvi; b) drugi; c) tretji; 4. Silicij reagira z: a) kovinami, vodikom, halogeni; a) kovine, vodik, halogene; b) kovine, halogene, ki so lahko topni v alkalijah; b) kovine, halogene, ki so lahko topni v alkalijah; c) oksidi, kisline, nekovine. c) oksidi, kisline, nekovine. 5. Silikatne kisline: a) silicidi; b) hidrosilikati; c) silikati; a) silicidi; b) hidrosilikati; c) silikati;

Silicij.
Silicij - element glavne podskupine IV skupine tretjega obdobja periodičnega sistema kemijskih elementov DI Mendeleev, z atomsko številko 14, atomska masa: 28.0855. V spojinah ponavadi kaže stopnjo oksidacije +4 (valenca IV) in zelo redko +3, +2 in +1 (valence, III, II in I). V periodnem sistemu se Mendelejev silicij nahaja v skupini IVA (A - označuje, da je to glavna podskupina) (v skupini ogljika), v tretjem obdobju. Nemetall . Označena s simbolom Si(lat Silicij). V prosti obliki - rjavi prah ali svetlo sivi kompaktni material s kovinskim leskom. Rešetkasta struktura: kubični diamant.
Glavno stanje: + 14 Si 14 e 1s 2 2s 2 2p 6 3s 2 3p 2, p-element.
2. Fizikalne lastnosti.
Kristalni silicij je temno siva snov z jeklenim leskom. Struktura silicija je podobna strukturi diamanta. V njenem kristalu je vsak atom obdan s tetraedrskimi štirimi drugimi in je z njimi povezan s kovalentno vezjo, ki je veliko šibkejša kot med ogljikovimi atomi v diamantu. V silicijevem kristalu, tudi pri normalnih pogojih, se nekatere kovalentne vezi uničijo. Zato ima proste elektrone, ki povzročajo majhno električno prevodnost. Ko osvetlitev in ogrevanje poveča število zlomljenih vezi, kar pomeni, da se število prostih elektronov poveča in električna prevodnost poveča. Zato je treba pojasniti polprevodniške lastnosti silicija.
Silicij je zelo krhek, njegova gostota je 2,33 g / cm3. Podobno kot premog se nanaša na ognjevarne snovi.
Silicij sestavljajo trije stabilni izotopi: 2814Si (92,27%), 2914Si (4,68%) in 3014Si (3,05%).
3. Biti v naravi.
Najpogosteje v naravi se silicij nahaja v obliki silicijev dioksid - spojine na osnovi silicijevega dioksida (IV) SiO2 (približno 12% mase zemeljske skorje). Glavni minerali in kamni, ki jih tvori silicijev dioksid, so pesek (reka in kremen), kremen in kvarcit, kremen in glinenec. Naravni silikati imajo kompleksno sestavo in strukturo. Tukaj je sestava nekaterih naravnih silikatov:
ü feldspat K 2 O × Al 2 O 3 × 6SiO 2,
ü azbest 3MgO × 2SiO 2 × 2H 2 O,
k2 K2Ox3Al203x6Si02 × 2H2O,
kaolinit 3Al2O3x2Si02 × 2H2O.
Druga najpogostejša skupina silicijevih spojin je silikati in aluminosilikati
Opažena so posamezna dejstva o iskanju čistega silicija v domači obliki.
4. Kemijske lastnosti silicija in njegovih spojin.
Z kemijske lastnosti silicij, kot ogljik, je nekovinski, vendar je njegov nekovinski material manj izrazit, ker ima večji atomski polmer. Ker imajo atomi silicija na zunanji energijski ravni 4 elektrona, je za silicij značilno oksidacijsko stanje obeh -4 in +4 (poznana je silicijska spojina, kjer je stopnja oksidacije +2).
Silicij v normalnih pogojih je precej inerten, kar je treba pojasniti z močjo njegove kristalne rešetke. Neposredno sodeluje le z fluor:
Kisline (razen mešanice fluorovodikovega HF in dušikovega HNO 3)silicij ne deluje. Vendar se raztopi v alkalijskih hidroksidih, ki tvorijo silikat in vodik:
Od dveh alotropnih modifikacij silicija, kristaliničnega in amorfnega silicija je kemično aktivnejši. Odziva se s kisikom pri segrevanju tvorijo SiO 2:
kot tudi z vsemi halogenovna primer:
![]()
Pri visoki temperaturi silicij povezuje z ogljikomtvorjenje karborundne SiC:
Karborund ima kristalno mrežo v obliki diamanta, v kateri je vsak silicijev atom obkrožen s štirimi atomi ogljika in obratno, kovalentne vezi pa so zelo močne, kot v diamantu. Zato je v trdoti blizu diamanta. Brusni kamni in brusi so izdelani iz silicijevega karbida.
Magnezijev silicid. V reakcijah z aktivnimi kovinami, ki nastanejo z nastankom silicidi, Silicij deluje kot oksidant:
Pri visokih temperaturah silicij iz svojih oksidov pridobiva veliko kovin (!!!)
Silane Pod delovanjem klorovodikove kisline na silicide je najpreprostejša vodikova spojina silicija silan SiH 4:
Silan je strupen plin z neprijetnim vonjem, samovžigom v zraku (!!!):
Silicijev oksid (IV).Imenuje se tudi silicijev oksid (IV) silicijev dioksid. Je trdna ognjevzdržna snov. (tališče 1700 ° C) razširjena v naravi v dveh oblikah:
1) kristalni silicijev dioksid - v obliki kremenovega minerala in njegovih sort (kamniti kristali, kalcedona, ahat, jaspis, kremen); kremen oblikuje osnovo kremenovega peska, ki se pogosto uporablja v gradbeništvu in. \\ t silikatno industrijo;
2) amorfni silicijev dioksid - v obliki mineralne sestave opal SiO2 × n H20; zemeljske oblike amorfnega silicijevega dioksida so diatomit, tripoli (infuzorijska zemlja); Primer umetnega amorfnega brezvodnega silicijevega dioksida je silikagel, ki ga dobimo iz natrijevega metasilikata:
Silikagel ima razvito površino in zato dobro vpija vlago. .
Pri 1710 ° kremena se topi. S hitrim ohlajanjem nastane staljena masa kremenovo steklo . Ima zelo nizek koeficient ekspanzije, tako da se vroče steklo kvarca ne razpoči, ko se voda hitro ohladi. Laboratorijska steklovina in instrumenti za znanstvene raziskave so izdelani iz kremenovega stekla.
Najenostavnejša formula silicijevega oksida (IV) SO2 je podobna formuli ogljikovega monoksida (IV) CO 2. Medtem pa so njihove fizikalne lastnosti zelo različne (SiO2 - trdna, CO 2 - plin). Ta razlika je posledica strukture kristalnih mrež. C0 2 kristalizira v molekulski rešetki, SiO2 - v atomski. Struktura SiO 2 v ravninski sliki je lahko predstavljena na naslednji način:
Koordinacijsko število ogljikovega atoma v trdnem CO 2 je 2, silicij v SiO2 pa 4. Vsak silicijev atom je zaprt v tetraedru s 4 kisikovimi atomi. Istočasno je atom silicija v središču, kisikovi atomi pa so na vrhu tetraedra . Celoten kos silicijevega dioksida se lahko obravnava kot kristal, katerega formula je (SiO2) n. Ta struktura silicijevega oksida (IV) določa njeno visoko trdoto in ognjeodpornost .
Kemijske lastnosti silicijevega oksida (IV) SiO2 se nanaša na kislinske okside. Pri taljenju trdnih alkalij, bazičnih oksidov in karbonatov se tvorijo soli silicijeve kisline: \\ t
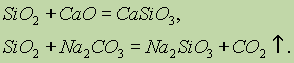
Samo fluorovodikova kislina sodeluje s silicijevim oksidom (IV): \\ t
Ta reakcija se uporablja za jedkanje stekla. .
Silicij (IV) se ne raztopi v vodi in z njim kemično ne sodeluje. (!!!) Zato se silicijeva kislina pridobi posredno z delovanjem s kislino na raztopino kalijevega ali natrijevega silikata: \\ t
V tem primeru lahko silicijevo kislino (odvisno od koncentracije začetnih raztopin soli in kisline) dobimo tako v obliki želatinaste mase, ki vsebuje vodo, kot v obliki koloidne raztopine (sol).
Silicic acid. SiO2 je anhidrid številnih silicijevih kislin, katerih sestava se lahko izrazi s splošno formulo: xSiO 2 × yH 2 O, kjer je x in y - cela števila:
1) x = 1, y = 1: Si02 × H20, t.j. metasilicinska kislina;
2) x = 1, y = 2: Si02 × 2H20, t.j. ortosilična kislina;
3) x = 2, y = 1: 2SiO2 × H20, t.j. H 2 Si 2 O 5 - bimetakrinske kisline.
Silikatna kislina je zgrajena iz tetraedričnih strukturnih enot (v vsaki taki enoti je atom silicija v središču tetraedra in v vrhovih so kisikovi atomi). Strukturne povezave, ki se združujejo v verige, tvorijo bolj stabilne polisilicijeve kisline:
Sestavo takih spojin lahko izrazimo s formulo (H2S03) n. Vendar je navadno silicijeva kislina predstavljena s formulo H 2 SiO 3. H 2 SiO 3 - kislina je zelo šibka, malo topna v vodi. Pri segrevanju se enostavno razgradi kot ogljikova kislina:
Vse silicijeve kisline so zelo šibke (šibkejše od premoga).
Silikati. Imenujejo se soli vseh silicijevih kislinsilikatiČeprav silikati praviloma v učni literaturi pomenijo soli metacilne kisline. Svojo sestavo navadno predstavlja formula v obliki spojin oksidov elementov. Na primer, kalcijev silikat CaSiO3 lahko izrazimo kot: CaO x Si02.
Silikati s sestavo R 2 O × nSiO 2, kjer je R 2 O - natrijev oksid ali kalij , kličejo topnega stekla , a njihove koncentrirane vodne raztopine - \\ t tekoče steklo . Najpomembnejše je steklo natrijevega soda..
Ko stojijo na zraku, raztopine silikatov postanejo motne, ker ogljikov dioksid (IV) v zraku iz nje izloča silicijevo kislino:
Silicic acid je praktično netopen v vodi - ta lastnost se uporablja kot kvalitativna reakcija na ion SiO 3 2-.
Silikati se pridobivajo s taljenjem kremena z alkalijami ali karbonati: \\ t
5. Odkritje ionskega SiO 3 2. (ničesar ne najdem ...)
6. Vloga silicijevih spojin pri tvorbi tal in gozdarstvu.
Magmatske kamnine so precej stabilne v svoji sestavi in vsebujejo predvsem spojine silicija, aluminija, železa, alkalij, magnezija in kalcija. Po vsebnosti Si0 2 so magmatske kamnine razdeljene v štiri skupine: kisle (\u003e 65%), srednje (52-65%), bazične (40-52%) in ultrabazične (\\ t<40 %). Наиболее представительны две большие группы: кислые и основные породы. Как будет видно в дальнейшем, при характеристике многих типов почв именно этот фактор приуроченности почв к кислым или основным магматическим почвообразующим породам является решающим в отношении генезиса, эволюции и свойств почв.
Kisle magmatske kamnine- graniti, pegmatiti, rioliti, dacit in drugi - imajo običajno svetlo rjavo barvo z izrazitimi kristali kremena, glinenca, sljude. Vsebnost SiO 2 v njih je visoka (več kot 65%) z veliko količino kalija in natrija. Hkrati je malo železa, kalcij in magnezij zanemarljivo. Tla na kislih magmatskih kamninah, na primer na granitih, se v zgodnjih fazah preperevanja razlikujejo po krhkosti, gramoznosti izvirnega materiala. Ko so prepereli v vlažnih razmerah, z lahkoto izgubijo zemeljsko alkalijske elemente, zaradi česar je zemlja na takšnih preperelih substratih (eluvium kamnin) izredno slaba, slabo plodna.
Glavne magmatske kamnine -Bazalt, gabro itd. imajo praviloma temno (črno) barvo. Za njih je značilna manjša vsebnost SiO2 v primerjavi s kislimi kamninami. Glavne magmatske kamnine so sorazmerno bogate s spojinami železa, mangana, kroma, kobalta, cinka, titana, niklja, bakra. Produkti njihovega preperevanja zelo hitro pridobijo glinast značaj, dolgo časa ohranjajo alkalno in nevtralno reakcijo, odlikuje pa jih povečana vsebnost humusa in glinastih mineralov. Tla na takih kamninah so bolj plodna.
Poleg kislih in osnovnih vrst se pogosto najdejo magmatske kamnine prehodnega tipa(srednja) - intruzivne kamnine dioritne skupine in njihovi nevsiljivi kolegi - andeziti. V skladu s tem prsti na teh kamninah dobijo podobne značilnosti kot pri kislih ali osnovnih kamninah. Veliko manj pogosti ultrabazične pasme:peridotiti in pikriti, ki imajo najnižjo vsebnost SiO2.
Metamorfne kamnine -prehodno med masivnimi kristaliničnimi in sedimentnimi kamninami. Starodavne sedimentne kamnine pod potapljanjem, visok tlak in temperature so metamorfizirane in tvorijo gneise, serpentinite, marmor, kvarcite, skrilavec. Gneisi so po sestavi posebej podobni granitnim. Tla, ki nastajajo na takih kamninah, imajo podobne lastnosti kot tla na samih kislih magmatskih kamninah.
Klor.
1. Položaj aluminija v tabeli DI Mendeleev. Struktura atoma, izražena stopnja oksidacije.
Klor - element glavne podskupine skupine VII, tretje obdobje, z atomsko številko 17. Označen je s simbolom Cl (lat. Chlorum). Kemično aktivna nekovinski . Vključena v halogensko skupino .
Enostavna snov klor pri normalnih pogojih - strupeni plin rumeno-zelene barve je težji od zraka, z močnim vonjem . Dvojna molekula klora (formula Cl 2).
Glavno stanje: +17 Cl 17e1s 2 2s 2 2p 6 3s 2 3p 5, p-element. Člen: -1 +1 +3 +5 +7.
Struktura elektronske lupine.
Na nivoju valenca vsebuje atom klora 1 neparni elektron : 1s 2 2s 2 2p 6 3s 2 3p 5, tako da je valenca 1 za atom klora zelo stabilna. Zaradi prisotnosti v atomu klora nezasedenih d-podzemeljskih orbitalov lahko atom klora pokaže druge stopnje oksidacije. Shema nastajanja vzbujenih stanj atoma:
Znane so tudi klorove spojine, v katerih atom klora formalno pokaže valenco 4 in 6, npr. ClO 2 in Cl 2 O 6. Vendar so te spojine radikali, kar pomeni, da imajo enega brez para.
2. Fizikalne lastnosti.
V normalnih pogojih je klor rumeno-zelen plin z zadušljivim vonjem. Nekatere njegove fizikalne lastnosti so predstavljene spodaj.
Gostota: 3.214 g / l, tekočina - pri -35 ° C - 1.557, TV. pri -105 0 С - 1,9 g / cm 3.
Tališče: 172,2 K
Vrelišče: 238,6 K
Toplota taljenja: 6.41 kJ / mol
Toplota izhlapevanja: 20,41 kJ / mol.
Klorov plin je razmeroma lahko utekočiniti. S tlakom 0,8 MPa (8 atmosfer) bo klor tekočina že pri sobni temperaturi. Kadar se klor ohladi na temperaturo –34 ° C, postane tudi tekočina pri normalnem atmosferskem tlaku. Tekoči klor je rumeno-zelena tekočina z zelo visokim korozivnim učinkom (zaradi visoke koncentracije molekul). Povečanje tlaka omogoča doseganje tekočega klora do temperature +144 ° C (kritična temperatura) pri kritičnem tlaku 7,6 MPa. V smislu električne prevodnosti se tekoči klor uvršča med najmočnejše izolatorje: pretok je skoraj milijardo krat slabši od destilirane vode in 10 22-krat slabši od srebra. Hitrost zvoka v kloru je približno pol in pol manjša kot v zraku.
3. Biti v naravi.
V naravi obstajata dva izotopa klora 35 Cl in 37 Cl. Klor je najpogostejši halogen v zemeljski skorji. . Klor je zelo aktiven - neposredno povezuje skoraj vse elemente periodičnega sistema. Zato v naravi najdemo le v obliki spojin v sestavi mineralov:
ü halite NaCl,
ü sylvina KCl,
ü sylvinite KCl · NaCl,
- biskofit MgCl2 · 6H2O,
ü karnalit KCl · MgCl2 · 6H2O,
Kainit KCl · MgSO4 · 3H2O.
Največje zaloge klora vsebujejo soli, vode, morja in oceani (vsebnost v morski vodi je 19 g / l). Klor predstavlja 0,024% skupnega števila atomov v zemeljski skorji; klicne številke (številke, ki izražajo povprečno vsebnost kemičnih elementov v zemeljski skorji, hidrosferi, Zemlji, vesoljskih telesih, geokemičnih ali kozmokemičnih sistemih itd. glede na skupno maso tega sistema. Izražena je v% ali g / kg.) klor - 0,017%. Človeško telo vsebuje 0,25% klorovih ionov. Pri ljudeh in živalih se klor nahaja predvsem v medceličnih tekočinah (vključno s krvjo) in ima pomembno vlogo pri uravnavanju osmotskih procesov kot tudi v procesih, povezanih z delovanjem živčnih celic.
4. Kemijske lastnosti klora in njegovih spojin. Klor.
Struktura silicijevega atoma. Si. +14. Razburjeno stanje. E. 3d. 3p. 3s. E. 3d. 3p. 3s. 1s 2s 2p 3s 3p. 2e 8e 4e. 2. 2. 6. 2. 2.
Slika 3 predstavitve "Silicon" na pouk kemije na temo "silicij"Dimenzije: 960 x 720 slikovnih pik, format: jpg. Če želite prenesti brezplačno sliko za lekcijo kemije, kliknite z desno tipko miške na sliko in kliknite "Shrani sliko kot ...". Če želite prikazati slike v lekciji, lahko brezplačno prenesete predstavitev »Silicon.ppt« z vsemi slikami v arhivu zip. Velikost arhiva - 562 KB.
Prenesite predstavitevSilicij
"Silicij in njegove spojine" - Struktura in lastnosti atomov. Polprevodnik. t taline (Si) = 1415 ° C, t taline (diamant) = 3730 ° C. Pridobivanje silicija. Odkritje silicija. Vključena je tudi v sestavo rastlin in živali. Fizikalne lastnosti silicija. Opeka je zato keramika, keramike pa so tudi ploščice in fragmenti stare grške amfore. Cilji: Kemijske lastnosti silicija.
"Silicijeve spojine" - silicij in njegove spojine. Kemijske lastnosti SiO2. Silane Pridobivanje silicijeve kisline. Lastnosti silicija. Silicijev oksid. Naravni silikati. Stanje oksidacije Štras Topaz. Pridobivanje silicija v laboratoriju. Biti v naravi. Kristalne rešetke. Odkritje silicija. Ametist. Pridobivanje silicija.
"Izotopi silicija" - Ločevanje izotopov silicija. Proizvodnja polikristalnega silicija. Možnosti uporabe monoizotopnega silicija. Izotopsko redčenje pri gojenju enega kristala iz kvarčnega lončka. Proizvodnja enokristalnih semen. Odvisnost položaja največjega Ramanovega pasu od atomske mase.
"Silicijska lekcija" - Kateri od najpomembnejših kemijskih elementov v živi in nežive naravi? Ogljikovi oksidi in silicij. Snov je pregledna. O manifestaciji nekovinskih in kovinskih lastnosti. Povzetek razmišljanja. Končno testiranje. Oksidi ogljika in silicijevih hidroksidov? Agregacijsko stanje: a) tekočina, b) plin, c) trdna snov.
"Silicij" - Silicij je preprosta snov. Fizične lastnosti. Silicijev oksid (IV). Silicidi Pomen za žive organizme. Interakcija s kovinami. Interakcija z nekovinami. Silicijev karbid. Silicij v naravi. Silicij. Izdelki iz silikatne industrije. Ena od vrst naravnih silicijevih spojin je silikat.
"Ogljik in silicij" - silicijev oksid (IV). Elementi skupine IV glavne podskupine. Strupenost. 7. Zanimivo za ogljik. Silikati. Dotaknite se na dotik. Diamant je najtežja naravna snov. Kemijske lastnosti Več kot 99% ogljika v ozračju je v obliki ogljikovega dioksida. Karbidi. 6. Uporaba. Eden najmehkejših med trdnimi snovmi.
Skupaj je predstavljenih 6 predstavitev.
