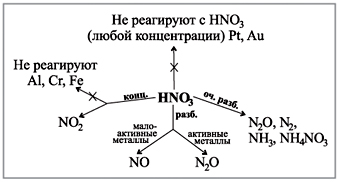
Шингэрүүлсэн давсны хүчлийн хүчийг тодорхойлдог эквивалент урвалууд. Сахилга батаас хоол тэжээлийн талаархи шалгалтын жагсаалт
Агаар мандалд усны дүр төрхөөр дамжуулан төмрийн хар тугалгын сульфид (II) -ийн мэдэгдлүүдтэй холбоотой хар тугалга bilil (PbCO3) агуулсан агуулах руу olyny farbs зурсан хуучин зургуудын Pochorninya гадаргуу. Хэрэв та гадаргууг усны хэт ислээр бүрхсэн бол цагаан өнгийн хар тугалга (II) сульфатаар урвал явагдана.
PbS + 4H2 O2 = PbSO4 + 4H2 O.
Ийм байдлаар хуучин зургуудыг сэргээж, oyinyi farbs зурсан.
Засосування кисню, сирки
Хоол хүнс хадгалах талбайг хүүхэд 61-ээр төлөөлдөг.
халдварын хувьд vikoristovuvati його хийхийг зөвшөөрөх ус уухгадаадын үйлдвэрийн хаягдал ус; анагаах ухаанд ариутгагч бодис болгон. Озон шүүдэсжилтийн үр дүнд ялах болно.
Согтууруулах ундааны хүчил үйлдвэрлэх, сирник бэлтгэх, Бенгалын гал түймэр, Сильской мужийн сургуулийн сурагчидтай тэмцэх, өвчтэй хүүхдүүдэд туслах дарс. Syrka нь gumi, barvnik болон пигмент, хэсэг ширхэг утас, luminophores болон онд агуулах мэдэх.
Жижиг. 61. Засосування сисню

Хагас цагийн исгэлэнгийн хувьд исэлдэлтийн хамгийн онцлог үе шатууд нь -2, хүхрийн атом, селен, телуру исэлдүүлэх шатууд -2, +2, +4, +6.
Хүч чадал, исгэлэн исэлдэлт нь метал, ус, хийц, металл бус бодисуудтай урвалд ордог.
Цахилгаан хангамж, хангамж
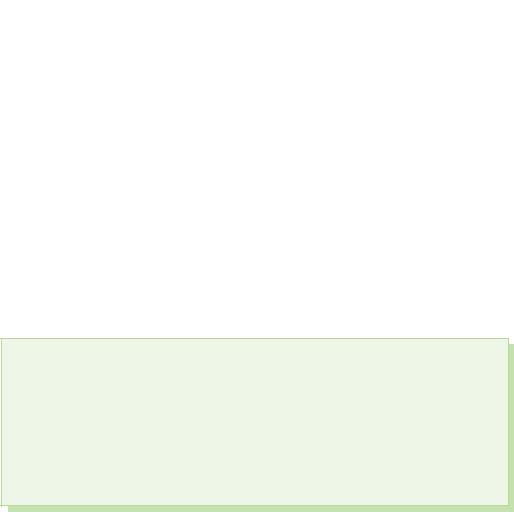
1. Томъёо хадгалах spoluk kisnyu s kalієm, kaltsієm болон alumіnієm. Исэлдсэн арьсны элементийн үе шатыг танилцуулж, өдөр гэж нэрлэнэ.
2. Хөнгөн цагааны сульфид дээр сиркагийн ихэнх хэсгийг хамгаална.
3. "Үнсэх" нэр - oxygenium нь "scho roozhuє хүчил" гэсэн утгатай. Бичнэ үү химийн томъёо vіdomih хүчлүүд танд, элементийг тавих агуулахад. Хүчиллэгийг нэрлэ.
4. Та ямар алотропийн өөрчлөлтүүдийг мэддэг вэ? Нэг төрлийн зүйлээс ямар үнэр гарч ирдэг вэ?
5. Хүмүүсийн амьсгалсан Кисен нь цусан дахь гемоглобины хамт алга болдог. 1 г гемоглобины массыг (n.u.) 1.35 см-ээр өгсөн бололтой. 3. Эрүүл хүний цусан дахь гемоглобины оронд 140 г / дм3. Загалын цусны хэмжээ - 6 дм3. Ард түмний цуснаас шалтгаалж болох тул исгэлэнгийн химийг хамгаалаарай.
6. 8.96 дм эзэлхүүнтэй ус өгөх үед таслагдах давсны хүчлийн висназнит массын хувь хэмжээ (n.u.)Масойутай усанд 3 ширхэг 500 гр.
7. Довтолгооны схемд Razstavte гүйцэтгэлоксидын үндсэн урвалууд:
a) H2 S + Cl2 + H2 O → H2 SO4 + HCl; b) H2 S + Br2 → S + HBr;
в) H2 S + O2 → S + H2 O.
Байна исэлдүүлэх, давамгайлах арьсны урвал.
§ 39. Kisnevmіsnі spoluki sіrki
Байна s'єdnannyakh s sirka viyavlyaє исэлдэлтийн үе шат+4 і +6.
Серка (IV) исэл. Цэвэр хүчил
Саарал исэл (IV) - SO2 (цэвэр хий) - є халуун усны үед үүсдэг хурц үнэртэй, барзгар хий:
S + O2 = t SO2.

Зарим зогсонги байдлыг олсон хүмүүсийн зарим нь шатаж болох чулуужсан тослог судалтай холбоотой байв. Сарлаг 1-р зуунаас дуу авиа хүртэл эртний түүхч Плиний Ср. Энэ нь "Галын галын үнэр нь бүх төрлийн увдисыг хадгалж, аливаа бузар хүчийг зайлуулж чаддаг" гэсэн үг юм. Сийвэнгийн (IV) оксидын ариутгагч, нян устгах үйлчилгээ нь нэг удаад харгис болно. Цагаан өнгөтэй хий нь хүнсний ногоо, жимс жимсгэнэ, жимс жимсгэнэ, тэдгээрийг ялзрахаас урьдчилан сэргийлэхийн тулд боловсруулах явцад зарцуулагддаг.
Усны ойролцоо цэвэр хийг гадагшлуулах (1 эзэлхүүн усанд 40 хүртэлх хэмжээтэй SO2) - нестик, давхар суурь эрлийн хүчил yaka isnu tilki in roschini:
SO2 + H2 O H2 SO3.
Цэвэр хүчил нь сул хүчил бөгөөд усны ялгаа нь ихэвчлэн гидросульфит ба сульфит-ионуудын мэдэгдлээс салдаг.
H + + HSO -, | - H + + SO 2–. |
||||
Цэвэр хүчил нь хүчилд зориулагдсан химийн хүч юм: үндсэн исэл, суурьтай харилцан үйлчлэлцэх, доод хүчлийн давс, зокрем, давснаас витисня, сул хүчилтэй урвалд ордог.
Na2CO3 + H2SO3 = Na2SO3 + H2O + CO2.
Серки исэл (VI)
Серка (VI) исэл, исэлдүүлэгч ийлдэс (IV) исэл нь катализаторын оролцоотойгоор 500 С-ийн температурт байдаг.
т, муур.
2SO + O −−−−− ← 2SO.
2 2 ←−−−−−3
Үрэлгэн сэтгэхүйн хувьд серки исэл (VI) SO3 нь 17 хэмээс доош температурт болор үг болж хувирдаг үржил шимгүй усны эх үүсвэр юм. Энэ нь ердийн хүчиллэг исэл бөгөөд устай хамт хүчтэй хүчиллэг хүчлийг хувиргадаг.
SO3 + H2 O = H2 SO4.
Сирчаны хүчил
График томъёо нь хүхрийн хүчлийн молекулын загвар бөгөөд бага зэрэг 62-д чиглэгддэг.
Жижиг. 62. Давсны хүчлийн молекулын график томьёо ба загвар
Байна үржлийн асуудал сирчаны хүчилє хүчтэй электролит,
і її disoсіatsіyu дараах байдлаар эргэлддэг.
H2 SO4 → 2Н + + SO4 2–.
Давсны хүчлийн физик хүч
Сирчана хүчил - чухал (хүч 1.83 г / см3), тослог, амбааргүй, үнэргүй. Вон ямар ч байдлаар ус руу явах болно.
1 моль химийн хэмжигдэхүүн дэх H2 SO4-ийг тодорхойлох үйл явцыг химийн урвалын дулааны нөлөөллийн утгыг тохируулах боломжтой 92 кЖ дулааныг харахын тулд хянадаг. Давсны хүчил ба усны харилцан үйлчлэлийн явцад их хэмжээний дулааныг дүрслэх нь H2 SO4 n H2 O төрлийн хоёр үгийн гидрат бүхий микро бөмбөрцөг үүссэний нотолгоо юм.
Жишээлбэл, H2 SO4 · H2 O; H2 SO4 2H2 O; H2 SO4 3H2 O гэх мэт.
шинэ хүчил ба ус нь түүнийг хүчтэй ус зөөгч бодис болгон ашиглах боломжийг олгодог, жишээлбэл, хий хатаах.
Усанд давсны хүчлийг тараах тохиолдолд нийлбэрийн хөгжлийг шахмал түлш хэлбэрээр хянаж болно. Чамайг санаж байна хүчилд ус нэмж болохгүй
их хэмжээгээр, дараа нь уусмалыг тасралтгүй хольж, хүчилийг ус руу хийнэ.
Хөгжилтэй эрх баригчиднимбэгийн хүчил. Сульфати
Сульфати. Шингэрүүлсэн сирчаны хүчил бүх зүйл хүч чадлын хүчлүүдийн онцлог шинж чанартай байдаг: үйл ажиллагаа ба усны дунд байрлах металуудтай солилцох; үндсэн амфотерийн исэл, суурь ба давс. Ерөнхийдөө, soli байдаг: дунд -сульфат, жишээлбэл K 2 SO 4 і хүчил -
гидросульфат, жишээ нь KHSO4.
Сульфат ба гидросульфатын ихэнх нь усанд сайн шингэдэг бөгөөд тэдгээрийн ихэнх нь зөвшөөрөгдсөн байдаг. талстууд... Деяки нь давсны хүчлийн талст сульфатын давс бөгөөд үүнийг vitriol гэж нэрлэдэг: цитрусын витриол CuSO4 ∙ 5H2 O, цагаан витриол FeSO4 ∙ 7H2 O ба ін.
Усны түвшинд органик хүчил ба давсыг доройтуулахын тулд янз бүрийн давс боловсруулж болно.
Ba (NO3) 2 + Na2 SO4 = BaSO4 ↓ + 2NaNO3;
Ba2 + + SO4 2– = BaSO4 ↓.
Урвалын үр дүнд сульфатын барийн бүслэлт үүснэ.
Лабораторийн үзлэг 6
Шингэрүүлсэн сирханойн хүчлийн химийн байгууллагуудын жор
Ашиглах таван туршилтын хоолой байдаг: металл (цайр, тэр ч байтугай царигийн доргиурт металл), үндсэн исэл, натрийн гидроксид, натрийн карбонат, хлоридын баар. Натрийн гидроксид фенолфталеины дусал дуслаар өгч, дусал дуслаарай. Арьсны туршилтын хоолойд 1-2 см3 шингэрүүлсэн сироп хийнэ. (Увага! Спиртийн хагасаар хэт ачааллыг хурдасгахын тулд үндсэн оксидтэй урвал нь дүрэмд харшлах болно.)
Чи юу хийдэг вэ? Химийн урвал хэтэрч байгааг илтгэх шинж тэмдгүүд юу вэ? Химийн урвалыг молекул болон ионы үүднээс хадгалах. Таны хийсэн исэлдэлтийн урвалын талаар юу хэлэх вэ? Шингэрүүлсэн сирханой хүчлийн химийн хүчний талаар тэмдэглэл хийх.
Төвлөрсөн сирчаны хүчилє хүчтэй исэлдүүлэгч бодис, шингэрүүлээгүй. Төвлөрсөн сирханойн хүчлийн харилцан үйлчлэлээр
металл харагдахгүй.
З усны идэвхжилтэй (алт, цагаан алтнаас бусад) хажууд байрлах металууд, серки (IV) SO-ийн зөвшөөрөгдсөн ислийн эсрэг урвал 2 :
Cu + 2H2 SO4 (conc) = t CuSO4 + SO2 + 2H2 O.
Ус хүртэл үйл ажиллагааны хүрээнд байдаг металлуудтай урвалд ороход хүчлийн концентраци нь усны исэл (IV) SO2, ус S эсвэл усны H2 S хүртэл төвлөрч болно. металл ба урвалын урсгал. Жишээлбэл:
4Zn + 5H2 SO4 (сэрвээ) = t 4ZnSO4 + H2 S + 4H2 O.
Нагадаєmo, scho zalizo, хөнгөн цагаан, deyakі іnshi нь хорон санаат хүмүүсийг төвлөрсөн сирчаны хүчилээр бэлчээхийн тулд шидсэн.
Төвлөрсөн сирчаны хүчил нь металл бус, жишээлбэл, syrkoy-тай энгийн үгстэй харьцахад сайн байдаг.
S + 2H2 SO4 = t 3SO2 + 2H2 O.
Исэлдүүлэгч багато нугалах органик spoluks, сирчан хүчил обгорта папир, даавуу, мод, одяг тэр шкиру. Энэ нь требагийн төвлөрсөн сирчаны хүчилд тохиолддог.
Баяжуулсан сирчаны хүчил нь дэгдэмхий хүчил, давсыг зайлуулахад тустай. Жишээлбэл:
NaCl (TV) + H2 SO4 (conc) = t NaНSO4 + HCl.
Бүгд Найрамдах Bilorus sirchan-д хүчил нь НӨАТ "Гомел Химичный үйлдвэр", НӨАТ "Гродно Азот"-оор эргэлддэг.
Хүчиллэг уух газар
Үнэрийг бяцхан 63-д толилуулж байна.
Жижиг. 63. Нимбэгийн хүчлийн зогсонги байдал
Сирчана хүчил H2 SO4 - чухал ач холбогдолтой, үнэргүй тослог ридингүй.
Сирхан хүчил нь үйл ажиллагаа ба усны хооронд зогсож буй металлуудтай хамт шингэлнэ; металлын исэл; суурь; давснаас.
Баяжуулсан хүчил ба металлуудтай харьцах үед ус харагдахгүй.
Усны түвшинд органик хүчил, давс муудахын тулд барийн давсыг томъёолох нь хор хөнөөлтэй байдаг.
Цахилгаан хангамж, хангамж
1. Хүхрийн исэл ба хүчиллэг хүчлүүдийн томъёог бич. Усны атомуудын исэлдэлтийн түвшинг харуул.
2. Ууланд 29.69 кЖ дулаан харагдаж байгаа тул исгэлэнд шатсан сиркигийн массыг олоорой. Чи үүнийг авсан нь сиркагийн (VI) исэл их байсан уу? Гал унтраах урвалын дулааны нөлөө 296.9 кЖ / моль болдог.
3. Усан дахь давс, хүчил, шүлтийг идэмхий хүснэгтэд шингэрүүлсэн давсны хүчил ба давсны 2 тэнцүү урвалыг нэмнэ. Нэрийг нь бичээрэй
v молекул ба ионы вигляд.
4. Нитратын уусмалд зориулж давсны хүчлээр шингэлсэн 200 г баартай, Ba (NO) массын фракц бүхий сульфатын барын химийн хэмжээгээр массыг хамгаална. 3) Зам тус бүрт 2 10%.
5. Төвлөрсөн давсны хүчлийн химийн хүчийг тодорхойлдог урвалын үндсэн дээр догол мөрний текстийг үзнэ үү. Тус улсад усны атомын исэлдэлтийн үе шатыг эхлүүлнэ. Арьсны урвалд энэ нь исэлдүүлэгч бодис юм.
6. Төвлөрсөн давсны хүчлийн сарлагийн хэмжээ (= 1.83 г / см 3) H2 SO4 98% массын хувьтай, 6.4 r масстай шаардлагатай уусмал уу?
7. Исэлдэлтийн үндсэн урвалыг эхлүүлэх схемийн үр ашгийг нэмэгдүүлэх.
a) HBr + H2SO4 → Br2 + SO2 + H2O; b) CaSO4 → CaO + SO2 + O2;
в) K2 S + HClO → K2SO4 + HCl.
Арьсны урвалд энэ нь исэлдүүлэгч бодис юм.
§ 40. Бүтээгдэхүүний химийн урвалын талаархи ойлголт
Хэл ярианы массыг хадгалах хуулийн дагуу хадгалсан хими нь урвалын бүтээгдэхүүнийг razrahunki, zokryuvat massu, obsyag chihichnuyu явуулах боломжийг олгодог. Практикт маш олон урвалууд урвуу, ярианы хэсэг нь ууршилт, уусмал эсвэл дайвар бүтээгдэхүүнийг батлах үр дүнд оролцдог. Энэ урвалын бүтээгдэхүүн нь бага байх ёстой, тэнцүү урвал үүсэхээс өмнө харагдах зүйл бага байна. Ийм зэрэглэлд бид онолын хувьд бүтээгдэхүүний жинг тэнцүү урвалаар хүлээн зөвшөөрвөл, эсвэл бүтээгдэхүүний химийн хэмжээ 100% байвал бүтээгдэхүүн рүү очих бодит үйл явцад 100% -иас бага байх болно.
Урвалын бүтээгдэхүүнд үзүүлэх урвалын эхлэл нь Грек цагаан толгойн үсэг (tsya) бөгөөд ижил хэсгүүдэд харагдана.
Химийн урвалын бүтээгдэхүүний төрөл гэдэг нь тухайн бүтээгдэхүүнд (эзэлхүүн, химийн хэмжигдэхүүн) бодитоор таслагдах бүтээгдэхүүнд (эзэлхүүн, химийн хэмжигдэхүүн) өртөг өндөртэй, урвалд зориулж тооцоолсон үнэ цэнэ юм.
Бүх тохиолдолд энэ нь химийн урвалын бүтээгдэхүүнд хамгийн чухал гэдгийг мэдэх болно. Жишээлбэл, vidomo үед серки (IV) исэлдсэн исэлд серка (VI) исэлд орох урвалд зориулагдсан.
2SO2 + O2 2SO3
vikhid нь 80% (эсвэл 0.8) болно, энэ нь 64 г жинтэй саарал (IV) исэл (эзэлхүүн 22.4 дм3, химийн хэмжээ 1 моль) ба зөвшөөрөгдөх саарал (VI) исэл гэсэн үг юм. жин 80 г биш (эзэлхүүн 22.4 дм3, химийн хэмжигдэхүүн 1 моль), масс 80 г ∙ 0.8 = 64 г (эзэлхүүн 17.9 дм3, химийн хэмжигдэхүүн)
Барааны цар хүрээнээс эхлээд бодит үйл явц хүртэл нэмэлт үйл ажиллагаа, үйл ажиллагааг нэвтрүүлэх шаардлагатай байна.
"Урвалын бүтээгдэхүүн рүү явах" гэсэн ойлголтоос rosary-ийн хавсралтын зургийг харахад хялбар байдаг.
хувьцаа 1. 48 г масстай саарал шингэнийг давсны үр дүнд 28.6 дм3 эзэлхүүнтэй хүхрийн исэл (IV) арилдаг. Урвалын бүтээгдэхүүнийг дүрслэн харуул.
м (S) = 48 гр | 1. Үзэгдэхүйц хэмжээний үр, |
||||
V практик (SO2) = 28.6 дм3 | урвалд орсон: | ||||
м (S) | |||||
(SO2) =? | n (S) | ||||
М (S) | 32 г / моль |
||||
2. Серка (IV) оксидын агуулахын урвал: S + O2 = SO2.
3. Бид серки ислийн (IV) онолын хэмжээг мэддэг:
1 моль S - 1 моль SO2;
1.5 моль S-1.5 моль SO2.
Химийн урвалын бүтээгдэхүүний орцын талаархи ойлголт |
4. Серки ислийн (IV) онолын шинжилгээг бид мэднэ:
V теор (SO2) = n теор (SO2) V m = 1.5 моль 22.4 моль / дм3 = 33.6 дм3.
5. Розрахумо вихид урвалын бүтээгдэхүүнд:
Хариулт: Эмийн хариу урвал 85% байна.
Хавсралт 2. Урвалын бүтээгдэхүүн 90% болохын тулд 8.96 дм3 эзэлхүүнтэй серки (IV) ислийг зайлуулахад шаардагдах FeS2-ийн жинг зааж өгнө үү.
V (SO2) = 8.96 дм3 | 1. Серки ислийн (IV) онолын харааны солилцоо: |
|||||||||||
(SO2) = 90% | V дасгал | V дасгал | ||||||||||
м (FeS2) =? | Од V онол = | |||||||||||
V онол | ||||||||||||
Vtheor (SO2) = | V дадлага (SO 2) | 8.96 дм 3 | 9.56 дм3. |
||||||||||
2. Саарал ислийн (IV) онолын химийн хэмжээг бид мэднэ: |
||||||||||||
n онол (SO 2) | V онол (SO 2) | 9.56 дм3 | ||||||||||
22.4 дм3 / моль |
||||||||||||
3. Сирка (IV) исэлд үзүүлэх агуулахын урвал ба випалд өгөх шаардлагатай пиритийн химийн хэмжээ:
х моль 0.4 моль
4FeS2 + 11O2 = 8SO2 + 2Fe2 O3, 4 моль 8 моль
x = 0.2 моль.
3. Випалд шаардлагатай пиритийн жингийн ачаар: m (FeS2) = 0.2 моль · 120 г / моль = 24 г.
Зөвлөмж: Сирка (IV) ислийг ажиглахын тулд 24 г масс авах шаардлагатай.

Химийн урвалын бүтээгдэхүүний төрөл гэдэг нь урвалд зориулж тооцоолсон бүтээгдэхүүн (овъёос, химийн тоо хэмжээ) бүтээгдэхүүнээс (овъёосны будаа, химийн тоо хэмжээ) бодитоор зүсэгдсэн бүтээгдэхүүнээс үнэтэй байдаг үнэ цэнэ юм. Odinitsi chi vidsotkah-ийн хэсгүүдэд эргүүлээрэй.
Цахилгаан хангамж, хангамж
1. Яагаад урвалын бүтээгдэхүүнд практик хариу үйлдэл үзүүлэх нь тэнцүү хариу үйлдэл үзүүлэхийн тулд бага, онолын хувьд бага даатгалын хамрах хүрээ гэж нэрлэгдэх ёстой вэ?
2. Усны химийн урвал, 1 моль, усыг 0.85 моль химийн хэмжээгээр тогтооно. Урвалын бүтээгдэхүүнийг дүрслэн харуул.
3. Давсны хүчлээс 200 г жинтэй хлоридын харилцан үйлчлэлийн үр дүнд 100 г жинтэй сульфатын тунадас үүсдэг.
4. Эзлэхүүн (n. U.) болон урвалын бүтээгдэхүүн 75% байна гэж 64 гр шатсан үрээр тогтоосон саарал (IV) исэл химийн хэмжээ хайх.
5. Саарал (IV) оксидын хэмжээг (n.u.) 89.6 дм-ээр багасгасан бол шатсан усны массыг тооцоол. 3 нь онолын хувьд боломжийн 80% болох ёстой.
6. Сэркийн (VI) исэлдсэн исэлдлийн үед таслагдсан вихид исэл (IV) бололтой.
зам 85%. Масс, эзэлхүүн (n.o.) ба химийн хэмжээгээр серки исэл (IV) урвалд ороход серки (VI) ислийг (n.u.) 2.24 дм3 эзэлхүүнээр зайлуулна.
7. Нэгдүгээрт, roschini дахь давсны массын хэсгийг эхлүүлж, 3.2 г массаас нэрэх үед, 192 г масстай сиропт хүчилд, хэрэв урвалын үр дүн 85% болвол таслагдана.
§ 41. Азот ба фосфор
Азот N ба фосфор P нь VA бүлгийн үечилсэн системд ялзардаг. Үе үе системүүдийн бүх бүлэгт Мис'як Ас, сурма Sb, висмут Би зэргийг танилцуулсан. Азот, фосфор є-г металл бусаар, мишьяк, сурма зэргийг металл руу, тїїнийг металлд авчирна.
Budova atomіv исэлдэлтийн тэр үе шат
VA бүлгийн атомын элементүүд нь хамгийн чухал энергийн түвшинд тус бүр 5 электронтой;
7 N ↓ | 15P ↓ |
Завдання.
- Чим викликана ийм өөрчлөлт мөн үү? Хоолны хромын нийлбэрт дихроматыг ямар хүчээр суулгах вэ?
- Туршилтын хоолойд 5-6 дусал кальцийн бихромат, 3 дусал давсны хүчил хийнэ. Калиюд 2 дусал иодид нэмж, туршилтын хоолойн оронд 10 дусал ус нэмнэ. Цардуулын дусал нэмэхийн оронд үзэгний жижиг хэсгийг туршилтын хоолой руу шилжүүлнэ. Чи zm_nilosya zabarvlennya цардуул уу? Юуны төлөө? Rivnyannya OVR болон vzvnyannya цахим арга.
- 15-р элементийн анхны шинж чанар R. Фосфорын аллотропийн өөрчлөлтийн хүч. Фосфорыг энгийн, эвхдэг үгсээр солилцох.
Эмийн санд мөнгөн ус (II) исэл зогсонги байдалд ордог бөгөөд хоол хийх доод антисептик юм тос, мөнгөн усны давсны үндсэн дээр шингэрүүлсэн натрийн гидроксидыг их хэмжээгээр яаж авах вэ.
Завдання.
1. Мөнгөн ус (II) исэлд үзүүлэх тусгай урвалыг бич. Тэмрява дээр яагаад үйл ажиллагаа явуулах шаардлагатай байгааг тайлбарлана уу?
3. Химийн үндсэн хуулиуд.
Анагаах ухаанд Vikoristannya spoluk цайр нь энэхүү tart, antiseptic дизайн дээр суурилдаг. 0.25% razchin цайрын сульфат 2% борын хүчил нь нэг удаа нүдний дусал бэлтгэх vykorytutsya.
Завдання.
- 100 мл (ρ = 1.02 г / мл) эзэлхүүнтэй цайрын сульфатын 0.25% уусмал бэлтгэнэ.
- Zd_ysniti засвар
Zn → ZnCl 2 → ZnSO 4 → Zn (NO 3) 2 → Zn (OH) 2 → Na 2 → NaCl
- Ковалентын холбоос, визнення, гэрэлтүүлгийн механизм, хүч зэргийг үзнэ үү. Валент. Үе шат нь исэлддэг.
· Перманганатометрийн аргаар zaliza эмийн чанарыг хянах эм зүйч .
Завдання.
1. Цахим аргаар тэгш хариулт, боловсрол бичих.
2. 20 мл хэмжээтэй хлоридын (III) 0.1 М уусмалтай урвалд ороход 0.5% -ийн хэмжээтэй (ρ = 1.004 г / мл) натрийн гидроксидын хэмжээ шаардлагатайг тооцоол.
3. Үе үеийн хууль гэж үечилсэн систематомын Будовагийн тухай өдрийн гэрэлд.
· Зализо, шинэчлэгдсэн, дотооддоо зогсонги байдалд ордог, гэхдээ энэ нь medi, vugilla, цахиурын хүчил, mis'yaku зэрэг сульфидын байшингаас харагдаж байна.
Завдання.
1. Байшингаас салах арга замыг санал болго. Obruntuvati vidpovid.
3. Химийн дуу авианы үндсэн төрөл. Байгаль нь хөгжилтэй дуу чимээ гаргадаг.
· Үр тариа бүхий перманганатын є организмын хувьд їkh zeshkozhennya хүчиллэг хүчилтэй H 2 Pro 2-ийн 3% усан уусмалыг явуулна.
Завдання.
1. Нийтлэг хариу үйлдэл бич. Цахим аргаар хариу өгөх түвшин
- Oxydi, viznachennya, ангилал, нэршил, хүч чадал, obsession арга.
· Бэлдмэл дэх үгсийн тоог перманганатометрийн аргаар гүйцэтгэдэг бөгөөд бид Fe2 + -ийг Fe3 + болгон исэлдүүлэхэд хэрэглэнэ. 0.1 Н уусмалаар халаах болон хөргөх явцад натрийн перманганатын хэмжээг тодорхойлохын тулд нөхөн сэргээгдэх уусмалуудын сонголтыг ашигладаг.
Завдання.
1. Үндсэн тодорхойлолтын үндэс болсон стандарт урвалуудыг бичих.
2. 200 мл 0.1 n KMnO 4 (бэлтгэлийн үнэ цэнийн эквивалентын хүчин зүйл) бэлтгэнэ.
3. Хүчил, viznachennya, ангилал, нэршил, хүч чадал, сэтгэл санааны арга замууд.
· Дунд зэргийн нитратын фармакопейн бэлдмэлийг доромжилсон зэрэглэлээр тараах хэрэгтэй: азотын хүчлийн шингэрүүлэлтээс эрдэс-дунд хайлшийн уусмал, байшингаас нитратыг зайлуулахын тулд давсны хүчлээр тунадасжуулах. бүслэлт, үр дүнд нь хүчиллэг орчинд цайр нь танилцуулсан байна, мөн дунд, байшингаас биш, дахин азотын хүчил.
Завдання.
- Нийтлэг урвалын мөрийг бич.
- Калорийн хлорид, иодид, бромидын бэлдмэлийн хүчинтэй байдлыг батлах үндэс болсон дунд нитрат суурьтай Cl-, Br-, J анионы зөв урвалыг тодорхойлох.
- Танилцуулга, viznachennya, ангилал, нэршил, эрх мэдэл, сэтгэл санааны арга замууд.
9. Дунд зэргийн нитрат нь элэгдэл, эргэлт, коньюнктивитийн төлөв байдал viglyadas 2.5 ба 10% үед зогсонги байдалд ордог. усны уусмал.
Завдання.
- 2% хэмжээтэй AgNO 3-ыг 50 мл-ээр (ρ = 1.015 г / мл) бэлтгэнэ. Зөрчлийн талаар хичнээн их оюун ухаан өгсөн бэ?
- Zd_ysniti засвар
Ag → AgNO 3 → AgCl → AgNO 3 → Ag
- Soli, viznachennya, ангилал, нэршил, эрх мэдэл, сэтгэл санааны арга замууд.
· Эм зүйч нь сульфатын бартай фармакопейн бэлдмэлийг тодорхойлох ёстой.
Завдання.
1. Використ сульфатыг анагаах ухаанд хэрхэн хэрэглэх вэ? Таних урвал явуулахын өмнө сульфат барийг яагаад натрийн карбонаттай хайлуулж авах ёстой вэ? Ижил төстэй урвалыг батлах нотолгоо.
2. BaSO4, CaSO4, Na2SO4 давсыг тодорхойлох урвалын эвдрэл.
3. А.Вернерийн хувьд нарийн төвөгтэй spoluks, viznachennya, budova, химийн дууны шинж чанар, ангилал, нэршил, диссоциаци. Эмнэлгийн болон химийн шинжилгээнд нарийн төвөгтэй шийдлүүдийн зогсонги байдал.
· Аюулгүй байдлын технологийг бүдүүлгээр устгах боломжийг олгодог амиакугийн өтгөрүүлсэн уусмал бүхий эм зүйч - баатрын толгой дээрх роботуудыг таталцлыг нэмэгдүүлэхгүйгээр удирдан чиглүүлсэн.
Завдання.
- Аюулгүй байдлын технологийг хөндөхгүйгээр амиакүгийн төвлөрсөн хүрээтэй ажиллахад та ямар өв залгамжлалыг хийж чадах вэ? Амиакыг хосоор нь салгахад сарлаг першу эмнэлгийн тусламж төлөх шаардлагатай байдаг.
- Zdіysniti тийм дахин төлөвлөлт.
(NH 4) 3 PO 4 → NH 3 → NH 4 NO 2 → N 2 → NO → NO 2 → HNO 3 → Hg (NO 3) 2 → NO 2
Молекул ба ионы үзэмжийн зөв урвалыг бичих, мөн OVR-ийн хувьд электрон балансын аргын түвшин.
- Химийн кинетик. Химийн урвалын хурд. Химийн урвалын хурд дээр уян хатан хүчин зүйлсийг дусаах.
· Эмийн азот нь усан дахь аммиак, аммонийн давс, азотын исэл, натрийн нитрит зэрэгт зогсонги байдалтай байдаг.
Завдання.
- Би азотын хүндэтгэлийг яах гэж байна вэ? Үндсэн хүчийг тодорхойлдог өгөгдсөн илтгэл ба тэнцүү урвалын томъёог бич.
- Исгэлэн дунд натрийн нитрат, кальцийн перманганатын хооронд rіvnyannya урвал бич. Урвалын аргаар урвалыг таних
- Хэлэлцэх боломжгүй, хүн чоно химийн урвалууд... Химична Ривновага. Үүнтэй адил чухал системүүдэд зориулсан Mac хууль. Ривноваги тогтмол. Ле Шателийн зарчимє.
· Эм зүйч нь натрийн сульфат, натрийн хлорид, натрийн гидрокарбонаттай давсыг тодорхойлох ажлыг хийх ёстой.
Завдання.
- SO 4 2-, Cl-, HCO 3- ионуудад Viconatie урвал.
- Rosrahuvati, талст гидрат Na 2 SO 4 · 10H 2 O-д грамм хэмжээ нь эм зүйч 500 грамм хэмжээний ус зайлуулах, Na 2 SO 4-ийн 5% -ийг зайлуулах шаардлагатай байна уу?
- Исэлдэлтэд хүргэдэг урвалууд. Исэлдэлтийн-амьдралын урвалын цахим онолын үндсэн заалтууд. Nayvazhivіshі исэлдүүлэх, тэргүүлэх тоо. Zrivnyannya исэл-vidnovnykh урвал электрон балансын аргаар болон ион-электрон аргаар.
Калиєва sіl sіrchanoіy хүчил ба бие махбодод маш олон гадны бэлдмэл (ксенобиотик) хувцаслах - lіkuvalny эмЭнэ бодисын солилцоо нь зарим ухаалаг бус ярианы мэдэгдлүүд дээр суурилдаг - бие махбодид шилжихэд хялбар байдаг.
Завдання.
- Otrimatyvu sіl sіl sіlchanoic хүчил хэвийн байдлаар, урвалжийн ширээн дээр vikoryuchi. Нийтлэг урвалын мөрийг бич.
- Ийм хурдан эргэдэг молекулын урвалын хүрээ:
S 2- + H 2 S → 2HS -
S 2- + 2H + → H 2 S
HS - + OH - → S 2– + H 2 O
· Тархалтын систем, тэмдэглэгээ, ангилал. Суспенз, аэрозоль, эмульс. Анагаах ухаан, эмийн санд Vikoristannya бүдүүн тархсан систем.
Эм зүйч сирханой хүчлийн 5% -ийн уусмалыг зайлуулах шаардлагатай.
Завдання.
- Хүчлийн концентраци дахь анион SO 4 2 исэлдэлтийн эрүүл мэнд ямар байх вэ? Шингэрүүлсэн болон баяжуулсан хүчлийн хүчийг тодорхойлох зөв урвалыг бичнэ үү.
- Сирханойн хүчлийн хүч чадлын 5%, майучи 50мл сирханойн хүчил, H 2 SO 4 30% -ийн массын хувийг бэлтгэнэ.
- Асар том ялгаа, ангилал, тэмдэглэгээ, молекул-кинетиктэр оптик хүч, татгалзах. Асар том ялгааны тогтвортой байдал. Коагуляци. Пептизаци. Будова хулгана. Dializ.
· Сірка, scho амин хүчлүүдийн агуулахад орох, организмд исэлдүүлэх. Бүхэл бүтэн эндоген сирхан хүчил нь фенол, крезол, индол зэрэг гадны хивэгний хувь заяаг хариуцдаг.
Завдання.
- Хүчиллэг хүчлийн хүчийг тайлбарлаж, хүчилтэй роботын дүрмийг үгүйсгэ.
- H 2 SO 4 25% масстай, 1.18 г / мл өтгөрүүлсэн сирханойн хүчлийн эзэлхүүнтэй Росрахувати нь кальцийн гидроксидыг саармагжуулахын тулд 50 мл-ийн эзэлхүүнтэй, KOH 12% -ийн масстай байх шаардлагатай. ба зузаан 1.1 г / мл.
- Шийдвэрийн үнэн, үнэ цэнэ, гол ойлголт, шийдвэрийн үйл явц хүртэлх өдөр. Тархалт. Осмос. Осмотик саваа.
· Ус ихтэй үйлдвэрийн дүүрэгт хүчиллэг хавтан авахад амаргүй.
Завдання.
- Шхо ирсэн химийн агуулах qikh бүсэд хүчиллэг хавтангууд? Як Вин дүр эсгэх үү? Энгийн хариу үйлдэл бичнэ үү.
- Эрт давсны гидролизийн молекул ба хурдан түвшин:
K 2 S, Na 2 SO 4, Na 2 SO 3, Al 2 (SO 4) 3, Cr 2 S 3
Байгальд орохын тулд Сирвододен маш олон зүйлбиологийн процессыг хөгжүүлэх, ашигт малтмалын усанд явагддаг.
Завдання.
- Эрх мэдлийн хүч.
- Zd_ysniti хувилбар:
H 2 S → SO 2 → H 2 SO 3 → NaHSO 3 → Na 2 SO 3
Молекул ба ионы үзэгчид энгийн хариу үйлдэл бичнэ үү.
- Хүчил, суурь, давс, усны диссоциаци. Razchiny дахь хүчил-суурь rivnovaga. Ionny dobutok vodi, рН-уусмал.
· (Sulphur praecipitafum) бүрсэн sirki є sirka-ийн албан ёсны эм.
Завдання.
- Дарсны хүч, тосны алотропийн өөрчлөлтийг тайлбарла.
- Zd_ysniti хувилбар:
Электрон балансын аргаар Zr_vnyati урвалууд.
- Гидролиз. Гидролизийн үйл явцад мэдрэмтгий байдал. Төрөл бүрийн давсны гидролиз. Гидролизийн алхам. Гидролизийн үе шатуудад шинэ хүчин зүйлсийг нэвтрүүлэх.
Эм зүйч нь хэт ислийн хэт ислийн 3% -ийн уусмалыг тодорхойлох урвалыг явуулна: 1 мл шингэрүүлсэн давсны хүчил, 1 мл шингэрүүлсэн давсны хүчил, 1 мл эфир, 0.5 мл кальцийн бихромат уусмал. хүчил дэх давсны хүчлийн концентраци 6
Завдання.
- Усны хэт ислийг тодорхойлох виконати урвал.
- Цахим балансын аргыг ашиглан усны хэт исэл ба эрүүл мэндийн ялгааг тодорхойлох стандарт бичих.
- VII бүлгийн толгойн пидгрупп ба сполукын элементүүдийн ерөнхий шинж чанар. Эмч- биологийн ач холбогдолтойгалоген
· Kisen є нь GF-ийн тодорхойлсон эмийн бүтээгдэхүүн юм. Янз бүрийн төрлийн исгэлэн өлсгөлөнгөөр амьсгалахад зориулсан Yogo zasosovyut.
20. Завдання.
- CO, 2, NO, NO2 илрүүлэх зөв урвалыг бич.
- Исгэлэнг үгүйсгэх лабораторийн аргын үндэс болох r_vnyannya урвалыг бичих. Электрон тэнцвэрийн аргаар урвалын индукцийн түвшин
- Хлор, хлорын ус, давсны хүчил, хлорид. Хлор ба нөгөө хагасын физик, химийн хүч. Галогенийн анагаах ухаан, биологийн ач холбогдол.
· Натри хлорид, натрийн бромид, натрийн иодид дээр үндэслэсэн эмийг эм зүйчээр хянан засварлах.
Завдання.
- Ямар ч зорилгоор эмийн сан, анагаах ухаанд давс хэрэглэх боломжтой.
- Anioni Cl-, Br-, J- дээр Vykonati yakіsnі урвал.
- Хүчиллэг хлорын физик, химийн хүч. Отримання. Засосування.
· Эмийн бэлдмэлийн иодыг зайлуулах үйлдвэрлэлийн аргуудын нэг бол өрөмдлөгийн уснаас иодыг харах үйл явц юм. Өрөмдлөгийн усны ойролцоо Йодиди нь схемийн дагуу исэлдүүлнэ.
NaJ + NaNO 2 + H 2 SO 4 → J 2 + Na 2 SO 4 + NO + H 2 O
22. Завдання.
- Сарлагийн иодын бэлдмэл, эмэнд хэрхэн гацах талаар.
- Урвалыг сурахын тулд напивреакцийн аргаар иодын донтолтын үндэс суурийг тавих.
- Халькогений шинж чанар. хүч нь исгэлэн гэж його spoluk. Анагаах ухаан, биологийн утга учир
· Натри хлорид, кальци, кальци дахь эм зүйч viznacha лавлагаа эм.
Завдання.
- Ямар ч зорилгоор використ болон эмийн бэлдмэл.
- Өгөгдсөн давсыг тодорхойлох урвалын виконати.
- Би усаар исгэлэн spoluki. Усны физик, химийн эрх мэдэлтнүүд. Пероксид ус, эрчим хүч, анагаах ухаанд хадгалалт. Организмын амьдрал дахь усны утга учир.
· Исгэлэн хагны гипохлорит бүхий Зи сполук галогенууд нь халдваргүйжүүлснээр анагаах ухааны сонирхол болдог.
Завдання.
- Энэ нь гипохлоритын хүчин чадал дээр суурилдаг уу? Нийтлэг урвалын мөрийг бич.
- Росрахувати, 2 литр идэвхтэй хлорыг арилгахын тулд хэдэн грамм хлор вапна авах шаардлагатай.
- Сирка ба сполуки. Вилной сиркагийн алотропи. Ус, ус, ус, хүчил, давсны физик, химийн хүч.
· Шивэх шүүсний хүчиллэг чанаргүй тохиолдолд давсны хүчлийг дотор нь шингэлж хэрэглэх шаардлагатай.
Завдання.
- Хүчилтэй роботын үндсэн дүрмийг дахин уншина уу.
- Rosrahuvati, 36.5% -ийн уусмал (ρ = 1.19 г / мл) давсны хүчлийн саванд хийж, үүнийг бэлтгэхийн тулд 100 мл авах шаардлагатай. 8.2% (ρ = 1.040 г / мл) хүчил.
- Усны исэл, онгон хүчил, органик хүчлийн физик, химийн хүч. Сульфитууд. Сульфати. Эрх мэдэл, эзэмшил, эзэмшил.
Эмийн сан нь 33% -ийн кальцийн ацетатыг арилгаж, органик хүчилд суурилсан 30% -ийн кальцийн карбонатын уусмалаар уусгах боломжтой стандарт шийдлүүдийн нэг юм.
Завдання.
1. Молекул болон ионы үзэгчидтэй тэнцүү урвалыг бич.
- V бүлгийн толгойн бүлгийн элементүүдийн үндсэн шинж чанар. Азотын хүч. Организмын амьдрал дахь азотын үнэ цэнэ.
· Хүчтэй суурь ба сул хүчил болох ярианы ялгааг зааж өгөх. GFH сарлагийн тогтворжуулагчийн захиалгын хувьд 1 литр уусмал тутамд 4 мл хэмжээтэй натрийн хлоридын 0.1 н уусмалыг нийлүүлнэ.
Завдання.
- CH3COONa давсны гидролизийн урвалын жишээг бич.
- Rosrahuvati, NaOH хэдэн грамм хүндэтгэх хэрэгтэй, 500 мл 0.1n хэмжээтэй тайрах. Аюулгүй байдлын технологийн өргөн хүрээний шийдлүүдийг бэлтгэх.
- Амиак. Амони давс. Хүч чадал. Анагаах ухаан, эмийн сангийн зогсонги байдал.
Эм зүйч тос хийх жор бэлтгэсэн: 1 г кальцийн карбонат, 0.5 г натрийн тетраборатыг 70 мл нэрмэл усанд хийж, 10 г стеарин хайлуулж, 15 г вазелин олиа, нимгэн урсгалаар сарнайг бүлээн карбонат болгон хутгана. устай. ...
Завдання.
- Өнгөрсөн хугацаанд та хэдэн үг үрчилж авсан бэ? Юуны төлөө дүр эсгэхийн тулд дунд хүнээ няцлах вэ? Ижил төстэй урвалыг батлах нотолгоо.
- Роботуудад зориулсан техно-химийн ваги бэлтгэх. Техно-химийн тересс дээр 1 г калори карбонатыг хүндэтгэ.
- Азотын исэл. Азотын хүчил ба давс. Физик болон химийн эрх мэдэлтнүүд. Азоттой эмнэлгийн болон биологийн үнэ цэнэ
Эм зүйч хоосон ам, хоолойг зайлахын тулд 200 мл-ийн 0.05% перманганат бэлтгэх шаардлагатай.
Завдання.
- Ямар эрх мэдэл дээр kali runtuet його улс төрийн үйл ажиллагааг permanganate? Yaki spoluksyu манганы дотор зогсонги байдалд ордог уух зорилгоор?
- 200 мл 0.05% KMnO 4 (ρ = 0.9994 г / мл) арилгахын тулд KMnO 4 грамм хэмжээг ашиглах шаардлагатай. Өгөгдсөн хүрээг олж авах арга техникийг харуулах.
- Будова азотын хүчлийн молекулууд. Азотын хүчил ба давсны физик, химийн хүч. Mediko - азот ба сполукийн биологийн үнэ цэнэ.
Эмийн бүтээгдэхүүнд мөнгөн усны (II) исэл агуулагддаг бөгөөд энэ нь антисептик шинж чанартай бөгөөд мөнгөн усны (II) шингэрүүлсэн давс хэлбэрээр натрийн гидроксидыг ялгаруулдаг.
Завдання.
1. Мөнгөн ус (II) исэлд үзүүлэх тусгай урвалыг бич. Темрява дээр ямар хариу үйлдэл хийх шаардлагатай вэ?
3. Химийн үндсэн хуулиуд.
K 2 Cr 2 O 7 + H 2 O 2 + H 2 SO 4 = K 2 SO 4 + H 2 CrO 6 + H 2 O
Nadchromic хүчил, нэгэн зэрэг олж болно, H 2 CrO 6 нь цэнхэр өнгөний нэг юм. Н2О2 бэлдмэлийг хүчлээр дүүргэх, дэмжих үйл ажиллагаа.
Завдання.
- электрон аргаар Zrіvnyati tsyu урвал.
- Ямар төрлийн хром нь исэлдэлтийн хүчийг үүсгэж болох ба энэ нь яах вэ?
- Фосфор, фосфорын исэл ба фосфорын хүчлийн хүч, тэдгээрийн эзэмшил. Фосфорын анагаах ухаан, биологийн үнэ цэнэ
· Магнийн исэл (85%) ба магнийн хэт исэл (15%) є-ийн нийлбэрийг бид "магнийн хэт исэл" гэж нэрлэдэг бөгөөд энэ нь гэдэс дотрыг гадагшлуулах үед зогсонги байдалд ордог.
Завдання.
- Антацид ба нян устгах эмийг тайлбарла. Ижил төстэй урвалыг батлах нотолгоо.
- Rosrahuvati, энэ бэлдмэлийг 100 гр бэлтгэхийн тулд та хэдэн грамм MgO, MgO 2 авах хэрэгтэй. Техно-химийн терес дээр 10 г магнийн ислийг хүндэтгэ.
- Толгойн пидгруппын IV бүлгийн элементүүдийн ерөнхий шинж чанар. Будова, Физик хүчнүүрстөрөгч дэх алотроп. Нүүрсэн дэх хүчтэй хүний баяр хөөртэй хүч.
· Viglyadi зайлах үед зогсож натрийн гидрокарбонат (ундны сод) зайлж, нүд нь гал гарсан үед угаах, дээд dichny язгууртнуудын салиа бүрхүүлүүд.
Завдання.
- Энэ нь натрийн гидрокарбонатын хүчийг антисептик мөн үү? Ижил төстэй урвалыг батлах нотолгоо. Натрийн тетраборат Na 2 B 4 O 7 ∙ 10H 2 Pro-тай антисептик болгон юу хэрэглэж болох вэ?
- NaHCO 3-ийн 5% -ийн уусмалыг 50 мл эзэлхүүнтэй (= 1.036 г / мл) бэлтгэнэ.
- Молекулын Budova, нүүрс дэх хүчлийн сполукийн физик, химийн хүч. Mediko - нүүрсэнд агуулагдах биологийн утга.
Натрийн гидрокарбонатаас өшөө авдаг антацид бэлдмэлүүдэд хүчиллэгээр хянагддаг залуу өвчний үед використови, тобто. ацидоз.
Завдання.
- Давсны үнэ ямар хэмжээгээр антацид хэрэглэх ёстой вэ? Ижил төстэй урвалыг батлах нотолгоо. Зорилгодоо хүрэхийн тулд ямар төрлийн яриаг худалдаж авч болох вэ?
- Zd_ysniti хувилбар:
NaOH → NaHCO 3 → Na 2 CO 3 → NaCl → NaNO 3
Молекул ба ионы үзэгчид энгийн хариу үйлдэл бичнэ үү.
Viconati урвал Na 2 CO 3 → NaCl → NaNO 3.
- Цахиур гэж його spoluky, танил байгаль, татгалзал, физик, химийн хүч. Mediko - биологийн утгатай цахиур.
· 2.5%-ийн NaCl уусмалыг AgNO 3-ыг зайлуулах үед зутанг угаахдаа дотооддоо хэрэглэнэ.
Завдання.
1. Би яагаад NaCl уусмал хэрэглэх ёстой вэ? Ижил төстэй урвалыг батлах нотолгоо.
3. Гурав дахь бүлгийн толгойн бүлгийн элементүүдийн ерөнхий шинж чанар. Хүч тэр його сполук уйтгартай байна. Анагаах ухаанд анагаах ухаан, биологийн ач холбогдол.
· Ховор lykarsky хэлбэрийг үржүүлэхэд ін'єкцій, ін'кцій, vikoristovyut іzotonіchny rozchin шинж тэмдэг.
Завдання.
1. Мөн изотоник ялгаа нь юу вэ? Түүнийг яагаад изотоник гэж нэрлэдэг вэ?
3. Alumіnіy гэж yogo spoluky, эрх мэдэл, татгалзах. Хөнгөн цагааны эмнэлгийн болон биологийн ач холбогдол.
· 3% -ийн усны уусмалын хэт исэл ус zasosovyat сарлаг zovn_shn_y нян устгах zasib.
Завдання.
1. Усны хэт исэл нь нян устгах ба цус-нугасны үндсэн дээр ямар үндэс суурьтай байдаг. Та аялахдаа ямар гадаад айлчлалд анхаарах хэрэгтэй вэ?
2. Росрахувати, бага. 500 мл 3% -ийн уусмал (ρ = 1.005 г / мл) -ийг зайлуулахын тулд Pergidrol (Н 2 Pro 2-ийн 30% усан уусмал, ρ = 1.1 г / мл) авна. Аюулгүй байдлын технологийг хангахын тулд өргөн хүрээний шийдлүүдийг бэлтгэ.
3. II бүлгийн толгойн металлууд. Zagalny шинж чанар, татгалзах, физик, химийн хүч. Кальци, магнийн давс. Усны хатуулаг. Усунэння жорсткости води. II бүлгийн элементүүдийн эмнэлгийн болон биологийн ач холбогдол.
· Дүүргэгч тээрэмээр эм үйлдвэрлэх өнөөгийн эмийн үйлдвэр, тархсан системийн төрөл, организмд нэвтрүүлэх арга.
Завдання.
1. Ямар системийг дисперс гэж нэрлэдэг вэ?
Тархсан системийг хэрхэн ангилах вэ?
Вигляди тархсан систем нь эм агуулдаг уу? Тодорхой өгзөг авчир.
- Razchinnik-ийг солих аргыг ашиглан Отримати нохойн гидрозол.
- Гадны металлын чухал шинж чанар, эзэмшил, физик, химийн хүч. Naivazhlivіshі poluchny metalіv. Металлын эмнэлгийн болон биологийн үнэ цэнэ
үед viglyadі ус razchinіv іznіh илтгэл, зогсонги rіdki болж эхэлнэ. ликарски форми, scho Би дахин ялгааг өөрчилж болно.
Завдання.
- Spravzhn_ razchini, razchinn_st, өдөөн хатгасан, сүйтгэхгүй байх, разчини хэт олшрох. Тэдэнд ямар хүнд сурталтай хүмүүс байдаг вэ?
- Цитрусын витриол CuSO 4 ∙ 5H 2 O-тай 100 мл (ρ = 1.051 г / мл) эзэлхүүнтэй CuSO 4-ийн 5% разин бэлтгэнэ.
- Анхны шинж чанар нь d - элементүүд юм. Металл битийн pidgroup I бүлэг ба їkh spoluk. Эмнэлгийн болон биологийн ач холбогдол.
· ОХУ-д шүүс, бага шүүстэй шинэхэн ногоон, бүтээлч сирувиныг цахилгаанаар боловсруулдаг: жимс жимсгэнэ, жимс жимсгэнэ, хүнсний ногооны үндэс үр тариа, хүнсний ногооны жижиг организм, шүүсний гадаад төрх (дотоод байгалийн) тусламжтайгаар. Дотоод vmist бол тоосгоны асар том ялгаа юм. нуклейн хүчил, нүүрс ус, таннин
Завдання.
1. Таныг "асар том" гэж нэрлэдэг үү? Сарлагийн үнэрийг ангилах уу? Асар том ялгааны хүчийг дахин уншина уу. Өсөн нэмэгдэж буй сирувинаас шүүсийг харахын үндэс нь ямар процесс байдаг вэ?
2. Гидрозолыг давсны (III) гидроксидээр FeCl-ийн гидролизийн аргаар отримат хийнэ 3. Нахиалах бүдүүвчийг бич.
- Металлуудыг битийн дагуу хоёр дахь бүлэг, шинж чанар, физик, физик, химийн хүч чадал. Эмнэлгийн болон биологийн ач холбогдол.
Валерианы үндэсийн ханд дээр үндэслэн шахмалыг бэлтгэхдээ магнийн карбонатыг суурь наповнувах болгон ашиглахыг зөвлөдөггүй, учир нь энэ нь изовалерины хүчлийг саармагжуулах, вальтратыг хүчиллэг болтол гаргаж авах боломжтой.
Завдання.
1. Магнийн карбонатын хүч чадлын илрэлийг тайлбарла. Молекул ба ионы үзэгчид энгийн хариу үйлдэл бичнэ үү. Валерианы хандтай шахмал бэлтгэхийн тулд би яаж ялах вэ?
2. Zd_ysniti хувилбар:
MgO → MgCl 2 → MgSO 4 → Mg (OH) 2 → MgOHCl
Молекул ба ионы үзэгчид энгийн хариу үйлдэл бичнэ үү.
3. Хоёрдогч пид бүлгийн VI, VII бүлгийн элементүүдийн ерөнхий шинж чанар. Хром, манган, сполукын исэлдүүлэх хүч. Эмнэлгийн болон биологийн ач холбогдол.
· lіkarskoy roslinnoy syruvin-аас viluchennya биологийн идэвхт яриа нь эмийн virobniztvі-д нүүрстөрөгчийн хүчлийн хий vikoristoyuyut Zrіdzheniy.
Завдання.
- Нүүрсхүчлийн хийд ямар хүчин зүйлээр хий нь цих зорилгоор задралд ордог вэ?
- Zd_ysniti хувилбар:
C → CH 4 → CO → CO 2 → BaCO 3 → Ba (HCO 3) 2 → BaCO 3 → CO 2
Молекул ба ионы үзэгчтэй мэдээлэл солилцоход үзүүлэх хариу үйлдэл.
- VIII бүлгийн элементүүдийн ерөнхий шинж чанарууд нь битийн пидгрупп юм. Сэтгэлийн хүч бол тэр його сполук. Эмнэлгийн болон биологийн ач холбогдол.
Сахилга батаас хоол тэжээлийн талаархи шалгалтын жагсаалт
Химийн хуулиудын талаархи үндсэн ойлголт. Атомдоо төрсөн өдрийн мэнд хүргэе.
Үелэх хууль ба үечилсэн систем Д.И. Менделеев атомын гэрэлд.
Визначення, химийн дуу чимээний шинж чанарыг хар, бод.
Утга, гэрэлтүүлгийн механизм, ковалент холбоосын хүч. Валент. Үе шат нь исэлддэг.
Оксидис: нэршил, ангилал, нэршил, хүч чадал, хүсэл тэмүүллийн аргууд.
Хүчилүүд: viznachennya, ангилал, нэршил, хүч чадал, эзэмших арга.
Оруулсан материал: виз, ангилал, нэршил, эрх мэдэл, автах арга.
Soli: нэршил, ангилал, нэршил, хүч чадал, хүсэл тэмүүллийн аргууд.
Цогцолбор spoluks: viznachennya, Werner нь budova, tipi, нэршил.
Химийн урвалын хурд. Албаны хүмүүс, scho химийн урвалын мэдрэмжийг тарина.
Буцааж болдоггүй ба буцах химийн урвалууд. Химична Ривновага. М.Шателийн зарчимє. Ривноваги тогтмол.
Исэлдэлтийн-заагч урвал: үнэ цэнэ, үндсэн ойлголт, өдөр тутмын исэлдэлт ба шинэчлэл, шинэ исэлдэлт ба хар тугалганы урвал.
Тархалтын систем: тэмдэглэгээ, ангилал. Бүдүүн тархсан системүүд: суспенз, аэрозоль, эмульс.
Асар том ялгаа: үнэ цэнэ, хүч чадал, хүсэл тэмүүлэл, будова хулгана.
Жинхэнэ шийдвэрүүд: үнэ цэнэ, үндсэн ойлголт, өдөр тутмын шийдвэрлэх үйл явц. Тархалт. Осмос. Осмотик саваа.
Цахилгаан диссоциацийн онолын үндсэн заалтууд. Цахилгаан диссоциацийн механизм. Алхам бол диссоциацийн тогтмол юм.
Хүчил, суурь, давсны диссоциаци. Ус ба рН-ууссан диссоциаци.
Гидролизийн дутагдал. Төрөл бүрийн давсны гидролиз. Гидролизийн алхам.
VII бүлгийн үндсэн бүлгийн элементүүдийн үндсэн шинж чанарууд. Галогенийн анагаах ухаан, биологийн ач холбогдол
Хлор, хлорын ус, давсны хүчил. Татгалзах, хүч чадал. Хлориди.
Кисневи сполукихлор.
Халькогений шинж чанар. Тэр його сполуки Кисен. Анагаах ухаан, биологийн утга учир
Vlastivosti spoluk исгэлэн ус (ус, усны хэт исэл). medi-аас Zastosuvannya N 2 Pro 2. Драйверын үнэ цэнэ.
Сирка. Вилной сиркагийн алотропи. Дэлхийн хөгжилтэй эрх баригчид. Сирводен. Усны хүчил ба давс.
Усны исэл, цэвэр ба цэвэр хүчил, цэвэр ба цэвэр хүчлүүдийн давс гэх мэт физик, химийн хүч.
V бүлгийн толгойн бүлгийн элементүүдийн үндсэн шинж чанарууд Ижил чадлын азот.
Аммиак ба аммиакийн давсны хүч. Анагаах ухаан, эмийн сангийн зогсонги байдал.
Азотын исэл. Азотын хүчил ба давс. Физик болон химийн хүч, хадгалалт.
Азотын хүчлийн физик, химийн хүч. нитрати. Mediko - азот ба сполукийн биологийн үнэ цэнэ.
15-р элементийн шинж чанар R. Vilny фосфор: alotropia, физик, химийн хүч, эзэмшил.
Фосфин. Фосфорын исэл ба фосфорын хүчил: хүч чадал, эзэмшил. Фосфорын анагаах ухаан, биологийн үнэ цэнэ
Толгойн пидгруппын IV бүлгийн элементүүдийн ерөнхий шинж чанар. Нүүрсэнд: нүүрсэнд агуулагдах алотропуудын физик хүч, химийн хүч.
Нүүрс дэх Kisnevy spoluky: будова молекулууд, физик, химийн хүч. Сполук нүүрсэнд байгаа Mediko-биологийн утга.
Цахиур нь spoluky: байгаль, татгалзал, физик, химийн хүчний мэдлэг. Mediko - биологийн утгатай цахиур.
Гурав дахь бүлгийн толгой бүлэг: элементүүдийн үндсэн шинж чанарууд. Энэ його spoluky хил: татгалзах, физик, химийн хүч, анагаах ухаанд хадгалах.
Хөнгөн цагаан ба його spoluky: хэт автах, физик, химийн хүч. Хөнгөн цагааны эмнэлгийн болон биологийн ач холбогдол.
II бүлгийн толгойн металлууд: шинж чанар, хүсэл тэмүүлэл, физик, химийн хүч. Кальци, магнийн давс. Усны хатуулаг. Усунэння жорсткости води. II бүлгийн элементүүдийн эмнэлгийн болон биологийн ач холбогдол.
Шалбааг хаясан: шинж чанар, эзэмшил, эрх мэдэл, navazhliv spoluks. Эмнэлгийн болон биологийн ач холбогдол.
d-элементүүдийн шинж чанар нь анхдагч юм. Металл битийн пидгрупп I бүлэг. Podnannya mіdі, sіbla. Эмнэлгийн болон биологийн ач холбогдол.
Хоёр дахь бүлгийн металлууд: Будовийн шинж чанар, физик, химийн хүч. Эмнэлгийн болон биологийн ач холбогдол.
VI, VII бүлгийн хоёрдогч бүлгүүд: бүлгийн элементүүдийн онцлог шинж чанар, хром, манганы хүч, тэдгээрийн сполук. Эмнэлгийн болон биологийн ач холбогдол.
VIII бүлэгт зааж: бүлгийн элементүүдийн ерөнхий шинж чанар, энэ бүлгийн хүч. Эмнэлгийн болон биологийн ач холбогдол.
Устаткування.Эрдэмтдийн өмнө арьсны ширээн дээр хичээлийн төлөвлөгөө, азотын хүчлийн металлтай харилцан үйлчлэлийн диаграмм, урвалжийн багц, хавсаргасан материалын туршилт байна.
Азотын исэл
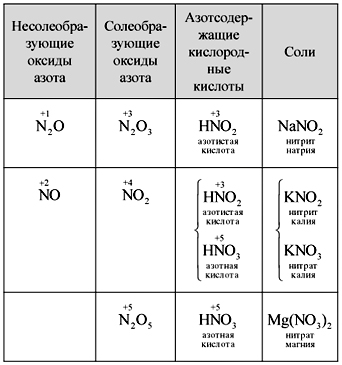
Вчитель.Азотын ислийн томъёог бичнэ үү. Ислийг давс үүсгэдэг үү, давсгүй гэж нэрлэдэг үү? Юуны төлөө?
Эрдэмтэд бие даан таван азотын ислийн томьёог бичиж, нэрлэж, азоттой холилдсон исгэлэн хүчлийг тааж, исэл ба хүчлийн хоорондох хэлбэрийг томъёолдог. Эрдэмтдийн нэг нь тунг (хүснэгт) бичнэ.
Хүснэгт
Азотын исэл, хүчил, давсыг солих
Мэдээллийн үзүүлэн:
азотын (IV) оксидын устай харилцан үйлчлэл
Вчитель. Усан онгоцтой байхҮГҮЙ 2 Лакмусын vip тестийн оронд усны түрлэг, усны түрлэг байдаг.
Хэн sposterіgaєmo? Rosechin chervonin-ийг хоёр хүчилээр дамжуулж, зүгээр.
2NO 2 + H 2 O = HNO 2 + HNO 3.
Азотын исэлдэлтийн үе шатҮГҮЙ 2 хаалга +4, tobto. вон аж үйлдвэрийн mіzh +3 і +5, хөшүүн байдлын түвшинд азотын (IV) ислийг азот ба азот гэсэн хоёр хүчил хэлбэрээр авчирдаг.
Та будова молекулуудын агуулах
Вчитель.Азотын хүчлийн молекулын томъёог бичихийн тулд молекул жинг тооцоолж исэлдсэн элементийн үе шатыг илэрхийлнэ үү. Бүтцийн болон электрон томъёог хадгалах.
Ийм томъёог боловсруулах эрдэмтэд (Зураг 1).
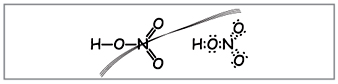
Вчитель.Томъёоны тоогоор арван электрон азотыг ороож болох бөгөөд энэ нь улаан өнгөтэй байж болохгүй, учир нь Бусад хугацаанд азот олддог бөгөөд шинэ бөмбөгний сүүлчийн бөмбөгөнд аль болох их электроник байхгүй байж болно. Хэт давтамжийг суллаж байгаа мэт шингээж авдаг боловч азотын атом ба хүчил дэх атомуудын аль нэгний хооронд донор-хүлээн авагч механизмын ард ковалент холбоос үүсдэг.(Зураг 2).
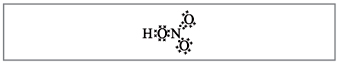
Жижиг. 2. Азотын хүчлийн электрон томъёо.
Хар цэгээр тэмдэглэсэн электрон ба азотын атом
Азотын хүчлийн бүтцийн томъёог дараах байдлаар гаргаж болно(Зураг 3) :
Жижиг. 3. Азотын хүчлийн бүтцийн томъёо
(довтлогчтой хандивлагч-хүлээн авагчийн заалт)
Гэсэн хэдий ч, энэ нь дэд холбоос нь kisny хоёр атомын хооронд тэнцүү хуваагдсан байна өмнөх замаар авчирсан байна. Азотын хүчил дэх исэлдсэн азотын үе шат нь үнэтэй +5, валент (араатны хүндэтгэл) нь цахим бооцооны сонголтоос илүү үнэтэй байдаг.
Азотын хүчлийн физик хүч
Вчитель.Энд нэг лонх шингэрүүлсэн концентрацитай азотын хүчил байна. Бие махбодийн хүчийг тодорхойл.
Эрдэмтэд сарлагийн ридина нь ус, зажлуур өнгөтэй, хурц үнэртэй, азотын хүчилд чухал ач холбогдолтой гэж тодорхойлсон. Өнгө, үнэргүй Разчин азотын хүчил.
Вчитель. Додам, азотын хүчлийн буцлах температур +83 ° C, хөлдөх температур -41 ° В, тобто. Цэ ридин нарын сэргэлэн оюуны төлөө. Хурц үнэртэй, түүнийг тайлахад хүчил нь гэрэл гарахаас өмнө бага зэрэг төвлөрдөг, эсвэл халах үед ихэвчлэн нурдаг гэж тайлбарладаг.
Хүчиллэг хүчний хими
Вчитель. Хүчилүүдийг ямар хэллэгээр сольж байгааг таагаарай?(Шинжлэх ухааны нэр.)
Урвалж хэрэглэхээсээ өмнө урвалын жагсаалтыг зөгнөж, болгоомжлолтоо бичээрэй (TED гэрэлд эрэлтийг бичихэд үзүүлэх хариу үйлдэл).
Одоо бид азотын хүчлийн өвөрмөц хүчээр өөрсдийгөө тэжээж байна.
Бид өнгөлсөн, гэхдээ zbergannі zhovtіє тохиолдолд хүчил, одоо бид химийн урвал явуулж байна:
4HNO 3 = 2H 2 O + 4NO 2 + O 2.
(Шинжлэх ухааны үүднээс урвалын электрон тэнцвэрийг бие даан бүртгэх.)
"Бүри хий"(NO 2) фарбу хүчил.
Ялангуяа хүчил нь метал болж буурдаг. Тэд хүчилээс ус цацдаг гэдгийг та мэднэ, эс тэгвээс азотын хүчилтэй харилцан үйлчлэлийн явцад алдагдахгүй.
Үдэшлэг дээр байгаа диаграммыг гайхшруулаарай, хүчил ба концентраци нь металтай урвалд ороход хий хэрхэн харагддагийг харуулсан болно.(Диаграммтай робот.)
Мэдээллийн үзүүлэн:
төвлөрсөн азотын хүчлийн мидитэй харилцан үйлчлэл
Илүү үр дүнтэй нь азотын хүчлийн урвалыг үзүүлэх явдал юм (конц.) Дунд зэргийн нунтаг, эсвэл зөгийн балны жижиг хэсгүүдтэй сум нэмсэн.
Шинжлэх ухааны хувьд урвалын электрон балансыг бие даан бүртгэх:
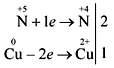
Хүчилд дурлах
Вчитель. Азотын хүчлийн тэжээл нь харагдахгүй байгаа тул хичээл нь ойлгомжгүй байх болно.
Лабораторийн арга: нитрат дээр төвлөрсөн давсны хүчлийн дия (Зураг 5).
NaNO3 + H2SO4 = NaHSO4 + HNO3.
Промисловосты үед амик аргаар үндсэн эзэмшил дэх хүчил.
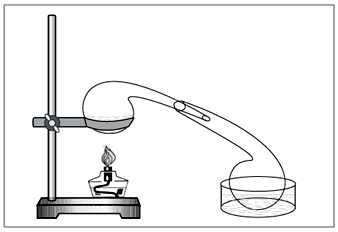
Жижиг. 5. Лабораторид азотын хүчлийг зайлуулах зориулалттай
гараар сонгосон vikoristovuvati хуучирсан химийн хоол - retort
Хүчиллэгийг 2000 ° C хүртэл температурт (цахилгаан нум) азот ба хүчилтэй байлгах арга нь тийм ч өргөн биш юм.
Орос улсад азотын хүчлийг зайлуулах түүх нь химич-технологич Иван Иванович Андреев (1880-1919) нэртэй холбоотой байв.
Вин 1915 х. Аммиакаар хүчиллэгжүүлэх анхны суурилуулалтыг нээж, 1917 онд үйлдвэрийн хэмжээнд задлах аргуудыг хэрэгжүүлсэн. Донецкийн ойролцоох анхны барилгын үйлдвэр.
Бүх арга нь хэд хэдэн алхмуудыг агуулдаг.
1) Боловсролын болон нийгмийн арга хэмжээг бэлтгэх.
2) Платинум цитци дээр амиаку киснем повитрягийн исэлдэлт:
4NH 3 + 5O 2 = 4NO + 6H 2 O.
3) Цаашид азотын исэл (II) азотын исэл (IV) хүртэл исэлдэж:
2NO + O2 = 2NO2.
4) Ус ба хүчлийн агууламжаас азотын (IV) ислийг тодорхойлох:
3NO2 + H2O = 2HNO3 + NO.
Хүчил агуулсан үйл явцыг явуулахад хялбар, бүх азотын (IV) исэл нь азотын хүчил болж хувирдаг.
5) Азотын хүчлийг зайлуулах үе шатны дүгнэлт - исэлээс азот руу агаар мандал зэрэг хий цэвэрлэх. Цих хийн агуулах: 98% хүртэл азот, 2-5% хүчил, 0.02-0.15% азотын исэл. (Азотыг аммиакийг исэлдүүлэхийн тулд авсан аммиакийн эх үүсвэрээс авдаг.) Хэрэв эдгээр хий дэх азотын исэл 0.02% -иас их байвал азотын катализаторыг катализатор болгохын тулд тусгайлан хийдэг бөгөөд энэ нь тийм ч бага тоо гарах болно. исэлдэлтийн томоохон асуудлууд.
Хоол тэжээлийн тухай хэлсэн бүх мацаг барилтаар бичсэн: хүчил бидэнд юу хэрэгтэй вэ?
Сорох хүчил
Вчитель.virobrytvu нь азотын хүчил vicarious: азотын сайн, эхний ээлжинд ами хүчлийн давс (х vv obsess?); вибуховийн яриа (яагаад?); барвникив; nіtratіv, хэрхэн довтолгооны түвшинд байх талаар.
Хаалтын материал
Ангид зориулсан фронтын туршлага
- Яагаад азотын хүчил дэх исэлдсэн азотын хэмжээ +5, харин chotiri-ийн валент байдаг вэ?
- Азотын хүчил тод металлтай урвалд орохгүй юу?
- Та давсны хүчил, азотын хүчил авах хэрэгтэй, ширээн дээр зөгийн бал, хөнгөн цагаан, цайр гэсэн гурван металл байдаг. Юу гэсэн үг вэ?
Туршилт
Сонголт 1
1. Азотын атом дахь энергийн түвшний электронуудын хуваарилалттай ямар тооны тоо хамааралтай вэ?
1) 2, 8, 1; 2) 2, 8, 2; 3) 2, 4; 4) 2, 5.
2. Практик урвалын практик байдлыг дуусгах:
1) HNO 3 (ягаан) + Cu ...;
2) Zn + HNO 3 (конц.) ...;
3) HNO 3 + MgCO 3 ...;
4) CuO + KNO 3….
3. Дүрмээр бол үйл явцын нэг үе шатыг танилцуулна амлалтуудазотын хүчил.
1) 4NH 3 + 5O 2 = 4NO + 6H 2 O;
2) 5HNO 3 + 3P + 2H 2 O = 3H 3 PO 4 + 5NO;
3) N 2 + O 2 = 2NO.
4. Исэлдэлтийн сөрөг үе шатууд нь доод хэсэгт азотоор илэрдэг.
1) N 2 O; 2) ҮГҮЙ; 3) NO 2; 4) Na 3 N.
5. Зөгийн балны үртэс нь концентрацитай азотын хүчилтэй харилцан үйлчлэлцэх нь батлагдсан хүртэл:
1) NO 2; 2) ҮГҮЙ; 3) N 2; 4) NH 3.
Сонголт 2
1. Азотын валентийн утга нь нэг юм.
1) 1; 2) 2; 3) 5; 4) 4.
2. Баяжуулсан азотын хүчлийн натри, хөнгөн цагаан, цайр, зализо, хром зэрэг дэвшилтэт металлуудтай харилцан үйлчлэлцэх боломжуудыг бич.
3. Азотын хүчилд зориулсан є syruvinoy гэх мэт чичиргээтэй яриа:
1) азот ба ус;
2) amіak, заримдаа тэр ус;
3) нитрат.
4. Баяжуулсан азотын хүчил нь дараахтай урвалд ордоггүй.
1) нүүрстөрөгчийн давхар ислийн хий;
2) давсны хүчил;
3) нүүрсэнд;
4) гидроксидын баар.
5. Бүр шингэрүүлсэн хүчил ба магнийн харилцан үйлчлэлээр дараахь дүр эсгэх хэрэгтэй.
1) NO 2; 2) ҮГҮЙ; 3) N 2 O; 4) NH 4 NO 3.
Гэрчлэл Сонголт 1. 1 – 4;
3 – 1; 4 – 4; 5 – 1. Сонголт 2. 1 – 4;
3 – 2; 4 – 1; 5 – 4. |
Тривневий залик спиннер 11 анги
Сэдэв: " МЕТАЛ"
Хичээлийн хэлбэр:залик
Цил: "Металл бус" сэдвээр тэтгэлгийн талаархи мэдлэгийг дахин авч үзэх; талаар олон нийтэд мэдээлэл өгөх асар их хүчметалл бус ба сполук; дагалдах болон ялгаатай аж ахуйн нэгжүүдээс стандарт бус, амьдралын нөхцөл байдлын талаархи мэдлэгийг боловсруулахад дэмжлэг үзүүлэх.
Завдання:
1. Олон нийтийн эзэмшлийг шинэчлэн боловсруулж, металл бус ба їх сполукуудын талаархи судалгааны мэдлэгийг хаах; хөгжлийг төөрөгдүүлсэн логик, володя химийн үүднээс авч үзэх; дэвшилтэт, боломжтой, стандарт бус барилгуудын тусламжтайгаар хүмүүсийн материалыг албан ёсны - логик хүлээн авахаас дүрслэлийн логик мессеж рүү шилжих.
2. Razvinuvichki болгоомжтой, өршөөл илрүүлэх, үйлдвэрийг сэргээх, vivinya smut харж, баримтуудыг барьж, wow, энэ нь логикийн муу бодол санаа, роботууд; vchiti rozmіrkovuvati, robiti pripuschennya, урьдчилсан мэдээ.
3. Эрдэмтдийн танин мэдэхүйн үйл ажиллагаа, бүтээлч бие даасан байдлыг ашиглан дүрслэх үндсэн санааг илэрхийлэхийг хүлээн зөвшөөрөх.
4. Vihovuvati vmіnnya pratsyuvati өөрийгөө хянахаас өөрийгөө хянах. Амьдралд амьдардаг хүмүүсийн холбоосыг харуул. Vihovuvati шинжлэх ухааны svitoglyad эрх мэдлийн харилцан холболтын үндсэн дээр гэж budovi.
Энэ урвалжтай харьцах:туршилтын хоолой, спиртийн чийдэн, туршилтын хоолой, сирник ба расчини: ;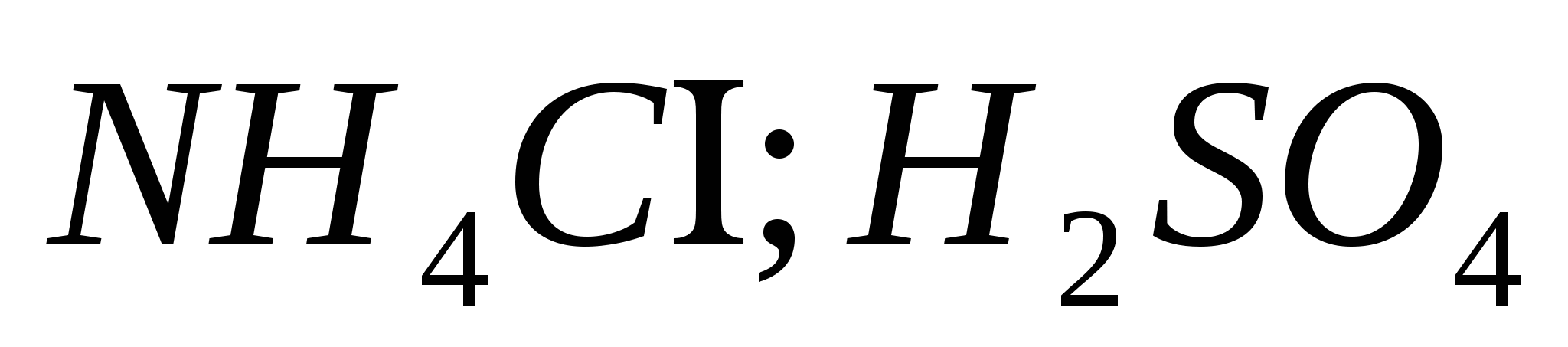 ;
; ;
;
 .
.
Орцны өмнөх бэлтгэл.
Багш нь эхлэлийн төрлүүдийн эвхэгддэг байдлын гурван түвшинг бэлтгэсэн: тест, онолын тэжээл, үгийн ойлголт, хөгжил.
Багш таныг сургахад бэлэн байна, учир нь та багаа шинэчлэх гэж байна.
1-2 хоногийн хугацаанд мэдээллийн хуудсыг оффис руу илгээдэг.
Маршрутын хуудас нь арьсанд харагдана. Алхам дээрх роботуудын диаграммыг маршрутын хуудсан дээр зааж өгсөн болно.
МАРШРУТЫН ХУУДАС.
Ф.І. эрдэмтэн
Алхамыг нэрлэ
Үе шатуудын хуваарь
Регистрийн дугаар
Буцаах гарын үсэг
Розрахунковын асуудал
Rosp_znavannya
Дахин хувилгаан
Хичээлдээ яв.
Эрдэмтэд маршрутын хуудас, 5 хоосон хуудас, үзэгний хамт ангид орж, 1-р дугаарын утгуудын алхам руу орно. Эрдэмтэд эвхэгддэг байдлын мэдлэгийг цуглуулж, хэрэв та унтвал тайзан дээр шинэ үсэг рүү буцна. "Ярианы зориулалт"-ын тухай.
Робот дээр арьсны үе шатыг нэвтрүүлсэн 7 - 8 quills нь vistavlya-г маршрутын хуудас rivn болгон хувиргадаг, үгүй.
Тооцооллыг бүх үе шатуудын арифметик дундажаар харуулав.
НЭМЭГЧ
"Яриаг хүлээн зөвшөөрөх"
1 эргэв
1. Та үүнийг мэдэж байгаа эсэхээ шалгаарай 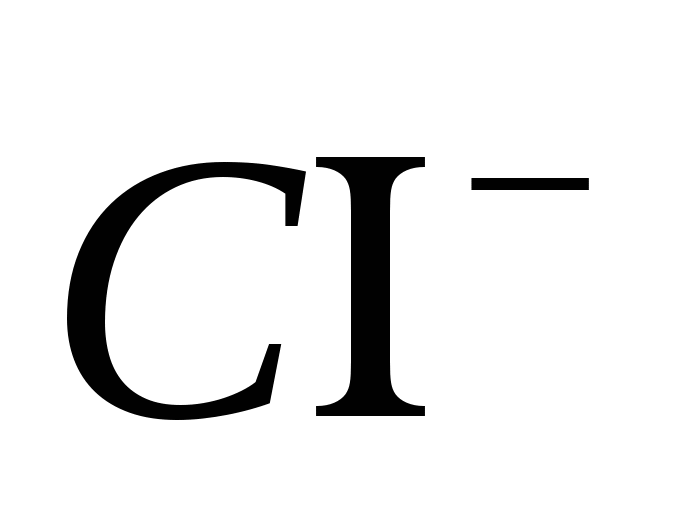
2. Ион тунгалаг байгаа эсэхийг шалгаарай 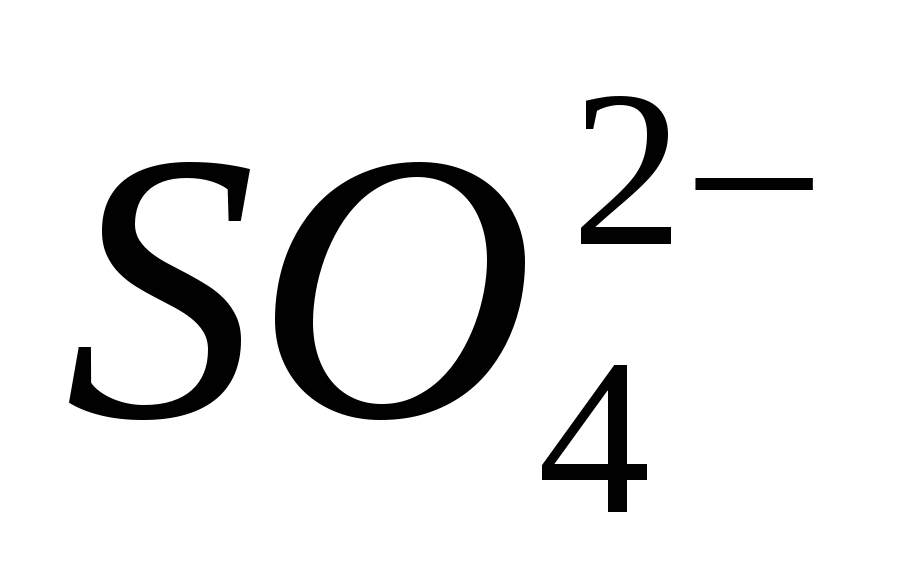
3. Ион тунгалаг байгаа эсэхийг шалгаарай 
4. Үүнийг тодорхой болго 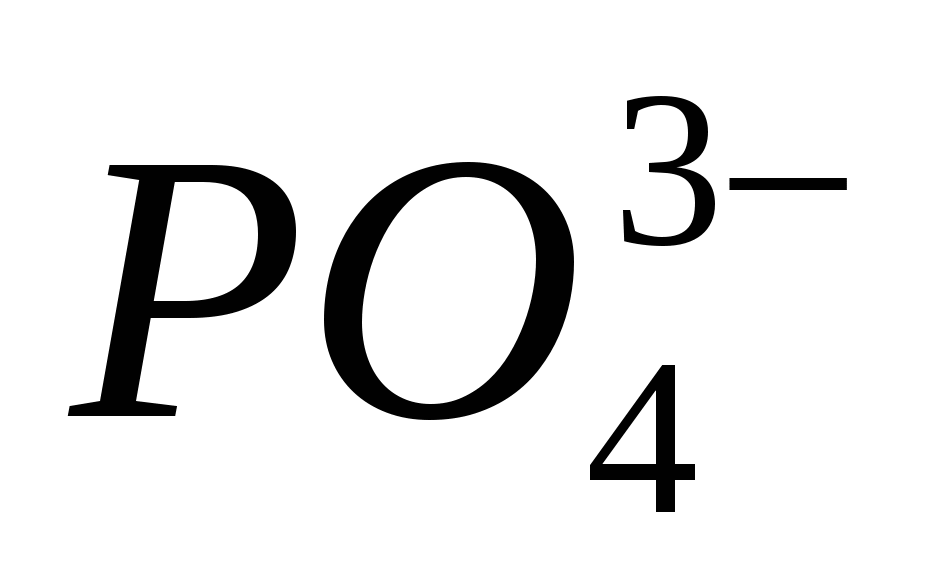
5. Ион тунгалаг байгаа эсэхийг шалгаарай 
2 эргэв
1. Нэг урвалжийн цаана байгаа ялгааг тодорхойлно уу:
2. Нэг урвалжийн ялгааг тодорхойлно уу:
3. Нэг урвалжийн ялгааг тодорхойлно уу:
4. Нэг урвалжийн ялгааг тодорхойлно уу: 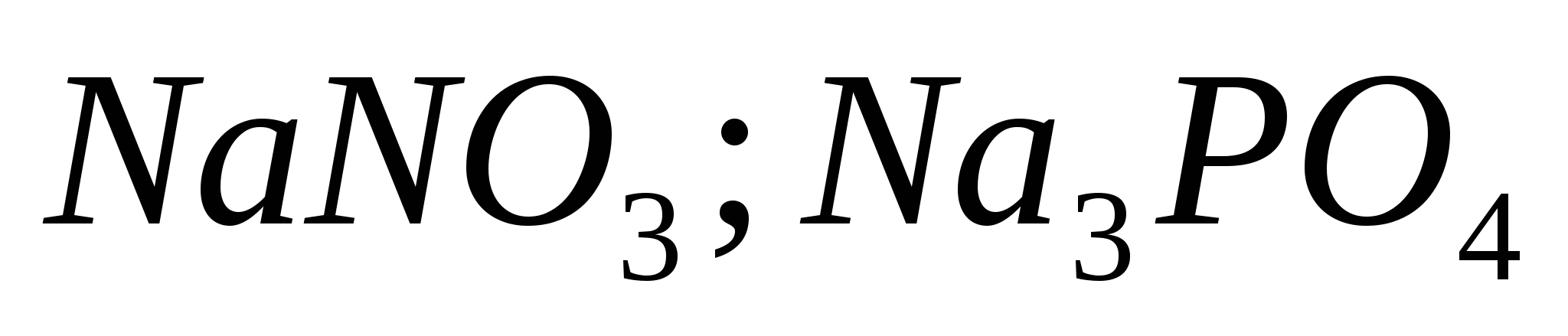 ;
;
5. Нэг урвалжийн ялгааг тодорхойлно уу:
3 эргэв
1. Зөвшөөрөх нэмэлт урвалжгүйгээр зураг төсөл:
2. Зөвшөөрөх нэмэлт урвалжгүйгээр зураг төсөл:
3. Зөвшөөрөх нэмэлт урвалжгүйгээр зураг төсөл:
4. Зөвшөөрөх нэмэлт урвалжгүйгээр зураг төсөл:
5. Зөвшөөрөх нэмэлт урвалжгүйгээр зураг төсөл:
"Ярианы хянан үзэх" товчийг дарна уу.
1 эргэв
1. Стандарт урвалуудыг дуусгах
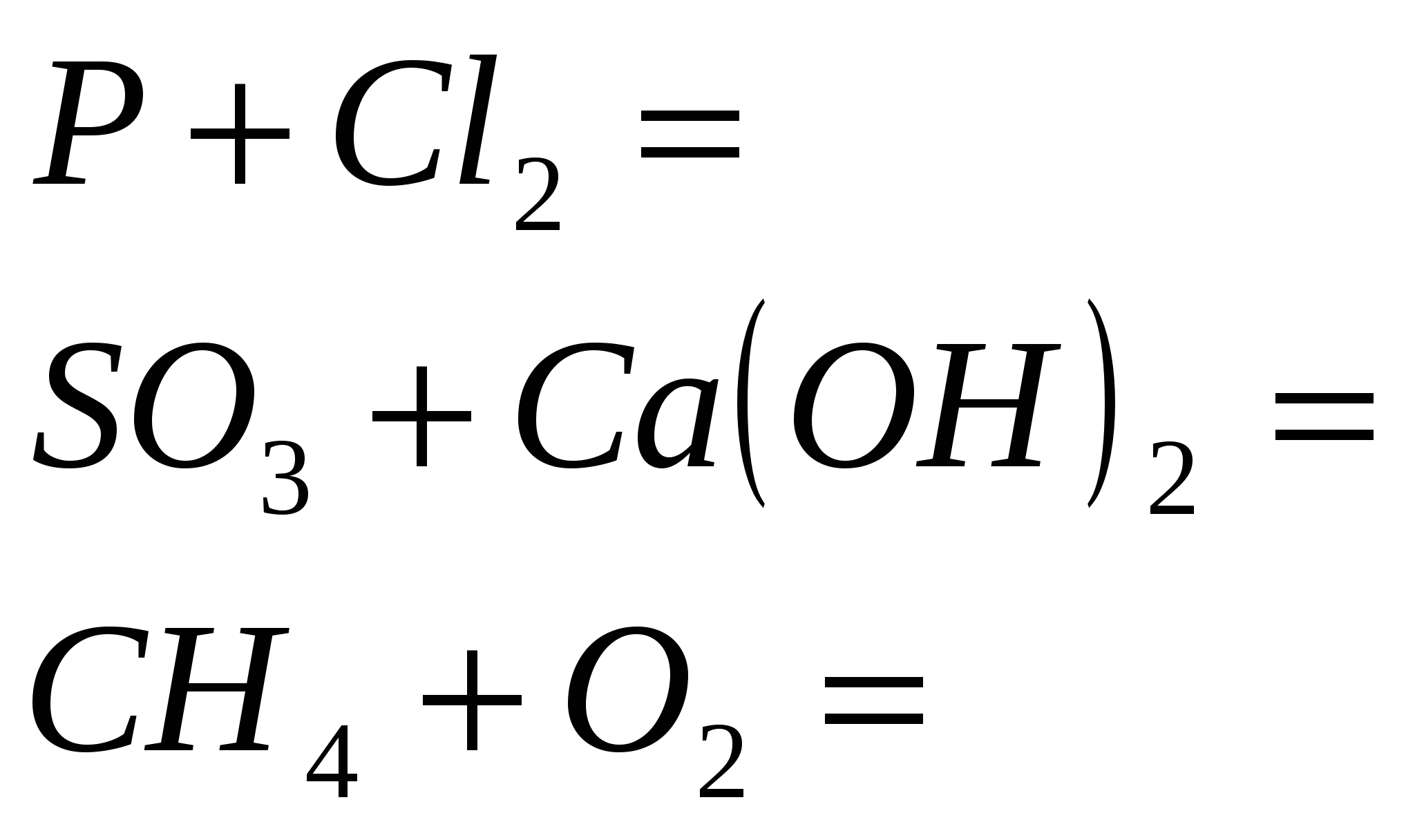
2. Ердийн урвалыг дуусгах
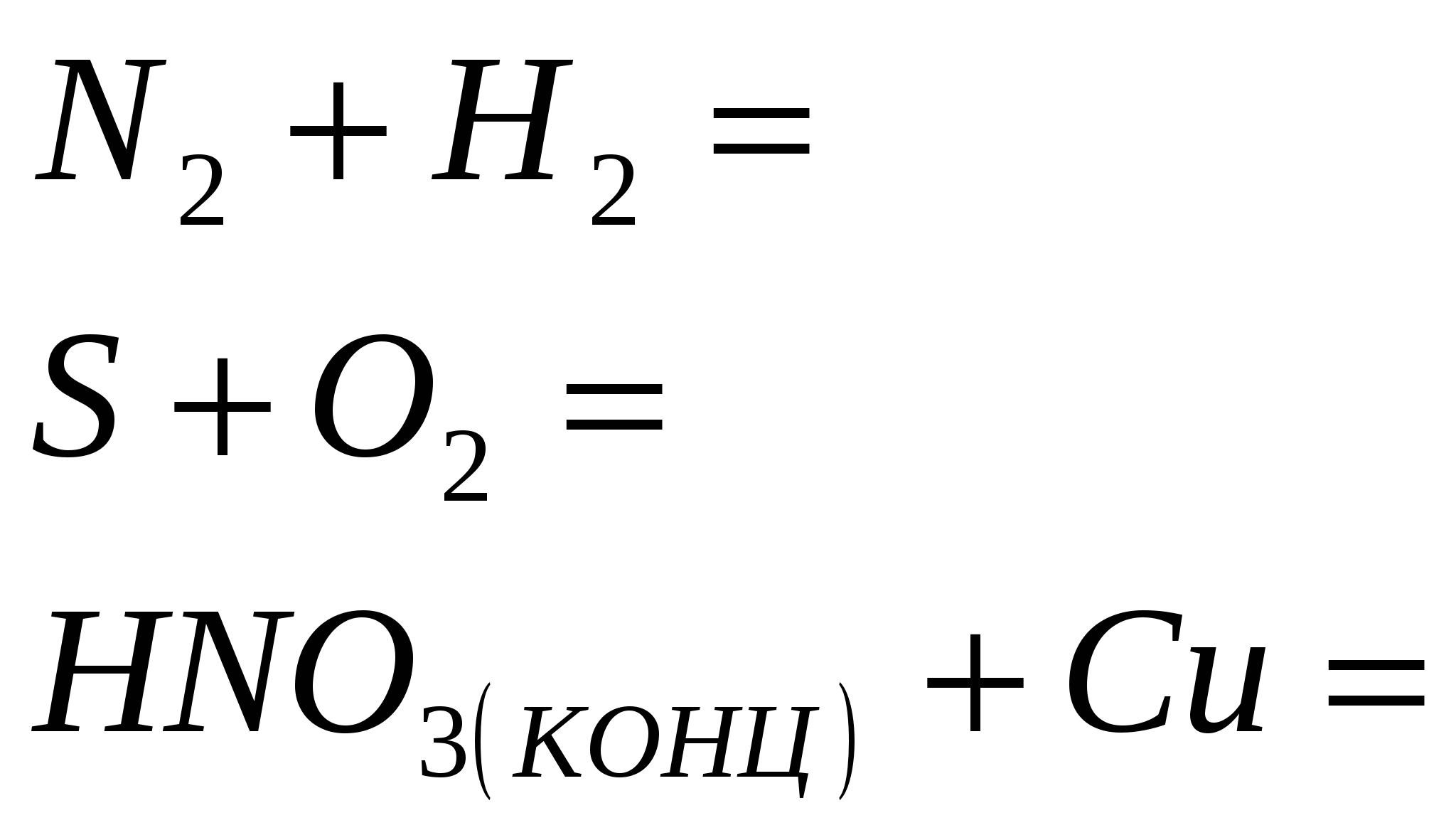
3. Стандарт урвалуудыг дуусгах
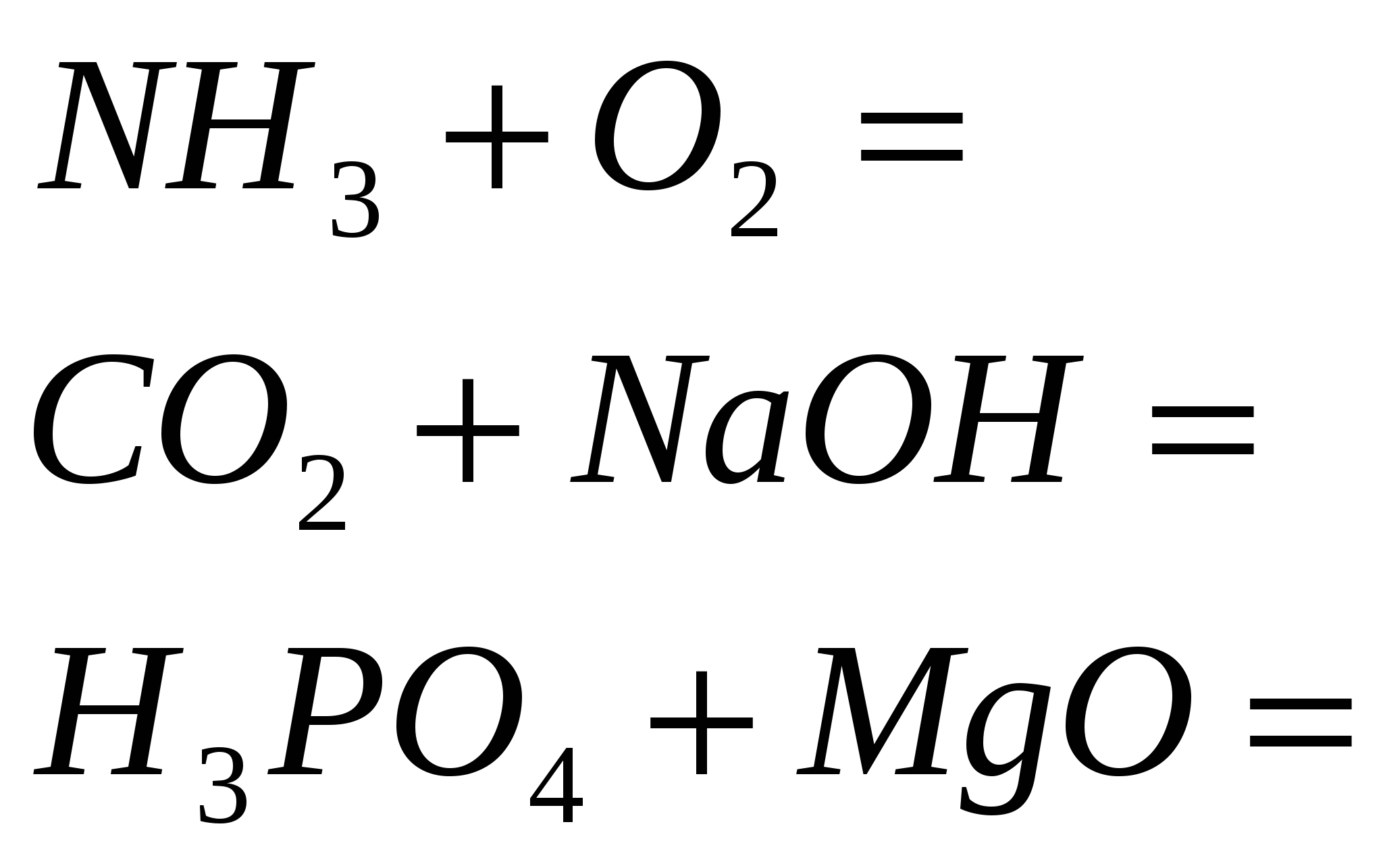
4. Стандарт урвалуудыг дуусгах
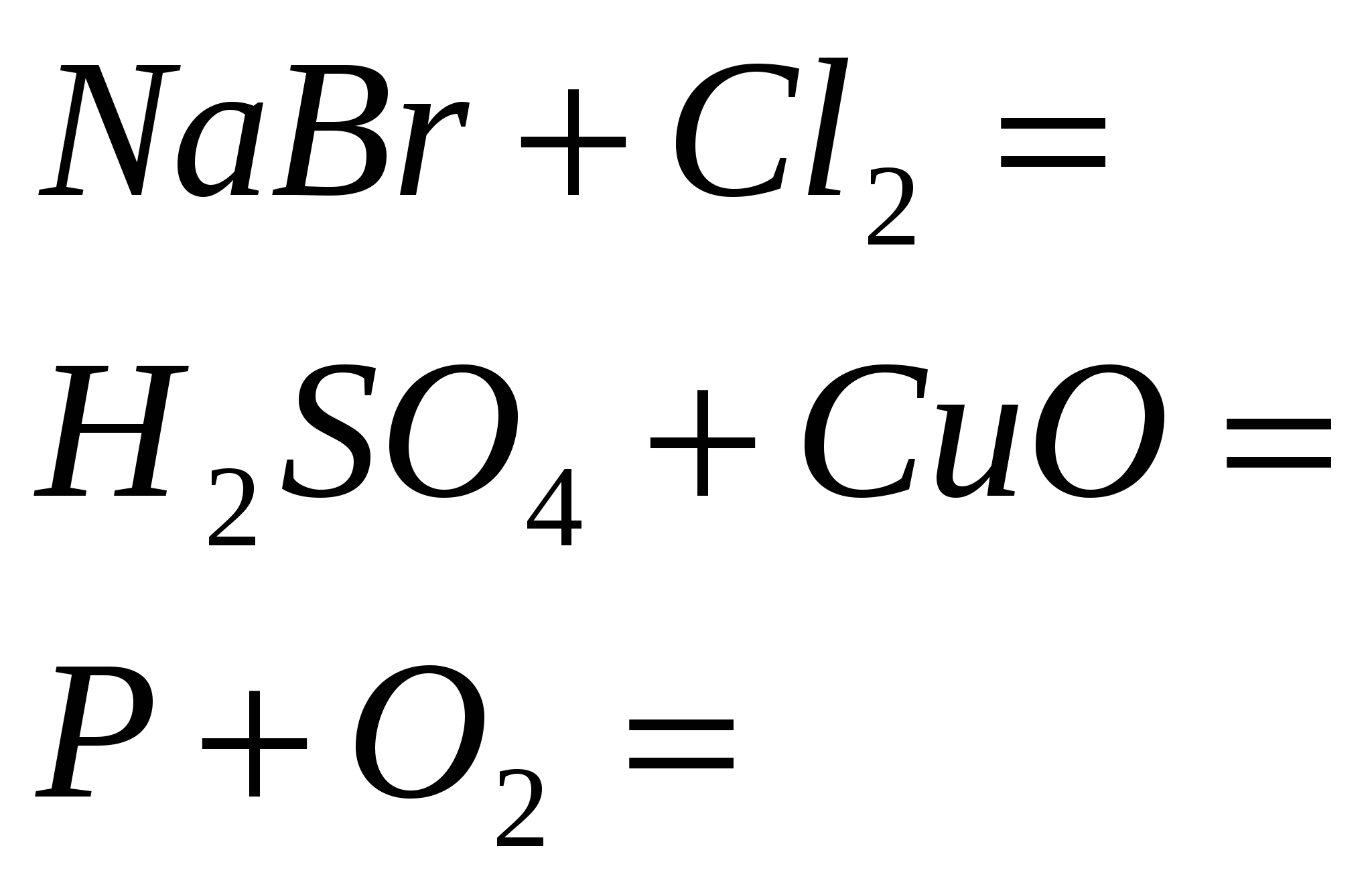
5. Стандарт урвалуудыг дуусгах
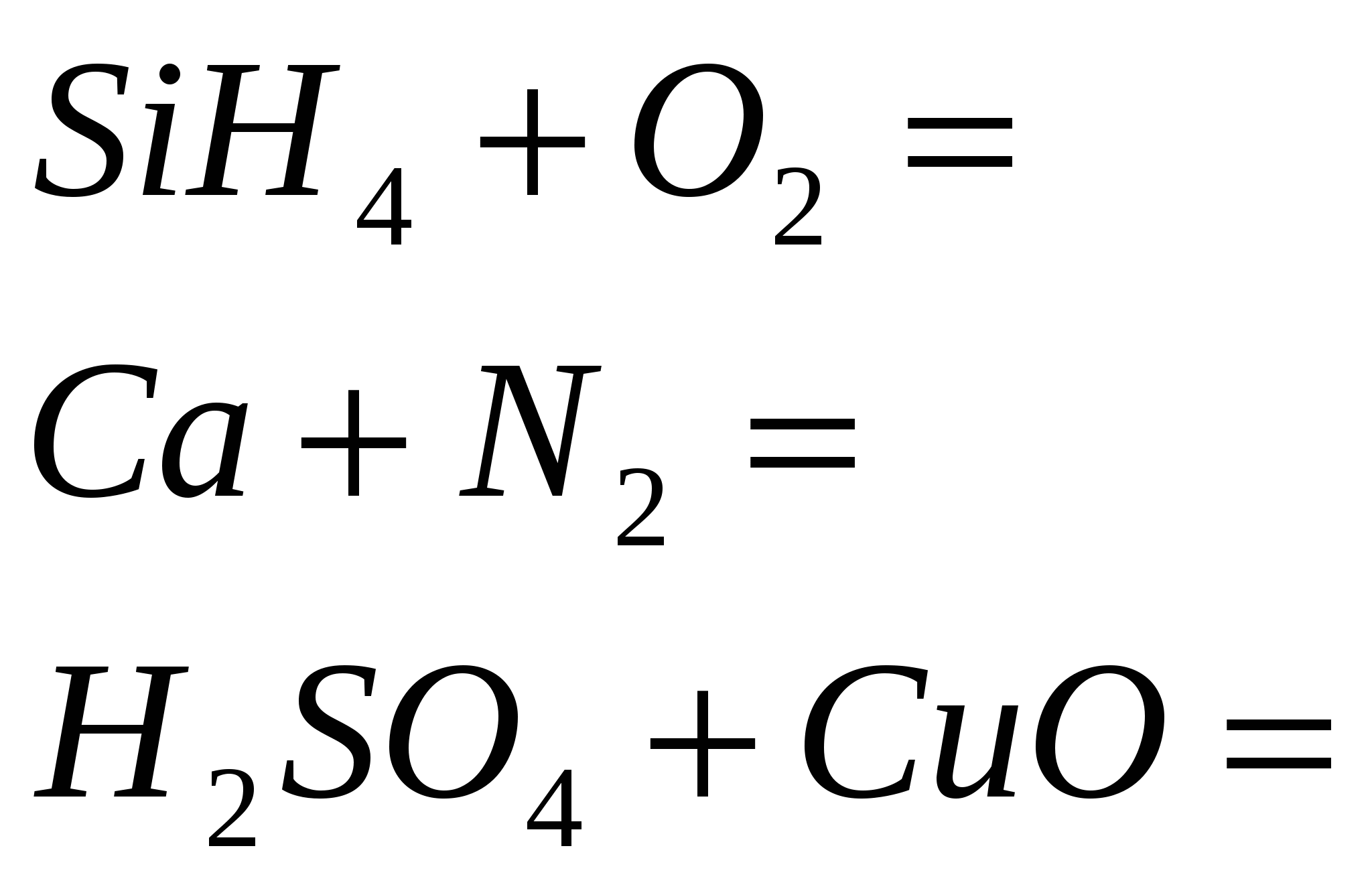
2 эргэв
Засвар хийхгүй:
3эргэв
Засвар хийхгүй:
3.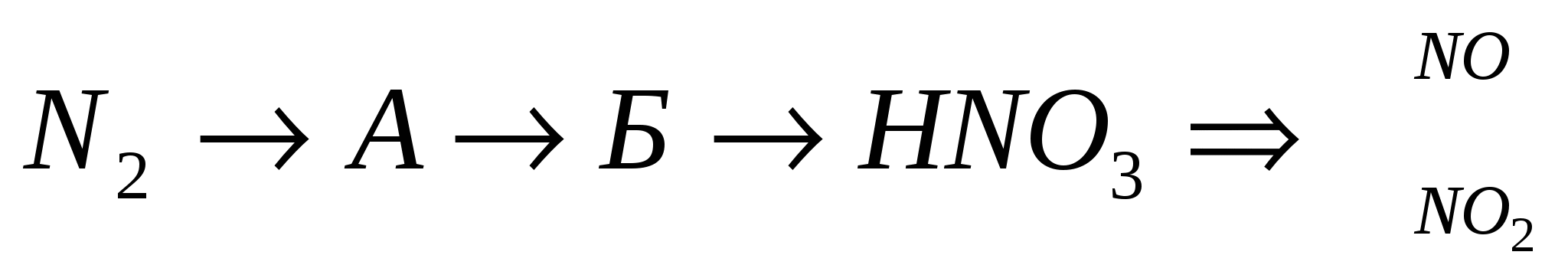
"Туршилт" алхам
Сонголт 1
a) O, b) S, c) Cl, d) C, e) Si.
а)  , b) C, c)
, b) C, c)  , G)
, G)  д)
д)  .
.
а)  , б)
, б) 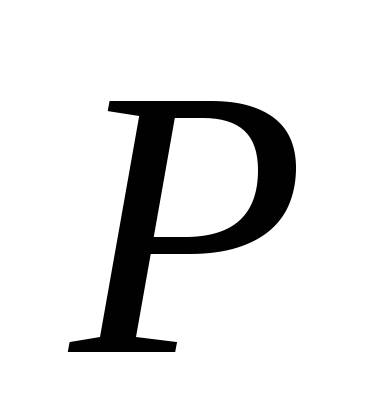 , v)
, v)  , G)
, G)  д)
д)  .
.
4. Элементийн электрон томьёо. Його нисдэг воднева сполук:
а)  , б)
, б)  , v)
, v)  , G)
, G)  .
.
5. Цуврал дахь гидрогалийн хүчлийн өсөлтийн хүч:
а) ![]()
б) 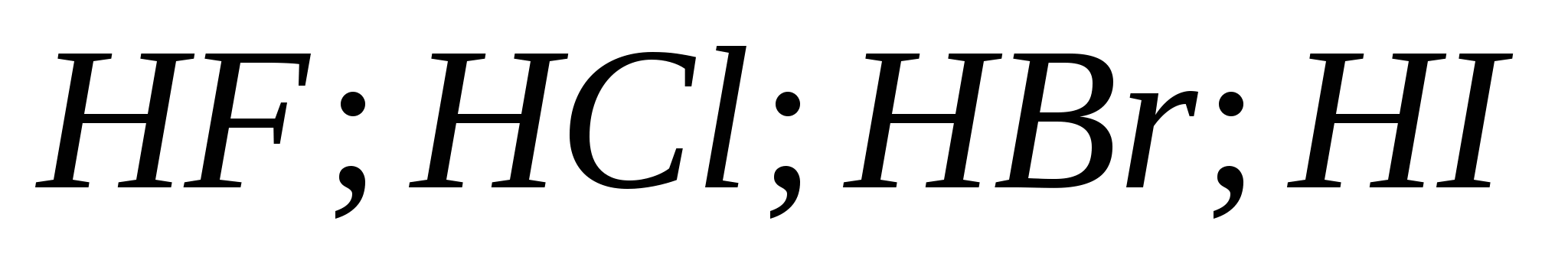
v) 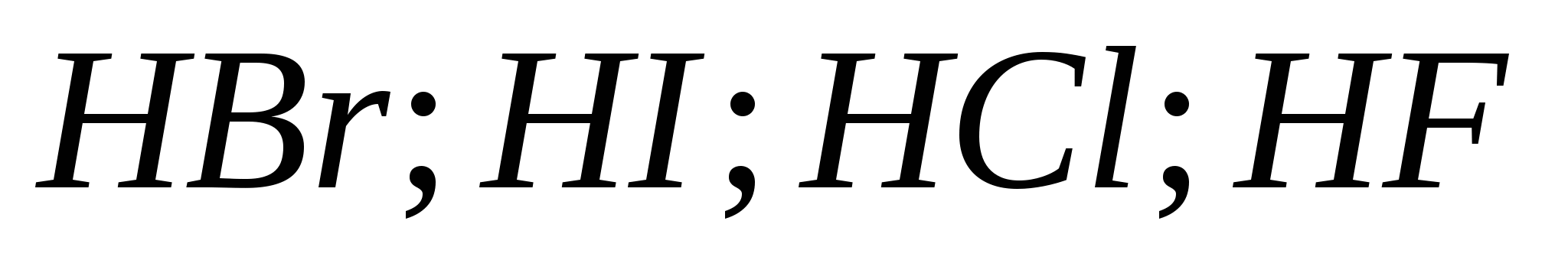
G) 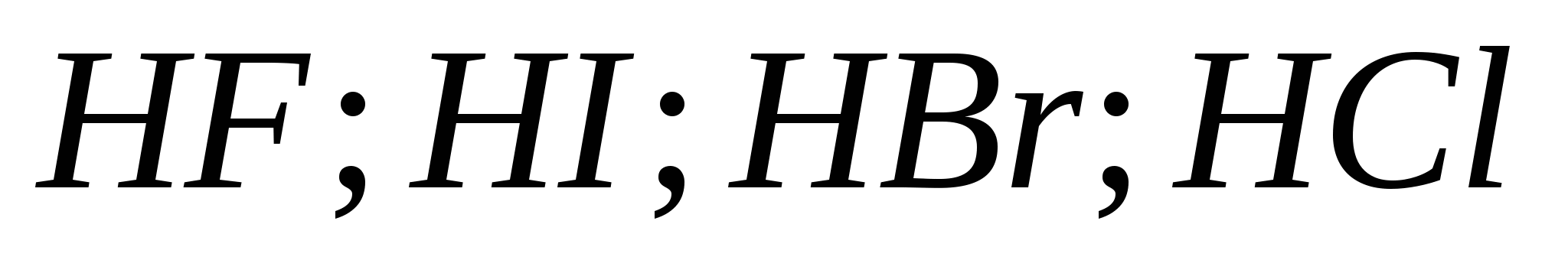
6. Бойовых диахын өмнө галогенуудаас яриа гацсан байна:
а) фтор; б) хлор; в) иод; г) бром.
7. Атомыг хөгжүүлэх исэлдүүлэх чадвартай шингэрүүлсэн сирчаны хүчил:
а)  , б)
, б)  , v)
, v)  .
.
8.Азотын исэл V-ийг нэгтгэж болно:
а) 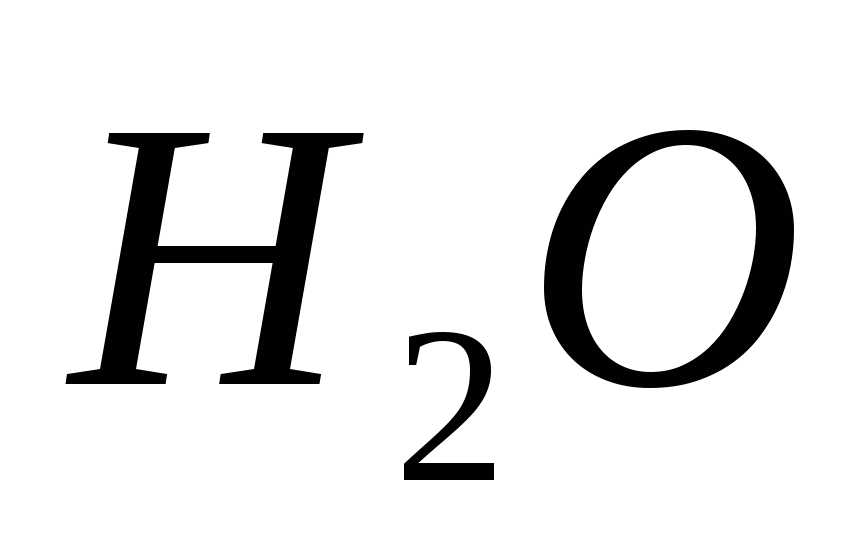 , б)
, б) 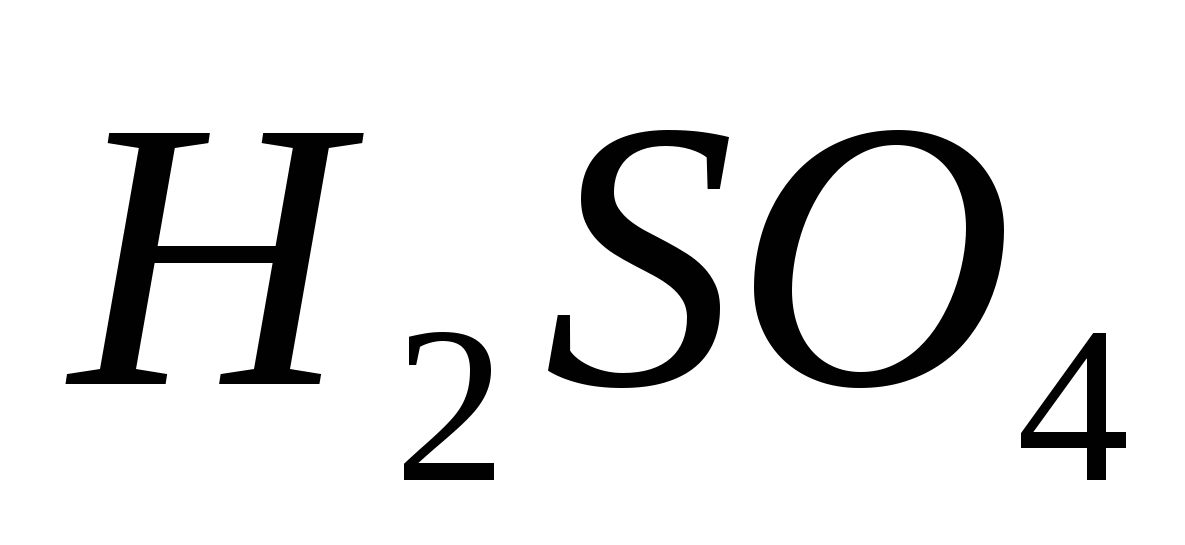 , v)
, v)  , G)
, G) 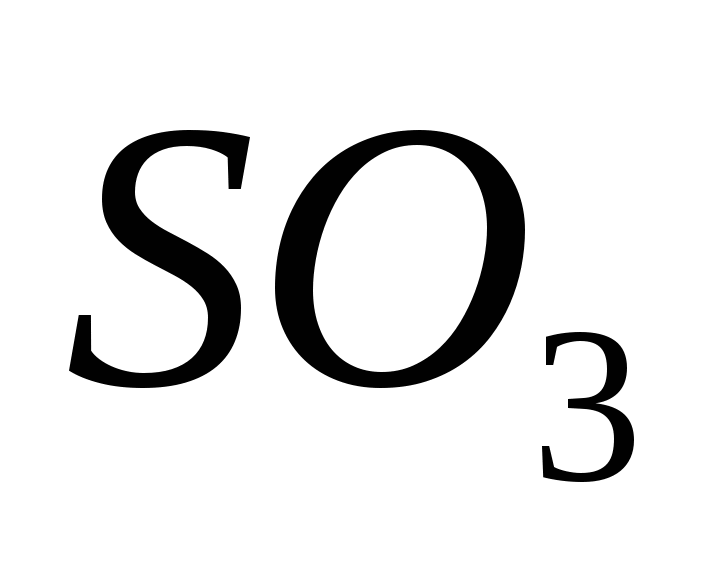 д)
д) 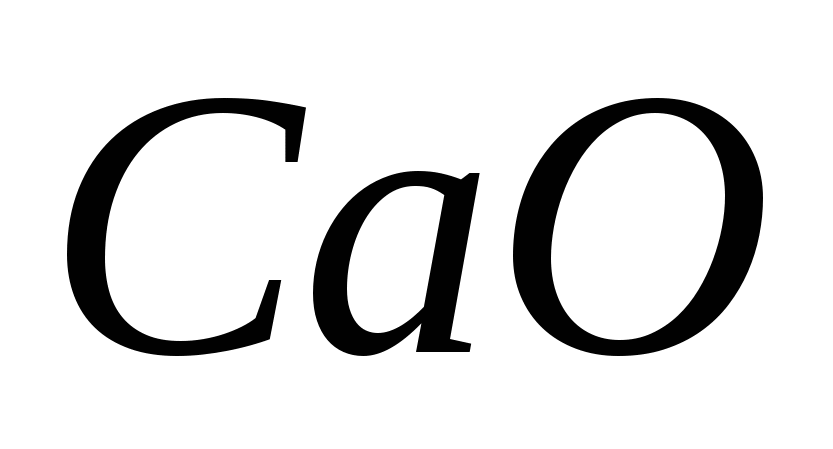 .
.
9. Хариу үйлдэл: Америкт ийм эрх баригчдыг авчрах:
a) исэлдэлтийн, б) дан, в) хүчил, г) суурь.
10. Дараалсан хүчлийн хүч
а) өөрчлөгдөх, б) өсөх, в) их өөрчлөгдөх, дараа нь өөрчлөгдөх; г) унах, өсөх, д) өөрчлөгдөхгүй байх.
Сонголт 2
Атомын болор нигүүлслүүд нь батлагдсан энгийн яриа байж болно:
а)  , б)
, б)  , v)
, v)  , G)
, G)  д)
д)  .
.
2. Хэвийн оюун ухаанд зориулсан хий є:
а)  , б)
, б)  , v)
, v)  , G)
, G)  д)
д) 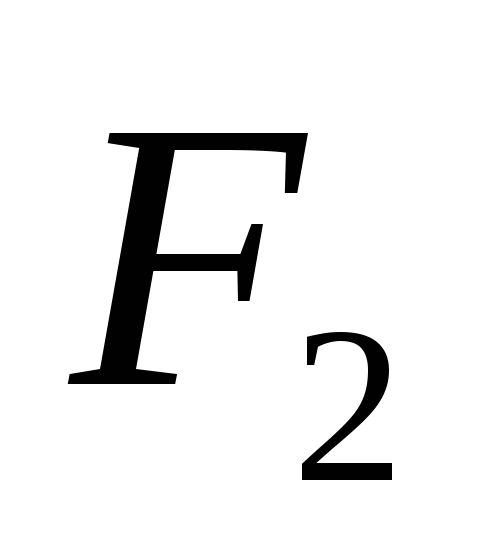 .
.
3. Аллотропик өөрчлөлтүүд нь дараах элементүүдийг тогтооно.
а)  , б)
, б)  , v)
, v)  , G)
, G)  д)
д)  ,
,
4. Элементийн электрон томьёо. Його нисдэг воднева сполук:
а) 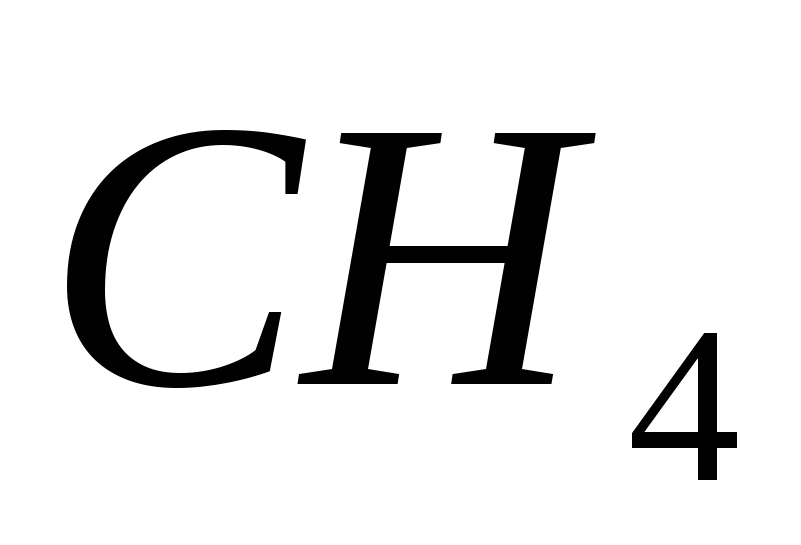 , б)
, б)  , v)
, v)  , G)
, G)  д)
д)  .
.
5. Зуны усан замын гол хүч нь дараах дарааллаар өөрчлөгдөнө.
а) 
б) 
v) 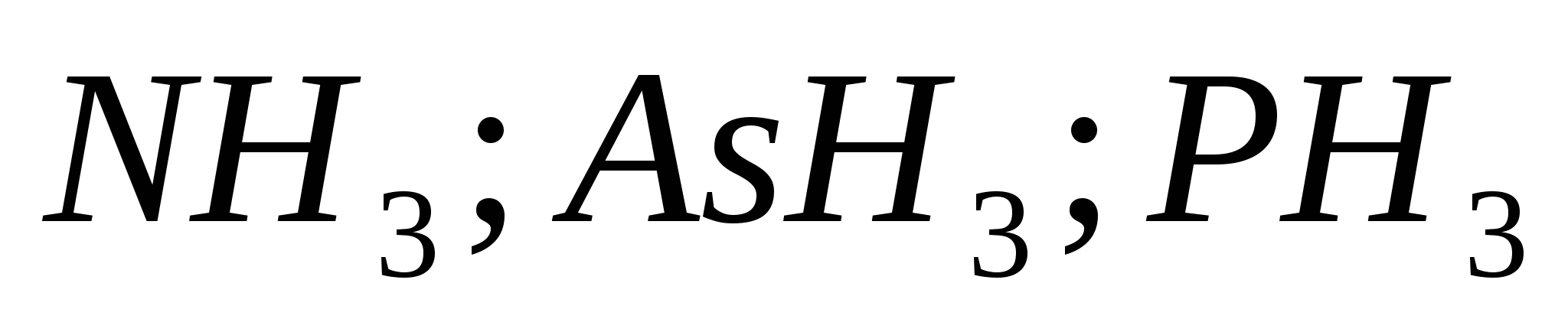
G) 
6. Хлорт наалдахын тулд та төвлөрсөн уусмалыг ашиглаж болно.
а)  , б)
, б) 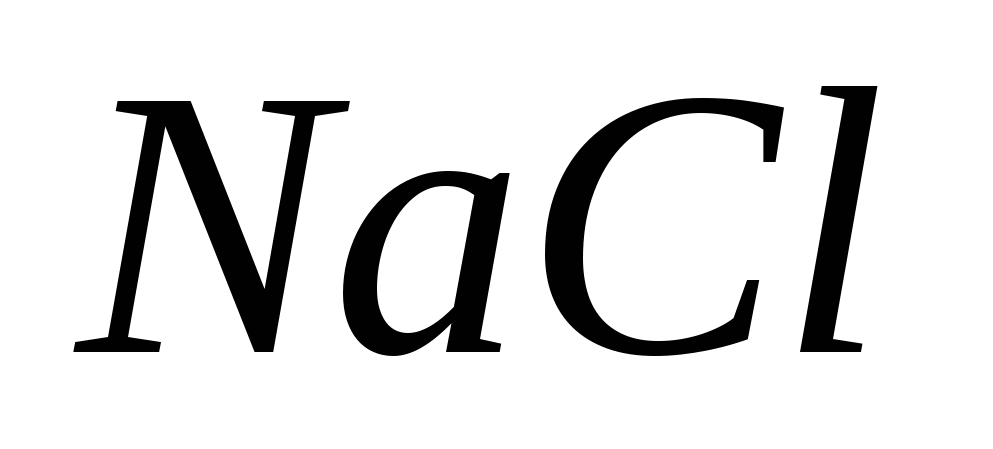 , v)
, v)  , G)
, G)  .
.
7. Баяжуулсан сирчаны хүчил нь атомын рахунокийн исэлдүүлэх хүч юм.
а)  , б)
, б)  , v)
, v)  .
.
ТАЙЛБАР: 9-10 зөв үзэл бодол - "5"; 7-8- "4"; 5-6- "3"; 5-2-оос бага
ETAP "онол"
Би Райвен ("3" хүртэл)
Шингэрүүлсэн давсны хүчлийн хүчийг тодорхойлох ердийн урвалуудыг бичнэ үү.
Серки оксидын (VI) хүчийг тодорхойлох тусгай урвалуудыг бичнэ үү.
Натрийн хүчлийн хүчийг тодорхойлох ердийн урвалуудыг бич.
Фосфор (V) оксидын хүчийг тодорхойлох холбогдох урвалуудыг бичнэ үү.
Америкийн хүчийг тодорхойлсон урвалын хариуг бич.
II ryven ("4" дээр)
Хоёр дахь үеийн металл бус зуны рашааны томьёог бич. Хэрхэн, яагаад хүчиллэг хүч өөрчлөгддөгийг тайлбарла.
Гурав дахь үеийн бусад металл бус ислийн томъёог бич. Хэрхэн, яагаад хүчиллэг хүч өөрчлөгддөгийг тайлбарла.
III үеийн хамгийн хүчиллэг элементүүдийн томъёог бич. Хэрхэн, яагаад хүчиллэг хүч өөрчлөгддөгийг тайлбарла.
Усан дээр суурилсан дэгдэмхий металл бус VI пидгруппийн томьёог бичнэ үү. Хэрхэн, яагаад хүчиллэг хүч өөрчлөгддөгийг тайлбарла.
VA пидгруппын элементүүдийн хамгийн хүчиллэг хүчлүүдийн томъёог бич. Хэрхэн, яагаад хүчиллэг хүч өөрчлөгддөгийг тайлбарла.
III түвшин ("5" дээр)
Давсны болон азотын хүчлүүдийн хүчиллэг ба хүчиллэг шинж чанарыг тодорхойлно. Энгийн хариу үйлдлийг баталгаажуулна уу.
Саарал исэл (IV) ба нүүрстөрөгчийн (IV) ислийн исэлдэлтийн болон хүчиллэг хүчийг тодорхойлно. Энгийн хариу үйлдлийг баталгаажуулна уу.
Ус ба фторын исэлдэлтийн болон хүчиллэг чанарыг өөрчлөх. Энгийн хариу үйлдлийг баталгаажуулна уу.
Баяжуулсан болон шингэрүүлсэн азотын хүчлийн хүчиллэгийг тодорхойлно. Энгийн хариу үйлдлийг баталгаажуулна уу.
Нүүрстөрөгчийн (II) исэл ба нүүрстөрөгчийн (IV) ислийн хүчиллэгийг тодорхойлно. Энгийн хариу үйлдлийг баталгаажуулна уу.
ETAP "Розрахунковагийн асуудал"
Би Райвен ("3" хүртэл)
II ryven ("4" дээр)
37 г кальцийн гидроксид аммонийн сульфаттай харилцан үйлчлэхэд 15 г аммиак арилгадаг. Амиак% оролтын массын хэсгийг тооцоол.
Исгэлэн 62 г фосфор, 130 г фосфорын (V) исэлд спалюванныг зайлуулна. Фосфорын исэл (V)% -д оруулах массын хувийг тооцоол.
8.96 литр хлорын усыг саармагжуулахад хэдэн грамм 10%-ийн натрийн гидроксид хэрэгтэй вэ?
Нүүрстөрөгчийн давхар исэл дэх литрийн шүүлтүүрийг 10 кг-ийн савлагаатай вапняк болгон засаж, байшингийн 20% -ийг арилгаж болно.
900 гр 10%-ийн гидроксидын 11.2 литр нүүрстөрөгчийн давхар ислийг дамжуулахын тулд хэдэн грамм бүслэлт хийх вэ?
III түвшин ("5" дээр)
"razchinennya" 32 гр зөгийн бал нь 80% азотын хүчил (pl. 1.46 г / мл) ямар хэмжээ шаардлагатай вэ?
4 литр (NU) азотын (IV) ислийг зайлуулахын тулд хэт төвлөрсөн азотын хүчилтэй урвалд ороход Яка масаны орчин шаардлагатай бөгөөд энэ гаралтын хэмжээ 96% болох вэ?
Давсны хүчлийн концентрацид "эвдэрсэн" үед 4.2 л (n.u.) саарал (IV) исэл бүхий 20 г алтны хайлш. Хайлшийн% -ийн массын хувийг визнит.
Хлор дахь хийн нийлбэр ба 1 л эзэлхүүнийг кальцийн иодидын уусмалаар дамжуулсан. Цому дотор 5.08 р иодыг харсан. Муу нийлбэрээс хлорын хийн хэсгийг (%) хай.
10 г масстай цахиур ба вугиллагийн хэмжээг хэт төвлөрсөн натрийн гидроксидын хүрээнд асгав. Урвалын үр дүнд 5.6 литр ус (n.o.) харагдсан. tsіy sumіshі үед цахиурын массын хэсгийг (%) Visnite.
