Sio2 физик шинж чанар. Хүчилтөрөгч нэгдлүүд. Цахиур (II) SiO
Цахиур исэл (II) SiO. Энэ нь байгаль дээр тохиолддоггүй, гэхдээ хариу урвалаар олж авч болно:
SiO 2 + Si → 2 SiO.
Хэвийн даралтаар цахиурт металлын хуримтлал нь ойролцоогоор 1200 ° С байдаг (эхлэх материал нь өөрсдийгөө ууршдаггүй) эхэлдэг. Хос хосоор нь SiO нь бие даасан нэгдэл юм. Элементүүдийн диссертацийн энерги нь 789 кЖ / моль. Хатуу төлөвт хувиргах нь хийн шатанд хурдан хөргөх ("бөхөөх") хийгдэнэ. Өөрөөр хэлбэл тэгшитгэлээр задлах нь өнгөрөх хугацаатай байна:
2 SiO = SiO 2 + Si.
Цахиурын исэл нь атмосферийн хүчилтөрөгчөөр аажмаар исэлддэг бөгөөд цахиурын хүчил давс болон устөрөгчийг ялгаруулахын тулд шүлтээр амархан уусгана. Энэ нь хүчирхэгжиж, хүчирхэг сөрөг цэнэг авдаг.
Цахиур исэл (IV) SiO 2.Цахиур исэл (IV) нь бас цахиур гэдэг. Энэ нь галд тэсвэртэй бодис юм. (хайлах цэг 1700 ° C)хоёр хэлбэрээр түгээмэл тархсан: 1) талст цахиур - кварцын эрдэс ба түүний сорт (чулуулгийн болор, манжин, оникс, хаш чулуу, цахиур чулуу); кварц нь барилгын болон силикатын үйлдвэрлэлд өргөн хэрэглэгддэг кварцын элсний суурь болдог; 2) аморф цахиур - Ашигт малтмалын спирт хэлбэрийн SiO 2 хэлбэрээр nH 2 O; аморфилийн цахиурын дэлхийн хэлбэрүүд нь диатомит, tripoli (infusorial earth); Хиймэл аморфгүй усгүй цахиурын жишээ бол силикатын гель бөгөөд энэ нь натрийн метилийн эфирээс үүсдэг.
Цахиурын гель нь боловсруулсан гадаргуутай тул чийг шингээдэг.
1710 ° кварц хайлж байна. Хайлсан массыг хурдан хөргөх үед кварцын шил үүснэ. Энэ нь тэлэлтийн коэффициент маш багатай тул ус хурдан хөргөх үед халуун кварцын шил хагардаггүй. Шинжлэх ухааны судалгааны лабораторийн багаж хэрэгсэл нь кварцын шилээр хийгдсэн.
Хавтгай дүрс дэх SiO 2-ийн бүтцийг дараах байдлаар илэрхийлж болно:
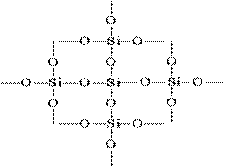
Цахиур атом бүр 4 хүчилтөрөгчийн атомын тетраэдрт оршдог. Энэ тохиолдолд цахиур атом нь төвд байрладаг ба хүчилтөрөгчийн атом нь тетраэдрийн орой дээр байрлана. Цахиурын бүхэл хэсгийг томъёо нь (SiO 2) n гэсэн цул хэлбэрээр авч үзэж болно. Цахиурын исэл (IV) -ийн ийм бүтэц нь түүний өндөр хатуулаг, хугарлын байдлыг тодорхойлдог.
Цахиурын исэл (IV) SiO 2 -ийн химийн шинж чанар нь хүчиллэг исэлд хамаарна. Хатуу шүлтлэг, үндсэн исэл болон карбонаттай холилдохдоо цахиурын хүчлийн давс үүснэ.
Зөвхөн hydropluoric acid нь цахиурын оксид (IV) (шилэн эшлэгтэй) харилцан үйлчилдэг:
SiO 2 + HF → SiF 4 + H 2 O
Silicon (IV) оксид нь усанд уусдаггүй ба химийн хувьд энэ нь харилцан үйлчилдэггүй. Тиймээс, цахиурын хүчлийг гидролизээр шууд бус байдлаар гаргаж авдаг:
SiS 2 + H 2 O ↔ H 2 S + H 4 SiO 4 orthosilicon хүчил.
H 4 SiO 4 нь халах ба зогсох үед уусдаг бөгөөд полимержих процесс явагдаж байна.
2 H 4 SiO 4 → H 2 O + H 6 Si 2 O 7 диторокриммитын хүчил.
2 H 6 Si 2 O 7 → H 2 O + H 10 Si 4 O 13 tetraorotremilicic хүчил.
Тэр бөгжийг хаадаг:
H 10 Si 4 O 13 → H 2 O + (H 2 SiO 3) 4 тетрраметакилик хүчил.
Энэ тохиолдолд, цахиурын хүчил (давсны ба хүчилд уусмалыг анхлан уусгасан концентрациас хамаарч) нь холимог ус агуулсан желатин масс хэлбэрээр, коллойд уусмал (sol) хэлбэртэй байна. Ашигласан силикатын хүчил нь бэлдмэлийн эхлэл болон материалаас хамаарна. Бүх силикатын хүчлүүд нь маш сул (нүүрснээс бага).
Хэрэв уусмал дахь нүүрсхүчлийн хүчил давсных нь силикатын хүчлийг гаргаж авбал урвуу урвал нь кальцинжих явцад тохиолддог. Эхнийх нь силикацийн хүчил бага диссоциаци, хоёрдахь нь халах үед бага хэлбэлзэлтэй байдагтай холбоотой.
Халсан полисиликик хүчил ба тэдгээрийн аажмаар усгүйжүүлэлтийг нэрлэнэ цахиурын гель . Энэ нь усыг сайн шингээж өгдөг. Энэ нь үнэтэй элементийг исэлдүүлэхээс сэргийлдэг.
Герман дэд бүлэг
Ge (+4) Sn (+2, +4) Pb(+2) - тэсвэртэй исэлдэлтийг илэрхийлнэ
Germanium 1871 онд DI Mendeleev-д урьдчилан таамаглаж, 1886 онд илрүүлсэн. Тин ба хар тугалга нь хүн төрөлхтөнд хамгийн их мэддэг байсан элементүүдэд хамаарагдана: Египтчүүд тэдгээрийг МЭӨ 3000 гаруй жилийн хүдрээс хайлуулж чаджээ. er Энэтхэгт хар тугалга 2500 жил, цагаан тугалга 1500 жилийн настай байсан. er Эртний Хятадад үйлдвэрлэсэн цагаан тугалга хайлуулах.
Хүлээн авсан.Германий байгалийн нэгдлүүд нь Geo 2-т хувирч, устөрөгчөөр багасдаг.
Geo 2 + H 2 t → Ge + H 2 O ойролцоогоор 1000 ° C-ийн температурт
Тинийг байгалийн эрдэсээс олж авдаг кварцитит(SnO 2):
SnO 2 + C → Sn + CO.
Аж үйлдвэрийн хар тугалгын хэмжээг бууруулах хамгийн энгийн схем нь дараалсан хоёр урвал дээр үндэслэнэ:
PbS + O 2 → SO 2 + PbO Галена(PbS) шатааж, дараа нь нүүрсээр багасгасан:
PbO + С → СО + Pb.
Програм.Эдгээр гурван элемент нь орчин үеийн технологийн хувьд маш чухал юм. Цагаан тугалга, хар тугалганы зарим нэгдэл нь ихээхэн ашиг тустай байдаг. Тэргүүлэх уламжлал нь маш их хортой байдаг.
Germanium нь ердийн хагас дамжуулагч юм (n-хэлбэрийн өргөн bandgap нь 0.75 eV) ба цахилгааны инженерчлэлийн янз бүрийн хэрэглээг олж мэднэ. Энэ нь AC шулуутгагч үйлдвэрлэхэд өргөн хэрэглэгддэг.. Энэхүү аппликейшн нь гермиумтай цэвэр германий болон германий хайлш хоёрын хоорондох холболтоос үүдэлтэй нэгдсэн цахилгаан дамжуулах чанар дээр суурилдаг. Одоогийн (электрон урсгал) ийм гүүрэн дээр германумаас хайлш хүртэл бараг л явагддаг, гэхдээ эсрэгээрээ. Germanium rectifiers нь маш өндөр (ойролцоогоор 98%) үр ашигтай бөгөөд маш том (зөв ажилласнаар) үйлчилгээний хугацаагаар тодорхойлогддог. Ийм тэгшитгэлийн гол дутагдал нь халаахад мэдрэг чанар нь - 70 ° С-ээс дээш, тэдний үр ашгийг хурдан бууруулдаг.
Чухал ашиглалтын бүс герман бол хэт улаан туяаны оптик, 2 микроноос илүү долгионы урттай цацраг туяа нь бараг л хоцордоггүй. Үүний эсрэгээр, гэрэл ба ойролцоо хэлбэлзэлтэй (0.2-2 микрон), германиум энергийг эрчимтэй шингээж авдаг. Гялалзсан металл гадаргуу (сайн дулааныг хадгалж байдаг боловч сайн халдаггүй) германиум хальсан бүрхүүлээр хучигдсан бол гадаргуу нь киногүйгээр илүү их дулааныг халаана. Энэ нь нарны гэрлийн үйл ажиллагааны доор бэлтгэсэн нэг баррель нь буцалж буй усыг авч болно гэж мэдээлсэн байна.
Тинийг голчлон төмрийн тугалган тугалганаас хамгаалахын тулд ихэвчлэн ашигладаг. (лаазалсан үйлдвэрлэлд зориулсан цагаан тугалга). Ийм цагаан тугалганы зузаан нь маш бага хэмжээтэй байдаг. Цахилгааны салбарт конденсаторыг үйлдвэрлэхэд нарийн ширхэгтэй хавтан (Stannioles гэгддэг) цагаан тугалга . Хар тугалга нь зайны ялтсууд, цахилгааны кабелиуд, сумнууд, буудлага, цацраг туяа, цацраг туяанаас хамгаалах, химийн үйлдвэр (дамжуулах хоолой гэх мэт) -ийг үйлдвэрлэхэд ашиглагддаг. Маш их хэмжээний цагаан тугалга ба хар тугалга нь техникийн хэд хэдэн чухал хайлш үйлдвэрлэхэд зарцуулагддаг.
Тэдгээрийн хамгийн чухал нь зэс, Cu, Sn хайлш), холхивчийн хайлш (Pb, Sn гэсэн суурьтай хайлшаар хийгдсэн ба Sb ба Cu агуулсан), хэвийн хайлш (5-30% Sn, 10-20% Sb, үлдсэн хэсэг нь Pb) ба ердийн "зөөлөн" solder (30-70% Sn, 70-30% Pb). Энэ нь ихэвчлэн 90% Pb, 6% Sn, 4% Sb хямд хайлшаар солигддог. Хамгийн чухал нь 98% Pb, 1% Ca, 1% Na-ийн холимогтой хольцтой хольц юм.
Цахиур (цахиур, цахиур) нь маш хүчирхэг, хатуулаг, хугарал бүхий өнгөгүй талстаас бүрэлдсэн бодис юм. Цахиурын давхар исэл нь хүчилд тэсвэртэй, устай харилцан үйлчилдэггүй. Урвалын температур нэмэгдэхийн хэрээр бодис нь гидрофлуорийн хүчлээр уусдаг бөгөөд энэ нь маш сайн диэлектрик юм.
Байгалийн хувьд цахиурын диоксид нь өргөн тархалттай: талст цахиурын оксид нь эрдэнийн чулуу, оникс (талст цахиурын диоксидын нэгдэл), чулуулгийн талст (их хэмжээний талстууд), кварц (чөлөөт цахиурын диоксид), манан, аметист, morion, цахиур).
Хэвийн нөхцөлд (байгалийн орчны температур, даралтанд) цахиурын диоксид, тридимит, кварц, кристобалит зэрэг гурван талст өөрчлөлт ордог. Температур өсөхөд цахиурын диоксид эхлээд coesite болж, дараа нь стишовит (1962 онд солирын тогоонд олдсон ашигт малтмал) үүсдэг. Судалгаанаас харахад энэ нь дэлхийн гадаргуугийн ихээхэн хэсэг болох цахиурын диоксидын дериватив юм.
Энэ бодисын химийн томьёо - SiO 2
Цахиур бэлтгэх
Цахиурын диоксид нь кварцын баяжмал үйлдвэрлэх кварцын ургамал үйлдвэрлэлийн зориулалтаар үйлдвэрлэдэг бөгөөд энэ нь химийн болон электроникийн үйлдвэрлэлд ашигладаг, оптик, резин, будаг, лак дүүргэгч, үнэт эдлэл хийх гэх мэт үйлдвэрлэлд ашиглагддаг. Байгалийн цахиурын диоксид, өөрөөр хэлбэл цахиур гэдэг нэр томъёог барилгын (бетон, элс, дуу чимээ, дулаалгын материал) өргөнөөр ашигладаг.
Синтетик аргаар цахиурын диоксидыг нийлэгжүүлэлтийн аргаар синтетик аргаар синтетик аргаар хийдэг. Зарим тохиолдолд бусад уусдаг силикатууд эсвэл ионы нөлөөн дор коллоид цахиурын колоридыг шахах аргаар явуулдаг. Цаашилбал цахиурын давхар исэл нь 500 градусын температуртай цахиурын хүчилтөрөгчтэй исэлддэг.
Цахиурын диоксидын хэрэглээ
Цахиур агуулсан материалыг өндөр технологи, өдөр тутмын амьдралд өргөн хэрэглэдэг. Цахиурын диоксид нь шилэн, керамик, бетон эдлэл, зүсэх материал, радио инженер, хэт авианы суурилуулалт, асаагуур үйлдвэрлэдэг. Олон тооны найрлагатай цахиур нь шилэн кабелийн үйлдвэрлэлд ашиглагддаг.
Бүрхүүлгүй аморф цахиурын диоксид нь хүнсний бүтээгдэхүүнийг E551 тоогоор бүртгэгдсэн нэмэлт бүтээгдэхүүн бөгөөд үндсэн бүтээгдэхүүнийг clumping болон caking болгохоос хамгаална. Диоксид  цахиурын хоолыг шүдний эм бэлдмэл үйлдвэрлэхэд эмийн бэлдмэлийн орц болгон эмийн салбарт хэрэглэдэг. Энэ бодис нь чипс, жигнэмэг, эрдэнэ шишийн мод, түргэн уусдаг кофе гэх мэт.
цахиурын хоолыг шүдний эм бэлдмэл үйлдвэрлэхэд эмийн бэлдмэлийн орц болгон эмийн салбарт хэрэглэдэг. Энэ бодис нь чипс, жигнэмэг, эрдэнэ шишийн мод, түргэн уусдаг кофе гэх мэт.
Silica Harm
Цахиурын диоксидын бодис нь ходоод гэдэсний зам өөрчлөгдөхгүй өнгөрөхийг албан ёсоор нотолж, дараа нь энэ нь биеэс бүрэн арилдаг болохыг албан ёсоор нотолж байна. Францын мэргэжилтнүүдийн 15 жилийн судалгаагаар өндөр зэрэглэлийн хөнгөнцагааны ундны ус уух нь Alzheimer-ийн өвчин 10% -иар буурах эрсдэлийг бууруулдаг.
Тиймээс цахиурын диоксидын аюулын талаархи мэдээлэл нь химийн идэвхгүй бодис бөгөөд хуурамч зүйл юм: E551 хоол тэжээлийн нэмэгдэл, амаар уух нь эрүүл мэндэд бүрэн аюулгүй байдаг.
Цахиурын исэл SiO 2 нь хатуу, маш боловсронгуй бодис (1700 ° C -аас их хайлах цэг), кварцын эрдэс, кристобалит, tridymite хэлбэрээр ихэвчлэн тархсан байдаг.
Ердийн температурт кварц нь тогтворжсон өөрчлөлт бөгөөд температур полиморфик өөрчлөлтийг ажиглавал:
Мономер хэлбэрээр хийгдсэн бүх өөрчлөлтийн цахиур нь байхгүй; Энэ нь үргэлж полимержин бөгөөд тетраэдрагийн "барьсан" маш хүчтэй атомын сүлжээ юм
Цахиур атомын бүр (SiO 2) n талстууд нь хүчилтөрөгчийн дөрвөн атомаар хүрээлэгдсэн тетрагаар хүрээлэгдсэн бөгөөд тэдгээр нь тус бүр гүүр болно. Хүчилтөрөгчийн нийтлэг атомаар дамжуулан өөр өөр өнцөгт тетраэдрүүд бие биенээ холбож, тасралтгүй гурван хэмжээст lattice үүсгэх; Сансарт тетраэдрийг харилцан зохицуулах нь цахиурын нэг буюу өөр өөрчлөлтийг тодорхойлдог.
Цахиурын бетоны бат бөхийн өөр өөр өөрчлөлт нь янз бүр байна. Энэ нь Si-O-Si өнцгөөс болон Si-O зайд нөлөөлдөг. Жишээлбэл, цахиурын төрөл бүрийн өөрчлөлтийн Si-O-Si бөөрөнхий өнцөг нь 120-аас 180 ° хооронд хэлбэлзэнэ. Кварц-тридимит-кристобалит трансекционууд нь өндөр температурт тохиолдож болох бондын эвдрэл ба хувирал дагалддаг.
Кварц Ихэвчлэн маш сайн хэлбэрийн талстууд, заримдаа их хэмжээтэй хэлбэрээр хэлбэрждэг. Кристалууд нь спираль хэлбэртэй төв тэнхлэгийн эргэн тойронд эргэлддэг тетраэдрээс үүсдэг. Ижил болор байдлаар, тэр чигтээ зүг чигтэй байж болно. Эдгээр талстууд нь оптик изомерууд юм. Тэд гэрлийн туйлшралыг эргүүлж, баруун болон зүүн гараараа байж болно. Эдгээр болон бусад талстууд нь толинийн дүрснээс сэдэв байдлаар ялгаатай байдаг.
Кварц нь шинжлэх ухаан, технологийн олон салбарт хэрэглэгддэг бөгөөд түүний талстууд нь ихэвчлэн хиймэл ургадаг. Зарим төрлийн кварц нь тусгай нэр юм. Ил тод өнгөгүй талстыг чулуулгийн талст гэж нэрлэдэг. Кварцын өнгөт сортууд байдаг: кварц, нил ягаан (ягаан болор), хар хүрэн (утаатай тоороз), ногоон (хризостринат) гэх мэт. Кварцын талстыг өөр бусад хольцнуудыг өөрчилдөг. Шохойн хэлбэрийн сортууд нь оникс, хаш чулуу болон бусад зүйлүүдээс бүрддэг.
Тридимит нь галт уулын чулуулагт тохиолддог боловч маш бага хэмжээтэй байдаг. Тридимит болон солирын гарал үүсэлтэй.
Кристобалитид заримдаа лида дээр суулгасан жижиг талст хэлбэртэй тридимит хэлбэртэй байдаг. Тридимит ба кристобалит нь кварцаас илүү "сул" бүтэцтэй байдаг. Ийнхүү кристобалит, тридимит, кварцын нягт 2.32 байна. 2.26 ба 2.65 г / см3.
Хүйтэн хөргөлттэй хайлмагийг цахиур нь аморф кварцын шил үүсгэдэг. Шилний хэлбэртэй цахиур нь мөн байгальд байдаг. Аморф шилний нягт 2.20 гр / см3 - бүх талст өөрчлөлтийнхээс бага байна. Кварцын шил нь ердийн тэлэлтийн бага зэрэг коэффициенттэй тул температурын гэнэтийн өөрчлөлтөд тэсвэртэй лабораторийн шилэн савыг бэлтгэхэд ашигладаг.
Усан дахь цахиурын бүх өөрчлөлт нь 25 ° С температурт, кварцын 7, кристобалит 12, тридимит 16, кварцын шил 83 мг / л байна. Иймд хэвийн нөхцөлд зөвхөн шүлтлэг уусмал ба гидроффураторын хүчлийг хэрэглэнэ.
SiO 2 + 2KO = K 2 SiO 3 + H 2 O, (1)
SiO 2 + 4HF = SiF 4 + 2H 2 O. (2)
Сүүлчийн урвалыг "эшлинг" шилэнд хэрэглэдэг.
Нэмсэн цахиур нь үндсэн исэл, шүлтүүд (урвал (1) ба карбонатуудтай урвалд орно:
SiO 2 + CaO = СaSiO 3, (3)
SiO 2 + Na 2 CO 3 = Na 2 SiO 3 + CO 2. (4)
Хариултууд (3) ба (4) нүдний шил, цемент зэрэг үйлдвэрлэлийн үйлдвэрлэлийн давуу талыг тодорхойлно. Иймээс энгийн шилний найрлага (жишээлбэл, аяга, аяга үйлдвэрлэл) -ийг Na2 O. CaO томьёогоор илэрхийлнэ. 6SiO 2. Ийм шил нь натри, элс, шохойн чулууг холих замаар гаргаж авдаг. Хийдлийг хий бүрэн арилгах хүртэл ~ 1400 ° С температурт явуулна.
Na 2 CO 3 + CaCO 3 + 6SiO 2 = Na 2 O. CaO. 6SiO 2 + 2CO 2.
Шилний тусгай ангийн хувьд - галд тэсвэртэй, "хугарашгүй" - хоол хийх үед бари, хар тугалга, борооны исэл нэмнэ. Өнгөт шил авахын тулд янз бүрийн нэмэлтийг хэрэглэж болно. Тухайлбал, кобальт оксид Co 2 O 3 нь цэнхэр өнгө, хромын исэл Cr 2 O 3, ногоон өнгөтэй, манганы диоксид MnO 2 ягаан өнгөтэй байдаг.
SiO 2 оксид нь хэд хэдэн силикатын хүчлүүдийн альдегид бөгөөд найрлага нь xSiO 2 ∙ yH 2 O томъѐогоор томъѐолж болно. Энд x ба y бүхэл тоо байна. 1) x = 1, y = 1: SiO 2. H 2 Өө, тиймээ. H 2 SiO 3 - мета-цахиурын хүчил; 1) x = 1, y = 2: SiO 2. 2H 2 O, i.e. Ортопилик хүчил; 1) x = 2, y = 1: 2SiO 2. H 2 Өө, тиймээ. H 2 Si 2 O 5 - бимета силикатын хүчил.
Молекулууд нэгээс илүү SiO 2 молекул агуулдаг хүчлүүд нь полисиликонид хамаардаг.
Цахиурын хүчлүүдээс хамгийн энгийн нь H 2 SiO 3 бөгөөд цахиур нь зөвхөн цахиур бөгөөд цахиур нь давс юм. Силикатуудаас зөвхөн натри, калийн силикатууд усанд уусдаг ба үлдсэн силикатууд нь галд тэсвэртэй, усгүй уусдаг бодис юм.
Силикатын уусмал нь агаарт байхдаа турбидийг ургадаг, учир нь CO2 нь давсны хүчиллэг силикатын хүчил үүсгэдэг учир H2 SiO 3 нь нүүрстөрөгчийн хүчлээс суларч, эхний 2 дахь H2 SiO 3-ийн диссоциаци тогтмол K1 = 2.2, 10 -10 ).
H 2 SiO 3 нь уснаас бүрэн уусдаггүй - энэ шинж чанар нь силикат ионыг илрүүлэх чанарын хариу урвал болгон ашигладаг:
Na 2 SiO 3 + CO 2 + H 2 O = Na 2 CO 3 + H 2 SiO 3 ↓.
Силицатыг SiO2 -ээр шүлт ба карбонаттай хольж олно.
Натри, калийн силикатын концентрацитай уусмалыг шингэн шил гэж нэрлэдэг бөгөөд тэдгээр нь маш их гидролизд явагддаг тул шүлтлэг урвалтай байдаг.
K 2 SiO 3 + H 2 O 2KON + H 2 SiO 3 ↓.
Жишээ нь, цавуу, ус нэвтэрдэггүй даавуу үйлдвэрлэхэд шингэн шил хэрэглэдэг.
Цемент нь барилгын ажилд маш өргөн хэрэглэгддэг бөгөөд усны холилдсон үед холилдсон байдаг. Ихэвчлэн цементийг их эргэдэг зууханд үйлдвэрлэдэг бөгөөд янз бүрийн силикатууд шарж, газар (-1000 ° С хэмд).
Цемент хэд хэдэн төрөлд багтдаг боловч цемент ба портланд цемент гэсэн хоёр төрлийн цементийг ялгах боломжтой. Кальцийн силикатаас бүрддэг уламжлалт цементийг "тохируулах" үйл явц нь агаар дахь нүүрстөрөгчийн давхар исэлээс болж кальцийн карбонат үүсэхээс үүсдэг.
Цао. SiO 2 + CO 2 + H 2 O = CaCO 3 ↓ + H 2 SiO 3 ↓.
Портланд цемент нүүрстөрөгчийн давхар ислийн агууламжийг тогтоохдоо энэ процесст оролцоогүй бөгөөд цахиурын гидролиз нь уусдаггүй талстын гидрат үүсэх үед үүсдэг.
Ca 3 SiO 5 + H 2 O = Ca 2 SiO 4 + Ca (OH) 2,
Ca 2 SiO 4 + 4H 2 O = Ca 2 SiO 4. 4H 2 O ↓.
· Карбид болон силикицид
Металлаар хийгдсэн карбон болон цахиурын холимог, карбид, силикуляци, түүнчлэн метал гидридтай цахиурын харилцан үйлчлэлээр авч үздэг.
· 2 Ca 2 + Si = Ca 2 Si + 2H 2.
· Эдгээр бүх урвал нь өндөр температурт явагддаг. Карбидын дунд "метанид", "ацетилен" гэж нэрлэдэг. Эхнийх нь исэлдэлтийн төлөвт нүүрстөрөгч агуулсан метаны уламжлал -4 (2 C, Аль 4 C 3), хоёр дахь нь нүүрстөрөгчийн исэлдэлтийн зэрэг ацетилен дериватив -1 (Li 2 C 2, Ag 2 C 2, Cu 2 C 2 , CAC 2). Мөнгөний исэл, зэс (I) хлоридын аммиакийн уусмалаар ацетилений дамжуулалтаар мөнгөн ба зэсийн (1) ацетилид амархан олж авч болно. Ихэнх метанид ба ацетилеидууд ус (ялангуяа хүчилтэй) идэвхтэй урвалд орж, холбогдох нүүрсустөрөгчийг ялгаруулдаг:
· СаС 2 + 2Н 2 О = Са (ОН) 2 + С 2 Н 2,
· Al 4 C 3 + 12H 2 O = 4Al (OH) 3 ↓ + 3CH 4,
· Ag 2 C 2 + 2HCl = 2AgCl ↓ + C 2 H 2.
Карбидынхээс ялгаатай нь зөвхөн шүлтлэг эсвэл шүлтлэг металлын силикидууд нь ус, хүчилтэй харилцан үйлчилдэг бөгөөд хамгийн энгийн хэлбэрийн цахиур моносиланыг үйлдвэрлэдэг. Энэ нь голдуу silane Si 4:
· Ca 2 Si + 4HCl = 2CaCl 2 + SiH 4.
· Силан бол хөгцэрхэг шатамхай, SiO 2-т шатаж буй ус, усаар дүүргэсэн өнгөгүй хий юм.
· SiH 4 + 2O 2 = SiO 2 + 2H 2 O.
· Шүрэн шүлтлэгийг дараах томъёогоор задлана.
· SiH 4 + 2KON + H 2 O = K 2 SiO 3 + 4H 2,
· Ус нь мөн л silane гидролизд явагддаг, гэхдээ удаан байдаг.
· SiH 4 + 2H 2 O = SiO 2 + 4H 2.
· Агааргүй бол 400 ° С-аас их халсан үед цахиур нь цахиур болон устөрөгчийг задалдаг (цахиур үйлдвэрлэх аргын нэг юм):
· SiH 4 = Si + 2H 2.
· Моносиланаас гадна Si 2 H 6, trisilane Si 3 H 8, tetrasilane Si 4 H 10, гэх мэт. Тухайн мужид нэгдлүүд нь зөвхөн Si 6 H 14 хүртэлх тусгаарлагдсан байна. Эдгээр бүх нэгдлүүд нь гомоген цуврал цувралуудтай байдаг бөгөөд тэдгээрийн ерөнхий томьёо Si n H 2 n + 2 нь хамааралтай. Аляскийн адил силанууд өнгөгүй бөгөөд гомолог цувралуудын эхний гишүүд нь хэвийн нөхцөлд хийнүүд нь дараахь шингэн байна. Силан ба гидрокарбоны химийн үйл ажиллагаа өөр өөр байдаг: хангалттай инертагүй алканаас ялгаатай. Энэ нь нүүрстөрөгчтэй харьцуулахад устөрөгчтэй харьцуулахад цахиурын доод давхрага, хүчилтөрөгчөөр цахиурын өндөр агууламжтай холбоотой юм. Үүнээс гадна, Si-Si бонд нь С-С бондоос бага бат бөх байна. C - H бондтой харьцуулахад Si - H бонд нь илүү ионы шинж чанартай байдаг.
· Si-E болон CE бондын энерги.
· Si-Si бондын бага чадал нь гомологуудтай сирийн цуврал хязгаарлалтын улмаас үүсдэг.
· Карбид болон силикуляцын дунд цахиурын карбид болон нүүрстөрөгч цахиурын аль алиныг нь хэрэглэдэг карборундум SiC нь тусгай газар юм. Carborundum нь алмаазтай төстэй бүтэцтэй тул хайлах цэг өндөртэй байдаг. Түүний хатуулаг нь алмааз шиг ойрхон байдаг. Химийн хувьд SiC нь маш тогтвортой байдаг.
· Коллоид шийдлүүдийн ойлголт
Технологи, шинжлэх ухаанд тархсан систем нь нэг бодис нь өөр бодисоор доторхи хэсгүүдээр жигд хуваарилагддаг байдаг.
Тархсан системд тараагдсан үе шат - нарийн найрлагатай бодис ба тархалтын орчин байдаг - тараагдсан үе шат тархсан нэг төрлийн бодис юм. Дисперсийн системд жирийн (үнэн) шийдэл, коллоидын уусмал, суспенз, эмульс зэрэг орно. Эдгээр нь үндсэндээ ширхэгийн хэмжээгээр, өөрөөр хэлбэл тархалтын түвшин (хуваагдал) юм.
1-ээс бага нуман ширхэгийн ширхэглэлтэй уусмалууд нь уусгагч молекул буюу ионоос бүрдэх жинхэнэ уусмал юм. Тэднийг нэг фазын систем гэж үзэх ёстой. 100 нм-ээс их ширхэгийн ширхэглэлтэй системүүд нь бүдүүн ширхэгт тархсан системүүд ба эмульсүүд.
Түдгэлзүүлэлт нь тараагдсан үе шат нь хатуу бөгөөд тархалтын орчин нь шингэн, хатуу нь шингэнд бараг л уусдаггүй систем юм.
Эмульс нь тараагдсан үе ба тархалтын орчин хоёулаа харилцан адилгүй шингэн байдаг шингэний системүүд юм. Эмульсийн нэг жишээ бол сүү бөгөөд шингэний жижиг бөмбөлгүүд шингэн дээр хөвж байдаг.
Суспенз болон эмульсүүд нь амбулаторийн систем юм.
Коллоидын уусмалууд нь дисперсийн тэжээлт орчин болон тархалтын фазтай хоёр фазын системийг маш их тархдаг бөгөөд сүүлийн үеийн хугарлын хэсгүүдийн шугаман хэмжээ нь 1- 100 нм хүртэл хэлбэлздэг. Бөөмийн хэмжээгээр коллойд уусмал нь жинхэнэ уусмал, эмульс болон эмульсийн хоорондын завсрын үе юм. Коллойд хэсгүүд нь ихэвчлэн олон тооны молекулууд эсвэл ионуудаас тогтдог.
Коллоидын уусмалууд нь бас л уусдаг. Эдгээр нь тархалт ба конденсацийн аргаар олж авдаг. Дэгдээхэй нь "коллойд тээрэм" тусгай зориулалтаар хийгддэг. Конденсацийн аргад коллоидын бөөмүүдийг атомууд эсвэл молекулыг нэгтгэх замаар үүсдэг. Химийн олон урвал явагдах явцад конденсаци үүсч, өндөр тархалттай систем үүсдэг (хур тунадас, гидролиз, исэлдэлт багасгах урвал гэх мэт).
1 нм - nanometer (1 nm = 10 -9 м).
Бодит шийдлүүдтэй харьцуулбал ялтсууд нь Tyndall-ийн нөлөөлөл, өөрөөр хэлбэл, гэрлийн тархийг коллоид хэсгүүдээр тарааж өгдөг. Хөнгөн конус гэрлийн туяагаар дамжих үед энэ нь харанхуй өрөөнд харагдаж байна. 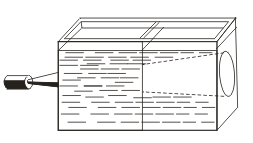 . Иймд энэ шийдэл нь коллоид эсвэл үнэн эсэхийг мэдэх боломжтой.
. Иймд энэ шийдэл нь коллоид эсвэл үнэн эсэхийг мэдэх боломжтой.
Нөөцийн гол шинж чанаруудын нэг нь тэдгээрийн тоосонцрууд ижил дохионы цахилгаан цэнэгтэй байдаг. Үүний улмаас тэдгээр нь том хэсгүүдтэй нийлж, тунадас үүсгэдэггүй. Үүний зэрэгцээ зарим уусмалын метал, сульфид, силикат, цагаан тугалганы хүчил зэрэг нь сөрөг утгатай байдаг бол зарим нь жишээлбэл, гидроксид, металын оксид нь эерэг цэнэгтэй байдаг. Төлбөрийн эзэлхүүн нь колоидын хэсгүүдээр уусмалаас ионууд шингээх замаар тайлбарлагдана.
Шарыг тунадасжуулахын тулд бөөмс нь том дүүргэгчид нийлүүлэх шаардлагатай байдаг. Бөөмийг хосолсон том хэсгүүдийн нэгдэл гэж нэрлэнэ, тунадасжилтыг тунадас гэж нэрлэдэг.
Ихэвчлэн уусмалд нэмэх үед колонк үүсдэг. Үүнд: 1) электролит, 2) тоосонцор нь эсрэг цэнэгтэй өөр уусмал, 3) дулаан халах үед үүсдэг.
