Хүхрийн. Устөрөгчийн сульфид ба сульфид
4.doc
240Хүхрийн. Устөрөгчийн сульфид, сульфид, гидросульфид зэрэг болно. Хүхрийн исэл (IV) ба (VI). Хүхрийн хүчил ба хүхрийн хүчил ба тэдгээрийн давс. Хүхрийн хүчил этанол. Натри Тиосульфат
4.1. Хүхрийн
Хүхэр бол хэд хэдэн мянган жилийн турш хэрэглэсэн химийн цөөн хэдэн элементүүдийн нэг юм. Энэ нь байгаль дээр өргөн тархсан байдаг бөгөөд чөлөөт төлөв (уугуул хүхрийн) болон нэгдлийн аль алинд нь байдаг. Хүхэр агуулсан эрдсүүдийг сульфид (пирит, гялтгануур, дамми), сульфат гэсэн хоёр бүлэгт хувааж болно. Байгалийн хүхэр нь Итали (Sicily Island) болон АНУ-д их хэмжээгээр агуулагддаг. ТУХН-ийн хүрээнд уугуул хүхрийн ордууд нь Ижил мөрний бүсэд, Төв Азийн мужууд, Крым болон бусад газруудад олддог.
Эхний бүлгийн ашигт малтмал нь PbS, зэсийн гэрэл Cu 2 S, мөнгөний хэмжээ - Ag 2 S, цайрын хагарал - ZnS, кадмитай - CdS, пирит эсвэл төмрийн пирит - FeS 2, халькопирит - CuFeS 2, cinnabar - HgS.
Хоёр дахь бүлгийн эрдсүүд нь гипс CaSO 4 2H 2 O, mirabilite (Glauber's salt) - Na 2 SO 4 10H 2 O, калитийн - MgSO 4 H 2 O.
Хүхэр нь уураг молекулуудын нэг хэсэг юм. Органик хүхрийн нэгдлүүд газрын тосоор олддог.
Авах
1. Байгалийн нэгдлүүдээс хүхрийг олж авахад, жишээлбэл, хүхрийн хүхрийн агууламж өндөр температурт халаана. Хүхрийн пирит төмрийн (II) сульфид болон хүхэр үүсгэх задрана:
2. Хүхэрт хүчилтөрөгчийн дутагдлаар хүхэрт устөрөгчийг исэлдүүлж болно.
2H 2 S O 2 = 2S 2H 2 O
3. Өнөө үед хүхрийн давхар исэл SO2 нь нүүрстөрөгчийн давхар оксидын хэмжээг бууруулах хүхрийн диоксид нь хүхрийн хүдрээс металл хайлуулахад түгээмэл хэрэглэгддэг дайвар бүтээгдэхүүн юм:
SO 2 C = CO 2 S
4. Металлургийн болон коксын зуухны хаягдал хий нь хүхрийн давхар исэл, устөрөгчийн сульфидийн холимог агуулдаг. Энэхүү хольц нь катализатор дээр өндөр температурт дамждаг:
H 2 S SO 2 = 2H 2 O 3S
^ Физик шинж чанар
Хүхэр бол хэцүү, хатуу, нимбэгний шар өнгөтэй. Энэ нь усанд уусдаггүй боловч нүүрстөрөгчийн дисульфид болон бусад уусмалуудад CS 2 анилин уусдаг.
Муу дулаан ба цахилгааны гүйдэл дамжуулдаг. Хүхэр нь хэд хэдэн янзаар өөрчлөгдөж байдаг.
1 . ^ Rhombic хүхэр (хамгийн тогтвортой), талстууд нь octahedra хэлбэртэй байдаг.
Хүхэр халаавал өнгө, зууралдамтгай байдал өөрчлөгдөх ба эхнийх нь цайвар шар үүснэ. Дараа нь температур нэмэгдэж, энэ нь харанхуй болж, хуруу шилнээс урсахгүй, цааш халаахад наалдамхай чанар дахин унаж, 444, 6 ° С хүхрийн .
2. ^ Моноклиний хүхэр - Хайлмал хүхэр аажмаар хөргөх замаар олж авсан хар шар өнгийн зүү хэлбэрээр өөрчлөх.
3. Хуванцар хүхэрбуцалж халах хүхэр нь хүйтэн усанд юүлнэ. Резинэн шиг амархан сунгасан (fig 19-ийг үзнэ үү).
Байгалийн хүхэр нь дөрвөн тогтвортой изотопоос бүрдэнэ: 32 16 S, 33 16 S, 34 16 S, 36 16 S.
^ Химийн шинж чанар
Хүчтэй гадаад эрчим хүчний түвшинтэй хүхрийн атом нь хоёр электрон хавсаргаж, зэрэглэл тогтоох боломжтой
Исэлдэлт -2. Хүхэр нь метал ба устөрөгчтэй (Na 2 S, H 2 S) нэгдлээр ийм исэлдэлтийн төлөв байдлыг үзүүлдэг. Электроныг илүү электрон элементүүдийн элемент болгон атомууд руу суллах, эсвэл хомсдох үед хүхрийн исэлдэлт зэрэг нь 2, 4, 6 байж болно.
Хүхэр нь хүйтэнд харьцангуй идэвхгүй байдаг боловч температур нэмэгдэж, урвалын идэвх нэмэгдэнэ. 1. Металлуудтай, хүхэр нь исэлдүүлэх шинж чанартай. Эдгээр хариу урвалууд нь сульфид (алт, цагаан алт, изидиумтай харилцан үйлчлэлцдэггүй): Fe S = FeS
2. Хэвийн нөхцөлд хүхэрлэг хий нь урвалд ордоггүй бөгөөд 150-200 ° С эргэх урвал явагдана.
3. Металл, хүхэртэй урвалаар хүхрийг ердийн исэлдүүлэгч бодис гэж үздэг ба хүчтэй исэлдүүлэгчид байгаа шинж чанарыг бууруулдаг.
S 3F 2 = SF 6 (иодтой урвалд ордоггүй)
4. Хүчилтөрөгч хүхрийн хүхрийг 280 ° С-д, 360 ° С-д агаарт цацагдана. Энэ нь SO 2 болон SO 3 хольц юм.
S O 2 = SO 2 2S 3O 2 = 2SO 3
5. Агааргүй халсан үед хүхэр нь шууд фосфортой нүүрстөрөгчтэй исэлддэг шинж чанартай байдаг.
2P 3S = P 2 S 3 2S C = CS 2
6. Нарийн төвөгтэй бодисуудтай харилцан үйлчлэлцэх үед хүхрийг гол төлөв буурах бодисоор хийдэг.
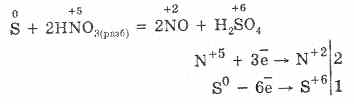
7. Хүхрийн нөөц нь зохисгүй хариу үйлдэл хийх чадвартай. Иймээс шүлтлэг, сульфит, сульфидтай хүхэр нунтаг буцалгах үед үүсдэг:
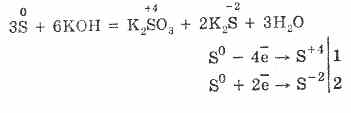
Програм
Хүхрийн үйлдвэрлэл нь өргөн хэрэглээний болон хөдөө аж ахуйн салбарт өргөн хэрэглэгддэг. Түүний үйлдвэрлэлийн бараг тал орчим нь хүхрийн хүчил үйлдвэрлэхэд хэрэглэдэг. Хүдэр нь резинийг арилгана. Энэ тохиолдолд резинийг резин болгон хувиргадаг.
Хүхрийн (нарийн нунтаг) хүхрийн хэлбэрээр усан үзмийн талбай ба хөвөнгийн өвчнөөс сэргийлэхэд хэрэглэдэг. Энэ нь бууны нунтаг, тэмцээн, гэрэлтүүлэгч бодисыг олж авахад ашиглагддаг. Анагаах ухаанд арьсны өвчний эмчилгээнд хүхрийн бэлдмэл бэлтгэсэн.
4.2. Устөрөгчийн сульфид, сульфид, гидросульфид зэрэг болно
Устөрөгчийн сульфид бол усны аналог юм. Электрон томъёо
Энэ нь H-S-H бонд үүсэх үед хүхрийн атомын гадаад түвшний хоёр p-электронууд оролцдог болохыг харуулж байна. H2 S молекул нь өнцгийн хэлбэртэй байдаг тул энэ нь туйл юм.
^ Байгаль дээр байх
Устөрөгчийн сульфид нь галт уулын хий болон зарим эрдэсийн эх үүсвэрүүд, тухайлбал, Pyatigorsk, Matsesta гэх мэт. Энэ нь янз бүрийн амьтан, ургамлын үлдэгдэл бүхий хүхрийн агууламж бүхий органик бодисын задралын улмаас үүсдэг. Энэ нь бохир ус, хог хаягдал, хог хаягдал хаях шинж чанарыг тайлбарладаг.
Авах
1. Устөрөгчийн сульфидыг халаах замаар хүхэртэй устөрөгчтэй шууд холбон авч болно.
2. Гэхдээ төмрийн (III) сульфид дээр гидрохлор буюу хүхрийн хүчлийн шингэрүүлсэн үйлчлэлээр ихэвчлэн авдаг.
2 HCl FeS = FeCl 2 H 2 S 2 H 2 Fe Fe = Fe 2 H 2 S Энэ урвалыг Kipp аппаратад хэрэглэдэг.
^ Физик шинж чанар
Хэвийн нөхцөлд устөрөгчийн сульфид нь ялзарсан өндөгний хүчтэй шинж чанар бүхий өнгөгүй хий юм. Маш хортой, амьсгалах нь гемоглобинтай холбогддог бөгөөд согог үүсгэдэг, энэ нь эрүүл бус байна.
Ко үхэлд хүргэдэг. Бага концентрацид бага аюултай. Үүнийг яндангийн кабинетаар, эсвэл hermetically хаалттай төхөөрөмжүүдтэй хамтран ажиллах шаардлагатай байна. Үйлдвэрлэлийн байранд H 2 S-ийн зөвшөөрөгдөх агууламж 1 литр агаарт 0.01 мг байна.
Устөрөгчийн сульфид нь усанд уусдаг (усны эзэлхүүн 20 ° С 2.5 эзлэхүүнтэй устөрөгч сульфидын усанд харьцангуй сайн байдаг).
Устөрөгчийн сульфидын уусмалыг устөрөгчийн сульфидийн ус буюу хүхэрт сульфидийн хүчил гэж нэрлэнэ (энэ нь сул хүчилд байгаа шинж чанарыг илрүүлдэг).
^ Химийн шинж чанар
1, Хүчтэй халсан үед хүхэрт устөрөгч нь хүхрийн болон устөрөгч үүсгэнэ.
2. Хийн устөрөгчийн сульфид нь агаарт шатаж буй цэнхэр дөлөнд хүхрийн исэл (IV) болон ус үүсдэг:
2H 2 S 3O 2 = 2SO 2 2H 2 O
Хүчилтөрөгч, хүхэр, ус дутмаг байгаа нь: 2H 2 S O 2 = 2S 2H 2 O
3. Устөрөгчийн сульфид бол маш хүчтэй буурах бодис юм. Энэ чухал химийн шинж чанарыг дараах байдлаар тайлбарлаж болно. H 2 S-ийн уусмалаар хүчилтөрөгчийн молекулуудыг агаарт гаргахад харьцангуй хялбар байдаг:
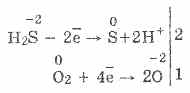
Үүний зэрэгцээ агаарт хүчилтөрөгч хүхэрт хүхэрт исэлдэж, устөрөгчтэй сульфидын усны булчинг үүсгэдэг:
2H 2 S O 2 = 2S 2H 2 O
Энэ нь хүхэрт устөрөгч нь маш их хэмжээгээр хуримтлагдаж, органик бодис задрахад агаарт хүчилтөрөгч хүчилтөрөгчийг исэлдүүлдэг.
4, Устөрөгчийн сульфид нь галогенийн уусмалаар хүчтэй урвалд орно, жишээ нь:
H 2 S I 2 = 2HI S Хүхрийн уусмалыг чөлөөлж, иодын уусмал өөрчлөгдөнө.
5. Янз бүрийн исэлдүүлэгчид нь хүхэрт устөрөгчтэй хүчтэй урвалд орно: азотын хүчил, хүхрийн чөлөөт үйлчлэл дор үүсдэг.
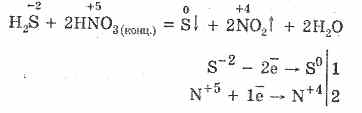
6. Устөрөгчийн сульфидын уусмал нь диссоциацийн улмаас хүчиллэг байдаг:
H 2 SH HS - HS - H S -2
Эхний шат нь ихэвчлэн давамгайлдаг. Энэ нь сульфатын хүчил юм: нүүрстөрөгчийн хүчлээс сул, сульфид нь H 2 S-ыг сульфидээс авдаг.
Сульфид болон hydrosulphides
Гидрофлуорийн хүчил нь салат байдлаар хоёр эгнээ үүсгэдэг:
Дунд зэрэг - сульфид (Na 2 S);
Цайр - гидосульфид (NaHS).
Эдгээр давсыг олж авч болно: устөрөгчийн сульфидтай гидроксидийн харилцан үйлчлэлээр: 2NaOHH 2 S = Na 2 S 2H 2 O
Металлаар хүхэртэй шууд харьцдаг:
H2 S буюу давсны хоорондох давсны солилцооны урвал:
Pb (NO 3) 2 Na 2 S = PbS 2NaNO 3
CuSO 4 H 2 S = CuS H 2 SO 4 Cu 2 H 2 S = CuS 2H
Hydrosulphides нь бараг л усанд уусдаг.
Шүлтийн болон шүлтлэг металлын хүчиллэгүүд нь усанд амархан уусдаг.
Хүнд металлын сульфидууд нь усанд уусдаггүй эсвэл усанд бага зэрэг уусдаг (FeS, MnS, ZnS); Тэдгээрийн зарим нь шингэлсэн хүчил (CuS, PbS, HgS) уусдаггүй.
Уусмалын хүчил давсны хүчлийн хувьд усан уусмал дахь сульфидууд өндөр гидролизаттай байдаг. Жишээлбэл, усанд ууссан шүлтийн металлын сульфидууд нь шүлтлэг урвалтай байдаг.
Na 2 S НОНГҮНЦ НОО
Устөрөгчийн сульфидийн нэгэн адил сульфидын бүх сульфидууд нь хүчтэй бууруулагч бодис юм.
3PbS -2 8HN 5 O 3 (р.) = 3PbS 6 O 4 4H 2 O 8N 2 O
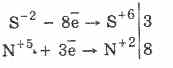
Зарим сульфидууд нь онцгой шинж чанартай байдаг: CuS ба PbS - хар, CdS - шар, ZnS - цагаан, MnS - ягаан, SnS - хүрэн, Ал 2 2 S - улбар шар. Калийн чанарын шинжилгээ нь сульфидын янз бүрийн уусмал, тэдгээрийн олон янзын өнгөөр ялгагдана.
^ 4.3. Хүхрийн исэл (IV) ба хүхрийн хүчил
Хүхрийн исэл (IV) буюу хүхрийн давхар исэл нь хэвийн нөхцөлд, хурц үнэртэй, өнгөгүй хий юм. Хэрэв -10 ° C-д хөргөж байвал энэ нь өнгөгүй шингэнд шингэрүүлнэ.
Авах
1. Лабораторийн нөхцөлд хүчиллэг исэл (IV) -ийг хүчилд хүчилд агуулагдах давсны хүчилд шилжүүлэн тэдгээрийн хүчлийн хүчлийн үйлчлэлээр авна.
Na 2 SO 3 H 2 SO 4 = Na 2 SO 4 S0 2 H 2 O 2NaHSO 3 H 2 SO 4 = Na 2 SO 4 2SO 2 2H 2 O 2HSO - 3 2H = 2 SO 2 2H 2 O
2. Мөн идэвхтэй металаар халсан үед хүхрийн давхар исэл нь хүхрийн хүчлийн харилцан үйлчлэлээр үүсдэг.
Cu 2H 2 SO 4 = CuSO 4 SO 2 2H 2 O
Cu 4H 2 SO 2-4 = Cu 2 SO 2-4 SO 2 2H 2 O
3. Хүхрийн хүчил агаар эсвэл хүчилтөрөгч шатаахад хүхрийн исэл (IV) мөн үүсдэг:
4. Аж үйлдвэрийн нөхцөлд SO2-ийг FeS 2 эсвэл хүхрийн өнгөт металлын хүдэр (цайрын хольцын ZnS, хар тугалганы гялбааны PbS гэх мэт) ашиглан пиритээр гаргаж авна.
4FeS 2 11О 2 = 2Fe 2 O 3 8SO 2
Молекулын бүтцийн томъёо SO 2:
Хүхрийн дөрвөн атом ба дөрвөн хүчилтөрөгчийн атомаас 4 электрон SO 2 молекул дахь бондын үүсэх үед оролцдог. Бондын электрон хос ба ганцхан электрон хоѐр хүхрийн хоёр талын харилцан таталцал нь молекулыг өнцгийн хэлбэрийг өгдөг.
Химийн шинж чанар
1. Хүхрийн исэл (IV) нь хүчиллэг исэлийн бүх шинж чанарыг харуулдаг:
Усны харилцан үйлчлэл
Шүлттэй харилцан үйлчилнэ
Үндсэн исэлдүүлэгчтэй харилцан үйлчлэлцдэг.
2. Хүхрийн исэл (IV) нь шинж чанарыг бууруулах замаар тодорхойлогдоно:
S 4 O 2 O 0 2 2S 6 O -2 3 (халаах үед катализаторын үед)
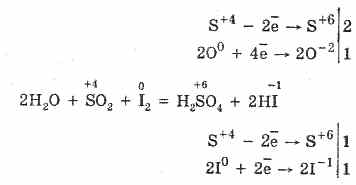
Хүчтэй бууруулах агентууд SO 2 нь исэлдүүлэгч бодис юм.
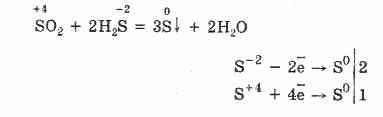
Хүхрийн (IV) оксидын хоёрдогч чанарыг хүхрийн оронд исэлдэлтийн төлөв 4-т тайлбарлаж байгаа тул 2 электронаас татгалзаж, S 6-руу исэлдэж, 4-ийг авч, S ° хүртэл бууруулж болно. Эдгээр болон бусад шинж чанаруудын илрэл нь реактив бүрэлдэхүүн хэсгийн шинж чанараас хамаарна.
Хүхрийн исэл (IV) нь усанд уусдаг (SO2-ийн 40 эзэлхүүн нь 20С-д 1 эзэлхүүнд уусдаг). Энэ тохиолдолд зөвхөн усан уусмал дотор байгаа хүхрийн хүчил:
SO 2 H 2 OH 2 SO 3
Энэ урвалыг буцаах боломжтой. Усан уусмалаар хүхрийн оксид (IV) болон хүхрийн хүчил нь химийн тэнцвэрт байдалд шилжиж болно. H 2 SO 3 (хүчил саармагжуулах)
Та) урвал нь хүхрийн хүчил үүсэх чиглэлд явагддаг; SO2 (азот эсвэл халаалтын уусмалаар дамжин үлээж), урвал эхлэн материал руу шилждэг. Хүхрийн хүчлийн уусмал нь хүхрийн исэл (IV) агуулдаг бөгөөд энэ нь хурц үнэрийг өгдөг.
Хүхрийн хүчил нь хүчиллэг шинж чанартай. Шийдвэрийн хувьд энэ нь алхам алхмаар задардаг:
H 2 SO 3 H HSO - 3 HSO - 3 H SO 2- 3
Тогтмол тогтворгүй, тогтворгүй байдаг. Бакасын хүхрийн хүчил нь хоёр төрлийн давс үүсгэдэг:
Дунд зэрэг - сульфит (Na 2 SO 3);
Цайр - гидросульфит (NaHSO 3).
Шүлт нь хүчиллэгийг бүрэн саармагжуулах үед сульфи үүснэ:
H 2 SO 3 2NaOH = Na 2 SO 3 2H 2 O
Гидросульфит нь шүлтийн дутагдалтай байдаг.
H 2 SO 3 NaOH = NaHSO 3 H 2 O
Хүхрийн хүчил ба түүний давс нь урвалын түншийн мөн чанараар тодорхойлогддог шинж чанарыг бууруулж, исэлдүүлэх, шинж чанарыг бууруулдаг.
1. Тиймээс хүчилтөрөгчийн сульфатын үйл ажиллагааны дор сульфаттай исэлддэг.
2Na 2 S 4 O 3 O 0 2 = 2Na 2 S 6 O -2 4
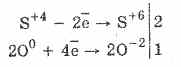
Хүхрийн хүчлийн исэлдэлт нь бром болон калийн перманганатын тусламжтайгаар илүү хялбар байдаг.
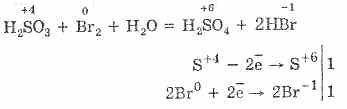
5H 2 S 4 O 3 2KMn 7 O 4 = 2H 2 S 6 O 4 2Mn 2 S 6 O 4 K 2 S 6 O 4 3H 2 O
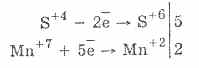
2. Илүү хүчтэй бодис багасгах үед сульфит нь исэлдүүлэх шинж чанартай байдаг.
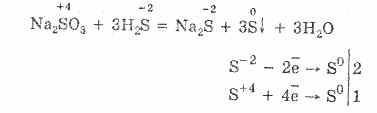
Бараг бүх гидросульфит болон шүлтийн металлын сульфит нь хүхрийн хүчил давсны хүчлийг уусгана.
3. H 2 SO 3 нь сул хүчил учраас сульфит ба гидросульфидын хүчлүүдийн SO2-ийг гаргахад хүргэдэг. Энэ арга нь ихэвчлэн SO2-ийг олж авахад ихэвчлэн ашиглагддаг лабораторийн нөхцөлд:
NaHSO 3 H 2 SO 4 = Na 2 SO 4 SO 2 H 2 O
4. Усны уусдаг сульфитууд нь гидролизмд ороход амархан тул OH-ийн концентраци нь уусмалыг нэмэгдүүлнэ.
Na 2 SO 3 НАСНАЦЭЭ 3 NaOH
Програм
Хүхрийн исэл (IV) болон хүхрийн хүчил нь олон өнгөөр будагдсан, өнгөний нэгдэл үүсгэдэг. Дулаан, эсвэл гэрэлд дахин задарч болно. Тиймээс SO 2 ба H 2 SO 3-ийн нөлөөгөөр хлорыг шингээх нөлөө өөр байдаг. Ихэвчлэн хүхэр (IV) rxid ноос, торго, сүрэл цайрдаг.
Хүхрийн исэл (IV) нь олон бичил биетнийг хөнөөдэг. Тиймээс мөөгөнцөр мөөгөнцөрийг устгахын тулд тэд түүхий зоорь, зоорь, дарсны торх гэх мэтийг хэрэглэдэг. Түүнчлэн жимс, жимсгэний тээвэрлэлт, хадгалалтанд ашиглагддаг. Их хэмжээний хүхрийн исэл IV) нь хүхрийн хүчил үүсгэхэд ашиглагддаг.
Нэн чухал хэрэглээ нь мод, цаасны целлюлозыг эмчлэхэд хэрэглэдэг кальцийн гидросульфит CaHSO 3 (сульфит архи) уусмал юм.
^ 4.4. Хүхрийн исэл (VI). Хүхрийн хүчил
Хүхрийн ислээс (VI) (20-р хүснэгтийг үз) нь өнгөгүй шингэн бөгөөд 16.8 ° С температурт хатуу талст масс хүртэл бэхждэг. Энэ нь чийгийг маш хүчтэй шингээж, хүхрийн хүчил үүсгэнэ: SO 3 H 2 O = H 2 SO 4
Хүснэгт 20. Хүхрийн ислүүдийн шинж чанар
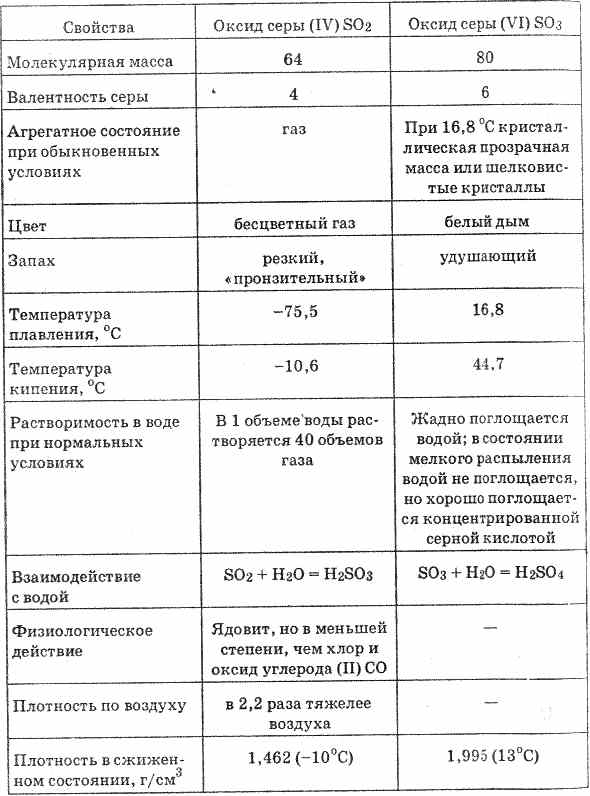
Ус дахь хүхрийн ислүүд (VI) -ийг татан буулгах нь их хэмжээний дулаан ялгаруулдаг.
Хүхрийн исэл (VI) нь хүхрийн хүчилд маш их уусдаг. Усгүй хүчил дэх SO 3 уусмалыг oleum гэж нэрлэнэ. Oleums нь SO 3 хүртэл 70% -ийг агуулдаг.
Авах
1. Хүхрийн оксид (VI) хүхрийн давхар ислийг 450 ˚C-ийн температурт катализатортой байлгах хүчилтөрөгчийн исэлдэлтээр олж авна. Хүхрийн хүчил үйлдвэрлэл:
2SO 2 O 2 = 2SO 3
2. SO 2 руу SO 3-ыг исэлдүүлэх өөр нэг арга бол азотын (IV) исэлийг исэлдүүлэгч бодис болгон ашиглах явдал юм:
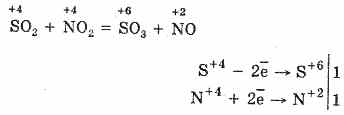
Үр дүнд нь азотын исэл (II) нь агаар мандлын хүчилтөрөгчтэй харилцан үйлчлэлцэж, азотын исэл (IV) руу хурдан шилжиж: 2NO O 2 = 2NO 2
SO 2-ын исэлдэлтэд дахин хэрэглэж болно. Тиймээс NO 2 нь хүчилтөрөгчөөр үйлчилдэг. SO 2-ээс SO 3 исэлдүүлэх арга нь азотын урвал юм. SO 3 молекул нь гурвалжин хэлбэртэй байдаг
Хүхрийн атом нь:
Ийм бүтэц нь холболтын электрон хос хосолмол байдалтай холбоотой юм. Хүхрийн атом нь үүсэхийн тулд зургаан гадаад электроныг бий болгосон.
Химийн шинж чанар
1. SO 3 - ердийн хүчиллэг исэл.
2. Хүхэрт исэл (VI) нь хүчтэй исэлдүүлэгч бодисын шинж чанартай байдаг.
Програм
Хүхрийн хүчил (VI) нь хүхрийн хүчил үүсгэхэд ашиглагддаг. Хамгийн чухал нь олж авах харилцааны арга юм
Хүхрийн хүчил. Энэ аргын дагуу та ямар ч концентраци, түүнчлэн oleum H 2 SO 4 авах боломжтой. Энэ процесс нь SO2-ийг олж авах гурван үе шаттай. SO 2-ын SO 3-ын исэлдэлт; H 2 SO 4 авах.
SO 2 тусгай зууханд пирит FeS 2 шатаах замаар олддог: 4FeS 2 11О 2 = 2Fe 2 O 3 8SO 2
Түргэн шуурхай болгохын тулд пирит нь урьдчилан хөрс, хүхрийг бүрэн дүүрэн шатаахын тулд урвалын улмаас агаарын (хүчилтөрөгч) их хэмжээгээр цацдаг. Зуухыг орхих хий нь хүхрийн (IV) исэл, хүчилтөрөгч, азот, хүнцэл нэгдлүүд (пирит дэх хольцоос), усны уураас бүрддэг. Энэ нь шарах хий юм.
Шатахууны хий нь бүрэн ариутгаж байгаа бөгөөд энэ нь хүнцэлийн нэгдэл, түүнчлэн тоос, чийг бага зэрэг агууламжтай байдаг тул катализаторыг хордуулна. Хийн цэвэршүүлсэн электростатик тундасжуулагч болон угаалгын цамхагаар дамжин хүнцэлийн нэгдлүүд болон тоосноос цэвэрлэгддэг. Хатаах цамхаг дахь чийгшлийн төвлөрсөн хүхрийн хүчлээр чийг шингээнэ. Хүчилтөрөгч агуулсан цэвэршүүлсэн хий нь дулааны солилцоог 450 ° С хүртэл халааж, контакттай аппаратанд оруулна. Контакттай аппарат дотор катализатораар дүүргэсэн lattice тавиурууд байдаг.
Өмнө нь нилээд буталсан металл цагаан алтыг катализатор болгон ашигласан. Дараа нь ванадийн нэгдлүүд болох ванадийн исэл (V) V 2 O 5 эсвэл ванадил сульфат VOSO 4, цагаан алтнаас хямд, илүү удаан хордуулдаг.
SO2-аас SO 3-ийн исэлдэлтийн урвалд урвалд ордог:
2SO 2 O 2 2SO 3
Тохойн хүчилтөрөгч дэх хүчилтөрөгчийн агууламж нэмэгдэхэд хүхрийн исэл (VI) -ийн ургацыг нэмэгдүүлдэг: 450 ° C температурт 95% буюу түүнээс дээш түвшинд хүрдэг.
Дараа нь хүхрийн ислийг (VI) үүсгэж дараа нь шингээлтийн цамхагт шингээлтийн аргаар тэжээж, төвлөрсөн хүхрийн хүчлээр шингээдэг. Энэ нь ханасан үед усгүй хүхрийн хүчлийг анх үүсгэдэг, дараа нь oleum. Цаашид oleum нь 98% хүхрийн хүчил хүртэл шингэлж хэрэглэгчдэд хүргэнэ.
Хүхрийн хүчил дэх бүтцийн томъёо:
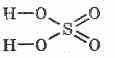
^ Физик шинж чанар
Хүхрийн хүчил нь 10.4 ° С-ийн талст, бараг хоёр дахин их хэмжээний, өнгөгүй, тослог шингэн юм ( = 1.83 гр / см3) ус, үнэргүй, жигд бус байдаг. Маш их гигроскоп. Чийг их хэмжээний дулаан ялгардаг тул усыг төвлөрсөн хүхрийн хүчил рүү асгаж болохгүй. Энэ нь хүчил үүсэх болно. Нь
Хүхрийн хүчил нь жижиг хэсгүүдэд ус нэмнэ.
Хүхрийн хүчилгүй хүхрийн хүчил 70% хүртэл уусгана. Халаахад SO 3-ийг H 3 SO 4-ийн 98.3% -ийн массын фракц үүсэх хүртэл арилгана. Усгүй H 2 SO 4 бараг цахилгаан гүйдэл хийхгүй байна.
^ Химийн шинж чанар
1. Энэ нь янз бүрийн найрлагатай ямар ч харьцаа, хэлбэрээр устай холино:
H 2 SO 4 H 2 O, H 2 SO 4 2H 2 O, H 2 SO 4 3H 2 O, H 2 SO 4 4H 2 O, H 2 SO 4 6.5H 2 O
2. Хүхрийн хүчлээр баяжуулсан хүчиллэг нь органик бодисыг элсэн чихэр, цаас, мод,
C 12 H 22 O 11 H 2 SO 4 = 12 C H 2 SO 4 11H 2 O
Нэгдмэл нүүрс нь хүчилтэй харьцдаг:
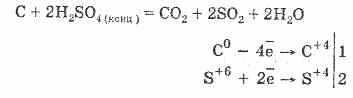
Хий шингэн алдалт нь хүхрийн хүчилээр ус шингээхэд суурилдаг.
Хүчтэй дэгдэмхий хүчил бол H 2 SO 4 хуурай давсны бусад хүчлүүдийг салгана:
NaNO 3 H 2 SO 4 = NaHSO 4 HNO 3
Хэрвээ давсны уусмал дээр H 2 SO 4 нэмбэл хүчилтөрөгч байхгүй болно.
H 2 SO 4 - хүчтэй dibasic хүчил: H 2 SO 4 H HSO - 4 HSO - 4 H SO 2- 4
Энэ нь тогтворгүй хүчтэй хүчлүүдийн бүх шинж чанартай.
Хүлээж авсан хүхрийн хүчил нь исэлдүүлэхгүй хүчлүүдийн бүх шинж чанараар тодорхойлогдоно. Тухайлбал: металлын хүчил төрөгчийн хүчлийн электродын цувралууд дахь устөрөгч хүртэлх металлуудтай харилцан үйлчилдэг:
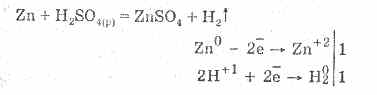
Металлтай харилцан үйлчлэл нь устөрөгчийн ионыг багасгадагтай холбоотой.
6. Хүхрийн хүчил нь концентрацитай энерик исэлдүүлэгч бодис юм. Халах үед ихэнх металлыг исэлдүүлдэг, үүнд агуулагдах цахиурын электрохимийн цувралууд ордог. Энэ нь зөвхөн цагаан алт, алтаар үйлчилдэггүй. Металлын үйл ажиллагаанаас хамаарч буурах бүтээгдэхүүн нь S -2, S ° ба S4 байж болно.
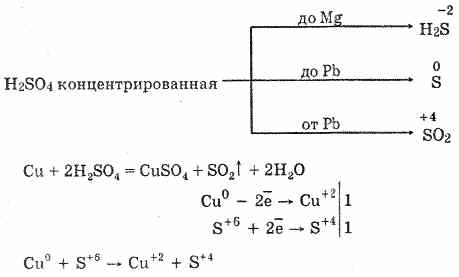
Хүйтэн, төвлөрсөн хүхрийн хүчил нь хөнгөн цагаан, төмөр, хром зэрэг хүчтэй металлуудтай харилцдаггүй. Энэ нь металлыг идэвхжүүлж байгаатай холбоотой юм. Энэ онцлогийг төмөр саванд тээвэрлэхэд өргөн хэрэглэгддэг.
Гэсэн хэдий ч, халах үед:
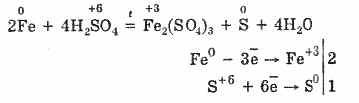
Иймээс хүхрийн хүчил нь хүчил үүсгэх атомыг багасгаж байгаатай холбоотойгоор металлтай харилцан үйлчилдэг.
SO 2-4 сульфатын ионы чанарын хариу урвал нь ус ба хүчилд уусдаггүй BaSO 4-ийн цагаан талст тунадас үүсгэдэг:
SO 2-4 Ba 2 BaSO 4
Програм
Хүхрийн хүчил нь химийн үйлдвэрлэлийн гол хүчин зүйл болох,
Органик хүчил, шүлтлэг, давс, эрдэс бордоо, хлор.
Хүхрийн хүчил нь янз бүрийн хэрэглээнээс эхлээд хүчилд ордог. Фосфат, азотын бордоог олохын тулд хамгийн их хэмжээгээр хэрэглэдэг. Дэгдэмтгий биш, хүхрийн хүчил нь гидрохлорид, гидроффлуор, фосфор, цууны хүчлийн бусад хүчил үүсгэхэд ашиглагддаг.
Нефтийн бүтээгдэхүүнийг бензин, керосин, тосолгооны тос - хортой хольцоос цэвэрлэж авдаг. Механик инженерийн хувьд хүхрийн хүчил нь бүрхүүлийн өмнө исэлдүүлэхээс өмнө металлын гадаргууг цэвэрлэж (никель бүрэх, хром бүрэх гэх мэт). Хүхрийн хүчил нь тэсрэх бодис, хиймэл утас, будагч бодис, хуванцар, бусад олон төрлийн бүтээгдэхүүн үйлдвэрлэхэд ашиглагддаг. Энэ нь зайг дүүргэхэд хэрэглэгддэг.
Хүхрийн хүчил давс нь чухал юм.
^ Натрийн сульфатNa 2 SO 4 усан уусмалаас Na 2 SO 4 10H 2 O гидрат хэлбэрээр глюберийн давс гэж нэрлэдэг. Энэ эмийг laxative гэж хэрэглэдэг. Усгүй натрийн сульфатыг сод болон шил үйлдвэрлэхэд хэрэглэдэг.
^ Аммонийн сульфат(NH 4) 2 SO 4 - азотын бордоо.
Калийн сульфатK 2 SO 4 - potash бордоо.
Кальцийн сульфат CaSO 4 нь гипс рецептор CaSO 4 2H 2 O хэлбэрээр үүсдэг. 150 ° С хүртэл халаавал усаа алдаж, 2CaSO 4 H 2 O hydrate галд автдаг. Устай холилдсон усыг холих үед alabaster нь CaSO 4 2H 2 O руу шилждэг. Гипсум нь барилгын (гипс) -д өргөн хэрэглэгддэг.
Магнийн сульфатMgSO 4 нь далайн чанадад гашуун амттай байдаг. Гашийн давс гэж нэрлэгддэг кристалл гидрат нь жаахан сулруулж хэрэглэдэг.
Витриол- металлын сульфатын физик гидратын техникийн нэр, нэршил нь хатаасан давс биш юм. Зэсийн сульфатCuSO 4 5H 2 O нь хөх хортой бодис юм. Ургамлыг шингэрүүлсэн уусмалаар шүршиж үрийг тариалахаас өмнө тариалсан. Төмрийн vitriolFeSO 4 7H 2 O нь цайвар ногоон бодис юм. Ургамлын хортон шавьж, бэх, ашигт малтмалын будаг зэргийг хянах зорилгоор ашигладаг. Цайрын сульфатZnSO 4 7H 2 O нь эрдэс бодисын бэх, структурчи, эмийн үйлдвэрлэлд ашиглагддаг.
^ 4.5. Хүхрийн хүчил этанол. Натри Тиосульфат
Хүхрийн хүчил эфир нь диайчил сульфат (RO 2) SO2 агуулдаг. Эдгээр нь их хэмжээний буцалж буй шингэн; усан дахь уусмалд бага байх; шүлт, согтууруулах ундаа, хүхрийн хүчил давсны хүчил бий болно. Доод диклил сульфатууд нь алкилатын бодисууд юм.
Диэтилийн сульфат(C 2 H 5) 2 SO 4. Хайлуулах цэг -26 ° С, буцалж буй цэг 210 ° С, спиртэнд уусдаг усанд уусдаггүй. Этилийн спиртийг хүхрийн хүчлээр урвалд оруулна. Органик нэгдлүүд дэх этилацийн бодис уу? Арьсанд нэвтэрнэ.
Диметил сульфат(CH 3) 2 SO 4. Хайлмал цэг -26.8 ° С, буцалж буй цэг 188.5 ° С. Архи, усанд уусдаг. Уусгагч (тэсэрдэггүй) үед аммиактай урвалд орно; Хүхэр нь фенолын эфир зэрэг зарим нэг үнэрт нэгдлүүд юм. Энэ нь 150% -ийн метилийн спиртийн 60% -ийг харилцан үйлчлэлцүүлэн авдаг. Энэ нь органик нэгдлийн метилийн гаралтай бодис юм. Хорт хавдар үүсгэдэг, нүд, арьс, амьсгалын эрхтэн эрхтэнд нөлөөлдөг.
^ Натри Тиосульфат Na 2 S 2 O 3
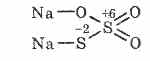
Тиосульфурын хүчил Давсны хүчийн хоёр өөр исэлдэлттэй гэж үздэг 6 ба -2. Усанд уусдаг сайн бүтэцтэй кристалл бодис. Калифорнийн Na 2 S 2 O 3 5H 2 O хэлбэрээр, гипосульфит гэж нэрлэдэг. Натрийн сульфидыг буцалгах явцад хүхэртэй харилцан үйлчлэлцэж авна.
Na 2 SO 3 S = Na 2 S 2 O 3
Тиосульфурын хүчлийн адил хүчтэй бууруулагч бодис бөгөөд хлорыг хүхрийн хүчилд амархан исэлдүүлдэг.
Na 2 S 2 O 3 4Cl 2 5H 2 O = 2H 2 SO 4 2NaCl 6HCl
Натрийн тиосульфатыг хлорын шингээлт (эхний хийн маск) -д хэрэглэхэд энэ урвал дээр үндэслэсэн.
Бага хэмжээний исэлдэлт нь натрийн тиосульфат сул исэлдүүлэгч бодисууд үүсдэг. Энэ нь тетрацион хүчлийн давс, жишээ нь:
2Na 2 S 2 O 3 I 2 = Na 2 S 4 O 6 2NaI
Натри тиосульфат нь хүхрийн хүчилээс аж үйлдвэрийн хийд цэвэршүүлэхэд NaHSO 3, хүхрийн будаг үйлдвэрлэх дайвар бүтээгдэхүүн юм. Энэ нь хүдрээс мөнгө гаргаж авахын тулд бөс даавууг хлороор хийсэн ул мөрийг арилгахад ашигладаг. нь иодометрийн урвалж, хүнцэлийн нэгдлүүд, мөнгөн ус, үрэвслийн эсрэг бодисыг хордуулах хоргүйжүүлэх арга юм.
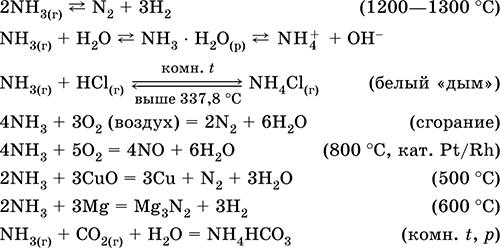
Химийн элементийн хүхрийг VIA бүлэг, PSCE 3-р үе дээр байрладаг. Хүхрийн атомын гадаад электрон давхаргад 6 электрон байна. Металл ба устөрөгчтэй бодис үүсгэх исэлдүүлэгч бодисын шинж чанарыг харуулж, хүхрийн исэлдэлтийн төлөвт -2 (2 электрон авдаг) олж авна.
Хүчилтөрөгч агуулсан нэгдлүүдийн найрлагад хүхрийн үзүүлэлтийн исэлдэлт нь +4 ба +6 байна. Тиймээс хүхэр нь исэлдэлтийн мужуудаар тодорхойлогддог -2; 0; +4; +6.
Байгальд, хүхэр нь түүний төрөлх муж болон эрдсийн найрлагад байдаг. Жишээ нь, хүхэр нь хар тугалганы гялбаа (гол бүрэлдэхүүн хэсэг нь хүхрийн хүчил), зэсийн гялбаа (үндсэн бүрэлдэхүүн хэсэг нь зэсийн сульфид Cu 2 S).
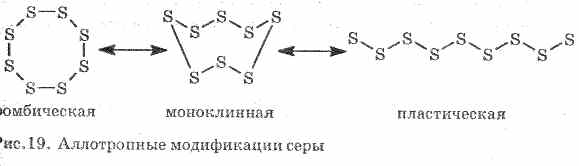
Хүхэрт хэдхэн энгийн бодис үүсгэдэг - аллотропын өөрчлөлтүүд. Өрөөний температурт ромбик хүхэр хамгийн тогтвортой байдаг (Зураг 1). Энэ бодис нь S 8 молекулаас бүрдэнэ. Rhombic хүхэр шар бөгөөд + 112.8 ° C температурт хайлдаг.
Зураг. 1. Хүхрийн хүдрийн ромбины өөрчлөлт
Халах үед ромбо хүхэр аажмаар наалдамхай хар хүрэн масс болж хувирдаг. Энэ нь хүхрийн - хуванцар хүхрийн өөр нэгэн төрлийн өөрчлөлтийг өөрчилдөг. Хуванцар хүхрийн шугаман хүхрийн молекулуудаас бүрддэг.
Металл болон устөрөгчтэй химийн урвалаар хүхэр үүсэх нь исэлдүүлэгч бодисын үүрэг гүйцэтгэдэг. Түүний исэлдэлтийн зэрэг 0-ээс -2 болж буурдаг. Хүчилтөрөгч, хүхрийн үйлчлэлийг бууруулагч бодисын хариу урвалаар 0-ээс 4 хүртэлх исэлдэлтийн түвшинг нэмэгдүүлдэг.
Хүхрийн оролцоотой харилцан үйлчлэлийн жишээг авч үзье.
Хүхэр нь устөрөгчтэй харилцан үйлчлэх үед хүхэрт сульфид үүснэ.
Цайр нь хүхэр, цайрын сульфидтай харилцан үйлчилж эхлэх үед:
Хүхэрт хүхэрт хүхэр үүсэх (IV) (Зураг 2):

Зураг. 2. Хүчилтөрөгчийг хүхэрт шатаах
Исэлдэлтийн төлөв "-2" хүхрийн нэгдлүүдийн шинж чанарыг авч үзье. Эдгээр нэгдлүүд нь устөрөгчийн сульфид ба сульфидууд - устөрөгчийн сульфидийн хүчлүүдийн давс юм.
Устөрөгчийн сульфид бол ялзарсан өндөгний үнэртэй хий юм. Энэ нь агаарт шатдаг. Үүнээс гадна хүчилтөрөгч дутагдах, хүчилтөрөгчийн дутагдал үүсч, шаталт нь өөр өөр байдаг.
Хүхэрт хүчилтөрөгчөөр устөрөгчийн сульфидыг хүхэрт исэл (IV), усаар үүсгэдэг.
2H 2 S + 3O 2 = 2SO 2 + 2H 2 O.
Хүчилтөрөгч дутагдалтай учраас устөрөгчийн сульфидийн бүрэн бус шаталт нь хүхрийн агууламжтай: 2H 2 S + O 2 = 2S + 2H 2 O.
Устөрөгчийн сульфид нь усанд уусдаг. Үүний шийдэл нь сул хүхэрт сульфидийн хүчил юм. Устөрөгчийн сульфидийн давсыг sulfide гэж нэрлэдэг. Гидроффлуор хүчил ба усанд уусдаг сульфидууд нь солилцооны урвал руу ордог.
Устөрөгчийн сульфидийн хүчил, зэс (II) хлоридын харилцан үйлчлэл нь зэс (II) сульфид болон гидрохлорын хүчилд уусдаггүй: H 2 S + CuCl 2 = CuS + 2HCl.
Калийн сульфид нь цайр нитраттай харилцан үйлчлэхэд цайрын сульфидын хуримтлагдах ба калийн нитрат үүснэ: K 2 S + Zn (NO 3) 2 = ZnS + 2 KNO 3.
Лавлагаа
- Orzhekovsky P.A. Химийн чиглэлээр даалгавар, дасгалын цуглуулга: 9-р анги: П.А. Orzhekovsky болон бусад. "Хими. 9-р анги / P.A. Orzhekovsky, N.A. Titov, F.F. Хегел - М.: AST: Astrel, 2007. (хуудас 91-97)
- Orzhekovsky P.A. Химийн: 9-р анги: судалгаа. ерөнхий дүр зураг. байгууллага / P.A. Orzhekovsky, Л. Meshcheryakova, L.S. Пакс - М.: AST: Astrel, 2007. (§ 34)
- Orzhekovsky P.A. Химийн: 9-р анги: ерөнхий судалгаа. байгууллага / P.A. Orzhekovsky, Л. Meshcheryakova, M.M. Шалашов. - М.: Astrel, 2013. (§§ 20, 21)
- Rudzitis G.E. Хими: neorgan. хими Органик Хими: судалгаа. 9-р бүлгийн / G.E. Рудзит, F.G. Feldman. - М.: Боловсрол, Москва сурах бичиг OJSC, 2009.
- Хомченко I.D. Ахлах сургуульд химийн чиглэлээр даалгавар, дадлага хийх. - М: RIA "Шинэ давалгаа": Хэвлэлийн Umerenkov, 2008.
- Хүүхдэд зориулсан нэвтэрхий толь. Боть 17. Хими / Бүлэг. ed. V.A. Володин, Вед. шинжлэх ухаан ed. I. Леонон. - М.: Avanta +, 2003.
- Боловсролын дижитал эх үүсвэрүүдийн нэг цуглуулга (сэдэв дэх видео туршлага) ().
- "Хими ба Амьдрал" сэтгүүлийн цахим хувилбар ().
Гэрийн даалгавар
- c. 136 № 3; p.140 № 2 2-4 сурах бичгийн P.A. Orzhekovsky "Хими: 9-р анги" / P.A. Orzhekovsky, Л. Meshcheryakova, M.M. Шалашов. - М.: Astrel, 2013.
Сульфид (хүхрийн, хүхрийн - хүхэр)
илүүдэл электростатик элемент бүхий хүхрийн нэгдлүүд; устөрөгчийн сульфидийн хүчлээр давс гэж үзэж болно Устөрөгчийн сульфидийн хүчил) H 2 S. M цуврал ерөнхий томьёоны M2 S болон хүчиллэг (гидросульфидын) дундаж томъѐо (хэвийн) М MHS-ийн томъѐоны дундаж (хэвийн) M байна, энд M нь monovalent метал байна. C. шүлтийн металууд нь өнгөгүй, усанд уусдаг. Тэдний усан уусмал нь маш их гидролизд, шүлтлэг юм. Хүчил шингэрүүлэх үйл ажиллагааны дагуу H 2 S. C. шүлтлэг гадаргуугийн металууд нь өнгөгүй, усанд бага зэрэг уусдаг. H 2 S чийглэг агаарт ялгардаг ба бусад шинж чанар нь S. шүлтийн металлтай төстэй. Эдгээр болон бусад С-ийн сульфатууд нь амархан исэлддэг. Хүнд металлын ус нь усанд уусдаггүй. Бараг бүгд хар, хар хүрэн (цагаан ZnS, ягаан MnS, шар CdS, улбар шар-улаан Sb 2 S 3, шар SnS 2). Хүчлийн химийн шинжилгээнд C. ба ac ба C. ammonium-ийн тэгш бус харьцааг ашигладаг. I.К. Малина.
Их Зөвлөлтийн нэвтэрхий толь. - М.: Зөвлөлтийн нэвтэрхий толь. 1969-1978 .
"Сульпидес" гэж юу вэ?
Хүхрийн нэгдэл, зарим металл бус металлууд. Металл сульфидууд нь устөрөгчийн сульфидийн хүчил H2S: дунд зэргийн (жишээ нь, Na2S) болон хүчиллэг, эсвэл гидросульфид (NaHS) давирхай юм. Байгалийн сульфид, өнгөт метал болон SO2-ийг шатаах замаар гаргаж авдаг. Фосфорын сульфид ба ... ... Big Encyclopedic Dictionary
Орчин үеийн нэвтэрхий толь
Сульфид - SULFIDES, метал ба зарим металл бус хүхрийн нэгдэл органик бус сульфидууд. Сульфидын хүдэрт орсон; фосфор (жишээлбэл, CdS, ZnS) ашигладаг. Молибдений сульфид, титан хатуу тослох материал. Фосфорын сульфид ... ... Зурган толь бичиг
- (шинэ латин, латинаас хүхрийн хүхэр). Зарим биед агуулагдах хүхэр, хүчил, хүчилд тохирох хүчилтэй нэгдлүүд. ОХУ-д багтсан гадаад үгсийн толь бичиг. Chudinov, AN, 1910. SULFIDES Novolatinsk., Лат. хүхэр, хүхэр. Холболт ... ... ОХУ-ын гадаад хэлний тайлбар толь
1. Металл болон зарим металл бус байгалийн хүхэр нэгдлүүд. Химийн бодис холбоо нь устөрөгчийн сульфидийн хүчил H2S-ийн давс гэж үздэг. Олон тооны элемент нь полисульфидыг H2Sx-ийн полимер сульфурфины хүчил агуулдаг. Гол ... ... Геологийн нэвтэрхий толь
Сульфид - метал болон зарим металл бус хүхрийн нэгдлүүд; Устөрөгчийн сульфидийн хүчил H2S металлын сульфидын давс. [Бетон ба төмөр бетоны хувьд толь бичгийн толь бичиг. FSUE "SIC" Барилга "NIIZHB, A. A. Gvozdeva метроны буудал, Москва, 2007. 110 х.] ... ... Барилгын материалын нэр томьёо, тодорхойлолт, тайлбар нэвтэрхий толь
SULPHES, s, u сульфид, нөхөр (зүйл) Металл ба зарим металлын хүхэртэй химийн нэгдлүүд. Органик Байгалийн. | adj сульфид, өө, Толь бичгийн Ozhegova. S.I. Озегов, Н.Ю. Шевчов. 1949 1992 ... Толь бичгийн Ozhegova
Сульфид, R2S (R aromatic radical) нь дусаагатай давсны уусмалыг 60 дусал Brockhaus болон Эфрон нарын нэвтэрхий толь
SULFIDES - (1) Органик бус химийн хувьд хүхрийн агууламж бүхий хүхрийн атомууд нь 2-р исэлдэлтийн төлөвтэй байна. Харьцангуй устөрөгчийн сульфидийн хүчил (H2S-ийн усан уусмал) -ийн давс гэж үздэг. Ихэнх нь байгалийн ... ... Big Polytechnic Encyclopedia
Өө; mn (сульфидын нэгж, м). [Лат. хүхрийн хүхэр] Хим. Хүхрийн нэгдэл, зарим металл бус металлууд. C. титан. Органик Байгалийн. (эрдсийн анги). ◁ Сульфид, өө. Холимог холимогоор нь холино. Хүдрийн хүдрээс. * * * хүхрийн нэгдэлийн сульфид ... Үгийн толь бичиг
- Латины хүхрийн хүхрийн хувьд металлын нэгдэл (түүнчлэн металлын B, Si, P, As гэх мэт) металын нэгдэл нь исэлдэлтийн төлөвтэй -2 гэсэн хүхрийн агууламжтай химийн нэгдэл юм. Устөрөгчийн сульфидын давс гэж ... ... Википедиа
Номууд
- Пананерозойч, Андрей Борисович Хэйлзов нарын санал зөрөлдсөн хэлбэрийн ураны ордууд. Уран бүтцийн болон давхаргазүйн бус зөрчилдөөний гадаргуу дээрх ураны орд дахь ураны ордуудын онцлогийг Уралын бүсийн 3 бүс нутгийн жишээн дээр авч үзлээ.
Хүхрийн - 3-р үеийн элемент болон тогтмол хугацааны системийн VIA бүлэг, 16-р цувралын элемент chalcogens. Атом атомын цахим томъёо [10 На] 3с 2 3p 4, шинж чанарын исэлдэлтэд 0, -II, + IV, + VI, S VI төлөв тогтвортой гэж үздэг.
Хүхрийн исэлдэх хэмжээ:
Хүхрийн эконометрт 2.60, энэ нь металлын бус шинж чанартай байдаг. Устөрөгч ба хүчилтөрөгчийн нэгдлүүд нь янз бүрийн анионуудад агуулагддаг бөгөөд хүчилтөрөгч агуулсан хүчил, тэдгээрийн давс, хоёр төрлийн нэгдэл үүсгэдэг.
Байгаль дээр - арван тав химийн тархалтын элемент (металл бус дахь долоо дахь). Энэ нь үнэгүй (уугуул) болон холбоотой хэлбэрээр олддог. Өндөр организмын хувьд чухал элемент юм.
С. Энгийн бодис. Кристал шар (α-rhombic ба β-monoclinic,
95.5 ° C) буюу аморф (хуванцар). Ширээний сүлжээт S 8 молекулууд (хавтгай бус "коррона" төрлийн мөчлөгүүд), аморфийн хүхрийн S n гинжнээс бүрдэнэ. Бага хайлах бодис, шингэний зуурамтгай байдал 200 ° С (хамгийн ихдээ S 8 молекулын зөрүү, S n гинжийг хооронд нь холбодог). Молекулын S 8, S 6, S 4, S 2 молекулуудаар. 1500 ° C-д monoatomic sulfur (энгийн хялбар химийн тэнцэтгэлд S хүхрийн ямар нэг хүхрийг төлөөлдөг) гарч ирдэг.
Хүхрийн усанд уусдаггүй, хэвийн нөхцөлд энэ нь урвалд ордоггүй, энэ нь нүүрстөрөгчийн дисульфид CS 2-т уусдаг.
Сульфур, ялангуяа нунтагласан, халах үед өндөр идэвхтэй байдаг. Металл болон металлын бус исэлдүүлэгч бодисоор үйлчлэх
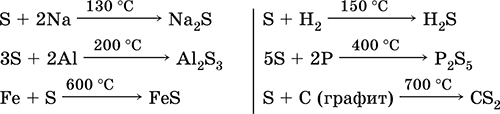
гэж юу вэ агентийг бууруулах - Фтор, хүчилтөрөгч, хүчил (буцалгах үед):
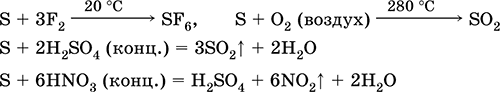
Хүхрийн шүлтийн уусмал дахь задрал:
3S 0 + 6KOH (conc.) = 2K 2 S -II + K 2 S IV O 3 + 3H 2 O
Өндөр температур (400 ° С) үед хүхрийн хүчлийн иод устөрөгчийн иодоос гаралтай:
S + 2NI (g) = I 2 + H 2 S,
харин уусмалд хариу урвал нь эсрэг чиглэлтэй байна:
I 2 + H 2 S (p) = 2 HI + S ↓
Авах: in аж үйлдвэр нүүрсний хий гаргах бүтээгдэхүүний деплурацийн үеэр гарсан унаган хүхэр (усны уурыг ашиглан) байгалийн ордоос хайлуулсан.
Сульфур нь нүүрсхүчлийн дисульфид, хүхрийн хүчил, сульфурам (ват) будагч бодисыг синтезлэхэд ашигладаг, нунтаглаг хөгц, ургамлын өвчин эмчлэхэд зориулагдсан ургамлуудыг хамгаалах арга хэрэгсэл болгон ашигладаг.
Устөрөгчийн сульфид H 2 S. Хүчилтөрөгч үнэгүй хүчил. Өнгөгүй хий нь агаараас хүнд байна. Молекул нь давхар дутуу тетраэдрийг бүтэцтэй [:: S (H) 2]
(sp 3 - гибридизаци, H - S - H jack өнцөг нь тетраэдрээс хол байдаг). 400 ° C хүртэл халсан үед тогтворгүй байдаг. Энэ нь усанд бага зэрэг уусдаг (20 0С-ийн температурт 2.6 л / 1л H 2 O), ханасан уусмал нь 0.1 м, "устөрөгчийн сульфидийн ус" юм. Уусмал дахь сул хүчлийн хүчил, хоёр дахь шатанд S 2 ион (хамгийн их агууламж S2 -1 нь 1 10 -13 моль / л) тэнцүү байна. Агаарт зогсох үед уусмал үүлэрхэг (саатуулагч - сахароз) болдог. Энэ нь аммиакийн амин дэмээр бүрэн шүлтлэгээр саармагжуулдаг. Хүчтэй бууруулах агент. Энэ нь ионы солилцооны урвал руу ордог. Sulfiding agent нь маш бага уусамтгай чанар бүхий өөр өөр өнгийн өнгөтэй сульфидын уусмалд уусдаг.
Чанарын урвал - сульфидын тунадас, H 2 S-ийн бүрэн бус шаталт, дөлөнд (шаазан хусуур) нэвтрүүлсэн хүйтэн объект дээр шар хүхрийн орд үүснэ. Нефть, байгалийн болон коксын хийн зуухыг цэвэршүүлэх нэмэлт бүтээгдэхүүн.
Энэ нь аналитик урвалж болох хүхрийн, органик бус, органик хүхэр агуулсан нэгдлүүдийг үйлдвэрлэхэд ашигладаг. Хэт хортой. Хамгийн чухал урвалуудын тэгшитгэл:
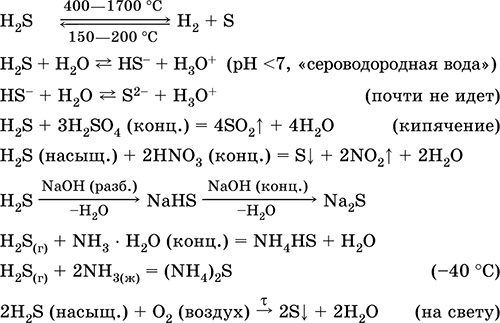

Авах: in аж үйлдвэр - шууд синтез:
H 2 + S = H 2 S(150-200 ° C)
халууны хүхэрээр парафинаар;
нь лабораториуд - хүчтэй хүчлүүдээр сульфидуудыг нүүлгэх
FeS + 2NCl (дүгнэлт) = FeCl 2 + H 2 S
эсвэл хоёртын нэгдлүүдийн гидролизын бүрэн:
Аль 2 S 3 + 6H 2 O = 2Ал (OH) 3 ↓ + 3 H 2 S
Натрийн сульфид Na2 S. Хүчилтөрөгч үнэгүй давс. Цагаан, маш гигроскоп. Ялзралгүйгээр задалдаг, дулаан нь тогтвортой. Энэ нь усанд уусдаг бөгөөд уусмалд маш шүлтлэг орчин үүсгэдэг. Агаарт зогсох үед уусмал үүлэрхэг (коллойд хүхэр) болж, шар (полисульфидийн өнгө) хувирдаг. Ердийн бууруулагч агент. Хүхрийн хүчил. Энэ нь ионы солилцооны урвал руу ордог.
Чанарын урвал S2-ийн ион дээр MnS, FeS, ZnS нь HCl (s) руу задардаг янз бүрийн өнгөтэй металлын сульфидуудыг устгана.
Энэ нь хүхрийн будаг, целлюлозыг үйлдвэрлэхэд хэрэглэгддэг бөгөөд аналитик химийн урвалж болох арьс ширний ширэмний арьсыг цэвэрлэхэд ашигладаг.
Хамгийн чухал урвалуудын тэгшитгэл:
Na 2 S + 2NCl (Dec.) = 2NaCl + H 2 S
Na 2 S + 3H 2 SO 4 (төг) = SO 2 + S ↓ + 2H 2 O + 2NaHSO 4 (50 ° С хүртэл)
Na 2 S + 4HNO 3 (дүгнэлт) = 2NO + S ↓ + 2H 2 O + 2NaNO 3 (60 ° C)
Na 2 S + H 2 S (сууна) = 2NaHS
Na 2 S (t) + 2O 2 = Na 2 SO 4 (400 ° С-ээс дээш)
Na 2 S + 4H 2 O 2 (төгсгөлд) = Na 2 SO 4 + 4H 2 O
S 2- + M 2+ = MnS (corporal) ↓; FeS (хар) ↓; ZnS (цагаан) ↓
S 2- + 2Ag + = Ag 2 S (хар) ↓
S 2- + M 2+ = CdS (шар) ↓; PbS, CuS, HgS (хар) ↓
3S 2- + 2Bi 3+ = Bi 2 S 3 (хар - хар) ↓
3S 2- + 6H 2 O + 2 М 3+ = 3H 2 S + 2 М (OH) 3 ↓ (M = Al, Cr)
Авах нь аж үйлдвэр - ашигт малтмалын услалт mirabilite Na2 SO 4 10H 2 O нь багасгах бодис агуулж байгаа үед:
Na 2 SO 4 + 4H 2 = Na 2 S + 4H 2 O (500 ° C, муур 2 O 3)
Na 2 SO 4 + 4C (кокс) = Na 2 S + 4CO (800-1000 ° C)
Na 2 SO 4 + 4CO = Na 2 S + 4СO 2 (600-700 ° C)
Хөнгөн цагаан сульфид Ал 2 S 3. Хүчилтөрөгч үнэгүй давс. Цагаан, Al - S бонд нь голчлон ковалент юм. N2-ийн хэт их даралтын дор задардаггүй, үүнийг хялбархан сугалж авдаг. Энэ нь агаарт исэлддэг. Устай бүрэн гидролизаци нь уусмалаас ялгардаггүй. Хүчтэй хүчлээр задалдаг. Энэ нь цэвэр устөрөгчийн сульфидын хатуу эх сурвалж болдог. Хамгийн чухал урвалуудын тэгшитгэл:
Аль 2 S 3 + 6H 2 O = 2Ал (OH) 3 ↓ + 3H 2 S (цэвэр)
Al 2 S 3 + 6NCl (Dec.) = 2AlCl 3 + 3H 2 S
Al 2 S 3 + 24HNO 3 (төгсгөлд) = Ал 2 (SO 4) 3 + 24NO 2 + 12H 2 O (100 ° C)
2Ал 2 S 3 + 9O 2 (агаар) = 2Ал 2 О 3 + 6SO 2 (700-800 ° C)
Авах: хүчилтөрөгч, чийггүй байх үед хайлсан хүхэртэй хөнгөнцагааны харилцан үйлчлэл:
2Ал + 3S = AL 2 S 3(150-200 ° C)
Төмөр (II) сульфидын FeS. Хүчилтөрөгч үнэгүй давс. Хэдийгээр ногоон, хар толботой хар, саарал, вакууманд халсан үед задалдаг. Нойтон төлөвт агаарт хүчилтөрөгч мэдрэмтгий байдаг. Усанд уусдаггүй. Устөрөгчийн сульфидтай төмрийн (II) давсны уусмалд уусалтыг хангаж чадахгүй байна. Хүчиллэгээр задарна. Энэ нь төмрийн хүдрийн хатуу эх үүсвэр болох төмрийн үйлдвэрлэлийн түүхий эд болгон ашигладаг.
Төмөр (III) Fe 2 S 3-ийн найрлага (тодорхойгүй).
Хамгийн чухал урвалуудын тэгшитгэл:
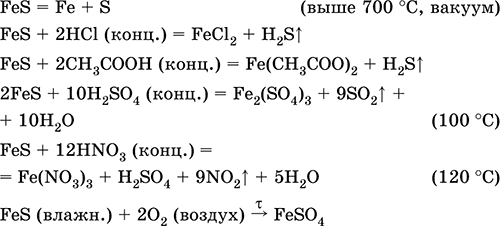
Хүлээн авах:
Fe + S = Fes (600 ° C)
Fe 2 O 3 + H 2 + 2H 2 S = 9 Fes + 3H 2 O (700-1000 ° C)
FeCl 2 + 2NH 4 HS (g) = Fes ↓ + 2NH 4 Кл + H 2 S
Төмрийн дисульфидын FeS 2. Хоёртын холболт. Энэ нь ионикийн бүтэц Fe 2+ (-S - S-) 2-. Хар шар, дулаанд тогтвортой, гал авалцдаг. Усанд уусдаггүй уусмал нь шингэлсэн хүчил, шүлттэй урвалд ордоггүй. Энэ нь агаарт шарж хүчил-исэлдүүлэгч бодисоор задардаг. Энэ нь төмр, хүхэр, хүхрийн хүчил үйлдвэрлэх түүхий эд, органик синтез дэх хурдасгагч юм. Байгальд - хүдрийн эрдсүүд пирит болон marcasite.
Хамгийн чухал урвалуудын тэгшитгэл:
FeS 2 = FeS + S (1170 ° C, вакуумаас дээш)
2FeS 2 + 14H 2 SO 4 (дүгнэлт, Уулс) = Fe 2 (SO 4) 3 + 15SO 2 + 14Н 2 O
FeS 2 + 18HNO 3 (дүгнэлт) = Fe (NO 3) 3 + 2H 2 SO 4 + 15NO 2 + 7H 2 O
4FeS 2 + 11O 2 (агаар) = 8SO 2 + 2Fe 2 O 3 (800 ° C, шарах)
Аммоны гидросульфидын NH 4 HS. Хүчилтөрөгчийг үнэгүй хүчиллэг давс. Цагаан, даралтын дор хайлуулсан. Маш тогтворгүй, халуун тогтворгүй байна. Энэ нь агаарт исэлддэг. Энэ нь усанд уусдаг бөгөөд катион болон анионоор гидролизд (давамгайлах) нь шүлтлэг орчныг үүсгэдэг. Шийдэл нь агаарт шар өнгөтэй болдог. Энэ хүчил нь хүхрийн агууламжийг ханасан уусмалаар задалдаг. Шүлтлэгийг саармагжуулахгүй, дунд уусмал (NH 4) 2 S уусмал дээр байхгүй (дундаж давсыг олж авах нөхцөлийг "H 2 S" гарчгийг үзнэ үү). Энэ нь зураг боловсруулагчдын бүрэлдэхүүн хэсэг болох задлан шинжилгээний урвалж (сульфидын тундасжуулагч) болж ашиглагддаг.
Хамгийн чухал урвалуудын тэгшитгэл:
NH 4 HS = NH 3 + H 2 S (20 ° С-ээс дээш)
NH 4 HS + HCl (Dec.) = NH 4 Cl + H 2 S
NH 4 HS + 3HNO 3 (ерөнхийдөө) = S ↓ + 2NO 2 + NH 4 NO 3 + 2H 2 O
2NH 4 HS (H 2 S) + 2CuSO 4 = (NH 4) 2 SO 4 + H 2 SO 4 + 2CuS ↓
Авах: NH3 3-ын концентрацитай уусмалыг устөрөгчийн сульфидтай уусгасан:
NH 3 H 2 O (дүгнэлт) + H 2 S (g) = NH 4 HS + H 2 O
Шинжилгээний химийн хувьд NH 4 HS ба NH 3 H 2 O-тэй тэнцүү хэмжээний уусмал нь (NH 4) 2 S-ийн уусмал гэж тооцогддог ба урвалын тэгшитгэлийг бичихэд дундаж давсны найрлагад ашиглагддаг боловч аммонийн сульфид нь бүрэн усыг NH 4 HS ба NH 3 H 2 O.
Хүхрийн давхар исэл. Сульфитууд
Хүхрийн давхар исэл SO 2. Хүчиллэг исэл. Гадаад байдал нь өнгөгүй үнэртэй. Молекул нь бүрэн бус гурвалжингийн бүтэцтэй: [S (O) 2] (sp 2 - гибридизаци), σ, π - S = O бонд агуулсан. Шингэн шингэрч, халууны хувьд тогтвортой. Энэ нь усанд уусдаг (20 0С-т 40л / л). Хүчлийн хүчилд тэсвэртэй, фосфорийн бүтээгдэхүүнүүд HSO 3 - ба SO 3 - Ион HSO 3 - хоёр төрлийн этикомер хэлбэрүүдтэй - тэгш хэмтэй (хүчиллэг бус) тетраэдрийг (сп 3 - гибридизацийн) бүтэцтэй, холимогт давамгайлж, тэгш хэмтэй (хүчиллэг) бүрэн бус тетраэдрийг бүтээх (S (O) 2 (OH)] (sp 3 - гибридизаци) бүтэцтэй. Ионы SO 3 2- нь тетраэдр [мөн (S (O) 3].
Шүлттэй аммиакийн амин хүчилтэй урвалд ордог. Ердийн бууруулагч, сул исэлдүүлэгч бодис.
Чанарын урвал - шаравтар "иодын ус" -ыг өнгөөр ялгах. Хүхрийн хүчил, хүхрийн хүчил үйлдвэрлэх завсрын үе.
Энэ нь ноос, торгон, сүрэл цайруулах, жимс жимсгэнэ хадгалах, ариутгах, антиоксидант, хөргөгч байдлаар хэрэглэдэг. Хортой.
H2 SO 3 (хүхрийн хүчил) нэгдэл нь тодорхойгүй (байхгүй).
Хамгийн чухал урвалуудын тэгшитгэл:
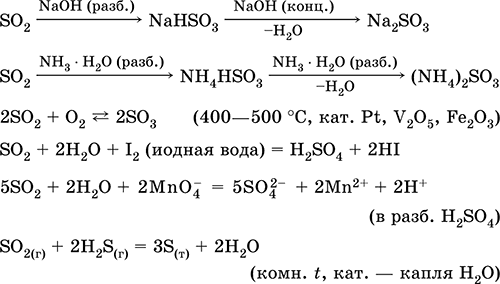
Усанд уусгах ба хүчиллэг шинж чанар:
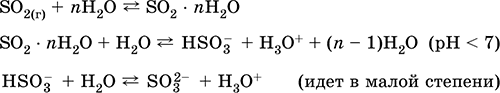
Авах: аж үйлдвэрт - хүчилтөрөгчөөр баяжуулсан агаар дахь хүхэрийг шатаах, бага хэмжээний хэмжээгээр сульфидын хүдэр (SO2 - пиритийг шатаах явцад хий) хийнэ:
S + O 2 = SO 2(280-360 ° C)
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8 SO 2(800 ° C, шарж)
лабораторид сульфитыг хүхрийн хүчлээр сольсон байна.
BaSO 3 (t) + H 2 SO 4 (төгсгөлд) = BaSO 4 ↓ + SO 2 + H 2 O
Натрийн сульфат Na 2 SO 3. Saline Цагаан Агаарт халаавал хайлж хийлгүйгээр задрах ба аргон даралтат дор хайлуулна. Нойтон төлөв ба агаар дахь хүчилтөрөгчийг мэдрэх уусмалаар. Энэ нь усанд уусдаг, анионоор гидролизд орно. Хүчиллэгээр задарна. Ердийн бууруулагч агент.
Чанарын урвал ион дээр SO 3 2 - баруун сульфит цагаан тунадас үүсэх бөгөөд хүчлийн хүчил (HCl, HNO 3) уусмал руу шилждэг.
Энэ нь аналитик хими, гэрэл зургийн уусмалуудын нэгдэл, хлорыг саармагжуулагч бодисыг цайруулахад хэрэглэдэг.
Хамгийн чухал урвалуудын тэгшитгэл:
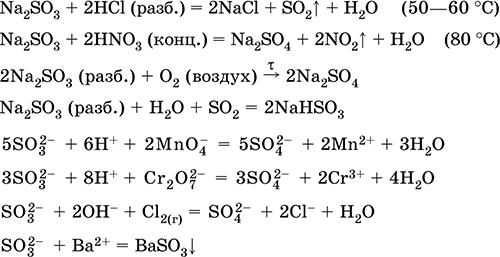
Хүлээн авах:
Na 2 CO 3 (дүгнэлт) + SO 2 = Na 2 SO 3 + CO 2
Хүхрийн хүчил. Сульфатууд
Хүхрийн хүчил H 2 SO 4. Оксиг хүчил. Өнгөгүй шингэн, маш их наалдамхай (тослог), маш гигроскоп. Молекул нь гажигтай тет тетраэдрийн бүтэцтэй (сп 3 гиб глюкозиаци), ковалент σ - S - OH ба σπ - bonds S = O бонд агуулсан. Ионы SO 4 2- зөв тетраэдрийн бүтэцтэй. Энэ нь шингэн төлөвт (~ 300 градус) өргөн температуртай байдаг. 296 хэмээс хэт халсан үед хэсэгчлэн задалдаг. Энэ нь устай изототропийн холимог (массын фракци 98.3%, буцалгах цэг нь 296-340 ° C), хүчтэй халалтаар бүрэн задардаг. Хязгааргүй холимог (хүчтэй) exo-Effect). Уусмал дахь хүчтэй хүчил, шүлтийн болон аммиакийн гидратаар саармагжуулна. Хүхэрт сульфатыг хөрвүүлэх (ердийн нөхцөлд төвлөрч буй хүчил илүүдэлтэй, уусдаг гидросульфатууд үүсдэг), харин Be, Bi, Co, Fe, Mg, Nb металлыг төвлөрсөн хүчилд шилжүүлж, түүнтэй урвалд ордоггүй. Үндсэн исэл ба гидроксидуудтэй урвалд орсноор сул хүчлүүдийн давсыг задалдаг. Нойтон исэлдүүлэгч уусмал (H I-ээс шалтгаалан) нь хүчтэй исэлдүүлэгч - төвлөрсөн уусмал (S VI-ийн улмаас). SO 3-ийг уусгаад түүнтэй урвалд орно (хүнд тослог шингэн үүсдэг - oleum H 2 S 2 O 7).
Чанарын урвал SO 4 2- 2- ион - цагаан барийн сульфатын BaSO 4 хур тунадас (тунадас нь давсны болон азотын хүчлийг BaSO 3-ийн цагаан тунадастай харьцуулахад хувиргадаггүй).
Үүнийг хүчилтөрөгчийн бордоо, тэсрэх бодис, будагч бодис, мансууруулах бодис, органик нэгдлээр үйлдвэрлэхэд, үйлдвэрлэлийн гол чухал хүдэр, ашигт малтмалын "нээх" (боловсруулах эхний үе шат), нефть бүтээгдэхүүний боловсруулалтад, электролизийн ус, тугалга батерейны электролит . Хортой, арьс түлэгдэхэд хүргэдэг. Хамгийн чухал урвалуудын тэгшитгэл:
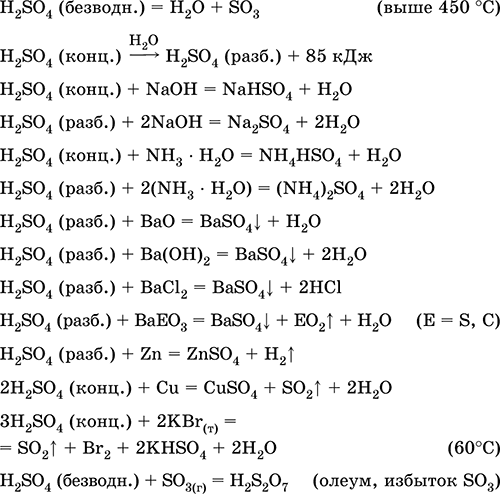
Авах нь аж үйлдвэр:
а) хүхрийн, сульфидын хүдэр, устөрөгчийн сульфид болон сульфатын хүдрээс SO 2-ын нэгдлийг нэгтгэсэн:
S + O 2 (агаар) = SO 2(280-360 ° C)
4FeS 2 + 11O 2 (агаар) = 8 SO 2 + 2Fe 2 O 3 (800 ° C, шарах)
2H 2 S + 3O 2 (g) = 2 SO 2 + 2H 2 O (250-300 ° C)
CaSO 4 + С (кокс) = CaO + SO 2 + CO (1300-1500 ° C)
b) контактын аппарат дахь SO 2-аас SO 3-ийг хөрвүүлэх:
c) төвлөрсөн ба усгүй хүхрийн хүчлийг нэгтгэх:
H 2 O (H2 SO 4) + SO 3 = H 2 SO 4(conc., anhyd.)
(H 2 SO 4-ийг үйлдвэрлэхэд SO 3-ын шингээлтийг хольцын хүчтэй халаалт, H 2 SO 4-ийн урвуу задралаас шалтгаалан хийгээгүй);
d) нэгтгэх oleum - усгүй H 2 SO 4, дисарийн хүчил H 2 S 2 O 7 ба SO 3 илүүдэл хольц. SO 3 ууссан уусмалд усыг нэвчүүлэхгүй байхыг баталгаажуулах (H2 SO 4 нь усанд ороход нэн даруй үүсдэг) бөгөөд энэ нь түүнийг аюулгүй савлахад хүргэдэг.
Натрийн сульфат Na 2 SO 4. Saline Цагаан, гигроскоп. Мөөгөнцрийг задалгүйгээр задална. Маягтууд нь калийн гидрат (эрдэс бодис mirabilite) ус алдах; техникийн нэр Glauber-ийн давс. Энэ нь гидролизэд ордоггүй усанд уусдаг. H 2 SO 4 (conc.), SO 3 -тай урвалд орно. Халах үед устөрөгч, коксоор сэргээгдэнэ. Энэ нь ионы солилцооны урвал руу ордог.
Энэ нь мансууруулах бодисын хувьд шил, целлюлоз, ашигт малтмалын будаг үйлдвэрлэхэд ашиглагддаг. Каспийн тэнгисийн Кара-Богаз-Голын булан дахь давстай нууруудад агуулагддаг.
Хамгийн чухал урвалуудын тэгшитгэл:
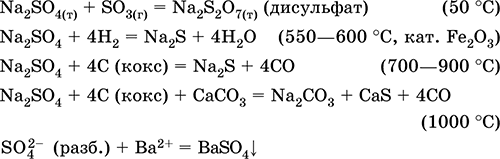
Калийн гидосульфат KHSO 4. Исгэлэн үхэр давс. Цагаан, гигроскоп, гэхдээ талстын гидратыг үүсгэдэггүй. Халааж хайлж, задалдаг. Энэ нь усанд сайн уусдаг бөгөөд анион нь уусмал дахь диссоциацитай бол уусмал нь хүчтэй хүчил юм. Энэ нь шүлтлэгээр саармагжуулдаг.
Энэ нь ашигт малтмалын эрдэсийн салшгүй хэсэг болох металлургийн флюшийн бүрэлдэхүүн хэсэг болгон ашиглагддаг.
Хамгийн чухал урвалуудын тэгшитгэл:
2KHSO 4 = K 2 SO 4 + H 2 SO 4 (240 ° C хүртэл)
2KHSO 4 = K 2 S 2 O 7 + H 2 O (320-340 ° C)
KHSO 4 (лийр) + KOH (дүгнэлт) = K 2 SO 4 + H 2 O KHSO 4 + KCl = K 2 SO 4 + HCl (450-700 ° C)
6KHSO 4 + M 2 O 3 = 2KM (SO 4) 2 + 2K 2 SO 4 + 3H 2 O (350-500 ° C, M = Al, Cr)
Авах: Хүйтэн дэх калийн сульфатын эмчилгээ (6О% -аас их) хүхрийн хүчил
K 2 SO 4 + H 2 SO 4 (conc.) = 2 KHSO 4
Кальцийн сульфат CaSO 4. Saline Цагаан, маш гигроскоп, галд тэсвэртэй, тайрч байхдаа задалдаг. Байгалийн CaSO 4 нь маш түгээмэл эрдсийн хэлбэртэй байдаг гипс CaSO 4 2H 2 O. 130 ° C үед гипс нь зарим хэсгийг нь ус алдаж, оруулдаг шатаах гипс2CaSO 4 H 2 O (техникийн нэр alabaster). Бүрэн усгүйжүүлсэн (200 ° C) гипс нь ашигт малтмалд хариу үйлдэл үзүүлдэг антридритCaSO 4. Энэ нь усанд бага зэрэг уусдаг (20 0С-т 0.206 г / 100г H 2 O) халах үед уусамтгай байдал буурдаг. H 2 SO 4 -тай урвалд орно. Хайлуулах явцад коксын дахин сэргэсэн. Цэвэр усны "тогтмол" хатуулгийн ихэнхийг тодорхойлдог (дэлгэрэнгүй мэдээллийг 9.2-ыг үзнэ үү).
Хамгийн чухал урвалуудын тэгшитгэл: 100-128 ° C
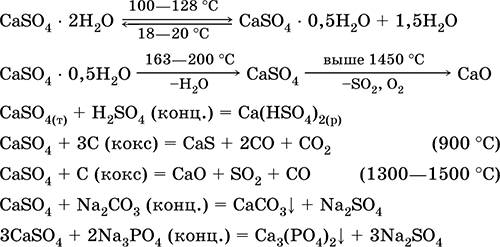
Энэ нь төмөрлөг судлал, цаасны дүүргэгчид SO 2, H 2 SO 4 ба (NH 4) 2 SO 4 үйлдвэрлэлийн түүхий эд болгон ашиглагддаг. Шатсан гипсээс бэлтгэсэн зуурмаг нь Ca (OH) 2-ыг үндэслэн хольцоос илүү хурдан тогтоодог. Хатуужуулалт нь усыг холбох, чулууг массын хэлбэрээр гипс үүсгэдэг. Шатаасан гипс нь гипс, архитектур, гоёл чимэглэлийн хэлбэр, бүтээгдэхүүн, хуваалтын хана, хавтан, чулуугаар хийхэд ашиглагддаг.
Хөнгөнцагаан калийн сульфат KAl (SO 4) 2. Давхар үхэр давс. Цагаан, гигроскоп. Хүчтэй дулаан задалдаг. Маягтууд нь кальцийн гидрат - хөнгөн цагааны калийн хөнгөн цагаан. Хөнгөн цагааны уусмалаар гидролиз хийж усанд уусна. Шүлттэй аммиакийн амин хүчилтэй урвалд ордог.
Энэ нь бөс даавуу, арьс шир боловсруулах, шинэхэн ус цэвэршүүлэх коагулянт, цаасны найрлага, найрлага, гоо сайхны мэс заслын гаднах цус алдалт зэргийг ашигладаг. Энэ нь хөнгөн цагааны болон калийн сульфатын нийлмэл талсжилтаар үүсдэг.
Хамгийн чухал урвалуудын тэгшитгэл:
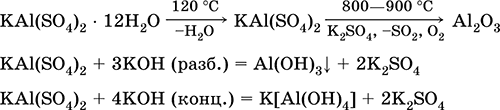
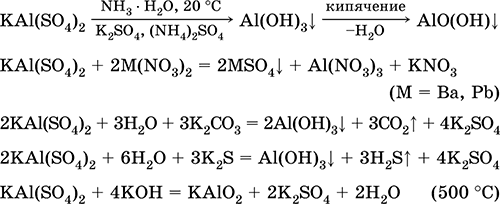
Chromium (III) sulfate - potassium KCr (SO 4) 2. Давхар үхэр давс. Улаан (харанхуй ягаан гидрат, техникийн нэр калийн цагаан). Халалтаас болж хайлуулж задалдаггүй. Энэ нь усанд амархан уусдаг (усан уусмалын саарал-цэнхэр өнгийг aquacomplex 3+), энэ нь хром (III) катионоор гидролизэгдэнэ. Шүлттэй аммиакийн амин хүчилтэй урвалд ордог. Исэлдэх исэлдүүлэгч ба сулруулах бодис. Энэ нь ионы солилцооны урвал руу ордог.
Чанарын урвал Cr 3+ ионыг Cr 2+ руу эсвэл исэлдүүлэх шар КрO 4 2- руу шилжүүлнэ.
Энэ нь арьс ширний зориулалтаар арьс ширний зориулалтаар ашигладаг, будах бөс даавуу, зураг дээр урвалж хэрэглэдэг. Энэ нь хром (III) болон калийн сульфатын нийлмэл талсжилтаар үүсдэг. Хамгийн чухал урвалуудын тэгшитгэл:
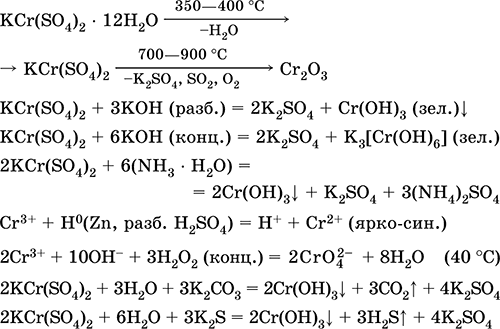
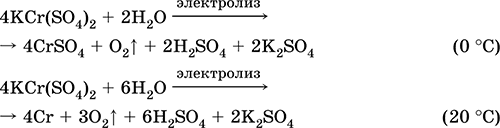
Manganese (II) sulfate MnSO 4. Saline Цагаан, кальцин, хайлж, задалдаг. Crystalline hydrate MnSO 4 5H 2 O - улаан - ягаан, техникийн нэр манганы vitriol. Энэ уусмалын усанд уусдаг, усны ягаан (бараг өнгөгүй) уусмал нь aquacomplex 2+; катионоор гидролизат хийнэ. Шүлттэй аммиакийн амин хүчилтэй урвалд ордог. Исэлдүүлэгчийг сулруулах нь ердийн (хүчтэй) исэлдүүлэгч бодисуудтай урвалд ордог.
Чанарын урвал Mn 2+ ион руу MnO 4-ийн ионтой хамт шилжинэ, сүүлчийн ягаан өнгө арилах, Mn2+ -ээс MnO4-ийн исэлдэлт, ягаан өнгө үүснэ.
Mn, MnO 2 болон манганы бусад нэгдлүүдийг бичил биетэн болон аналитик урвалжаар олж авахад хэрэглэдэг.
Хамгийн чухал урвалуудын тэгшитгэл:
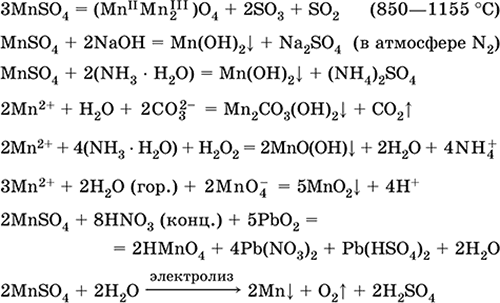
Хүлээн авах:
2MnO 2 + 2H 2 SO 4 (conc.) = 2 MnSO 4 + O 2 + 2H 2 O (100 ° C)
Төмөр (II) сульфат FeSO 4. Saline Цагаан (гидрат цайвар ногоон, техникийн нэр төмрийн vitriol),гигроскоп. Халаахад задардаг. Энэ нь усанд уусдаг бөгөөд катионоор бага хэмжээгээр гидролизд ордог. Энэ нь агаар дахь хүчилтөрөгчийн уусмалыг хурдан исэлдүүлдэг (уусмал шар болж, үүлэрхэг болдог). Хүчилд исэлдүүлэгч бодисууд, шүлтүүд, аммиакийн гидратуудтай урвалд ордог. Ердийн бууруулагч агент.
Энэ нь ашигт малтмалын будаг, электролит, мод бэлгэвч, фунгицид, цус багадах эмийн бүрэлдэхүүн хэсэг болгон ашигладаг. Лабораторид давхар давсыг Fe (NH 4) 2 (SO 4) 2 6N 2 O (ихэвчлэн) давс mora) агаарын илүү тэсвэртэй.
Хамгийн чухал урвалуудын тэгшитгэл:
![]()
Хүлээн авах:
Fe + H 2 SO 4 (ар.) = FeSO 4+ H 2
FeCO 3 + H 2 SO 4 (ар.) = FeSO 4 + CO 2 + H 2 O
7.4. VA-бүлэг метал бус
Азотын хэмжээ Аммони
Азотын хэмжээ - 2-р үеийн элемент ба Цуврал системийн VA бүлгийн дугаар 7. Атомын электрон томъёо [2 He] 2s 2 2p 3, шинж чанарын исэлдэлтэд 0, -III, + III, + V, багадаа + II, + IV болон бусад; N v мужийг харьцангуй тогтвортой гэж үздэг.
Азотын исэлдлийн хэмжээ:
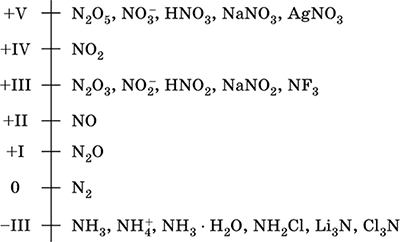
Азотын хувьд электроны чадавхи (3.07) өндөр, F ба O-ийн дараа гурав дахь нь металлын (хүчиллэг) шинж чанарыг харуулдаг. Хүчилтөрөгч агуулсан хүчил, давс ба хоёрдогч нэгдэл, мөн аммонийн катионы NH 4 ба түүний давсны хэлбэрүүд.
Байгаль дээр - долдугаарт химийн тархалтын элемент (металлын бус ес дэх). Бүх организмын чухал элемент юм.
Азотын N 2. Энгийн бодис. Энэ нь маш тогтвортой σππ - бондын N ≡ N нь туйлын бус молекулуудаас бүрдэнэ. Энэ нь энгийн нөхцөлд азотын химийн шинж чанарыг тайлбарладаг. Өнгөгүй, үнэргүй хий нь өнгөгүй шингэн (O 2-той ялгаатай) уусдаг.
Агаарын үндсэн бүрэлдэхүүн хэсэг: 78.09% эзэлхүүнтэй, 75.52% жинтэй. Шингэн агаараас азот хүчилтөрөгч O 2-ыг багасгана. Энэ нь усанд бага зэрэг уусдаг (20 0С-т 15,4 мл / 1л H 2 O), азотын уусмалын хэмжээ нь хүчилтөрөгчөөс бага байдаг.
Өрөөний температурт N 2 лити (чийгтэй орчинд) лити нитратын Ли 3 Н үүсгэх, бусад элементүүдийн нитридыг хүчтэй халаана.
N 2 + 3Mg = Mg 3 N 2 (800 ° C)
Цахилгааны урсацад N 2 фторын урвалд орж хүчилтөрөгчтэй маш бага хэмжээгээр урвалд ордог:
Аммиакийг үүсгэх урвуу урвал нь 350 ° С хүртэл даралттай ба гагнуурын хүчин зүйл (Fe / F 2 O 3 / FeO, Pt лабораторид) байх ёстой.
Le Chatelier зарчмын дагуу аммиакийн өсөлт нь даралт болон температурын бууралтаас болж үүсдэг. Гэсэн хэдий ч бага температурт урвалын хурд маш бага байдаг тул уг процессийг 450-500 ° C-д явуулж, 15% -ийн аммиакийн гарц руу хүрдэг. Шингэлсэн N 2, H 2 реакторт буцаж очиж хариу урвалын хэмжээг нэмэгдүүлнэ.
Азот нь хүчил, шүлттэй холбоотой химийн хувьд идэвхгүй бөгөөд шаталтанд дэмжлэг үзүүлэхгүй.
Авах нь аж үйлдвэр - шингэн агаарыг фрактиваар нэрэх буюу агаараас хүчилтөрөгчийг химийн аргаар устгах, жишээлбэл, 2C (кокс) + O 2 = 2CO халаалтын замаар Эдгээр тохиолдолд азотыг ихэвчлэн аргон (голдуу аргон) -ийн бохирдуулагч агуулсан байдаг.
Дотор нь лабораториуд Химийн цэвэр азотын бага хэмжээг дунд зэргийн халаалттай хослуулан авч болно.
N -III H 4 N III O 2 (t) = N 2 0 + 2H 2 O (60-70 ° C)
NH 4 Cl (p) + KNO 2 (p) = N 2 0 + KCl + 2H 2 O (100 ° C)
Энэ нь аммиак, азотын хүчил болон бусад азотын агуулсан бүтээгдэхүүнийг хими, металлургийн процессын инертийн орчин, шатамхай бодис хадгалахад ашигладаг.
Аммиак NH 3. Хоёрдогч бодис, азотын исэлдлийн зэрэг нь III юм. Хурц үнэртэй өнгөгүй хий. Молекул нь бүрэн бус тетраэдрийг [: N (H) 3)] (sp 3 гиб-гибридизацийн) бүтэцтэй. 3-р холимог тойрог дахь электрон донор хосын NH 3 3 молекул дахь азотын орц нь устөрөгчийн катионы шинж чанарын нэмэлт хариу урвалыг үүсгэдэг. аммони NH 4 +. Өрөөний температурт даралтаар шингэрүүлсэн байна. Устөрөгчийн бондоос шингэн төлөвтэй холбоотой байдаг. Тогтмол биш. Энэ нь усанд уусдаг (20 0 С-ийн температурт 700л / л-ээс дээш H 2 O); ханасан уусмалын эзлэх хувийн жин = 34% масс ба = 99% эзэлхүүнтэй, pH = 11.8.
Өндөр реактив, нэмэлт хариу үйлдэл хийх хандлагатай байдаг. Хүчилтөрөгч үүсч, хүчлээр үйлчилнэ. Энэ нь (N-IIII) ба исэлдэлтээс (H I) -ийн шинж чанарыг бууруулдаг. Зөвхөн кальцийн исэлээр хатаадаг.
Чанарын урвал - Хлоридтай нүүрстөрөгчтэй цагаан утаа үүсэх, Hg 2 (NO 3) 2 уусмалаар чийгшүүлнэ.
HNO 3 болон аммонийн давсуудын синтезийн завсрын бүтээгдэхүүн. Сод, азотын бордоо, будагч бодис, тэсрэх бодис үйлдвэрлэхэд ашигладаг. шингэн аммиак бол хөргөгч юм. Хортой.
Хамгийн чухал урвалуудын тэгшитгэл:
Авах: in лабораториуд - сод шохой (NaOH + CaO) халсан үед аммонийн аммиакийг нүүлгэх:
эсвэл аммиакийн усан уусмалыг буцалгана, дараа нь хийн хатаагаад хатаана.
Дотор нь аж үйлдвэр Аммон нь азотоос (устөрөгчөөр) устдаг. Техникийн нэрээр шингэрүүлсэн хэлбэрээр эсвэл төвлөрсөн усан уусмал хэлбэрээр үйлдвэрлэвэл үйлдвэрлэсэн болно аммиакийн ус.
Ammonia Hydrate NH 3 H 2 O. Интермеолкулсийн нэгдэл. Цагаан, Кристал сүлжээ нь NH 3 болон H 2 O молекулууд бөгөөд H 3 N ... HON. Аммиакийн усан уусмалаар сулхан суурьтай уусмал (диссоциацийн бүтээгдэхүүн - NH4 cation ба OH анион). Аммонийн катион нь тогтмол π-тетраhedral бүтэцтэй (sp 3 - гибридизаци). Уусмалыг буцалгаж бүрэн хэмжээгээр тогтворгүй байдаг. Хүчтэй хүчлүүдээр саармагжуулж байдаг. Төвлөрсөн уусмал дээр (N III-ийн улмаас) шинж чанарыг бууруулахыг харуулж байна. Энэ нь ионы солилцоо болон нийлэмжийн урвал руу ордог.
Чанарын урвал - Хлортой HCl-тэй холбоотой цагаан утаа үүсэх.
Энэ нь ампотерик гидроксидын хур тунадасны үед уусмал дахь сул шүлтийн орчинг үүсгэхэд ашигладаг.
1мл аммиакийн уусмал нь ихэвчлэн NH 3 H 2 O гидрат, NH 4 + болон OH ион (зөвхөн гидратын задралаас хамаарч 0,4%); Тиймээс ионы "аммонийн гидроксидын NH 4 OH" нь уусмал дээр бараг байхгүй бөгөөд хатуу гидратад ийм нэгдэл байхгүй. Хамгийн чухал урвалуудын тэгшитгэл:
NH 3 H 2 O (дүгнэлт) = NH 3 + H 2 O (NaOH буцалгах)
NH 3 H 2 O + HCl (Dec.) = NH 4 Cl + H 2 O
3 (NH 3 H 2 O) (дүгнэлт) + CrCl 3 = Cr (OH) 3 ↓ + 3NH 4 Cl
(NH 3 H 2 O) (төг) + Збр 2 (p) = N 2 + 6NH 4 Br + 8H 2 O (40-50 ° C)
2 (NH 3 H 2 O) (дүгнэлт) + 2KMnO 4 = N 2 + 2 МnO 2 ↓ + 4H 2 O + 2KON
4 (NH 3 H 2 O) (дүгнэлт) Ag 2 O = 2OH + 3H 2 O
4 (NH 3 H 2 O) (дүгнэлт) + Cu (OH) 2 + (OH) 2 + 4H 2 O
6 (NH 3 H 2 O) (дүгнэлт) + NiCl 2 = Cl 2 + 6H 2 O
Азотын аммиакийн уусмал (3-10% - - цаг) гэж нэрлэдэг шингэн аммиак (нэрийг алкемистийн нэрээр нэрлэсэн), төвлөрсөн уусмал (18.5-25%) аммиакийн ус (үйлдвэрээс гаргасан).
