28 г цахиурыг хүчилтөрөгчтэй холбоход. Цахиурын хүчилтөрөгчийн нэгдлүүд
Kremniy.Obschaya harakteristika.Osnovnoe ялгаатай нь нүүрстөрөгчийн: байхгүй н устөрөгч (silanesийн хэдэн) нь soedineniyah.Silitsidy.Soedineniya харилцаа холбоо, исэлдэж, gidroliz.Tetraftorid болон цахиурын дөрвөн хлорт, цахиурын gidroliz.Geksaftorosilikaty.Kislorodnye soedineniya.Oksid (IV) .Silikagel.Kremnevaya kislota.Silikaty.Rastvorimost болон gidroliz.Prirodnye силикатууд болон алюминосиликат tseolity.Kremniyorganicheskie soedineniya.Silikony siloksany.Ispolzovanie болон анагаах ухаанд цахиурын нэгдлүүд.
Silicon (латик силики), Si, үечилсэн системийн IV бүлгийн химийн элемент; атомын дугаар 14, атомын масс 28.086. Silicon нь цахим гибридизацийн sp3-ыг үзүүлдэг
орбитууд. Цахиур атомын гадаад электрон давхаргад valence 3d-
орбит (Si: 3s23p23d0),
Хүчилтөрөгчийн дараах цахиур нь царцдасын хамгийн нийтлэг элемент юм. Чөлөөт нүүрстөрөгчөөс ялгаатай нь цахиур нь байгальд байдаггүй. Түүний хамгийн түгээмэл нэгдлүүд нь цахиурын исэл (IV) SiO2 ба силикатын хүчил давс, силикатууд юм. Тэдгээр нь дэлхийн царцдасын бүрхүүл болдог. Цахиурын нэгдэл нь ургамал, амьтанд илэрдэг. Химийн шинж чанараар цахиур, нүүрстөрөгч гэх мэт цахиур нь метал бус боловч металлын бус чанар нь атомын радиустай учраас
Silicon. бараг бүх металлтай нэгдлүүдийг бүрдүүлдэг микицид (Bi, Tl, Pb, Hg-тэй хамт нэгдлүүд олдоогүй). 250 silicides, түүний бүтэц (MeSi, MeSi2, Me5Si3, Me3Si, Me2Si нар.) Ер нь сонгодог valencies нийцэхгүй байна авсан байна. Силицид нь хугарлын болон хатуулгийн ялгаатай; хамгийн их практик ач холбогдол ferrosilicon (тусгай хайлш см-ийн баяжуулах аргыг бууруулах. төмрийн хайлш) болон MoSi2 молибдений silicide байна (цахилгаан халаагуур, хийн турбин ир гэх мэт. г.).
Силан Силикулид дээр давсны хүчлийн үйл ажиллагааны хүрээнд цахиурын хамгийн энгийн устөрөгчийн нэгдэл нь SiH4 silane:
Силан бол хортой хий юм. агаар
Тэд реактив бөгөөд хүчтэй бууруулах агентууд юм.
өрөөний температурт усаар урвалд:
SiH4 + 2H2O → SiO2 + 4H2,:
Тетрафлюорид Цахиур нь элементийн флюоринтай цахиурын диоксидыг флюринациар үүсгэдэг.
Флюринацийн процессыг дөлөнд реактороор хоёр үе шаттайгаар явуулж, нэгдүгээр үе шатаас элементийн флуорены давтамжийг 2-р шат хүртэл гүйцэтгэж байна.
Техникийн үр дүн нь өндөр ургац, бүтээгдэхүүний чанар бүхий тасралтгүй горимд цахиур үйлдвэрлэх явдал юм.
Цахиурт тетрафлуорид SiF4 нь гидрофлуорик (гидрофлавр) хүчил үүсгэдэг.
Na2SiO3 + 6HF ® 2NaF + SiF4 + 3H2O
Цахиурын хүчилтөрөгчийн нэгдлүүд
Цахиурын хүчилтөрөгч хамгийн чухал хэсэг нь цахиурын давхар исэл SiO2 (цахиур) бөгөөд энэ нь хэд хэдэн талст өөрчлөлттэй.
Бага температурын өөрчлөлт (1143 К хүртэл) гэж кварц гэж нэрлэдэг. Кварц нь пиезелик шинж чанартай байдаг. Кварцын байгалийн сорт: чулуулгийн болор, молор, кальцит. Цахиурын сортууд нь манан, opal, оникс,. хаш чулуу, элс.
Цахиур нь химийн тэсвэртэй; Энэ нь зөвхөн фторын, гидроффтор хүчил ба шүлтийн уусмалаар нөлөөлдөг. Энэ нь амархан шилэн шилээр (кварцын шил) ордог. Кварцын шил нь хэвийн, химийн болон дулааны хувьд тэсвэртэй байдаг. Тодорхойлогдсон SiO2 силикатын хүчил тусгай найрлагатай байдаггүй. Ерөнхийдөө цахиурын хүчил нь xH2O-ySiO2 гэж бүртгэгддэг. Олж авсан silicas: H2SiO3 (H2O-SiO2) - metasilicic (гурван oksokremnievaya), H4Si04 (2H20-Si02) - orthosilicic (тетра-oksokremnievaya), H2Si2O5 (H2O * SiO2) - dimetakremnievaya.
Шилний хүчил нь маш бага уусдаг бодис юм. Нүүрстэй харьцуулахад цахиурын метавобоал чанар багатай учраас H2SiO3 нь электролит H2CO3-ээс сул байдаг.
Силикат хүчлийн давс-силикатын уусмалууд нь уусдаггүй (шүлтийн металлын силикатаас бусад). Уусмал силикатууд нь тэгшитгэлээр гидролизэгдэнэ
2SiO3 - + H20 = Si2O52- + 20H-.
Уусдаг силикатын концентрацитай уусмалыг шингэн шил гэж нэрлэнэ. Ердийн цонхны шилэн силикатын натри, кальци нь Na20-CaO-6Si02-ийн найрлагатай. Энэ нь хариу урвалаар гардаг
Олон төрлийн силикатууд (илүү нарийвчлалтай, oxosilicates) мэдэгддэг. Оксосиликатын бүтцэд тодорхой дэглэмийг мөрддөг: бүгдээрээ хүчилтөрөгчийн атомаар холбогддог Si04 тетраэдрээс бүрдэнэ. хамгийн түгээмэл хослол tetrahedrons (Si2O76-), (Si3O9) 6- (Si40l2) 8 (Si6O1812-), бүтцийн нэгж болох гинж, хуурцаг, meshes болон завсар (Зураг 4) болгон нэгтгэж болно юм.
Хамгийн чухал байгалийн силикатууд нь жишээлбэл тальк (3MgO * H20-4Si02) ба асбест (SmgO * H2O * SiO2). SiO2-ийн адилаар шилмэл (аморф) байдал нь силикатын шинж чанар юм. Шилэн талсжсан талстжсан талстыг нарийн талст хэлбэрээр авах боломжтой байдаг. Сүүдэр нь хүч чадлаар тодорхойлогддог.
Силикатаас гадна aluminosilicates нь өргөн тархсан байдаг. Алюминосиликатууд - хүрээний оксосиликатууд, цахиур атомын нэг хэсэг нь trivalent Al; Жишээ нь Na12 [(Si, Al) 04] 12.
Силиксийн хүчлийн хувьд коллоид төлөв нь H2SiO3-ийн хүчил давс шууд нөлөөлдөггүй шинж чанартай байдаг. Зарим нөхцөлд цахиурын хүчил (sols) -ын коллойд уусмал (жишээ нь, халсан үед) нь цахиурын хүчлийг ил тод, нэгэн төрлийн гель шиг масс-гель болгон хувиргаж болно. Гель нь SiO2 молекулуудаас бүрдэх орон зайн, маш сул бүтэц бүхий өндөр молекулын нэгдлүүд бөгөөд эдгээр нь H2O молекулуудаар дүүрсэн байдаг. Шингэх цахиурын гелийг цахиурын гель олж авдаг - өндөр шингээх хүчин чадалтай сүвэрхэг бүтээгдэхүүн.
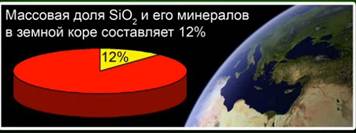
Цахиур исэл (IV) (цахиур) - Дэлхийн царцдасын хамгийн түгээмэл нэгдэл нь массын 12% -ийг янз бүрийн эрдэс бодисоор бүрдүүлдэг. Кристал ба аморфийн цахиураас ялгах. Цахиурын исэл (IV) -ийн хамгийн энгийн томъёо нь SiO2 юм. Энэ нь атомын схемд хувирдаг.
1) Кристал цахиур - кварцын эрдэс ба түүний сорт (чулуулгийн, манжин, чулуу, оникс, цахиур чулуу, цахиур чулуу); кварц нь барилгын болон силикатын салбарт өргөн хэрэглэгддэг кварцын элсний суурь болдог.
2) Аморфилын цахиур - SiO2 nH2O-ийн цахиурын найрлага хэлбэрээр; Аморфилийн цахиурын дэлхийн хэлбэрүүд нь диатомит, Триполи (infusorial earth); Хиймэл аморфгүй усгүй цахиурын жишээ бол цахиурын гель бөгөөд энэ нь натрийн метиликатаас гаргаж авдаг.
Na2SiO3 + 2HCl = 2NaCl + H2SiO3
Цахиурын гель нь боловсруулсан гадаргуутай тул чийгийн худаг шингэсэн байдаг.
Цахиурын гель нь гидравлик хүчил (nSiO2 · mH2O) уусмалаас үүссэн хатаасан гель рН\u003e 5-6. Хатуу hydrophilic sorbent.
Авах
Үүнийг шүлтийн металлын силикатын уусмалаар хүчиллэгжүүлж дараа нь гелийг хатаана.
Цахиурын хүчил. SiO2 нь хэд хэдэн силикатын хүчил байдаг
Цахиурын хүчил нь тетраэдрийн бүтцийн нэгжүүдээс бүрдэнэ (эдгээр нэгж бүрт цахиур атом нь тетраэдрон төвд байдаг ба хүчилтөрөгчийн атомууд орой дээр байрладаг). Бүтцийн холбоо, гинжит холбоосууд нь илүү тогтвортой полисилкон хүчил үүсгэдэг:
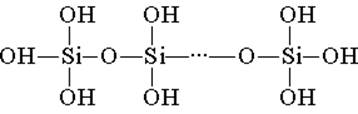
Ийм нийлмэл найрлага нь (H2SiO3) n хэлбэрээр илэрхийлж болно. Гэсэн хэдий ч цахиурын хүчил нь ихэвчлэн H2SiO3 томъёогоор төлөөлдөг. H2SiO3 - хүчил маш сул, ус багатай уусдаг. Халаахад амархан нүүрстөрөгчийн хүчилтэй адилаар задарч болно.
Бүх силикатын хүчлүүд нь маш сул (нүүрснээс бага).
Силикатууд. Силикатын хүчлүүдийн давсыг силикат гэж нэрлэдэг боловч боловсролын материалдаа силикат нь метафильстины хүчил давсныг илэрхийлдэг. Тэдний найрлага нь элементийн ислүүдийн нэгдлүүдийн хэлбэрээр илэрхийлэгддэг. Жишээлбэл, кальцийн силикат CaSiO3-ийг CaO × SiO2 гэж илэрхийлж болно.
Силикат бүтэц R2O × nSiO2, үүгээр R2O - натрийн буюу калийн исэл, усны шилэн дуудаж, тэдний төвлөрсөн усан уусмалын - усны шил. Хамгийн чухал нь натрийн уусдаг шил юм.
Агаарт зогсоход силикатын уусмалууд нь булингартай болтлоо өсдөг. Яагаад гэвэл нүүрстөрөгчийн давхар исэл (IV)
Шилний хүчил нь усанд уусдаггүй бөгөөд энэ нь ионы SiO32-ийн чанарын хариу урвал болгон ашигладаг.
Силикатыг цахиурын холимогоор шүлтлэг буюу карбонатаар хутгах замаар гаргаж авна.
Цахиурын хүчил түүний татан буулгах хэмжээ нь хэд хэдэн хүчин зүйлээс хамаардаг бөгөөд үүнээс хамгийн чухал нь цахиурын давхар ислийн агууламж, тархалтын түвшин, температур зэргийг өөрчилдөг. Цахиурын гельийг усаар сэгсэрч байх үед цөцгийн хувьд тэнцвэрт байдал хэдхэн цагийн дотор бий болно. Кварцын хувьд олон сар, тэр ч байтугай жил хэрэгтэй болно.
БИДНИЙ БАЙГУУЛЛАГА (Латин silex, төрөл нас барсан silicis эхлэн - цахиур * байгалийн силикатууд, ... N naturliche Silikate, ... Мөн silicatos naturales, силикатууд naturels е) - ашигт малтмалын ангилал, silicic давс, iso- болон geteropolikremnievyh хүчлийн. Байгалийн силикатын эзлэх хувь нь дэлхийн царцдасын массын 75%, ашигт малтмалын 25% -ийг бүрдүүлдэг. байгаль онд 700 гаруй байгалийн силикатууд, гол чулуулаг бүрдүүлэгч эрдэс (хээрийн жоншны, pyroxenes, амфиболууд, гялтгануур, гэх мэт) зэрэг байдаг.
Алюминосиликатууд - байгалийн ба синтетик силикатын бүлэг, цахиур, хөнгөн цагаан агуулсан комплекс анионууд. Нарийн анионы жишээ: -, -, 2 -. Na +, K +, Mg2 +, Ca2 +, ба заримдаа Ba2 + болон Ли + катионуудаар ажилладаг.
Байгалийн хөнгөнцагааниликат нь хамгийн түгээмэл ашигт малтмал бөгөөд тэдгээр нь дэлхийн царцдасын массын 50 хүртэл хувийг эзэлдэг. Үүнд: хээрийн жонш (albite, orthoclase, anortite), шаварлаг эрдсүүд болон гялтгануур.
Зеолитууд - Эдгээр нь кальци, натри, кали, бари, бусад зарим элементтэй усан aluminosilicates юм. Зeолит бүлэгт 40 гаруй төрлийн эрдсүүдээс бүрддэг ба энэ нь физикийн болон химийн шинж чанаруудад (ялангуяа талст усны гидрогеултын усны молекулууд) ялгаатай байдаг. Гэхдээ бараг бүх ашигт малтмал энэ бүлгийн нийтлэг өмч юм - тэд сайн Сорбент ионы солилцооны шинж, хувь хүний ион, молекулын шигшүүр ажлын хөдөлгөөнийг өөрчлөх чадвартай байх юм. Харьцангуй саяхан эдгээр ашигт малтмалууд гэнэтийн ашиглалтыг олж илрүүлсэн бөгөөд тэд хөдөө аж ахуйн салбарт ашиглагдаж эхэлсэн.
Органик химийн нэгдлүүд - молекулууд нь цахиур ба нүүрстөрөгчийн атомууд хоорондоо холбоотой байдаг нэгдлүүд. Органик эслэгийн нэгдлүүд нь заримдаа силикон гэж нэрлэдэг. Тосолгооны материал, полимер, резин, резин, шингэний тос, эмульс үйлдвэрлэхэд органик цилиндрүүд хэрэглэгддэг. Органик эслэгийн нэгдлүүд нь гоо сайхан, гэр ахуйн химийн бодис, будаг, лак, угаалгын бодис хэрэглэдэг. Нийлмэл органик нэгдлүүд дээр суурилсан бүтээгдэхүүнээс органик цилиндр дээр суурилсан бүтээгдэхүүний онцлог шинж чанар нь өндөр гүйцэтгэлийн шинж чанар, шинж чанар, хүний хэрэглээний аюулгүй байдлыг хангаж байдаг. Силикон полимерийг хоол хийх хөгц хийхэд ашиглаж болно. Органик целлюлозын нэгдлүүд болон чигжээсийн полимержилт нь хүний хувьд аюулгүй бөгөөд олборлолт шаарддаггүй.
Силокан - молекул дахь цахиур ба хүчилтөрөгчийн атомыг агуулсан нэгдлүүд. Хамгийн өндөр нь өндөр молекул жинтэй siloxanes - поли азосилоксанууд; Силикон полимерийг үзнэ үү.
Силиксон (polyorganosiloxanes) - хүчилтөрөгчийн өндөр молекул жинтэй органик цилиндртэй нэгдлүүд нь R = органик бүлэг (метил, этил эсвэл фенил) бүхий химийн томъѐо. Энэ тодорхойлолт нь маш ховор, полиморфилогоксан (жишээлбэл, PMS төрлийн силикон тос, NGL төрлийн усыг засах эсвэл бага молекул жинтэй SKTN rubbers), цаашилбал цахиурын "цахиур", "цахиур", " силикон ".
Металлын цахиур  Кристал цахиур
Кристал цахиур
Silicon (Si). Энэ химийн элемент нь дэлхийн царцдасын бүтцийн 1/4 юм. Кварц, чулуу, элс, шавар, боржин чулуу, гялтгануур, асбест гэх мэт цахиурын химийн нэгдлүүд
Цахиур нь завсрын элемент (ампотерик) бөгөөд метал ба метал бус шинж чанарыг агуулдаг. Энэ нь метал болон металлын бус химийн нэгдлийг үүсгэж болно.
Цэвэр цахиур - саарал өнгөт химийн энгийн бодис, хатуу, галд тэсвэртэй, хэврэг байдаг. Кристал цахиур Энэ нь металлын гялалзуулж, хагас дамжуулагчийн үйлдвэрт өргөн хэрэглэгддэг (хагас дамжуулагч юм).
Цахиур нь болор талст шиг талст цахиур), мөн аморф мужид ( аморф цахиур). Цахиурын цахиур нь хайлмал металлын аморфийн цахиурын уусмалыг хөргөх замаар үүсдэг. Цаашилбал, цахиурын цахиур нь маш нэвтэрхий материал бөгөөд амархан аморфын нунтаг болж амархан бутдаг. Тиймээс, аморф цахиур нь цахиурын цахиурын болор талстын хэсэг юм.
Үнэгүй байдалд цахиур нь олж авахад маш хэцүү байдаг. Үйлдвэрийн үйлдвэрлэл нь SiO 2-ийн химийн томъёогоор кварцын сэргэлттэй холбоотой бөгөөд энэ нь халуун кокс (нүүрстөрөгч) үүсгэдэг.
SiO 2 + C → CO 2 + Si
Лабораторид цэвэр цахиурыг цахиурын элсээс металлын магнигаар багасгаж дараах урвалыг ашиглана.
SiO 2 + 2Mg → Si + 2MgO.
Энэ урвалын үед аморфилийн цахиурын хүрэн нунтаг үүсдэг. Халаахад нунтаг нь шүлтлэг концентрацитай уусмалаар аажмаар урвалд орно (жишээлбэл, натрийн гидроксид NaOH)
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2, энэ нь нийлмэл бодисыг - шингэн шил гэж нэрлэдэг.
Цахиурын химийн үйл ажиллагаа талстын талбайн хэмжээнээс хамаардаг нь сонирхолтой юм. Кристал цахиур нь аморфоос илүү химийн идэвхтэй байдаг. Өнгөрсөн бэлэн ч энгийн температурт фтор урвалд орж, 400-ийн температурт - 600 0 С зохих химийн төрөл зүйлийг бий болгох хүчилтөрөгч, хлор, Бром, хүхэр урвалд ордог. Өндөр температурт цахиур нь азот болон нүүрстөрөгчтэй урвалд орж азотын давхар исэл, цахиурын карбидыг үүсгэдэг.
Хэрэв та hydropluoric HF (hydrofluoric) болон азотын HNO 3 хүчлүүдийн холимогт цахиурыг уусгуулах гэж оролдвол урвал үргэлжлэхгүй. Гэхдээ хэрэв та калийн гидроксидоор шүлттэй химийн урвал явуулдаг бол цахиурын хүчил давс үүсэх
Si + KOH → K 2 SiO 3 + H 2
Хэрэв коксын зуухны цахиур (элс) -ийг кальцид шахаж авбал маш хатуу талст бодис болж хувирдаг. Carborundum SiC
SiO 2 + 3C → SiC + 2CO
Carborundum - маш хатуу ба галд тэсвэртэй бодис. Аж үйлдвэрт эдгээр шинж чанаруудаас шалтгаалан их хэмжээгээр үйлдвэрлэгддэг. Сонирхолтой нь carborundum болор сүлжээ нь хамгийн хүнд хэцүү бодисын алмаазтай төстэй байдаг ч гэсэн тусдаа нүүрстөрөгч атомууд цахиур атомаар солигддог.
Өндөр температурт, түүнчлэн цахиуртай металлын нэгдэл дэх хүчлүүдийн үйлчлэлд химийн урвалын үед, silane SiH 4.
Силан - Энэ нь өөрөө шатдаггүй өнгөгүй хий юм. Энэ нь агаарт цахиур, ус үүсгэх боломжтой.
SiH 4 + 2O 2\u003e → SiO 2 + 2H 2 O
Хэрэв SiO2-ийн цахиур исэл нь хлор агуулсан урсгалд нүүрстөрөгчийг халаадаг бол химийн урвал нь цахиурын хлорид
SiO 2 + 2C + 2 Cl 2 → SiCl 4 + 2CO
Silicon chloride цахиур, давсны: - энэ нь зөвхөн 54 0 С цахиурын хлорид нь шингэн, буцалж буй температур хоёр хүчлүүд нь уусмал үүсэх нь усанд амархан уусдаг юм
SiCl 4 + H 2 O → H 2 SiO 3 + HCl
Хэрэв энэ химийн урвал чийглэг агаарын орчинд явагдвал хоёр хүчил үүсэх үед зузаан утаа үүснэ.
Цахиур фтор SiF 4 - гидроффлуорийн хүчил ба цахиурын оксидын химийн урвалын үр дүнд үүссэн
SiO 2 + 4HF → SiF 4 + 2H 2 O
Цахиурын фтор нь "хүчтэй" үнэртэй өнгөгүй хий юм. Мөн цахиурын хлорид, усан дахь энэ хийн нь цахиур, гидроффлорик гэсэн хоёр хүчлийг үүсгэдэг. Гэсэн хэдий ч цахиур фтор нь фторын хүчилтэй харилцан үйлчилж болно hexafluorosilicic хүчил химийн томъёо нь H 2 SiF 6. Түүний давс, хүчил нь хортой байдаг.
Silicon
Үндсэн метал ба металлын бус
Энэ хичээлээр та "Цахиур" гэсэн сэдвийг судална. Цахиурын талаархи мэдээллийг авч үзэх цахиурын цахиурын талаарх цахим бүтцийг судалж, цахиурын аллотропийг судалж, физик болон химийн шинж чанаруудыг тайлбарлах. Цахиурыг үйлдвэрлэлийн салбарт болон бусад салбарт хэрхэн ашигладаг талаар олж мэдээрэй. Та цахиур, цахиурын хүчил, түүний давстай силикаттай танилцах болно.
Сэдэв: Үндсэн металлууд болон металл бус
Хичээл: Цахиур. Нобелийн хий
Цахиур нь дэлхийн царцдасын хамгийн нийтлэг химийн элементүүдийн нэг юм. Түүний агууламж бараг 30% байна. Байгаль дээр гол төлөв цахиурын диоксид, силикат, хөнгөнцагааниликат зэрэг янз бүрийн хэлбэртэй байдаг.
Цахиур нь бараг бүхэлдээ нэгдэл дэх тетравлаз юм. Энэ тохиолдолд цахиур атом нь сэтгэл хөдөлгөм төлөвт байна. Зураг. 1.
Энэ мужид орохын тулд гурван цулын нэг нь 3б-ийн тойрог зам дээр сул орон зай эзэлдэг. Энэ тохиолдолд газар дээрх төлөвт 2 хосгүй электрон оронд аз жаргалын байдалд байгаа цахиур атом нь 4 гарангүй электрон байна. Тэрээр солилцооны механизмаар 4 ковалент бондыг байгуулж чадна.


Цахиур атомууд нь олон бонд үүсэх хандлагатай байдаггүй, гэхдээ нэг бонд бүхий Si-O- хэлбэрийн нэгдлүүд юм. Силон нь нүүрстөрөгчөөс ялгаатай нь алло-булшны нийлэгжилт биш юм.
Нэг нь allotropic modification нь талст цахиурцахиур атом тус бүр sp 3 гибридизацид ордог. Зураг. 2, 3. Кристал цахиур нь металлын гялалзсан, харанхуй саарал өнгийн хатуу, галд тэсвэртэй, удаан эдэлгээтэй талст юм. Энгийн нөхцөлд хагас дамжуулагч. Заримдаа аморфийн цахиур нь цахиурын бусад аллотропийн өөрчлөлтийг үүсгэдэг. Энэ нь хар хүрэн нунтаг бөгөөд химийн хувьд идэвхтэй байдаг цахиурын цахиураас илүү байдаг. Алёотропын өөрчлөлт нь үүсэлтэй цэг юм.
Цахиурын химийн шинж чанар
1. Halogens-тай харилцан холбоотой
Si + 2F 2 → SiF 4
2. Халах үед цахиур нь хүчилтөрөгчөөр шатдаг бол цахиур (IV) үүснэ.
Si + O 2 → SiO 2
3. Өндөр температурт цахиур нь азот эсвэл нүүрстөрөгчтэй харилцан үйлчилдэг.
3Si + 2N 2 → Si 3 N 4
4. Цахиурын хүчил нь хүчиллэг усан уусмалаар хариу үйлдэл үзүүлэхгүй. Гэвч энэ нь шүлтээр уусдаг.
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2
5. Цахиур нь металоор бүрсэн үед цахиурын найрлага үүсдэг.
Si + 2Mg → Mg 2 Si
6. Цахиур нь устөрөгчтэй шууд харилцдаггүй боловч цахиурын устөрөгчийн нэгдлүүд нь усыг силикатын харилцан үйлчлэлээр гаргаж авдаг.
Mg 2 Si + 4H 2 O → 2 Мг (OH) 2 + SiH 4 (silane)
Силанууд нь алканзын бүтэцтэй төстэй боловч ихээхэн идэвхтэй байдаг. Хамгийн тогтвортой моносилан нь агаарт шатамхай болно.
SiH 4 + 2 O 2 → SiO 2 + 2H 2 O
Цахиур авах
Цахиур нь цахиурын исэл (IV)
SiO 2 + 2Mg → Si + 2MgO
Эдгээр ажлуудын нэг нь өндөр цэвэршилттэй цахиурыг олж авах явдал юм. Энэ зорилгоор техникийн цахиурыг цахиур тетрахлорид руу шилжүүлдэг. Үүний үр дүнд тетрахлоридыг силан болгон бууруулж, халах үед цахиур болон устөрөгч руу цахиур задрана.
Цахиур нь хоёр исэл үүсгэх боломжтой: SiO 2 - цахиурын исэл (IV) ба SiO - цахиурын исэл (II).
SiO - цахиурын исэл (II) - энэ бол цахиурын оксид (IV) цахиурын харилцан үйлчлэлээр үүссэн аморфийн хар хүрэн бодис юм.
Si + Сио 2 → 2 Сио.
Тогтвортой хэдий ч энэ бодис бараг ашиглагдахгүй байна.
SiO 2 - цахиур исэл (IV)


Энэ бодис нь дэлхийн царцдасын 12% -ийг эзэлдэг. Зураг. 4. Энэ чулуу нь чулуулаг, кварц, аметист, жорлон, жорлон, манжин зэрэг эрдсүүдийг төлөөлдөг. Зураг. 5
SiO 2 - цахиурын исэл (IV) - молекулын бус бүтэцтэй бодис.
Түүний болор сүлжээ нь атом юм. Зураг. 6. SiO 2 талстууд нь хүчилтөрөгчийн атомаар харилцан холбогдсон тетраэдрр хэлбэртэй байдаг. (SiO 2) н молекулын томъёо илүү зөв болно. SiO 2 нь атомын бүтэц, CO2-ийн молекулын бүтцээс бүрддэг тул тэдгээрийн шинж чанар нь тодорхой байна. CO 2 нь хий, SiO 2 нь хатуу, тунгалаг, тунгалаг талст бодис юм.
Химийн шинж чанарSi2 орчим
1. Цахиурын исэл (IV) SiO 2 нь хүчиллэг исэл юм. Энэ нь устай урвалд ордоггүй. Цахиурын хүчил нь SiO-ийн усаар шингээж авах боломжгүй. 2. Давс, силикатын давс нь SiO2-ийн халуун шүлтийн уусмалаар урвалд ордог.
SiO 2 + 2NaOH Na 2 SiO 3 + H 2 O
2. Шүлтийн болон шүлтлэг металлын карбонаттай бодисууд.
CaCO 3 + SiO 2 CaSiO 3 + CO 2
3. Металлтай харилцан үйлчилдэг.
SiO 2 + 2Mg → Si + 2MgO
4. Флуоруфорын хүчилтэй урвалд орох.
SiO 2 + 4HF → SiF 4 + 2H 2 O
SiF 4 + 2HF → H2
Силикатын хүчлийн ба цахиурын химийн шинж чанар
Цахиурын хүчил авах
Силикатын хүчил нь полимер хольц юм. Silicic Acid Formulas -
H 2 SiO 3 (мета хэлбэр) болон H 4 SiO 4 (ortho хэлбэр) - элементүүдийн харьцаа, бодит бүтэц биш. Конвенцид, онгоцон дээр силикарийн хүчлүүдийн найрлагыг Fig. 7
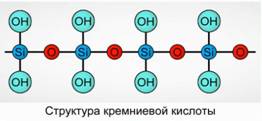
Цахиурын хүчлийн хувьд H 2 SiO 3 томъёог үргэлж хэрэглэдэг.
1. H 2 Сио 3 халаахад задардаг
H 2 SiO 3 H 2 O + SiO 2 (цахиурын гель)
2. Шүлтийн уусмалуудтай харилцан үйлчилнэ
H 2 SiO 3 + 2NaOH Na 2 SiO 3 + 2H 2 O
Шилний хүчил давс - силикатууд - ионы нэгдлүүдтэй холбогдоно. Эдгээр нь өнгөгүй, хатуу бодис юм. Литиас бусад шүлтийн металлын силикатууд усанд уусдаг.
1. Уусдаг силикатыг анионоор гидролиз хийж болно
Na 2 SiO 3 + H 2 O ⇆ NaHSio 3 + NaOH
2. Уусдаг силикатууд хүчтэй хүчилтэй харилцан үйлчилдэг.
Na 2 SiO 3 + 2HCl → H 2 SiO 3 ↓ + 2NaCl
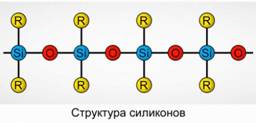
Polyorganosiloxanes (силикон)
Полиногенилоксан (силикон) нь хүчилтөрөгч, өндөр молекул жинтэй органик цилиндртэй нэгдэл юм.
R 2 [ Сио] n
R нь органик бүлэг (метил, этил эсвэл фенил). Силикан төрлийн бүтэц нь цахиур атом, хүчилтөрөгч солигддог гинж юм. Зураг.8. Гинжин ба органик бүлгүүдийн уртыг өөр өөрөөр өөр өөр шинж чанар бүхий силиконууд олж авч болно. Полимержих нөхцөлийг өөрчилснөөр өөр өөр урттай молекулуудыг авч болно.


Богино гинжний полимер нь шингэн, урт нь үнэ цэнэтэй тослох материал юм. Зураг. 9-ийнхаас үл хамааран их хэмжээний температурын хязгаарт байгаа үл хөдлөх хөрөнгийг хадгалдаг
100 0 С + 300 0 С. Молекулууд нь бага температурт мэдрэмтгий байдаггүй резинийг бүрдүүлдэг. Эвдрэлийн өндөр эсэргүүцэлтэй байх нь химийн хувьд идэвхгүй байдаг. Зураг. 10. Энэ нь програмын янз бүрийн хувилбаруудыг үүсгэдэг. Эдгээр нь хиймэл зүрх, бөөрний машин үйлдвэрлэхэд ашиглагддаг бөгөөд гутлын гутлын зориулалтаар ашиглаж болно. Силоксан полимерууд нь янз бүрийн зөөлөн суулгац үүсгэхийн тулд анагаах ухаанд хэрэглэгддэг. Учир нь эдгээр полимерүүд нь химийн идэвхгүй бөгөөд биед татгалздаггүй. Тэд усаар moistened биш юм. Энэ нь тосыг хэрэглэдэг. Энэ тосыг гартаа хэрэглэхдээ тэр резинэн бээлий орлуулах болно.
Органик бус цэцэрлэг
Натрийн силикатаар дүүргэсэн тунгалаг шилэн саванд өнгөт давсны талстыг жишээлбэл, зэс сульфатыг дүрнэ. Хэсэг хугацааны дараа, үлдэгдэл силикатаас бүрддэг талстуудаас үүссэн нимгэн хөндий хоолой харагдаж байна. Зураг. 11

"Тэнэг" шаварт ороорой
Натрийн силикат ба эмнэлгийн архины хэмжээ ижил байна. Тунадасыг шүүж, архи уухгүй байхаар шахаж гаргана. Энэ бол шаваас юм. Зураг. 12. Үүнийг цонхны шаваас болгон ашиглахаар төлөвлөсөн тул энэ нэрээр нэрлэгдсэн байна. Гэвч энэ зорилгодоо хүрэхийн тулд иймэрхүү шинж чанарууд байдаггүй юм байна. Хэрвээ бөмбөгийг өнхрүүлж, шалан дээр хаячихвал резинэн бөмбөлөг шиг үсрэх болно. Хэрвээ ширээн дээр тавих юм бол шингэн шиг тархдаг. Хэрэв та хатуу объектыг цохих юм бол энэ нь хатуу биетэй адил болно. Хэсэг хугацааны дараа, согтууруулах ундаа хатах үед энэ шаваас нь сүйрэх болно.
![]()
Хичээлийг нэгтгэн дүгнэх
Энэ хичээлээр та "Цахиур" гэсэн сэдвийг судалсан. Цахиурын тухай цахиурын тухай мэдээлэл, цахиур нь цахиур нь оршдог цахиурын организмыг судалж физик, химийн шинж чанарыг тайлбарласан. Тэд цахиурыг үйлдвэрлэлийн болон бусад салбарт хэрхэн ашигладаг талаар сурч мэдсэн. Та цахиур, силикатын хүчил, түүний давстай хамт силикатуудтай танилцсан.
Лавлагаа
1. Рудзити G.E. Химийн. Ерөнхий хими үндэс 11-р анги: Боловсролын байгууллагын сурах бичиг: үндсэн түвшин / G.E. Рудзит, F.G. Feldman. - 14 дахь хэвлэл. - М.: Гэгээрэл, 2012.
2. Popel P.P. Хими: 8х: Ерөнхий боловсролын сургуулийн сурах бичиг / PP. Попел, L.S. - К .: ИЦ "Академи", 2008. - 240 х.
АНУ-ын Габриэлэн Химийн. 11-р анги. Үндсэн түвшин. 2-р хэвлэл. - М.: Drofa, 2007. - 220 х.
Гэрийн даалгавар
1. №2-4 (х 138) Рудзити G.E. Химийн. Ерөнхий хими үндэс 11-р анги: Боловсролын байгууллагын сурах бичиг: үндсэн түвшин / G.E. Рудзит, F.G. Feldman. - 14 дахь хэвлэл. - М.: Гэгээрэл, 2012.
2. Полиоценилоксоксайнуудын хэрэглээ гэж юу вэ?
3. Цахиурын этотропийн өөрчлөлтийн шинж чанаруудыг харьцуулна.
