कैल्शियम और मैग्नीशियम यौगिक
इसलिए, कल निर्धारित किया गया है कि कुचल अंडे में कैल्शियम कितना निहित है, तो सवाल उठता है "पीने के लिए या पीने के लिए नहीं"। अधिकांश पुरुषों की तरह, मैं एक वैज्ञानिक दृष्टिकोण से सब कुछ लेकर आता हूं और जब तक मैं इसे खुद नहीं देखता, एक महिला के लिए एक शब्द का पता लगाना, जांचना, महसूस करना। इसलिए, मैं अपने विचारों को अंडेशेल और कैल्शियम के बारे में मिली जानकारी के आधार पर साझा करूंगा।
एक से अधिक खाद्य योज्य के रूप में अंडे के खोल के उपयोग के बारे में इंटरनेट पर जानकारी एकत्रित करना डॉक्टरों की आलोचनात्मक टिप्पणी के बाद आया कि अंडे के छिलके में मौजूद कैल्शियम कार्बोनेट पानी में अघुलनशील है और इसलिए इसे शरीर द्वारा अवशोषित नहीं किया जा सकता है।
इसके अलावा, मेरे दोस्त के पति या पत्नी की कहानी को याद किया गया था कि गर्भावस्था के दौरान उसने अपने डॉक्टर से कहा था, जिसने देखा था कि वह कुचले हुए अंडे के गोले ले रही थी - डॉक्टर ने उसे मना कर दिया और कुछ प्रकार के कैल्शियम युक्त जटिल निर्धारित किए।
सच कहाँ है?
वास्तव में, कैल्शियम कार्बोनेट CaCO3 (ठीक इसी प्रकार, कैल्शियम अंडे में होता है) पानी और शराब में अघुलनशील होता है।
कैल्शियम अवशोषण के लिए वास्तव में आवश्यक पूर्व शर्त इसका पानी घुलनशीलता है।
लेकिन याद रखें कि हमारे पाचन का आधार पेट में उत्सर्जित हाइड्रोक्लोरिक एसिड है।
और यही हमारे पेट में होता है:
СaCO3 + 2HCl (हाइड्रोक्लोरिक एसिड) = СaCl2 (कैल्शियम क्लोराइड) + Co2 + H20
लेकिन कैल्शियम क्लोराइड पानी में पूरी तरह से घुलनशील है !!! यह इस रूप में है कि कैल्शियम अवशोषित होता है!
डॉक्टरों को नहीं पता? या वे केवल चालाक हैं और हमें दवाएं बेचते हैं!
साथ ही, इस प्रतिक्रिया के दौरान, गैस्ट्रिक अम्लता में कमी होती है। उच्च अम्लता से पीड़ित लोगों के लिए क्या महत्वपूर्ण है।
एक उदाहरण मेरी पत्नी है, उसकी उच्च अम्लता है, और वह हर दिन थोड़ा कुचल अंडे लेती है और यह एक ही बार में दो समस्याओं को हल करती है और कैल्शियम की कमी की भरपाई करती है और उसकी अम्लता को कम करती है। लेकिन अंडे के छिलके का पाउडर बुझ गया नींबू का रस पी नहीं सकते - मतली है! और अब मैं समझता हूं कि क्यों।
जैसा कि हमने ऊपर देखा, कैल्शियम कार्बोनेट से कैल्शियम के अवशोषण के लिए उच्च अम्लता के साथ गैस्ट्रिक रस की आवश्यकता होती है।
वास्तविक जीवन में, बहुत बार ऐसी स्थिति होती है जब पेट की अम्लता कम या शून्य होती है। यह स्थिति विशेष रूप से पुराने लोगों की विशेषता है, जब ऑस्टियोपोरोसिस को रोकने के लिए कैल्शियम की आवश्यकता विशेष रूप से अधिक है। उदाहरण के लिए, 50 वर्षों के बाद, लगभग 40% लोगों में कम अम्लता होती है। इन शर्तों के तहत, कैल्शियम कार्बोनेट का अवशोषण, जिसमें हाइड्रोक्लोरिक एसिड को पेट में घुलने की आवश्यकता होती है, 2% तक गिर जाता है।
शायद यह जवाब है कि पुराने लोगों को कैल्शियम की कमी से जुड़े रोगों से पीड़ित होने की अधिक संभावना है - वे इसे अपने सामान्य रूप में आत्मसात नहीं कर सकते हैं।
अब विचार करें कि क्यों कुचल अंडे प्राप्त करने के लिए कई व्यंजनों को नींबू के रस के साथ बुझाने की सलाह दी जाती है।
जब हम कुचल साइट्रिक एसिड में नींबू का रस जोड़ते हैं, तो कैल्शियम कार्बोनेट (CaCo3) साइट्रिक एसिड (C6H8O7) के साथ प्रतिक्रिया करता है और हम प्राप्त करते हैं कैल्शियम साइट्रेट (सीए 3 (C6H5O7) 2):
2C6H8O7 + 3CaCO3 = Ca3 (C6H5O7) 2 + 3CO2 / 3H2O
यहाँ यह है। और कैल्शियम साइट्रेट का अवशोषण, जिसे पेट में हाइड्रोक्लोरिक एसिड की आवश्यकता नहीं होती है, 44% है। नतीजतन, कम अम्लता की शर्तों के तहत, कैल्शियम साइट्रेट कार्बोनेट से 11 गुना अधिक कैल्शियम में शरीर में प्रवेश करता है!
और कैल्शियम साइट्रेट पहले से ही एक प्रसिद्ध दवा है जो हमें पैसे के लिए बेची जाती है! और वे ऐसा करते हैं, केवल वे नींबू का रस नहीं, बल्कि साइट्रिक एसिड का उपयोग करते हैं!
वैसे, कैल्शियम कार्बोनेट (हमारे कटा अंडे) एक पंजीकृत खाद्य योज्य है। E170, और कैल्शियम साइट्रेट (नींबू के रस के साथ डाला गया हमारा कटा हुआ अंडे का छिलका) एक पंजीकृत खाद्य योज्य है। E333! और उन्हें कई खाद्य उत्पादों, विशेष रूप से डेयरी उत्पादों, दूध सहित, कैल्शियम के प्रतिशत को बढ़ाने के लिए जोड़ा जाता है !।
तो अधिक भुगतान क्यों करें!
निष्कर्ष, यदि आपके पास उच्च अम्लता है - तो शायद सिर्फ कटा हुआ अंडे के छिलके का उपयोग करना बेहतर है, अगर अम्लता कम है, तो नींबू के रस के साथ अंडे के खोल के पाउडर को बुझाना बेहतर है।
और अधिक,
रात में, शरीर से खनिज लवणों की एक त्वरित रिहाई होती है (हड्डी में resorptive प्रक्रियाओं के सर्कैडियन त्वरण)। इसलिए, दोपहर और शाम के बाद कैल्शियम की तैयारी लेनी चाहिए।यह रात की दूसरी छमाही में कैल्शियम के त्वरित नुकसान को रोक देगा, विशेष रूप से आंत में इसके कम स्तर (या अनुपस्थिति) के साथ। कैल्शियम की फार्माकोथेरेप्यूटिक गतिविधि का नकारात्मक खुराक पर निर्भर प्रभाव भी नोट किया गया है: कम मात्रा में यह बायोमेट्रिक उच्च की तुलना में बेहतर अवशोषित होता है.
इस सिलसिले में दवा लेने के लिए अधिक तर्कसंगत एक दिन में कई बार।
हम पढ़ते हैं, हम चर्चा करते हैं। नीचे इस विषय पर कुछ लेख दिए गए हैं।
__________________________________________________________________________________________________________
कैल्शियम साइट्रेट बनाम कैल्शियम कार्बोनेट
का स्रोत< http://www.ortho.ru/77_KMD/Ca_Sravni.htm >
_________________________________________________________________________________________________________
कैल्शियम साइट्रेट।
कैल्शियम साइट्रेट कैल्शियम को अवशोषित करने का एक उत्कृष्ट स्रोत है, जो शरीर में बहुत महत्वपूर्ण भूमिका निभाता है, क्योंकि यह कई एंजाइमी प्रक्रियाओं और रक्त के थक्के को प्रभावित करता है। कैल्शियम की कमी से हड्डियों में कमजोरी और ऑस्टियोपोरोसिस होता है। छोटे बच्चों के लिए, यह दंत स्वास्थ्य के लिए अच्छा है, रक्तचाप को स्थिर करने के लिए वयस्कों को कैल्शियम की नियमित मात्रा की आवश्यकता होती है।
राष्ट्रीय कैंसर संस्थान (यूएसए) के अनुसार, ई -333 पूरक संभावित रूप से पेट के कैंसर और अन्य कैंसर को रोक सकता है। इसके अलावा, शरीर से भारी धातुओं को हटाने के लिए दवा में कैल्शियम साइट्रेट का उपयोग किया जाता है।
चूँकि कैल्शियम साइट्रेट मानव शरीर में कैल्शियम के सबसे महत्वपूर्ण परिवहन रूपों में से एक है, इसका उपयोग शरीर में कैल्शियम के भंडार को फिर से भरने के लिए कम प्रभावी कैल्शियम कार्बोनेट (E-170 एडिटिव) के साथ दवा में किया जाता है। उसी कारण से, कैल्शियम साइट्रेट का उपयोग आहार पूरक (आहार की खुराक) के रूप में किया जाता है।
खाद्य उद्योग में, ई -333 एडिटिव का उपयोग स्टेबलाइजर, संरक्षक, अम्लता नियामक, रंग निर्धारणकर्ता के रूप में किया जाता है।
स्टेबलाइज़र के रूप में, खाद्य योज्य E-333 का उपयोग गाढ़ा दूध, क्रीम, क्रीम पनीर के निर्माण में किया जाता है। जैम, जेली और डिब्बाबंद फल में, ई -333 additive का उपयोग अम्लता नियामक के रूप में किया जाता है। कैल्शियम साइट्रेट व्यापक रूप से दूध और डेयरी उत्पादों, बेकरी और आटा उत्पादों, और शीतल पेय में कैल्शियम को समृद्ध करने के लिए उपयोग किया जाता है।
उपस्थिति में, कैल्शियम साइट्रेट एक सफेद पाउडर होता है जिसमें एक स्पष्ट खट्टा स्वाद होता है। पानी में घुलनशील। कैल्शियम साइट्रेट का आणविक सूत्र: Ca3 (C6H5O7) 2। कैल्शियम हाइड्रॉक्साइड के साथ साइट्रिक एसिड की पारस्परिक क्रिया द्वारा E-333 प्राप्त करें।
गुण और तकनीकी कार्य:
भोजन की खुराक के संभावित नाम:
- ई-333
- ई-333
- कैल्शियम साइट्रेट
- कैल्शियम साइट्रेट
- मोनोकैल्शियम साइट्रेट
- डायसीलियम साइट्रेट
- ट्रिकल कैल्शियम साइट्रेट
_____________________________________________________________________________________________
कैल्शियम साइट्रेट
बीसवीं सदी के मध्य में। एक प्रकार का "बूम" शुरू हुआ: जैव रसायनविदों, शरीर विज्ञानियों, जैव-भौतिकीविदों, फार्मासिस्टों और चिकित्सकों ने अंगों और शरीर प्रणालियों की गतिविधि को विनियमित करने में कैल्शियम की भूमिका का अध्ययन करने के लिए एक बढ़ती रुचि दिखाना शुरू किया। कैल्शियम आयनों को मांसपेशियों की कोशिकाओं के उत्तेजना और संकुचन, कोशिका झिल्ली पारगम्यता के विनियमन, अंतरकोशिकीय बातचीत, रक्त जमावट, हार्मोन स्राव, मध्यस्थों, एंजाइमों में शामिल पाया गया है; सेल में प्रवेश करने वाले सिग्नल ट्रांसड्यूसर का कार्य करते हैं, ऊर्जा सहित इंट्रासेल्युलर चयापचय के नियमन की प्रक्रियाओं में भाग लेते हैं। कार्डियोमायोसाइट्स और मुक्त कैल्शियम आयनों के जहाजों की झिल्ली की सतह पर कोशिकाओं के साइटोसोल में 1000 गुना अधिक है। बाह्य अंतरिक्ष से वे विशेष कैल्शियम चैनलों के माध्यम से साइटोप्लाज्म में प्रवेश करते हैं, सभी अंगों की कोशिकाओं की विभिन्न शारीरिक प्रक्रियाओं और कार्यों को प्रभावित करते हैं, संवहनी स्वर, सिस्टोल की तीव्रता, डायस्टोल।
कैल्शियम हड्डी के ऊतकों के निर्माण और इसकी सामान्य संरचना और कार्य के संरक्षण में महत्वपूर्ण भूमिका निभाता है। विशेष प्रोटीन के साथ, कैल्शियम आयन हड्डी की कठोरता और लोच प्रदान करते हैं।
यह सब चिकित्सा अभ्यास में अपने लवण के आधार पर कैल्शियम की तैयारी के विकास और परिचय के लिए एक सैद्धांतिक आधार के रूप में कार्य करता है। वर्तमान में, चिकित्सा पद्धति में, इस तरह के कैल्शियम लवण जैसे कि ग्लिसरॉस्फेट, ग्लूकोनेट, कार्बोनेट, लैक्टेट, साइट्रेट, क्लोराइड, फॉस्फेट और कई अन्य का उपयोग किया जाता है।
दवा CALCIUM CITRATE के फार्माकोकाइनेटिक्स की अपनी विशेषताएं हैं। कैल्शियम घुलनशील, आयनित रूप में आंत से अवशोषित होता है। दवा का विघटन पेट के अम्लीय वातावरण में बेहतर होता है। भंग आयनित कैल्शियम सभी ऊतकों में अच्छी तरह से प्रवेश करता है, अपरा बाधा में प्रवेश करता है, स्तन के दूध में गुजरता है। मल में मुख्य रूप से उत्सर्जित, लगभग 20% - मूत्र के साथ। कैल्शियम साइट्रेट की एक महत्वपूर्ण विशेषता गुर्दे की पथरी बनाने की कम क्षमता है, जो इस नमक के दीर्घकालिक उपयोग के साथ महत्वपूर्ण है। यह इस तथ्य के कारण है कि साइट्रेट नमक मूत्र में ऑक्सालेट की मात्रा को कम करता है।
जैवउपलब्धता किस गति और सीमा से निर्धारित होती है सक्रिय संघटक खुराक के रूप से अवशोषित, यह चिकित्सीय कार्रवाई की साइट पर उपलब्ध है।
रात में, शरीर से खनिज लवणों की एक त्वरित रिहाई होती है (हड्डी में resorptive प्रक्रियाओं के सर्कैडियन त्वरण)। इसलिए, दोपहर और शाम के बाद कैल्शियम की तैयारी की जानी चाहिए, जो रात के दूसरे भाग में कैल्शियम के त्वरित नुकसान को रोक देगा, विशेष रूप से आंत में इसके कम स्तर (या अनुपस्थिति) के साथ। कैल्शियम की फार्माकोथेरेप्यूटिक गतिविधि के नकारात्मक खुराक पर निर्भर प्रभाव पर ध्यान दिया जाता है: यह बायोमेटल उच्च खुराक की तुलना में कम मात्रा में बेहतर अवशोषित होता है। इस संबंध में, दवा को दिन में कई बार लेना अधिक तर्कसंगत है। विभिन्न आयु समूहों के लिए कैल्शियम सेवन (तालिका) के विभिन्न शारीरिक मानदंड हैं।
तालिका
विभिन्न उम्र के लोगों में कैल्शियम के सेवन की अनुशंसित दर
(कनाडा सोसाइटी फॉर ओस्टियोपोरोसिस के अनुसार)
विटामिन डी, हाइड्रोक्लोरिक एसिड, लैक्टोज, साइट्रिक एसिड, भोजन में प्रोटीन की उपस्थिति, फास्फोरस, मैग्नीशियम, साथ ही कुछ खाद्य पदार्थ जैसे कि मक्खन, अंडे, दूध, मछली, कॉड वसा, गोभी, आदि कैल्शियम आयनों के अवशोषण में योगदान करते हैं।
कैल्शियम अवशोषण बिगड़ रहा है: भोजन में प्रोटीन की कमी, शाकाहारी भोजन का सख्त पालन, मैग्नीशियम की कमी, फास्फोरस, ऑक्जेलिक एसिड से भरपूर खाद्य पदार्थ (सॉरेल, रबर्ब, पालक)।
पाचन अंगों (गैस्ट्रिटिस, एंटरटाइटिस, कोलाइटिस, पेप्टिक अल्सर), अग्न्याशय (मधुमेह, अग्नाशयशोथ), अन्य अंतःस्रावी अंगों के विकृति के रोगों में कैल्शियम अवशोषण धीमा हो जाता है।
यह जोर दिया जाना चाहिए कि कुछ दवाओं, विशेष रूप से ग्लूकोकार्टिकोआड्स, प्रणालीगत उपयोग के लिए हार्मोनल गर्भनिरोधक दवाएं, लेवोथायरोक्सिन भी कैल्शियम आयनों के अवशोषण को खराब करती हैं।
वैज्ञानिक अनुसंधान (ओस्टियोपोरोसिस के लिए कनाडाई सोसाइटी के डेटा) के परिणामों के अनुसार, इस बात का कोई पुख्ता प्रमाण नहीं है कि ऑस्टियोपोरोसिस की रोकथाम या उपचार के लिए अन्य खनिजों (मैग्नीशियम, जस्ता, तांबा, आदि) के अतिरिक्त सेवन की सिफारिश की जा सकती है।
यूक्रेन और अन्य देशों में किए गए नैदानिक अध्ययनों के परिणामों ने कई बीमारियों के उपचार में इस दवा की उच्च प्रभावशीलता की पुष्टि की है। कैल्शियम साइट्रेट का उपयोग विभिन्न रोगों में रोगनिरोधी उद्देश्यों के लिए भी किया जाता है।
बुजुर्ग लोगों में ऑस्टियोपोरोसिस के साथ, ओस्टोमैलेशिया कैलिक सीट को प्रति दिन 2-6 टैबलेट निर्धारित किया जाता है, दैनिक खुराक को 3-4 खुराक में विभाजित करता है। दवा भोजन से पहले या भोजन के 1-1.5 घंटे बाद 3 महीने तक ली जाती है। ऐसे रोगियों को प्रति दिन 400-800 IU का विटामिन डी 3 भी निर्धारित किया जाना चाहिए, और आहार में तेल, दूध, मछली और अंडे भी शामिल करने चाहिए।
CALCIUM CITRATE न केवल वयस्कों के लिए, बल्कि बच्चों, किशोरों के लिए भी कैल्शियम प्रदान करने के लिए इष्टतम खुराक का रूप है, क्योंकि यह हड्डियों के खनिज घनत्व को बढ़ाने में मदद करता है, हड्डियों के द्रव्यमान को बढ़ाता है, दांतों और दांतों के तामचीनी को मजबूत करता है। 6 महीने से कम उम्र के बच्चों को 1/2 गोलियां (250 मिलीग्राम) (कुचल, दूध की एक छोटी मात्रा में भंग) निर्धारित किया जाता है, 6–12 महीने की उम्र में - 1 साल की उम्र में 2 बार एक दिन में 1/2 गोलियां - 10 साल - 1-2 गोलियां, 10-18 साल पुरानी - प्रति दिन 2-3 गोलियां।
कैल्शियम साइट्रेट की नियुक्ति के लिए संकेत हैं:
विभिन्न उत्पत्ति के रक्तस्राव के कारण हाइपोकैल्सीमिया, साथ ही गर्भावस्था और स्तनपान के दौरान, चोटों के साथ - कैल्शियम आयनों के लिए शरीर की बढ़ती आवश्यकता को भरने के लिए;
पाचन तंत्र के रोगों में कैल्शियम के अवशोषण का उल्लंघन और गुर्दे और आंतों के माध्यम से कैल्शियम उत्सर्जन का एक बढ़ा हुआ स्तर;
हाइपोपैरथायरायडिज्म, विभिन्न जीनों के जीवों की निर्जलीकरण, दवाइयां लेते समय एलर्जी, एलर्जी और एलर्जी संबंधी जटिलताओं, संवहनी दीवार की पारगम्यता में वृद्धि, रक्त के थक्के को कम करना।
ग्लूकोकार्टोइकोड्स, मौखिक गर्भ निरोधकों, लेवोथायरोक्सिन लेते समय CALCIUM CITRATE निर्धारित किया जाना चाहिए। पिछले तीन मामलों में, दवा भोजन के बाद दिन में 6 बार 1 गोली ली जाती है।
कैल्शियम साइट्रेट, एक नियम के रूप में, अच्छी तरह से सहन किया जाता है, कभी-कभी अपच संबंधी लक्षण (कब्ज या दस्त, मतली, उल्टी, भूख न लगना, पेट में दर्द), पॉल्यूरिया हो सकता है।
एल्यूमीनियम युक्त एंटासिड के साथ कैलकोर सीटेट का एक साथ उपयोग उनकी प्रभावशीलता में कमी के कारण अनुशंसित नहीं है। यह कैल्शियम की अन्य तैयारी के साथ एक साथ निर्धारित करने के लिए अवांछनीय है।
निष्कर्ष में, हम CALCIUM CITRATE के सकारात्मक औषधीय गुणों को नोट कर सकते हैं:
साइट्रेट कैल्शियम नमक अच्छी तरह से भंग हो जाता है और पाचन तंत्र में अवशोषित हो जाता है, जिससे शरीर में कैल्शियम का अच्छा अवशोषण होता है और तदनुसार, रोगनिरोधी या इसके प्रभाव में दवा की प्रभावशीलता चिकित्सीय आवेदनइसकी पुष्टि कई नैदानिक अध्ययनों के परिणामों से होती है।
दवा लेने पर गुर्दे में पत्थर के गठन का कम जोखिम लंबे समय तक उपयोग के साथ कैल्शियम सल्फेट के मूल्य को बढ़ाता है।
है चेकमैन, नेशनल मेडिकल यूनिवर्सिटी के क्लिनिकल फार्माकोलॉजी के पाठ्यक्रम के साथ फार्माकोलॉजी विभाग के प्रमुख, नेशनल एकेडमी ऑफ साइंसेज के सदस्य और यूक्रेन के मेडिकल साइंसेज अकादमी के संवाददाता, विज्ञान और प्रौद्योगिकी के सम्मानित कार्यकर्ता, प्रोफेसर।
पेज 1
एसिड के साथ कार्बोनेट की प्रतिक्रिया का उपयोग कार्बोनेट के नमूने के रूप में किया जा सकता है। कार्बोनिक एसिड एक बहुत कमजोर और अस्थिर एसिड है। कम वाष्पशील और मजबूत अम्लों की क्रिया से इसके लवणों को निचोड़ा जा सकता है।
इसी तरह, एसिड के साथ कैल्शियम कार्बोनेट की प्रतिक्रियाएं आगे बढ़ती हैं।
हाइड्रोक्लोरिक एसिड के साथ कार्बोनेट की प्रतिक्रिया कैल्शियम क्लोराइड और मैग्नीशियम क्लोराइड देती है, जो पानी में अच्छी तरह से घुल जाती है और विभिन्न सांद्रता के समाधान के रूप में रहती है। इस प्रकार के कलेक्टरों में प्रतिक्रिया की दर मुख्य रूप से दबाव और तापमान पर निर्भर करती है।
हाइड्रोक्लोरिक एसिड के साथ कार्बोनेट की प्रतिक्रिया के परिणामस्वरूप कैल्शियम क्लोराइड और मैग्नीशियम, पानी में अच्छी तरह से घुलनशील और विभिन्न सांद्रता के समाधान के रूप में शेष है।
प्रतिक्रिया में गैर-सूखे सोडियम कार्बोनेट की शुरूआत एक उच्च दबाव और उत्प्रेरक की मात्रा में वृद्धि की आवश्यकता है।
सूचीबद्ध या देखी गई घटनाओं का स्पष्टीकरण: सल्फ्यूरिक एसिड के साथ कैल्शियम कार्बोनेट की प्रतिक्रिया पहले हिंसक रूप से क्यों शुरू होती है और फिर बंद हो जाती है। क्यों जब गर्म शुष्क अमोनियम कार्बोनेट पदार्थ ट्यूब से गायब हो जाता है।
पोर्टलैंड सीमेंट की स्थिरता पर कैल्शियम कार्बोनेट के लाभकारी प्रभाव को एल्यूमीनियम युक्त क्लिंकर खनिजों के साथ कार्बोनेट की प्रतिक्रिया से समझाया जा सकता है। इस प्रकार, सीमेंट पत्थर का एल्युमिनियम घटक रासायनिक रूप से बाध्य होता है, क्योंकि यह पर्यावरण के सल्फेट्स के संपर्क में आने से पहले होता है।
बेरियम कार्बोनेट के कुछ अनुप्रयोग बेरियम सल्फेट के व्यावहारिक अशुद्धता पर आधारित होते हैं, जो बेरियम कार्बोनेट की प्रतिक्रिया से सल्फेट आयनों वाले पदार्थों से बनता है। इसलिए, जब जलने से पहले एक ईंट को सुखाया जाता है, तो इसकी सतह पर सफेद खिलता दिखाई देता है, जो मिट्टी में निहित जिप्सम या मैग्नीशियम सल्फेट के क्रिस्टलीकरण के कारण होता है। ऐसा होने से रोकने के लिए, मिट्टी में बेरियम कार्बोनेट मिलाया जाता है, जिससे सल्फेट आयन की वर्षा होती है।
ठोस पदार्थों के रसायन विज्ञान के लिए अपने परिचय में, हेडवाल, सैद्धांतिक रूप से संभव प्रतिक्रिया के एक उदाहरण के रूप में, SiO2 के साथ कैल्शियम कार्बोनेट की प्रतिक्रिया के परिणामस्वरूप होता है, जिसके परिणामस्वरूप कैल्शियम सिलिकेट बनता है। उन्होंने इस उदाहरण के साथ कहा कि तथाकथित भूतापीय मेटामोर्फोस के साथ, सामान्य तापमान पर्याप्त नहीं है, क्योंकि कैल्शियम कार्बोनेट और सिलिकिक एसिड के बीच प्रतिक्रिया केवल 500 सी के तापमान पर प्रयोगशाला स्थितियों में देखी जा सकती है।
इस प्रक्रिया में कफ गठन की लागत को कम करने के लिए, क्लिमा और वार्ड ने चूने के साथ समृद्ध अमोनियम कार्बोनेट की प्रतिक्रिया के कारण अमोनियम कार्बोनेट समाधान (अमोनियम नाइट्रेट के बजाय) का उपयोग करने और कफ बनाने का सुझाव दिया।
जैसे ही तापमान बढ़ता है, प्रतिक्रिया अधिक क्षारीय सिलिकेट के गठन की ओर बढ़ जाती है। नाइट्रोजन की एक धारा में 726 से 805 सी के तापमान पर क्वार्ट्ज के साथ सोडियम कार्बोनेट की प्रतिक्रिया पर गिब्सन और वार्ड 11 ने दिखाया कि सोडियम कार्बोनेट की पर्याप्त मात्रा की उपस्थिति में ऑर्थो-सिलिकेट बनता है। प्रतिक्रिया दर समय, नमूने के आकार, गैस प्रवाह दर और प्रतिक्रिया मिश्रण की संरचना पर निर्भर करती है। गिब्सन और वार्ड का तर्क है कि इंटरमीडिएट-ग्रेड सोडियम सिलिकेट्स हैं।
एक्स्ट्रा सोडियम कार्बोनेट को हाइड्रोक्लोरिक एसिड के साथ मिलाया जाता है। विश्लेषण किए गए उत्पाद में सल्फर की मात्रा की प्रतिक्रिया सोडियम कार्बोनेट की मात्रा से होती है।
और कैल्शियम कार्बोनेट और ये रासायनिक यौगिक कैसे बातचीत करते हैं।
कैल्शियम कार्बोनेट
CaCO Ca कैल्शियम कार्बोनेट जालीCCO Ca दुनिया भर में एक बहुत ही सामान्य यौगिक है; इसमें निम्न शामिल हैं: चाक, चूना पत्थर, संगमरमर, आदि। इसलिए, यह ध्यान देने योग्य है कि मनुष्यों के लिए इस पदार्थ की भूमिका बहुत महत्वपूर्ण है, क्योंकि कैल्शियम कार्बोनेट व्यापक रूप से खाद्य उद्योग में, एक प्राकृतिक सफेद डाई के रूप में उपयोग किया जाता है। CaCO Ca का उपयोग कागज, प्लास्टिक के निर्माण में, निर्माण में और कई अन्य क्षेत्रों में भी किया जाता है।
कैल्शियम कार्बोनेट पाउडर या ठोस रूप में एक सफेद पदार्थ (ठोस क्रिस्टल) है। वह पानी के साथ प्रतिक्रिया करने में सक्षम है, लेकिन इसमें पूरी तरह से भंग नहीं हुआ है। इसलिए, पानी अशांत हो जाता है, और इसमें एक सफेद अवक्षेप होता है। लेकिन अगर पानी की प्रतिक्रिया उपस्थिति में होगी, तो हमें एक घुलनशील एसिड नमक, कैल्शियम बाइकार्बोनेट मिलेगा:
CaCO Ca + CO₃ + H₂O → Ca (HCO₂)
विचार करें कि कैल्शियम कार्बोनेट कैसे बनाया जाता है।
कैल्शियम कार्बोनेट का अधिकांश प्राकृतिक स्रोतों से प्राप्त होता है। तो, एक नियम के रूप में, कैल्शियम कार्बोनेट प्राप्त करने के लिए, एक स्वच्छ स्रोत, अक्सर संगमरमर का उपयोग करें।
 माइकल एंजेलो बुओनारोती द्वारा डेविड की संगमरमर की मूर्ति
माइकल एंजेलो बुओनारोती द्वारा डेविड की संगमरमर की मूर्ति
लेकिन प्रयोगशाला स्थितियों में, कैल्शियम ऑक्साइड को शांत करके कैल्शियम कार्बोनेट प्राप्त किया जा सकता है। कैल्सीनेशन जलने की सामान्यीकृत धारणा को संदर्भित करता है, जिसके परिणामस्वरूप रसायन नए गुण प्राप्त करते हैं। फायरिंग पर्याप्त तापमान पर की जाती है, पिघलने तक नहीं पहुंचती है।
परिणामस्वरूप कैल्शियम ऑक्साइड के साथ पानी मिलाया जाता है, प्रतिक्रिया हाइड्रॉक्साइड पैदा करती है। फिर तकनीशियनों को कार्बन डाइऑक्साइड मिलता है, जो पहले प्राप्त समाधान से गुजरता है। गठित अवक्षेप कैल्शियम कार्बोनेट है:
सीएओ + एचओओ = सीए (ओएच);
Ca (OH) + CO₂ = CaCO₃ + H .O
यदि हम कार्बोनिक एसिड और कैल्शियम के नमक को एक उच्च तापमान (900 - 1000 डिग्री सेल्सियस) तक गर्म करते हैं, तो रासायनिक प्रक्रिया के परिणामस्वरूप हमें कार्बन डाइऑक्साइड (कार्बन डाइऑक्साइड), साथ ही कैल्शियम ऑक्साइड सीएओ - निर्माण में उपयोग किया जाने वाला क्विकर:
CaCO Ca = CaO + CO₂
यदि तापमान और भी अधिक (1500 ° C) है, तो प्रतिक्रिया उत्पादों में कैल्शियम कार्बाइड और कार्बन मोनोऑक्साइड होगा।
हाइड्रोक्लोरिक एसिड
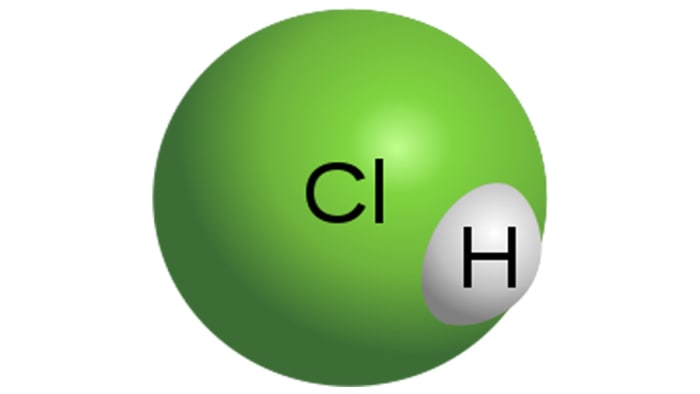 हाइड्रोक्लोरिक एसिड अणु
हाइड्रोक्लोरिक एसिड अणु
एचसीएल एक मजबूत मोनोबैसिक एसिड है, जो पानी में हाइड्रोजन क्लोराइड को भंग करके प्राप्त किया जाता है। यह एक बेरंग तरल है, हालांकि तकनीकी एसिड में पीले रंग का टिंट हो सकता है, उदाहरण के लिए, लोहे की अशुद्धता के कारण। एचसीएल के गुण सीधे समाधान में हाइड्रोजन क्लोराइड की एकाग्रता पर निर्भर करेंगे।
हाइड्रोक्लोरिक एसिड के लवण को क्लोराइड कहा जाता है। यह पदार्थ बहुत कास्टिक है, इसलिए, सावधानी से निपटने की आवश्यकता होती है: यहां तक कि अगर त्वचा पर एक छोटी सी बूंद गिरती है, तो एक मजबूत रासायनिक जला से बचा नहीं जा सकता है। इसलिए, जब मजबूत एसिड के साथ काम करते हैं, तो हमेशा अपने साथ तटस्थ रखने की सलाह दी जाती है: कमजोर क्षारीय समाधान, (बेकिंग सोडा, आदि)। यह याद रखने योग्य है कि जब एक केंद्रित एसिड एचसीएल वाष्प के साथ एक कंटेनर खोलते हैं, जो आंखों और श्वसन प्रणाली को प्रतिकूल रूप से प्रभावित करते हैं। इसलिए, रासायनिक प्रयोगों में, एक श्वासयंत्र और चश्मे का उपयोग करना सबसे अच्छा होगा।
हाइड्रोक्लोरिक एसिड प्राप्त करना
हाइड्रोजन क्लोराइड गैस पानी में घुल जाती है। हाइड्रोजन क्लोराइड स्वयं इस प्रकार प्राप्त किया जाता है: हाइड्रोजन को क्लोरीन में जलाया जाता है, जिससे एक सिंथेटिक एसिड प्राप्त होता है। वैकल्पिक रूप से, हाइड्रोक्लोरिक एसिड को साइड गैसों का उपयोग करके प्राप्त किया जा सकता है, जो कई रासायनिक प्रयोगों में प्राप्त होते हैं, उदाहरण के लिए, जब क्लोरीनयुक्त हाइड्रोकार्बन क्लोरीनयुक्त होते हैं। इस तरह से प्राप्त एसिड को एब्सिक कहा जाता है।
दवा, उद्योग में हाइड्रोक्लोरिक एसिड लागू करें, और रासायनिक प्रतिक्रियाओं के लिए भी।
हाइड्रोजन क्लोराइड की तीखी गंध के साथ रंगहीन एसिड धातुओं के साथ अच्छी तरह से प्रतिक्रिया करता है। रिडॉक्स प्रतिक्रिया होती है। प्रतिक्रिया प्रक्रिया में कम करने वाले तत्व धातु के परमाणु हैं, और ऑक्सीकरण एजेंट हाइड्रोजन केेशन हैं।
धातुओं के साथ मुख्य रूप से रासायनिक प्रतिक्रियाएं हाइड्रोजन की रिहाई के साथ होती हैं। बातचीत की तीव्रता धातु की गतिविधि पर निर्भर करती है, उदाहरण के लिए, क्षार धातु लिथियम हिंसक रूप से प्रतिक्रिया करता है, जबकि इस तत्व के मजबूत ऑक्साइड फिल्म के कारण एल्यूमीनियम के साथ प्रतिक्रिया कमजोर होती है।
हाइड्रोक्लोरिक एसिड और जस्ता:
2HCl + Zn = ZnCl₂ + Hn
हाइड्रोक्लोरिक एसिड और लोहा:
2HCl + Fe = FeCl₂ + HCl
हाइड्रोक्लोरिक एसिड और मैग्नीशियम:
2HCl + Mg = MgCl₂ + Hg
 मैग्नीशियम क्लोराइड, बर्फ से सड़कों को साफ करने के लिए उपयोग किया जाता है
मैग्नीशियम क्लोराइड, बर्फ से सड़कों को साफ करने के लिए उपयोग किया जाता है
धातु आक्साइड के साथ, एसिड नमक और पानी बनाता है:
CuO + 2HCl = CuCl₂ + H .O
हाइड्रोक्लोरिक एसिड और कैल्शियम कार्बोनेट की प्रतिक्रिया
प्रयोग के लिए की आवश्यकता होगी:
टेस्ट ट्यूब;
रासायनिक पिपेट;
ठोस कैल्शियम कार्बोनेट (संगमरमर);
हाइड्रोक्लोरिक एसिड;
दस्ताने;
श्वासयंत्र।
चेतावनी! इस अनुभव को खुद करने की कोशिश मत करो!
एक अच्छी तरह हवादार क्षेत्र में प्रयोग का संचालन करें, हाइड्रोक्लोरिक एसिड के साथ काम करते समय सावधानी बरतें।
बर्तन में संगमरमर के कुछ टुकड़े जोड़ें और कुछ हाइड्रोक्लोरिक एसिड को विंदुक करें। नतीजतन, बुलबुले के गठन के साथ एक त्वरित प्रतिक्रिया होगी - कार्बन डाइऑक्साइड जारी किया जाता है। यह एक विनिमय प्रतिक्रिया है, जिसके उत्पाद हैं: एक कमजोर और अस्थिर यौगिक, कार्बोनिक एसिड, जो कार्बन डाइऑक्साइड और पानी में विघटित होता है। हाइड्रोक्लोरिक एसिड में कैल्शियम कार्बोनेट के विघटन की प्रतिक्रिया का समीकरण:
CaCO Ca + 2HCl (पतला।) → CaCl₂ + CO₂ + H .O
- मैग्नीशियम तत्व की विशेषता: इलेक्ट्रॉनिक संरचना, संभव ऑक्सीकरण राज्य, बुनियादी यौगिक: ऑक्साइड, हाइड्रॉक्साइड, लवण। निर्माण में इसकी क्या भूमिका है और क्या है?
MgCO 3 = MgO + CO 2
आवेदन।
उद्योग में इसका उपयोग रबड़ के उत्पादन में भराव के रूप में अपवर्तक, सीमेंट और पेट्रोलियम उत्पादों के शुद्धिकरण के लिए किया जाता है। अल्ट्रा-लाइट मैग्नीशियम ऑक्साइड का उपयोग सतहों की सफाई के लिए एक बहुत ही बढ़िया अपघर्षक के रूप में किया जाता है, विशेष रूप से, इलेक्ट्रॉनिक्स उद्योग में।
दवा में, इसका उपयोग गैस्ट्रिक रस की बढ़ती अम्लता के मामले में किया जाता है, क्योंकि यह हाइड्रोक्लोरिक एसिड की अत्यधिक सामग्री के कारण होता है। जले हुए मैग्नेशिया भी लिया जाता है जब एसिड पेट में गलती से निकल जाता है।
खाद्य उद्योग में यह खाद्य योज्य E530 के रूप में पंजीकृत है।
यह एक पूर्ण परावर्तक है - एक पदार्थ जिसमें एक व्यापक वर्णक्रमीय बैंड में एक के बराबर गुणांक होता है। उपलब्ध सफेद मानक के रूप में इस्तेमाल किया जा सकता है।
मैग्नीशियम हाइड्रॉक्साइड - मुख्य धातु हाइड्रॉक्साइड मैग्नीशियम है। कमजोर अघुलनशील आधार।
मानक परिस्थितियों में, मैग्नीशियम हाइड्रॉक्साइड एक बेरंग हेक्सागोनल जाली है। 350 डिग्री सेल्सियस से ऊपर के तापमान पर मैग्नीशियम ऑक्साइड और पानी में विघटित हो जाता है। मुख्य मैग्नीशियम कार्बोनेट बनाने के लिए कार्बन डाइऑक्साइड और हवा से पानी को अवशोषित करता है। मैग्नीशियम हाइड्रॉक्साइड पानी में व्यावहारिक रूप से अघुलनशील है, लेकिन अमोनियम लवण में घुलनशील है। यह एक कमजोर आधार है। यह खनिज ब्रूसाइट के रूप में प्रकृति में होता है।
हो रही है।
क्षार के साथ घुलनशील मैग्नीशियम लवण की सहभागिता:
सामान्य तौर पर:
Mg 2+ + 2OH - = Mg (OH) 2 2
उदाहरण:
MgCl 2 + 2NaOH = Mg (OH) 2 2 + 2NaCl
Mg (NO 3) 2 + 2KOH = Mg (OH) 2 2K + 2KNO 3
जले हुए डोलोमाइट के साथ मैग्नीशियम क्लोराइड के समाधान की बातचीत:
MgCl 2 + काओ × MgO + 2H 2 O = 2 Mg (OH) 2 ¯ + CaCl 2
जल वाष्प के साथ धातु मैग्नीशियम की सहभागिता:
Mg + 2H 2 O = Mg (OH) 2 H + H 2 -
रासायनिक गुण
सभी कमजोर ठिकानों की तरह, मैग्नीशियम हाइड्रॉक्साइड थर्मल रूप से अस्थिर है। 350 ° C पर गर्म होने पर विघटित होता है:
नमक और पानी बनाने के लिए एसिड के साथ इंटरेक्शन (तटस्थकरण प्रतिक्रिया):
Mg (OH) 2 + 2HCl = MgCl 2 + 2H 2 O
Mg (OH) 2 + H 2 SO 4 = MgSO 4 + 2H 2 O
नमक और पानी बनाने के लिए अम्लीय ऑक्साइड के साथ सहभागिता:
Mg (OH) 2 + SO 3 = MgSO 4 + H 2 O
हाइड्रॉक्साइमेग्नेट्स के गठन के साथ क्षार के गर्म केंद्रित समाधान के साथ सहभागिता:
Mg (OH) 2 + 2NaOH = Na 2
Mg (OH) 2 + Sr (OH) 2 = Sr
आवेदन।
मैग्नीशियम हाइड्रॉक्साइड का उपयोग सल्फर डाइऑक्साइड को बाँधने के लिए किया जाता है, अपशिष्ट जल उपचार के लिए एक flocculant के रूप में, थर्मोप्लास्टिक पॉलिमर (पॉलीओफ़िंस, पीवीसी) में एक ज्वाला मंदक के रूप में, डिटर्जेंट में, मैग्नीशियम ऑक्साइड, चीनी शोधन, टूथपेस्ट के घटक के रूप में।
दवा में, इसका उपयोग पेट में एसिड को बेअसर करने के लिए दवा के रूप में किया जाता है, साथ ही साथ एक बहुत मजबूत रेचक भी।
यूरोपीय संघ में, मैग्नीशियम हाइड्रॉक्साइड एक खाद्य योजक E528 के रूप में पंजीकृत है।
मैग्नीशियम लवण।
अधिकांश मैग्नीशियम लवण पानी में अत्यधिक घुलनशील होते हैं। आयन एमजी 2+ समाधानों को एक कड़वा स्वाद देता है। मैग्नीशियम हैलिड्स, MgF2 के अपवाद के साथ, अत्यधिक हीड्रोस्कोपिक हैं - वे हवा में खून बहाते हैं।
मैग्नीशियम क्लोराइड MgCl 2 (मैग्नीशियम क्लोराइड) 718 ° पर निर्जल पिघलाता है। पानी के निशान की उपस्थिति में यह हवा में "धूम्रपान करता है" - यह एचसीएल और एमजीओ में विघटित होता है। रंगहीन क्रिस्टलीय हाइड्रेट 1, 2, 4, 6, 8 और 12 पानी के अणुओं के साथ जलीय घोल से निकलता है। तापमान रेंज में -3.4 से 116.7 ° तक, MgCl 2 × 6H 2 0 क्रिस्टलीय हाइड्रेट स्थिर होता है, जो स्वाभाविक रूप से बिस्कॉफाइट खनिज के रूप में होता है, और बड़ी मात्रा में समुद्री लताओं के वाष्पीकरण द्वारा प्राप्त होता है। मैग्नीशियम क्लोराइड डबल लवण बनाता है, जिनमें से खनिज कार्नेलाइट KCl × MgCl 2 × 6H 2 O - मैग्नीशियम और पोटेशियम क्लोराइड का स्रोत - अत्यंत महत्वपूर्ण है।
आवेदन।
1. मैग्नीशियम क्लोराइड का उपयोग मुख्य रूप से धातु मैग्नीशियम के उत्पादन में किया जाता है, MgCl 2 × 6H 2 0 का उपयोग मैग्नेशिया सीमेंट्स को प्राप्त करने के लिए किया जाता है।
2. एक योज्य के रूप में बर्फ और बर्फ के आवरण को संसाधित करने के लिए उपयोग किया जाता है। बर्फ के साथ प्रतिक्रिया के परिणामस्वरूप, यह पिघलने का कारण बनता है। इसमें 3 खतरा वर्ग (मध्यम खतरनाक पदार्थ) और आक्रामक संक्षारक गुण हैं।
मैग्नीशियम बाइकार्बोनेट - मैग्नीशियम और कार्बोनिक एसिड के अम्लीय नमक एमजी (एचसीओ 3) 2 के साथ केवल जलीय घोल में मौजूद होते हैं।
हो रही है।
मैग्नीशियम कार्बोनेट के निलंबन के माध्यम से कार्बन डाइऑक्साइड का संचरण:
MgCO 3 + CO 2 + H 2 O = Mg (HCO 3) 2
भौतिक गुण।
मैग्नीशियम बाइकार्बोनेट केवल जलीय घोल में मौजूद होता है।
पानी में मैग्नीशियम बाइकार्बोनेट की उपस्थिति इसकी अस्थायी कठोरता का कारण बनती है।
रासायनिक गुण
जब समाधान पर ध्यान केंद्रित करते हैं, तो मैग्नीशियम बाइकार्बोनेट विघटित हो जाता है:
Mg (HCO 3) 2 = MgCO 3 + CO 2 - + H 2 O
मैग्नीशियम हाइड्रोफॉस्फेट (विघटित मैग्नीशियम फॉस्फेट) - मैग्नीशियम और फॉस्फोरिक एसिड का एक अम्लीय नमक सूत्र MgHPO 4 के साथ, पानी में थोड़ा घुलनशील, क्रिस्टलीय हाइड्रेट बनाता है।
हो रही है।
मैग्नीशियम ऑक्साइड या मैग्नीशियम कार्बोनेट पर ऑर्थोफोस्फोरिक एसिड का प्रभाव:
MgO + H 3 PO 4 = MgHPO 4 + H 2 O
MgCO 3 + H 3 PO 4 = MgHPO 4 + CO 2 - + H 2 O
मैग्नीशियम क्लोराइड पर सोडियम ऑर्थोफॉस्फेट के अपघटन की क्रिया:
MgCl 2 + 2Na 2 HPO 4 = MgHPO 4 + 2NaCl
डायहाइड्रोजेन फॉस्फेट मैग्नीशियम का अपघटन:
Mg (H 2 PO 4) 2 = MgHPO 4 + H 3 PO 4
भौतिक गुण.
मैग्नीशियम हाइड्रोजन फॉस्फेट सफेद क्रिस्टल बनाता है, जो क्रिस्टलीय हाइड्रेट्स होते हैं: 225 ° C तक के तापमान पर, MHHPO4 मोनोहाइड्रेट बनता है। H 2 O, 36 ° С के तापमान पर 2.32 g / cm O का घनत्व, MgHPO4 ट्राइहाइड्रेट बनता है। 3 एच 2 ओ, घनत्व 2.10 ग्राम / सेमी 2, के साथ कमरे का तापमान MgHPO4 हेप्टाहाइड्रेट बनता है। 7 एच 2 ओ।
रासायनिक गुण.
जब गर्म पायरोफॉस्फेट में चला जाता है:
आवेदन।
खाद्य पूरक E343 में प्रयुक्त।
मैग्नीशियम डाइहाइड्रोजेन फॉस्फेट - मैग्नीशियम और ऑर्थोफोस्फोरिक एसिड की धातु का अम्लीय नमक सूत्र एमजी (एच 2 पीओ 4) 2, रंगहीन हीड्रोस्कोपिक क्रिस्टल के साथ, पानी में घुलनशील, क्रिस्टलीय हाइड्रेट बनाता है।
हो रही है।
ऑर्थोफोस्फोरिक एसिड में हाइड्रोक्साइड या मैग्नीशियम ऑक्साइड का विघटन:
भौतिक गुण.
मैग्नीशियम डाइहाइड्रोजेन फॉस्फेट रंगहीन क्रिस्टल बनाता है।
Mg (H 2 PO 4) 2 का क्रिस्टलीय हाइड्रेट रचना। nH 2 O, जहाँ n = 2, 4, 6।
मैग्नीशियम कार्बाइड - सूत्र Mg। 2 के साथ मैग्नीशियम और कार्बन के द्विआधारी अकार्बनिक यौगिक। फॉर्मूला Mg 2 C के साथ मैग्नीशियम कार्बाइड भी जाना जाता है।
हो रही है।
सिंटरिंग मैग्नीशियम फ्लोराइड और कैल्शियम कार्बाइड:
मैग्नीशियम पाउडर के ऊपर बहने वाली एसिटिलीन:
650 डिग्री सेल्सियस पर मैग्नीशियम पाउडर के साथ पेंटेन को बहाल करके, अधिक जटिल कार्बाइड एमजी 2 सी 3 प्राप्त किया जा सकता है।
रासायनिक गुण.
जब मध्यवर्ती कार्बाइड Mg2C3 के गठन के साथ गर्म विघटित होता है:
पानी के साथ बातचीत:
मैग्नीशियम कार्बोनेट, मैग्नीशियम कार्बोनेट, MgCO 3 - कार्बोनिक एसिड का मैग्नीशियम नमक।
गुण।
सफेद क्रिस्टल, घनत्व 3,037 ग्राम / सेमी 3,। 500 डिग्री सेल्सियस पर यह ध्यान देने योग्य है, और 650 डिग्री सेल्सियस पर यह पूरी तरह से एमजीओ और सीओ 2 में विघटित है। पानी में मैग्नीशियम कार्बोनेट की घुलनशीलता नगण्य है (25 डिग्री सेल्सियस पर 22 मिलीग्राम / एल) और बढ़ते तापमान पर घट जाती है। जब CO 2 को MgCO 3 के जलीय निलंबन के साथ संतृप्त किया जाता है, तो Mg (HCO 3) 2 बाइकार्बोनेट के गठन के कारण उत्तरार्द्ध घुल जाता है। CO2 की अधिकता के अभाव में जलीय घोलों से, बुनियादी मैग्नीशियम कार्बोनेट उत्सर्जित होते हैं। कई धातुओं के कार्बोनेट के साथ, मैग्नीशियम कार्बोनेट डबल लवण बनाता है, जिसमें प्राकृतिक खनिज डोलोमाइट MgCO 3 · CaCO 3 शामिल हैं।
प्रकृति में व्यापकता.
मैग्नीशियम कार्बोनेट व्यापक रूप से खनिज मैग्नेसाइट के रूप में प्रकृति में वितरित किया जाता है।
आवेदन।
मूल मैग्नीशियम कार्बोनेट 3MgCO 3 · Mg (OH) 2 · 3H 2 O (तथाकथित सफेद मैग्नेशिया) का उपयोग थर्मल इन्सुलेशन सामग्री के निर्माण के लिए रबर के यौगिकों में भराव के रूप में किया जाता है।
ग्लास, सीमेंट, ईंटों के उत्पादन में मैग्नीशियम कार्बोनेट आवश्यक है।
मैग्नीशियम नाइट्रेट Mg (NO 3) 2 - एक क्यूबिक जाली के साथ रंगहीन हीड्रोस्कोपिक क्रिस्टल; गलनांक 426 ° C (अपघटन के साथ)। पानी में घुलनशीलता (जी प्रति 100 ग्राम): 73.3 (20 डिग्री सेल्सियस), 81.2 (40 डिग्री सेल्सियस), 91.9 (60 डिग्री सेल्सियस)। इथेनॉल, मेथनॉल, तरल NH3 में भी घुलनशील। एकाग्रता के आधार पर, गैर-, हेक्सा- और डायहाइड्रेट्स जलीय समाधानों से क्रिस्टलीकृत होते हैं।
जटिल उर्वरकों के घटक, चूंकि मैग्नीशियम क्लोरोफिल का हिस्सा है, जो प्रकाश संश्लेषण के लिए आवश्यक है, कई एंजाइमों की गतिविधि को बढ़ाता है और फास्फोरस ट्रांसपोर्टर के रूप में कार्य करता है। उच्च विलेयता और कम विद्युत चालकता उत्पाद को विशेष रूप से उच्च नमक सांद्रता के साथ सिंचाई के पानी का उपयोग करते हुए विशेष रूप से पर्ण खिलाने और प्रजनन के लिए उपयुक्त बनाते हैं। उर्वरक का उपयोग सब्जियों, जामुन, फलों की फसलों, अंगूर की जड़ और पत्ते के पोषण के लिए किया जाता है; पाइरोटेक्निक रचनाओं में ऑक्सीकारक।
अथ जलकर कोयला हो जाना- कार्बन डाइऑक्साइड के साथ किसी भी समाधान की संतृप्ति। निर्माण में उपयोग किया जाता है।
खनिज कार्बोनेशन - सिलिकेट्स में सिलिकिक एसिड को कार्बोनेट बनाने के लिए कार्बोनिक एसिड द्वारा प्रतिस्थापित किया जाता है। कार्बोनेट्स की, अवसादी चट्टानों में चट्टान बनाने वाला खनिज कैल्साइट (लाइम स्पर) CaCO3 है। मैग्नेसाइट - MgCO3 और डोलोमाइट - CaMg (CO3) 2 कम आम हैं। साफ पानी, कार्बोनिक एसिड युक्त नहीं, केल्साइट को थोड़ी मात्रा में (0.03 ग्राम प्रति लीटर पानी) में भंग किया जाता है; मैग्नेसाइट व्यावहारिक रूप से अघुलनशील है। यदि पानी में कार्बन डाइऑक्साइड होता है, तो कैल्सिट अम्लीय कैल्शियम कार्बोनेट के गठन के साथ आसानी से घुल जाता है, पानी में घुलनशील - सीए (एचसीओ 3) 2।
कार्बोनाइजेशन एक ऐसा परिवर्तन है जो C0 2 वायु के संपर्क में आने पर पोर्टलैंड सीमेंट पर कंक्रीट में होता है। नमी की उपस्थिति में कैल्शियम हाइड्रॉक्साइड Ca (OH) 2 विशेष रूप से प्रभावित होता है। जब यह कार्बन डाइऑक्साइड को अवशोषित करता है तो कैल्शियम हाइड्रॉक्साइड कैल्शियम कार्बोनेट में बदल जाता है। कैल्शियम कार्बोनेट पानी में खराब रूप से घुलनशील है और परिणामस्वरूप, कंक्रीट की सतह पर छिद्रों को बंद करने का अर्थ है (जिसका अर्थ है घने, जलरोधक कंक्रीट)।
आमतौर पर, कंक्रीट में छिद्रित पानी का पीएच 10.5 से 11.5 तक होता है। यदि कार्बनीकरण के कारण यह घटकर 9 और उससे कम हो जाता है, तो सुदृढीकरण का क्षरण संभव है। इसलिए, कार्बोनेटेड परत की मोटाई सुदृढीकरण की रक्षा करने में एक महत्वपूर्ण कारक है: जितना गहरा कार्बनकरण, स्टील के जंग का खतरा उतना ही अधिक होगा। कार्बोनाइजेशन की गहराई को फिनोलफथेलिन के साथ कंक्रीट का इलाज करके निर्धारित किया जा सकता है। फिनोलफथेलिन की कार्रवाई के तहत क्षारीय गुणों की उपस्थिति को गुलाबी रंग की उपस्थिति से संकेत मिलता है, जबकि कार्बोनेटेड कंक्रीट अपने मूल रंग को बरकरार रखता है।
उच्च गुणवत्ता वाले घने कंक्रीट में बहुत धीरे-धीरे कार्बनीकरण हो जाता है। यह संभावना नहीं है कि 50 साल तक ऑपरेशन के बाद भी 5-10 मिमी से अधिक की गहराई पर कार्बोनाइजेशन मनाया जाएगा। दूसरी ओर, कम-शक्ति पारगम्य कंक्रीट का कार्बोनाइजेशन गहराई 10 साल से कम समय में 25 मिमी तक पहुंच सकता है। अनुभव से पता चलता है कि कम-गुणवत्ता वाले ठोस उत्पाद विशेष रूप से कार्बनीकरण के लिए अतिसंवेदनशील होते हैं।
- कैल्शियम तत्व की विशेषता: इलेक्ट्रॉनिक संरचना, संभव ऑक्सीकरण राज्य, मुख्य यौगिक: ऑक्साइड, हाइड्रॉक्साइड, लवण।
कैल्शियम - दूसरे समूह के मुख्य उपसमूह का एक तत्व, रासायनिक तत्वों डीआई मेंडेलीव की आवर्त सारणी की चौथी अवधि, परमाणु संख्या 20 के साथ। यह प्रतीक कै (लाट। कैल्शियम) द्वारा दर्शाया गया है। इलेक्ट्रॉनिक संरचना 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 = [18 Ar] 4s 2, ऑक्सीकरण अवस्था +2, 0. क्षारीय पृथ्वी धातुओं का संदर्भ देती है।
सरल पदार्थ कैल्शियम चांदी-सफेद रंग का एक नरम, रासायनिक रूप से सक्रिय क्षारीय पृथ्वी धातु है। औद्योगिक उत्पादन: पिघला हुआ कैल्शियम क्लोराइड का इलेक्ट्रोलिसिस।
कैल्शियम ऑक्साइड CaO - मूल ऑक्साइड, क्विकटाइम। सफेद, हीड्रोस्कोपिक। आग्नेय के दौरान आग रोक, थर्मल अस्थिर, अस्थिर। पानी के साथ सख्ती से प्रतिक्रिया करता है (एक उच्च एक्सो-प्रभाव के साथ), एक जोरदार क्षारीय समाधान बनाता है, इस प्रक्रिया को लेज़र स्लेजिंग कहा जाता है। एसिड, धातु ऑक्साइड, गैर-धातुओं के साथ प्रतिक्रिया करता है। इसका उपयोग निर्माण में बाध्यकारी सामग्री के एक घटक, अन्य कैल्शियम यौगिकों को संश्लेषित करने के लिए किया जाता है।
उद्योग में उत्पादन - चूना पत्थर की गोलीबारी (900 - 1200 o C)
कैल्शियम हाइड्रॉक्साइड Ca (OH) 2 - हाइड्रेटेड चूना, मूल हाइड्रॉक्साइड। मध्यम हीटिंग के साथ विघटित। सफेद, हीड्रोस्कोपिक। हवा से नमी और कार्बन डाइऑक्साइड को अवशोषित करता है। ठंड में थोड़ा घुलनशील। पानी, और भी कम - उबलते पानी में। हाइड्रॉक्साइड (निलंबन को दूध का चूना कहा जाता है) की वर्षा के कारण एक स्पष्ट समाधान (चूने का पानी) जल्दी से बादल बन जाता है। गुणात्मक प्रतिक्रिया CaCO3 तलछट की उपस्थिति और समाधान में इसके संक्रमण के साथ चूने के पानी के माध्यम से कार्बन डाइऑक्साइड का संचरण है। एसिड और एसिड ऑक्साइड के साथ प्रतिक्रियाएं, आयन विनिमय प्रतिक्रियाओं में प्रवेश करती हैं।
इसका उपयोग चूने के मोर्टार (रेत + स्लेड चूने + पानी) की तैयारी के लिए किया जाता है, जो पत्थर और ईंटवर्क, परिष्करण (पलस्तर) की दीवारों और अन्य निर्माण उद्देश्यों के लिए एक संबंध सामग्री के रूप में काम करता है। ऐसे समाधानों का जमना हवा से CO2 के अवशोषण के कारण होता है।
Ca (OH) 2 + CO 2 → CaCO 3 H + H 2 O
सीए (ओएच) 2 + एच २ एसओ ४ → सीएएसओ ४ + २ एच २ ओ,
लवण के साथ अभिक्रियाएँ यदि एक अवक्षेप बनाती हैं:
Ca (OH) 2 + Na 2 SO 3 → CaSO 3 2 + 2NaOH
कैल्शियम लवण।
कैल्शियम सल्फेट (CaSO 4) - अकार्बनिक यौगिक, सल्फ्यूरिक एसिड का कैल्शियम नमक।
प्रकृति में CaSO 4 डाइहाइड्रेट के रूप में पाया जाता है? 2H 2 हे (जिप्सम, सेलेनाइट) और निर्जल अवस्था में - एनहाइड्राइट।
कैल्शियम क्लोराइड, CaCl2 - हाइड्रोक्लोरिक एसिड का कैल्शियम नमक।
उच्च हीड्रोस्कोपिक गुणों को रोकता है। घुलनशीलता (प्रति 100 ग्राम H2O): 74 (20 ° C) और 159 (100 ° C)। कम तापमान पर कैल्शियम क्लोराइड जलीय घोल (20% -18.57 ° C, 30% –48 ° C) पर जम जाता है।
CaCl2 · 6H2O का हाइड्रेट, 29.8 ° C तक स्थिर; उच्च तापमान पर, 4, 2 और 1 H2O अणुओं के साथ क्रिस्टलीय हाइड्रेट्स संतृप्त घोल से बाहर हो जाते हैं। जब CaCl2 * 6H2O (58.8%) को बर्फ या बर्फ (41.2%) के साथ मिलाया जाता है, तो तापमान -55 डिग्री सेल्सियस (क्रायोहाइड्रेट पॉइंट) तक गिर जाता है।
सोडा के उत्पादन में कैल्शियम क्लोराइड को उप-उत्पाद के रूप में प्राप्त किया जाता है।
रासायनिक प्रयोगशाला में, कैल्शियम क्लोराइड का उपयोग सुखाने की नलियों के लिए भराव के रूप में किया जाता है, जिसे कैल्शियम क्लोराइड भी कहा जाता है, जिसका उद्देश्य वायुमंडलीय जल वाष्प से बर्तन में पदार्थों को अलग करना और गैसों को सुखाने के लिए किया जाता है।
सीमेंट की स्थापना के लिए कैल्शियम क्लोराइड का उपयोग त्वरक के रूप में भी किया जाता है;
कैल्शियम कार्बोनेट (कैल्शियम कार्बोनेट) - अकार्बनिक रासायनिक यौगिक, कार्बोनिक एसिड और कैल्शियम का नमक। रासायनिक सूत्र —काओ ३। प्रकृति में, यह खनिजों के रूप में पाया जाता है - केल्साइट, अर्गोनाइट और वेटराइट, चूना पत्थर का मुख्य घटक है, संगमरमर, चाक, अंडे के खोल का हिस्सा है। पानी और इथेनॉल में अघुलनशील।
पोटीन, विभिन्न सीलेंट - इन सभी में कैल्शियम कार्बोनेट महत्वपूर्ण मात्रा में होते हैं। इसके अलावा, कैल्शियम कार्बोनेट घरेलू रसायनों के उत्पादन में एक आवश्यक घटक है।
कैल्शियम कार्बोनेट का व्यापक रूप से सफाई प्रणालियों में उपयोग किया जाता है, पर्यावरण प्रदूषण का मुकाबला करने के साधन के रूप में, और कैल्शियम कार्बोनेट की मदद से, मिट्टी के एसिड-बेस संतुलन को बहाल किया जाता है।
- निर्माण में कैल्शियम और मैग्नीशियम के ऑक्साइड और हाइड्रॉक्साइड के उपयोग को दर्शाता उदाहरण।
कैल्शियम ऑक्साइड और हाइड्रॉक्साइड:
जब कमरे में सफेदी।
जब लकड़ी की बाड़ को सफेद करना और राफ्टर्स को गलाना - सड़ने और आग से बचाने के लिए।
चूना मोर्टार की तैयारी के लिए। चूने का उपयोग प्राचीन काल से चिनाई के निर्माण के लिए किया जाता रहा है। मिश्रण आमतौर पर इस अनुपात में तैयार किया जाता है: कैल्शियम हाइड्रॉक्साइड (हाइड्रेटेड चूना) और पानी के मिश्रण के एक हिस्से में रेत के तीन या चार हिस्से (वजन के हिसाब से) डाले जाते हैं। जब ऐसा होता है, तो मिश्रण प्रतिक्रिया द्वारा कठोर हो जाता है: Ca (OH) 2 + CO2 → CaCO3 ↓ + H2O। यह एक एक्ज़ोथिर्मिक प्रतिक्रिया है, ऊर्जा रिलीज 27 किलो कैलोरी (113 kJ) है।
जैसा कि प्रतिक्रिया से देखा जा सकता है, इसके दौरान पानी निकलता है। यह एक नकारात्मक कारक है, क्योंकि चूने के मोर्टार के साथ निर्मित कमरों में, उच्च आर्द्रता लंबे समय तक बनी रहती है। इस संबंध में, साथ ही साथ कैल्शियम हाइड्रॉक्साइड पर कई अन्य लाभों के कारण, सीमेंट ने व्यावहारिक रूप से इसे समाधान के निर्माण के लिए बांधने की मशीन के रूप में रखा है। इसके अलावा, यह स्टोव बिछाने के दौरान उपयोग के लिए भी अस्वीकार्य है, क्योंकि उच्च तापमान के प्रभाव में, घुटन कार्बन डाइऑक्साइड जारी किया जाता है।
सिलिकेट कंक्रीट की तैयारी के लिए। सिलिकेट कंक्रीट की संरचना चूने के मोर्टार की संरचना के साथ समान है; हालांकि, यह एक अन्य विधि द्वारा तैयार किया गया है - कैल्शियम ऑक्साइड और क्वार्ट्ज रेत का मिश्रण पानी के साथ इलाज नहीं किया जाता है, लेकिन 9-15 वायुमंडल के दबाव में आटोक्लेव में सुपरहीट (174.5-197.4 डिग्री सेल्सियस) जल वाष्प के साथ।
सिलिकेट ईंटों के निर्माण में।
ऑक्साइड और मैग्नीशियम हाइड्रॉक्साइड:
सीमेंट्स के उत्पादन के लिए दुर्दम्य सामग्री (मैग्नेसाइट बिल्डिंग बोर्ड) की संयुक्त प्रणालियों के उत्पादन के लिए। मैग्नीशियम ऑक्साइड (कास्टिक मैग्नेसाइट) का उपयोग एक बांधने की मशीन के रूप में किया जाता है, जो जब MgCl2 समाधान के साथ मिश्रित होता है, तो हवा में जल्दी से कठोर और ताकत हासिल करने में सक्षम होता है।
- प्राकृतिक जल की कठोरता: परिभाषा, कठोरता के प्रकार, पानी की कठोरता को दूर करने के तरीके: शारीरिक, रासायनिक (प्रतिक्रिया समीकरण), भौतिक-रासायनिक।
एक समाधान में कैल्शियम या मैग्नीशियम लवण की एक बड़ी मात्रा वाले प्राकृतिक पानी को कठोर पानी कहा जाता है, जिसमें शीतल जल होता है, जिसमें कैल्शियम या मैग्नीशियम लवण बहुत कम होता है।
इनमें से पहला कैल्शियम और मैग्नीशियम बाइकार्बोनेट की उपस्थिति के कारण है, दूसरा मजबूत एसिड, सल्फेट या कैल्शियम और मैग्नीशियम के क्लोराइड की उपस्थिति के लिए है। कार्बोनेट कठोरता के साथ पानी के लंबे समय तक उबलने के साथ, इसमें एक उपसर्ग दिखाई देता है, जिसमें मुख्य रूप से CaCO3 शामिल है, और एक ही समय में CO2 जारी की जाती है।
कैल्शियम कार्बोनेट के अपघटन के परिणामस्वरूप ये दोनों पदार्थ दिखाई देते हैं:
इसलिए, कार्बोनेट कठोरता को अस्थायी कठोरता भी कहा जाता है। मात्रात्मक रूप से, अस्थायी कठोरता को पानी से निकाले गए बाइकार्बोनेट की सामग्री की विशेषता होती है जब इसे एक घंटे के लिए उबला जाता है। इस तरह के उबाल के बाद बची हुई कठोरता को निरंतर कठोरता कहा जाता है।
पानी में मौजूद कैल्शियम और मैग्नीशियम आयनों के मिलिवाइलेंट्स की राशि से पानी की कठोरता व्यक्त की जाती है। कठोरता का एक सहस्त्राब्दी 20.04 mg / l या 12.16 mg / l की सामग्री से मेल खाता है।
प्राकृतिक जल की कठोरता व्यापक रूप से भिन्न होती है। यह अलग-अलग जलाशयों में अलग-अलग है, और एक ही नदी में पूरे वर्ष (बाढ़ के दौरान न्यूनतम) में भिन्न होता है। नदियों और झीलों की तुलना में समुद्रों के पानी की कठोरता बहुत अधिक है। इस प्रकार, काला सागर के पानी की कुल कठोरता 65.5 mq / l है। विश्व महासागर के पानी की कठोरता का औसत मूल्य 130.5 meq / l (22.5 meq / l प्रति meq / l सहित) है।
कैल्शियम या मैग्नीशियम लवण की एक महत्वपूर्ण मात्रा के पानी में उपस्थिति कई तकनीकी उद्देश्यों के लिए पानी को अनुपयुक्त बना देती है। इस प्रकार, लंबे समय तक स्टीम बॉयलरों को कठोर पानी से खिलाने के साथ, उनकी दीवारें धीरे-धीरे नाकी के घने क्रस्ट से ढंक जाती हैं। परत की मोटाई पर पहले से ही इस तरह की परत बॉयलर की दीवारों द्वारा गर्मी के हस्तांतरण को बहुत कम कर देती है और परिणामस्वरूप ईंधन की खपत में वृद्धि होती है। इसके अलावा, यह हीटिंग पाइप और बॉयलर की दीवारों पर दोनों में ब्लिस्टरिंग और क्रैकिंग का कारण बन सकता है।
साबुन के साथ कठोर पानी फोम नहीं देता है, क्योंकि फैटी एसिड के घुलनशील सोडियम लवण - पामिटिक और स्टीयरिक - साबुन में निहित एक ही एसिड के अघुलनशील कैल्शियम लवण में बदल जाते हैं:
कुछ तकनीकी प्रक्रियाओं को करते समय कठोर जल का उपयोग नहीं किया जा सकता है, उदाहरण के लिए, जब रंगाई।
पानी की निरंतर कठोरता इसमें मुख्य रूप से कैल्शियम और मैग्नीशियम के सल्फेट्स और क्लोराइड की उपस्थिति के कारण होती है और उबालने से समाप्त नहीं होती है। अस्थायी (हटाने योग्य) और निरंतर कठोरता का योग पानी की कुल कठोरता है।
कठोरता को निर्धारित करने के विभिन्न तरीके हैं।
उनमें से दो पर विचार करें:
1) हाइड्रोक्लोरिक एसिड के एक समाधान का उपयोग करके अस्थायी कठोरता का निर्धारण
2) कुल कठोरता का निर्धारण करने के लिए जटिल पद्धति।
मिथाइल ऑरेंज की उपस्थिति में हाइड्रोक्लोरिक एसिड के साथ पानी के एक नमूने के अनुमापन के दौरान, बाइकार्बोनेट का अपघटन होता है, जिससे अस्थायी कठोरता होती है:
दृढ़ संकल्प की विधि। परीक्षण पानी के 100 मिलीलीटर एक विंदुक या मापने वाले सिलेंडर के साथ एक शंक्वाकार फ्लास्क में लिया जाता है, मिथाइल ऑरेंज की 2-3 बूंदों को जोड़ा जाता है और 0.1 और के साथ शीर्षक दिया जाता है। नारंगी रंग दिखाई देने तक एचसीएल समाधान।
गणना परिणाम विश्लेषण। 1 मिली 0.1 एन। HCl समाधान 0.1 / 1000 g-eq या 0.1 mg-eq Ca 2+ से मेल खाता है। V (HCl) 0.1 V (HCl) / 1000 g-eq या 0.1 V (HCl) mg-eq Ca 2+ से मेल खाती है। 0.1 V (HCl) mEq V A की मात्रा में है। 1 लीटर पानी प्रति मिलीग्राम-समकक्षों में कठोरता को व्यक्त करने के लिए, आपको वी ए द्वारा पाए गए मूल्य को विभाजित करना होगा और इसे 1000 से गुणा करना होगा, अर्थात अध्ययन के तहत पानी की कठोरता।
![]()
उन्मूलन के तरीके.
थर्मल नरम। पानी के आधार पर उबलते हुए, अस्थिर रूप से अस्थिर कैल्शियम और मैग्नीशियम बाइकार्बोनेट के पैमाने के गठन के साथ विघटित होते हैं:
Ca (HCO3) 2 → CaCO3 CO2 + CO2 + H2O।
उबालने से केवल अस्थायी (कार्बोनेट) कठोरता दूर होती है। जीवन में आवेदन पाता है।
नरम बनाने की क्रिया। विधि पानी के लिए सोडा ऐश Na2CO3 या हाइड्रेटेड चूना Ca (OH) 2 के अतिरिक्त पर आधारित है। उसी समय, कैल्शियम और मैग्नीशियम लवण अघुलनशील यौगिकों में गुजरते हैं और, परिणामस्वरूप, अवक्षेप।
उदाहरण के लिए, हाइड्रेटेड चूने के अतिरिक्त कैल्शियम लवणों का अघुलनशील कार्बोनेट में रूपांतरण होता है:
Ca (HCO3) 2 + Ca (OH) 2 → 2CaCO3 2 + 2H2O
पानी की समग्र कठोरता को खत्म करने के लिए सबसे अच्छा अभिकर्मक सोडियम ऑर्थोफोस्फेट Na3PO4 है, जो अधिकांश घरेलू और औद्योगिक उत्पादों का हिस्सा है:
3Ca (HCO3) 2 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 6NaHH3
3MSO4 + 2Na3PO4 → Mg3 (PO4) 2 SO + 3Na2O4
कैल्शियम और मैग्नीशियम ऑर्थोफोस्फेट्स पानी में बहुत खराब घुलनशील होते हैं, और इसलिए आसानी से यांत्रिक निस्पंदन द्वारा अलग हो जाते हैं। यह विधि अपेक्षाकृत उच्च पानी की खपत पर उचित है, क्योंकि इसमें कई विशिष्ट समस्याओं को हल करना शामिल है: तलछट निस्पंदन, सटीक अभिकर्मक खुराक।
कटियन विनिमय। विधि आयन-एक्सचेंज ग्रैन्यूलर लोडिंग (अक्सर आयन-एक्सचेंज रेजिन) के उपयोग पर आधारित है। पानी के संपर्क में ऐसा भार कठोरता लवण (कैल्शियम और मैग्नीशियम, लोहा और मैंगनीज) के उद्धरणों को अवशोषित करता है। इसके बजाय, आयनिक रूप के आधार पर, यह सोडियम या हाइड्रोजन के आयन देता है। इन विधियों को क्रमशः Na-cationization और H-cationization कहा जाता है। ठीक से चयनित आयन-एक्सचेंज लोडिंग के साथ, पानी की कठोरता एकल-चरण सोडियम cationization के साथ 0.05-0.1 ° W तक कम हो जाती है, दो-चरण लोडिंग के साथ - 0.01 ° W तक। उद्योग में, आयन-एक्सचेंज फिल्टर कैल्शियम और मैग्नीशियम आयनों को सोडियम और पोटेशियम आयनों के साथ प्रतिस्थापित करते हैं, जो शीतल जल का उत्पादन करते हैं।
रिवर्स ऑस्मोसिस। विधि पानी के माध्यम से एक अनुमापनीय झिल्ली (आमतौर पर पॉलियामाइड) पर आधारित है। एक साथ कठोरता के लवण के साथ, अधिकांश अन्य लवण हटा दिए जाते हैं। सफाई दक्षता 99.9% तक पहुंच सकती है।
नैनोफिल्ट्रेशन (झिल्ली के छेदों का नाममात्र व्यास नैनोमीटर की इकाइयों के बराबर होता है) और पिकोफिल्टरेशन (झिल्ली के छेदों का नाममात्र व्यास पिकोमीटर की इकाइयों के बराबर होता है) होते हैं।
इस विधि के नुकसान के रूप में ध्यान दिया जाना चाहिए:
रिवर्स ऑस्मोसिस झिल्ली को आपूर्ति किए गए पानी के पूर्व-उपचार की आवश्यकता;
उत्पादित 1 लीटर पानी की अपेक्षाकृत उच्च लागत (महंगे उपकरण, महंगी झिल्ली);
उत्पादित पानी का कम खनिजकरण (विशेषकर जब पिकोफिल्ट्रेशन)। पानी लगभग डिस्टिल्ड हो जाता है।
Electrodialysis। यह एक विद्युत क्षेत्र की कार्रवाई के तहत पानी से लवण को हटाने पर आधारित है। विघटित पदार्थों के आयनों को हटाने से विशेष झिल्ली के कारण होता है। जिस तरह रिवर्स ऑस्मोसिस तकनीक के उपयोग के साथ कठोरता आयनों के अलावा, अन्य लवणों को निकालना होता है।
कठोरता वाले लवण से पूरी तरह से साफ पानी आसुत हो सकता है।
