مركبات الكالسيوم والمغنيسيوم
لذلك ، بعد تحديد كمية الكالسيوم الموجودة في قشرة البيض المسحوقة بالأمس ، نشأ السؤال "للشرب أم عدم الشرب؟". مثل معظم الرجال ، أتيت بكل شيء من وجهة نظر علمية وحتى أرى ذلك بنفسي ، اكتشف ، تحقق ، أشعر بكلمة لامرأة. لذلك ، سأشارك أفكاري على أساس المعلومات التي تم العثور عليها حول قشر البيض والكالسيوم.
جمع المعلومات على الإنترنت حول استخدام قشرة البيضة كإضافة غذائية أكثر من مرة عبر الملاحظات النقدية للأطباء بأن كربونات الكالسيوم الموجودة في قشرة البيضة غير قابلة للذوبان في الماء وبالتالي لا يمكن أن يمتصها الجسم.
علاوة على ذلك ، تم تذكر قصة زوج صديقي أنه خلال فترة الحمل أخبرت طبيبها ، الذي كان قد لاحظ أنها كانت تأخذ قشور البيض المسحوق - قام الطبيب بإثنائها ووصف له نوعا من المركب المحتوي على الكالسيوم.
اين الحقيقة؟
في الواقع ، كربونات الكالسيوم CaCO3 (على وجه التحديد في هذا النوع ، الكالسيوم في قشر البيض) غير قابل للذوبان في الماء والكحول.
الشرط المسبق الضروري بالفعل لامتصاص الكالسيوم هو قابليته للذوبان في الماء.
ولكن تذكر أن أساس هضمنا هو حمض الهيدروكلوريك تفرز في المعدة.
وهذا ما يحدث في معدتنا:
СaCO3 + 2HCl (حمض الهيدروكلوريك) = СaCl2 (كلوريد الكالسيوم) + Co2 + H20
لكن كلوريد الكالسيوم قابل للذوبان في الماء تماما !!! في هذا الشكل يتم امتصاص الكالسيوم!
لا أعرف الأطباء؟ أو انهم ببساطة ماكرة ويبيعون لنا أدوية!
بالإضافة إلى ذلك ، خلال هذا التفاعل ، يحدث انخفاض في حموضة المعدة. ما هو مهم للأشخاص الذين يعانون من حموضة عالية.
على سبيل المثال زوجتي ، لديها حموضة عالية ، وهي تأخذ قشر البيض الصغير كل يوم ، وهذا يحل مشكلتين في وقت واحد ويعوض نقص الكالسيوم ويقلل من حموضتها. لكن مسحوق قشرة البيضة انطفأ عصير الليمون لا يمكن أن تشرب - هناك غثيان! والآن أفهم لماذا.
كما رأينا أعلاه ، لامتصاص الكالسيوم من كربونات الكالسيوم يتطلب عصير المعدة مع حموضة عالية.
في الحياة الواقعية ، يحدث الوضع غالباً عندما تكون حموضة المعدة منخفضة أو صفرية. هذه الحالة خاصة مميزة لكبار السن ، عندما تكون الحاجة إلى الكالسيوم عالية بشكل خاص لمنع هشاشة العظام. على سبيل المثال ، بعد 50 عامًا ، تحدث الحموضة المنخفضة في حوالي 40٪ من الأشخاص. في ظل هذه الظروف ، تنخفض نسبة امتصاص كربونات الكالسيوم ، التي تتطلب حمض الهيدروكلوريك في المعدة ، إلى 2٪.
ربما كان هذا هو الجواب الذي يجعل كبار السن أكثر عرضة للمعاناة من الأمراض المرتبطة بنقص الكالسيوم - فهم لا يستطيعون استيعابه في شكله المعتاد.
الآن النظر في لماذا ينصح العديد من وصفات لتلقي قشر البيض سحقت لإطفاء ذلك مع عصير الليمون.
عندما نضيف عصير الليمون إلى حمض السيتريك المسحوق ، يتفاعل كربونات الكالسيوم (CaCo3) مع حامض الستريك (C6H8O7) ونحصل على سيترات الكالسيوم (Ca3 (C6H5O7) 2):
2C6H8O7 + 3CaCO3 = Ca3 (C6H5O7) 2 + 3CO2 + 3H2O
ها هي وامتصاص سيترات الكالسيوم ، التي لا تتطلب حمض الهيدروكلوريك في المعدة ، هو 44٪. ونتيجة لذلك ، في ظل ظروف انخفاض الحموضة ، يدخل سيترات الكالسيوم الجسم في 11 مرة أكثر من الكالسيوم من الكربونات!
وسيترات الكالسيوم هي بالفعل دواء معروف يباع لنا من أجل المال! ويفعلون ذلك ، فقط لا يستخدمون عصير الليمون ، ولكن حمض الليمون!
بالمناسبة ، كربونات الكالسيوم (قشر البيض المبشور) هو مضاف غذائي مسجل. E170، وسيترات الكالسيوم (لدينا قشر البيض تمزيقه مع عصير الليمون) هي المضافات الغذائية المسجلة. E333! وتضاف إلى العديد من المنتجات الغذائية ، وخاصة منتجات الألبان ، بما في ذلك الحليب ، لزيادة نسبة الكالسيوم!
لماذا تدفع أكثر!
الاستنتاج ، إذا كنت تعاني من حموضة عالية - فمن الأفضل استخدام قشور البيض الممزقة فقط ، إذا كانت الحموضة أقل ، فمن الأفضل التخلص من مسحوق قشر البيض بعصير الليمون.
وأكثر من ذلك ،
في الليل ، هناك تسارع إطلاق الأملاح المعدنية من الجسم (تسارع الإيقاع الدوري لعمليات المسح في العظام). لذلك ، ينبغي اتخاذ الاستعدادات الكالسيوم بعد الغداء وفي المساء.وهذا سيمنع فقدان الكالسيوم المتسارع في النصف الثاني من الليل ، خاصة مع انخفاض مستوى (أو غياب) في الأمعاء. ويلاحظ أيضا التأثير السلبي المعتمد على الجرعة لنشاط دوائي من الكالسيوم: في الجرعات المنخفضة يتم امتصاص هذا biometall أفضل من مرتفع.
في اتصال مع هذا أكثر عقلانية لتناول الدواء عدة مرات في اليوم.
نقرأ ونناقش. فيما يلي بعض المقالات حول هذا الموضوع.
__________________________________________________________________________________________________________
سترات الكالسيوم مقابل كربونات الكالسيوم
مصدر< http://www.ortho.ru/77_KMD/Ca_Sravni.htm >
_________________________________________________________________________________________________________
سترات الكالسيوم.
سيترات الكالسيوم هي مصدر ممتاز للكالسيوم الممتص ، والذي يلعب دورا هاما جدا في الجسم ، لأنه يؤثر على العديد من العمليات الأنزيمية وتجلط الدم. نقص الكالسيوم يؤدي إلى هشاشة العظام وهشاشة العظام. بالنسبة للأطفال الصغار ، فهو مفيد لصحة الأسنان ؛ يحتاج الكبار إلى تناول الكالسيوم بانتظام لتحقيق استقرار ضغط الدم.
وفقا للمعهد الوطني للسرطان (الولايات المتحدة) ، يمكن أن يحول ملحق E-333 على الأرجح سرطان القولون وسرطانات أخرى. بالإضافة إلى ذلك ، تستخدم سيترات الكالسيوم في الطب لإزالة المعادن الثقيلة من الجسم.
ولما كانت سيترات الكالسيوم واحدة من أهم أشكال نقل الكالسيوم في جسم الإنسان ، فإنها تستخدم في الطب مع كربونات الكالسيوم الأقل فاعلية (E-170 المضافة) لتجديد احتياطيات الكالسيوم في الجسم. لنفس السبب ، يستخدم سيترات الكالسيوم في شكل مكملات غذائية (المكملات الغذائية).
في صناعة المواد الغذائية ، يتم استخدام المادة المضافة 333-E كمثبت ، مادة حافظة ، منظم الحموضة ، مثبت اللون.
كعامل استقرار ، يتم استخدام المضافات الغذائية E-333 في صناعة الحليب المكثف والقشدة والجبن الكريمي. في المربى ، والهلام والفاكهة المعلبة ، يتم استخدام مادة الإضافة 333 كمنظم الحموضة. كما تستخدم سيترات الكالسيوم على نطاق واسع لإثراء الكالسيوم في الحليب ومنتجات الألبان والمخابز ومنتجات الدقيق والمشروبات الغازية.
في المظهر ، سيترات الكالسيوم هو مسحوق أبيض مع طعم الحامض وضوحا. قابل للذوبان في الماء. الصيغة الجزيئية لسيترات الكالسيوم: Ca3 (C6H5O7) 2. الحصول على E-333 من تفاعل حمض الستريك مع هيدروكسيد الكالسيوم.
الخصائص والوظائف التكنولوجية:
الأسماء المحتملة للمكملات الغذائية:
- E-333
- E-333
- سترات الكالسيوم
- سيترات الكالسيوم
- سيترات مونوكالسيوم
- سترات ديكالسيوم
- سترات Tricalcium
_____________________________________________________________________________________________
سيترات الكالسيوم
في منتصف القرن العشرين. بدأ نوع من "الطفرة": بدأ علماء الكيمياء الحيوية ، وعلماء الفيزيولوجيا ، وعلماء الفيزياء الحيوية ، وعلماء الصيدلة والأطباء في إظهار اهتمام متزايد بدراسة دور الكالسيوم في تنظيم نشاط الأعضاء وأنظمة الجسم. تم العثور على أيونات الكالسيوم التي تشارك في الإثارة والتقلص من الخلايا العضلية ، وتنظيم نفاذية غشاء الخلية ، والتفاعلات بين الخلايا ، تخثر الدم ، إفراز هرمون ، وسطاء ، الانزيمات. أداء وظيفة محول إشارة تدخل الخلية ، والمشاركة في عمليات تنظيم الأيض داخل الخلايا ، بما في ذلك الطاقة. على سطح غشاء الخلايا العضلية والأوعية الدموية من أيونات الكالسيوم الحرة هو 1000 مرة أكثر من العصارة الخلوية في الخلايا. من الفضاء خارج الخلية أنها تخترق السيتوبلازم من خلال قنوات الكالسيوم الخاصة ، التي تؤثر على مختلف العمليات الفيزيولوجية ووظائف الخلايا من جميع الأجهزة ، نغمة الأوعية الدموية ، وشدة الانقباض ، الانبساط.
يلعب الكالسيوم دورًا مهمًا في تكوين أنسجة العظام والحفاظ على هيكله ووظائفه الطبيعية. جنبا إلى جنب مع البروتينات الخاصة ، أيونات الكالسيوم توفر صلابة العظام ومرونة.
كل هذا بمثابة الأساس النظري لتطوير وإدخال مستحضرات الكالسيوم على أساس الأملاح في الممارسة الطبية. حاليا ، في الممارسة الطبية ، وتستخدم مثل أملاح الكالسيوم مثل الجليسرين الفوسفات ، غلوكونات ، كربونات ، اللاكتات ، سترات ، كلوريد والفوسفات وغيرها الكثير.
الحرائك الدوائية للعقار CALCIUM CITRATE لها خصائصها الخاصة. يتم امتصاص الكالسيوم من الأمعاء في شكل قابل للذوبان ، المتأين. يحدث تفكك الدواء بشكل أفضل في البيئة الحمضية للمعدة. الكالسيوم المتأين الذائب يخترق جيدا في جميع الأنسجة ، يخترق حاجز المشيمة ، يمر في حليب الثدي. تفرز أساسا في البراز ، حوالي 20 ٪ - مع البول. من الخصائص المهمة في سيترات الكالسيوم انخفاض القدرة على تشكيل حصوات الكلى ، وهو أمر مهم مع استخدام هذا الملح على المدى الطويل. هذا يرجع إلى حقيقة أن الملح سيترات يقلل من كمية أكسالات في البول.
يتم تحديد التوافر البيولوجي من خلال السرعة والمدى الذي العنصر النشط يمتص من شكل الجرعة ، فإنه يصبح متاحا في موقع العمل العلاجي المقصود.
في الليل ، هناك تسارع إطلاق الأملاح المعدنية من الجسم (تسارع الإيقاع الدوري لعمليات المسح في العظام). ولذلك ، ينبغي اتخاذ الاستعدادات الكالسيوم بعد الغداء وفي المساء ، والتي ستمنع فقدان الكالسيوم المتسارع في النصف الثاني من الليل ، وخاصة مع انخفاض مستوى (أو غياب) في الأمعاء. لوحظ التأثير السلبي المعتمد على الجرعة للنشاط الدوائي للكالسيوم: يتم امتصاص هذا البيومولوم بشكل أفضل عند الجرعات المنخفضة مقارنة بالجرعات العالية. في هذا الصدد ، من المنطقي تناول الدواء عدة مرات في اليوم. لمختلف الفئات العمرية هناك معايير فسيولوجية مختلفة من تناول الكالسيوم (الجدول).
طاولة
المعدل الموصى به من تناول الكالسيوم في الناس من مختلف الأعمار
(وفقا للجمعية الكندية لهشاشة العظام)
فيتامين (د) ، حمض الهيدروكلوريك ، اللاكتوز ، حمض الستريك ، وجود البروتين في الغذاء ، الفوسفور ، المغنيسيوم ، وكذلك بعض الأطعمة مثل الزبدة والبيض والحليب والسمك ، ودهون القد ، والملفوف ، وما إلى ذلك ، تساهم في امتصاص أيونات الكالسيوم.
امتصاص الكالسيوم يزداد سوءًا: نقص البروتين في الطعام ، التقيد الصارم بالنظام الغذائي النباتي ، نقص المغنيسيوم ، الفوسفور ، الأطعمة الغنية بحمض الأكساليك (حميض ، راوند ، سبانخ).
يبطئ امتصاص الكالسيوم في أمراض الجهاز الهضمي (التهاب المعدة ، التهاب الأمعاء ، التهاب القولون ، القرحة المعوية) ، البنكرياس (السكري ، التهاب البنكرياس) ، أمراض أخرى من الغدد الصماء.
وينبغي التأكيد على أن بعض الأدوية ، وخاصة السكرية ، والعقاقير الهرمونية لمنع الحمل للاستخدام الجهازي ، ليفوثيروكسين يزيد أيضا من سوء امتصاص أيونات الكالسيوم.
وفقا لنتائج البحث العلمي (بيانات الجمعية الكندية لهشاشة العظام) ، لا يوجد دليل مقنع على أساسه يمكن التوصية باستهلاك إضافي للمعادن الأخرى (المغنيسيوم والزنك والنحاس وغيرها) للوقاية من هشاشة العظام أو علاجه.
وقد أكدت نتائج الدراسات السريرية التي أجريت في أوكرانيا وبلدان أخرى فعالية عالية من هذا الدواء في علاج العديد من الأمراض. كما يستخدم سيترات الكالسيوم لأغراض وقائية في مختلف الأمراض.
مع هشاشة العظام في كبار السن ، وتوصف لين العظام CALCIUM CITRATE 2-6 أقراص يوميا ، وتقسيم الجرعة اليومية إلى 3-4 جرعات. يتم تناول الدواء قبل الوجبات أو بعد 1 إلى 1.5 ساعة من الوجبة لمدة 3 أشهر. كما ينبغي وصف هؤلاء المرضى بفيتامين D3 البالغ 400-800 وحدة دولية في اليوم الواحد ، ويشمل أيضًا الزيت والحليب والأسماك والبيض في النظام الغذائي.
CALCIUM CITRATE هو شكل الجرعة المثلى لتوفير الكالسيوم ليس فقط للبالغين ، ولكن أيضا للأطفال ، وكذلك المراهقين ، لأنه يساعد على زيادة كثافة المعادن في العظام ، وزيادة كتلة العظام ، وتعزيز العاج ومينا الأسنان. يتم وصف الأطفال الذين تقل أعمارهم عن 6 أشهر 1/2 حبة (250 ملغ) (سحقت ، تذاب في كمية صغيرة من الحليب) ، في سن 6-12 شهرا - أيضا 1/2 حبة 2 مرات في اليوم ، في عمر 1 سنة - 10 سنوات - 1-2 حبة ، من 10 إلى 18 عامًا - 2-3 حبة يوميًا.
مؤشرات للتعيين: الكالسيوم سيترات هي:
نقص كلس الدم الناجم عن النزف من أصل مختلف ، وكذلك خلال فترة الحمل والرضاعة ، مع الإصابات - لملء حاجة الجسم المتزايدة لأيونات الكالسيوم.
انتهاك امتصاص الكالسيوم في أمراض الجهاز الهضمي وزيادة مستوى إفراز الكالسيوم من خلال الكلى والأمعاء ؛
قصور جارات الدرق ، تجفاف كائن حي من نشوء مختلف ، أمراض الحساسية ومضاعفات الحساسية أثناء تناول الأدوية ، زيادة نفاذية جدار الأوعية الدموية ، تخثر الدم المنخفض.
يجب أن توصف CALCIUM CITRATE عند تناول الجلوكوكورتيكوديات ، وسائل منع الحمل عن طريق الفم ، levothyroxine. في الحالات الثلاث الأخيرة ، يتم أخذ الدواء 1 قرص 6 مرات يوميا بعد وجبات الطعام.
سيترات الكالسيوم ، كقاعدة عامة ، جيدة التحمّل ، وأحيانًا أعراض تشنج (الإمساك أو الإسهال ، الغثيان ، التقيّؤ ، فقدان الشهية ، آلام في البطن) ، يمكن أن تحدث بثور.
لا ينصح بالاستخدام المتزامن لـ CALCIUM CITRATE مع مضادات الحموضة المحتوية على الألومنيوم بسبب انخفاض فعاليتها. من غير المرغوب وصفه في وقت واحد مع مستحضرات الكالسيوم الأخرى.
في الختام ، يمكن أن نلاحظ الخصائص الدوائية إيجابية من CALCIUM CITRATE:
سيترات ملح الكالسيوم مذاب بشكل جيد وامتصاص في الجهاز الهضمي ، مما يؤدي إلى امتصاص جيد للكالسيوم في الجسم ، وبالتالي ، فإن فعالية الدواء في الوقائية أو تطبيق علاجيوهذا ما تؤكده نتائج العديد من الدراسات السريرية.
انخفاض خطر تشكيل الحجر في الكلى عند تناول الدواء يزيد من قيمة كبريتات الكالسيوم مع الاستخدام لفترات طويلة.
IS شكمان ، رئيس قسم علم الصيدلة مع مسار الصيدلة السريرية للجامعة الطبية الوطنية ، عضو المقابلة في الأكاديمية الوطنية للعلوم وأكاديمية العلوم الطبية في أوكرانيا ، تكريم عامل العلوم والتكنولوجيا ، أستاذ
الصفحة 1
يمكن استخدام تفاعل الكربونات مع الأحماض كعينة للكربونات. حمض الكربونيك هو حمض ضعيف جدا وغير مستقر. يمكن تقليبها من أملاحها بواسطة عمل أحماض أقل تقلبًا وأقوى.
وبالمثل ، تستمر تفاعلات كربونات الكالسيوم مع الأحماض.
يعطي تفاعل الكربونات مع حمض الهيدروكلوريك كلوريد الكالسيوم وكلوريد المغنيسيوم ، الذي يذوب جيدا في الماء ويبقى في شكل محلول من تركيزات مختلفة. معدل التفاعل في جامعي هذا النوع يعتمد بشكل رئيسي على الضغط ودرجة الحرارة.
نتيجة تفاعل كربونات مع حمض الهيدروكلوريك كلوريد الكالسيوم والمغنيسيوم ، قابل للذوبان بشكل جيد في الماء وتبقى في شكل حل من تركيزات مختلفة.
يستلزم إدخال كربونات الصوديوم غير المجففة في التفاعل زيادة الضغط وزيادة كمية المحفز.
شرح الظواهر المذكورة أو الملاحظة: لماذا يبدأ تفاعل كربونات الكالسيوم مع حامض الكبريتيك في أول الأمر بعنف ثم يتوقف. لماذا عندما تختفي مادة كربونات الأمونيوم الجافة الساخنة من الأنبوب.
يمكن تفسير التأثير النافع لكربونات الكالسيوم على ثبات الاسمنت البورتلاندي بواسطة تفاعل الكربونات مع معادن الكلنكر المحتوية على الألمنيوم. وبالتالي ، فإن مكون ألومينات من الحجر الأسمنتي مرتبط كيميائياً قبل أن يتلامس مع كبريتات البيئة.
وتستند بعض تطبيقات كربونات الباريوم على عدم قابلية الذوبان العملي لكبريتات الباريوم ، التي تتشكل عن طريق تفاعل كربونات الباريوم مع المواد التي تحتوي على أيونات الكبريتات. لذلك ، عند تجفيف لبنة قبل الحرق ، يظهر الإزهار الأبيض على سطحه ، وينتج عن تبلور الجبس أو كبريتات المغنيسيوم الموجودة في الطين. لمنع حدوث ذلك ، تتم إضافة كربونات الباريوم إلى الطين ، مما يؤدي إلى ترسيب أيون الكبريتات.
في مقدمةه لكيمياء المواد الصلبة ، Hedwal ، كمثال على رد فعل ممكن من الناحية النظرية ، يؤدي إلى رد فعل كربونات الكالسيوم مع SiO2 ، مما يؤدي إلى تشكيل سيليكات الكالسيوم. يرافق هذا المثال من خلال ملاحظة أنه مع ما يسمى التحولات الحرارية الأرضية ، فإن درجة الحرارة المعتادة ليست كافية ، حيث يمكن ملاحظة التفاعل بين كربونات الكالسيوم وحمض السليسيوم في الظروف المختبرية فقط عند درجات حرارة تبلغ 500 درجة مئوية.
لتقليل تكلفة تشكيل البلغم في هذه العملية ، اقترح كلما وارد استخدام محلول كربونات الأمونيوم (بدلاً من نترات الأمونيوم) وخلق البلغم بسبب تفاعل كربونات الأمونيوم المخصب مع الجير.
مع ارتفاع درجة الحرارة ، ينتقل التفاعل نحو تكوين سيليكات أكثر قلوية. أظهر Gibson و Ward11 على تفاعل كربونات الصوديوم مع الكوارتز عند درجة حرارة من 726 إلى 805 درجة مئوية في تيار من النيتروجين أن سيليكات ortho تتشكل في وجود كمية كافية من كربونات الصوديوم. يعتمد معدل التفاعل على الوقت وحجم العينة ومعدل تدفق الغاز وتكوين خليط التفاعل. يجادل جيبسون وارد بأن هناك سيليكات صوديوم متوسطة الدرجة.
تتم معايرة كربونات الصوديوم الزائدة مع حمض الهيدروكلوريك. يتم حساب كمية الكبريت في المنتج الذي تم تحليله من خلال كمية كربونات الصوديوم المتفاعلة.
وكربونات الكالسيوم وكيف تتفاعل هذه المركبات الكيميائية.
كربونات الكالسيوم
كربونات الكالسيوم كربونات الكالسيومكاركو هو مركب شائع جدا في العالم ؛ يتكون من: الطباشير ، الحجر الجيري ، الرخام ، إلخ. ولذلك ، تجدر الإشارة إلى أن دور هذه المادة بالنسبة للبشر مهم جدا ، لأن كربونات الكالسيوم تستخدم على نطاق واسع في صناعة الأغذية ، كصبغة بيضاء طبيعية. كما يستخدم CaCO₃ في صناعة الورق والبلاستيك والبناء وفي العديد من المجالات الأخرى.
كربونات الكالسيوم هي مادة بيضاء (بلورات صلبة) في شكل مسحوق أو صلب. إنه قادر على التفاعل مع الماء ، ولكن ليس مذابًا تمامًا فيه. لذلك ، يصبح الماء عكرًا ، وهناك راسب أبيض فيه. ولكن إذا حدث التفاعل مع الماء في الوجود ، فسوف نحصل على ملح حامض قابل للذوبان ، بيكربونات الكالسيوم:
CaCO₃ + CO₂ + H₂O → Ca (HCO₃)
النظر في كيفية صنع كربونات الكالسيوم.
يتم الحصول على معظم كربونات الكالسيوم من المصادر الطبيعية. لذا ، للحصول على كربونات الكالسيوم ، كقاعدة عامة ، استخدم مصدرًا نظيفًا ، غالبًا ما يكون رخامًا.
 تمثال من الرخام من ديفيد بواسطة مايكل أنجلو بوناروتي
تمثال من الرخام من ديفيد بواسطة مايكل أنجلو بوناروتي
ولكن في الظروف المختبرية ، يمكن الحصول على كربونات الكالسيوم عن طريق تكليس أكسيد الكالسيوم. يشير التكليس إلى الفكرة العامة للحرق ، ونتيجة لذلك تحصل المواد الكيميائية على خصائص جديدة. يتم إطلاق النار بدرجة حرارة عالية بما يكفي ، لا تصل إلى ذوبان.
يتم خلط الماء مع أكسيد الكالسيوم الناتج ، ينتج التفاعل هيدروكسيد. ثم يحصل الفنيون على ثاني أكسيد الكربون ، والذي يتم تمريره من خلال الحل الذي تم الحصول عليه مسبقًا. الراسب المتكون هو كربونات الكالسيوم:
CaO + H₂O = Ca (OH)؛
Ca (OH) + CO₂ = CaCO₃ + H₂O
إذا قمنا بتسخين الملح من حمض الكربونيك والكالسيوم إلى درجة حرارة عالية (900 - 1000 درجة مئوية) ، ثم نتيجة للعملية الكيميائية سنحصل على ثاني أكسيد الكربون (ثاني أكسيد الكربون) ، وكذلك أكسيد الكالسيوم CaO - quicklime المستخدم في البناء:
CaCO₃ = CaO + CO₂
إذا كانت درجة الحرارة أعلى (1500 درجة مئوية) ، فستكون منتجات التفاعل كربيد الكالسيوم وأول أكسيد الكربون.
حمض الهيدروكلوريك
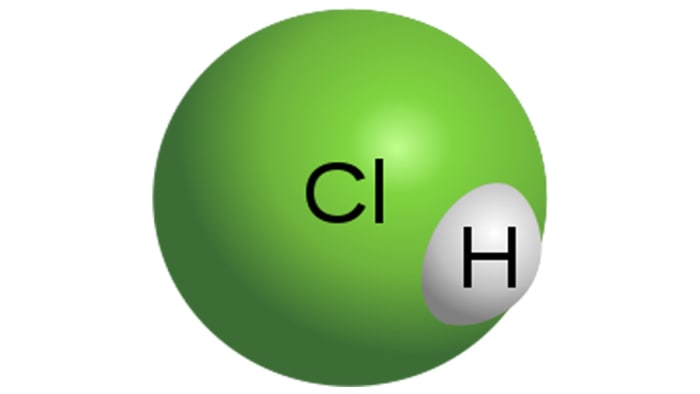 جزيء حمض الهيدروكلوريك
جزيء حمض الهيدروكلوريك
حمض الهيدروكلوريك هو حمض مونوباسيك قوي ، ويتم الحصول عليه عن طريق إذابة كلوريد الهيدروجين في الماء. وهو سائل عديم اللون ، على الرغم من أن الحمض التقني قد يكون له لون أصفر ، على سبيل المثال ، بسبب شائبة الحديد. تعتمد خصائص HCl بشكل مباشر على تركيز كلوريد الهيدروجين في المحلول.
تسمى أملاح حمض الهيدروكلوريك بالكلوريدات. هذه المادة كاوية جداً ، لذلك تتطلب مناورة دقيقة: حتى لو سقط قطرة صغيرة على الجلد ، لا يمكن تجنب الحرق الكيميائي القوي. لذلك ، عند العمل مع الأحماض القوية ، يُنصح دائمًا بحمل محايدة معك: حلول قلوية ضعيفة ، (صودا الخبز) ، إلخ. تجدر الإشارة إلى أنه عند فتح حاوية مع أبخرة حمض الهيدروكلوريك حمض مركزة ، والتي تؤثر سلبا على العين والجهاز التنفسي. لذلك ، في التجارب الكيميائية ، سيكون من الأفضل استخدام جهاز للتنفس والنظارات الواقية.
الحصول على حمض الهيدروكلوريك
يتم إذابة غاز كلوريد الهيدروجين في الماء. يتم الحصول على كلوريد الهيدروجين نفسه كما يلي: يتم حرق الهيدروجين في الكلور ، وبالتالي الحصول على حمض اصطناعي. بدلا من ذلك ، يمكن الحصول على حمض الهيدروكلوريك باستخدام الغازات الجانبية ، والتي يتم الحصول عليها في عدد من التجارب الكيميائية ، على سبيل المثال ، عندما يتم معالجة الكلوريدات الهيدروجينية بالكلور. يسمى الحمض الذي تم الحصول عليه بهذه الطريقة abgasic.
تطبيق حمض الهيدروكلوريك في الطب والصناعة ، وكذلك للتفاعلات الكيميائية.
يتفاعل حمض عديم اللون مع رائحة نفاذة لكلوريد الهيدروجين بشكل جيد مع المعادن. يحدث تفاعل الأكسدة والاختزال. العوامل المختزلة في عملية التفاعل هي ذرات المعدن ، والعوامل المؤكسدة هي كاتيونات الهيدروجين.
التفاعلات الكيميائية الأساسية مع المعادن يرافقها إطلاق الهيدروجين. تعتمد شدة التفاعل على نشاط المعدن ، على سبيل المثال ، الليثيوم المعدن القلوي يتفاعل بعنف ، في حين أن التفاعل مع الألمنيوم ضعيف بسبب فيلم أكسيد قوي لهذا العنصر.
حمض الهيدروكلوريك والزنك:
2HCl + Zn = ZnCl₂ + H₂
حمض الهيدروكلوريك والحديد:
2HCl + Fe = FeCl₂ + H₂
حمض الهيدروكلوريك والمغنيسيوم:
2HCl + Mg = MgCl₂ + H₂
 كلوريد المغنيسيوم ، يستخدم لتنظيف الطرق من الجليد
كلوريد المغنيسيوم ، يستخدم لتنظيف الطرق من الجليد
باستخدام أكاسيد المعادن ، يتشكل الحمض من الملح والماء:
CuO + 2HCl = CuCl₂ + H₂O
تفاعل حمض الهيدروكلوريك وكربونات الكالسيوم
للتجربة ستحتاج إلى:
أنبوب اختبار
ماصة كيميائية
كربونات الكالسيوم الصلبة (الرخام) ؛
حمض الهيدروكلوريك
قفازات.
تنفس صناعي.
تحذير! لا تحاول هذه التجربة بنفسك!
إجراء التجربة في منطقة جيدة التهوية ، توخي الحذر عند العمل مع حمض الهيدروكلوريك.
إضافة بضع قطع من الرخام إلى الوعاء و ماصة بعض حمض الهيدروكلوريك. ونتيجة لذلك ، سيكون هناك رد فعل فوري مع تشكيل فقاعات - يتم إطلاق ثاني أكسيد الكربون. هذا تفاعل تبادل ، منتجاته هي: مركب ضعيف وغير مستقر ، حمض كربونيك ، والذي يتحلل إلى ثاني أكسيد الكربون والماء. معادلة تفاعل انحلال كربونات الكالسيوم في حمض الهيدروكلوريك:
CaCO₃ + 2HCl (dil.) → CaCl₂ + CO₂ + H₂O
- خصائص عنصر المغنيسيوم: البنية الإلكترونية ، حالات الأكسدة المحتملة ، المركبات الأساسية: أكسيد ، هيدروكسيد ، أملاح. ما هو الكربنة وما هو دورها في البناء.
MgCO 3 = MgO + CO 2
التطبيق.
في الصناعة يتم استخدامه لإنتاج الحراريات ، والأسمنت ، وتنقية المنتجات النفطية ، كمادة حشو في إنتاج المطاط. يستخدم أكسيد المغنيسيوم فائق الخفة كاشطاح دقيق جدا لتنظيف الأسطح ، على وجه الخصوص ، في صناعة الإلكترونيات.
في الطب ، يتم استخدامه في حالة زيادة حموضة العصارة المعدية ، حيث أنه ينتج عن المحتوى الزائد لحمض الهيدروكلوريك. كما يؤخذ المغنيسيا المحروقة عندما يتم إطلاق الحمض بطريق الخطأ في المعدة.
في صناعة المواد الغذائية يتم تسجيلها كإضافة غذائية E530.
هو عاكس مطلق - مادة ذات معامل انعكاس تساوي واحد في نطاق طيفي واسع. يمكن استخدامه كمعيار أبيض متوفر.
هيدروكسيد المغنيسيوم - هيدروكسيد الفلز الرئيسي هو المغنيسيوم. قاعدة ضعيفة غير قابلة للذوبان.
تحت الظروف القياسية ، هيدروكسيد المغنسيوم هو شعرية سداسية عديم اللون. في درجات حرارة أعلى من 350 درجة مئوية تتحلل إلى أكسيد المغنيسيوم والماء. يمتص ثاني أكسيد الكربون والماء من الهواء لتشكيل كربونات المغنيسيوم الرئيسية. هيدروكسيد المغنيسيوم غير قابل للذوبان عمليا في الماء ، ولكنه قابل للذوبان في أملاح الأمونيوم. إنها قاعدة ضعيفة. يحدث في الطبيعة في شكل بروسايت المعدنية.
تحصل.
تفاعل أملاح المغنيسيوم القابلة للذوبان مع القلويات:
بشكل عام:
Mg 2+ + 2OH - = Mg (OH) 2 ¯
الأمثلة على ذلك:
MgCl 2 + 2NaOH = Mg (OH) 2 ¯ + 2NaCl
Mg (NO 3) 2 + 2KOH = Mg (OH) 2 ¯ + 2KNO 3
تفاعل محلول كلوريد المغنيسيوم مع الدولوميت المحترق:
MgCl 2 + CaO × MgO + 2H 2 O = 2 Mg (OH) 2 ¯ + CaCl 2
تفاعل المغنيسيوم المعدني مع بخار الماء:
Mg + 2H 2 O = Mg (OH) 2 ¯ + H 2 -
الخصائص الكيميائية
مثل جميع القواعد الضعيفة ، فإن هيدروكسيد المغنسيوم غير مستقر حرارياً. يتحلل عند تسخينه إلى 350 درجة مئوية:
تتفاعل مع الأحماض لتشكيل الملح والماء (رد فعل معادلة):
Mg (OH) 2 + 2HCl = MgCl 2 + 2H 2 O
Mg (OH) 2 + H 2 SO 4 = MgSO 4 + 2H 2 O
التفاعل مع الأكاسيد الحمضية لتشكيل الملح والماء:
Mg (OH) 2 + SO 3 = MgSO 4 + H 2 O
التفاعل مع المحاليل المركزة الساخنة من القلويات مع تشكيل hydroxymagnesates:
Mg (OH) 2 + 2NaOH = Na 2
Mg (OH) 2 + Sr (OH) 2 = Sr
التطبيق.
يستخدم هيدروكسيد المغنسيوم لربط ثنائي أكسيد الكبريت ، باعتباره من المواد العادمة لمعالجة المياه العادمة ، كمثبط للهب في البوليمرات الحرارية (البولي أوليفينات ، PVC) ، كمضاف في المنظفات ، لإنتاج أكسيد المغنيسيوم ، تكرير السكر ، كمكون في معاجين الأسنان.
في الطب ، يتم استخدامه كدواء لتحييد الحمض في المعدة ، فضلا عن ملين قوي جدا.
في الاتحاد الأوروبي ، يتم تسجيل هيدروكسيد المغنيسيوم كإضافة غذائية E528.
أملاح المغنيسيوم.
معظم أملاح المغنيسيوم عالية الذوبان في الماء. Ion Mg 2+ يعطي الحلول طعمًا مرًا. هاليدات المغنيسيوم ، باستثناء MgF2 ، هي شديدة الاسترطاب - ينزف في الهواء.
المغنيسيوم كلوريد MgCl 2 (كلوريد المغنيسيوم) يذوب لا مائي عند 718 درجة. في وجود آثار من الماء فإنه "يدخن" في الهواء - أنه يتحلل إلى حمض الهيدروكلوريك ومغو. يتم إطلاق هيدرات بلورية عديمة اللون مع 1 ، 2 ، 4 ، 6 ، 8 و 12 جزيئات الماء من المحلول المائي. في نطاق درجة حرارة تتراوح بين 3،4 إلى 116،7 درجة مستقر البلورية MgCl 2 × 6H 2 0، والذي يحدث في الطبيعة كما في bishofit المعدنية، وبكميات كبيرة يتم الحصول عليها عن طريق التبخر من المياه المالحة البحر. يشكل كلوريد المغنيسيوم أملاحاً مزدوجة ، منها معدن الكرنالايت KCl × MgCl 2 × 6H 2 O - مصدر المغنيسيوم وكلوريد البوتاسيوم - مهم للغاية.
التطبيق.
1. يستخدم كلوريد المغنيسيوم بشكل رئيسي في إنتاج المغنيسيوم المعدني ، ويستخدم MgCl 2 × 6H 2 0 للحصول على أسمنت magnesia.
2. تستخدم لمعالجة الثلج والغطاء الثلجي كمضاف. نتيجة للتفاعل مع الثلج ، فإنه يسبب ذوبان. ولديها درجة من الخطر الثالث (مواد خطرة معتدلة) وخصائص تآكل عدوانية.
بيكربونات المغنيسيوم - الملح الحمضي من المغنيسيوم وحمض الكربونيك مع الصيغة Mg (HCO 3) 2 ، موجود فقط في المحاليل المائية.
تحصل.
انتقال ثاني أكسيد الكربون من خلال تعليق كربونات المغنيسيوم:
MgCO 3 + CO 2 + H 2 O = Mg (HCO 3) 2
الخصائص الفيزيائية.
يوجد بيكربونات المغنيسيوم فقط في المحاليل المائية.
يسبب وجود بيكربونات المغنيسيوم في الماء صلابة مؤقتة.
الخصائص الكيميائية
عند تركيز المحلول ، تتحلل بيكربونات المغنيسيوم:
Mg (HCO 3) 2 = MgCO 3 + CO 2 - + H 2 O
المغنيسيوم Hydrophosphate (فوسفات المغنيسيوم المنفرط) - وهو ملح حمضي من المغنيسيوم وحمض الفوسفوريك مع الصيغة MgHPO 4 ، ذوبان قليل في الماء ، يشكل هيدرات بلورية.
تحصل.
تأثير حمض الفوسفوريك على أكسيد الماغنسيوم أو كربونات المغنيسيوم:
MgO + H 3 PO 4 = MgHPO 4 + H 2 O
MgCO 3 + H 3 PO 4 = MgHPO 4 + CO 2 - + H 2 O
عمل orthophosphate الصوديوم disfstituted على كلوريد المغنيسيوم:
MgCl 2 + 2Na 2 HPO 4 = MgHPO 4 + 2NaCl
تحلل المغنيسيوم فوسفات الهيدروجين:
Mg (H 2 PO 4) 2 = MgHPO 4 + H 3 PO 4
الخصائص الفيزيائية.
يشكل فوسفات الهيدروجين المغنيسيوم بلورات بيضاء ، وهي هيدرات بلورية: عند درجات حرارة تصل إلى 225 درجة مئوية ، يتم تكوين مونوهيدرات MgHPO4. H2O ، كثافة 2.32 جم / سم مكعب ، عند درجة حرارة 36 ° مئوية ، يتم تكوين ثلاثي هيدرات الميغبو 4. 3H 2 O، density 2.10 g / cm³، with درجة حرارة الغرفة يتم تشكيل MgHPO4 heptahydrate. 7 س 2 س.
الخصائص الكيميائية.
عندما يسخن يذهب إلى بيروفسفات:
التطبيق.
تستخدم في المكملات الغذائية E343.
المغنيسيوم هيدروجين فوسفات - الملح الحامضي لمعدن المغنيسيوم وحمض orthophosphoric مع الصيغة Mg (H 2 PO 4) 2 ، بلورات استرطابية عديمة اللون ، قابلة للذوبان في الماء ، تشكل هيدرات بلورية.
تحصل.
حل هيدروكسيد أو أكسيد المغنيسيوم في حامض الفوسفوريك:
الخصائص الفيزيائية.
يشكل فوسفات هيدروجين المغنيسيوم بلورات عديمة اللون.
تكوين هيدرات بلورية مشكلة من Mg (H 2 PO 4) 2. nH 2 O ، حيث n = 2 ، 4 ، 6.
كربيد الماغنسيوم - مركب ثنائي غير عضوي من المغنيسيوم والكربون مع الصيغة MgС 2. يعرف أيضا كربيد المغنيسيوم مع الصيغة Mg 2 C.
تحصل.
تلبيد المغنيسيوم الفلوريد وكربيد الكالسيوم:
يتدفق الأسيتيلين على مسحوق المغنيسيوم:
من خلال استعادة البنتان مع مسحوق المغنيسيوم عند 650 درجة مئوية ، يمكن الحصول على كربيد Mg 2 C 3 الأكثر تعقيدًا.
الخصائص الكيميائية.
عندما تتحلل ساخنة مع تشكيل كربيد المتوسطة Mg2C3:
تتفاعل مع الماء:
كربونات المغنيسيوم، كربونات المغنيسيوم ، MgCO 3 - ملح المغنيسيوم لحمض الكربونيك.
خصائص.
بلورات بيضاء ، كثافة 3،037 جم / سم ³. عند 500 درجة مئوية ، من الملاحظ ، وعند 650 درجة مئوية يتحلل بالكامل إلى MgO و CO2. إن ذوبانية كربونات الماغنسيوم في الماء غير ذات أهمية (22 مغ / ل عند 25 درجة مئوية) وتقل مع زيادة درجة الحرارة. عندما يكون ثاني أكسيد الكربون مشبعًا بتعليق مائي لـ MgCO 3 ، يتم إذابة الأخير بسبب تكوين بيكربونات Mg (HCO 3) 2. من المحاليل المائية في غياب فائض من ثاني أكسيد الكربون ، تنبعث كربونات المغنيسيوم الأساسية. مع كربونات عدد من المعادن ، تشكل كربونات الماغنسيوم أملاحًا مزدوجة ، والتي تشمل الدولوميت المعدنية الطبيعية MgCO 3 · CaCO 3.
الانتشار في الطبيعة.
يتم توزيع كربونات الماغنيسيوم على نطاق واسع في الطبيعة على شكل المغنسيت المعدني.
التطبيق.
يتم استخدام كربونات المغنيسيوم الأساسية 3MgCO 3 · Mg (OH) 2 · 3H 2 O (ما يسمى ب magnesia الأبيض) كمواد حشو في مركبات المطاط لتصنيع مواد العزل الحراري.
كربونات الماغنيسيوم ضرورية في إنتاج الزجاج والأسمنت والطوب.
نترات المغنيسيوم المغنيسيوم (NO 3) 2 - بلورات استرطابي عديم اللون مع شعرية مكعب. نقطة انصهار 426 درجة مئوية (مع التحلل). القابلية للذوبان في الماء (غرام لكل 100 غرام): 73.3 (20 درجة مئوية) ، 81.2 (40 درجة مئوية) ، 91.9 (60 درجة مئوية). أيضا قابل للذوبان في الإيثانول ، الميثانول ، السائل NH3. اعتمادا على التركيز ، يتبلور nona و hexa و dihydrates من المحاليل المائية.
مكون من الأسمدة المعقدة ، لأن المغنيسيوم هو جزء من الكلوروفيل ، وهو أمر ضروري لعملية التمثيل الضوئي ، ويزيد من نشاط العديد من الانزيمات ويعمل بمثابة الناقل الفوسفور. إن قابلية الذوبان العالية والموصلية الكهربية المنخفضة تجعل المنتج مناسبًا جدًا للتغذية الورقية والتسميد ، خاصة عند استخدام مياه الري بتركيز عالٍ من الملح. يستخدم الأسمدة لجذور والتغذية الورقية من الخضار والتوت ومحاصيل الفاكهة والعنب. مؤكسد في التراكيب النارية.
تفحيم- التشبع من أي حل مع ثاني أكسيد الكربون. تستخدم في البناء.
يتم استبدال الكربونات المعدنية - حمض السيليك في السيليكات بحمض الكربونيك لتشكيل كربونات. من الكربونات ، المعدن لتشكيل الصخور في الصخور الرسوبية هو الكالسيت (spider spar) CaCO3. المغنسيت - MgCO3 والدولوميت - CaMg (CO3) 2 هي أقل شيوعا. ال مياه نظيفةلا تحتوي على الكربونات ، وتذوب في كمية صغيرة (0.03 غرام لكل لتر من الماء) ؛ المغنسيت غير قابل للذوبان عمليا. إذا كان الماء يحتوي على ثاني أكسيد الكربون ، يذوب الكالسيت بسهولة مع تكوين كربونات الكالسيوم الحمضية ، قابل للذوبان في الماء - Ca (HCO3) 2.
الكربنة هو التغيير الذي يحدث في الخرسانة على الأسمنت البورتلاندي عندما تتعرض للهواء C02. يتأثر بشكل خاص هيدروكسيد الكالسيوم Ca (OH) 2 في وجود الرطوبة. يتم تحويل هيدروكسيد الكالسيوم إلى كربونات الكالسيوم عندما يمتص ثاني أكسيد الكربون. كربونات الكالسيوم غير قابلة للذوبان في الماء بشكل سيئ ، ونتيجة لذلك ، يميل إلى إغلاق المسام بإحكام على سطح الخرسانة (بمعنى الخرسانة الكثيفة والمضادة للماء).
عادة ، يتراوح الرقم الهيدروجيني لمياه المسام في الخرسانة من 10.5 إلى 11.5. إذا كان بسبب الكربنة فإنه ينخفض إلى 9 وأقل ، ثم من الممكن للتآكل من التعزيز. ولذلك ، فإن سمك الطبقة المتفحمة عامل مهم في حماية التعزيز: كلما كان الكربنة أعمق ، كلما زاد خطر تآكل الصلب. يمكن تحديد عمق الكربنة عن طريق معالجة الخرسانة مع الفينول فثالين. يشار إلى وجود خصائص قلوية تحت تأثير الفينول فثالين بمظهر لون وردي ، بينما يحتفظ الخرسانة الخرسانية بلونها الأصلي.
تخضع الخرسانة الكثيفة عالية الجودة للكربنة ببطء شديد. من غير المحتمل أن تتم ملاحظة الكربنة بعمق أكثر من 5-10 ملم حتى بعد العملية لمدة 50 سنة. من ناحية أخرى ، فإن عمق الكربنة للخرسانة منخفضة القوة يمكن أن تصل إلى 25 ملم في أقل من 10 سنوات. تظهر التجربة أن المنتجات الخرسانية منخفضة الجودة معرضة بشكل خاص للكربنة.
- خصائص عنصر الكالسيوم: البنية الإلكترونية ، حالات الأكسدة المحتملة ، المركبات الرئيسية: أكسيد ، هيدروكسيد ، أملاح.
الكلسيوم - عنصر من المجموعة الفرعية الرئيسية من المجموعة الثانية ، وهي الفترة الرابعة من الجدول الدوري للعناصر الكيميائية DI Mendeleev ، مع العدد الذري 20. ويرمز له بالرمز Ca (lat. Calcium). البنية الإلكترونية 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 = [18 Ar] 4s 2، state oxidation state +2، 0. تشير إلى معادن الأرض القلوية.
مادة بسيطة الكالسيوم هو معدن قلوي ناعم وناشط كيميائيا من اللون الأبيض الفضي. الإنتاج الصناعي: التحليل الكهربائي لكلوريد الكالسيوم المصهور.
أكسيد الكالسيوم CaO - الأكسيد الأساسي ، الجير الحي. أبيض ، استرطابي. مقاومة للحرارة ، غير مستقرة حراريا ، متقلبة أثناء الاشتعال. تتفاعل بقوة مع الماء (مع تأثير إكسو عالي) ، وتشكل محلول قلوي قوي ، وتسمى العملية بالخمور الجير. يتفاعل مع الأحماض ، أكاسيد المعادن ، غير المعادن. يتم استخدامه لتجميع مركبات الكالسيوم الأخرى ، وهي جزء من مواد التجليد في البناء.
الإنتاج في الصناعة - إطلاق الحجر الجيري (900 - 1200 o C)
هيدروكسيد الكالسيوم Ca (OH) 2 - الجير المطفأ ، هيدروكسيد أساسي. متحللة مع التدفئة المعتدلة. أبيض ، استرطابي. يمتص الرطوبة وثاني أكسيد الكربون من الهواء. ذوبان قليلا في البرد. الماء ، حتى أقل - في الماء المغلي. يصبح الحل الواضح (ماء الجير) غائما بسرعة بسبب هطول هيدروكسيد (يسمى التعليق بحليب الليمون). التفاعل النوعي هو انتقال ثاني أكسيد الكربون من خلال ماء الجير مع ظهور رواسب CaCO3 وانتقالها إلى محلول. يتفاعل مع الأحماض وأكاسيد الحمض ، ويدخل في تفاعلات التبادل الأيوني.
يتم استخدامه في البناء لإعداد ملاط الجير (الرمل + الجير المطفأ + الماء) ، والتي تعمل بمثابة مادة الترابط للحجر والطوب ، والانتهاء من (التجصيص) الجدران وأغراض البناء الأخرى. يرجع تراكم هذه المحاليل إلى امتصاص ثاني أكسيد الكربون من الهواء.
Ca (OH) 2 + CO 2 → CaCO 3 ↓ + H 2 O
Ca (OH) 2 + H 2 SO 4 → CaSO 4 + 2H 2 O،
يتفاعل مع الأملاح إذا كانت أشكال راسب:
Ca (OH) 2 + Na 2 SO 3 → CaSO 3 ↓ + 2NaOH
أملاح الكالسيوم.
كبريتات الكالسيوم (CaSO 4) - مركب غير عضوي ، ملح الكالسيوم لحمض الكبريتيك.
هل توجد في الطبيعة على أنها جراثيم CaSO 4؟ 2H 2 O (الجبس ، السيلينيت) وفي الحالة اللامائية - أنهيدريت.
كلوريد الكالسيوم، CaCl2 - ملح الكالسيوم من حمض الهيدروكلوريك.
يمتلك خصائص استرطابي عالية. الذوبان (غرام لكل 100 غرام H2O): 74 (20 درجة مئوية) و 159 (100 درجة مئوية). تتجمد المحاليل المائية لكلوريد الكالسيوم عند درجات حرارة منخفضة (20٪ عند -18.57 درجة مئوية ، و 30٪ عند -48 درجة مئوية).
يشكل هيدرات من CaCl2 · 6H2O ، ثابت حتى 29.8 درجة مئوية ؛ عند درجات حرارة أعلى ، تتساقط الهيدرات البلورية مع جزيئات 4 و 2 و 1 H2O من المحلول المشبع. عندما يتم خلط CaCl2 * 6H2O (58.8 ٪) مع الثلج أو الثلج (41.2 ٪) ، تنخفض درجة الحرارة إلى -55 درجة مئوية (نقطة cryohydrate).
يتم الحصول على كلوريد الكالسيوم كمنتج ثانوي في إنتاج الصودا.
في المختبر الكيميائي ، يستخدم كلوريد الكالسيوم كملء لأنابيب التجفيف ، ويسمى أيضا كلوريد الكالسيوم ، ويقصد بعزل المواد الموجودة في الوعاء من بخار الماء في الغلاف الجوي ومن أجل غازات التجفيف.
كما يستخدم كلوريد الكالسيوم كمسارع لوضع الأسمنت.
كربونات الكالسيوم (كربونات الكالسيوم) - مركب كيميائي غير عضوي ، ملح حمض الكربونيك والكالسيوم. الصيغة الكيميائية —CaCO 3. في الطبيعة ، وجدت في شكل المعادن - الكالسيت ، الأراجونيت و vaterite ، هو المكون الرئيسي للحجر الجيري والرخام والطباشير ، هو جزء من وعاء من البيض. غير قابلة للذوبان في الماء والايثانول.
المعجون ، ومانعات التسرب المختلفة - كل منها تحتوي على كربونات الكالسيوم بكميات كبيرة. أيضا ، كربونات الكالسيوم هو عنصر أساسي في إنتاج المواد الكيميائية المنزلية.
كما يستخدم كربونات الكالسيوم على نطاق واسع في أنظمة التنقية ، كوسيلة لمكافحة التلوث البيئي ، بمساعدة من كربونات الكالسيوم لاستعادة توازن الحمض القاعدي للتربة.
- أمثلة توضح استخدام أكاسيد وهيدروكسيدات الكالسيوم والمغنيسيوم في البناء.
أكسيد الكالسيوم والهيدروكسيد:
عند غسل الغرف.
عند غسل الأسوار الخشبية والعوارض الخشبية المتلألئة - للحماية من التعفن والنار.
لإعداد هاون الجير. وقد استخدم الجير لبناء البناء منذ العصور القديمة. يتم تحضير الخليط عادة بهذه النسبة: يتم إضافة ثلاثة أو أربعة أجزاء من الرمل (بالوزن) إلى جزء واحد من خليط من هيدروكسيد الكالسيوم (الماء الجير) والماء. عندما يحدث هذا ، يتصلب الخليط بواسطة التفاعل: Ca (OH) 2 + CO2 → CaCO3 ↓ + H2O. هذا هو تفاعل طارد للحرارة ، وإطلاق الطاقة هو 27 سعرة حرارية (113 كيلوجول).
كما يتبين من التفاعل ، يتم إطلاق المياه أثناء ذلك. هذا هو عامل سلبي ، لأنه في الغرف التي بنيت مع هاون الجير ، وتستمر الرطوبة العالية لفترة طويلة. في هذا الصدد ، وكذلك بسبب عدد من المزايا الأخرى على هيدروكسيد الكالسيوم ، فقد حل الاسمنت محلها عمليًا كمحفز لبناء الحلول. علاوة على ذلك ، من غير المقبول أيضًا استخدامه عند وضع المواقد ، لأنه تحت تأثير درجات الحرارة المرتفعة ، يتم إطلاق ثاني أكسيد الكربون الخانق.
لإعداد الخرسانة سيليكات. يتطابق تركيب خرسانة السليكات مع تركيبة المونة الجيرية ؛ ومع ذلك ، يتم تحضيرها بواسطة طريقة أخرى - حيث لا يتم معالجة خليط من أكسيد الكالسيوم ورمل الكوارتز بالماء ، ولكن مع بخار ماء فائق الحرارة (174.5-197.4 درجة مئوية) في الأوتوكلاف عند ضغط 9-15 الغلاف الجوي.
في تصنيع الطوب سيليكات.
أوكسيد وهيدروكسيد المغنيسيوم:
لإنتاج أنظمة مشتركة من المواد الحرارية (ألواح البناء المغنسيت) ، لإنتاج الأسمنت. يستخدم أكسيد المغنسيوم (المغنسيت الكاوية) كمواد رابطة ، والتي ، عند مزجه بمحلول MgCl2 ، تكون قادرة على التصلب بسرعة واكتساب القوة في الهواء.
- صلابة المياه الطبيعية: التعريف ، أنواع الصلابة ، طرق إزالة صلادة الماء: فيزيائية ، كيميائية (معادلات تفاعل) ، فيزيائية كيميائية.
وتسمى المياه الطبيعية التي تحتوي على كمية كبيرة من أملاح الكالسيوم أو الماغنسيوم في محلول ما بالماء العسر مقارنة بالمياه الناعمة التي تحتوي على القليل من أملاح الكالسيوم والمغنيسيوم أو بدونها.
يرجع السبب الأول إلى وجود بيكربونات الكالسيوم والمغنيسيوم ، والثاني لوجود أملاح الأحماض القوية ، والكبريتات أو الكلوريدات من الكالسيوم والمغنيسيوم. مع غليان الماء لفترة طويلة مع صلابة كربونات ، يظهر راسب في ذلك ، يتكون أساسا من CaCO3 ، وفي نفس الوقت يتم إطلاق CO2.
كل من هذه المواد تظهر نتيجة لتحلل كربونات الكالسيوم:
لذلك ، يسمى صلابة الكربونات أيضًا بالتصلب المؤقت. من الناحية الكمية ، تتميز الصلابة المؤقتة بمحتوى بيكربونات تم إزالتها من الماء عندما يتم غليها لمدة ساعة. يسمى الصلابة المتبقية بعد هذا الغليان صلابة ثابتة.
يعبر عن صلابة المياه بمجموع ملايين الدنا من الكالسيوم وأيونات المغنيسيوم الموجودة في الماء. واحد من مكاييل صلابة يتطابق مع محتوى 20.04 ملغ / لتر أو 12.16 ملغ / لتر.
تختلف صلابة المياه الطبيعية على نطاق واسع. يختلف في الخزانات المختلفة ، وفي نفس النهر يختلف طوال العام (الحد الأدنى خلال الفيضان). صلابة مياه البحار أعلى بكثير من الأنهار والبحيرات. وبالتالي ، فإن مياه البحر الأسود لديها صلابة إجمالية تبلغ 65.5 ملي / لتر. وتبلغ القيمة المتوسطة لصلابة مياه المحيط في العالم 130.5 مْك / لتر (بما في ذلك 22.5 مْك / لتر لكل م 2 / لتر).
إن وجود كمية كبيرة من أملاح الكالسيوم أو الماغنسيوم في الماء يجعل المياه غير مناسبة للعديد من الأغراض الفنية. وهكذا ، مع إطعام لفترات طويلة من المراجل البخارية بالماء العسر ، تصبح جدرانها تدريجيا مغطاة بقشرة كثيفة من nakiii. مثل هذه القشرة الموجودة بالفعل عند سمك الطبقة تقلل إلى حد كبير نقل الحرارة عن طريق جدران المرجل ، وبالتالي تؤدي إلى زيادة في استهلاك الوقود. بالإضافة إلى ذلك ، يمكن أن يسبب تقرحات وتكسير في كل من أنابيب التدفئة وعلى جدران المرجل نفسها.
الماء العسر لا رغوة الصابون منذ الصابون الواردة في أملاح الصوديوم ذوبان -palmitinovoy والأحماض الدهنية دهني - تتحول إلى أملاح الكالسيوم غير قابلة للذوبان من نفس الأحماض:
لا يمكن استخدام الماء العسر عند تنفيذ بعض العمليات التكنولوجية ، على سبيل المثال ، عند الصباغة.
يرجع الصلابة المستمرة للماء إلى وجود الكبريتات والكلوريدات في الغالب من الكالسيوم والمغنيسيوم ولا يتم التخلص منها بالغليان. مجموع الصلابة (القابلة للإزالة) المؤقتة والثابتة هو صلابة الماء الكلية.
هناك طرق مختلفة لتحديد الصلابة.
فكر في اثنين منهم:
1) تحديد الصلابة الزمنية باستخدام محلول معاير لحمض الهيدروكلوريك
2) طريقة complexometric لتحديد مجموع الصلابة.
خلال المعايرة لعينة من الماء مع حمض الهيدروكلوريك في وجود برتقال الميثيل ، يحدث تحلل البيكربونات ، مما يسبب صلابة مؤقتة:
طريقة التحديد. تؤخذ 100 مل من ماء الاختبار في قارورة مخروطية مع ماصة أو اسطوانة قياس ، تتم إضافة 2-3 قطرات من برتقال الميثيل ومعايرتها مع 0.1 و. حل HCl حتى يظهر اللون البرتقالي.
تحليل نتيجة الحساب. 1 مل 0.1 ن. يتوافق محلول HCl مع 0.1 / 1000 g-eq أو 0.1 mg-eq Ca 2+. V (HCl) يتوافق مع 0.1 V (HCl) / 1000 g-eq أو 0.1 V (HCl) mg-eq Ca 2+. 0،1 V (HCl) mEq في حجم V A. للتعبير عن صلابة في حكمه مليغرام لكل 1 لتر من الماء، فإنه لا بد من تقسيم الحصول على قيمة V ألف ومضروبا 1000، وهذا هو، ويجري التحقيق جمود الماء ..:
![]()
طرق القضاء.
تليين حراري. بناء على غليان الماء ، ونتيجة لالكربونات والماغنسيوم غير مستقرة حراريا تتحلل مع تشكيل مقياس:
Ca (HCO3) 2 → CaCO3 ↓ + CO2 + H2O.
الغليان يزيل فقط صلابة (كربونات) مؤقتة. يجد التطبيق في الحياة.
تخفيف الكاشف. تعتمد الطريقة على إضافة رماد الصودا Na2CO3 أو الجير المائي Ca (OH) 2 إلى الماء. في نفس الوقت ، تمر أملاح الكالسيوم والمغنيسيوم إلى مركبات غير قابلة للذوبان ، ونتيجة لذلك ، تترسب.
على سبيل المثال ، يؤدي إضافة الجير المطفأ إلى تحويل أملاح الكالسيوم إلى كربونات غير قابلة للذوبان:
Ca (HCO3) 2 + Ca (OH) 2 → 2CaCO3 ↓ + 2H2O
يعتبر كاشف الصوديوم Na3PO4 هو أفضل كاشف لإزالة القساوة الكلية للمياه ، وهو جزء من معظم المنتجات المنزلية والصناعية:
3Ca (HCO3) 2 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 6NaHCO3
3MgSO4 + 2Na3PO4 → Mg3 (PO4) 2 ↓ + 3Na2SO4
الكالسيوم والمغنيسيوم orthophosphates ذوبان ضعيفة جدا في الماء ، وبالتالي فصل بسهولة عن طريق الترشيح الميكانيكية. هذه الطريقة مبررة باستهلاك مرتفع نسبيا للمياه ، حيث أنها تنطوي على حل عدد من المشاكل المحددة: الترشيح الرواسب ، جرعة كاشف دقيقة.
تبادل الأيونات الموجبة. وتستند هذه الطريقة على استخدام التحميل الحبيبي التبادل الأيوني (في معظم الأحيان راتنجات التبادل الأيوني). هذا الحمل على اتصال مع الماء يمتص الكاتيونات من الأملاح صلابة (الكالسيوم والمغنيسيوم والحديد والمنجنيز). بدلا من ذلك ، اعتمادا على الشكل الأيوني ، فإنه يعطي أيونات الصوديوم أو الهيدروجين. هذه الأساليب على التوالي تسمى Na-cationization و H-cationization. مع تحميل التبادل الأيوني المختار بشكل صحيح ، تنخفض صلابة المياه مع كاتيونات الصوديوم أحادية المرحلة إلى 0.05-0.1 ° غرب ، مع التحميل على مرحلتين - إلى 0.01 درجة مئوية. في الصناعة ، تقوم فلاتر التبادل الأيوني باستبدال أيونات الكالسيوم والمغنيسيوم بأيونات الصوديوم والبوتاسيوم ، مما ينتج ماءًا نقيًا.
التناضح العكسي. وتستند هذه الطريقة على مرور المياه من خلال غشاء نصف نافذ (عادة مادة البولي أميد). جنبا إلى جنب مع أملاح الصلابة ، يتم إزالة معظم الأملاح الأخرى. يمكن أن تصل كفاءة التنظيف إلى 99.9٪.
هناك nanofiltration (القطر الاسمي لثقوب الغشاء يساوي وحدات نانومتر) و picofiltration (القطر الاسمي لثقوب الغشاء يساوي وحدات picometers).
وينبغي ملاحظة مساوئ هذه الطريقة:
الحاجة إلى المعالجة المسبقة للمياه الموردة لغشاء التناضح العكسي ؛
التكلفة العالية نسبياً 1 لتر من المياه المنتجة (معدات باهظة الثمن ، أغشية باهظة الثمن) ؛
تمعدن منخفض للمياه المنتجة (خاصة عندما تكون picofiltration). يصبح الماء مقطرًا تقريبًا.
الكهربي. يقوم على إزالة الأملاح من الماء تحت تأثير حقل كهربائي. إزالة الأيونات من المواد الذائبة تحدث بسبب الأغشية الخاصة. كما هو الحال مع استخدام تقنية التناضح العكسي ، يحدث إزالة الأملاح الأخرى ، بالإضافة إلى أيونات الصلابة.
يمكن تقطير المياه النظيفة بالكامل من أملاح الصلابة.
