الصيغة الكيميائية لحمض الكبريتيك. حامض الكبريتيك: الخصائص الكيميائية ، التحضير
H2SO3 ، ضعيف حمض ثنائي القاعدة. في شكل حر لا يتم تخصيصه ، موجود في حلول المياه. كبريتات حمض الكبريتيك ... قاموس موسوعي كبير
حامض الكبريتيك - (H2SO3) ضعيف حمض ثنائي القاعدة. موجود فقط في المحاليل المائية. الأملاح S. إلى. تطبق في ورقة اللب وصناعة المواد الغذائية. انظر أيضا الأحماض والأنهيدريدات ... الموسوعة الروسية حول حماية العمال
حمض الكبريتيك - - [A.S. غولدبرغ. قاموس الطاقة الروسي. 2006] مواضيع الطاقة بشكل عام EN حامض الكبريت ... دليل المترجم التقني
H2SO3 ، ضعيف حمض ثنائي القاعدة. في شكل حر لا يتم تخصيصه ، موجود في حلول المياه. كبريتيت حامض الكبريتيك. * * * حامض الكبريتيك ، حامض الكبريتيك ، H2SO3 ، ضعيف حمض ثنائي القاعدة. لم يتم تحديد Free، ... ... القاموس الموسوعي
حمض الكبريتيك - sulfito rūgštis statusas T sritis chemija formulė HėSO₃ atitikmenys: angl. حمض الكبريت روس. ryšiai حامض الكبريتيك: sinonimas - vandenilio trioksosulfatas (2 -) ... Chemijos terminų aiškinamasis žodynas
H2SO3 ، ضعيف حمض ثنائي القاعدة ، المقابلة لدرجة أكسدة الكبريت +4. معروف فقط في المحاليل المائية المخففة. ثوابت التفكك: K1 = 1.6 · 10 2 ، K2 = 1.0 · 10 7 (18 ° C). يعطي صفان من الأملاح: السلفيت العادي والحامض ... ... الموسوعة السوفييتية الكبرى
H2SO3 ، ضعيف حمض ثنائي القاعدة. في شكل حر لا يبرز ، فهو موجود في المياه. p rah. الأملاح S. ك. Sulfites ... العلوم الطبيعية. القاموس الموسوعي
انظر الكبريت ... القاموس الموسوعي للاتحاد الانجليزي Brockhaus و I.A. إيفرون
يتكون ثاني أكسيد الكبريت (ثاني أكسيد) عن طريق حرق الكبريت في الهواء أو الأكسجين. كما يتم الحصول عليها عن طريق التكليس في الهواء ("حرق") الكبريتيدات من المعادن ، على سبيل المثال ، بيريت الحديد:
وفقا لهذا التفاعل ، يتم الحصول على ثاني أكسيد الكبريت عادة في الصناعة (للطرق الصناعية الأخرى للحصول على سم ، 9 § 131).
ثاني أكسيد الكبريت هو غاز عديم اللون ("ثاني أكسيد الكبريت") مع مجموعة حادة من الكبريت الساخن. يتكثف بسهولة إلى سائل عديم اللون يغلي في. عندما يتبخر السائل ، يحدث انخفاض قوي في درجة الحرارة (قبل).
ثاني أكسيد الكبريت ذوباني بدرجة عالية في الماء (حوالي 40 مجلداً في 1 حجم من الماء في) ؛ في نفس الوقت ، يحدث التفاعل مع الماء جزئيا ويتم تشكيل حامض الكبريت:
وبالتالي ، ثاني أكسيد الكبريت هو أنهيدريد الكبريتيك. عند تسخينها ، تنخفض الذوبانية وينتقل التوازن إلى اليسار ؛ تدريجيا يتم الافراج عن جميع ثاني أكسيد الكبريت من الحل مرة أخرى.
يبنى الجزيء بشكل مشابه لجزيء الأوزون. تشكل نوى الذرات المكونة له مثلث متساوي الساقين:
هنا ، تكون ذرة الكبريت ، مثل ذرة الأوكسجين المركزي في جزيء الأوزون ، في حالة التهجين α وتقرب الزاوية إليها. موجه على عمودي على مستوى الجزيء ، لا يشارك المدار من ذرة الكبريت في التهجين. وبسبب هذه المدارات والموجهات المدارية المشابهة لذرات الأكسجين ، يتم تكوين رابطة ثلاثية المركز ؛ ينتمي زوج الإلكترون الذي يحمله إلى جميع الذرات الثلاث للجزيء.
يستخدم ثاني أكسيد الكبريت لإنتاج حامض الكبريتيك ، وأيضا (بكميات أقل بكثير) لتبييض القش والصوف والحرير وكمواد مطهرة (لتدمير فطريات العفن في الأقبية والأقبية وبراميل النبيذ وخزانات التخمير).
حمض الكبريتيك هو مركب هش للغاية. هو معروف فقط في المحاليل المائية. عند محاولة عزل حمض الكبريت ، فإنه يتفكك في الماء. على سبيل المثال ، عندما يعمل حمض الكبريتيك المركز على كبريتيت الصوديوم ، يتم إطلاق ثاني أكسيد الكبريت بدلاً من حمض الكبريت:
يجب حماية محاليل حامض الكبريتيك من الهواء ، وإلا فإنه يمتص الأوكسجين من الهواء ، ثم يتأكسد ببطء إلى حامض الكبريتيك:
حامض الكبريتيك هو عامل مختزل جيد. على سبيل المثال ، يتم استعادة الهالوجينات الحرة به إلى هاليدات الهيدروجين:
![]()
ومع ذلك ، عند التفاعل مع عوامل الاختزال القوية ، قد يلعب حمض الكبريتيك دور عامل مؤكسد. لذا ، فإن تفاعله مع كبريتيد الهيدروجين يستمر بشكل أساسي وفقًا للمعادلة:
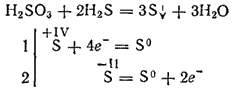
كونه حامض ثنائي الفوسفات ، فإن حامض الكبريت يشكل صفين من الأملاح. أملاحها المتوسطة تسمى الكبريتات وأملاح الحمض - hydrosulfites.
مثل الأحماض ، الكبريتات و hydrosulfites تقلل العوامل. عندما يتم أكسدتها ، يتم الحصول على أملاح حمض الكبريتيك.
يتحلل كبريتات الفلزات الأكثر نشاطًا أثناء التكليس بتشكيل الكبريتيدات والكبريتات (تفاعل الأكسدة الذاتية - التقليل الذاتي):
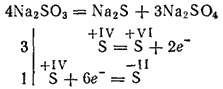
يستخدم البوتاسيوم وكبريتات الصوديوم لتبييض بعض المواد في صناعة النسيج لصبغ الأقمشة ، في التصوير الفوتوغرافي. يتم استخدام المحلول (هذا الملح فقط في المحلول) لمعالجة الخشب في ما يسمى بلب السلفيت ، ومن ثم يتم الحصول على الورق منه.
حامض الكبريت قادر على التفاعل مع الأكسجين. هذا يشكل حمض الكبريتيك. يستغرق هذا التفاعل وقتًا طويلاً للغاية ولا يمكن تحقيقه إلا في حالة انتهاك قواعد التخزين. يحتوي حامض الكبريتيك على خصائص مؤكسدة وخافضة. بمساعدتها يمكنك الحصول على أحماض الهالوجين. محلول مائي عند التفاعل مع الكلور يشكل حمض الهيدروكلوريك وحامض الكبريتيك.
عند التفاعل مع عوامل الاختزال القوية ، يلعب حمض الكبريت دور العامل المؤكسد. واحد من هذه المواد هو كبريتيد الهيدروجين ، وهو غاز ذو رائحة كريهة للغاية. التفاعل مع محلول مائي من حامض الكبريتيك ، فإنه يشكل الكبريت والماء. أملاح حامض الكبريتيك لها أيضا خصائص خفض. وتنقسم إلى الكبريتات والهيدروسلفايت. تنتج تفاعلات الأكسدة لهذه الأملاح حمض الكبريتيك.
إنتاج حامض الكبريتيك
ويتكون حمض الكبريتيك فقط من تفاعل ثاني أكسيد الكبريت والماء. بحاجة للحصول على الغاز الحامض. ويمكن القيام بذلك مع النحاس وحمض الكبريتيك. صب بلطف حامض الكبريتيك المركز في الأنبوب ورمي قطعة من النحاس في ذلك. تسخين الأنبوب مع مصباح الروح.
نتيجة للتسخين ، يتم تكوين كبريتات النحاس (كبريتات النحاس) ، ويتم تشكيل الماء وثاني أكسيد الكبريت ، والذي يجب تقديمه مع أنبوب خاص إلى المخروط. المياه واضحة. بهذه الطريقة ، يمكن الحصول على حامض الكبريتيك.
تذكر أن ثاني أكسيد الكبريت ضار بالبشر. يسبب تلف مجرى الهواء وفقدان الشهية والصداع. الاستنشاق لفترات طويلة قد يسبب الإغماء. عند العمل معه تحتاج إلى الحذر.
استخدام حمض الكبريتيك
يحتوي حامض الكبريتيك على خصائص مطهرة. يتم استخدامه في تطهير الأسطح ، تخمير الحبوب. يمكن استخدامه لتبييض بعض المواد التي تتحلل عندما تتفاعل مع المؤكسدات القوية (على سبيل المثال ، الكلور). وتشمل هذه المواد الصوف والحرير والورق وبعضها الآخر. وتستخدم خصائصه المضادة للبكتيريا لمنع تخمر النبيذ في براميل. وهكذا ، يمكن تخزين مشروب النبيل لفترة طويلة جدا ، والحصول على طعم النبيل ورائحة فريدة من نوعها.
يستخدم حامض الكبريتيك في صناعة الورق. يتم تضمين إضافة هذا الحمض في تكنولوجيا إنتاج لباب السلفيت. ثم يتم معالجتها بمحلول من hydrosulfite الكالسيوم لربط الألياف معًا.
