Metall bo'lmagan misollarning genetik qatorlari. Moddalarning sinflari orasidagi genetik aloqalar - Knowledge Hypermarket
Oddiy moddalar, oksidlar, bazlar, kislotalar va tuzlar o'rtasida ularning o'zaro almashinuvi (transformation) mavjudligi bilan genetik bog'lanish mavjud.
Misol uchun, oddiy moddalar - kislorod bilan ta'sir qilish natijasida kaltsiy oksidga aylanadi: 2Ca + O 2 = 2CaO.
Kaltsiy oksidi suv bilan ta'sir o'tkazganda CaO + H 2 O = Ca (OH) 2 hosil qiladi va ikkinchisi kislota bilan ishlaganda tuzga aylanadi: Ca (OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O.
Ushbu o'zgarishlarni sxema bilan ifodalash mumkin:
Ca → CaO → Ca (OH) 2 → CaSO 4
Xuddi shunga o'xshash sxema metall bo'lmagan, masalan, oltingugurt uchun yozilishi mumkin:
S → SO 3 → H 2 SO 4 → CaSO 4
Shunday qilib, bir xil tuz turli yo'llar bilan olinadi.
Tuzdan boshqa noorganik birikmalarga va oddiy moddalarga teskari o'tish ham mumkin:
CuSO 4 → Cu (OH) 2 → CuO → Cu
CuSO 4 + 2NaOH = Cu (OH) 2 ↓ + Na 2 SO 4
Cu (OH) 2 = CuO + H 2 O
CuO + H 2 = Cu + H 2 O (mis qisqarishi)
Noorganik birikmalar sinflari orasidagi o'xshashlik, bir sinfdagi moddalarni boshqa moddalardan ishlab chiqarishga asoslangan, bu genetik deb ataladi.
Murakkab birikmalarning xususiyatlari noorganik birikmalarning asosiy sinflarining genetik sxemasida aks ettiriladi (rasmga qarang). Unda noorganik moddalarning rivojlanish bosqichlari ikkita asosiy yo'nalish bo'yicha, odatiy metalllardan qarama-qarshi xususiyatlarga ega odatiy bo'lmagan metallargacha bo'lgan bosqichlarni aks ettiradi.
Atomning kimyoviy xossalari elektronlar va nodavlat bo'lmagan narsalarni ehson qilish qobiliyatidir. Ularning asosiy kimyoviy xususiyati atomlarning atomlarning elektronlar bir-biriga qarama-qarshi fazilatlarga ega bo'lish qobiliyatidir. Moddalar tarkibining murakkabligi bilan bu qarama qarshi tendentsiyalar paydo bo'ladi.
Odatda metallar va o'tish elementlari eng past oksidlanish holatida asosiy oksidlarni hosil qiladi, yuqori oksidlanish holatida odatiy bo'lmagan metallar va o'tish elementlari esa teskari kislota oksidlarini hosil qiladi.
Oddiy moddalar
Amfoter
Metall bo'lmagan metallar
Asosiy oksidlar
Amfoter
Kislota
Joylar
Amfoter
gidroksidlar
Noorganik birikmalarning asosiy sinflarining genetik sxemasi
Moddalar tarkibining yanada murakkabligi bilan gidroksidlar, asosga mos keladigan tayanch oksidlar va kislotaga mos kislota oksidi hosil bo'ladi. Xususiyatlarga va kislota qarama-qarshi bo'lgan asoslar bir-biri bilan faol reaksiyaga kirishib, tuzlarni hosil qiladi. Qarama-qarshiliklarning o'zaro ta'siri reaktsiyaning harakatlantiruvchi kuchi hisoblanadi. Shuning uchun asosiy va oksidli oksidlar, asoslar va kislotalar faol ravishda bir-biri bilan o'zaro ta'sir o'tkazadi va ularning ikki kislotali oksidi yoki ikki asosiy oksidi o'zaro ta'sir qilmaydi, chunki ularning xususiyatlari yaqin.
Shunday qilib, murakkab tarkibli moddalar uning tarkibiy qismlarining xususiyatlariga qarab belgilanadi. Ushbu funktsiyalarni o'zgartirishning asosiy qonunlari quyida keltirilgan ilovalarda umumlashtiriladi (6-jadval).
1. Bir qator raqami ortib boradigan davrlarda elementlarning xossalari metalldan metalgacha o'zgaradi. Tashqi darajadagi elektronlar soni ortadi, elementning oksidlanish darajasi oshadi, atom va ionning radiusi kamayadi, elektron uchun ionlashtiruvchi energiya va yaqinlik oshadi. Shunga ko'ra oksid va gidroksidlarning asosiy pasayishi va kislotali xossalari ortadi.
2. Asosiy quyi guruhlarda oksid va gidroksidlarning asosiy xossalari ortib borayotgan atom raqamlari bilan ortadi. Rakamlar sonining ortishi bilan yon guruhlarning elementlari uchun xususiyatlarning murakkabligi o'zgarishi xarakterlidir. Birinchidan, metall xususiyatlari yaxshilanib, keyinchalik kamayadi.
3. Faol metalllar kuchli oksid va gidroksidlarga mos keladi. Eng faol metallar alkali va gidroksidi-tuproqdir. Ular suvda eruvchan oksidlar va kuchli eriydigan bazalar hosil qiladi - gidroksidi.
4. Past faol metallar (barchasi gidroksidi va gidroksidi eritmalar) suvda eriydigan zaif bazalarni hosil qiladi:
Cu (OH) 2, Fe (OH) 3 ga asoslangan.
5. Oksidlar va kuchli oksidli xususiyatlarga ega gidroksidlar faol bo'lmagan metallarga mos keladi.
Amfoterik metallar amfoterik oksid va gidroksidlarni hosil qiladi.
7. Agar element turli darajadagi oksidlanishni namoyon qilsa, unda oksidlar va turli xususiyatlarga ega gidroksidlar unga mos keladi.
Mavzu: Metall va metallar va ularning birikmalari orasidagi genetik bog'lanish. 9-sinf
Maqsadlar: ta'lim: "genetik ketma-ketlik", "genetik birikma" tushunchasini mustahkamlash; genetik ketma-ketlikdagi reaktsiya tenglamalarini yaratish uchun elementlarning (metallarning va nometalllarning) genetik ketma-ketligini yaratishni o'rgatish; bilimlarning qanday o'rganilishini nazorat qilish kimyoviy xossalari oksidlar, kislotalar, tuzlar, asoslar: rivojlanish: xulosalarni tahlil qilish, solishtirish, umumlashtirish va xulosa qilish, kimyoviy reaktsiyalar tenglamalarini yaratish; Ta'lim: ilmiy dunyoqarashni shakllantirishga ko'maklashish.
Kurslarni taqdim etish: "Periodik tizim", "Suyultirilganlik jadvali", "Metall faoliyati seriyali", talabalarga ko'rsatmalar, bilimlarni sinash uchun topshiriqlar.
Harakatlaning: 1) Org. onda
2) d / s ni tekshiring
3) Yangi materialni o'rganing
4) siqish
5) D / C
1) Org. onda. Salomlar
2) d / s ni tekshiring.
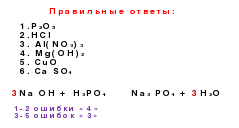
Genetika aloqalari - ularning o'zaro aloqalariga asoslangan turli sinflar o'rtasidagi aloqalardir.
Noorganik moddalarning sinflarini bilish uchun metallarning va nometalllarning genetik qatorini yaratish mumkin. Ushbu seriyalarning asosi bir xil element.
Metalllarning ikkita turi mavjud:
1
. Ba'zan gidroksidi bazaga aylanadigan genetik qator. Ushbu turkum quyidagi o'zgarishlarni qo'llash orqali ifodalanishi mumkin:metall → asosiy oksid → gidroli → tuz
Masalan, K → K
2 O → KOH → KCl2
. Baza tayanch bo'lmasa, genetik ketma-ketlikda ketma-ketlik o'zgarish zanjiri sifatida ifodalanishi mumkin:metall → asosiy oksid → tuz → eruvchan asos →
→asosiy oksid → metall
Masalan, Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu
1
. Eriydigan kislota seriyasidagi bog'lanish sifatida faoliyat ko'rsatadigan nometall bo'lmagan genlarning seriyasi. O'zgarishlar zanjiri quyidagicha ifodalanishi mumkin:metall bo'lmagan → kislota oksidi → eruvchan kislota → tuz
Masalan, P → P
2 O 5 → H 3 PO 4 → Na 3 PO 42
. Eriydigan kislota bo'lmagan qator metall bo'lmagan genlarning seriyasi ketma-ketlikda bog'lanishdir:no metal → oksid kislotasi → tuz → kislota →
→kislota oksidi → metall bo'lmagan
Misol uchun
Si→ Sion 2 → Na 2 Sion 3 → H 2 Sion 3 → Sion 2 → Si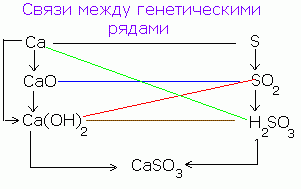
Dastlabki suhbat:
Genetika aloqasi nima? Genetik aloqalar - ularning o'zaro aloqalari asosida turli sinflar orasidagi bog'lanishdir.
Genetika ketma-ketligi - bir qator moddalar - turli kimyoviy elementlarning aralashmalari bo'lgan turli sinflar vakillari, o'zaro aloqalar bilan bog'langan va bu moddalarning o'zgarishini aks ettiruvchi. Ushbu seriyalarning asosi bir xil element.
Qanday turdagi genetik ketma-ketliklarni ajratish mumkin? Metalllarning ikkita turi farqlanishi mumkin:
a) gidroksidi asosi sifatida faoliyat ko'rsatadigan genetik qator. Ushbu turkum quyidagi o'zgarishlarni qo'llash orqali ifodalanishi mumkin:
metall → asosiy oksid → gidroli → tuz
masalan, kaliy K → K genetik seriyali
2 O → KOH → KClb) bazasi eruvchan tayanch bo'lgan genetik ketma-ketlikdir, unda seriya o'zgarish zanjiri sifatida ifodalanishi mumkin:
metall → baz oksidi → tuz → erimaydigan poydevori → asosiy oksid → metall
masalan: Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → CuNon-metallar orasida ikkita satrni ajratish mumkin:
a) Eriydigan kislota ketma-ketlikda bog'lanish sifatida faoliyat yuritadigan nometall bo'lmagan genlarning seriyasi. O'zgarishlar zanjiri quyidagicha ifodalanishi mumkin: metall bo'lmagan → kislota oksidi → eruvchan kislota → tuz.
Masalan: P → P
2 O 5 → H 3 PO 4 → Na 3 PO 4b) erimaydigan kislota bo'lmagan natriyning genetik qatori: metall bo'lmagan → kislota oksidi → tuz → kislota → kislota oksidi → neytral bo'lmagan ketma-ketlikda
Masalan: Si → SiO
2 → Na 2 Sion 3 → H 2 Sion 3 → SiO 2 → SiVazifalar bo'yicha vazifalarni bajarish:
1. Sizning versiyangizdagi oksidli formulalarni tanlang, sizning tanlovingizni tushuntiring, bu aralashmalar sinfining tarkibiy xususiyatlarini bilib oling. Ularni chaqiring.
Variantingizning formula ustunida kislota formulalarini toping va bu birikmalar tarkibini tahlil qilish asosida tanlovingizni tushuntiring.
3. kislota tarkibida kislota qoldiqlarining valentlarini aniqlang.
4. Tuzli formulalarni tanlang va ularni nomlang.
5. Variantingiz magniy va kislotalar bilan tuzilishi mumkin bo'lgan tuzlarning formulalarini tuzing. Ularni yozing, uni yozing.
6. O'zgarishlaringizning ustunli ustunida, asosiy formulalarni toping va bu birikmalar tarkibini tahlil qilish asosida tanlovingizni tushuntiring.
7. O'zingizning variantingiz bo'yicha, ortofosfor kislotasi eritmasi (gidroklorik, oltingugurtli) reaksiyaga kirishishi mumkin bo'lgan moddalarning formulalarini tanlang. Tegishli reaktsiya tenglamalarini bajaring.
9. Sizning variantingizning formulalari orasida bir-biri bilan ta'sirlasha oladigan moddalar formulalarini tanlang. Tegishli reaktsiya tenglamalarini bajaring.
10. Noorganik birikmalarning genetik birikmalariga zanjir hosil qiling, ular tarkibida sizning versiyangizda birinchi raqamda berilgan modda mavjud.
1-variant
Variant 2
Cao
Hno
3Fe (OH)
3N
2 OZN (NO
3 ) 2Cr (OH)
3H
2 SO 3H
2 SPbo
LiOH
Ag
3 PO 4R.
2 O 5NaOH
Zno
CO
2BaCl
2HCl
H
2 CO 3H
2 SO 4Cuso
4Ushbu moddalardan barcha formulalarni ishlatib, genetik chiziq hosil qilish. Reaksiya tenglamalarini yozing, bu bilan siz bu o'zgarishlarni amalga oshiring:
Men variant: ZnSO
4, Zn, ZnO, Zn, Zn (OH) 2 : II variant:Na 2 SO 4, NaOH, Na, Na 2 O 2 , Na 2 O4) ulash 1.
Al→ Al 2 O 3 → AlCl 3 → Al( OH) 3 → Al 2 O 32.
R.→ R. 2 O 5 → H 3 PO 4 → Na 3 PO 4 → Ca 3 ( PO 4 ) 23. Zn → ZnCl
2 → Zn (OH) 2 → ZnO → Zn (NO 3 ) 24. Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu5.N
2 O 5 → HNO 3 → Fe (NO 3 ) 2 → Fe (OH) 2 → FeS → FeSO 45) Topshiriq:
kaltsiydan kaltsiy karbonatiga bosqichma-bosqich o'tish va tibbiyotda biron bir tuzni ishlatish bo'yicha hisobot tayyorlash (qo'shimcha adabiyotlardan foydalanish).

Metalllarning ikkita turi quyidagicha ajralib turadi: 1. Ba'zan gidroksidi bazaga aylanadi. Ushbu ketma-ketlik quyidagi transformatsiyalar bilan ifodalanishi mumkin: metal - asosiy oksidi - gidroksidi tuz, masalan, kaliy K - K 2 O - KOH - KCl genetik seriyasi.

2. Eriydigan bazaning tayanch vazifasini bajaradigan genetik ketma-ketlikda ketma-ketlik o'zgarish zanjiri sifatida ifodalanishi mumkin: metall - asosiy oksid - tuzsiz eritma - asosiy oksid - metall. Cu - CuO - CuCl 2 - Cu (OH) 2 - CuO -\u003e Cu gen misoli mis "Cu - mis genetik bir qatordir"\u003e "title =" (! LANG: 2. Genetika seriyasi, unda eritilmagan eritma, unda seriya konversiyalash zanjiri sifatida ifodalanishi mumkin: metall asosli oksid - tuzsiz eritma - Asosiy oksidi metaldir Cu-CuO- CuCl2-Cu (OH) 2-CuO-\u003e"> title="2. Eriydigan bazaning tayanch vazifasini bajaradigan genetik ketma-ketlikda ketma-ketlik o'zgarish zanjiri sifatida ifodalanishi mumkin: metall - asosiy oksid - tuzsiz eritma - asosiy oksid - metall. Cu-CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e"> !}
Metall bo'lmagan metallar orasida ikkita turni ajratish mumkin: 1. Eriydigan kislota ketma-ketlikda bog'lanish sifatida faoliyat ko'rsatadigan nometall bo'lmagan genlarning seriyasi. O'zgarishlar zanjiri quyidagicha ifodalanishi mumkin: metall bo'lmagan kislota oksidli eruvchan kislota -sol. P - P 2 O 5 - H 3 PO 4 - Na 3 P 4. Fosforning genetik oralig'i

Noorganik birikmalar sinflari orasidagi genetik bog'lanish mavjud. Oddiy moddalardan murakkab va teskarisini olishingiz mumkin. Bir toifadagi birikmalardan boshqa sinfning birikmalarini olishingiz mumkin.
Noorganik moddalar sinflari orasidagi soddalashtirilgan genetik munosabat quyidagi sxema bilan ifodalanishi mumkin:
Non-metallar uchun bunday transformatsiyalar ketma-ketligi quyidagi jadvalda ifodalanishi mumkin: CANPO 4
R → R 2 O 5 → H 3 RO 4 → Ssh 3 (Ro 4) 2
(Saon) 3 PO 4
Odatdagi metallar uchun quyidagi o'zgarishlarni amalga oshiring:
Ba → BaO → Ba (OH) 2 → BaSO 4
Oksid va gidroksidi amfoterik (semimetal) bo'lgan metallar uchun quyidagi transformatsiyalar amalga oshirilishi mumkin:
Al → Al 2 O 3 → Al (OH) 3 → Na → AlCl 3 → AlOHCI 2 → Al (OH) 3 → Al 2 O 3.
Sinflar o'rtasidagi aloqalar:
1. Metall, metall bo'lmagan→ tuz.
Metall va metall bo'lmagan to'g'ridan-to'g'ri shovqin bilan kislorodsiz kislotalarning tuzlari (halidlar, sulfidlar) hosil bo'ladi:
2Na + C1 2 = 2NaCl
Ushbu birikmalar barqaror va qizdirilganda parchalanmaydi.
2. Asosiy oksidlar, oksidli oksidlar→ tuz.
CaO + CO 2 = CaCO 3;
Na 2 O + SO 3 = Na 2 SO 4.
3. Baza, kislotalar→ tuz.
Neytrallashtirish reaktsiyasi orqali amalga oshiriladi:
2NaOH + H 2 SO 4 = Na2S04 + 2H2O,
U - + H + → H 2 O;
Mg (OH) 2 + 2HCI = MgCl2 + 2H2O,
Mg (OH) 2 + 2H + → Mg 2+ + 2H 2 O.
4. Metallar→ asosiy oksidi.
Ko'pgina metallar oksidi hosil qilish uchun kislorod bilan ta'sir o'tkazadi:
2Ca + O 2 = 2CaO;
4A1 + 3O 2 = 2A1 2 O 3.
Oltin, kumush, platina va boshqa nobel metallar kislorod bilan ta'sir qilmaydi, bunday metallarning oksidlari bilvosita olinadi.
5. Non-metallar→ kislota oksidi.
Metall bo'lmagan metallar (halogen va nobud gazlar bundan mustasno) kislorod bilan ta'sir qiluvchi oksidlar hosil qiladi:
4P + 5O 2 = 2P2O5;
S + O2 = SO2.
6. Asosiy oksidlar→ sabablari.
Suv bilan bevosita ta'sir o'tkazish faqat gidroksidi va gidroksidi tuproqli gidroksidlari (gidroksidi) olinadi:
Na2O + H 2O = 2NaOH;
CaO + H 2 O = Ca (OH) 2.
Boshqa sabablar bilvosita olinadi.
7. kislota oksidi→ kislota.
Kislota oksidi tegishli kislotalarni hosil qilish uchun suv bilan reaksiyaga kirishadi:
SO 3 + H 2 O = H 2 SO 4;
R 2 O 5 + 3H 2 O = 2H 3 PO 4.
Istisno, suv bilan reaksiyaga kirishmagan SiO2.
8. Oksidlanish asoslari→ tuz.
Alkali kislota oksidlari bilan tuzlar hosil qilish uchun o'zaro ta'sir qiladi:
2NaOH + SO 3 = Na 2 SO 4 + H 2 O,
2OH - + SO 3 = SO 4 2- + H 2 O;
Ca (OH) 2 + SO 2 = CaCO 3 ↓ + H 2 O,
Ca 2+ + 2OH - + CO 2 → CaCO 3 ↓ + H 2 O.
9. kislotalar, asosiy oksidlar→ tuz.
Metal oksidi kislotalarda eriydi, tuzlarni hosil qiladi:
CuO + H 2 SO 4 = CuS04 + H 2 O,
CuO + 2H + = Cu 2+ + H 2 O;
Na 2 O + 2HS1 = 2NaCl + H 2 O,
Na 2O + 2H + = 2Na + + H 2 O.
10. asoslar→ asosiy oksidi.
Issiqlikda eriydigan bazalar va LiOH parchalanadi:
2LiOH = Li 2 O + H 2 O;
Cu (OH) 2 = CuO + H 2 O.
11. kislotalar→ kislota oksidi.
Ishqorli kislorodli kislotalar qizdirilganda (H 2 SiO 3) va hatto isitilmasdan (H 2 CO 3, HClO) ajralib chiqadi. Shu bilan birga, bir qator kislotalar isitish uchun chidamli (H 2 SO 4, H 3 PO 4).
H 2 SiO 3 = H 2 O + SiO 2;
H 2 CO 3 = H 2 O + CO 2.
12. Metal oksidi→ metallar.
Ba'zi og'ir metall oksidlari metall va kislorodga ajralishi mumkin:
2HgO = 2Hg + O 2.
Bundan tashqari, oksidlovchi moddalarni kamaytirish orqali oksidlardan metall olinadi:
3MnO 2 + 4Al = 3Mn + 2Al2O3;
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O.
13. kislota oksidi→ metall bo'lmagan
Ko'p metall bo'lmagan oksidi qizdirilganda parchalanmaydi. Metall bo'lmagan va kislorod faqat bir nechta noturg'un oksidi (halogen oksidi) bilan ajralib chiqadi.
Ba'zi nodir metallar mos oksitlarni qisqartirish yo'li bilan olinadi:
SiO 2 + 2Mg = 2MgO + Si.
Tuzlar, bazlar → bazalar.
Eritilmagan asoslar tegishli kislotalarning eritmalarida gidroksidi ta'sirida olinadi:
CuSO 4 + 2NaOH = Cu (OH) 2 ↓ + Na2S04,
Cu 2+ + 2OH - → Cu (OH) 2 ↓;
FeCl 2 + 2KOH = Fe (OH) 2 ↓ + 2KCl,
Fe 2+ + 2OH - Fe (OH) 2 ↓.
Tuzlar, kislotalar → kislotalar.
Agar eriydigan tuzlar kislotalar bilan reaksiyaga kirishsa (bosim ketma-ketliklari bo'yicha), natijada zaif yoki uchuvchan kislota:
Na 2 SiO 3 + 2HCl = 2NaCl + H 2 SiO 3 ↓,
SiO 3 + 2H + H 2 SiO 3 ↓;
NaCl (s) + H 2 SO 4 (k) = NaHSO 4 + HCl.
16. Tuzlar→ asosiy oksidlar, kislota oksidi.
Kislorodli kislotalar kislotalari (nitrat, karbonat) tuzlari qizdirilganda ajralib chiqadi:
CaCO 3 = CaO + CO 2;
2Cu (NO 3) 2 = 2CuO + 4NO 2 + O 2.
"INORGANIK KOMPONENTLAR TOMONIDAN GENETIK Bog'lanish" mavzusidagi mustaqil ish uchun mashq
Quyida sanab o'tilgan moddalarga nom bering, ularni noorganik birikmalar sinflariga o'tkazing: Na3P04, H2S03, NO, B2O3, MgS, BaI2, Ca (OH) 2, KNO3, HNO2, Cl2 O 7, Fe (OH) 2, P 2 O 5, HF, MnO 2.
Quyida keltirilgan moddalardan qaysi biriga mis, temir oksidi (P), bariy oksidi, azot oksidi (P), azot oksidi (V), kremniy oksidi, mis sulfat, kaliy xlorid , kaliy, magniy karbonat.
3. Yuqoridagi ro'yxatdan quyidagilarga tegishli moddalarning formulalarini yozing: 1) oksidi; 2) asoslar; 3) kislotalar; 4) tuzlar:
CO 2, NaOH, HCl, SO3, CuS04, NaNO3, KCl, H 2 SO 4, Ca (OH) 2, P2O5, HNO3, Al (OH) 3.
4. Zn (OH) 2, MgO, P 2 O 3, NaHCO 3, H 3 PO 3, Fe 2 (SO 4) 3, KOH, (AlOH) 3 (PO 4) 2, Ba (MnO 4 ) 2, CO, XI. Har bir modda qaysi sinfga tegishli ekanligini ko'rsating.
Quyidagi moddalarning molekulyar formulalarini yozing va har bir moddaning qaysi sinfga mansubligini ko'rsating:
1) mis (II) gidroksokarbonat;
2) azot oksidi (V);
3) nikel (II) gidroksidi;
4) bariy vodorod fosfat;
5) perklor kislotasi;
6) krom (III) gidroksid;
7) kaliy klorat;
8) vodorod sulfid kislota;
9) natriy sinkati.
6. Aloqaning reaktsiyalariga misollar keltiring:
1) oddiy moddalar - nometall;
2) oddiy modda va oksid;
3) oksidi;
4) oksid bo'lmagan murakkab moddalar;
5) metall va metall bo'lmagan;
6) uchta modda.
7. Quyidagi moddalardan qaysi biri javob berishi mumkin:
1) karbon monoksit (IV): HCl, O 2, NO 2, KOH, H 2 O;
2) magniy oksidi: Ba (OH) 2, HCl, CO 2, O 2, HNO 3;
3) temir (II) gidroksidi: KCl, HCl, KOH, O 2, H 2 O, HNO 3;
4) vodorod xloridi: Zn, MgO, ZnCl2, HNO3, Ca (OH) 2, Cu, (ZnOH) Cl.
8. Quyidagi moddalar orasidagi o'zaro ta'sirlar mavjudmi?
1) karbon monoksit (IV) va kaliy gidroksidi;
2) kaliy gidroksidi va kaltsiy gidroksidi;
3) kaltsiy fosfat va sulfat kislota;
4) kaltsiy gidroksidi va oltingugurt oksidi (IV);
5) sulfat kislota va kaliy gidroksidi;
6) kaltsiyli bikarbonat va fosforik kislota;
7) silika va sulfat kislotasi;
8) sink oksidi va fosfor oksidi (V).
Mumkin reaktsiyalarning tenglamalarini yozing, ular sodir bo'lgan sharoitlarni aniqlang. Agar reaktsiyalar turli moddalarga olib kelishi mumkin bo'lsa, unda ularni amalga oshirish sharoitida qanday farq borligini ko'rsating.
9. Quyidagi moddalarni olish uchun reaktsiyalar tenglamalarini bering: natriy ortofosfat (4 usul), kaliy sulfat (7 yo'l), sink gidroksidi.
10. Soda (natriy karbonat) ni ishlab chiqarish usullaridan biri suv va uglerod oksidi (IV) ning natriy aluminat ustidan ta'siri. Reaktsiya tenglamalarini yaratish.
11. Koeffitsientlarni o'zgartirib, reaktsiya mahsulotlarini yozing:
1) MgO + 2H 2SO 4 →
2) 2SO 2 + Ba (OH) 2 →
3) 3N 2 O 5 + 2Al (OH) 3 →
4) P 2 O 5 + 4NaOH →
5) P 2 O 5 + 6NaOH →
6) P 2 O 5 + 2NaOH →
12. Turli xil turdagi tuzlarni olish uchun reaktsiyalar tenglamalarini bajaring:
1) SO 2 + Ba (OH) 2 → (o'rta va kislota tuzlari),
2) A1 2 O 3 + H 2 O + HNO 3 → (o'rta tuz, asosiy tuzlar),
3) Na 2 O + H 2 S → (o'rta va kislotali tuzlar),
4) SO 3 + Sa (OH) 2 → (o'rta va asosiy tuzlar),
5) CaO + H 2 O + P 2 O 5 → (asosiy tuz, kislota tuzlari).
13. Reaktsiya tenglamalarini yakunlang:
CaO + A1 2 O 3 → CaHPO 4 + Ca (OH) 2 →
Cr 2 O 3 + H 2 SO 4 → AlOHSO 4 + NaOH →
Cr 2 O 3 + NaOH → CaCO 3 + CO 2 + H 2 O →
A1 2 O 3 + HClO 4 → Ca (HCO 3) 2 + HCl →
Mn 2 O 7 + KOH → ZnS + H 2 S →
NO 2 + Ca (OH) 2 → CaSO 4 + H 2 SO 4 →
Zn (OH) 2 + NaOH → (ZnOH) Cl + HCl →
Zn (OH) 2 + HNO3 → Bi (OH) 3 + H 2 SO 4 (etarli emas) →
AlCl 3 + NaOH (etishmayotgan) → (FeOH) Cl + NaHS →
AlCl 3 + NaOH → Na 2 ZnO 2 + H 2 SO 4 (haddan tashqari) →
AlC1 3 + NaOH (ortiqcha) → Ca (AlO 2) 2 + HCl (ortiqcha) →
14. Quyidagi transformatsiyalarni amalga oshirishingiz mumkin bo'lgan reaktsiya tenglamalarini yozing:
1) Cu → CuO → CuSO 4 → Cu (OH) 2 → CuC1 2 → Cu (NO 3) 2
2) Zn → ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → ZnCl2
3) R → R 2 O 5 → H 3 RO 4 → K 3 RO 4 → Sa 3 (RO 4) 2 → H 3 RO 4
4) Mg → MgO → MgCl 2 → Mg (OH) 2 → Mg (HSO 4) 2 → MgSO 4
5) Ca → CaO → Ca (OH) 2 → CaCO 3 → Ca (HCO 3) 2 → CO 2
6) Cr → Cr 2 (SO 4) 3 → Cr (OH) 3 → NaSrO 2 → Cr 2 O 3 → K
7) P → P 2 O 5 → HPO 3 → H 3 PO 4 → NaH 2 PO 4 → Na 3 PO 4
8) CuS → CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
9) Al → Al 2 O 3 → Al 2 (SO 4) 3 → Al (HSO 4) 3 → Al (OH) 3 → K
10) S → SO 2 → SO 3 → NaHSO 4 → Na 2 SO 4 → BaSO 4
11) Zn → ZnO → ZnCl 2 → Zn → Na 2
12) Zn → ZnSO 4 → ZnCl 2 → Zn (OH) 2 → Na 2 → Zn (NO 3) 2
13) Ca → CaCl 2 → CaCO 3 → Ca (HCO 3) 2 → Ca (NO 3) 2
14) Ca → Ca (OH) 2 → CaCO 3 → CaCl 2 → CaCO 3 → Ca (NO 3) 2
15) CuO → CuCl 2 → Cu (NO 3) 2 → CuO → CuSO 4 → Cu
16) CaO → Ca (OH) 2 → Ca (NO 3) 2 → Ca (NO 2) 2 → HNO 2 → NaNO 2
17) MgO → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
18) SO 2 → H 2 SO 3 → KHSO 3 → K 2 SO 3 → KHSO 3 → SO 2
19) P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2 → Ca (H 2 PO 4) 2 → CaHPO 4
20) CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
21) PbO → Pb (NO 3) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbCl2
22) ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2 → K 2
23) Al 2 O 3 → AlCl3 → Al (OH) 3 → NaAlO 2 → Al (OH) 3 → K
24) ZnSO 4 → Zn (OH) 2 → ZnCl2 → Zn → ZnO → Zn (NO 3) 2
25) AlCl 3 → Al (NO 3) 3 → Al (OH) 3 → NaAlO 2 → A1C1 3 → Al
26) Pb (NO 3) 2 → Pb (OH) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbSO 4
27) Fe 2 (SO 4) 3 → FeCl 3 → Fe (OH) 3 → FeOH (NO 3) 2 → Fe (NO 3) 3 → Fe 2 O 3
28) K → KOH → KHSO 4 → K 2 SO 4 → KCl → KNO 3
29) Cu (OH) 2 → CuOHNO 3 → Cu (NO 3) 2 → CuSO 4 → CuCl2 → Cu (NO 3) 2
30) CaCl 2 → Ca → Ca (OH) 2 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
31) Cu → Cu (NO 3) 2 → Cu (OH) 2 → CuSO 4 → Al 2 (SO4) 3 → A1C1 3
32) Mg → MgSO 4 → MgCl2 → MgOHCl → Mg (OH) 2 → MgOHNO 3
33) CuSO 4 → CuCl2 → ZnCl 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2
34) Hg (NO 3) 2 → Al (NO 3) 3 → Al 2 O 3 → NaAlO 2 → Al (OH) 3 → AlOHCI 2
35) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → AlCl 3 → Al (OH) 3 → A1 2 O 3
36) CuCl 2 → Cu (OH) 2 → CuSO 4 → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2
37) Fe (NO 3) 3 → FeOH (NO 3) 2 → Fe (OH) 3 → FeCl 3 → Fe (NO 3) 3 → Fe
38) Al 2 O 3 → AlCl3 → Al (OH) 3 → NaAlO 2 → NaNO3 → HNO3
39) Mg (OH) 2 → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
40) alyuminiy sulfat → alyuminiy xlorid → alyuminiy nitrat → alyuminiy oksid → kaliy aluminati → alyuminiy gidroksidi → alyuminiy gidroksidi → alyuminiy xlor.
41) Na → NaOH → Na 3 PO 4 → NaNO 3 → HNO3 → N 2 O 5
42) BaCO 3 → Ba (HCO 3) 2 → BaCO 3 → (BaOH) 2 CO 3 → BaO → BaSO 4
43) Cu → CuSO 4 → (CuOH) 2 SO 4 → Cu (OH) 2 → Cu (HSO 4) 2 → CuSO 4
44) bariy → bariy gidroksidi → bariy bikarbonat → bariy xlor → bariy karbonat → bariy xlor → bariy gidroksidi
45) P → P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → CaHPO 4 → Ca 3 (PO 4) 2
46) Cr → CrO → Cr 2 O 3 → NaCrO 2 → CrCl3 → Cr (OH) 3 → Cr 2 O 3 → Cr
47) Cr 2 O 3 → CrCl 3 → Cr (OH) 3 → Na3 → Cr 2 (SO4) 3 → CrCl3
48) K → KOH → KCl → KOH → K 2 SO 4 → KNO 3 → KNO 2
49) S → FeS → H 2 S → SO 2 → S → ZnS → ZnO → ZnCl 2 → Zn (OH) 2 → K 2
50) C → CO 2 → CO → CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2
51) S → CO 2 → NaHCO 3 → Na 2 CO 3 → CO 2
52) S → SO 2 → K 2 SO 3 → KHSO 3 → K 2 SO 3
53) Cu → Cu (OH) 2 → Cu (NO 3) 2 → CuO → Cu
54) R 2 O 5 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2
55) Fe → FeCl 2 → Fe (OH) 2 → FeSO 4 → Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (NO 3) 2 → ZnO
57) CuS → SO 2 → KHSO 3 → CaSO 3 → SO 2
58) SO 2 → H 2 SO 4 → CuSO 4 → CuO → Cu (NO 3) 2
59) KHSO 3 → CaSO 3 → Ca (HSO 3) 2 → SO 2 → K 2 SO 4
60) SO 2 → CaSO 3 → SO 2 → NaHSO 3 → SO 2
61) NaHCO 3 → Na 2 CO 3 → NaCl → NaHSO 4 → Na 2 SO 4
62) K → KOH → KCl → KNO 3 → K 2 SO 4 → KCl
63) NaCl → Na → NaOH → Na2SO4 → NaCl
64) Al → AlCl 3 → Al (OH) 3 → A1 2 O 3 → Al (OH) 3
65) CuO → Cu → CuCl 2 → CuSO 4 → CuS
Fe) FeSO 4 → Fe (OH) 2 → Fe → Fe (OH) 3 ga qarang
67) Fe Fe (OH) 2 → FeCl 2 → Fe (NO 3) 2 → Fe
68) Fe (NO 3) 3 → Fe 2 O 3 → FeCl 3 → Fe (NO 3) 3 → Fe
69) CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
70) MgCO 3 → MgO → MgCl 2 → Mg (OH) 2 → Mg (NO 3) 2
71) Mg → Mg (OH) 2 → MgSO 4 → MgCO 3 → Mg (HCO 3) 2
72) CaO → Ca (OH) 2 → CaCl 2 → CaCO 3 → CO 2
73) CaCO 3 → Ca (HCO 3) 2 → CaCl 2 → Ca (NO 3) 2 → O 2 ni tanlang
74) FeS → Fe 2 O 3 → Fe (OH) 3 → Fe 2 (SO 4) 3 → FeCl 3
75) KS1 → K 2 SO 4 → KOH → K 2 CO 3 → KOH
76) CuS → CuO → Cu (OH) 2 → CuSO 4 → Cu
77) Fe → Fe (OH) 3 → Fe (NO 3) 3 → FeCl 3 → Fe 2 (SO 4) 3
78) CuSO 4 → CuO → Cu (NO 3) 2 → CuO → CuS
79) ZnS → H 2 S → SO 2 → Na 2 SO 4 → NaOH
80) Al → Al (OH) 3 → A1 2 (SO 4) 3 → A1 2 O 3 → Al (OH) 3
81) CaCl 2 → CaCO 3 → Ca (HCO 3) 2 → CaCO 3 → CaSiO 3
82) S → ZnS → H 2 S → Ca (HSO 3) 2 → SO 2
83) Na 2 SO 4 → NaCl → HCl → CaCl 2 → Ca (NO 3) 2
84) Na 2 SO 3 → SO 2 → H 2 SO 4 → HCl → FeCl 2
85) S → Na 2 CO 3 → CaCO 3 → CaSiO 3 → H 2 SiO 3
86) P → P 2 O 5 → Ca (H 2 PO 4) 2 → CaHPO 4 → H 3 PO 4
87) Al → A1 2 O 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
88) HCl → CuCl 2 → Cl 2 → HCl → H 2
89) P 2 O 5 → Na 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4
90) NH 3 → NH 4 C1 → NH 3 ∙ H 2 O → NH 4 HCO 3 → NH 3
91) NH 4 C1 → KC1 → HCl → CuCl2 → Cu (OH) 2
NH3 → NH 4H 2 PO 4 → (NH 4) 2 HPO 4 → NH 3 → NH 4 NO 3
93) KOH → KHCO 3 → K 2 CO 3 → CO 2 → Ca (HCO 3) 2
94) Na → NaOH → NaHCO 3 → Na2S04 → NaOH
95) KNO 3 → K 2 SO 4 → KC1 → KNO 3 → KNO 2
96) Cl 2 → KC1 → K 2 SO 4 → KNO 3 → KHSO 4
97) FeSO 4 → FeS → SO 2 → KHSO 3 → K 2 SO 4
98) KOH → Cu (OH) 2 → CuSO 4 → Cu (OH) 2 → Cu
99) Fe 2 O 3 → FeCl 3 → Fe (OH) 3 → Fe (NO 3) 3 → Fe 2 O 3
100) Al → A1 2 O 3 → A1 (NO 3) 3 → A1 2 O 3 → Al (OH) 3
101) CaO → CaCO 3 → CaSiO 3 → Ca (NO 3) 2 → O 2
102) Cu → Cu (OH) 2 → Cu → CuSO 4 → CuCl 2
103) H 2 S → S0 2 → ZnSO 4 → ZnS → ZnO
104) Cl 2 → NaCl → HCl → CuCl2 → CuO
105) Cl 2 → FeCl 3 → Fe 2 O 3 → Fe (OH) 3 → Fe (NO 3) 3
106) P 2 O 5 → Ca 3 (PO 4) 2 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2
107) ZnS → ZnO → Zn → ZnCl 2 → Zn (NO 3) 2
108) ZnO → ZnSO 4 → Zn (NO 3) 2 → ZnO → Zn (OH) 2
109) H 3 PO 4 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2
110) CaCO 3 → Na 2 CO 3 → Na 3 PO 4 → NaH 2 PO 4 → Ca 3 (PO 4) 2
111) CaCl 2 → CaSO 3 → Ca (OH) 2 → CaCl 2 → Ca (NO 3) 2
112) NaOH → Na 2 CO 3 → NaHSO 4 → NaNO3 → NaHSO 4
113) Na 2 SiO 3 → Na 2 CO 3 → Na 2 SO 4 → NaCl → Na 2 SO 4
114) KNO 3 → KHSO 4 → K 2 SO 4 → KCl → Na 2 SO 4
SiO 2 → K 2 SiO 3 → H 2 SiO 3 → SiO 2 → CaSiO 3
116) Cu → CuCl 2 → Cu (NO 3) 2 → NO 2 → HNO 3
117) Ca (NO 3) 2 → O 2 → SiO 2 → H 2 SiO 3 → SiO 2
118) P → H 3 PO 4 → Ca 3 (PO 4) 2 → CaHPO 4 → Ca (H 2 PO 4) 2
119) CuSO 4 → Cu → CuS → CuO → CuCl 2
120) Al → A1 2 (SO 4) 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
121) S → SO 3 → H 2 SO 4 → KHSO 4 → BaSO 4
122) N 2 O 5 → HNO 3 → Cu (NO 3) 2 → CuO → Cu (OH) 2
123) Al → A1 2 O 3 → Al (OH) 3 → A1 2 (SO 4) 3 → A1 (NO 3) 3
124) Ca → Ca (OH) 2 → Ca (HCO 3) 2 → CaO → CaCl 2 ni aniqlang
125) NH 3 ∙ H 2 O → NH 4 C1 → NH 3 → NH 4 HCO 3 → (NH 4) 2 CO 3
126) Cu (OH) 2 → H 2 O → HNO3 → Fe (NO 3) 3 → Fe
127) SO 2 → Ca (HSO 3) 2 → CaCl 2 → Ca (OH) 2 → Ca (HCO 3) 2
128) NH 3 ∙ H 2 O → NH 4 HCO 3 → CaCO 3 → CaSiO 3 → CaCl2
129) CuSO 4 → Cu → CuO → Cu (OH) 2 → Cu
130) Fe (OH) 3 → Fe → FeCl 3 → Fe (NO 3) 3 → Fe
131) Zn → Zn (OH) 2 → Na 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn
132) Zn → ZnO → Na 2 ZnO 2 → Zn (OH) 2 → Na 2 → ZnCl 2
133) Zn → K 2 ZnO 2 → ZnSO 4 → K 2 → Zn (NO 3) 2 → ZnO
134) ZnO → Zn (OH) 2 → K 2 ZnO 2 → ZnSO 4 → ZnCl2 → ZnO
135) Zn → Na 2 → Na 2 ZnO 2 → Zn (NO 3) 2 → ZnO → Zn
136) Al → K 3 → Al (OH) 3 → Na 3 → A1C1 3 → Al (OH) 3
137) Al 2 O 3 → KAlO 2 → Al (OH) 3 → Al 2 O 3 → Na 3 → Al 2 O 3
138) Al (OH) 3 → A1 2 O 3 → K 3 → Al 2 (SO 4) 3 → A1 (NO 3) 3
139) A1C1 3 → K 3 → Al (NO 3) 3 → NaAlO 2 → Al 2 O 3
140) → Na 2 → Be (OH) 2 → Na 2 BeO 2 → BaBeO 2 ni tanlang
"INORGANIK KOMPONENTLARNING ASOSIY SINIFLARI" mavzusidagi tajriba tajribalari
Tajriba 1.Neytrallanish reaktsiyalari.
a) kuchli kislota va kuchli tayanchning o'zaro ta'siri.
5 ml 2N gidroksidi kislota eritmasini chinni idishga soling va unga 2 natriy gidroksidi eritmasi qo'shing. Eritmasini bir shisha tayoq bilan aralashtiramiz va litmusga ta'sirini tekshirib ko'ring, litmus testidagi eritmani tomchilatib yuboring. Neytral reaktsiyaga erishish kerak (ko'k va qizil litmus qog'oz rangi o'zgarmaydi). Olingan eritmani quruqlikka bug'lang. Nima yuzaga keldi? Molekulyar va ionli reaksiya tenglamalarini yozing.
b) zaif kislota va kuchli tayanchning o'zaro ta'siri.
2 ml gidroksidi eritmasidan 2 ml probirkaga soling va eritma neytral bo'lmaguncha sirka kislotasi eritmasini qo'shing. Molekulyar va ionli reaksiya tenglamalarini yozing. Zaif elektrolitlar (sirka kislotasi) ishtirok etadigan muvozanat ioni reaktsiyasi nima uchun suv molekulalarining hosil bo'lishiga qarab harakat qiladi.
Tajriba 2. Amfoterik gidroksidlar.
Laboratoriyada mavjud bo'lgan reaktivlardan sink gidroksidi cho'kmasi hosil qiling. Olingan cho'kmachani silkitib, oz miqdorini 2 naychaga quying. Naychalarning birida hidroklorik kislota eritmasi qo'shiladi, ikkinchisi - natriy gidroksidi eritmasi (ortiqcha). Nima kutilmoqda? Tegishli reaksiyalarning tenglamalarini molekulyar va ionli shaklda yozing.
Tajriba 3.Tuzlarning kimyoviy xossalari.
a) Tuzli eritmalarning suyuq eriydigan moddalar shakllanishi bilan o'zaro ta'siri.
2 ml natriy karbonat eritmasini kolba ichiga to'kib tashlang va oq cho'kma hosil bo'lgunga qadar bariy xlorid eritmasini qo'shing. Kimyoviy reaksiya tenglamasini ion va molekulyar shaklda yozing. Cho'kma ikki qismga bo'linadi. Sulfat kislota eritmasini quvurlardan biriga va natriy gidroksidni boshqasiga to'kib tashlang. Tarkibida kislotalar va gidroksidning eruvchanligi haqida xulosa qilish.
b) uchuvchan birikma hosil qilish uchun tuz eritmasi kislotalar bilan o'zaro ta'siri.
Naychani 2 ml natriy karbonat eritmasi bilan to'ldiring va kichik miqdordagi xlorid kislota eritmasini qo'shing. Nima kutilmoqda? Kimyoviy reaksiya tenglamalarini ion va molekulyar shaklda yozing.
c) tuz eritmalarining gidroksidi bilan uchuvchan birikma hosil bo'lishi bilan o'zaro ta'siri.
Naychadagi ba'zi ammoniy tuzining eritmasini biroz tushiring, 1-2 ml natriy gidroksidi eritmasi va qaynab turgan issiqlik qo'shing. Reaktsiya aralashmasi bilan sinov naychasida nam qizil litmus mesh qilish. Nima kutilmoqda? Izoh bering. Reaktsiya tenglamalarini yozing.
g ) Tuzlarning bir qismi bo'lgan metallga qaraganda ko'proq faol metallar bilan tuzlarning o'zaro ta'siri.
Temir (temir) tirnoqini nozik zımpara bilan tozalang. Keyin mis sulfat eritmasiga soling. Biroz vaqtdan so'ng, tirnoq yuzasida misni ozod qilishni kuzating. Reaktsiya tenglamasini ion va molekulyar shaklda yozing.
Tajriba 4.Asosiy va kislotali tuzlarni olish.
a) qo'rg'oshinli gidroksokarbonat tayyorlash.
(II) asetat eritmasiga bir oz qo'rg'oshin (II) oksid qo'shing va aralashmani bir necha daqiqa davomida qaynatib oling. Sovutilgan eritma cho'kma suvidan chiqariladi va u orqali karbonat angidrid o'tadi. Nima kutilmoqda? Çökeltiyi süzün va filtri qog'oz barglari orasida quriting. Qo'rg'oshin gidroksokarbonatning hosil bo'lgan cho'kindi rangini va tabiatini belgilang. Reaktsiya tenglamalarini yozing. Olingan tuzning grafik formulasini yarating.
b) magniy bikarbonat tayyorlash.
Ba'zi magniy tuzining juda sulandırılmış eritmasiga natriy karbonatning ozgina eritmasi qo'shiladi. Qanday modda o'zgaradi? Karbon dioksidi bilan cho'kma bilan to'yingan eritma. Cho'kkaning bosqichma-bosqich tarqalishiga e'tibor bering. Bu nima uchun sodir bo'ladi? Reaktsiya tenglamalarini yozing.
Tajriba 5.Murakkab tuzlarni olish.
a) Murakkab kationli birikmalarni shakllantirish.
2-3 ml mis (II) xlorid eritmasi bilan mis (II) gidroksid cho'kma hosil bo'lgunga qadar cho'kma bilan ammiak eritmasi qo'shing va keyin cho'kmasini eritish uchun ortiqcha ammiak eritmasini qo'shing. Olingan eritmaning rangi bilan Cu 2+ ionlarining rangini solishtiring. Eritmada qanday ionlar mavjud? Reaktsiya tenglamasini murakkab birikma olish uchun yozing.
b) murakkab anion bilan birikmalar hosil bo'lishi.
1-2 ml simob (II) nitrat eritmasiga tomchi tomchi HgI 2 cho'kmasini hosil qilish uchun kaliy iyodid eritmasi qo'shiladi. Keyin cho'kma eritmaguncha kaliy iyodid eritmasidan ko'p miqdorda quyiladi. Murakkab tuz olish reaktsiyalarini yozing.
Tajriba 6.Er-xotin tuzlarning (kaliy alumini) tayyorlash.
7,5 g Al 2 (SO4) 3 ∙ 18H 2 O dan torting va 50 ml suvda eritib, bu maqsad uchun etarlicha katta chinni idish olib keling. Reaksiya tengasini hisoblang va reaktsiya uchun zarur kaliy sulfat massasini torting. Kaliy sulfatning issiq to'yingan eritmasini tayyorlang va uni chinni idishga quying va aralashtirish bilan alyuminiy sulfat eritmasi qo'shing. Alyuminiy kaliy alum kristallarining yog'inini bir muncha vaqt o'tgach kuzatib boring. Sovutish va kristalizatsiya qilinganidan so'ng, ota-likni to'kib tashlang, filtr qog'ozining choyshablari orasidagi chuqur kristallarni quriting va olingan kristalllarni torting. Berilgan foiz nisbatlarini hisoblang.
QO'ShIMChA MASLAHATLAR
1. 16 g mis (II) sulfat eritmasi orqali vodorod sulfidini ortiqcha bosib, 1,92 g cho'kma hosil qilindi. Foydalanilgan eritmadagi mis sulfatning massa ulushini va iste'mol qilingan vodorod sulfid miqdorini toping.
2. 291 sm 3 mis (II) sulfat eritmasidan 10% massa ulushi bo'lgan sulfid shaklidagi misning to'liq yog'lanishi uchun 17,6 g temir (II) sulfidning ortiqcha xlorid kislotasi bilan reaktsiyasi natijasida olingan gaz ishlatilgan. Asl mis sulfat eritmasining zichligini toping.
3. K 2 S eritmasining sulandırılmış sülfürik kislota bilan ta'sir o'tkazish davomida chiqarilgan gaz, qo'rg'oshin (II) nitrat eritmasidan ortiqcha o'tadi. Olingan tuproqning miqdori 71,7 g bo'lsa, unda uning zichligi 1,176 g / sm3, massa ulushi esa 25% bo'lsa, reaksiyaga kirishgan sulfat kislota eritmasining hajmini toping.
4. 8 g mis (II) sulfat o'z ichiga olgan probirkaga 4.68 g natriy sulfid o'z ichiga olgan eritma qo'shildi. Çökelti süzüldü, süzüntü buharlaştınldı. Bug'lanishdan keyin filtrada moddalar massasini va mis sulfid cho'kmasini massasini aniqlang.
5. Ba'zi temir (II) sulfid xlorid kislota ko'pligi bilan ishlangan. Nominal gaz 12,5 sm 3 NaOH eritmasi bilan 25% massa ulushi va 1.28 g / sm 3 zichligi bilan kislota tuzi hosil qildi. Asl temir sulfid massasini toping.
6. 176 grammli temir (II) sulfid og'irligi ortiqcha xlorid kislota bilan ishlangan, natijada esa gaz ortiqcha havo bilan yondirilgan. Yonish vaqtida ishlab chiqarilgan gazni to'liq neytralizatsiya qilish uchun 40% massa ulushi va 1,4 g / sm 3 zichligi bilan KOH eritmasining qanday hajmi kerak?
7. 100 g texnik piritni qovurib bo'lgach, ular 400 sm dan 3 NaOH eritmasi bilan 25% massa ulushi va 1.28 g / sm 3 zichligi bilan butunlay neytrallangan gaz oldi. Piritdagi aralashmalarning massa ulushini aniqlang.
8. Temir, temir oksidi (II) va temir oksidi (III) aralashmasidan 2 g HC1 eritmasining 16 sm 3 massa ulushi 20% va zichligi 1.09 g / sm3 bo'lgan qo'shildi. Ko'p kislotani neytrallash uchun 10,8 sm 3 NaOH eritmasining 10% zichlikdagi 1.05 g / sm 3 massa ulushi kerak edi. Chiqarilgan vodorodning hajmi 224 sm3 (NU) bo'lsa aralashmaning moddalarini toping.
9. 10,5 g massa bilan Ca (OH) 2, CaCO 3 va BaSO 4 aralashmasi bor, aralashmaning ortiqcha xlorid kislota bilan ishlaganda 672 sm 3 (IU) gaz chiqarilib, 71,2 g kislota massa bilan reaksiyaga kirishdi 10% ulushi. Aralashdagi moddalarning massasini aniqlang.
10. Bariy xlorid, kaltsiy karbonat va natriy bikarbonat aralashmasi mavjud. Ushbu aralashmaning 10 grammida suvda eritilganda, erimaydigan qoldiq 3,5 g ga teng bo'ladi. Birinchi aralashmaning 20 gramini kaltsiyalashganda uning massasi 5,2 g ga kamayadi Bosh aralashmaning moddalar massasini toping.
11. Sulfat va nitrat kislotalarni o'z ichiga olgan eritma mavjud. Ushbu eritmaning 10 g ni to'liq neytralizatsiya qilish uchun 12,5 sm 3 KOH eritmasining massa ulushi 19% va zichligi 1,18 g / sm3 bo'lgan holda iste'mol qilinadi. Bariy xloridning ortiqcha miqdorini kislota eritmasining 20 g aralashmasiga qo'shganda, 4.66 g cho'kma tushadi. Aralashdagi kislotalarning massa ulushlarini toping.
12. 100 g KC1 va KNO3 aralashmasidan olingan barcha vodorod xloridi 71,8 sm 3 suvda eritildi. Bir xil tuz aralashmasi 100 g kaltsiyda 93,6 g qattiq qoldiq qoladi. Suvdagi vodorod xloridning massa ulushini toping.
13. Ca (OH) 2 eritmasidan 2 m 3 havo (NU) yuborilganda karbonat kislota tuzining 3 g tuproqi olinadi. Havodagi CO2 ning hajmini va massa ulushini toping.
14. Karbon dioksid 50 g CaC03 o'z ichiga olgan suspenziya orqali o'tkaziladi. Reaksiya 8,96 dm 3 gaz (NU) ga teng keldi. CaCO 3 ning massasi qattiq fazada qoldirilganmi?
15. CaO ga suv qo'shganda uning massasi 30% ga oshdi. CaO ning qanday massiv qismi (massa%) söndürülmüş?
16. 18,47 g gacha bo'lgan qo'rg'oshin (II) oksid vodorod oqimida isitiladi. Reaksiya natijasida, natijada olingan qo'rg'oshin va reaksiyaga etmagan oksid massasi 18.07 g ni tashkil qildi.
17. Issiqlik vaqtida karbonmonoksit temir (III) oksidi orqali o'tadi. Reaktsiyadan so'ng qattiq qoldiq massasi temir oksidi boshlang'ich massasidan 2 g gacha. Qanday reaktsiyaning CO miqdori (oksid butunlay kamaytiriladimi)?
18. Vodorodning 25 zichligi bilan N 2, CO 2 va SO 2 aralashmasidan 8,96 dm 3 (NU) aralashmasi bor. KH ning eritmasidan ko'p miqdorda o'tib ketganidan keyin aralashmaning hajmi 4 martaga kamayadi. Asl aralashmada gazlar hajmini toping.
19. Ikkita stakanda massa ulushi 2,5% bo'lgan 100 g HC1 eritmasi mavjud. Bir stakanda 10 g CaC03, boshqa tomondan esa 8,4 g MgCO 3 qo'shilgan. Reaktsiya natijasida ko'zoynak massasi qanday farq qiladi?
20. NaOHning massa ulushi 0,1% va kislota tuzi olish uchun 1 g / sm 3 zichligi bilan oltingugurt dioksidining qaysi hajmi (NU) 200 sm3 eritmadan o'tkazilishi kerak?
21. Karbon dioksidning maksimal miqdori (karbon dioksidi) NaOH ning 25% massa ulushi va 1.1 g / sm3 zichligi bilan 25 sm 3 eritmani o'zlashtira oladimi?
22. 20% KOH massasi va 1.19 g / sm 3 zichlikdagi eritmaning eng kam miqdori qaysi 23,2 g magnetitning karbon monoksit bilan to'liq pasayishi bilan hosil qilingan barcha karbon dioksidni so'raydimi?
23. Koksning minimal massasi 24,5 g ortofosfor kislotasi bilan reaksiyaga kirish kerak, shunda faqat kaliy dihidrogen fosfat mahsulotdir?
24. O'rtacha tuz olish uchun 5% tuz massa ulushi bilan 16 g kaltsiyli bikarbonat eritmasiga Ca (OH) 2 minimal massasi qancha?
25. Qaysi massa kaliy vodorod fosfatini 12.25 g H 3 PO 4 o'z ichiga olgan eritma qo'shilishi kerak, shundan so'ng eritma faqat kaliy dihidrogen fosfat o'z ichiga oladi?
Solüsyon ichida 56.1 g kaltsiy va magnezium karbonat aralashmasi mavjud. Ularni uglevodorbonlarga aylantirish uchun ular 7 dm 3 (NU) etanni yondirish natijasida hosil bo'lgan barcha karbon dioksidni sarfladilar. Birinchi aralashmada kaltsiy karbonat massasini toping.
27. Natriy gidroksidi va dihidrogen fosfatning 9,5 g aralashmasi o'rta tuzga, NaOHning massa ulushi 27,7% va 1,3 g / sm 3 zichlikka ega bo'lgan eritma 10 sm 3 ga aylantirilishi kerak. Aralashdan vodorod fosfat massasini toping.
28. Karbon dioksidni 6 g NaOH o'z ichiga olgan eritmasidan o'tkazish orqali 9,5 g kislotali va o'rta tuzlar aralashmasi qo'lga kiritildi. Iste'mol qilinadigan karbonat angidrid miqdorini toping.
29. KOH eritmasidan 11,2 dm 3 (NU) CO2 dan keyin 57,6 g kislotali va o'rta tuzlar aralashmasi olingan. O'rtacha tuzning massasini toping.
30. 1,2 g dihidro- va 4,26 g natriy vodorod fosfatini olish uchun qanday ortofosfor kislotasi massasini zararsizlantirish kerak?
31. NaOH 3.6 g gidroksulfat va 2.84 g natriy sulfatni olish uchun sulfat kislota eritmasiga qo'shilgan. Reaksiyaga kirgan kislota va gidroksidi miqdorini aniqlang.
32. Vodorod xlorini 200 santimetr NaOH eritmasidan 10% massa ulushi va 1.1 g / sm 3 zichligi bilan o'tkazgandan so'ng, natijada olingan eritma NaOH ning massa ulushi yarimga kamaydi. Olingan eritmada NaClning massa ulushini aniqlang.
33. Mis va uning oksidli (II) 14,4 g aralashmasidan 80% HNO 3 massa ulushi bilan 48,5 g eritma iste'mol qilindi. Birinchi aralashmada mis va oksid massa ulushlarini toping.
6.2 g natriy oksid massasi 100 sm 3 suvda eritildi va 1-sonli eritma olinadi, keyin bu natriyga neytral bo'lgunga qadar 10% massa ulushi bo'lgan xlorid kislotasi qo'shiladi va № 2 eritmasi olinadi. :
1) 1, 2-sonli eritmalardagi moddalarning massa ulushi;
2) 1-sonli eritmani neytrallashga ketadigan HC1 eritmasining massasi.
35 g. 3 g sink 18,69 sm 3 HC1 eritmasi bilan massa ulushi 14,6% va zichligi 1,07 g / sm 3 bilan ta'sir o'tkazadi. Issiq isitilganda, hosil bo'ladigan gaz 4 g gacha issiq CuO dan o'tib ketadi.
36. Kaltsiy hidridni ortiqcha suv bilan davolashdan so'ng chiqarilgan gaz, FeO orqali o'tkazib yuborilgan. Natijada oksid massasi 8 g ga kamaydi, suv bilan ishlov berilgan CaH2 massasini toping.
37. CaCO 3 namunasini kaltsiyalash jarayonida uning massasi 35,2% ga kamaydi. Qattiq reaktsiya mahsuloti 0.112 dm 3 (NU) gazni olish uchun ortiqcha hidroklorik kislota ichida eritildi. Kaltsiy karbonatning asl namunasining massasini aniqlang.
38. Mis nitrati ajralib chiqdi va natijada mis (II) oksid vodorod bilan butunlay kamaydi. Olingan mahsulotlar P 2 O 5 bilan naychadan o'tib, undan keyin 3,6 g gacha naychaning massasi oshib ketdi. Eksperimentda olingan dissotsiatsiya uchun zarur bo'lgan 88% massa ulushi va 1.87 g / sm 3 zichligi bo'lgan sulfat kislotaning minimal miqdori nima? mis va buzilgan tuzning massasi nima?
39. Kislorodsiz kislorodsiz sovuqda KH eritmasidan ko'p miqdorda nitrat oksidi (IV) emdirilganda 40,4 g KNO 3 olinadi. Qanday modda hali ham shakllanmoqda va uning miqdori qanday?
40. Hidroklorik va 400 g eritmani neytrallash uchun sulfat kislota, massa ulushi 10% va zichligi 1,115 g / sm3 bo'lgan 287 sm 3 natriy gidroksid eritmasi iste'mol qilingan. Agar bariy xloridning ortiqcha eritmasi boshlang'ich probirkaga 100 g qo'shilsa, 5,825 g cho'kma qoladi. Birinchi probirkada kislotalarning massa ulushini aniqlang.
41. Natriy gidroksid eritmasi orqali karbonat angidriddan o'tgandan keyin 13,7 g o'rta va kislota tuzlari aralashmasi olingan. Ularni natriy xloridga aylantirish uchun 75 g xlorid kislotadan 10% HCI massa ulushi kerak. Qabul qilingan karbon dioksid hajmini toping.
42. Umumiy massa bilan 600 g eritmaning bir xil massa kislotali massa ulushiga ega bo'lgan xlorid va sulfat kislotalarning aralashmasi natriy bikarbonatning ortiqcha va 32,1 dm 3 gazdan (Na) olingan. Birinchi aralashdan kislotalarning massa ulushini toping.
43. NaOH eritmasining 1 dm3 ni neytrallash uchun 63,0% massa ulushi va 1,5 g / sm 3 zichligi bilan 66,66 sm 3 HNO 3 eritmasi iste'mol qilindi. Bir xil miqdordagi gidroksidi miqdorini zararsizlantirish uchun massa ulushi 24,5% va 1,2 g / sm zichlikdagi sulfat kislota eritmasining hajmi qanday bo'lishi kerak edi?
44. Har qanday hajmdagi nisbati 5% massa ulushi va 1.03 g / sm3 zichligi va 5% massa ulushi va to'liq neytralizatsiya qilish uchun 1,1 g / sm 3 zichligi bilan bariy gidroksid eritmasi bilan sulfat kislota eritmasini olishi kerak? Javobni kislota eritmasiga gidroksidi eritmasining miqdori sifatida tasavvur qiling.
45. Ammiak eritmasining 0,9 g / sm 3 zichligi va 25% massa ulushi bilan ammiak eritmasining minimal hajmini hisoblang, bu kaltsiy karbonatning massa ulushiga ega bo'lgan 0,5 kg'lik tabiiy kireçtaşı ayrışmasıyla olingan karbonat angidrid to'liq 92% ga teng bo'lgan emilimi uchun zarur.
46. 2.92 g natriy gidroksid va natriy karbonat aralashmasidan xloridga aylantirilishi uchun 1,344 dm 3 vodorod xlorid (NU) talab qilinadi. Aralashmada natriy karbonat massasini toping.
47. Massiv ulushi 16% bo'lgan 25 g mis (II) sulfat eritmasiga massa ulushi 16% bo'lgan natriy gidroksidi eritmasi qo'shildi. Shakllangan cho'kma suzilgan, undan keyin filtrat gidroksidi bo'lgan. Filtrni to'liq neytralizatsiya qilish uchun eritmaning molyar konsentratsiyasi 0,1 mol / dm 3 bo'lgan sulfat kislota eritmasi 25 sm 3 ni oldi. Qo'shimcha natriy gidroksidi eritmasining massasini hisoblang.
48. CuO miqdorini 11,2 dm 3 (NU) bo'lgan 15,8 g vodorod massasi bilan to'liq qisqartirish natijasida olingan modda konsentrlangan sulfat kislotada isitish orqali eritildi. Reaksiya natijasida chiqarilgan gaz hajmi (NU) nima?
49. HCl ning massa ulushi 20% va zichligi 1.10 g / sm3 bo'lgan 50 sm 3 ta gidroklorik kislota to'liq neytralizatsiya qilish uchun 20% KOH massa ulushiga ega kaliy gidroksidi eritmasi ishlatilgan. Olingan eritmadagi suvning kimyoviy miqdori qanday?
50. C02 dan ortiq miqdorda ortiqcha 0.84 g issiq ko'mir o'tishi natijasida olingan gaz 14,0 g qizdirilgan mis (II) oksid bilan reaksiyaga yuboriladi. Oxirgi reaktsiyada olingan moddalarni to'liq eritish uchun nitrat kislotaning 63% massa ulushi va 1,4 g / sm 3 zichligi bilan qanday hajmi kerak bo'ladi?
51. Mis (II) nitratning doimiy vazniga kaltsiyalashganda, tuzning og'irligi 6,5 g ga kamaydi.
52. Xlorid kislota miqdori ko'paytirilganda alyuminiy aralashmasi noma'lum monovalent metall bilan 6.72 dm 3 (NW) gaz chiqarildi va aralashmaning massasi ikki baravarga kamaydi. Qoldiqni seyreltilmiş nitrat kislota bilan muomala qilganda 0,373 dm 3 (NU) NO chiqdi. Noma'lum metallni aniqlang.
Tovoq namunasining massasi 105 g, tarkibida kislorod elementining kimyoviy miqdori 1 mol. Teglar namunasidagi CaCO 3 ning massa ulushini aniqlang (kislorod faqat kaltsiy karbonat tarkibiga kiradi).
54. Oltingugurt oksidi (VI) ning suv bilan o'zaro ta'siri natijasida eritma 25% gacha bo'lgan sulfat kislotasining massa ulushiga to'g'ri keldi. Ushbu probirkaga Ba (OH) 2 ning ortiqcha qo'shilganda 29,13 g og'irlikdagi bir cho'kma yotqizildi, kislota eritmasi hosil bo'lishida SO 3 va H 2 O massalari qanday sarflandi?
55. SO 2 dan 200 g eritmani massa ulushiga ega NaOH bilan 16% almashtirganda, tuzlarning aralashmasi shakllantirildi, shu jumladan 41,6 g kislota tuzi. SO2 ni olish uchun og'irlik bo'yicha 4,5% miqdoridagi aralashmalar mavjud bo'lgan oltingugurt massasi nima? O'rtacha tuzning vazni qanday?
80 g Ca (NO 3) 2 eritmasi bilan 50 g Na 2 CO 3 eritmasi oldi. Yomg'ir ajratilib, ko'p miqdorda gidroklorik kislota bilan ishlov berishda 2.24 dm 3 (NU) gaz chiqdi. Dastlabki hallarda tuzlarning ommaviy fraktsiyalari qanday? Cho'kimni ajratib bo'lgandan keyin eritmadagi natriy nitratning massa ulushi qanday?
57. Sink kükürt kislotasi bilan ta'sir qilganda, argon nisbatan 1.51 zichlikli SO 2 va H 2 S aralashmasidan 10 dm 3 (NU) hosil bo'ladi. Ruxning kimyoviy miqdori qanday eritiladi? Gaz aralashmasidagi SO 2 ning massa ulushi nima?
58. Umumiy sig'imi 11 g bo'lgan sink va alyuminiy talaşlardan iborat aralashmaning namunasi gidroksidi eritmasidan ortiqcha eriydi. Aralashdagi sinkning massa ulushi 30% bo'lsa, bo'shatilgan gazning hajmini (NU) aniqlang.
59. Natriy gidroksidi og'irligi 4,0 gramm og'irligi 9,8 g bo'lgan alyuminiy gidroksidi bilan qoldiqlari olingan bo'lib, olingan natriy metaaluminate massasini hisoblang.
60. 10 g konsentrlangan nitrat kislota bilan mis va alyuminiy aralashmasi qayta ishlanganda xona harorati 2.24 dm 3 gaz (NU) chiqarildi. Kondensat miqdori KOH eritmasidan ortiqcha ishlov berishda gazning qaysi hajmi (NU) chiqariladi?
61. 20 g og'irlikdagi mis va alyuminiy qotishmasi ortiqcha alkali bilan ishlangan, erimaydigan qoldiq joyga jamlangan nitrat kislotada eriydi. Olingan tuz izolyatsiya qilingan, doimiy og'irlik bilan kalsine qilingan va 8 g qattiq turpoq qo'lga qilindi. Sarflangan NaOH eritmasining hajmini 40% massa ulushi va 1,4 g / sm 3 zichligi bilan aniqlang.
62. 39 g og'irlikdagi alyuminiy va metall oksidi (II) (amfoterik bo'lmagan oksidi) aralashmasi KOH eritmasidan ko'p miqdorda ishlangan, chiqadigan gaz 27 g suv olish uchun yondirilgan. Erimaydigan qoldiq butun eritmaning 25.2 sm3 eritmasida butunlay eritilib, 36.5% HCl massa ulushiga va 1.19 g / sm 3 zichligiga ega. Oksidni aniqlang.
63. Sink va mis chiplari aralashmasi KOH eritmasidan ko'p miqdorda ishlangan, 2.24 dm 3 (NU) gaz chiqarilgan. Xuddi shu metall namunani to'liq klorlash uchun 8,96 dm 3 (NU) bo'lgan xlor kerak edi. Namuna ichidagi sinkning massa ulushini hisoblang.
64. 49 g massa bilan temir, alyuminiy va magniyning talaşlari aralashmasi haddan tashqari suyultirilgan H 2 SO 4 bilan ishlangan, shu bilan 1,95 mol gaz olinadi. 4.9 g og'irlikdagi bir xil aralashmaning yana bir qismi gidroksid eritmasi bilan ishlangan, 1,68 dm 3 (NU) gaz olinadi. Aralashdagi metallar massasini toping.
65. 10 g NaOH va 13,6 g ZnCl 2 o'z ichiga olgan eritmalar birlashtirganda cho'kindi massasi qanday hosil bo'ladi?
Al, Mg, Fe, Zn aralashmalarining ikkita qismi bor, ularning har biri og'irligi 7,4 g, bir qismi esa xlorid kislotada eriydi va 3,584 dm 3 gaz (NU) olinadi, ikkinchisi gidroksidi eritma va 2,016 dm 3 gaz (NU) olingan. Har ikkala aralashmada A1 atomiga 3 Zn atom mavjudligi ma'lum. Aralashdagi metallar massasini toping.
1 g gacha bo'lgan mis, magniy va alyuminiy aralashmasi ortiqcha xlorid kislota bilan ishlangan. Eritma suziladi, filtratga qo'shimcha NaOH eritmasi qo'shiladi. Cho'kma ajratilgan va 0,2 g doimiy massaga kalsifikatsiyalangan, gidroklorik kislota bilan muomala qilinganidan keyin erimaydigan qoldiq havoda kalsifikatsiyalangan va 0,8 g qora modda olinadi. Aralashdan alyuminiyning massa ulushini toping.
68. Sink, magniy va misning kislorod qotishma oqimida qizdirilganda aralashmaning massasi 9,6 g ga ko'paytirildi. Mahsulot qisman gidroksidi eritiladi va eritmaning 40 sm 3 qismi KOH 40% massa ulushi va 1,4 g / sm zichligi bilan ajralib turishi kerak 3 Qotishma bir qismi bilan reaktsiya uchun 0,7 mol HC1 kerak. Qotishmada metallning kimyoviy miqdorini toping.
69. 5 g og'irlikdagi mis va sinkning qotishmasi NaOH eritmasidan ortiqcha ishlov berildi. Shundan so'ng, qattiq turpoq ajratilgan va joyga jamlanganda HNO3 bilan muomala qilingan, shu tarzda olingan tuz izolyatsiya qilingan, qattiq og'irligiga kalsine qilingan va 2.5 g qattiq turpoq qo'lga qilindi. Qotishmada metall massasini aniqlang.
70. 12,8 g og'irlikdagi mis va alyuminiy qotishmasi ortiqcha xlorid kislota bilan ishlangan. Eriydigan qoldiq joyga jamlanganda nitrat kislotada eritildi, natijada olingan eritma bug'lanib, quruq qoldiq qattiq vaznga kalsifikatsiya qilindi va 4 g qattiq modda olinadi. Qotishmada misning massa ulushini aniqlang.
71. Bir massaning nisbati A1 ning ikki qismini olishi kerak, shuning uchun gidroksidi eritmasiga qo'shilsa va ikkinchisi teng miqdordagi vodorodga qo'shilsa, u holda hidroklorik kislota qo'yiladi?
72. Alyuminiy va mis (II) oksidi aralashmasidan KOH eritmasidan ortiqcha ishlov berishda 6.72 dm 3 (NU) gaz chiqarildi va aralashmaning bir qismini xona haroratida joyga jamlanganda HNO3 eritib, 75,2 g tuz qo'lga kiritildi. Boshlang'ich moddalar aralashmasini massasini toping.
73. Qanday massiv mis (II) oksidning miqdori alyuminiydan ortiqcha eritmaning 139,87 sm 3 ni 40% NaOH va zichligi 1,43 g / sm3 bilan reaksiyaga kelish orqali olingan vodorod bilan tiklanishi mumkin?
74. Ikki metallning 7,83 gramm qotishmasini to'liq oksidlanish bilan 14,23 g oksid hosil bo'lib, uning tarkibida 4,0 g gacha cho'kma hosil bo'lgan. Agar ularning kationlari +2 va +3 oksidlanish holatiga ega bo'lsa va oksidlarning molar nisbati 1: 1 bo'lsa (metal oksidi oksidlanish holati +3 bilan amfoterik xususiyatlarga ega deb hisoblang) qotishma hosil qiluvchi metallar sifatli tarkibini aniqlang.
75. Bir xil massaga ega ikkita alyuminiy bo'linmasi eritildi: biri kaliy gidroksid eritmasida, ikkinchisi esa xlorid kislotada. Evolvedan gazlarning hajmi (nos) bir-birlari bilan qanday bog'liq?
76. 1000 grammli alyuminiyli mis qotishmasi ortiqcha gidroksidi eritmasi bilan ishlangan, erimaydigan tuproq nitrat kislotada eritilib, eritma bug'langandan so'ng qoldiq doimiy og'irlik bilan kaltsiylangan. Yangi qoldiqning miqdori 0,3998 g dir. Qotishma metalllar massasi nima?
77. 20 g og'irlikdagi sink va misning bir qotishmasi massa ulushi 30% va zichligi 1,33 g / sm3 bo'lgan NaOH eritmasidan ko'p miqdorda ishlangan. Qattiq qoldiq izolyatsiya qilingan va konsentrlangan HNO3 eritmasidan ko'p miqdorda ishlov berildi. Ushbu jarayon davomida hosil bo'lgan tuz izolyatsiya qilingan va doimiy og'irlikda kaltsillangan. Qattiq qoldiqning massasi 10,016 g bo'lib, qotishmalarda metallning massa ulushlarini va iste'mol qilinadigan gidroli eritmaning hajmini hisoblang.
2 g gacha bo'lgan mis va alyuminiy qotishmasi gidroksidi eritmasidan ortiqcha ishlov berildi. Qoldiq, suzilgan, yuvilgan, HNO3 ichida eritilgan, eritma bug'lanib va qattiq vaznga kalsinatsiyalangan. Kalsinlanishdan keyin qoldiqning massasi 0,736 g bo'lgan. Qotishmalarda metallning massa ulushlarini hisoblang.
79. Temir, mis va alyuminiy aralashmalarining klorlanishi 8,96 dm 3 xlor (NU) ni talab qiladi va shu namunaning vodorod xlor bilan o'zaro ta'siri 5.6 dm 3 (NU) ni talab qiladi. Metalllarning ishqoriy bilan aralashmasi bilan bir xil massa bilan aloqa qilishda 1,68 dm 3 (NU) gaz chiqadi. Aralashmaning kimyoviy miqdori toping.
80 grammli kaliy hidrit miqdori 80 sm 3 hajmli suvda eritildi va natijada olingan eritma 0.81 g og'irlikdagi alyuminiy qo'shildi. Natijada olingan eritmadagi moddalarning massa ulushlarini foizning yuzdan bir qismigacha aniqlik bilan toping.
ADABIYOTLAR RO'YXATI
1. Baranov, V.P. Noorganik birikmalarning zamonaviy rus nomenklaturasi / V.P. Barannik // Umumjamol kimyoviy jamiyati jurnali. D.I. Mendeleev. - 1983. - XXVIII. - 9-16-betlar.
2. Wroblewski, A.I. Kimyo simulyatori / A.I. Wroblewski. - 2-nashr., Pererab. va qo'shing. - Minsk: Krasiko-Print, 2007. - 624 p.
3. Glinka, N.L. Umumiy kimyo fanining vazifalari va mashqlari: tadqiqotlar. Universitetlar uchun qo'llanma / ed. V.A. Rabinovich va X.M. Rubina. - M .: Integral-Press, 2004. - 240 p.
4. Lidin, R.A. Umumiy va noorganik kimyo vazifalari: tadqiqotlar. yuqori talabalar uchun qo'llanma. tadqiqotlar. muassasalar / R.A. Lidin, V.A. Sut, L.L. Andreeva; tomonidan. R.A. Lidina. - M .: VLADOS, 2004. - 383 p.
5. Lidin, R.A. Noorganik moddalar nomenklaturasining asoslari / R.A. Lidin [et al.]; tomonidan. B.D. Stepina. - M.: Kimyo, 1983. 112 bet.
6. Stepin, B.D. IUPAC qoidalarini noorganik moddalar nomenklaturasiga Rossiya / B.D. Stepin, R.A. Lidin // Butunjahon kimyoviy jamiyatining jurnali. D.I. Mendeleev. - 1983. - XXVIII. - 17-20-betlar.
| Kirish .................................................................. Noorganik moddalar diapazoni uchun umumiy qoidalar ... oksidi ....................................... Asosiy oksid ...................................................... ... kislota oksidi .................................... ............................ Amfoterik oksidlar ................................................................. Oksidlarni olish ......................................................................... Mustaqil ish uchun mashq "Oksid" mavzusi .................................................................. Kislotalar .............................................................................. «Asitlar» mavzusidagi mustaqil ish uchun mashqotlar ................................................................. ........................................................................ "Vaqflar" mavzusidagi mustaqil ish uchun mashqotlar .................................................................. Tuzlar .......................................................................... "Tuzlar" mavzusidagi mustaqil ish uchun mashqotlar ................................................................... Noorganik birikmalar sinflari orasidagi genetik munosabatlar. "Noorganik birikmalar sinflari orasidagi genetik aloqalar" mavzusida mustaqil ish olib borish mashqlari ................................................................... "Noorganik birikmalarning asosiy toifalari ..." ..... Hisoblash vazifalari |
ta'lim: "genetik ketma-ketlik", "genetik bog'lanish" tushunchalarini belgilash; genetik ketma-ketlikdagi reaktsiya tenglamalarini yaratish uchun elementlarning (metallarning va nometalllarning) genetik ketma-ketligini yaratishni o'rgatish; oksidlar, kislotalar, tuzlar, bazlarning kimyoviy xossalari haqidagi bilimlarni qanday o'zlashtirishini tekshirish;
rivojlanmoqda: xulosani tahlil qilish, qiyoslash, umumlashtirish va xulosa qilish qobiliyatini rivojlantirish, kimyoviy reaktsiyalar tenglamalarini yaratish;
ta'lim : ilmiy dunyoqarashni shakllantirishga yordam beradi.
2. Sinflarni ta'minlash: "Periyodik tizim", "Eriydiganlik jadvali", "Metall faoliyati seriyali", talabalarga ko'rsatmalar, bilimlarni sinash uchun topshiriqlar.
3. Ishlash tartibi:
3.1. Frontal so'rov.
3.2. Vazifalarni hal qilish.
3.3. Variantlarda tekshirish ishlarini bajarish.
4. Hisobotni joylashtirish:
4.1. Amaliy mashg'ulot mavzusini va maqsadlarini yozing.
4.2. Muammolarni hal qilish.
4.3. O'zingizning mustaqil ishingizning versiyasini, daftarchada yozishni va o'qituvchini ko'rib chiqish uchun topshiring.
Ishlar davom etmoqda
1. Dastlabki suhbat:
Genetik bog'lanish nima?
Genetika aloqasi - bu ularning interkonsiyalari asosida turli sinflar orasidagi aloqalardir.
Genetik qator nima?
Genetik qator - bir qator moddalar - turli kimyoviy elementlarning aralashmalari bo'lgan turli sinflarning vakillari, o'zaro aloqalar bilan bog'langan va bu moddalarning o'zgarishini aks ettiruvchi. Ushbu seriyalarning asosi bir xil element.
Odatda qanday genetik qatorlar ajratiladi?
Metalllarning ikkita turi mavjud:
a) gidroksidi asosi sifatida faoliyat ko'rsatadigan genetik qator. Ushbu turkum quyidagi o'zgarishlarni qo'llash orqali ifodalanishi mumkin:
metall → asosiy oksid → gidroli → tuz
masalan, kaliy K + K 2 O → KOH → KCl ning genetik seriyali
b) bazasi eruvchan tayanch bo'lgan genetik ketma-ketlikdir, unda seriya o'zgarish zanjiri sifatida ifodalanishi mumkin:
metall → baz oksidi → tuz → erimaydigan poydevori → asosiy oksid → metall
masalan: Cu → CuO → CuCl 2 → Cu (OH) 2 → CuO → Cu
Non-metallar orasida ikkita satrni ajratish mumkin:
a) Eriydigan kislota ketma-ketlikda bog'lanish sifatida faoliyat yuritadigan nometall bo'lmagan genlarning seriyasi. O'zgarishlar zanjiri quyidagicha ifodalanishi mumkin: metall bo'lmagan → kislota oksidi → eruvchan kislota → tuz.
Masalan: P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
b) erimaydigan kislota bo'lmagan natriyning genetik qatori: metall bo'lmagan → kislota oksidi → tuz → kislota → kislota oksidi → neytral bo'lmagan ketma-ketlikda
Misol uchun: Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Vazifalar bo'yicha vazifalarni bajarish:
| 1-variant | Variant 2 |
|
I variant: ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2
Opsiyon II: Na2S04, NaOH, Na2, Na2O2, Na2O
Uy vazifasi: kaltsiydan kaltsiy karbonatiga bosqichma-bosqich o'tish va tibbiyotda biron bir tuzni ishlatish bo'yicha hisobot tayyorlash (qo'shimcha adabiyotlardan foydalanish).
Amaliy dars uchun ko'rsatma
Noorganik moddalarning asosiy sinflari o'rtasidagi genetik munosabatlar.
Maqsadlar: "genetik ketma-ketlik", "genetik bog'lanish" tushunchalarini belgilash; Genetika seriyasiga mos keladigan reaktsiya tenglamalarini hosil qilish uchun elementlarning genetik qatorlarini (metallarni va nometallalarni) o'rganishni o'rganish; oksidlar, kislotalar, tuzlar, asoslarni takrorlang.
Ishlar davom etmoqda
Tushunchalarning ta'riflarini yozing:
Genetik munosabatlar - __________________________________________
Genetik satr - ___________________________________________
Alkali baz bo'lib ishlaydigan metallarning genetik qatori. umuman vakili: metall → asosiy oksid → gidroli → tuz. Ushbu seriyali kaliydan foydalaning. Reaktsiyalarning tenglamalarini yozing, natijada bu o'zgarishlarni amalga oshiring.
Eriydigan kislota seriyasidagi bog'lanish sifatida faoliyat ko'rsatadigan nometall bo'lmagan genlarning seriyasi quyidagi kabi ifodalanadi: metall bo'lmagan → kislota oksidi → eruvchan kislota → tuz. Ushbu ketma-ketlikni fosfor yordamida qiling. Reaktsiyalarning tenglamalarini yozing, natijada bu o'zgarishlarni amalga oshiring.
Genetik satr, bu erda tayanch eruvchan emas transformatsiyalar zanjiri bilan ifodalanadigan bo'lishi mumkin: metall → asosiy oksid → tuz → erimaydigan tayanch → asosiy oksid → metal. Ushbu ketma-ketlikni mis yordamida tuzing. Reaktsiyalarning tenglamalarini yozing, natijada bu o'zgarishlarni amalga oshiring.
Eriydigan kislota ketma-ketlikda bog'lanish sifatida faoliyat ko'rsatadigan nometall bo'lmagan genlarning seriyasi transformatsiyalar zanjiri bilan ifodalanadigan bo'lishi mumkin: metall bo'lmagan → kislota oksidi → tuz → kislota → kislota oksidi → metall bo'lmagan. Ushbu ketma-ketlikni silikon yordamida tuzing. Reaktsiyalarning tenglamalarini yozing, natijada bu o'zgarishlarni amalga oshiring.
Variantlar uchun vazifalarni bajarish:
| 1-variant | Variant 2 |
|
1. Sizning versiyangizdagi oksidli formulalarni tanlang, sizning tanlovingizni tushuntiring, bu aralashmalar sinfining tarkibiy xususiyatlarini bilib oling. Ularni chaqiring.
Variantingizning formula ustunida kislota formulalarini toping va bu birikmalar tarkibini tahlil qilish asosida tanlovingizni tushuntiring.
3. kislota tarkibida kislota qoldiqlarining valentlarini aniqlang.
4. Tuzli formulalarni tanlang va ularni nomlang.
5. Variantingiz magniy va kislotalar bilan tuzilishi mumkin bo'lgan tuzlarning formulalarini tuzing. Ularni yozing, uni yozing.
6. O'zgarishlaringizning ustunli ustunida, asosiy formulalarni toping va bu birikmalar tarkibini tahlil qilish asosida tanlovingizni tushuntiring.
7. O'zingizning variantingiz bo'yicha, ortofosfor kislotasi eritmasi (gidroklorik, oltingugurtli) reaksiyaga kirishishi mumkin bo'lgan moddalarning formulalarini tanlang. Tegishli reaktsiya tenglamalarini bajaring.
9. Sizning variantingizning formulalari orasida bir-biri bilan ta'sirlasha oladigan moddalar formulalarini tanlang. Tegishli reaktsiya tenglamalarini bajaring.
10. Noorganik birikmalarning genetik birikmalariga zanjir hosil qiling, ular tarkibida sizning versiyangizda birinchi raqamda berilgan modda mavjud.
Ushbu moddalardan barcha formulalarni ishlatib, genetik chiziq hosil qilish. Reaksiya tenglamalarini yozing, bu bilan siz bu o'zgarishlarni amalga oshiring:
Men variant: ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2
IIvariantni tanlang: Na 2SO 4, NaOH, Na, Na2O2, Na2O
Uy vazifasi: kaltsiydan kaltsiy karbonatiga bosqichma-bosqich o'tish va tibbiyotda biron bir tuzni ishlatish bo'yicha hisobot tayyorlash (qo'shimcha adabiyotlardan foydalanish).
