Metal olmayan örneklerin genetik serileri. Madde sınıfları arasındaki genetik ilişki - Bilgi Hipermarketi
Basit maddeler, oksitler, bazlar, asitler ve tuzlar arasında, yani karşılıklı geçiş olasılığı (dönüşüm) arasında genetik bir bağlantı vardır.
Örneğin, basit bir madde - oksijen ile etkileşimin bir sonucu olarak kalsiyum bir okside dönüşür: 2Ca + 02 = 2CaO.
Su ile etkileşime girdiğinde kalsiyum oksit kalsiyum hidroksit oluşturur CaO + H20 = Ca (OH) 2 ve ikincisi asit ile etkileşime girdiğinde bir tuza dönüşür: Ca (OH) 2 + H2S04 = CaS04 + 2H2O
Bu dönüşümler şema ile temsil edilebilir:
Ca → CaO → Ca (OH) 2 → CaSO 4
Metal olmayan, örneğin kükürt için benzer bir şema yazılabilir:
S → SO3 → H 2S04 → CaS04
Böylece aynı tuz çeşitli şekillerde elde edilir.
Tuzdan diğer inorganik bileşik sınıflarına ve basit maddelere ters geçiş de mümkündür:
CuSO 4 → Cu (OH) 2 → CuO → Cu
CuS04 + 2NaOH = Cu (OH) 2 ↓ + Na2S04
Cu (OH) 2 = CuO + H20
CuO + H2 = Cu + H20 (bakır azaltma)
İnorganik bileşik sınıfları arasında, bir sınıftaki maddelerin diğerlerinden olan maddelerin üretimine dayanan benzer bir ilişki genetik olarak adlandırılır.
Kompleks bileşiklerin özellikleri, ana inorganik bileşik sınıflarının genetik şemasına yansıtılmaktadır (şekle bakınız). Tipik metallerden zıt özelliklere sahip tipik metal olmayan metallere kadar iki ana hat boyunca inorganik maddenin gelişme aşamalarını yansıtır.
Bir atomun kimyasal özelliği elektronları bağışlama kabiliyeti olan metaller ve temel kimyasal özelliği, özelliklerinde birbirlerinin karşısına elektron bağlayabilmeleri olan metal olmayan metallerdir. Maddelerin bileşimindeki karışıklıkla birlikte, bu karşıt eğilimler ortaya çıkmaya devam ediyor.
En düşük oksidasyon durumundaki tipik metaller ve geçiş elemanları bazik oksitler, yüksek oksidasyon durumundaki tipik metal olmayanlar ve geçiş elemanları zıt asit oksitler oluştururlar.
Basit maddeler
amfoterik
Sigara metaller
Bazik oksitler
amfoterik
asidik
zeminler
amfoterik
hidroksitler
İnorganik bileşiklerin ana sınıflarının genetik şeması
Maddelerin bileşiminin daha da karmaşıklaşmasıyla birlikte, hidroksitler, baza karşılık gelen baz oksitler ve aside karşılık gelen asit oksitler oluşturulur. Özelliklerde ve aside zıt bazlar aktif olarak birbirleriyle reaksiyona girerek tuz oluştururlar. Karşıtların etkileşimi, reaksiyonun itici gücüdür. Bu nedenle, bazik ve asidik oksitler, bazlar ve asitler birbirleriyle aktif olarak etkileşime girerler ve iki asidik oksit veya iki bazik oksit, özellikleri yakın olduğu için etkileşime girmez.
Böylece, karmaşık bir bileşiğin özellikleri, kurucu elementlerinin özelliklerine dayanarak belirlenir. Bu özelliklerin değişiminin ana yasaları aşağıdaki uygulamalarda özetlenmiştir (Tablo 6).
1. Sıra sayısında artış olan dönemlerde, elemanların özellikleri metalikten metalik olmayana değişir. Dış seviyedeki elektronların sayısı artar, elementin oksidasyon derecesi artar, atom ve iyon yarıçapı düşer, iyonlaşma enerjisi ve elektron için afinite artar. Buna göre, bazik azalır ve oksitlerin ve hidroksitlerin asidik özellikleri artar.
2. Ana alt gruplarda, artan atom sayısı ile birlikte oksitlerin ve hidroksitlerin temel özellikleri artar. Sıra sayısında artış gösteren yan grupların elemanları için özelliklerde daha karmaşık bir değişiklik karakteristiktir. İlk önce, metalik özellikler geliştirilmiş ve sonra azaltılmıştır.
3. Aktif metaller, kuvvetli şekilde belirgin bazik özelliklere sahip oksitler ve hidroksitlere karşılık gelir. En aktif metaller alkali ve toprak alkalidir. Alkaliler - suda çözünür oksitler ve güçlü çözünür bazlar oluştururlar.
4. Düşük aktif metaller (alkali ve alkali toprak hariç tümü) suda çözünmesi zor olan zayıf bazlar oluşturur:
Cu (OH) 2, Fe (OH) 3.
5. Kuvvetli şekilde belirgin asidik özelliklere sahip oksitler ve hidroksitlerin aktif metal olmayanlara karşılık gelmesi.
6. Amfoterik metaller amfoterik oksitler ve hidroksitler oluşturur.
7. Bir element farklı derecelerde oksidasyon gösterirse, farklı özelliklere sahip oksitler ve hidroksitlere karşılık gelir.
Konu: Metaller ile metal olmayanlar ve bunların bileşikleri ARASINDAKİ GENETİK BAĞLANTI. 9. sınıf
Amaçlar: eğitim: "genetik seri", "genetik bağlantı" kavramını pekiştirmek; genetik diziye karşılık gelen reaksiyon denklemlerini oluşturmak için genetik element dizilerinin (metaller ve metal olmayan) nasıl yapıldığını öğretmek; bilginin nasıl öğrenildiğini kontrol edin kimyasal özellikler oksitler, asitler, tuzlar, bazlar; geliştirme: analiz etme, karşılaştırma, özetleme ve sonuçları çıkarma, kimyasal reaksiyon denklemlerini oluşturma yeteneğini geliştirmek; Eğitimsel: Bilimsel bir dünya görüşü oluşumunu teşvik etmek.
Sınıfları sağlamak: "Periyodik Sistem", "Çözünürlük Tablosu", "Metaller Etkinlik Serisi" tabloları, öğrenciler için talimatlar, bilgi test etme görevleri.
İlerleme: 1) Org. an
2) d / s'yi kontrol edin
3) Yeni materyal çalışın
4) Sabitleme
5) D / C
1) Org. an Hoş geldiniz.
2) d / s'yi kontrol edin.
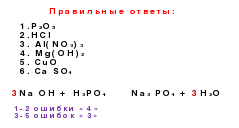
Genetik bağlantılar, etkileşimlerine bağlı olarak farklı sınıflar arasındaki bağlantılardır.
İnorganik madde sınıflarını bilerek, genetik seri metalleri ve metal olmayan maddeleri yapmak mümkündür. Bu serilerin temeli aynı unsurdur.
Metaller arasında iki tür satır vardır:
1
. Alkalinin baz olarak görev yaptığı genetik seri. Bu seri aşağıdaki dönüşümleri kullanarak gösterilebilir:metal → bazik oksit → alkali → tuz
Örneğin, K → K
2 O → KOH → KCl2
. Bazın çözünmeyen bir baz olduğu genetik seri, daha sonra seri bir dönüşüm zinciri olarak gösterilebilir:metal → baz oksit → tuz → çözünmez baz →
→bazik oksit → metal
Örneğin, Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu
1
. Çözülebilen asidin seri içinde bir bağlantı görevi gördüğü metal olmayan genetik seri. Dönüşüm zinciri aşağıdaki gibi gösterilebilir:metal dışı → asit oksit → çözülebilir asit → tuz
Örneğin, P → P
2 Ey 5 → H 3 PO 4 → Na 3 PO 42
. Çözünmeyen asidin, seri içinde bir bağlantı görevi gördüğü metal olmayan genetik seri:metal olmayan → asit oksit → tuz → asit →
→asit oksit → metal olmayan
Örneğin
si→ SiO 2 → na 2 SiO 3 → 'H 2 SiO 3 → SiO 2 → si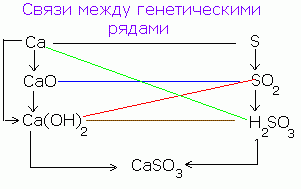
Açık görüşme:
Genetik bağlantı nedir? Genetik bağlantılar, birbirleriyle iç içe geçmiş olmalarına göre farklı sınıflar arasındaki bağlantılardır, genetik seri nedir?
Genetik seri - bir madde serisi - dönüşümlerle birbirine bağlanan ve bu maddelerin dönüşümlerini yansıtan bir kimyasal elementin bileşikleri olan farklı sınıfların temsilcileri. Bu serilerin temeli aynı unsurdur.
Hangi tip genetik seriler ayırt edilebilir? Metaller arasında iki tip seriler ayırt edilebilir:
a) Alkalinin baz görevi gördüğü bir genetik seri. Bu seri aşağıdaki dönüşümleri kullanarak gösterilebilir:
metal → bazik oksit → alkali → tuz
örneğin, potasyumun genetik serisi K → K
2 O → KOH → KClb) Bazın çözünmez bir baz olduğu genetik seri, daha sonra seri bir dönüşüm zinciri olarak gösterilebilir:
metal → baz oksit → tuz → çözünmez baz → baz oksit → metal
örneğin: Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → CuMetal olmayanlar arasında iki tür sırayı ayırt etmek de mümkündür:
a) Çözülebilen asidin seri içinde bir bağlantı görevi gördüğü metal olmayan genetik seri. Dönüşümler zinciri aşağıdaki şekilde temsil edilebilir: metal olmayan → asit oksit → çözülebilir asit → tuz.
Örneğin: P → P
2 Ey 5 → H 3 PO 4 → Na 3 PO 4b) Çözünmeyen asidin: metal dışı → asit oksidin → tuz → asit → asit oksidin → metal olmayan dizinin içinde bir bağlantı görevi gördüğü metal olmayan genetik sıra
Örneğin: Si → SiO
2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → SiSeçenekler için görevlerin yürütülmesi:
1. Sürümünüzdeki oksit formüllerini seçin, tercihinizi bu bileşik sınıfı bileşiminin özelliklerine göre açıklayın. Onları arayın.
2. Varyantınızın formül sütununda asit formüllerini bulun ve bu bileşiklerin bileşimlerinin analizine dayanarak seçiminizi açıklayın.
3. Asit kalıntılarının asit kompozisyonundaki değerlerini belirleyin.
4. Tuz formüllerini seçin ve adlandırın.
5. Magnezyum ve varyantınızın asitleri ile oluşabilecek tuzların formüllerini hazırlayın. Onları yazın, adlandırın.
6. Varyasyonunuzun formül sütununda, temel formülleri bulun ve bu bileşiklerin kompozisyonunun analizine dayanarak seçiminizi açıklayın.
7. Varyantınızda, bir ortofosforik asit çözeltisinin (hidroklorik, sülfürik) reaksiyona girebileceği maddelerin formüllerini seçin. Uygun reaksiyon denklemlerini yapın.
9. Seçeneğinizin formülleri arasında, birbirleriyle etkileşime girebilecek maddelerin formüllerini seçin. Uygun reaksiyon denklemlerini yapın.
10. Formülü bir numaralı sürümünde verilen bir maddeyi içeren inorganik bileşiklerin genetik bağ zincirini yapın.
Seçenek 1
Seçenek 2
CaO
HNO
3Fe (OH)
3N-
2 EyZn (NO
3 ) 2Cr (OH)
3'H
2 SO 3'H
2 SPbO
LiOH
Ag
3 PO 4P
2 Ey 5NaOH
ZnO
CO
2BaCl
2HCl
'H
2 CO 3'H
2 SO 4CuSO
4Bu maddelerden bütün formülleri kullanarak genetik bir çizgi oluşturur. Bu dönüşüm zincirini başarabileceğiniz reaksiyon denklemlerini yazın:
Ben seçenek: ZnSO
4, Zn, ZnO, Zn, Zn (OH) 2 : II seçeneği:na 2 SO 4, NaOH, na, na 2 Ey 2 , na 2 Ey4) Bağlama1.
Al→ Al 2 Ey 3 → AlCl 3 → Al( OH) 3 → Al 2 Ey 32.
P→ P 2 Ey 5 → 'H 3 PO 4 → na 3 PO 4 → Ca 3 ( PO 4 ) 23. Zn → ZnCl
2 → Zn (OH) 2 → ZnO → Zn (NO 3 ) 24. Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu5.N
2 Ey 5 → HNO 3 → Fe (NO 3 ) 2 → Fe (OH) 2 → FeS → FeSO 45) Ödev:
kalsiyumdan kalsiyum karbonata kademeli bir geçişi çizelgeleyin ve herhangi bir tuzun tıpta kullanımı hakkında bir rapor hazırlayın (ek literatür kullanarak).

Metaller arasında iki tür sıra ayırt edilebilir: 1. Alkalinin bir baz olarak etki ettiği genetik seri. Bu seri aşağıdaki dönüşümlerle gösterilebilir: metal - bazik oksit - alkali - tuz, örneğin, genetik potasyum K - K20 O - KOH - KCl serisi.

2. Çözünmeyen bir bazın bir baz olarak işlev gördüğü bir genetik seri, daha sonra seri bir dönüşümler zinciri olarak gösterilebilir: metal - baz oksit - tuz - çözülmez baz - baz oksit - metal. Cu - CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e Cu genetik bakır serisi "\u003e Cu, genetik bir bakır dizisidir"\u003e "title =" (! LANG: 2. Bazın çözünmez bir baz olduğu genetik seri, daha sonra seri bir dönüşüm zinciri olarak gösterilebilir: metal baz oksit - tuz - çözünmeyen baz - Ana oksit metaldir Cu - CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e"> title="2. Çözünmeyen bir bazın bir baz olarak işlev gördüğü bir genetik seri, daha sonra seri bir dönüşümler zinciri olarak gösterilebilir: metal - baz oksit - tuz - çözülmez baz - baz oksit - metal. Cu - CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e"> !}
Metal olmayanlar arasında, iki tür sırayı ayırt etmek de mümkündür: 1. Çözülebilir asidin, seri içinde bir bağlantı görevi gördüğü genetik olmayan metalik seri. Dönüşüm zinciri aşağıdaki gibi temsil edilebilir: metal olmayan - asit oksit - çözülebilir asit - sol. P-- P 2 O 5 - H 3 PO 4 - Na 3 PO 4. Fosfor Genetik Aralığı

İnorganik bileşiklerin sınıfları arasında genetik bir bağlantı vardır. Basit maddelerden karmaşık ve tam tersine alabilirsiniz. Bir sınıfın bileşiklerinden başka bir sınıfın bileşiklerini elde edebilirsiniz.
İnorganik bileşiklerin sınıfları arasındaki basitleştirilmiş genetik ilişki, aşağıdaki şema ile temsil edilebilir:
Metal olmayanlar için bu tür dönüşümlerin sekansı aşağıdaki şema ile gösterilebilir: CANPO 4
Р → Р 2 О 5 → Н 3 РО 4 → Са 3 (РО 4) 2
(Saon) 3 PO 4
Tipik metaller için aşağıdaki dönüşüm zincirini yapabilirsiniz:
Ba → BaO → Ba (OH) 2 → BaSO 4
Oksitleri ve hidroksitleri amfoterik olan (semimetal) metaller için aşağıdaki dönüşümler gerçekleştirilebilir:
Al → Al203 → Al (OH) 3 → Na → AlCl3 → AlOHCl2 → Al (OH) 3 → Al203.
Sınıflar arasındaki bağlantılar:
1. Metal olmayan metaller→ tuz.
Metallerin ve metallerin doğrudan etkileşimi ile oksijensiz asitlerin tuzları (halojenürler, sülfitler) oluşur:
2Na + C1 2 = 2NaCl
Bu bileşikler kararlıdır ve ısıtıldığında ayrışmazlar.
2. Bazik oksitler, asit oksitler→ tuz.
CaO + C02 = CaC03;
Na20 + S03 = Na2S04.
3. Bazlar, asitler→ tuz.
Nötralizasyon reaksiyonu ile gerçekleştirilir:
2NaOH + H2S04 = Na2S04 + 2H20,
HE - + H + → H20;
Mg (OH) 2 + 2HC1 = MgCl2 + 2H20,
Mg (OH) 2 + 2H + → Mg2 + + 2H2O
4. Metaller→ bazik oksitler.
Metallerin çoğu oksitler oluşturmak için oksijenle etkileşime girer:
2Ca + 02 = 2CaO;
4A1 + 3O2 = 2A1203.
Altın, gümüş, platin ve diğer asil metaller oksijenle etkileşime girmez, bu metallerin oksitleri dolaylı olarak elde edilir.
5. Metal olmayanlar→ asit oksitler.
Metal olmayan (halojenler ve soy gazlar hariç) oksijenle etkileşime girerek oksitler oluşturur:
4P + 5O2 = 2P205;
S + O 2 = S02.
6. Bazik oksitler→ tabanı.
Su ile doğrudan etkileşim sadece alkali ve toprak alkali metallerin (alkali) hidroksitleri elde edilebilir:
Na20 + H20 = 2NaOH;
CaO + H20 = Ca (OH) 2.
Kalan zemin dolaylı olarak elde edilir.
7. Asit oksitler→ asit elde edildi.
Asit oksitler, karşılık gelen asitleri oluşturmak için suyla reaksiyona girer:
S03 + H20 = H2S04;
R205 + 3H20 = 2H3PO4.
Bunun istisnası, suyla reaksiyona girmeyen Si02'dir.
8. Bazlar, asit oksitler→ tuz.
Alkaliler, tuzlar oluşturmak için asidik oksitler ile etkileşime girer:
2NaOH + S03 = Na2S04 + H20,
2OH - + S03 = S04 2- + H20;
Ca (OH) 2 + O2 = CaCO3 ↓ + H20,
Ca 2+ + 2OH - + C02 → CaCO 3 ↓ + H 2 O.
9. Asitler, bazik oksitler→ tuz.
Metal oksitler asitlerde çözünür ve tuz oluşturur:
CuO + H2S04 = CuS04 + H20,
CuO + 2H + = Cu2 + + H20;
Na20 + 2HS1 = 2NaCl + H20,
Na20 + 2H + = 2Na + + H20.
10. Zeminler→ bazik oksitler.
Çözünmeyen bazlar ve LiOH ısıtıldığında ayrışır:
2LiOH = Li20 + H20;
Cu (OH) 2 = CuO + H20.
11. Asitler→ asit oksitler.
Kararsız oksijen içeren asitler ısıtıldığında (H2S03) ve hatta ısıtmadan (H2C03, HC1O) ayrışır. Aynı zamanda, bir çok asit ısınmaya karşı dirençlidir (H2S04, H3P04).
H 2 SiO3 = H20 + Si02;
H2C03 = H20 + C02.
12. Metal oksitler→ metaller.
Bazı ağır metal oksitler metal ve oksijene ayrışabilir:
2HgO = 2Hg + 02.
Aynı zamanda, indirgeyici ajanların yardımıyla karşılık gelen oksitlerden metaller elde edilir:
3Mn02 + 4Al = 3Mn + 2Al203;
Fe203 + 3H2 = 2Fe + 3H2O
13. Asit oksitler→ olmayan metaller.
Metal olmayan oksitlerin çoğu ısıtıldığında ayrışmaz. Metal olmayan ve oksijen sadece bazı dengesiz oksitleri (halojen oksitler) ayrıştırır.
Bazı metal olmayan metaller, karşılık gelen oksitlerden indirgenerek elde edilir:
Si02 + 2Mg = 2MgO + Si.
14. Tuzlar, bazlar → bazlar.
Çözünmeyen bazlar, alkalilerin karşılık gelen asitlerin çözeltileri üzerindeki etkisiyle elde edilir:
CuS04 + 2NaOH = Cu (OH) 2↓ + Na2S04,
Cu2 + + 2OH - → Cu (OH) 2 ↓;
FeCl2 + 2KOH = Fe (OH) 2 ↓ + 2KCl,
Fe2 + + 2OH - = Fe (OH) 2 ↓.
15. Tuzlar, asitler → asitler.
Çözünür tuzlar, sonuç daha zayıf veya uçucu bir asitse, asitlerle (basınç serisine uygun olarak) reaksiyona girer:
Na2Si3 + 2HCl = 2NaCl + H2Si3S
SiO3 2- + 2H + → H2 SiO3 ~;
NaCl (s) + H2S04 (k) = NaHS04 + HC1.
16. Tuzlar→ bazik oksitler, asit oksitler.
Bazı oksijen içeren asitlerin (nitratlar, karbonatlar) tuzları ısıtıldığında ayrışır:
CaC03 = CaO + C02;
2Cu (N03) 2 = 2CuO + 4NO2 + 02.
BAĞIMSIZLIK ÇALIŞMALARI, İNORGANİK BİLEŞİKLERİN SINIFLARI ARASINDAKİ GENETİK BAĞLANTI KONUĞU ÇALIŞMALARI
1. Aşağıda listelenen maddelere isim verin, inorganik bileşiklerin sınıflarına dağıtın: Na3P04, H2Si3, NO, B203, MgS, BaI2, Ca (OH) 2, KNO3, HNO2, Cl2 O7, Fe (OH) 2, P205, HF, MnO2.
2. Aşağıda listelenen hangi maddelerden bir aşamada hidroksit (asit veya baz) elde etmek mümkündür: bakır, demir oksit (P), baryum oksit, azot oksit (P), azot oksit (V), silikon oksit, bakır sülfat, potasyum klorür potasyum, magnezyum karbonat.
3. Yukarıdaki listeden, aşağıdakilerle ilgili maddelerin formüllerini yazınız: 1) oksitler; 2) zemin; 3) asitler; 4) tuzlar:
C02, NaOH, HC1, S03, CuS04, NaN03, KCl, H20S, Ca (OH) 2, P205, HNO3, Al (OH) 3'tür.
4. Maddeleri adlandırın: Zn (OH) 2, MgO, P203, NaHC03, H3P03, Fe2 (S04) 3, KOH, (AlOH) 3 (P04) 2, Ba (Mn04 ) 2, CO, HI. Her maddenin hangi sınıfa ait olduğunu belirtin.
5. Aşağıdaki maddelerin moleküler formüllerini yazın ve her bir maddenin hangi sınıfa ait olduğunu belirtin:
1) bakır (II) hidroksokarbonat;
2) azot oksit (V);
3) nikel (II) hidroksit;
4) baryum hidrojen fosfat;
5) perklorik asit;
6) krom (III) hidroksit;
7) potasyum klorat;
8) hidrojen sülfit asit;
9) sodyum çinkoat.
6. Aşağıdakiler arasındaki bağlantının reaksiyonlarına örnekler verin:
1) metal olmayan basit maddeler;
2) basit madde ve oksit;
3) oksitler;
4) oksit olmayan kompleks maddeler;
5) metal ve metal olmayan;
6) üç madde.
7. Aşağıdaki maddelerden hangisi reaksiyona girebilir:
1) karbon monoksit (IV): HC1, 02, N02, KOH, H20;
2) magnezyum oksit: Ba (OH) 2, HC1, C02, 02, HN03;
3) demir (II) hidroksit: KCl, HC1, KOH, O2, H20, HN03;
4) hidrojen klorit: Zn, MgO, ZnCl2, HN03, Ca (OH) 2, Cu, (ZnOH) Cl.
8. Aşağıdaki maddeler arasındaki etkileşim mümkün mü?
1) karbon monoksit (IV) ve potasyum hidroksit;
2) potasyum hidrosülfat ve kalsiyum hidroksit;
3) kalsiyum fosfat ve sülfürik asit;
4) kalsiyum hidroksit ve kükürt oksit (IV);
5) sülfürik asit ve potasyum hidroksit;
6) kalsiyum bikarbonat ve fosforik asit;
7) silika ve sülfürik asit;
8) çinko oksit ve fosfor oksit (V).
Olası reaksiyonların denklemlerini yazınız, oluştukları koşulları belirtiniz. Eğer reaksiyonlar farklı maddelere yol açabiliyorsa, uygulama koşullarındaki farkın ne olduğunu belirtin.
9. Aşağıdaki maddeleri elde etmek için reaksiyonların denklemlerini verin: sodyum ortofosfat (4 yol), potasyum sülfat (7 yol), çinko hidroksit.
10. Soda (sodyum karbonat) üretme yöntemlerinden biri, suyun ve karbon monoksitin (IV) sodyum alüminat üzerindeki etkisidir. Reaksiyon denklemlerini oluşturur.
11. Katsayıları değiştirir, reaksiyon ürünlerini yazar:
1) MgO + 2H2S04 →
2) 2S02 + Ba (OH) 2 →
3) 3N205 + 2Al (OH) 3 →
4) P205 + 4NaOH →
5) P205 + 6NaOH →
6) P205 + 2NaOH →
12. Farklı tuz türlerini almak için reaksiyon denklemlerini yapın:
1) S02 + Ba (OH) 2 → (orta ve asit tuzları),
2) A1203 + H20 + HNO3 → (orta tuz, bazik tuzlar),
3) Na20 + H2S → (orta ve asit tuzları),
4) S03 + Sa (OH) 2 → (orta ve bazik tuzlar),
5) CaO + H20 + P205 → (bazik tuz, asit tuzları).
13. Reaksiyon denklemlerini tamamlayın:
CaO + A1203 → CaHPO 4 + Ca (OH) 2 →
Cr203 + H2S04 → AlOHS04 + NaOH →
Cr203 + NaOH → CaC03 + C02 + H20 →
A1203 + HClO4 → Ca (HCO3) 2 + HC1 →
Mn207 + KOH → ZnS + H2S →
NO2 + Ca (OH) 2 → CaS04 + H2S04 →
Zn (OH) 2 + NaOH → (ZnOH) Cl + HCl →
Zn (OH) 2 + HNO3 → Bi (OH) 3 + H2S04 (yetersiz) →
AlCl3 + NaOH (eksik) → (FeOH) Cl + NaHS →
AlCl3 + NaOH → Na2Zn02 + H2S04 (fazla) →
AlC1 3 + NaOH (fazla) → Ca (Al02) 2 + HC1 (fazla) →
14. Aşağıdaki dönüşümleri gerçekleştirebileceğiniz reaksiyon denklemlerini yazın:
1) Cu → CuO → CuS04 → Cu (OH) 2 → CuC1 2 → Cu (NO 3) 2
2) Zn → ZnO → ZnS04 → Zn (OH) 2 → Na2 ZnO2 → ZnCl2
3) Р → Р 2 O 5 → Н 3 РО 4 → К 3 РО 4 → Са 3 (РО 4) 2 → Н 3 РО 4
4) Mg → MgO → MgCl2 → Mg (OH) 2 → Mg (HSO 4) 2 → MgS04
5) Ca → CaO → Ca (OH) 2 → CaCO 3 → Ca (HCO 3) 2 → CO 2
6) Cr → Cr2 (S04) 3 → Cr (OH) 3 → NaСrO2 → Cr203 → K
7) P → P 2 O 5 → HPO 3 → H3P04 → NaH2PO4 → Na3PO4
8) CuS → CuO → CuS04 → Cu (OH) 2 → CuO → Cu
9) Al → Al 2 O 3 → Al 2 (SO 4) 3 → Al (HSO 4) 3 → Al (OH) 3 → K
10) S → S02 → S03 → NaHS04 4 → Na2S04 → BaS04
11) Zn → ZnO → ZnCl2 → Zn → Na2
12) Zn → ZnS04 → ZnCl2 → Zn (OH) 2 → Na2 → Zn (NO3) 2
13) Ca → CaCl2 → CaCO3 → Ca (HCO 3) 2 → Ca (NO 3) 2
14) Ca → Ca (OH) 2 → CaCO3 → CaCl2 → CaCO3 → Ca (NO 3) 2
15) CuO → CuCl2 → Cu (N03) 2 → CuO → CuS04 → Cu
16) CaO → Ca (OH) 2 → Ca (NO 3) 2 → Ca (NO 2) 2 → HNO 2 → NaNO 2
17) MgO → MgS04 → MgCl2 → Mg (N03) 2 → Mg (OH) 2 → MgO
18) S02 → H 2 S03 → KHSO 3 → K 2 S03 → KHSO 3 → S02
19) P 2 O 5 → H3P04 → Ca (H2P04) 2 → Ca3 (P04) 2 → Ca (H2P04) 2 → CaHPO 4
20) C02 → Ca (HCO3) 2 → CaC03 → CaCl2 → Ca (NO3) 2 → CaS04
21) PbO → Pb (NO3) 2 → PbO → Na2PbO2 → Pb (OH) 2 → PbCl2
22) ZnO → ZnS04 → Zn (OH) 2 → Na2 ZnO2 → Zn (OH) 2 → K2
23) Al203 → AlCl3 → Al (OH) 3 → NaA102 → Al (OH) 3 → K
24) ZnS04 → Zn (OH) 2 → ZnCl2 → Zn → ZnO → Zn (NO3) 2
25) AlCl3 → Al (NO3) 3 → Al (OH) 3 → NaA102 → A1C1 3 → Al
26) Pb (NO3) 2 → Pb (OH) 2 → PbO → Na2PbO2 → Pb (OH) 2 → PbS04
27) Fe 2 (S04) 3 → FeCl3 → Fe (OH) 3 → FeOH (NO3) 2 → Fe (NO3) 3 → Fe203
28) K → KOH → KHSO 4 → K2S04 → KCl → KNO 3
29) Cu (OH) 2 → CuOHNO3 → Cu (NO3) 2 → CuS04 → CuCl2 → Cu (NO3) 2
30) CaCl2 → Ca → Ca (OH) 2 → CaCl2 → Ca (NO 3) 2 → CaS04
31) Cu → Cu (N03) 2 → Cu (OH) 2 → CuSO 4 → Al 2 (SO 4) 3 → A1C1 3
32) Mg → MgS04 → MgCl2 → MgOHCl → Mg (OH) 2 → MgOHNO3
33) CuS04 → CuCl2 → ZnCl2 → Zn (OH) 2 → Na2 ZnO2 → Zn (OH) 2
34) Hg (NO3) 2 → Al (NO3) 3 → A1203 → NaA102 → A1 (OH) 3 → A1HCl2
35) ZnS04 → Zn (OH) 2 → ZnCl2 → AlCl3 → Al (OH) 3 → A1203
36) CuCl2 → Cu (OH) 2 → CuS04 → ZnS04 → Zn (OH) 2 → Na2Zn02
37) Fe (NO3) 3 → FeOH (NO3) 2 → Fe (OH) 3 → FeCl3 → Fe (NO3) 3 → Fe
38) Al203 → AlCl3 → Al (OH) 3 → NaA102 → NaNO3 → HNO3
39) Mg (OH) 2 → MgS04 → MgCl2 → Mg (N03) 2 → Mg (OH) 2 → MgO
40) alüminyum sülfat → alüminyum klorür → alüminyum nitrat → alüminyum oksit → potasyum alüminat → alüminyum hidroksit → alüminyum hidroksit → alüminyum klorür.
41) Na → NaOH → Na3P04 → NaNO3 → HNO3 → N205
42) BaCO 3 → Ba (HCO 3) 2 → BaCO 3 → (BaOH) 2 CO3 → BaO → BaSO 4
43) Cu → CuS04 → (CuOH) 2S04 → Cu (OH) 2 → Cu (HSO 4) 2 → CuS04
44) baryum → baryum hidroksit → baryum bikarbonat → baryum klorür → baryum karbonat → baryum klorür → baryum hidroksit
45) P → P205 → H3P04 → Ca (H2P04) 2 → CaHPO 4 → Ca3 (PO4) 2
46) Cr → CrO → Cr203 → NaCrO2 → CrCl3 → Cr (OH) 3 → Cr203 → Cr
47) Cr203 → CrCl3 → Cr (OH) 3 → Na3 → Cr2 (SO 4) 3 → CrCl3
48) K → KOH → KCl → KOH → K2S04 → KNO 3 → KNO 2
49) S → FeS → H 2 S → S02 → S → ZnS → ZnO → ZnCl2 → Zn (OH) 2 → K 2
50) C → CO 2 → CO → CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2
51) С → C02 → NaHC03 → Na2C03 → C02
52) S → S02 → K2S03 → KHSO3 → K2S03
53) Cu → Cu (OH) 2 → Cu (N03) 2 → CuO → Cu
54) R 2 02 5 → H 3 4 4 → СаНРО 4 → D (2 2 4 4) 2 → D 2 (8 4) 2
55) Fe → FeCl2 → Fe (OH) 2 → FeSO 4 → Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (N03) 2 → ZnO
57) CuS → S02 → KHSO3 → CaS03 → S02
58) S02 → H2S04 → CuS04 → CuO → Cu (N03) 2
59) KHSO 3 → CaS03 → Ca (HSO 3) 2 → S02 → K2S04
60) S02 → CaS03 → S02 → NaHS03 3 → S02
61) NaHC03 → Na2C03 → NaCl → NaHS04 → Na2S04
62) K → KOH → KCl → KNO3 → K2S04 → KCl
63) NaCl → Na → NaOH → Na2S04 → NaCl
64) Al → AlCl3 → Al (OH) 3 → A1203 → Al (OH) 3
65) CuO → Cu → CuCl2 → CuS04 → CuS
66) Fe → FeSO 4 → Fe (OH) 2 → Fe → Fe (OH) 3
67) Fe → Fe (OH) 2 → FeCl2 → Fe (NO 3) 2 → Fe
68) Fe (NO3) 3 → Fe203 → FeCl3 → Fe (NO3) 3 → Fe
69) CuO → CuS04 → Cu (OH) 2 → CuO → Cu
70) MgC03 → MgO → MgCl2 → Mg (OH) 2 → Mg (NO3) 2
71) Mg → Mg (OH) 2 → MgS04 → MgC03 → Mg (HC03) 2
72) CaO → Ca (OH) 2 → CaCl2 → CaCO 3 → CO 2
73) CaCO 3 → Ca (HCO 3) 2 → CaCl2 → Ca (NO 3) 2 → 02
74) FeS → Fe203 → Fe (OH) 3 → Fe2 (SO4) 3 → FeCl3
75) KS1 → K2S04 → KOH → K2C03 → KOH
76) CuS → CuO → Cu (OH) 2 → CuS04 → Cu
77) Fe → Fe (OH) 3 → Fe (NO3) 3 → FeCl3 → Fe2 (SO4) 3
78) CuSO 4 → CuO → Cu (N03) 2 → CuO → CuS
79) ZnS → H 2 S → S02 → Na2S04 → NaOH
80) Al → Al (OH) 3 → A1 2 (S04) 3 → A1203 → Al (OH) 3
81) CaCl2 → CaCO 3 → Ca (HCO 3) 2 → CaCO 3 → CaSiO 3
82) S → ZnS → H 2 S → Ca (HSO 3) 2 → S02
83) Na2S04 → NaCl → HC1 → CaCl2 → Ca (N03) 2
84) Na2S03 → S02 → H2S04 → HC1 → FeCl2
85) С → Na 2C03 → CaCO3 → CaSiO 3 → H 2 SiO3
86) P → P205 → Ca (H 2 PO 4) 2 → CaHPO 4 → H 3 PO 4
87) Al → A1203 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
88) HCI → CuCl2 → Cl2 → HCI → H2
89) P205 → Na2 HPO 4 → Na3P04 → Ca3 (PO4) 2 → CaS04
90) NH3 → NH4 C1 → NH3H2O → NH4HCO3 → NH3
91) NH4C1 → KC1 → HC1 → CuCl2 → Cu (OH) 2
92) NH3 → NH4H2P04 → (NH4) 2 HPO4 → NH3 → NH4NO3
93) KOH → KHC03 → K2C03 → CO2 → Ca (HC03) 2
94) Na → NaOH → NaHC03 → Na2S04 → NaOH
95) KNO 3 → K2S04 → KC1 → KNO 3 → KNO 2
96) Cl 2 → KC1 → K2S04 → KNO 3 → KHSO 4
97) FeSO 4 → FeS → SO 2 → KHSO 3 → K 2 SO 4
98) KOH → Cu (OH) 2 → CuS04 → Cu (OH) 2 → Cu
99) Fe203 → FeCl3 → Fe (OH) 3 → Fe (NO 3) 3 → Fe203
100) Al → A1203 → A1 (NO3) 3 → A1203 → A1 (OH) 3
101) CaO → CaCO 3 → CaSiO 3 → Ca (NO 3) 2 → 02
102) Cu → Cu (OH) 2 → Cu → CuS04 → CuCl2
103) H 2 S → S02 → ZnS04 → ZnS → ZnO
104) Cl2 → NaCl → HCl → CuCl2 → CuO
105) Cl 2 → FeCl3 → Fe203 → Fe (OH) 3 → Fe (NO3) 3
106) P 2 O 5 → Ca 3 (PO 4) 2 → H3P04 → CaHPO 4 → Ca (H 2 PO 4) 2
107) ZnS → ZnO → Zn → ZnCl2 → Zn (NO 3) 2
108) ZnO → ZnS04 → Zn (N03) 2 → ZnO → Zn (OH) 2
109) H3P04 → NH4H2P04 → (NH4) 2 HPO 4 → Na3P04 → Ca3 (PO4) 2
110) CaCO 3 → Na2C03 → Na3P04 → NaH2P04 → Ca3 (PO4) 2
111) CaCl2 → CaS03 → Ca (OH) 2 → CaCl2 → Ca (NO 3) 2
112) NaOH → Na2C03 → NaHS04 → NaN04 → NaHS04
113) Na2Si3 → Na2C03 → Na2S04 → NaCl → Na2S04
114) KNO 3 → KHSO 4 → K2S04 → KCl → Na2S04
115) Si02 → K2 Si02 → H2 Si02 → Si02 → CaSi03
116) Cu → CuCl2 → Cu (NO3) 2 → NO2 → HNO3
117) Ca (N03) 2 → 02 → Si02 → H2 Si02 → Si02
118) P → H3P04 → Ca3 (P04) 2 → CaHPO 4 → Ca (H2P04) 2
119) CuS04 → Cu → CuS → CuO → CuCl2
120) Al → A1 2 (S04) 3 → Al (OH) 3 → A1C1 3 → A1 (NO3) 3
121) S → S03 → H2S04 → KHS04 → BaS04
122) N205 → HNO3 → Cu (N03) 2 → CuO → Cu (OH) 2
123) Al → A1203 → Al (OH) 3 → A1 2 (S04) 3 → A1 (NO3) 3
124) Ca → Ca (OH) 2 → Ca (HCO 3) 2 → CaO → CaCl2
125) NH3H2O → NH4C1 → NH3 → NH4HC03 → (NH4) 2C03
126) Cu (OH) 2 → H20 → HNO 3 → Fe (NO 3) 3 → Fe
127) S02 → Ca (HSO3) 2 → CaCl2 → Ca (OH) 2 → Ca (HCO 3) 2
128) NH3H2O → NH4HCO3 → CaCO3 → CaSiO 3 → CaCl2
129) CuSO 4 → Cu → CuO → Cu (OH) 2 → Cu
130) Fe (OH) 3 → Fe → FeCl3 → Fe (NO 3) 3 → Fe
131) Zn → Zn (OH) 2 → Na2 → Zn (OH) 2 → Na2 ZnO2 → Zn
132) Zn → ZnO → Na2 ZnO2 → Zn (OH) 2 → Na2 → ZnCl2
133) Zn → K2 ZnO2 → ZnSO 4 → K2 → Zn (NO3) 2 → ZnO
134) ZnO → Zn (OH) 2 → K2ZnO2 → ZnSO 4 → ZnCl2 → ZnO
135) Zn → Na2 → Na2 ZnO2 → Zn (NO3) 2 → ZnO → Zn
136) Al → K3 → Al (OH) 3 → Na3 → A1C1 3 → Al (OH) 3
137) A1203 → KA102 → A1 (OH) 3 → A1203 → Na3 → A1203
138) Al (OH) 3 → A1203 → K3 → A1 2 (S04) 3 → A1 (NO3) 3
139) A1C1 3 → K3 → Al (NO3) 3 → NaA102 → A120
140) Be → Na 2 → Be (OH) 2 → Na 2 BeO 2 → BaBeO 2
“INORGANİK BİLEŞİKLERİN TEMEL SINIFLARI” KONUSU DENEYSEL DENEYİMLER
DENEYİM 1.Nötralleşme Reaksiyonları.
a) Güçlü bir asit ve güçlü bir bazın etkileşimi.
Bir porselen kalıba 5 ml 2N hidroklorik asit çözeltisi dökün ve damla damla 2 n sodyum hidroksit çözeltisi ekleyin. Solüsyonu bir cam çubukla karıştırın ve solüsyonun bir damlaını turnusol testine aktararak litmus üzerindeki etkisini test edin. Nötr bir reaksiyon elde etmek gereklidir (mavi ve kırmızı turnusol kağıdı rengini değiştirmez). Elde edilen çözeltiyi kuruyana kadar buharlaştırın. Ne kuruldu? Moleküler ve iyonik reaksiyon denklemlerini yazar.
b) Zayıf bir asit ve güçlü bir bazın etkileşimi.
Bir test tüpüne 2 ml 2N alkali çözeltisi dökün ve çözelti nötr olana kadar bir asetik asit çözeltisi ekleyin. Moleküler ve iyonik reaksiyon denklemlerini yazar. Zayıf bir elektrolitin (asetik asit) yer aldığı denge iyon reaksiyonunun neden su moleküllerinin oluşumuna doğru kaydığını açıklayın.
DENEYİM 2. Amfoterik hidroksitleri.
Laboratuarda bulunan reaktiflerden, bir çinko hidroksit çökeltisi elde edin. Elde edilen çökeltiyi çalkalayın ve küçük miktarlarda 2 tüpe dökün. Tüplerden birine, diğerine - bir sodyum hidroksit çözeltisi (fazla) içeren bir hidroklorik asit çözeltisi ekleyin. Ne gözlenir? Karşılık gelen reaksiyonların denklemlerini moleküler ve iyonik formda yazınız.
DENEYİM 3.Tuzların kimyasal özellikleri.
a) Tuz çözeltilerinin az miktarda çözünür bir maddenin oluşumu ile etkileşimi.
Tüpün içine 2 ml sodyum karbonat çözeltisi dökün ve beyaz bir çökelti görünene kadar baryum klorür çözeltisi ekleyin. Kimyasal reaksiyon denklemini iyonik ve moleküler formda yazınız. Çökelti iki bölüme ayrılmıştır. Tüplerden birine sülfürik asit çözeltisini, diğerine ise sodyum hidroksit dökün. Çökeltinin asit ve alkalilerdeki çözünürlüğü hakkında bir karara varın.
b) Uçucu bir bileşik oluşturmak için tuz çözeltisinin asitlerle etkileşimi.
Tüpün içine 2 ml sodyum karbonat çözeltisi dökün ve az miktarda hidroklorik asit çözeltisi ekleyin. Ne gözlenir? Kimyasal reaksiyon denklemlerini iyonik ve moleküler formda yazınız.
c) Uçucu bir bileşiğin oluşumu ile tuz çözeltilerinin alkalilerle etkileşimi.
Tüpün içine biraz amonyum tuzu çözeltisi dökün, 1-2 ml sodyum hidroksit çözeltisi ekleyin ve kaynamaya ısıtın. Islak kırmızı turnusol testi yapmak için reaksiyon karışımı olan bir test tüpünde. Ne gözlenir? Bir açıklama yap. Reaksiyon denklemlerini yazın.
g ) Tuzların, tuzun bir parçası olan metalden daha aktif metallerle etkileşimi.
Demir (çelik) çiviyi ince zımpara kağıdı ile temizleyin. Sonra bakır sülfat çözeltisine daldırın. Bir süre sonra, tırnak yüzeyindeki bakırın serbest kaldığını gözlemleyin. Karşılık gelen reaksiyon denklemini iyonik ve moleküler formda yazın.
DENEYİM 4.Bazik ve asitli tuzların elde edilmesi.
a) Kurşun hidroksokarbonatın hazırlanması.
Kurşun (II) asetat çözeltisine az miktarda kurşun (II) oksit ekleyin ve karışımı birkaç dakika kaynatın. Soğutulan çözelti çökeltiden boşaltılır ve içinden bir karbon dioksit akışı geçer. Ne gözlenir? Çökeltiyi filtre edin ve filtre kağıdı tabakaları arasında kurutun. Elde edilen kurşun hidroksokarbonat çökeltisinin rengini ve doğasını işaretleyin. Reaksiyon denklemlerini yazın. Elde edilen tuzun grafik formülünü hazırlayın.
b) Magnezyum bikarbonatın hazırlanması.
Çok yüksek oranda seyreltilmiş bir miktar magnezyum tuzu çözeltisine az miktarda sodyum karbonat çözeltisi ekleyin. Hangi madde çöker? Karbondioksit ile çökeltme ile doymuş çözelti. Çökeltinin kademeli çözünmesini gözlemleyin. Bu neden oluyor? Reaksiyon denklemlerini yazın.
DENEYİM 5.Karmaşık tuzlar elde etmek.
a) Kompleks katyonlu bileşiklerin oluşumu.
Bir bakır (II) hidroksit çökeltisi oluşana kadar 2-3 ml bakır (II) klorür çözeltisi içeren bir tüpe damla damla amonyak çözeltisi ekleyin ve sonra çökeltiyi çözmek için fazla miktarda amonyak çözeltisi ekleyin. Cu 2+ iyonlarının rengini elde edilen çözeltinin rengiyle karşılaştırın. Çözeltide hangi iyonlar var? Karmaşık bir bileşik elde etmek için reaksiyon denklemini yazın.
b) Karmaşık bir anyon ile bileşiklerin oluşumu.
1-2 ml civa (II) nitrat çözeltisine, HgI2 çökeltisi oluşturmak üzere damla damla seyreltilmiş bir potasyum iyodür çözeltisi ekleyin. Daha sonra çökelti çözülene kadar fazla miktarda potasyum iyodür çözeltisi dökün. Karmaşık bir tuz elde etme reaksiyonlarını yazın.
DENEYİM 6.İkili tuzların hazırlanması (potasyum alum).
7.5 g Al 2 (S04) 3 H 18H20 tartın ve bu amaç için yeterince büyük bir porselen kap alarak, 50 ml suda çözün. Reaksiyon denklemini hesaplayın ve reaksiyon için gerekli olan potasyum sülfat kütlesini tartın. Sıcak bir doymuş potasyum sülfat çözeltisi hazırlayın ve karıştırılarak alüminyum sülfat çözeltisi ile porselen kalıba dökün. Bir süre sonra alüminyum potasyum alum kristallerinin çökelmesine dikkat edin. Soğuduktan ve kristallendikten sonra ana likörü dökün, filtre kristalleri arasındaki şap kristallerini kurutun ve elde edilen kristalleri tartın. Verim yüzdesini hesaplayın.
YERLEŞTİRME GÖREVLERİ
1. Fazla miktarda hidrojen sülfitin 16 g bakır (II) sülfat çözeltisinden geçirilmesiyle 1.92 g çökelti elde edildi. Kullanılan çözeltideki bakır sülfatın kütle payını ve tüketilen hidrojen sülfit hacmini bulun.
2. Bakırın,% 10'luk bir kütle fraksiyonu ile 291 cm3 bakır (II) sülfat çözeltisinden sülfit formunda tamamen çökeltilmesi için, 17.6 g demir (II) sülfitin fazla hidroklorik asit ile reaksiyona sokulmasıyla elde edilen gaz kullanılmıştır. Orijinal bakır sülfat çözeltisinin yoğunluğunu bulun.
3. K 2S çözeltisinin seyreltik sülfürik asit ile etkileşimi sırasında salınan gaz, fazla miktarda kurşun (II) nitrat çözeltisinden geçirilir. Elde edilen çökelti 71.7 g kütleye sahiptir, yoğunluğu 1.176 g / cm3 ise ve kütle oranı% 25 ise, reaksiyona giren sülfürik asit çözeltisinin hacmini bulun.
4. 8 g bakır (II) sülfat içeren bir çözeltiye, 4.68 g sodyum sülfat içeren bir çözelti ilave edildi. Çökelti süzüldü, süzüntü buharlaştırıldı. Buharlaştırmadan sonra süzüntü içindeki maddelerin kütlesini ve bakır sülfit çökeltisinin kütlesini belirleyin.
5. Bazı demir (II) sülfitin bir kısmı fazla hidroklorik asit ile muamele edilmiştir. Elde edilen gaz,% 25'lik bir kütle payına ve 1.28 g / cm3 yoğunluğa sahip olan 12.5 cm3 NaOH çözeltisi ile reaksiyona girerek bir asit tuzu oluşturdu. Orijinal demir sülfitin kütlesini bulun.
6. 176 g ağırlığındaki demir (II) sülfit, fazla hidroklorik asit ile muamele edildi ve elde edilen gaz, fazla havada yandı. Yanma sırasında ortaya çıkan gazı tamamen nötralize etmek için% 40 kütle oranına ve 1.4 g / cm3 yoğunluğa sahip olan KOH çözeltisinin hacmi nedir?
7. 100 g teknik piritin kavrulması sırasında,% 25 kütle oranı ve 1.28 g / cm3'lük bir yoğunluğa sahip 400 cm3 NaOH çözeltisi ile tamamen nötrleştirilmiş bir gaz elde ettiler. Pirit içindeki safsızlıkların kütle payını belirleyin.
8. 2 g demir, demir oksit (II) ve demir oksit (III) karışımına,% 20'lik bir kütle fraksiyonu ve 1.09 g / cm3'lük bir yoğunluğa sahip HC1 çözeltisinin 16 cm3'ü ilave edildi. Fazla asidi nötralize etmek için,% 10 yoğunluk 1.05 g / cm3 kütle fraksiyonuyla 10.8 cm3 NaOH çözeltisi aldı. Salınan hidrojenin hacmi 224 cm3 (NU) ise karışımdaki maddelerin kütlelerini bulun.
9. Bir Ca (OH) 2, CaC03 ve BaS04'ün 10.5 g'lık bir kütleye sahip bir karışımı vardır .. Karışım fazla bir hidroklorik asit ile muamele edildiğinde, 672 cm3 (IU) gaz serbest bırakıldı ve 71.2 g asit bir kütle ile reaksiyona sokuldu % 10 payı. Karışımdaki maddelerin kütlesini belirleyin.
10. Bir baryum klorür, kalsiyum karbonat ve sodyum bikarbonat karışımı var. Bu karışımın 10 gramı su içinde çözündüğü zaman, çözünmeyen tortu 3.5 grama eşittir, ilk karışımın 20 gramı hesaplanırken kütlesi 5.2 gr azalır, ilk karışımdaki maddelerin kütle kısımlarını bulun.
11. Hem sülfürik hem de nitrik asit içeren bir çözelti var. Bu çözeltinin 10 gramını tamamen nötralize etmek için,% 19'luk bir kütle oranı ve 1,18 g / cm3'lük bir yoğunlukla 12.5 cm3 KOH çözeltisi tüketilir. 20 g aynı asit çözeltisi karışımına fazla miktarda baryum klorür ilave edildiğinde, 4.66 g çökelti dökülür. Karışımdaki asitlerin kütle fraksiyonlarını bulun.
12. 100 g KC1 ve KN03 karışımından elde edilen tüm hidrojen klorür 71.8 cm3 suda çözüldü. Aynı tuz karışımından 100 g hesaplanırken, 93.6 g katı artık kalır. Sudaki hidrojen klorürün kütle payını bulun.
13. Bir Ca (OH) 2 çözeltisinden 2 m3 havayı (NU) geçirerek, 3 g karbonik asit tuzu çökeltisi elde edildi. Havadaki C02'nin hacmini ve kütle payını bulun.
14. Karbondioksit 50 g CaC03 içeren bir süspansiyondan geçirilir. Reaksiyon, 8.96 dm3 gazı (NU) aldı. Katı fazda kalan CaCO 3 kütlesi nedir?
15. CaO'ya su eklerken kütlesi% 30 artmıştır. CaO'nun hangi kısmı (% kütle olarak) söndürüldü?
16. 18.47 g ağırlığındaki kurşun (II) oksit, bir hidrojen akışında ısıtıldı. Reaksiyondan sonra, ortaya çıkan kurşun ve reaksiyona girmemiş oksidin kütlesi 18.07 g idi, reaksiyona girmeyen kurşun oksit kütlesi nedir?
17. Karbon monoksit ısıtıldığında demir (III) oksitten geçirilir. Reaksiyondan sonra katı tortunun kütlesi, başlangıçtaki demir oksit kütlesinden 2 g daha azdır. Reaksiyon hangi hacimde CO aldı (oksit tamamen azaldı)?
18. Bağıl hidrojen yoğunluğu 25 olan bir N2, C02 ve S02 karışımı 8.96 dm3 (NU) vardır. Karışımın bir KOH çözeltisi fazlalığından geçmesinden sonra karışımın hacmi 4 kat azalmıştır. Orijinal karışımdaki gaz miktarlarını bulun.
19. İki bardakta, kütle oranı% 2.5 olan 100 g HC1 çözeltisi vardır. Bir bardakta 10 g CaC03, diğerinde - 8.4 g MgC03 eklenmiştir. Reaksiyondan sonra gözlüklerin kütlesi ne kadar farklı olacaktır?
20. Bir asit tuzunu elde etmek için,% 0.1 kütle NaOH fraksiyonuna ve 1 g / cm3 yoğunluğa sahip bir çözeltiden 200 cm3'lük bir çözeltiden hangi hacim (NU) kükürt dioksit geçirilmelidir?
21. Karbon dioksitin maksimum miktarı (karbondioksit),% 25'lik bir NaOH kütlesi fraksiyonu ve 1.1 g / cm3'lük bir yoğunluğa sahip 25 cm3'lük bir çözeltiyi emebilir mi?
22.% 20 KOH kütle oranına ve 1.19 g / cm3 yoğunluğa sahip asgari çözelti hacmi ve 23.2 g magnetitin karbon monoksit ile tamamen indirgenmesi ile üretilen tüm karbondioksiti emebilen madde nedir?
23. Ürünün sadece potasyum dihidrojen fosfat olması için 24.5 g ortofosforik asit ile reaksiyona sokulması gereken minimum KOH kütlesi nedir?
24. Bir orta tuz elde etmek için% 5 tuz kütle fraksiyonu ile 16 g kalsiyum bikarbonat çözeltisi ilave etmek için minimum Ca (OH) 2 kütlesi nedir?
25. 12.25 g H3P04 içeren bir çözeltiye, hangi potasyum hidrojen fosfat kütlesinin eklenmesi gerekir ki bundan sonra çözelti sadece potasyum dihidrojen fosfat içerir?
26. Çözelti, süspansiyon halinde 56.1 g kalsiyum ve magnezyum karbonat karışımı ihtiva etti. Onları hidrokarbonatlara dönüştürmek için 7 dm3 (NU) etan yakılarak üretilen tüm karbon dioksit harcandı. İlk karışımda kalsiyum karbonat kütlesini bulun.
27. 9.5 g sodyum hidro- ve dihidrojen fosfat karışımını bir orta tuza dönüştürmek için,% 27.7'lik NaOH kütleli bir fraksiyonu ve 1.3 g / cm3'lük bir yoğunluğa sahip 10 cm3'lük bir çözelti gereklidir. Karışımdaki hidrojen fosfat kütlesini bulun.
28. 6 g NaOH içeren bir çözeltiden karbon dioksit geçirilerek, 9.5 g asit ve orta tuz karışımı elde edildi. Tüketilen karbondioksit miktarını bulun.
29. KOH çözeltisinden 11.2 dm3 (NU) C02 geçtikten sonra, 57.6 g asit ve ortam tuzları karışımı elde edildi. Orta tuzun kütlesini bulun.
30. 1.2 gr dihidro ve 4.26 gr sodyum hidrojen fosfat elde etmek için hangi ortofosforik asit kütlesinin nötrleştirilmesi gerekir?
31. 3.6 g hidrosülfat ve 2.84 g sodyum sülfat elde etmek için sülfürik asit çözeltisine NaOH eklenmiştir. Reaksiyona giren asit ve alkalilerin kimyasal miktarlarını belirleyin.
32. Hidrojen klorürün% 10'luk bir kütle fraksiyonu ve 1.1 g / cm3'lük bir yoğunluğa sahip 200 cm3 NaOH çözeltisinden geçirilmesinden sonra, sonuçtaki çözeltideki NaOH kütle oranı yarıya indirgenmiştir. Elde edilen çözeltideki NaCl'nin kütle payını belirleyin.
33. 14.4 g bakır ve oksit (II) karışımının çözülmesi,% 80 HN03 kütle oranı ile 48.5 g çözelti tüketmiştir. İlk karışımdaki bakır ve oksit kütle fraksiyonlarını bulun.
34. Sodyum oksit kütlesi 6.2 g olan 100 cm3 su içinde çözülmüş ve çözelti No. 1 elde edilmiş, daha sonra% 10'luk bir kütle payına sahip hidroklorik asit bu çözeltiye ortam nötr hale gelinceye kadar eklenmiş ve çözelti No. 2 elde edilmiştir. :
1) 1, 2 numaralı çözeltilerdeki maddelerin kütle fraksiyonları;
2) 1 numaralı çözeltiyi nötrleştirmeye giden HC1 çözeltisinin kütlesi.
35.3 g çinko,% 14.6'lık bir kütle oranı ve 1.07 g / cm3'lük bir yoğunluğa sahip 18.69 cm3 HC1 çözeltisi ile etkileşime girer. Isıtıldığında elde edilen gaz 4 g ağırlığındaki sıcak CuO'dan geçirilir, elde edilen bakırın kütlesi nedir?
36. Kalsiyum hidrürün fazla su ile işlenmesinden sonra salınan gaz FeO'yu kaçırdı. Sonuç olarak, oksit kütlesi 8 g azaldı, suyla işlem görmüş CaH2 kütlesini bulun.
37. CaCO 3 numunesinin kalsinasyonu sırasında, kütlesi% 35.2 azalmıştır. Katı reaksiyon ürünleri, 0.112 dm3 (NU) gaz elde etmek için fazla bir hidroklorik asit içinde çözüldü. Orijinal kalsiyum karbonat numunesinin kütlesini belirleyin.
38. Bakır nitrat ayrıştırıldı ve elde edilen bakır (II) oksit, hidrojen ile tamamen indirgendi. Elde edilen ürünler P205 içeren bir tüpten geçti ve bundan sonra tüp kütlesi 3,6 g arttı, deneyde elde edilen çözülme için gereken% 88'lik kütle oranı ve 1,87 g / cm3'lük bir yoğunluğa sahip minimum sülfürik asit hacmi nedir bakır ve ayrıştırılmış tuzun kütlesi nedir?
39. Nitrik oksidin (IV), oksijensiz ortamda soğukta fazla miktarda KOH çözeltisi tarafından emilmesi üzerine 40.4 g KN03 elde edildi. Hangi madde hala oluşur ve kütlesi nedir?
40. Hidroklorik içeren 400 g çözeltisini nötralize etmek ve sülfürik asit% 10 kütle oranı ve 1.115 g / cm3 yoğunluğu ile 287 cm3 sodyum hidroksit çözeltisi tüketmiştir. İlk çözeltinin 100 gramına fazla miktarda baryum klorür çözeltisi ilave edilirse, 5.825 gram çökelti dökülecektir. İlk çözelti içindeki asitlerin kütle fraksiyonlarını belirleyin.
41. Sodyum hidroksit çözeltisinden karbon dioksit geçtikten sonra, 13.7 g ortam ve asit tuzları karışımı elde edildi. Bunları sodyum klorüre dönüştürmek için,% 10'luk bir HCI kütle fraksiyonuna sahip 75 g hidroklorik asit gereklidir. Emilen karbon dioksit hacmini bulun.
42. Aynı kütle asit fraksiyonları ile toplam 600 g çözelti kütlesine sahip bir hidroklorik ve sülfürik asit karışımı, fazla miktarda sodyum bikarbonat ile muamele edildi ve 32.1 dm3 gaz (No.) elde edildi. İlk karışımdaki asitlerin kütle payını bulun.
43. 1 dm3 NaOH çözeltisini nötralize etmek için, 66.66 cm3 HN03 çözeltisi,% 63'lük bir kütle fraksiyonu ve 1.5 g / cm3'lük bir yoğunlukla tüketildi. Aynı miktarda alkaliyi nötralize etmek için% 24.5 kütle fraksiyonu ve 1.2 g / cm3 yoğunlukta hangi hacimde sülfürik asit çözeltisi gerekir?
44. Hangi hacim oranında,% 5 kütle kesirine ve 1.03 g / cm3 yoğunluğa sahip bir sülfürik asit çözeltisini ve% 5 kütle kesirine ve 1.1 g / cm3 yoğunluğa sahip bir baryum hidroksit çözeltisine sahip olmalı? Cevabı asit çözeltideki alkali çözeltinin hacminin bir bölümü olarak düşünün.
45. 0.9 g / cm3'lük bir yoğunluğa ve% 25'lik bir kütle oranına sahip minimum amonyak çözeltisi hacmini hesaplayın; bu, 0.5 kg doğal kireçtaşının% 92'ye eşit kütle fraksiyonu ile ayrıştırılmasıyla elde edilen karbon dioksitin tamamen emilmesi için gereklidir.
46. 2.92 g sodyum hidroksit ve sodyum karbonat karışımının klorüre tamamen dönüştürülmesi için, 1.344 dm3 hidrojen klorür (NU) gereklidir. Karışımdaki sodyum karbonat kütlesini bulun.
47.% 16'lık bir kütle payına sahip 25 g bakır (II) sülfat çözeltisine,% 16'lık bir kütle payına sahip bir miktar sodyum hidroksit çözeltisi ilave edildi. Oluşan çökelti süzüldü, daha sonra süzüntü alkalin oldu. Süzüntünün tamamen nötrleştirilmesi için, çözeltinin 0.1 mol / dm3 molar konsantrasyonunda 25 cm3'lük bir sülfürik asit çözeltisi aldı. Eklenen sodyum hidroksit çözeltisinin kütlesini hesaplayın.
48. CuO'nun 15.2 g hidrojen kütlesi ile 11.2 dm3 (NU) bir kütle ile tamamen indirgenmesiyle elde edilen madde, konsantre sülfürik asit içerisinde ısıtılarak eritilir. Tepkimenin bir sonucu olarak salınan gazın hacmi (NU) nedir?
49. 50 cm3 hidroklorik asidin,% 20'lik bir HC1 kütle oranı ve 1.10 g / cm3'lük bir yoğunluğa sahip tam nötrleştirilmesi için,% 20'lik bir kütle KOH'lı bir kütle fraksiyonuna sahip bir potasyum hidroksit çözeltisi kullanıldı. Elde edilen çözeltide bulunan suyun kimyasal miktarı nedir?
50. 0.84 g sıcak kömürden fazla miktarda C02 geçirilerek elde edilen gaz, 14.0 g ısıtılmış bakır (II) oksit ile reaksiyona gönderilir. Son reaksiyonda elde edilen maddenin tamamen çözülmesi için% 63'lük bir kütle fraksiyonu ve 1.4 g / cm3'lük bir yoğunluğa sahip olan bir nitrik asit çözeltisinin hacmi nedir?
51. Sabit bakır (II) nitrat ağırlığına kalsine edildiğinde, tuzun ağırlığı 6.5 g azaldı, hangi ağırlıktaki tuz ayrıştırıldı?
52. Aşırı hidroklorik asit kullanıldığında, bilinmeyen bir monovalent metal içeren bir alüminyum karışımı üzerine 6.72 dm3 (NW) gaz salındı ve karışımın kütlesi yarıya indirildi. Tortuyu seyreltik nitrik asit ile muamele ederken, 0.373 dm3 (NU) NO serbest bırakıldı. Bilinmeyen metalleri tanımlayın.
53. Tebeşir numunesinin kütlesi 105 g ve bileşimindeki oksijen elemanının kimyasal miktarı 1 mol. Tebeşir numunesindeki CaCO3 kütle fraksiyonunu belirleyin (oksijen sadece kalsiyum karbonat bileşimine dahil edilir).
54. Sülfür oksidin (VI) su ile etkileşmesinde,% 25'lik bir kütle sülfürik asit fraksiyonu ile bir çözelti elde edildi. Bu çözeltiye fazla miktarda Ba (OH) 2 eklendiğinde, 29.13 g ağırlığındaki bir çökelti çökeltildi, bir asit çözeltisinin oluşumu için hangi kütlelerde S03 ve H20 harcandı?
55. S02 ila 200 g,% 16'lık bir NaOH kütle oranına sahip bir çözeltiden geçerken, 41.6 g bir asit tuzu içeren bir tuzlar karışımı oluşturulmuştur. Ağırlıkça% 4.5 safsızlık içeren sülfür kütlesi nedir, SO2 elde etmek için kullanıldı? Orta tuzun ağırlığı nedir?
56. 80 g Ca (N03) 2 çözeltisi ile etkileşimi, 50 g Na2C03 çözeltisi aldı. Çökelti, fazla hidroklorik asit ile işlenirken ayrıldı, 2.24 dm3 (NU) gaz serbest bırakıldı. İlk çözeltilerdeki tuzların kütle kısımları nelerdir? Çökeltiyi ayırdıktan sonra çözelti içindeki sodyum nitratın kütle oranı nedir?
57. Çinko sülfürik asit ile etkileşime girdiğinde, 10 dm3 (NU) bir SO2 ve H2S karışımı ile 1.51 argon nispi yoğunluğa sahip bir madde oluşur. Çözünen çinkonun kimyasal miktarı nedir? S02'nin gaz karışımındaki kütle oranı nedir?
58. Toplam 11 g kütleye sahip bir çinko ve alüminyum talaş karışımının bir örneği, fazla alkali bir çözelti içinde çözüldü. Karışımdaki çinko kütle oranı% 30 ise salınan gazın hacmini (NU) belirleyin.
59. 4.0 g ağırlığındaki sodyum hidroksit, 9.8 g ağırlığındaki alüminyum hidroksit ile alaşımlı hale getirildi, elde edilen sodyum metaalüminatın kütlesini hesaplayın.
60. Konsantre edilmiş nitrik asit ile 10 g bakır ve alüminyum karışımı işlenirken oda sıcaklığı 2.24 dm3 gaz (NU) salındı. Aşırı KOH çözeltisi ile aynı karışım kütlesini işlerken hangi hacimde (NU) gaz açığa çıkacaktır?
61. 20 g ağırlığında bir bakır ve alüminyum alaşımı fazla miktarda alkali ile muamele edildi, çözünmeyen kalıntı konsantre nitrik asit içinde çözüldü. Elde edilen tuz izole edildi, sabit ağırlığa getirildi ve 8 g katı tortu elde edildi. Harcanan NaOH çözeltisinin hacmini,% 40'lık bir kütle fraksiyonu ve 1.4 g / cm3'lük bir yoğunluk ile belirleyin).
62. 39 g ağırlığındaki alüminyum ve metal oksit (II) (amfoterik olmayan oksit) karışımı, fazla miktarda KOH çözeltisi ile işlendi, çıkan gaz, 27 g su elde etmek için yakıldı. Çözünmeyen kalıntı,% 36.5'lik bir HC1 kütle oranı ve 1.19 g / cm3'lük bir yoğunluğa sahip bir çözeltinin 25.2 cm3'ünde tamamen çözüldü. Oksit belirle.
63. Bir çinko ve bakır cips karışımı, fazla KOH çözeltisi ile işleme tabi tutulurken, 2.24 dm3 (NU) bir gaz çıkarıldı. Aynı metal numunesinin tamamen klorlanması için 8.96 dm3 (NU) hacminde klor gerekiyordu. Örnekteki çinko kütle oranını hesaplayın.
64. 49 g kütleye sahip bir demir, alüminyum ve magnezyum talaş karışımı, fazla seyreltilmiş H2S04 ile muamele edildi, böylece 1.95 mol gaz elde edildi. Aynı kanşımın 4.9 g ağırlığındaki bir başka kısmı, fazla miktarda alkali solüsyon ile muamele edildi, 1.68 dm3 (NU) gaz elde edildi. Karışımdaki metallerin kütlesini bulun.
65. 10 g NaOH ve 13.6 g ZnCl2 içeren çözeltileri birleştirirken oluşan tortu kütlesi nedir?
66. Al, Mg, Fe, Zn karışımının iki kısmı vardır, bunlar molar bileşimde aynıdır, her biri 7.4 g ağırlığındadır Bir kısım hidroklorik asit içinde çözülmüş ve 3.584 dm3 gaz (NU) elde edilmiş, diğeri alkali çözeltide ve 2.016 dm3 gaz (NU) aldı. Her iki karışımda da A1 atomu başına 3 Zn atomu olduğu bilinmektedir. Karışımdaki metallerin kütlesini bulun.
67. 1 g ağırlığında bir bakır, magnezyum ve alüminyum karışımı, fazla bir hidroklorik asit ile muamele edildi. Çözelti süzüldü, süzüntüye bir miktar NaOH çözeltisi ilave edildi. Çökelti ayrıldı ve sabit 0.2 g'lik bir kütleye kalsine edildi Hidroklorik asit ile muameleden sonra çözülen tortu havada kalsine edildi ve 0.8 g siyah madde elde edildi. Karışımdaki alüminyum kütle oranını bulun.
68. Çinko, magnezyum ve bakırın oksijen alaşımı akışında ısıtıldığında karışımın kütlesi 9.6 g artar, ürün alkali olarak kısmen eritilir ve çözülme için% 40 KOH kütle kesirli ve 1.4 g / cm yoğunluklu bir çözeltinin 40 cm3'ü gereklidir. 3. Alaşımın aynı kısmı ile reaksiyon için, 0.7 mol HC1 gereklidir. Alaşımlı metallerin kimyasal miktarlarını bulun.
69. 5 g ağırlığında bir bakır ve çinko alaşımı, fazla miktarda NaOH çözeltisi ile işlendi. Daha sonra katı kalıntı ayrılmış ve konsantre edilmiş HN03 ile muamele edilmiş, bu şekilde elde edilen tuz izole edilmiş, sabit ağırlığa getirilmiş ve 2.5 g katı bir artık elde edilmiştir. Alaşımdaki metallerin kütlesini belirleyin.
70. 12.8 g ağırlığında bir bakır ve alüminyum alaşımı, bir miktar hidroklorik asit ile işlendi. Çözünmeyen kalıntı, konsantre nitrik asit içinde çözüldü, elde edilen çözelti buharlaştırıldı, kuru kalıntı sabit ağırlığa getirildi ve 4 g katı madde elde edildi. Alaşımlı bakırın kütle payını belirleyin.
71. Hangi kütle oranında iki kısım Al almalıdır ki, biri alkali çözeltisine eklendiğinde diğeri de eşit miktarda hidrojene hidroklorik aside bırakılmalıdır?
72. Aşırı KOH çözeltisi içeren bir alüminyum ve bakır (II) oksit karışımı işlenirken, 6.72 dm3 (NU) gaz serbest bırakıldı ve karışımın aynı kısmı konsantre HN03 içinde oda sıcaklığında çözülerek 75.2 g tuz elde edildi. İlk madde karışımının kütlesini bulun.
73. Hangi bakır (II) oksit kütlesini, fazla miktarda alüminyumu 139.87 cm3'lük bir çözelti ile% 40 NaOH ve 1.43 g / cm3'lük bir yoğunlukta reaksiyona sokarak elde ederek hidrojen geri kazanabilir?
74. 7.83 g'lık iki metal alaşımının tamamen oksidasyonu ile, işlem sırasında fazla miktarda alkali çözünmemiş 4.03 g tortu kaldığı 14.23 g oksit oluşmuştur. Katyonları +2 ve +3 oksidasyon durumuna sahipse ve oksitlerin molar oranı 1: 1 ise (oksidasyon durumuyla metal oksidin amfoterik özelliklere sahip olduğunu varsayalım) varsa, alaşımı oluşturan metallerin kalitatif bileşimini belirleyin.
75. Aynı kütleye sahip iki parça alüminyum çözüldü: biri potasyum hidroksit çözeltisinde, diğeri hidroklorik asit içinde. Gelişen gaz hacimleri (nos) birbirleriyle nasıl ilişkilidir?
76. 1.000 g ağırlığında alüminyum içeren bir bakır alaşımı, fazla miktarda alkali çözeltiyle işlendi, çözünmemiş çökelti nitrik asit içinde çözüldü, sonra çözelti buharlaştırıldı, tortu sabit ağırlığa getirildi. Yeni tortunun kütlesi 0.398 g'dır, alaşımdaki metal kütlesi nedir?
77. 20 g ağırlığında bir çinko ve bakır alaşımı,% 30'luk bir kütle fraksiyonu ve 1.33 g / cm3'lük bir yoğunluğa sahip fazla miktarda NaOH çözeltisi ile muamele edildi. Katı tortu izole edildi ve fazla miktarda konsantre bir HN03 çözeltisi ile işlendi. Bu işlem sırasında oluşan tuz izole edildi ve sabit ağırlığa kalsine edildi. Katı tortunun kütlesi 10.016 g idi, alaşımdaki metallerin kütle fraksiyonlarını ve tüketilen alkali solüsyon hacmini hesaplayın.
78. 2 g ağırlığında bir bakır ve alüminyum alaşımı, fazla miktarda alkali çözeltiyle işlendi. Kalıntı süzüldü, yıkandı, HN03 içerisinde çözündürüldü, çözelti buharlaştırıldı ve sabit ağırlığa kadar kalsine edildi. Kalsifikasyondan sonra kalıntının kütlesi 0.736 g idi, alaşımdaki metallerin kütle fraksiyonlarını hesaplayın.
79. Bir demir, bakır ve alüminyum karışımının klorlanması 8.96 dm3 klorin (NU) gerektirir ve aynı numunenin hidrojen klorid ile etkileşimi 5.6 dm3 (NU) gerektirir. Alkali ile aynı metal karışımının aynı kütlesi ile etkileşime girdiğinde, 1.68 dm3 (NU) gaz açığa çıkar. Karışımdaki metallerin kimyasal miktarlarını bulun.
80. 5.0 g ağırlığındaki potasyum hidrid su içinde 80 cm3 hacminde çözülmüş ve sonuçtaki çözeltiye 0.81 g ağırlığında alüminyum eklenmiş, sonuçtaki çözeltideki maddelerin kütle kısımlarını yüzde binde bir hassasiyetle bulabilirsiniz.
EDEBİYAT LİSTESİ
1. Barannik, V.P. İnorganik bileşiklerin modern Rus isimlendirmesi / V.P. Barannik // Tüm Birlikler Kimya Derneği Dergisi. DI Mendeleyev. - 1983. - Cilt XXVIII. - sayfa 9-16.
2. Wroblewski, A.I. Kimya simülatörü / A.I. Wroblewski. - 2. baskı, Pererab. ve ekleyin. - Minsk: Krasiko-Print, 2007. - 624 s.
3. Glinka, N.L. Genel kimyada görevler ve alıştırmalar: çalışmalar. üniversiteler için el kitabı / ed. VA Rabinoviç ve H.M. Rubina. - M .: Integral Press, 2004. - 240 s.
4. Lidin, R.A. Genel ve inorganik kimyadaki görevler: çalışmalar. yüksek öğrenciler için kullanım kılavuzu. Proc. kurumlar / R.A. Lidin, V.A. Milk, L.L. Andreev; ed. RA Lidin. - M .: VLADOS, 2004. - 383 p.
5. Lidin, R.A. İnorganik maddelerin adlandırılmasının temelleri / R.А. Lidin [ve diğ.]; ed. BD Stepin. - M: Kimya, 1983. - 112 s.
6. Stepin, B.D. IUPAC kurallarının Rusça / B.D.'deki inorganik bileşiklerin isimlendirilmesinde uygulanması. Stepin, R.A. Lidin // All-Union Kimya Derneği Dergisi. DI Mendeleyev. - 1983. - Cilt XXVIII. - sayfa 17–20.
| Giriş ………………………………………………………………………… inorganik maddeler için genel kurallar ………… .. Oksitler …………………………………… ………………………………… Bazik oksitler …………………………………………………………… ... Asit oksitler ………………………………… ............................ Amfoterik oksitler …………………………………………………………… .. Oksitlerin elde edilmesi ………………………………………………………………. “Oksitler” konusu ………………………………………………………………. Asitler …………………………………………………………………………. “Asitler” konusunda bağımsız çalışma çalışmaları ……………………………………………………………………………………………………………………………………………………………………. ……… .. “Vakıflar” konusunda bağımsız çalışma çalışmaları. ……………………………………………………………. Tuzlar ………………………………………………………………………………. "Tuzlar" konusunda bağımsız çalışma çalışmaları, inorganik bileşiklerin sınıfları arasındaki genetik ilişki ....................................................................................................................................................... …………… .. “İnorganik bileşiklerin sınıfları arasında genetik bağlantı” konulu bağımsız çalışma çalışmaları… ………………………………………………… “inorganik bileşiklerin ana sınıfları ……………” üzerine deneysel deneyler ……… .. Yerleşim görevleri ………………………………………………………………… Referanslar ………………………………… |
eğitim: "genetik seri", "genetik bağlantı" kavramını düzeltmek; genetik diziye karşılık gelen reaksiyon denklemlerini oluşturmak için genetik element dizilerinin (metaller ve metal olmayan) nasıl yapıldığını öğretmek; oksitlerin, asitlerin, tuzların, bazların kimyasal özelliklerinin bilgisinin nasıl özümsendiğini kontrol etmek;
gelişmekte: analiz, karşılaştırma, özetleme ve sonuçları çıkarma, kimyasal reaksiyonların denklemlerini oluşturma becerisini geliştirmek;
eğitici : Bilimsel bir dünya görüşü oluşumunu teşvik eder.
2. Sınıf verilmesi: “Periyodik sistem”, “Çözünürlük tablosu”, “Metaller aktivite serisi”, öğrenciler için talimatlar, bilgiyi sınama görevleri.
3. Performans sırası:
3.1. Ön anket.
3.2. Görevlerin çözümü.
3.3. Seçenekler üzerinde doğrulama çalışması yapın.
4. Rapor düzeni:
4.1. Uygulamalı dersin konusunu ve hedeflerini yazınız.
4.2. Kayıt problem çözme.
4.3. Kendi bağımsız çalışma sürümünüzü, bir not defterine yazma ve gözden geçirilmek üzere öğretmene aktarma kararınızı çözün.
İş ilerleme
1. Açık görüşme:
Genetik bağlantı nedir?
Genetik bağlantılar - bunlar karşılıklı dönüşümlerine dayanarak farklı sınıflar arasındaki bağlantılardır.
Genetik seri nedir?
Genetik sıra - bir dizi madde - dönüşümlerle birbirine bağlanan ve bu maddelerin dönüşümlerini yansıtan bir kimyasal elementin bileşikleri olan farklı sınıfların temsilcileri. Bu serilerin temeli aynı unsurdur.
Ne tür genetik seriler genellikle tahsis edilir?
Metaller arasında iki tür satır vardır:
a) Alkalinin baz görevi gördüğü bir genetik seri. Bu seri aşağıdaki dönüşümleri kullanarak gösterilebilir:
metal → bazik oksit → alkali → tuz
örneğin, K → K 2 O → KOH → KCl potasyumun genetik serisi
b) Bazın çözünmez bir baz olduğu genetik seri, daha sonra seri bir dönüşüm zinciri olarak gösterilebilir:
metal → baz oksit → tuz → çözünmez baz → baz oksit → metal
örneğin: Cu → CuO → CuCl2 → Cu (OH) 2 → CuO → Cu
Metal olmayanlar arasında iki tür sırayı ayırt etmek de mümkündür:
a) Çözülebilen asidin seri içinde bir bağlantı görevi gördüğü metal olmayan genetik seri. Dönüşümler zinciri aşağıdaki şekilde temsil edilebilir: metal olmayan → asit oksit → çözülebilir asit → tuz.
Örneğin: P → P 2 O 5 → H3P04 → Na3PP4
b) Çözünmeyen asidin: metal dışı → asit oksidin → tuz → asit → asit oksidin → metal olmayan dizinin içinde bir bağlantı görevi gördüğü metal olmayan genetik sıra
Örneğin: Si → SiO 2 → Na2 SiO3 → H 2 SiO3 → SiO 2 → Si
Seçenekler için görevlerin yürütülmesi:
| Seçenek 1 | Seçenek 2 |
|
I seçeneği: ZnS04, Zn, ZnO, Zn, Zn (OH) 2
Seçenek II: Na2S04, NaOH, Na, Na202, Na20
Ödev: kalsiyumdan kalsiyum karbonata kademeli bir geçişi çizelgeleyin ve herhangi bir tuzun tıpta kullanımı hakkında bir rapor hazırlayın (ek literatür kullanarak).
Pratik ders için talimatlar
Ana inorganik maddelerin sınıfları arasındaki genetik ilişki.
Amaç: "genetik seri", "genetik bağlantı" kavramını düzeltmek; genetik diziye karşılık gelen reaksiyon denklemlerini oluşturmak için genetik element dizileri (metaller ve metal olmayan) yapmayı öğrenir; oksitlerin, asitlerin, tuzların, bazların özelliklerini tekrarlar.
İş ilerleme
Kavramların tanımlarını yazınız:
Genetik ilişki - __________________________________________
Genetik sıra - ___________________________________________
Alkalinin baz olarak görev yaptığı genetik bir metal serisi. genel olarak temsil edilebilir: metal → bazik oksit → alkali → tuz. Potasyum kullanarak bu seriyi yapın. Reaksiyonların denklemlerini, bu dönüşüm zincirini gerçekleştirebileceğiniz yardımı ile yazın.
Çözülebilen asidin seri içinde bir bağlantı görevi gördüğü metal olmayan genetik seri aşağıdaki gibi gösterilebilir: metal olmayan → asit oksit → çözülebilir asit → tuz. Bu seriyi fosfor kullanarak yapın. Reaksiyonların denklemlerini, bu dönüşüm zincirini gerçekleştirebileceğiniz yardımı ile yazın.
Bazın çözünmez baz olduğu genetik sıra dönüşümler zinciri ile temsil edilebilir: metal → bazik oksit → tuz → çözünmez baz → bazik oksit → metal. Bakır kullanarak bu seriyi oluşturun. Reaksiyonların denklemlerini, bu dönüşüm zincirini gerçekleştirebileceğiniz yardımı ile yazın.
Çözünmeyen asidin seri içinde bir bağlantı görevi gördüğü metal olmayan genetik seri dönüşümler zinciri ile temsil edilebilir: metal olmayan → asit oksit → tuz → asit → asit oksit → metal olmayan. Bu seriyi silikon kullanarak oluşturun. Reaksiyonların denklemlerini, bu dönüşüm zincirini gerçekleştirebileceğiniz yardımı ile yazın.
Seçenekler için görevleri gerçekleştirin:
| Seçenek 1 | Seçenek 2 |
|
1. Sürümünüzdeki oksit formüllerini seçin, tercihinizi bu bileşik sınıfı bileşiminin özelliklerine göre açıklayın. Onları arayın.
2. Varyantınızın formül sütununda asit formüllerini bulun ve bu bileşiklerin bileşimlerinin analizine dayanarak seçiminizi açıklayın.
3. Asit kalıntılarının asit kompozisyonundaki değerlerini belirleyin.
4. Tuz formüllerini seçin ve adlandırın.
5. Magnezyum ve varyantınızın asitleri ile oluşabilecek tuzların formüllerini hazırlayın. Onları yazın, adlandırın.
6. Varyasyonunuzun formül sütununda, temel formülleri bulun ve bu bileşiklerin kompozisyonunun analizine dayanarak seçiminizi açıklayın.
7. Varyantınızda, bir ortofosforik asit çözeltisinin (hidroklorik, sülfürik) reaksiyona girebileceği maddelerin formüllerini seçin. Uygun reaksiyon denklemlerini yapın.
9. Seçeneğinizin formülleri arasında, birbirleriyle etkileşime girebilecek maddelerin formüllerini seçin. Uygun reaksiyon denklemlerini yapın.
10. Formülü bir numaralı sürümünde verilen bir maddeyi içeren inorganik bileşiklerin genetik bağ zincirini yapın.
Bu maddelerden bütün formülleri kullanarak genetik bir çizgi oluşturur. Bu dönüşüm zincirini başarabileceğiniz reaksiyon denklemlerini yazın:
ben seçeneği: ZnS04, Zn, ZnO, Zn, Zn (OH) 2
IIseçenek: Na2S04, NaOH, Na, Na202, Na20
Ödev: kalsiyumdan kalsiyum karbonata kademeli bir geçişi çizelgeleyin ve herhangi bir tuzun tıpta kullanımı hakkında bir rapor hazırlayın (ek literatür kullanarak).
