Sülfürik asidin kimyasal formülü. Sülfürik asit: kimyasal özellikleri, hazırlanması
H2S03, zayıf dibazik asit. Serbest bir şekilde tahsis edilmemiş, su çözeltilerinde bulunur. Sülfürik asit sülfitleri ... Büyük Ansiklopedik Sözlük
Sülfürik asit - (H2S03) zayıf dibazik asit. Sadece sulu çözeltilerde bulunur. Tuzlar S.'den Sülfitlere. Kağıt hamuru ve gıda endüstrisinde uygulanır. Ayrıca bakınız Asitler ve anhidritler ... Emek korumasında Rus ansiklopedisi
sülfürik asit - - [A.S. Goldberg. İngilizce Rusça enerji sözlüğü. 2006] Genel olarak enerji konuları EN sülfürik asit ... Teknik Tercüman Kılavuzu
H2S03, zayıf dibazik asit. Serbest bir şekilde tahsis edilmemiş, su çözeltilerinde bulunur. Sülfürik asit sülfitleri. * * * Sülfürik asit, sülfürik asit, H2S03, zayıf dibazik asit. Ücretsiz seçilmedi, ... ... Ansiklopedik sözlük
sülfürik asit - sulfito rūgštis statusas T sritis chemija formulė H₂SO₃ atitikmenys: açılı. kükürtlü asit rus. sülfürik asit ryšiai: sinonimas - vandenilio trioksosülfatas (2–) ... Chemijos terminų aiškinamasis žodynas
H2SO3, zayıf dibazik asit, kükürt oksidasyon derecesine karşılık gelen +4. Sadece seyreltik sulu çözeltilerde bilinir. Ayrışma sabitleri: K1 = 1.6 · 10 2, K2 = 1.0 · 10 7 (18 ° C). İki sıra tuz verir: normal Sülfitler ve ekşi ... Büyük Sovyet Ansiklopedisi
H2S03, zayıf dibazik asit. Serbest formda vurgulanmayan, sularda var. p rah. Tuzlar S. K. Sülfitler ... Doğa bilimi. Ansiklopedik sözlük
Sülfür'ü görün ... Ansiklopedik sözlük FA Brockhaus ve I.A. Efron
Sülfür dioksit (dioksit) hava veya oksijende kükürt yakılarak oluşur. Aynı zamanda, metallerin, örneğin demir piritlerin havada ("yanma") sülfürlerinde kalsine edilerek elde edilir:
Bu reaksiyona göre, genellikle endüstride kükürt dioksit elde edilir (cm, 9 § 131 elde etmek için diğer endüstriyel yöntemler için).
Kükürt dioksit, keskin bir sıcak kükürt böreği olan renksiz bir gazdır ("kükürt dioksit"). Kaynama noktasında renksiz bir sıvıya oldukça kolay bir şekilde yoğunlaşır. Sıvı buharlaştığında, sıcaklıkta (önce) kuvvetli bir düşüş olur.
Kükürt dioksit suda yüksek oranda çözünür (1 hacim sudaki yaklaşık 40 hacim); Aynı zamanda, su ile reaksiyon kısmen gerçekleşir ve sülfürik asit oluşur:
Dolayısıyla, kükürt dioksit, sülfürik asit anhidrittir. Isıtıldığında, çözünürlük azalır ve denge sola kayar; kademeli olarak tüm sülfür dioksit tekrar çözeltiden salınır.
Molekül, ozon molekülüne benzer şekilde inşa edilir. Kurucu atomlarının çekirdekleri bir ikizkenar üçgen oluşturur:
Burada, ozon molekülündeki merkezi oksijen atomu gibi kükürt atomu a-hibridizasyon durumundadır ve açıya yakındır. Molekül düzlemine dik olarak yönlendirilen kükürt atomunun yörüngesi hibridizasyona katılmamaktadır. Bu orbitaller ve benzer şekilde yönlendirilmiş oksijen atomlarının orbitalleri nedeniyle, üç merkezli bir bağ oluşur; onu taşıyan elektron çifti molekülün üç atomuna da aittir.
Kükürt dioksit, sülfürik asit üretmek için ve ayrıca (çok daha küçük miktarlarda) saman, yün, ipek ve dezenfektan olarak ağartmak için kullanılır (bodrumlarda, kilerlerde, şarap fıçılarında, fermantasyon tanklarındaki küf mantarlarının imhası için).
Sülfürik asit çok kırılgan bir bileşiktir. Sadece sulu çözeltilerde bilinmektedir. Sülfürik asidi izole etmeye çalışırken, suya parçalanır. Örneğin, konsantre sülfürik asit sodyum sülfit üzerine etki ettiğinde, sülfürik asit yerine sülfür dioksit salınır:
Sülfürik asit çözeltisi havadan korunmalıdır, aksi takdirde havadaki oksijeni emer, yavaş yavaş sülfürik aside oksitlenir:
Sülfürik asit iyi bir indirgeyici maddedir. Örneğin, serbest halojenler, hidrojen halojenürlere geri yüklenir:
![]()
Bununla birlikte, güçlü indirgeyici ajanlarla etkileşime girdiğinde, sülfürik asit bir oksitleyici ajanın rolünü oynayabilir. Dolayısıyla, hidrojen sülfit ile reaksiyonu esasen denklemine göre ilerler:
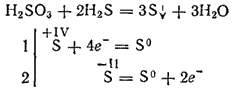
Diyabazik olan sülfürik asit, iki sıra tuz oluşturur. Orta tuzlarına sülfit, asit tuzları - hidrosülfit denir.
Asit gibi, sülfit ve hidrosülfit azaltıcı maddelerdir. Oksitlendiklerinde, sülfürik asit tuzları elde edilir.
Kalsinasyon sırasındaki en aktif metallerin sülfürleri, sülfür ve sülfatların oluşumu ile ayrışırlar (kendi kendine oksidasyon reaksiyonu - kendi kendini azaltma):
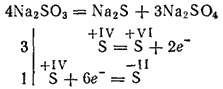
Potasyum ve sodyum sülfitler, tekstil endüstrisindeki bazı malzemelerin fotoğrafçılıkta boyanmasında kumaşların ağartılmasında kullanılır. Çözelti (bu tuz sadece çözelti içinde bulunur) ahşabı daha sonra kağıdın elde edildiği sülfit hamuru olarak işlemek için kullanılır.
Sülfürik asit oksijen ile reaksiyona girebilir. Bu, sülfürik asidi oluşturur. Bu reaksiyon çok uzun zaman alır ve sadece depolama kurallarının ihlal edilmesi durumunda mümkündür. Sülfürik asit hem oksitleyici hem de indirgeyici özelliklere sahiptir. Onun yardımıyla halojen asitleri elde edebilirsiniz. Klor ile reaksiyona girdiğinde sulu bir çözelti hidroklorik ve sülfürik asidi oluşturur.
Güçlü indirgeyici ajanlarla reaksiyona girdiğinde, sülfüröz asit bir oksitleyici ajanın rolünü oynar. Bu maddelerden biri, çok hoş olmayan bir kokusu olan bir gaz olan hidrojen sülfürdür. Sulu bir sülfürik asit çözeltisi ile etkileşime girdiğinde, sülfür ve su oluşturur. Sülfürik asit tuzları da indirgeyici özelliklere sahiptir. Sülfitlere ve hidrosülfitlere ayrılırlar. Bu tuzların oksidasyon reaksiyonları sülfürik asit üretir.
Sülfürik asit üretimi
Sülfürik asit sadece kükürt dioksit ve su etkileşimi ile oluşur. Ekşi gaz almam lazım. Bu, bakır ve sülfürik asit ile yapılabilir. Konsantre sülfürik asidi yavaşça tüpe dökün ve içine bir parça bakır atın. Tüpü bir ruhu lamba ile ısıtın.
Isıtma sonucunda, özel bir tüp yardımı ile koniye getirilmesi gereken bakır sülfat (bakır sülfat), su ve kükürt dioksit oluşur. temiz su. Bu şekilde, sülfürik asit elde edilebilir.
Kükürt dioksitin insanlara zararlı olduğunu unutmayın. Hava yolu hasarına, iştah kaybına ve baş ağrısına neden olur. Uzun süreli solunması bayılmaya neden olabilir. Onunla çalışırken dikkatli olmalısınız.
Sülfürik asit kullanımı
Sülfürik asit, antiseptik özelliklere sahiptir. Yüzeylerin dezenfeksiyonunda, tane fermantasyonunda kullanılır. Güçlü oksidanlarla (örneğin, klor) reaksiyona girdiğinde parçalanan bazı maddeleri ağartmak için kullanılabilir. Bu maddeler yün, ipek, kâğıt ve diğerlerini içerir. Antibakteriyel özellikleri, fıçılarda şarabın fermantasyonunu önlemek için kullanılır. Böylece, soylu içecek çok uzun süre saklanabilir, soylu bir tat ve eşsiz bir aroma elde edilir.
Kağıt üretiminde sülfürik asit kullanılır. Bu asidin eklenmesi, sülfit hamuru üretim teknolojisine dahil edilmiştir. Sonra lifleri birbirine bağlamak için bir kalsiyum hidrosülfit çözeltisi ile muamele edilir.
