Silikon yapısının şeması. Elektron kabuğu yapısı
Atomun PS Yapısındaki Konumu: III. Dönem; grup IV, lider; Çekirdek şarjı: +14 Si; Bağıl atomik kütle: Ar (Si) = 28 Atomik yapı: p = 14, e = 14, n = = 14 Elektronik formül: +14 Si2e; 8e; 4e; +14 Si 1s 2 2s 2 2p 6 3s 2 3p Si 1s 2 2s 2 2p 6 3s 2 3p 2 Nemetall;
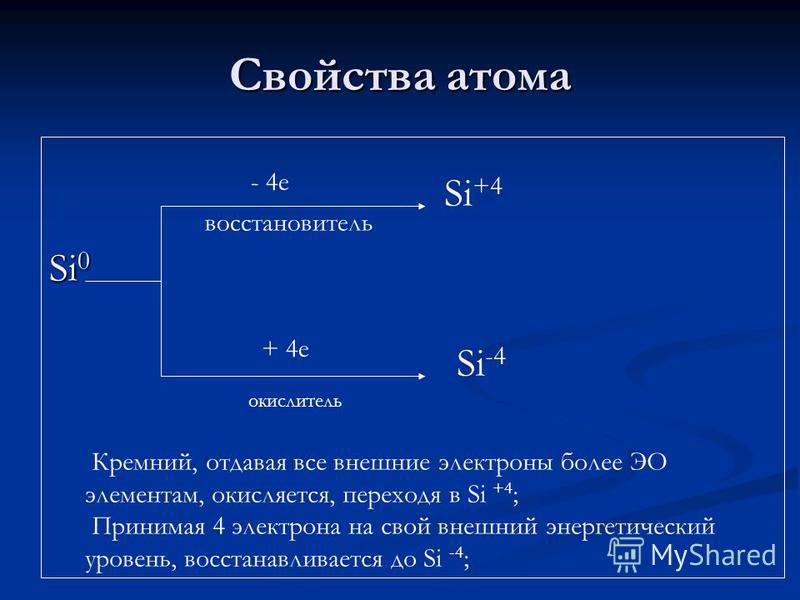
Atomik özellikler Si indirgeyici ajan + 4 e oksitleyici Si + 4 Si -4 Silikon, tüm dış elektronları daha fazla EO elementine veren, oksitlenir, Si + 4'e geçer; 4 elektronu dış enerji seviyesine alarak Si-4'e düşürür;

Silisyumun fiziksel özellikleri Silisyum metal değildir, kristalimsi ve amorf halde bulunur. Kristalin silikon, çok sert fakat kırılgan metalik bir parlaklığa sahip grimsi çelik bir maddedir. Şekilsiz silikon - kahverengi toz. p = 2.33 g / cm3; t pl = C; t kip. = C;

Silisyumun kristal yapısı Silisyumun kristal kafesi kübik bir yüz merkezli elmas türüdür. Fakat Si - Si arasındaki daha uzun bağ uzunluğu nedeniyle, silikonun sertliği elmasınkinden önemli ölçüde daha azdır. Silikon, yalnızca C'nin üzerinde ısıtıldığında kırılgandır.

elektro fiziksel özellikler Elemental silikon Elemental silikon, tipik bir yarı iletkendir. tipik yarı iletken. Kristalin silikonun elektrofiziksel özellikleri, içinde bulunan iz kirliliklerinden büyük ölçüde etkilenir. P-tipi iletkenliğe sahip silikon tek kristallerinin elde edilmesi için, 3. grup bor, alüminyum, galyum ve indiyum elementlerinin katkı maddeleri, elektronik katkı maddesi katkısı ile silikonun içine sokulur. elemanlar V fosfor, arsenik veya antimon grupları.


Çakmaktaşı Çakmaktaşı, bu Çakmaktaşı, bu çirkin ve çok çirkin ve çok dayanıklı taş, dayanıklı taş, taş çağının bir taş temeli - yüzyıl - çakmaktaşı çalışma araçlarının yüzyıl. çakmaktaşı aletler İki sebep var: - silikonun yaygınlığı ve bulunabilirliği; - silikonun yaygınlığı ve bulunabilirliği; - yontma sırasında keskin kesme kenarları oluşturma yeteneği; - yontma sırasında keskin kesme kenarları oluşturma yeteneği;




Bunu biliyor musunuz .. Saf formda silikon elde etme yöntemi Nikolai Nikolayevich Beketov tarafından geliştirilmiştir. Rusya'da silikon fabrikalarında üretilmektedir: Kamensk - Uralsky (Sverdlovsk Bölgesi) Kamensk - Uralsky (Sverdlovsk Bölgesi) Shelekh (Irkutsk Bölgesi). Shelekh (Irkutsk bölgesi).

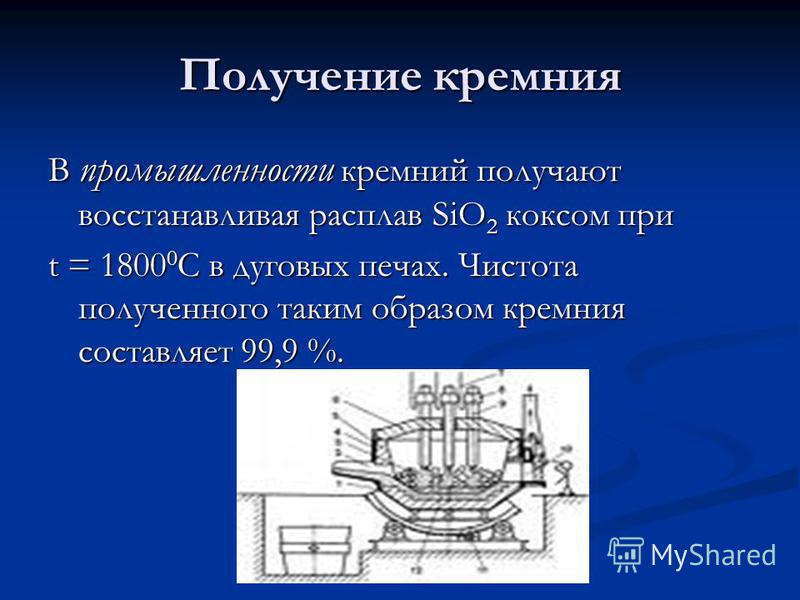
Silisyum Üretimi Endüstride, ark ocaklarında t = C'deki kokuyla Si02'nin eriyiği azaltılarak silikon elde edilir. Bu şekilde elde edilen silikonun saflığı% 99.9'dur.
Silikon Laboratuvarı üretim yönteminin elde edilmesi: SiO Mg 2MgO + Si SiO Mg 2MgO + Si


Silisyumun kimyasal özellikleri 400 - C'ye ısıtıldığında, silikon oksijenle reaksiyona girerek silikon dioksit oluşturur: Si + O 2 SiO 2 Si + O 2 SiO 2



![]()
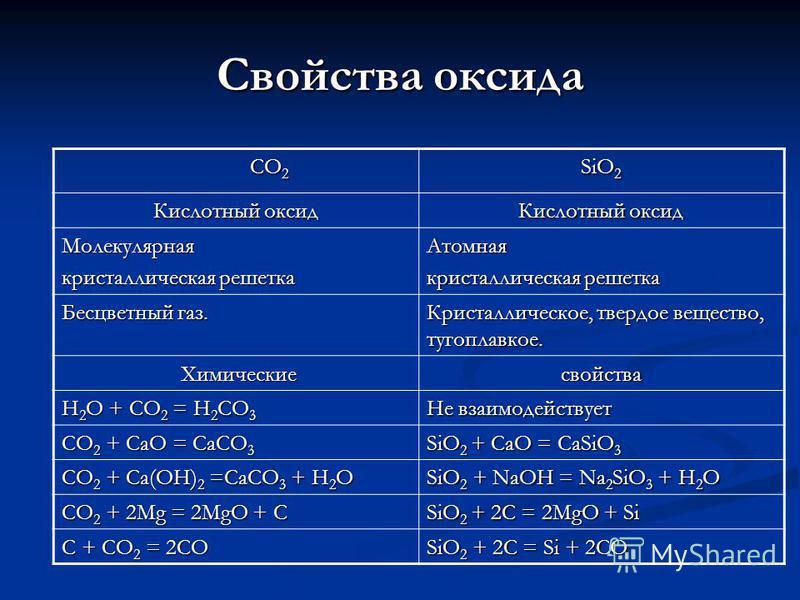
C02C02 Si02 oksit Asit oksit özellikleri Moleküler kristal kafes Atomik Renksiz gaz. Kristal, katı, refrakter. Kimyasal Kimyasal Özellikler H20 + C02 = H 2C03 Tepkime Vermez C02 + CaO = CaC03 SiO2 + CaO = CaSiO3C02 + Ca (OH) 2 = CaC03 + H20 O Si02 + NaOH = Na 2 SiO3 + H202 C02 + 2Mg = 2MgO + C SiO2 + 2C = 2MgO + Si C + C02 = 2CO Si02 + 2C = Si + 2CO
Asitlerin özellikleri H2C03H2 SiO3 Dibazik, oksijen içeren, zayıf, kırılgan, yarasa. Dibazik, oksijen içeren, zayıf, suda çözünmeyen. Alma: C02 + H20 = H 2 C03 Alma: Si02 + H20 = Yapamaz Kararsız, kırılgan, ayakta dururken veya ısıtıldığında ayrışır: H 2 C03 = C02 + H2O Saf halde seçilemez, çünkü ısıtıldığında ayrışır: H 2 SiO 3 = SiO 2 + H20 Zn + H2C03 = ZnCO 3 + H 2 Küçük gaz evrimi __________

Silisik Asit Karbonik Asitler - Karbonatlar; - hidrokarbonlar; - silikatlar; - silikatlar; Karbonatlar tuzların tüm özelliklerine sahiptir, güçlü elektrolitlerdir, iyonlara tamamen ayrışırlar (suda çözünür). Sadece alkali metal tuzları çözünür, diğerleri çözünmez oluşturur veya hiç tuz oluşturmaz (Al +3, Cr +3, Ag +).
![]()



Biyolojik rol En önemli silikon bileşiği SiO 2, bitki ve hayvan yaşamı için esastır. Onun sayesinde sazlık, sazlık Onun sayesinde sazlık, sazlık ve at kuyruğu süngü gibi sağlam durur. ve atkuyruğu süngü gibi sıkı durur. Keskin saz yaprakları kesilmiş Keskin saz yaprakları bıçak gibi kesilmiş, biçilmiş tarla bıçaklarında anız, biçilmiş tarlada iğneler gibi anız kesilmiş anız ve tahılların sapları iğneye benzer yapışır ve tahılların sapları o kadar güçlü olmaz ki tarlalardaki alanın yağmurdan düşmesine izin vermeyin ve tarlalardaki rüzgar alanının yağmurdan ve rüzgardan geçmesine izin vermeyin


Silikon, insan vücudunda sürekli bulunan iz elementtir. En büyük miktarı lenf düğümlerinde, aortun bağ dokusu, trakea, saç ve ciltte bulunur. Epitel hücreleri oluşturmak için silikon gerekir. Silikon, insan vücudunda sürekli bulunan iz elementtir. En büyük miktarı lenf düğümlerinde, aortun bağ dokusu, trakea, saç ve ciltte bulunur. Epitel hücreleri oluşturmak için silikon gerekir. Silisyum kemik mineralizasyonu sürecinde önemli bir rol oynar; arter duvarının esnekliğini korumak için gerekli, bağışıklık sistemi üzerinde olumlu bir etkisi vardır ve insan vücudundaki dokulardaki yaşlanma sürecini yavaşlatır. Kanda ortalama silikon içeriği 8,25 mg / gün'dür. Yaşla birlikte, vücuttaki seviyesi azalır, bu nedenle yaşlılarda silikon ihtiyacı artma eğilimindedir. Silisyumun vücut tarafından emilimini, kalsiyum, magnezyum, manganez ve potasyum varlığını arttırır. Silisyum kemik mineralizasyonu sürecinde önemli bir rol oynar; arter duvarının esnekliğini korumak için gerekli, bağışıklık sistemi üzerinde olumlu bir etkisi vardır ve insan vücudundaki dokulardaki yaşlanma sürecini yavaşlatır. Kanda ortalama silikon içeriği 8,25 mg / gün'dür. Yaşla birlikte, vücuttaki seviyesi azalır, bu nedenle yaşlılarda silikon ihtiyacı artma eğilimindedir. Silisyumun vücut tarafından emilimini, kalsiyum, magnezyum, manganez ve potasyum varlığını arttırır.

Silisyumun biyolojik rolü, kendi eşsiz silika iskeletlerini yaratan, canlı organizmaların en narin topakları olan diatomlar ve radyolaryanlar - alt canlı organizmaların bileşimine de dahil edilir. Silisyum, aynı zamanda silika iskeletlerinin eşsiz güzelliğini yaratan, canlı maddenin en hassas topakları olan diatomlar ve radyolarerler olan alt canlı organizmaların bir parçasıdır. Diatomlar Radiolaria Self-control 1. Silikonun periyodik sistemdeki yeri nedir: a) 2 periyot, 4 og. b) 3 dönem, 3 gr. bölüm. c) 3 dönem, 4 gr. bölüm) 2 periyod, 4 gr. b) 3 dönem, 3 gr. bölüm. c) 3 dönem, 4 gr. bölüm. 2. Silikon kafes: a) iyonik; b) atomik; c) moleküler; a) iyonik; b) atomik; c) moleküler; 3. Silisyumun doğasında görülme sıklığına göre ... eleman: a) ilk; b) ikinci; c) üçüncü; a) ilk; b) ikinci; c) üçüncü; 4. Silikon, aşağıdakilerle reaksiyona girer: a) metaller, hidrojen, halojenler; a) metaller, hidrojen, halojenler; b) alkalilerde kolayca çözünür olan metaller, halojenler; b) alkalilerde kolayca çözünür olan metaller, halojenler; c) oksitler, asitler, metal olmayanlar. c) oksitler, asitler, metal olmayanlar. 5. Silisik asit tuzları: a) Silisitler; b) hidrosilikatlar; c) silikatlar; a) silisitler; b) hidrosilikatlar; c) silikatlar;

Silikon.
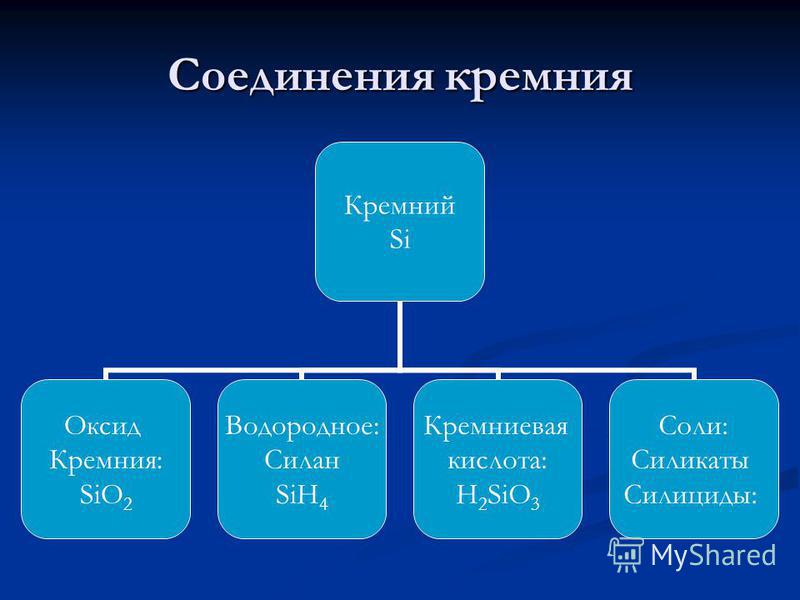
silikon - DI Mendeleev kimyasal elementlerin periyodik sisteminin 3. periyodunun grubunun ana alt grubu IV'ün bir elemanı, atom numarası 14 olan atomik kütle: 28.0855. Bileşiklerde, genellikle +4 (değer IV) ve çok nadiren +3, +2 ve +1 (sırasıyla değer, III, II ve I) oksidasyon derecesi sergiler. Periyodik tablodaki Mendeleev silikonu IVA grubunda bulunur. (A, bunun ana alt grup olduğunu gösterir) (karbon grubunda), üçüncü dönemde. Metal olmayan . Sembolüyle gösterilir si(lat. Silisyum). Serbest formda - kahverengi toz veya metalik bir parlaklık ile açık gri kompakt malzeme. Kafes yapısı: kübik, elmas.
Ana devlet: + 14 Si 14 e 1s 2 2s 2 2p 6 3s 2 3p 2, p elemanı.
2. Fiziksel özellikler.
Kristalin silikon, çelik parıltılı koyu gri bir maddedir. Silikonun yapısı, elmasın yapısına benzer. Kristalinde, her bir atom dörtlü tetrahedral ile çevrilidir ve bir elmas içindeki karbon atomları arasında olduğundan çok daha zayıf olan bir kovalent bağ ile bağlanır. Bir silikon kristalinde, normal şartlar altında bile, kovalent bağların bazıları tahrip edilir. Bu nedenle, küçük bir elektrik iletkenliğine neden olan serbest elektronlara sahiptir. Aydınlatma ve ısıtma arttıkça kopuk bağların sayısı artar, bu da serbest elektronların sayısının arttığı ve elektriksel iletkenliğin arttığı anlamına gelir. Bu yüzden silisyumun yarı iletken özelliklerini açıklamalıdır.
Silikon çok kırılgandır, yoğunluğu 2.33 g / cm3'tür. Kömür gibi, refrakter maddelere atıfta bulunur.
Silikon üç kararlı izotoptan oluşur: 2814Si (% 92.27), 2914Si (% 4.68) ve 3014Si (% 3.05).
3. Doğada olmak.
Doğada en sık, silikon şeklinde bulunur silis - silikon dioksit (IV) Si02 (dünya kabuğunun kütlesinin yaklaşık% 12'si) bazlı bileşikler. Silisyum dioksitin oluşturduğu ana mineraller ve kayalar kum (nehir ve kuvars), kuvars ve kuvarsit, çakmaktaşı ve feldispattır. Doğal silikatlar karmaşık bir yapıya ve yapıya sahiptir. İşte bazı doğal silikatların bileşimi:
ü Feldspat K 2 O × A120 3 × 6SiO 2,
ü asbest 3MgO × 2SiO 2 × 2H 2 O,
ü mika K2O × 3Al203 × 6SiO2 × 2H2O,
ü Kaolinit 3Al 2 O 3 × 2SiO 2 × 2H 2 O.
Silikon bileşiklerin doğasında en sık kullanılan ikinci grup, silikatlar ve alümino-silikatlar.
Doğal formda saf silikon bulmanın tek gerçekleri belirtilmiştir.
4. Silisyumun kimyasal özellikleri ve bileşikleri.
üzerinde kimyasal özellikler karbon gibi silisyum metal değildir, ancak metal dışı daha az belirgindir, çünkü daha büyük bir atom yarıçapına sahiptir. Silikon atomları dış enerji seviyesinde 4 elektrona sahip olduğundan, hem -4 hem de +4'ün oksidasyon durumu silisyumun karakteristiğidir (oksidasyon derecesinin +2 olduğu bir silikon bileşiği bilinmektedir).
Normal şartlar altında silikon, etkisizdir ve kristal örgüsünün gücüyle açıklanmalıdır. Doğrudan yalnızca etkileşimde bulunur florin:
asitler (hidroflorik HF ve nitrik HNO3 karışımı hariç)silikon etki etmez. Bununla birlikte, alkali metal hidroksitlerde çözünerek silikat ve hidrojen oluşturur:
Silisyum, kristalimsi ve şekilsiz iki allotropik modifikasyondan amorf silikon daha kimyasal olarak aktiftir. İle tepki verir oksijen ısıtıldığında, Si02 oluşturur:
yanı sıra tüm halojenlerörneğin:
![]()
Yüksek sıcaklıkta silikon bağlanır karbonlukarborundum SiC'nin oluşturulması:
Carborundum'da, her bir silikon atomunun dört karbon atomu ile çevrili olduğu ve bunun tersi olduğu ve kovalent bağların elmasta olduğu gibi çok güçlü olduğu elmas benzeri bir kristal kafes vardır. Bu nedenle sertlikte elmasa yakındır. Taşlama taşları ve taşlama taşları silisyum karbürden yapılmıştır.
Magnezyum silisiti. Aktif metallerle reaksiyonlarda, oluşumu ile oluşan silisid, Silikon oksitleyici bir ajan görevi görür:
Yüksek sıcaklıklarda, silikon birçok metalleri oksitlerinden kurtarır. (!!!)
Silan. Silisitler üzerindeki hidroklorik asidin etkisi altında, silikonun en basit hidrojen bileşiği silan SiH4'tür:
Silan, havasında kendiliğinden tutuşabilen, hoş olmayan bir kokuya sahip zehirli bir gazdır (!!!):
Silisyum oksit (IV).Silisyum oksit (IV) de denir silis. Katı bir refrakter maddedir. (erime noktası 1700 ° C) doğada iki şekilde yaygınlaşır:
1) kristalimsi silika - bir kuvars minerali ve çeşitleri (kaya kristali, kalsedon, akik, jasper, çakmaktaşı) şeklinde; kuvars inşaatta yaygın olarak kullanılan kuvars kumlarının temelini oluşturur ve silikat endüstrisi;
2) amorf silika - Opal mineral bileşimi SiO 2 şeklinde; n H20; amorf silisin toprak formları, diatomit, tripolidir (infüzyon edici toprak); yapay amorf susuz silika örneği, sodyum metasilikattan elde edilen silis jelidir:
Silika jel gelişmiş bir yüzeye sahiptir ve bu nedenle nemi iyi emer. .
1710 ° 'de kuvars erir. Erimiş kütlenin hızlı soğutulması ile oluşur kuvars camı . Çok düşük bir genleşme katsayısına sahiptir, böylece su hızlı bir şekilde soğutulduğunda sıcak kuvars camı çatlamaz. Laboratuar kapkacakları ve bilimsel araştırma aletleri kuvars camdan yapılmıştır.
En basit silikon oksit (IV) S02 formülü, karbon monoksit (IV) C02 formülüne benzer. Bu arada, fiziksel özellikleri çok farklıdır (Si02 - katı, CO2 - gaz). Bu fark kristal kafeslerin yapısından kaynaklanmaktadır. C02, moleküler kafes içinde, Si02 - atomik olarak kristalleşir. Düzlemsel bir görüntüdeki Si02 yapısı aşağıdaki gibi gösterilebilir:
Katı CO2 içindeki bir karbon atomunun koordinasyon sayısı 2'dir ve Si02'deki silikon 4'tür. Her silikon atomu, 4 oksijen atomlu bir tetrahedron içine alınır. Aynı zamanda, silikon atomu merkezdedir ve oksijen atomları tetrahedronun köşelerinde yer almaktadır. . Tüm silis parçası, formülü (Si02) n olan bir kristal olarak düşünülebilir. Silikon oksidin bu yapısı (IV), yüksek sertliğini ve refrakterliğini belirler. .
Silisyum oksidin (IV) Si02 kimyasal özellikleri asit oksitlerdir. Katı alkaliler, bazik oksitler ve karbonatlarla kaynaşırken, silisik asit tuzları oluşur:
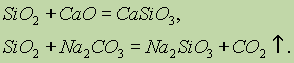
Sadece hidroflorik asit, silikon oksitle (IV) etkileşime girer:
Bu reaksiyon, camı oymak için kullanılır. .
Silikon (IV) suda çözülmez ve kimyasal olarak etkileşime girmez. (!!!) Bu nedenle, silisik asit dolaylı olarak bir potasyum veya sodyum silikat çözeltisi üzerinde bir asitle etki ederek elde edilir:
Bu durumda, silisli asit (ilk tuz ve asit çözeltilerinin konsantrasyonuna bağlı olarak), hem su içeren jelatinli bir kütle formunda hem de bir koloidal çözelti (sol) formunda elde edilebilir.
Silisik asit Si02, bileşimi genel formülüyle ifade edilebilen birkaç silisik asitin anhidritidir: xSiO2xyH20, burada x ve y - tamsayılar:
1) x = 1, y = 1: Si02 x H20, yani H2 Si03 - metasilik asit;
2) x = 1, y = 2: Si02 x 2H20, yani H4 Si04 - ortosilik asit;
3) x = 2, y = 1: 2SiO2 × H20, diğer bir deyişle H2 Si205 - bimetakrinik asit.
Silisik asit, tetrahedral yapısal birimlerden yapılır (her bir birimde, silikon atomu tetrahedronun merkezindedir ve üstlerinde oksijen atomları vardır). Zincirlerde birleşen yapısal bağlantılar daha kararlı polisilik asitler oluşturur:
Bu tür bileşiklerin bileşimi, formül (H2S03) n ile ifade edilebilir. Bununla birlikte, genellikle silisik asit, H2Si03 formülüyle temsil edilir. H2S02O - asit çok zayıf, suda az çözünür. Kolayca ısıtıldığında karbonik asit gibi ayrışır:
Tüm silisik asitler çok zayıftır (kömürden daha zayıftır).
Silikatlar. Tüm silisik asitlerin tuzları denirsilikatlarBununla birlikte, kural olarak, eğitim literatüründe silikatlar, metakilik asidin tuzlarını ima eder. Bileşimleri, genellikle, formül oksitlerle, elementlerin oksit bileşikleri formunda temsil edilir. Örneğin, kalsiyum silikat CaSiO3 şu şekilde ifade edilebilir: CaO × Si02.
R202 × nSiO2 bileşimindeki silikatlar, buradaki R2O - sodyum veya potasyum oksitler , denir çözünür cam , ve konsantre sulu çözeltileri - sıvı cam . Sodyum soda camı çok önemlidir..
Havada dururken silikatların çözeltileri bulanıklaşır, çünkü havadaki karbondioksit (IV) silisik asidi tuzlarından uzaklaştırır:
Silisik asit, suda pratik olarak çözünmez - bu özellik, iyon SiO3 2'ye nitel bir reaksiyon olarak kullanılır.
Silikatlar, silisin alkaliler veya karbonatlarla kaynaştırılmasıyla elde edilir:
5. SiO iyonunun keşfi 2. 2. (Hiçbir şey bulamıyorum ...)
6. Silikon bileşiklerinin toprak oluşumunda ve ormancılıktaki rolü.
Magmatik kayaçlar bileşiminde oldukça kararlıdır ve esas olarak silikon, alüminyum, demir, alkaliler, magnezyum ve kalsiyum bileşikleri içerir. Si0 2 içeriğine göre magmatik kayaçlar dört gruba ayrılır: asidik (\u003e% 65), orta (% 52-65), bazik (% 40-52) ve ultrabasik (<40 %). Наиболее представительны две большие группы: кислые и основные породы. Как будет видно в дальнейшем, при характеристике многих типов почв именно этот фактор приуроченности почв к кислым или основным магматическим почвообразующим породам является решающим в отношении генезиса, эволюции и свойств почв.
Asitli Magmatik Kayaçlar- granitler, pegmatitler, riyolitler, dasit ve diğerleri - genellikle belirgin kuvars, feldispat, mika kristalleri ile hafif ve kahverengimsi bir renge sahiptir. İçlerindeki Si02 içeriği, önemli miktarda potasyum ve sodyum ile yüksektir (% 65'ten fazla). Aynı zamanda, az demir, kalsiyum ve magnezyum önemsizdir. Asitli magmatik kayaçlar üzerindeki topraklar, örneğin granitler üzerindeki, kırılganlık durumuna bağlı olarak ayrışmanın erken aşamalarında, kaynak malzemenin çakıl karakterinde farklılıklar gösterir. Nemli koşullar altında havalandırıldığında, bu gibi yıpranmış yüzeylerde (kayaların eluviumu) bulunan toprağın aşırı derecede fakir, zayıf olduğu sonucu, toprak alkali elementlerini kolayca kaybederler.
Başlıca magmatik kayaçlar -bazalt, gabbro vb. kural olarak koyu (siyahtan) bir renge sahiptir. Asidik kayalara kıyasla daha düşük bir Si02 içeriği ile karakterize edilirler. Ana magmatik kayaçlar, demir, manganez, krom, kobalt, çinko, titanyum, nikel, bakır bileşikleri bakımından nispeten zengindir. Ayrışmalarının ürünleri oldukça hızlı bir şekilde kil karakterini kazanır, alkali ve nötr bir reaksiyonu uzun süre korur ve artmış humus ve kil mineralleri içeriğiyle ayırt edilir. Bu tür kayaların üzerindeki toprak daha verimlidir.
Asitli ve bazik türlere ek olarak sıklıkla bulunur geçiş tipi magmatik kayaçlar(orta) - diorit grubunun müdahaleci kayaları ve efüzyonlu muadilleri - andezitler. Buna göre, bu kayaların üzerindeki topraklar asidik veya bazik kayalara sınırlı olanlara benzer özellikler kazanır. Çok daha az yaygın ultrabazik ırklar:en düşük Si02 içeriğine sahip peridotitler ve pikitler.
Metamorfik kayalar -masif kristalin ve tortul kayaçlar arasında geçiş. Dalış altındaki eski tortul kayaçlar, yüksek basınç ve sıcaklıklar metamorfozlanır, cilalar, serpantinitler, mermer, kuvarsitler, şeyller oluşur. Gnays, özellikle granitlere bileşimde benzerdir. Bu tür kayaların üzerinde oluşan topraklar, asidik magmatik kayaçlar üzerindeki topraklara benzer özelliklere sahiptir.
Klor.
1. Alüminyumun DI Mendeleev tablosundaki konumu. Atomun yapısı, oksidasyon derecesini gösterdi.
klor - VII grubunun ana alt grubunun, 3. periyotta, atom numarası 17 olan bir element. Bu, Cl sembolü (lat. Chlorum) ile gösterilir. Kimyasal olarak aktif Metal olmayan . Halojen grubuna dahil olanlar .
Normal koşullar altında basit madde klor - zehirli gaz sarımsı-yeşil renk havadan daha ağır, güçlü bir koku ile . İki atomlu klor molekülü (formül Cl2).
Ana devlet: +17 Cl 17e1s 2 2s 2 2p 6 3s 2 3p 5, p elemanı. Art. -1 +1 +3 +5 +7.
Elektron kabuğunun yapısı.
Klor atomunun değerlik düzeyinde içerir 1 eşlenmemiş elektron : 1s 2 2s 2 2p 6 3s 2 3p 5, yani bir klor atomu için 1'in değeri çok kararlıdır. Kullanılmayan d-sublevel orbitallerinin klor atomundaki varlığından dolayı, klor atomu başka oksidasyon dereceleri sergileyebilir. Atomun uyarılmış hallerinin oluşum şeması:
Klor bileşikleri ayrıca, klor atomunun resmen değer 4 ve 6'yı, örneğin Cl02 ve Cl206'yı gösterdiği bilinmektedir. Bununla birlikte, bu bileşikler artık radikaldir, yani bir eşlenmemiş elektronu vardır.
2. Fiziksel özellikler.
Normal koşullar altında, klor boğucu bir kokuya sahip sarı-yeşil bir gazdır. Fiziksel özelliklerinden bazıları aşağıda sunulmuştur.
Yoğunluk: 3.214 g / l, sıvı - -35 ° C - 1.557, TV. -105 ° C - 1.9 g / cm3'te.
Erime noktası: 172.2 K
Kaynama noktası: 238.6 K
Füzyon ısısı: 6.41 kJ / mol
Buharlaşma ısısı: 20.41 kJ / mol.
Klor gazı nispeten kolay bir şekilde sıvılaştırılır. 0,8 MPa (8 atmosfer) basınçla başlayarak, klor oda sıcaklığında zaten sıvı olacaktır. −34 ° C sıcaklığa kadar soğutulduğunda, klor normal atmosferik basınçta da sıvı hale gelir. Sıvı klor, yüksek korozif etkisi olan (yüksek molekül konsantrasyonundan dolayı) sarı-yeşil bir sıvıdır. Basıncı artırarak, 7.6 MPa'lık kritik bir basınçta +144 ° C (kritik sıcaklık) sıcaklığına kadar sıvı klor varlığını elde edebilirsiniz. Elektriksel iletkenlik açısından, en güçlü yalıtkanlar arasında sıvı klor yer alır: akımı damıtılmış sudan neredeyse milyar kez, gümüşden ise 10-2 kat daha kötü iletir. Klordaki sesin hızı havadan yaklaşık bir buçuk kat daha azdır.
3. Doğada olmak.
Doğada, iki adet klorin 35 Cl ve 37 Cl izotopları vardır. Klor yer kabuğunda en yaygın halojendir. . Klor çok aktif - Periyodik sistemin neredeyse tüm unsurlarına doğrudan bağlanır. Bu nedenle, doğada, sadece minerallerin bileşimindeki bileşikler şeklinde bulunur:
ü halit NaCl,
ü sylvina KCl,
ü sylvinite KCl · NaCl,
ü bischofit MgCl2, 6H20,
ü Karnalit KCl · MgCl2 · 6H20,
ü Cainite KCl · MgS04 · 3H2O
En büyük klor rezervi tuzlarda, sularda, denizlerde ve okyanuslarda bulunur (deniz suyunun içeriği 19 g / l'dir). Klor, yer kabuğundaki toplam atom sayısının% 0,024'ünü oluşturur; clarke numarası (Bu sistemin toplam kütlesine göre yer kabuğunda, hidrosferde, Dünyada, uzay cisimlerinde, jeokimyasal ya da kozmokimyasal sistemlerde vb. kimyasal elementlerin ortalama içeriğini ifade eden sayılardır.) klor -% 0,017. İnsan vücudu ağırlıkça% 0.25 klor iyonları içerir. İnsanlarda ve hayvanlarda, klor esas olarak hücre içi sıvılarda (kan dahil) bulunur ve ozmotik işlemlerin düzenlenmesinde ve sinir hücrelerinin çalışmasıyla ilgili işlemlerde önemli bir rol oynar.
4. Klorun ve bileşiklerinin kimyasal özellikleri. Klor alıyorum.
Silisyum atomunun yapısı. Si. 14. Heyecanlı devlet. E. 3d. 3p. 3s. E. 3d. 3p. 3s. 1s 2s 2p 3s 3p. 2e 8e 4e. 2. 2. 6. 2. 2.
"Silikon" sunumunun 3. resmi "silikon" konulu kimya dersleriBoyutlar: 960 x 720 piksel, format: jpg. Kimya dersi için ücretsiz bir resim indirmek için resmin üzerine sağ tıklayın ve "Resmi farklı kaydet ..." seçeneğini tıklayın. Dersteki resimleri göstermek için ayrıca “Silicon.ppt” sunumunu tüm resimlerle birlikte zip arşivinde indirebilirsiniz. Arşiv boyutu - 562 KB.
Sunumu indirsilikon
"Silisyum ve bileşikleri" - Atomların yapısı ve özellikleri. Yarı İletken. erime (Si) = 1415 ° C, erime (elmas) = 3730 ° C Silikon alıyorum. Silisyumun keşfi. Ayrıca bitki ve hayvanların bileşimine dahil edilir. Silisyumun fiziksel özellikleri. Bu nedenle, tuğla seramiktir ve antik Yunan amforasının çinileri ve parçaları da seramiktir. Amaç: Silisyumun kimyasal özellikleri.
"Silikon bileşikleri" - Silikon ve bileşikleri. Si02'nin kimyasal özellikleri. Silan. Silisik asit almak. Silikon özellikleri Silisyum oksit Doğal silikatlar. Yükseltgenme durumu Yapay elmas. Topaz. Laboratuarda silikon alıyorum. Doğada olmak. Kristal kafesler. Silisyumun keşfi. Ametist. Silikon alıyorum.
"Silisyum izotopları" - Silisyum izotoplarının ayrılması. Polikristalin silikon üretimi. Monoisotopik silikon kullanımı için Beklentiler. Bir kuvars potadan tek bir kristal büyürken izotopik seyreltme. Tek kristal tohum üretimi. Raman bandının maksimumunun atom kütlesi üzerindeki pozisyonuna bağlılığı.
"Silikon Dersi" - Yaşayan ve olmayan doğadaki en önemli kimyasal elementlerden hangisi? Karbon ve silikon oksitleri. Madde saydamdır. Metalik olmayan ve metalik özelliklerin tezahürü. Yansıması özetliyor. Son test Karbon oksitler ve silikon hidroksitleri? Toplanma durumu: a) sıvı, b) gaz, c) katı.
"Silikon" - Silikon basit bir maddedir. Fiziksel özellikler Silisyum oksit (IV). Silisidler. Canlı organizmalar için anlam. Metallerle etkileşim. Metal olmayanlarla etkileşimi. Silisyum karbür. Doğada silikon. Silikon. Silikat endüstrisi ürünleri. Doğal silikon bileşiklerinden biri silikatlardır.
"Karbon ve silikon" - Silisyum oksit (IV). Ana alt grubun IV. Grubu elemanları. Toksisite. 7. Karbon hakkında ilginç. Silikatlar. Dokunuşa kaydırın. Elmas, en zor doğal maddedir. Kimyasal özellikleri Atmosferdeki karbonun% 99'undan fazlası karbon dioksit formundadır. Karbürler. 6. Uygulama Katılar arasında en yumuşaklardan biri.
Toplamda 6 sunum bulunmaktadır.
