Sio2'nin fiziksel özellikleri. Oksijen bileşikleri. Silisyum (II) SiO
Silisyum oksit (II) SiO. Doğada, bu gerçekleşmez, ancak reaksiyonla elde edilebilir:
Si02 + Si → 2 SiO.
Normal basınç altında, silikon monoksitin süblimasyonu yaklaşık 1200 ° C'de başlar (başlangıç materyallerinin kendisi henüz pratikte buharlaşmadığında). Çiftler halinde, SiO ayrı bir bileşiktir. Elementlerin ayrışma enerjisi 789 kJ / mol'dür. Katı hal haline getirme işlemi, yalnızca gaz fazının hızlı soğutulması (“su verme”) ile gerçekleştirilebilir. Aksi taktirde denklemden uzaklaşmanın geçme zamanı vardır:
2 SiO = Si02 + Si.
Silisyum monoksit, atmosferik oksijen ile yavaşça oksitlenir ve silisik asit tuzları oluşturmak ve hidrojenin salınması için kolayca alkalilerde çözünür. Sürtünme ile kolayca elektriklenerek güçlü bir negatif yük elde edilir.
Silisyum oksit (IV) Si02.Silisyum oksit (IV) de silika olarak adlandırılır. Katı bir refrakter maddedir. (erime noktası 1700 ° C)doğada iki şekilde yaygınlaşır: 1) kristalimsi silika - bir kuvars minerali ve çeşitleri (kaya kristali, kalsedon, akik, jasper, çakmaktaşı) şeklinde; kuvars inşaat ve silikat endüstrisinde yaygın olarak kullanılan kuvars kumlarının temelini oluşturur; 2) amorf silika - SiO 2 mineral opal bileşimi formunda nH20; amorf silisin toprak formları, diatomit, tripolidir (infüzyon edici toprak); Yapay amorf susuz silika örneği, sodyum metasilikattan elde edilen silis jelidir:
Silika jel gelişmiş bir yüzeye sahiptir ve bu nedenle nemi iyi emer.
1710 ° 'de kuvars erir. Erimiş kütlenin hızlı soğutulması ile kuvars camı oluşur. Çok düşük bir genleşme katsayısına sahiptir, böylece su hızlı bir şekilde soğutulduğunda sıcak kuvars camı çatlamaz. Laboratuar kapkacakları ve bilimsel araştırma aletleri kuvars camdan yapılmıştır.
Düzlemsel bir görüntüdeki Si02 yapısı aşağıdaki gibi gösterilebilir:
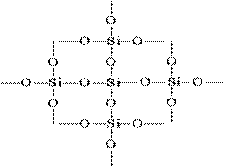
Her bir silikon atomu, 4 oksijen atomundan oluşan bir tetrahedron içine yerleştirilir. Bu durumda, silikon atomu merkeze yerleştirilmiş ve oksijen atomları tetrahedronun köşelerine yerleştirilmiştir. Tüm silis parçası, formülü (Si02) n olan bir kristal olarak düşünülebilir. Bu tür bir silikon oksit (IV) yapısı, yüksek sertliğini ve refrakterliğini belirler.
Silisyum oksidin (IV) Si02 kimyasal özellikleri asit oksitlerdir. Katı alkaliler, bazik oksitler ve karbonatlarla kaynaşırken, silisik asit tuzları oluşur:
Sadece hidroflorik asit silikon oksitle (IV) etkileşime girer (cam aşındırma):
Si02 + HF → SiF 4 + H20
Silisyum (IV) oksit suda çözülmez ve kimyasal olarak etkileşime girmez. Bu nedenle, silisik asit dolaylı olarak, örneğin hidrolizle elde edilir:
SiS 2 + H20 ↔ H2S + H4 SiO4 ortosilikon asit.
H4 Si04 çözülebilir, ısıtıldığında veya bekletildiğinde bir polimerizasyon işlemi devam eder:
2 H4 SiO4 → H20 + H6 Si207- diorthokremnievy asit.
2H6 Si207 → H20 + H10 Si4O13 tetraorotremilik asit.
Yüzüğü kapatıyor:
H 10 Si4O13 → H20 + (H2 SiO3) 4 tetramethacilicic asit.
Bu durumda, silisli asit (ilk tuz ve asit çözeltilerinin konsantrasyonuna bağlı olarak), hem su içeren jelatinli bir kütle formunda hem de bir koloidal çözelti (sol) formunda elde edilebilir. Elde edilen silisik asidin bileşimi, başlangıç maddelerine ve hazırlama şartlarına bağlıdır. Tüm silisik asitler çok zayıftır (kömürden daha zayıftır).
Bir çözeltideki karbonik asit, tuzlarından silisik asit çıkarırsa, kalsinasyon sırasında ters reaksiyon meydana gelir. Birincisi, silisik asitin düşük mukavemetinden (ayrışma derecesi), ikincisi ise ısıtıldığında düşük uçuculuğundan kaynaklanmaktadır.
Isıtılmış polisilik asitler ve bunların aşamalı dehidrasyonları, ince Si02 olarak adlandırılabilir. silika jeli . Suyu iyi emer, pahalı elementlerin oksitlenmesini önlemek için cihazlara yerleştiririm.
Almanya alt grubu
Ge (+4) Sn (+2, +4) Pb(+2) - dirençli oksidasyon durumları
Germanyum, 1871'de DI Mendeleev tarafından tahmin edildi ve 1886'da keşfedildi. Kalay ve kurşun, uzun zamandır insanoğlunun en çok bilinen unsurlarıydı: Mısırlılar, M.Ö. 3000 yıllarından beri cevherleri koklayabiliyorlardı. e. Hindistan'da kurşun yaklaşık 2500 yıl, kalay 1500 yıl boyunca tanındı. e. Antik Çin'de üretilen eritme tenekesi.
Alınıyor.Doğal germanyum bileşikleri Ge02'ye dönüştürülür ve hidrojen ile indirgenir:
GeO 2 + H 2 t → Ge + H 2 O, yaklaşık 1000 ° C sıcaklıkta
Kalay doğal mineralden elde edilir cassiterite(Sn02):
Sn02 + C → Sn + CO.
Endüstriyel kurşun azaltma için en basit şema, iki ardışık reaksiyona dayanır:
PbS + O 2 → S02 + PbO galen(PbS) yakılır ve daha sonra kömür ile indirgenir:
PbO + С → СO + Pb.
Uygulama.Her üç unsur da modern teknoloji için çok önemlidir. Bazı kalay ve kurşun bileşikleri de büyük kullanım alanıdır. Kurşun türevleri çok toksiktir.
Germanyum tipik bir yarı iletkendir (0.75 eV bant genişliği olan n-tipi) ve elektrik mühendisliğinde çeşitli kullanımlar bulur. En çok AC redresör üretimi için kullanılır.. Bu uygulama saf germanyum ve indiyum ile germanyum alaşımı arasındaki temastan kaynaklanan tek kutuplu iletkenlik dayanmaktadır. Akım (elektron akışı) bu tür bir kurulumda pratik olarak sadece germanyumdan alaşıma geçer, ancak tersi olmaz. Germanyum redresörleri son derece yüksek (yaklaşık% 98) verim ve çok büyük (düzgün çalışma) servis ömrü ile karakterize edilir. Bu tür redresörlerin temel dezavantajı, ısınma duyarlılığı - 70 ° C'nin üstünde, verimleri hızla düşer.
Önemli kullanım alanı almanya kızılötesi bir optik 2 mikrondan daha fazla dalga boyuna sahip ışınları pratikte geciktirmiyor. Aksine, ışık ve yakın mesafelerde (0.2 - 2 mikron), germanyum yoğun bir şekilde enerji emer. Parlak bir metal yüzey (sıcaklığı iyi depolayan ancak iyi ısınmayan) germanyum film ile kaplanmışsa, yüzey filmsiz bir şekilde daha fazla ısınır. Bu şekilde hazırlanan güneş ışığının etkisiyle namluda kaynar su elde edilebileceği bildirildi.
Kalay, paslanmaya karşı korumak için çoğunlukla demir kalaylamada kullanılır. (konserve endüstrisi için teneke). Mikron sırasına göre, bu tür kalay kaplamaların kalınlığı çok küçüktür. İnce tabakalar halinde (Stannioles adı verilen) elektrik endüstrisinde kapasitör üretimi için kalay tüketilir. . Kurşun, akü plakalarının, elektrik kablolarının plakalarının, mermilerin ve atışların, X-ışınlarına ve g ışınlarına karşı ve ayrıca kimya endüstrisinde (boru hatları, vb.) Korunmasında kullanılır. Çok sayıda teknik açıdan önemli alaşımların imalatına çok büyük miktarda kalay ve kurşun harcanmaktadır.
Bunlardan en önemlileri çeşitli bronzlardır (Cu ve Sn alaşımları), rulmanlar için alaşımlar (genellikle Pb veya Sn bazında yapılan ve aynı zamanda Sb ve Cu içeren bebekler), tipografik alaşımlar (% 5-30 Sn,% 10-20 Sb, Gerisi Pb) ve normal “yumuşak” lehimdir (% 30-70 Sn,% 70-30 Pb). Genellikle% 90 Pb,% 6 Sn,% 4 Sb daha ucuz bir alaşımla değiştirilebilir. Yaklaşık olarak% 98 Pb,% 1 Ca,% 1 Na'lık bir bileşime sahip olan rulmanlar için büyük önem arz etmektedir.
Silika (silika, silika), yüksek mukavemet, sertlik ve refrakterliğe sahip renksiz kristallerden oluşan bir maddedir. Silikon dioksit asitlere karşı dayanıklıdır ve suyla etkileşime girmez. Reaksiyon sıcaklığının artmasıyla, madde alkalilerle etkileşime girer, hidroflorik asit içinde çözülür, mükemmel bir dielektriktir.
Doğada, silikon dioksit yaygın olarak dağılır: kristalin silikon oksit, jasper, akik (kristalin silikon dioksit bileşikleri), kaya kristali (maddenin büyük kristalleri), kuvars (serbest silikon dioksit), kalsedon, ametist, morion, topaz (renkli kristaller) gibi minerallerle temsil edilir. silika).
Normal koşullar altında (doğal ortam sıcaklığında ve basınçta), silikon dioksitin üç kristal modifikasyonu vardır - tridimit, kuvars ve kristobalit. Sıcaklık arttığında, silikon dioksit önce kolesite, sonra da stishovite (1962'de göktaşı kraterinde bulunan bir mineral) dönüşür. Yapılan araştırmalara göre, dünya mantosunun büyük bir bölümünü oluşturan bir silikon dioksit türevi olan stishovit.
Maddenin kimyasal formülü - SiO 2
Silika hazırlanması
Silisyum dioksit, endüstriyel olarak saf kuvars konsantresi üreten kuvars tesislerinde üretilir, daha sonra kimya ve elektronik endüstrisinde, optik, kauçuk ve boya ve vernik dolgu maddelerinin, mücevher yapımcılığının, vb. İmalatında kullanılır. Aksi takdirde silika olarak adlandırılan doğal silikon dioksit, inşaatta (beton, kum, ses ve ısı yalıtım malzemeleri) yaygın olarak kullanılmaktadır.
Silisyum dioksitin sentetik bir yöntemle sentezi, asitlerin sodyum silikat üzerindeki etkisiyle, bazı durumlarda diğer çözünür silikatlar üzerindeki veya iyonların etkisi altında kolloidal silika pıhtılaşma yöntemi ile gerçekleştirilir. Ek olarak, silikon dioksit, yaklaşık 500 derece santigrat sıcaklıkta oksijenin oksijene oksidasyonu ile üretilir.
Silikon dioksit uygulaması
Silikon içeren malzemeler hem yüksek teknolojiler alanında hem de günlük yaşamda yaygın olarak kullanılmaktadır. Silisyum dioksit, cam, seramik, beton ürünleri, aşındırıcı malzemelerin yanı sıra radyo mühendisliği, ultrasonik tesisler, çakmaklar, vb. İmalatında kullanılır. Bir dizi bileşen ile birlikte, fiber optik kabloların üretiminde silika kullanılır.
Gözeneksiz amorf silikon dioksit ayrıca, gıda endüstrisinde, E551 numarası altında kayıtlı olan ve ana ürünün topaklanmasını ve topaklanmasını önleyen bir katkı maddesi olarak da kullanılır. dioksit  silikon endüstrisi, ilaç endüstrisinde bir ilaç enterosorbenti olarak, diş macunu imalatında kullanılır. Bu madde cipslerde, krakerlerde, mısır çubuklarında, hazır kahvede vs. bulunur.
silikon endüstrisi, ilaç endüstrisinde bir ilaç enterosorbenti olarak, diş macunu imalatında kullanılır. Bu madde cipslerde, krakerlerde, mısır çubuklarında, hazır kahvede vs. bulunur.
Silika Zararı
Resmi olarak, silikon dioksit maddesinin, gastrointestinal kanaldan değişmeden geçtiğini onayladı, ardından vücuttan tamamen çıkarıldı. Fransız uzmanlar tarafından yapılan 15 yıllık bir araştırmaya göre, yüksek alümina içme suyu içmek Alzheimer hastalığı gelişme riskini% 10 azaltıyor.
Bu nedenle, kimyasal olarak inert bir madde olan silikon dioksitin tehlikeleri hakkında bilgi yanlıştır: Oral olarak alınan E551 diyet takviyesi sağlık için tamamen güvenlidir.
Silisyum oksit Si02, esas olarak kuvars minerali, ayrıca cristobalit ve tridimit formunda bulunduğu, yaygın olarak dağılmış, katı, çok refrakter bir maddedir (1700 ° C'den fazla erime noktası).
Her zamanki sıcaklıklarda, kuvars sabit bir modifikasyondur, artan sıcaklık polimorfik dönüşümleri gözlenir:
Bir monomer formundaki tüm modifikasyonların silisleri mevcut değildir; her zaman polimeriktir ve çok güçlü bir atomik kafes oluşturan tetrahedranın “inşa edilmiş”
(Si02) n kristallerindeki her silikon atomu, her biri köprülenmiş dört oksijen atomuyla dörtgen bir şekilde çevrelenmiştir. Yaygın bir oksijen atomu vasıtasıyla, farklı açılardaki tetrahedra birbirlerine bağlanır ve sürekli üç boyutlu bir kafes oluşturur; tetrahedranın uzayda karşılıklı düzenlenmesi, silisin bir veya başka bir modifikasyonunu belirler.
Silika bağ dayanımının farklı modifikasyonlarında değişkenlik gösterir. Bu, Si-O-Si açılarının ve Si-O mesafelerinin büyüklüğünü etkilemektedir, örneğin, silisin çeşitli modifikasyonlarındaki Si-O-Si bağ açısı 120 ila 180 ° arasında değişmektedir. Kuvars-tridimit-cristobalit geçişlerine, sadece yüksek sıcaklıklarda oluşabilecek bağların kırılması ve dönüşümü eşlik eder.
Kuvars. Genellikle doğada, bazen oldukça büyük boyutlu, son derece iyi biçimlendirilmiş kristaller formunda bulunur. Kristaller, spiral şeklinde, merkezi eksen etrafındaki spiral şeklinde düzenlenmiş tetrahedralardan oluşturulur. Aynı kristalde, sarmalın yönü zıt olabilir. Bu kristaller optik izomerlerdir. Işığın kutuplanma düzlemini döndürürler ve hem sağ hem de solak olabilirler. Bu ve diğer kristaller, ayna görüntülerinden özne olarak farklılık gösterir.
Kuvars, bilim ve teknolojinin çeşitli alanlarında kullanılır ve kristalleri genellikle yapay olarak yetiştirilir. Bazı kuvars türleri özel isimlerdir. Şeffaf renksiz kristallere kaya kristali denir. Renkli kuvars çeşitleri de vardır: gül kuvars, menekşe (ametist), koyu kahverengi (dumanlı topaz), yeşil (krisopraz), vb. Kuvarsın diğer maddelerin karışımları ile kristal halinde modifikasyonuna kalsedon denir. Kalsedon çeşitleri akik, jasper ve diğerleri, kaya kristali ve renkli kuvars çeşitleri değerli ve yarı değerli taşlar olarak kullanılmaktadır.
Tridimit, volkanik kayalarda, ancak çok küçük miktarlarda meydana gelir. Bilinen tridimit ve göktaşı kökenli.
Doğadaki kristobalit, bazen tridimit gibi lav içerisine gömülü küçük kristaller şeklinde bulunur. Tridimit ve cristobalit, kuvarsdan daha "gevşek" bir yapıya sahiptir. Böylece, cristobalit, tridimit ve kuvars yoğunluğu 2.32'dir; Sırasıyla 2,26 ve 2,65 g / cm3'tür.
Yavaş soğuma ile eritilen silika kolayca şekilsiz kuvars cam oluşturur. Cam formunda Silika da doğada bulunur. Şekilsiz camın yoğunluğu, tüm kristalli modifikasyonlardan daha düşük, 2.20 g / cm3'tür. Kuvars camı, hafif bir genleşme katsayısına sahiptir, bu nedenle, sıcaklıktaki ani değişikliklere dayanıklı laboratuvar cam eşyası hazırlamak için kullanılır.
Sudaki tüm silika modifikasyonları pratik olarak çözünmez (25 ° C sıcaklıkta, kuvarsın çözünürlüğü 7, kristobalit - 12, tridimit - 16, kuvars camı - 83 mg / l'dir). Bu nedenle normal şartlar altında, sadece alkalin çözeltileri ve hidroflorik asit bunlara etki eder:
Si02 + 2KO = K2 Si02 + H20, (1)
Si02 + 4HF = SiF 4 + 2H2O (2)
İkinci reaksiyon, camın "aşınmasında" kullanılır.
Eklenen silika, silikatları oluşturmak için bazik oksitler, alkaliler (reaksiyon (1)) ve karbonatlarla reaksiyona girer:
Si02 + CaO = SaSi03, 3 (3)
Si02 + Na2C03 = Na2 SiO3 + C02. (4)
Tepkimeler (3) ve (4), çeşitli camların ve ayrıca sementin endüstriyel üretiminin altındadır. Bu nedenle, sıradan camın bileşimi (örneğin, bulaşık üretimi için pencere), Na2O CaO formülüyle ifade edilir. 6SiO 2. Bu cam, bir soda, kum ve kireçtaşı karışımı kaynaştırılarak üretilir. İşlem, gazların tamamen giderilmesine kadar -1400 ° C sıcaklıkta gerçekleştirilir:
Na2C03 + CaC03 + 6Si02 = Na2O. CaO. 6SiO 2 + 2CO 2.
Özel cam sınıfları için - refrakter, "kırılmaz" - pişirme sırasında baryum, kurşun, bor oksitleri ekleyin. Renkli camlar elde etmek için çeşitli katkı maddeleri de eklenir, örneğin, kobalt oksit Co2O3 eklenmesi mavi bir renk, krom oksit Cr203 - yeşil, manganez dioksit MnO2 - pembe verir.
Si02 oksit, x ve y'nin tamsayı sayıları: 1) x = 1, y = 1: Si02 olan formülünün genel formülü ile ifade edilebilen bir dizi silisik asitin bir anhidritidir. H 2 Oh, yani H2S02O3 - meta-silikon asidi; 1) x = 1, y = 2: Si02. 2H20, yani ortosilik asit; 1) x = 2, y = 1: 2Si02. H 2 Oh, yani H 2 Si205 - bimeta silisik asit.
Molekülleri birden fazla Si02 molekülü içeren asitler polisilikona aittir.
Silisik asitlerin en basiti, genellikle basitçe silikon olarak adlandırılan H2S03'tür ve tuzları silikatlardır. Silikatlardan yalnızca sodyum ve potasyum silikatlar suda çözünür, geri kalan silikatlar ise refrakter, suda çözünmeyen maddelerdir.
Silikat asit çözeltileri havada dururken bulanıklaşır, çünkü içerisindeki CO2 silisik asidi tuzlarından uzaklaştırır (H2S03 karbonik asitten daha zayıftır; ilk aşamada H2S03'ün ayrılma sabiti K1 = 2.2, 10 -10'a eşittir. ).
H 2 SiO3 suda neredeyse çözünmez - bu özellik silikat iyonlarının tespiti için kalitatif bir reaksiyon olarak kullanılır:
Na2Sio3 + C02 + H20 = Na2C03 + H2 SiO3.
Silikatlar, Si02'nin alkaliler veya karbonatlarla kaynaştırılmasıyla elde edilir.
Konsantre sodyum ve potasyum silikat çözeltilerine sıvı cam denir, yüksek oranda hidrolize olmaları nedeniyle kuvvetli bir alkali reaksiyona sahiptirler:
K2 SiO3 + H202KON + H2 SiO3 ↓.
Sıvı cam, örneğin tutkal, su geçirmez kumaşların imalatında kullanılır.
Çimento, inşaatta suyla karıştıkça sertleşen bağlayıcı olarak çok yaygın olarak kullanılır. Genellikle çimento, çeşitli silikatların kavrulduğu ve öğütüldüğü büyük döner fırınlarda (-1000 ° C sıcaklıkta) üretilir.
Birkaç çimento türü vardır, ancak iki çimento tipini “pıhtılaşma” ilkesine göre (sıradan çimento ve Portland çimentosu) ayırmak şartlı olarak mümkündür. Kalsiyum silikattan oluşan geleneksel çimentoyu "ayarlama" işlemi, havadaki karbondioksit nedeniyle kalsiyum karbonat oluşumundan kaynaklanır:
CaO. Si02 + C02 + H20 = CaCO3 ↓ + H2 SiO3 ↓.
Portland çimentosu kurulurken karbondioksit sürece dahil değildir ve silikatların hidrolizi müteakiben çözünmeyen kristalin hidratların oluşumu ile meydana gelir:
Ca3Si5 + H20 = Ca2 SiO4 + Ca (OH) 2,
Ca2 SiO4 + 4H20 = Ca2 SiO4. 4H2O.
· Karbürler ve silisitler
· Metal ve karbonhidrat ve silisitler içeren karbon ve silikon bileşikleri, söz konusu reaksiyonların yanı sıra, silikonun metal hidritlerle etkileşimi ile de elde edilir, örneğin:
· 2CaH2 + Si = Ca2Si + 2H2.
· Bütün bu reaksiyonlar yüksek sıcaklıklarda gerçekleşir. Karbürler arasında "metanitler" ve "asetilen" de bulunur. Birincisi, oksidasyon durumunda -4 (Be2C, Al4C3) karbon içeren metan türevleri, ikincisi - bir derece karbon oksidasyon derecesine sahip asetilen türevleri olarak -1 (Li2C2, Ag2C2, Cu2C2) CAC2). Gümüş ve bakır (I) 'in asetillidleri, asetilen, gümüş oksit veya bakır (I) klorürün amonyak çözeltisinden geçirilerek kolayca elde edilebilir. Çoğu metanitler ve asetilitler, suyla (özellikle asitlerle) aktif olarak reaksiyona girerek karşılık gelen hidrokarbonları serbest bırakır:
· СаС 2 + 2Н 2 О = Са (ОН) 2 + С 2 Н 2,
· Al4C3 + 12H20 = 4Al (OH) 3 ↓ + 3CH4,
· Ag2C2 + 2HCl = 2AgCl ↓ + C2H2.
· Karbürlerden farklı olarak, sadece alkali veya alkalin toprak metallerinin silisitleri su ve asitlerle etkileşime girerek, genellikle silan SiН4 olarak adlandırılan en basit hidrojen bileşiği silikon monosilanı üretir:
· Ca2Si + 4HCl = 2CaCl2 + SiH4.
· Silan, küf kokusu olan, havada kendiliğinden tutuşabilen, Si02 ve suya yanabilen renksiz bir gazdır:
· SiH4 + 2O2 = Si02 + 2H2O
Alkaliler çok kolay bir şekilde silanı denklem ile ayrıştırırlar:
· SiH4 + 2KON + H20 = K2Si3 + 4H2,
· Su aynı zamanda silanı hidrolize eder, ancak daha yavaştır:
· SiH4 + 2H20 = Si02 + 4H2.
· Hava erişimi olmadan 400 ° C'nin üzerinde ısıtıldığında, silan silikon ve hidrojene ayrılır (silikon üretme yöntemlerinden biri):
· SiH4 = Si + 2H2.
· Monosilanın yanı sıra, disilan Si2H6, trisilan Si3H8, tetrasilan Si4H10, vb. De bilinmektedir. Bireysel durumda, bileşikler sadece Si6H14 dahil olmak üzere izole edilmiştir. Tüm bu bileşikler, SinH2n + 2 genel formülünün tekabül ettiği homolog silan dizisine aittir. Alkanlar gibi silanlar da renksizdir, homolog serinin ilk üyeleri normal koşullar altında gaz halindedir, aşağıdakiler sıvılardır. Silanların ve hidrokarbonların kimyasal aktivitesi farklıdır: yeterince inert alkanların aksine, silanın tümü reaktif. Bu, karbon ile karşılaştırıldığında hidrojen için düşük silikon afinitesine ve silikon için oksijenin çok yüksek afinitesine bağlıdır. Ayrıca, Si-Si bağları С-С bağlarına göre daha az dayanıklıdır. C - H bağının aksine, Si - H bağ daha iyonik bir karaktere sahiptir.
· Si-E ve CE bağlarının enerjisi.
Si-Si bağının düşük mukavemeti, homolog silan serisinin sınırlılığından kaynaklanmaktadır.
· Karbürler ve silisitler arasında, hem silisyum karbür hem de karbon silisit denebilecek carborundum SiC tarafından özel bir yer işgal edilmiştir. Karborundum, elmas benzeri yapısı nedeniyle yüksek bir erime noktasına sahiptir; sertliği elmasın yakınında. Kimyasal olarak, SiC çok kararlıdır.
· Kolloidal çözümler kavramı
Doğada ve teknolojide, dağınık sistemler genellikle bir maddenin bir başka maddenin içindeki parçacıklar olarak eşit şekilde dağıldığı bulunur.
Dağınık sistemlerde dağılmış fazın dağıldığı, dağılmış bir faz - ince bölünmüş bir madde ve bir dağılma ortamı - homojen bir madde vardır. Dispers sistemler arasında sıradan (gerçek) çözümler, kolloidal çözeltilerin yanı sıra süspansiyonlar ve emülsiyonlar bulunur. Birbirlerinden esas olarak parçacık boyutlarında, yani dağılma derecesinde (parçalanma) farklılık gösterirler.
1 nm'den küçük partikül büyüklüğü olan sistemler çözünen moleküllerinden veya iyonlarından oluşan gerçek çözümlerdir. Tek fazlı bir sistem olarak düşünülmelidir. 100 nm'den büyük partikül büyüklüğü olan sistemler kaba dağılmış sistemlerdir - süspansiyonlar ve emülsiyonlar.
Süspansiyonlar, dağınık fazın bir katı ve dağılma ortamının bir sıvı olduğu ve katının pratikte sıvı içinde çözünmez olduğu dağınık sistemlerdir.
Emülsiyonlar, hem dağılmış fazın hem de dağılma ortamının karşılıklı olarak karışamayan sıvılar olduğu dağıtılmış sistemlerdir. Bir emülsiyon örneği, içinde küçük yağ toplarının bir sıvıda yüzdüğü süttür.
Süspansiyonlar ve emülsiyonlar iki fazlı sistemlerdir.
Kolloidal çözeltiler, bir dağılım ortamı ve dağılmış bir fazdan oluşan yüksek oranda dağılmış iki fazlı sistemlerdir ve ikinci parçacıkların doğrusal boyutları, 1 ila 100 nm aralığındadır. Görülebileceği gibi, parçacık boyutuna göre kolloidal çözeltiler, gerçek çözeltiler ile süspansiyonlar ve emülsiyonlar arasında orta düzeydedir. Kolloidal parçacıklar genellikle çok sayıda molekül veya iyondan oluşur.
Kolloidal çözeltilere ayrıca sol denir. Dağılım ve yoğuşma yöntemleriyle elde edilirler. Dispersiyon en sık özel “kolloid değirmenleri” kullanılarak gerçekleştirilir. Yoğuşma yönteminde, kolloidal parçacıklar atomları veya molekülleri agrega halinde birleştirerek oluşturulur. Birçok kimyasal reaksiyon sırasında, yoğuşma meydana gelir ve yüksek oranda dağılmış sistemler oluşur (çökeltme, hidroliz, yükseltgenme-indirgenme reaksiyonları, vb.).
1 nm - nanometre (1 nm = 10-9 m).
Gerçek çözümlerin aksine, sind, Tyndall etkisi, yani ışığın koloidal parçacıklar tarafından saçılmasıyla karakterize edilir. Bir ışık konisi bir ışık huzmesi içinden göründüğünde, karanlık bir odada belirir. 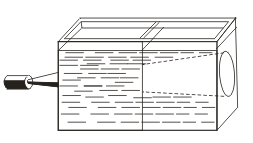 . Böylece bu çözümün kolloidal veya doğru olup olmadığını anlayabilirsiniz.
. Böylece bu çözümün kolloidal veya doğru olup olmadığını anlayabilirsiniz.
Solların önemli özelliklerinden biri, parçacıklarının aynı işaretten elektrik yüküne sahip olmalarıdır. Bundan dolayı daha büyük partiküller halinde birleşmezler ve çökelmezler. Aynı zamanda, bazı solların parçacıkları, örneğin metaller, sülfitler, silisik ve kalay asitleri negatif bir yüke sahipken, diğerleri, örneğin hidroksitler, metal oksitler pozitif bir yüke sahiptir. Bir yükün görünümü iyonların çözeltiden kolloidal parçacıklar tarafından adsorpsiyonu ile açıklanmaktadır.
Bir solu çökeltmek için parçacıklarının daha büyük topaklara birleşmesi gerekir. Parçacıkların daha büyük topaklara birleştirilmesine pıhtılaşma, yerçekiminin etkisi altında tortulaşma tortulaşma denir.
Genellikle pıhtılaşma, solta ilave edilirken meydana gelir: 1) elektrolit, 2) parçacıkları zıt bir yüke sahip olan bir başka sol ve 3) ısıtıldığında.
