Çözünmüş sülfürik asidin gücünü karakterize eden eşit reaksiyonlar. Disiplinlerden sınav yemeklerinin listesi
Depoya kurşun beyazı (PbCO3) giren zeytin farbları ile yazılmış eski resimlerin yüzeyinin karartılması, atmosferde dolaşan suyun varlığı ile siyah kurşun (II) sülfür çözeltileriyle bağlantılıdır. Yüzeyi su ile peroksit ile boyarsanız, kurşun (II) sülfat çözeltisinin beyaz bir renkle reaksiyonu gözlenir:
PbS + 4H2O2 = PbSO4 + 4H2O.
Bu şekilde, zeytin farblarıyla boyanmış kararmış eski tabloları restore ediyorlar.
Zastosuvannya ekşi ve sirki
Ekşiliğin durgunluk alanları küçük olan 61 ile temsil edilir.
enfeksiyon için vicoristovuvati yogo'ya izin ver içme suyu endüstriyel atık suların o kaynağı; tıpta dezenfektan zasib olarak. Ozon muzaffer ve yak vidbіlyuyuchiy zasib.
Sülfürik asit üretimi, syrnikiv'in hazırlanması, bengal yangınları, güçlü devletin shkidniklerine karşı mücadele ve bu tür rahatsızlıkların yüceltilmesi için Syrka vicorist. Serka, sakız, barniki ve pigmentler, parça lifler, luminoforlar ve diğerlerinin üretimi sırasında zastosuvannya'yı bilir.
mal. 61. Öpüşme

En küçük elementlerden olan dışkıdaki ekşi için en karakteristik oksidasyon aşaması -2'dir, kükürt, selenyum ve teluryum atomları -2, +2, +4 ve +6 oksidasyon aşamasını gösterir.
Ekşi ve kükürt gücünün oksitleri, metaller, su ve diğer metal olmayanlarla reaksiyonlarında kendini gösterir.
Soruşturma ve görev
1. Asitli formülleri potasyum, kalsiyum ve alüminyum ile katlayın. Cilt elementinin oksidasyon aşamasını belirtin ve hastalığı adlandırın.
2. Alüminyum sülfürde sirka'nın Razrahuyte kütle oranı.
3. "Kysen" adı - oksijenyum "asit üreten" anlamına gelir. bir yere yaz kimyasal formüller elementi bırakacağınız depoya asitleri getirin. Asitleri adlandırın.
4. Ekşi ve ekşinin ne tür alotropik modifikasyonlarını biliyor musunuz? Neden birer birer kokuyorlar?
5. Bir insanın soluduğu kisen, kandaki hemoglobinden yükselir. 1 g ağırlığındaki hemoglobinin hacmi (n.a.) 1.35 cm3 olduğu görülmektedir. 3. Sağlıklı insanların kanındaki hemoglobin miktarı 140 g/dm3'tür. Toplam kan hacmi 6 dm3'tür. Razrahuyte khіmіchnu ekşi değil, insanların kanında opinetytsya değilsin.
6. Ayrı sirvodnyu hacmi (n.a.) 8.96 dm olması durumunda alınan, sirkovodnoy asidinin kütle fraksiyonunu belirleyin. 3, 500 g kütleli suda.
7. Saldırgan şemalardaki katsayıları genişletin oksit belirgin reaksiyonlar:
a) H2S + Cl2 + H20 → H2S04 + HCl; b) H2S + Br2 → S + HBr;
c) H2 S + O2 → S + H2 O.
saat cilt reaksiyonu oksitleyici bir maddeyi gösterir.
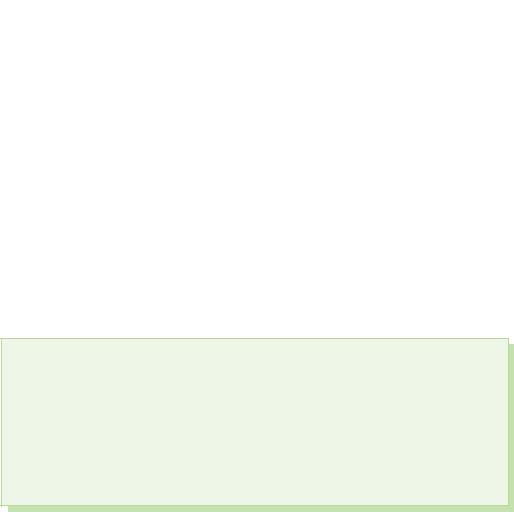
§ 39. Kisnevmisnі spoluki sirka
saat ekşi sirka ile z'ednannyah oksidasyon aşamasını gösterir+4 ve +6.
Sirka(IV) oksit. Sülfürik asit
Oksit (IV) - SO2 (sirşit gazı) - hava sıcakken ortaya çıkan keskin bir karakteristik kokuya sahip namlusuz bir gazdır:
S + O2 = tSO2.

Sirka'nın en yeni zastosuvanlarından biri, yanması gereken can sirkasının fümigasyonuna bağlanmıştı. Antik tarihçi Pliny Sr.'nin MÖ 1. yüzyılda yazdığı gibi. e., "Sirka ocağının kokuları her türlü tılsımlardan korur ve tüm kötü ruhları uzaklaştırır." Sülfür oksitin (IV) dezenfektanları ve bakterisidal güçleri dolaylı ve bulaşıcıdır. Sebze, meyve ve meyvelerin işlenmesi sırasında çürümelerini önlemek için kükürt gazı stoklanır.
Su yakınında sülfürik gaz salınımı (1 hacim su başına 40 hacme kadar SO2) - leke bırakmaz, çift bazlı sülfürik asit yalnızca perakende satışta mevcut olduğu için:
SO2 + H2 O H2 SO3.
Kükürtlü asit zayıf bir asittir, sulu çözeltilerde genellikle hidrosülfit ve sülfit iyonlarının çözeltileri ile aşamalar halinde ayrışır:
H+ + HSO – , | – H+ + SO2–. |
||||
Kükürtlü asit, asitler için kükürtlü kimyasal baskınlık sergiler: bazik oksitler, bazlar ile etkileşime girer, diğer asitlerin tuzlarının değişimi ile reaksiyona girer, zokrema, tuzlardan viskoz zayıf karbonik asit:
Na2CO3+H2SO3=Na2SO3+H2O+CO2.
Sirka(VI) oksit
Oksit (VI), yaklaşık 500 C sıcaklıkta bir katalizör varlığında oksitleyici oksite (IV) sahiptir:
t, kedi.
2SO + O −−−−−← 2SO .
2 2 ←−−−−−3
En büyük akıllar için, kükürt oksit (VI) SO3, 17 ° C'nin altındaki sıcaklıklarda beyaz kristal konuşmaya dönüşen çubuksuz bir asittir. Ce, su ile etkileşerek güçlü sülfürik asit oluşturan tipik bir asit oksittir:
SO3 + H2O = H2SO4.
sirkanik asit
Sülfürik asit molekülünün grafik formülü ve modeli küçük 62'ye işaret ediyor.
mal. 62. Sülfürik asit molekülünün grafik formülü ve modeli
saat üreme çemberleri sülfürik asitє güçlü elektrolit,
і її ayrışma aşağıdaki gibi ifade edilir:
H2 SO4 → 2Н+ + SO4 2– .
Sülfürik asidin fiziksel gücü
Sülfürik asit - vazo (kuvvet 1.83 g/cm3), yağlı, kokusuz, kokusuz. Bir çeşit su şişesinde suya gidecek.
H2S04'ü 1 mol kimyasal miktara dağıtma işlemine, kimyasal reaksiyonlardaki termal etkilerin büyüklükleriyle karşılaştırılabilecek 92 kJ ısı eşlik eder. Sülfürik asidin su ile etkileşiminde büyük miktarda sıcaklık görülmesi, hidratasyon tipi H2 SO4 n H2 O olan iki nehir arasında mineral filizlerinin kurulduğunun kanıtıdır.
Örneğin, H2S04H2O; H2SO4 2H2O; H2 SO4 3H2 O vb.
asitler ve hidratlar, örneğin gazları kurutmak için güçlü bir su itici ajan olarak viskoziteye її izin vermez.
Sumishi'nin suda değişen sülfürik asit ile serpilmesine püskürtme eşlik edebilir. Neyi hatırla ekşi için su dökemezsin
Kesintisiz karıştırma ile kaydırılan Lotі, suya asit dökün.
kimyasal güç sülfürik asit. sülfati
Sülfat. Çözünmüş sülfürik asit baskın asitlerin tüm karakteristik özelliklerini ortaya çıkarır: bir güne kadar aktif olması gereken metallerle etkileşim; bazik ve amfoterik oksitlerle, bazlar ve tuzlarla. Kimin tuzları yerleşmiş: orta - sülfat, örneğin K 2 SO 4 i ekşi -
hidrosülfat, örneğin KНSO4.
Sülfatların ve hidrosülfatların çoğu, bunlar açısından zengin su ile iyi ayırt edilir. kristal. Deyakі sülfürik asidin kristaloid tuzları ve vitriol olarak adlandırılır: midny vitriol CuSO4 ∙5H2 O, nazal vitriol FeSO4 ∙7H2 O ve içinde.
Su güllerinde sülfürik asit ve її tuzlarının asidik tezahürü için baryum tuzları kullanılır:
Ba(NO3)2 + Na2S04 = BaSO4 ↓ + 2NaNO3;
Ba2+ + SO4 2– = BaSO4 ↓.
Reaksiyonun bir sonucu olarak, beyaz bir baryum sülfat çökeltisi oluşur.
Laboratuvar sertifikası 6
Seyreltilmiş sülfürik asidin kimyasal güçlerinin takibi
Görünürde beş test tüpü bulundurun: metal (okuyucunun seçimine göre çinko veya diğer metal), bazik oksit, sodyum hidroksit, sodyum karbonat, baryum klorür. Sodyum hidroksit miktarına birkaç damla fenolftalein ekleyin ve dozu değiştirin. Deri test tüpüne 1-2 cm3 seyreltilmiş sülfürik asit ekleyin. (Dikkat! Bazik oksit ile reaksiyon doğru bir şekilde devam ederse, aşırı ısınmayı yarım alkol banyosu ile hızlandırın.)
Ne koruyorsun? Kimyasal reaksiyonların taşması hakkında söylenecek işaretler nelerdir? Moleküler ve iyonik formda eşit kimyasal reaksiyonları depolamak. Nasıl bir tepki verdiniz? Çözünmüş sülfürik asidin kimyasal gücü hakkında visnovok toplamak.
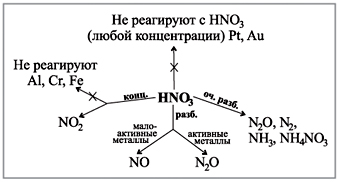
konsantre sülfürik asitє güçlü oksitleyici ajan, daha az seyreltilmiş. Konsantre sülfürik asit ile etkileşime girdiğinde
metallerde su görülmez.
W suyun yanında duran metaller (kırım altın ve platin), reaksiyon kükürt oksit (IV) ile ilerler. 2 :
Cu + 2H2 SO4(kons) = t CuSO4 + SO2 + 2H2 O.
Suya kadar aktivite aralığında olan metallerle reaksiyonda, konsantre sülfürik asit, kükürt okside (IV) SO2 indirgenebilir, kükürt S veya su H2 S, metalin aktivitesinde biriktirilir ve zihin sırasında zihin. reaksiyon. Örneğin:
4Zn + 5H2 SO4(kinetler) = t 4ZnSO4 + H2 S+ 4H2 O.
Tahmin edelim, soğuk, alüminyum ve diğer deakonlar, en büyük zihinler için konsantre sülfürik asitten geçiyor.
Sülfürik asit, basit konuşma metal olmayan maddelerle, örneğin kükürt ile etkileşim halinde konsantre edilir:
S + 2H2 SO4 = t 3SO2 + 2H2 O.
Oksitleyici zengin katlanabilir organik filizler, sülfürik asit kağıt, kumaş, tahta, giysi ve shkir yakar. Bu nedenle, konsantre sülfürik asit ile dikkatli olun.
Sülfürik asit, diğer uçucu asitleri ve bunların tuzlarını uzaklaştırmak için konsantre edilir. Örneğin:
NaCl (tv) + H2S04 (kons.) = t NaHSO4 + HCl.
Belarus Cumhuriyeti'nde Suriye asidi BAT "Gomel Chemical Plant", BAT "Grodno Azot" tarafından titreştirilir.
Sülfürik asidin durgunluk alanları
Kokular küçük olanı sunar 63.
mal. 63. Sülfürik asidin durgunluğu
Sülfürik asit H2 SO4, kokusuz, yağlı, yağlı bir anavatandır.
Sülfürik asit, metallerle etkileşim içinde çözülür, böylece bir güne kadar aktif olabilir; metal oksitler ile; temel bilgilerle; tuzlardan.
Konsantre sülfürik asidin metallerle etkileşimi ile su görülmez.
Su güllerinde sülfürik asit ve її tuzlarının asidik tezahürü için baryum tuzları kullanılır.
Soruşturma ve görev
1. Oksitleriniz ve sisnik asitleriniz için formülleri yazın. İçlerindeki sirka atomlarının oksidasyon derecesini belirtin.
2. Vznachete masu s_rki, scho ekşide yandı, babada yakshcho 29.69 kJ ısı gördü. Kükürt oksitin (VI) yerleştiği kimyasal miktarı nedir? Sıcak havanın reaksiyonunun termal etkisi 296.9 kJ/mol olur.
3. Koristuyuchis sofra rozchinnosti tuzları, sudaki asitler ve bazlar, tuzlarla seyreltilmiş sülfürik asidi 2 eşit reaksiyonda depolar. bir maç yaz
v moleküler ve iyonik görünüm.
4. Razrahuyte, 200 g kütleli baryum nitrat bazında sülfürik asit ile seyreltildiğinde çözünen baryum sülfatın kütlesi ve kimyasal miktarı, Ba'nın kütle fraksiyonu (NO 3)2'nin maliyeti %10'dur.
5. Konsantre sülfürik asidin kimyasal gücünü karakterize eden eşit reaksiyonlar paragrafının metninden kopyalayın. Sirka'daki atomların oksidasyon derecesini її spolukah olarak belirleyin. Cilt reaksiyonu oksitleyici bir madde gösterir.
6. Herhangi bir hacimde konsantre sülfürik asit (= 1.83 g/cm2) 3) H2 SO4 kütle fraksiyonu ile orta kütle 6.4 r'nin gerekli dağılımının %98'i?
7. Başlangıçlı oksidatif-oksidatif reaksiyonların eşitleme şemaları için katsayıları verin:
a) HBr + H2SO4 → Br2 + SO2 + H2O; b) CaSO4 → CaO + SO2 + O2;
c) K2S + HClO → K2SO4 + HCl.
Cilt reaksiyonu oksitleyici bir madde gösterir.
§ 40. Bir kimyasal reaksiyon ürününün çıktısını anlama
Chemіchnі rіvnyannya, skladі z urakhuvannymi mіchіchnі mіchіchnі mаsi rіchіvіn, razrahunki'ye izin ver, zоkrema masu sayımı, сhіmіchnu kіlkіst ürün. Pratikte birçok reaksiyon tersine çevrilir, buharlaşma, ayrılma veya yan ürünlerin benimsenmesi sonucu konuşmanın bir kısmı kullanılır. Bu ürün için reaksiyon daha az, daha düşük olmalıdır, reaksiyon eşit olana kadar gerçekleşmesi daha az olasıdır. Bu şekilde, kütlenin eşit reaksiyonu için teorik olarak risksiz olarak kabul edilirse veya ürünün kimyasal miktarı %100 ise, gerçek süreçte ürünün çıktısı %100'den az olacaktır.
Reaksiyonun ürününde Yunan alfabesinin harfi (tsya) ile belirtilir ve tek chi vіdsotkah'ın bölümlerinde görünür.
Ürüne aşırı kimyasal reaksiyon - üründen fiilen çıkarılan ağırlık miktarına (hacim, kimyasal miktar) eşit reaksiyon için hesaplanan ürünün ağırlığına (obsyagu, kimyasal miktar) eklenen değer:
Tüm bu varyasyonlarda, kimyasal reaksiyon ürününün çıktısı için aynı değeri bulacaksınız. Örneğin, her zamanki gibi, kükürt oksidin (IV) oksidasyonunun kükürt okside (VI) reaksiyonu için
2SO2 + O2 2SO3
%80 (veya 0.8) olduğunda, tse, ağırlıkça kükürt(IV) oksit 64 g (hacim 22.4 dm3, kimyasal miktar 1 mol) hacim 22.4 dm3, kimyasal miktar 1 mol) ve kütle 80 g ∙ 0.8 = 64 anlamına gelir g (hacim 17.9 dm3, kimyasal miktar
Malların gerçek üretim sürecindeki çıktısının büyüklüğünden, povnotі perevorennya syrovini, vitratah energії hakkında vysnovok'a acele edin, ek operasyonların tanıtılmasından sonra.
Rozrahunkiv'in "reaksiyonun ürünü dışında" kavramından birkaç örneğine göz atalım.
popo 1. 48 g kütleli sirka'nın haşlanması sonucu, 28.6 dm3 hacimde (n.a.) sirka(IV) oksit dışarı alındı. Reaksiyon ürününün son kullanma tarihini belirleyin.
m(S) = 48 gr | 1. Sirka'nın önemli ölçüde kimyasal miktarı, |
||||
V uygulama (SO2) = 28,6 dm3 | tepki gösterdi: | ||||
Hanım) | |||||
(SO2)=? | n(S) | ||||
HANIM) | 32 g/mol |
||||
2. Sülfür oksit (IV) ile nispeten eşit reaksiyon: S + O2 = SO2.
3. Kükürt oksitin (IV) teorik miktarını biliyoruz:
1 mol S - 1 mol S02;
1.5 mol S-1.5 mol SO2.
Bir kimyasal reaksiyonun ürününü anlamak |
4. Kükürt(IV) oksidin teorik değerini biliyoruz:
V teorisi (SO2) \u003d n teorisi (SO2) V m \u003d 1.5 mol 22.4 mol / dm3 \u003d 33,6 dm3.
5. Reaksiyon ürününden Razrahuymo:
Vidpovіd: ilaç reaksiyonuna karşı% 85 dorіvnyuє.
Örnek 2. 8.96 dm3 hacme (n.a.) sahip oksidi (IV) almak için canlılık için gerekli olan pirit FeS2 kütlesini seçin, böylece reaksiyon ürününün çıktısı %90 olur.
V(SO2) = 8,96 dm3 | 1. Kükürt(IV) oksidin önemli ölçüde teorik değeri: |
|||||||||||
(SO2) = %90 | V pratik | V pratik | ||||||||||
m (FeS2) =? | Yıldızlar V teorisi = | |||||||||||
V teorisi | ||||||||||||
V teor (SO2) = | V pratik (SO 2) | 8,96 mm3 | 9,56 dm3. |
||||||||||
2. Kükürt oksidin (IV) teorik kimyasal miktarını biliyoruz: |
||||||||||||
n teorisi(SO 2) | V teoremi(SO 2) | 9,56 dm3 | ||||||||||
22,4 dm3/mol |
||||||||||||
3. Vipal için gerekli olan kükürt(IV) oksit ve piritin kimyasal miktarı reaksiyonuna nispeten eşittir:
x mol 0.4 mol
4FeS2 + 11O2 = 8SO2 + 2Fe2 O3, 4 mol 8 mol
x = 0.2 mol.
3. Önemli ölçüde vipal vermek için gerekli olan masu pirit: m (FeS2) = 0,2 mol 120 g/mol = 24 g.
Gösterge: kükürt oksit (IV) bulundurmak için 24 g kütleli pirit gereklidir.

Ürüne aşırı kimyasal reaksiyon - eşit reaksiyon için hesaplanan, üründen fiilen çıkarılan ağırlık miktarını (obsyagu, kimyasal miktar) ürünün kütlesine (obsyagu, kimyasal miktar) artıran değer. Bir ve birkaç yüz parça halinde görünür.
Soruşturma ve görev
1. Reaksiyon ürününün pratik sonucu neden eşit reaksiyonun maliyetinden teorik olarak daha az ses çıkarsın?
2. Sirka'nın 1 mol'lük bir sulu kimyasal hesapla reaksiyonunda, sirkovodny 0.85 mol'lük bir kimyasal hesapla çözüldü. Reaksiyon ürününün son kullanma tarihini belirleyin.
3. Sonuç olarak, baryum klorürün sülfürik asitten 200 g kütle ile etkileşimi, 100 g kütleli baryum sülfat ile çöktürüldü.
4. Kükürt yakıldığında çözünmüş olan ve reaksiyon ürününün %75 daha sağlıklı olduğu anlamına gelen 64 g ağırlığındaki kükürt(IV) oksidin kimyasal miktarının hacmini (n.a.) belirleyin.
5. Yanmış sirka kütlesini hesaplayın ve sirka (IV) oksiti ihmal edin, hacim (n.a.) 89.6 dm3 3 teorik olarak mümkün olanın %80'i olmak.
6. Görünüşe göre, scho, kükürt oksidinin (IV) oksidasyonu sırasında çıkarılan kükürt oksidine (VI) sızdı,
daha pahalı %85. Reaksiyona giren ve böylece kükürt(VI) oksidi hacimce (n.a.) uzaklaştıran kükürt(IV) oksidin kütlesini, hacmini (n.a.) ve kimyasal miktarını belirleyin 2.24 dm3.
7. Kütlesi 3.2 g olan midi ve 192 g kütlesi olan sülfürik asidin dağılımı durumunda alınan bileşimdeki tuzun kütle fraksiyonunu seçin, böylece reaksiyon ürününün verimi % 85 olur. .
§ 41. Azot ve fosfor
Periyodik sistemin VA grubunda azot N ve fosfor P karıştırılır. Mish'yak As, antimon Sb ve bizmut Bi periyodik sistem grubundan önce görülebilir. Azot ve fosfor metal değildir, mish'yak ve antimon napіvmetalіv'a getirilir ve vismut metallere yalan söyler.
Oksidasyon aşaması olan Budova atomları
VA grubunun elementlerinin atomlarının her biri dış enerji seviyesinde 5 elektrona sahiptir, dış enerji seviyelerinin elektronik konfigürasyonu ns 2 np 3 örneğin: nitrojen - 2s 2 2p 3 fosfor - 3s 2 3p 3.
7N↓ | 15p↓ |
Yönetici.
- Neden viklikana böyle bir değişiklik? Eldiven kapları için krom sumishi'nin yaşamı hangi dikromat egemenliğine dayanmaktadır?
- Bir test tüpüne 5-6 damla potasyum dikromat ve 3 damla sülfürik asit dökün. 2 damla potasyum iyodür ekleyin ve test tüpünü 10 damla su ile seyreltin. Bir kısmını pipetle başka bir deney tüpüne aktarın ve bir damla nişasta ekleyin. Nişasta için ne değişti? Niye ya? OVR ve zvnyati'yi elektronik iyonik yöntemle katlama.
- 15 R elementinin önemli özelliği. Fosforda allotropik modifikasyonların baskınlığı. Fosforun basit ve kıvrımlı konuşmalarla etkileşimi.
Farmasötiklerde, cıva oksit (II), hazırlık için daha düşük bir antiseptik zasib olarak zastosovuetsya'dır. göz merhemleri, yak, ticari bir cıva tuzu üzerinde seyreltilmiş bir sodyum hidroksit çözeltisine sahiptir.Tüm işlemler karanlıkta gerçekleştirilir.
Yönetici.
1. Cıva oksit (II) için uygun bir reaksiyon yazın. Karanlıkta işlem yapmanın neden gerekli olduğunu açıklayın?
3. Kimyanın temel yasaları.
Tıpta çinko içeren Vikoristannya, yoga tart, antiseptik etkiye dayanmaktadır. % 0.25 çinko sülfat, % 2 borik asit ile birlikte oftalmik damlaların hazırlanmasında etkilidir.
Yönetici.
- 100 ml'lik bir hacimde (ρ = 1.02 g/ml) %0.25 çinko sülfat çözeltisi hazırlayın.
- Bir dönüşüm oluşturun
Zn→ZnCl 2 →ZnSO 4 →Zn(NO 3) 2 →Zn(OH) 2 →Na 2 →NaCl
- Kovalent bağ, randevu, görüyorsunuz, aydınlanma mekanizması, güç. değerlik. Oksidasyon aşaması.
· Eczacı, salin preparatının viskozitesini permanganatometri yöntemiyle kontrol etmelidir.
Yönetici.
1. Elektronik-iyonik yöntemi kullanarak benzer bir reaksiyon ve karşılaştırma yazın.
2. Reaksiyon için gerekli olan %0.5 (ρ = 1.004 g/ml) sodyum hidroksit miktarını 0,1 M miktar klorür (III) miktarı 20 ml olarak hesaplayınız.
3. Periyodik yasa periyodik sistem hafif vchennya'da atomun ömrü hakkında.
· Zalіzo, vіdnovlene, scho stosovuєtsya vnutrіshno yak protianemіchne zasіb, maє ama vilno, midi, vugіllya, silisik asit, mish'yaku gibi sülfürlüdür.
Yönetici.
1. Evin girişini güvence altına almak için bir yol isteyin. Obguruntuvati vіdpovіd.
3. Ana kimyasal bağ türü. Doğa kimyasal bir bağlantı kuracak.
· Permanganat є otrastami organizması için, їkh zneshkodzhennya z vokoristannyam %3 sulu H 2 Pro 2 asitleştirilmiş oküler asit çözeltisi harcar.
Yönetici.
1. Benzer bir yanıt yazın. Elektron iyon yöntemiyle reaksiyonu araştırın
- Oksidi, atama, sınıflandırma, isimlendirme, yetki ve bulundurma yöntemleri.
· Tükürüğün hazırlanmasında konuşmanın analizi, Fe2+'nın Fe3+'ya oksitlenme kabiliyetine dayanan permanganatometri yöntemiyle gerçekleştirilir. Solunan havanın alt kısmı, ısıtma sırasında ve soğutmadan sonra sülfürik asitten ayrılır, 0.1 N potasyum permanganat ile titre edilir.
Yönetici.
1. Tanımın temeli olan eşit reaksiyonları yazın.
2. 200 ml 0.1 N KMnO 4 hazırlayın (eşdeğerlik faktörü reaksiyona bağlıdır).
3. Asitlik, isimlendirme, sınıflandırma, isimlendirme, yetki, sahip olma yöntemleri.
· Farmakope ilaç nitratı bir sonraki rütbe tarafından çıkarıldı: bakır-gümüş alaşımı nitrik asitten ayrılır, nitratın evlerden uzaklaştırılması için saflaştırılır, hidroklorik asit ile çökeltilir. Viishov olan kuşatma, ekşi ortamda çinko ile restore edilir ve evlerde buruşmuş, zvilnene, nitrik asitte yeniden püskürtülür.
Yönetici.
- rіvnyannya іdpovіdnyh reaksiyonlarını yazın.
- Vikonaty, klorürler, iyodürler, potasyum bromürlerin müstahzarlarının doğruluğunun doğrulanmasının altında yatan çeşitli nitrat srіbla ile Cl-, Br-, J anioni'ye tepki verir.
- Kanıtlayın, atayın, sınıflandırın, isimlendirme, yetki, sahiplik yöntemleri.
9. Nitrat srіbla zastosovuєtsya zvnіshno erozіyah, vyrazkah, viglyadі 2.5 ve% 10'da gostroma konjonktivit su tedarik etmek.
Yönetici.
- Hacim 50 ml (ρ= 1.015 g/ml) olan %2 AgNO3 solüsyonu hazırlayın. Bu rozchin ile ilgilenmek için ne tür akıllara ihtiyaç var?
- Bir dönüşüm oluşturun
Ag→AgNO 3 →AgCl→ AgNO 3 →Ag
- Tuz, adlandırma, sınıflandırma, isimlendirme, yetki, bulundurma yöntemleri.
· Eczacı, farmakope ilacı baryum sülfatın tanımlamasını yapmalıdır.
Yönetici.
1. Tıpta baryum sülfat yöntemi nedir? Tanımlama reaksiyonlarından önce neden baryum sülfat sodyum karbonat ile alaşımlıdır? Vidpovіd eşit reaksiyonlarla onaylandı.
2. Viconati reaksiyonları ve BaSO4, CaSO4, Na2SO4 tuzlarının tanımlanması.
3. Karmaşık spoluky, atama, A. Werner için budov, kimyasal bağın doğası, sınıflandırma, isimlendirme, ayrışma. Tıpta ve kimyasal analizde Zastosuvannya kompleksi spoluk.
· Eczacı, yoğun amonyak ile çalışırken güvenlik ekipmanında büyük bir hasara izin verdi - işi lekeli gardıropta çekişi artırmadan gerçekleştirdi.
Yönetici.
- Ek güvenlik ekipmanı olmadan amonyak konsantrasyonu ile çalışırken kullanılabilecek sonuçlar nelerdir? Yaku pershu, zehirli amonyak buharları durumunda başvurmak için tıbbi yardım gereklidir.
- Böyle bir dönüşüm yaratın.
(NH 4) 3 PO 4 →NH 3 →NH 4 NO 2 →N 2 →NO→ NO 2 →HNO 3 →Hg(NO 3) 2 →NO 2
Moleküler ve iyonik görünüm ve OVR için reaksiyon denklemini yazın - elektron dengesi yöntemiyle bakın.
- Kimyasal kinetik. Kimyasal reaksiyonun hızı. Çeşitli faktörlerin kimyasal reaksiyonların hızı üzerindeki etkisi.
· Zі spoluk nitrojen tıpta su, tuz, amonyum, oksit dinitrojen ve sodyum nitritte zastosovuyutsya amonyak.
Yönetici.
- Nitrojene muzaffer verme yöntemi nedir? Bu konuşmaların formüllerini ve ana güçleri karakterize eden eşit tepkileri yazın.
- Sodyum nitratın potasyum permanganat ile asit ortamdaki eşit reaksiyonunu yazın. nap_reactions yöntemiyle reaksiyonu araştırın
- Geri dönüşü olmayan ve kurt adamlar kimyasal reaksiyonlar. Kimyasal kıskanç. Eşit sistemler için kütle yasası. Öz sermaye sabiti. Le Chatelier ilkesi.
· Eczacı, sodyum sülfat, sodyum klorür, sodyum bikarbonat tuzlarının tanımlamasını yapmalıdır.
Yönetici.
- Vikonaty, SO 4 2-, Cl-, HCO 3- iyonlarına tepki vermez.
- Razrahuvati, skіlki gram_v kristallohidrat Na 2 SO 4 10H 2 O, eczacının 500 g kütleli suda demlenmesi, Na 2 SO 4'ün% 5'ini alması gerekir mi?
- Oksit-su reaksiyonları. Oksidasyonu teşvik eden reaksiyonların elektronik teorisinin ana hükümleri. En önemli oksitleyiciler ve kılavuzlar. Elektronik denge yöntemi ve iyon-elektronik yöntem ile Zrivnyannya oksit-su reaksiyonları.
Sülfürik asidin potasyum gücü, vücuda yabancı ilaçlar (ksenobiyotikler) açısından zengin görünmektedir - tıbbi müstahzarlar bazı küçük konuşmaların çözümleriyle bu metabolitler - vücuttan kolayca atılan konjugatlar.
Yönetici.
- Sülfürik asidin potasyum gücünü farklı bir şekilde, reaktif masada temsili olarak alın. rіvnyannya іdpovіdnyh reaksiyonlarını yazın.
- Böyle hızlı iyonik eşitliklerle ifade edilen reaksiyonların moleküler eşitliklerini toplayın:
S 2- + H 2 S → 2HS -
S 2- + 2H + → H 2 S
HS - + OH - → S 2– + H 2 O
· Dispersiyon sistemleri, tanımı, sınıflandırılması. Süspansiyonlar, aerosoller, emülsiyonlar. Tıpta ve eczacılıkta kaba dağılımlı sistemlerin seçimi.
Eczacının %5 sülfürik asit alması gerekir.
Yönetici.
- Asit konsantrasyonunda SO 4 2 anyonunun oksitleyici özelliğinin birikimi nedir? Çözünmüş ve konsantre asidin gücünü karakterize eden reaksiyonların denklemini yazın.
- 50 ml sülfürik asidi %30 H2S04 kütle fraksiyonu ile yıkayarak %5 sülfürik asit çözeltisi hazırlayın.
- Koloidni razchini, sınıflandırma, atama, moleküler kinetik o optik güç, otrimannya. Sütunların kararlılığı. pıhtılaşma. Peptizasyon. Budova misel. Diyaliz.
· Amino asitlerin deposuna giren Sirka, organizmalarda oksitlenir. Endojen sülfürik asit durumunda, eksojen sporlarda yer alır - fenol, kresol ve indol.
Yönetici.
- Sülfürik asidin gücünü tanımlayın ve asitlerle çalışma kurallarını geçersiz kılın.
- Çözmek için, kütle fraksiyonu %25 H2SO4 ve kalınlığı 1.18 g / ml olan hangi hacimde sülfürik asit, potasyum hidroksit ile nötralizasyon için, 50 ml'lik bir hacimde, %12 KOH kütle fraksiyonu ile alınmalıdır. ve 1.1 g/ml'lik bir kalınlık
- Farklılaşma sürecinin gerçek farkı, tanımı, temel anlayışı, özü. Difüzyon. Osmoz. Ozmotik mengene.
· Çok fazla vugillyanın olduğu endüstriyel alanlarda, asidik odunlar sıklıkla dökülür.
Yönetici.
- nerelisin kimyasal depo tsikh bölgelerine yakın asit dosch? Nasıl şarap yaparsın? Eşit tepkiler yazın.
- İlerleyen tuzların hidrolizine eşit moleküler ve kısa vadeli iyonları katlayın:
K 2 S, Na 2 SO 4, Na 2 SO 3, Al 2 (SO 4) 3, Cr 2 S 3
Çevrede gezinme doğada yerleşiktir büyük sayılar pro sirchanih maden sularında rahunok biyokimyasal süreçler ve intikam için.
Yönetici.
- Günün gücü.
- Bir dönüşüm oluşturun:
H 2 S → SO 2 → H 2 SO 3 → NaHSO 3 → Na 2 SO 3
Moleküler ve iyonik görünüm için reaksiyonların denklemini yazın.
- Asitlerin, bazların, tuzların, suyun ayrışması. Rozchinah'ta asit-baz eşittir. İyonlu dobutok su, pH belirleyici.
· Sirka є sirka'nın resmi tıbbi hazırlığı, (Sulfur praecipitafum) ile kaplanmıştır.
Yönetici.
- Serbest sirka'nın gücünü ve sirka'nın alotropik modifikasyonlarını tanımlayın.
- Bir dönüşüm oluşturun:
Elektronik denge yöntemi ile Zrivnyati reaksiyonları.
- Hidroliz. Hidroliz işleminin özü. Farklı tuz türlerinin hidrolizi. Adım hidrolizi. Hidroliz aşamasında çeşitli faktörlerin akışı.
· Eczacı, %3 su peroksit çözeltisi tanımlama reaksiyonunu yürütür: 1 ml'ye kadar nihai çözelti, 1 ml seyreltilmiş sülfürik asit, 1 ml eter ve 0,5 ml potasyum dikromat ekleyin, sonuç olarak, eter, asit 6 varlığında mavi renge dönüşür.
Yönetici.
- Vikonaty reaksiyonu, vodny peroksiti tanımlar.
- Elektronik terazi yöntemiyle su peroksit ve terazinin eşit bir tanımını yazın.
- VII grubunun baş alt grubunun elemanlarının ve bunların yarısının karakteristik özelliği. Tıbbi biyolojik önemi halojenler.
· Kisen, GF'de farmasötik bir preparat ve açıklamalardır. Çeşitli asit açlığı türleri için inhalasyon için Yogo zastosovuyut.
20. Yönetici.
- Ortaya çıkan CO, 2, NO, NO2 evlerinin eşit reaksiyonlarını yazın.
- Asidi uzaklaştırmak için laboratuvar yönteminin temeli olan eşit reaksiyonları yazın. Elektron dengesi yöntemiyle reaksiyon indüksiyonu
- Klor, klorlu su, hidroklorik asit, klorür. Klor ve yogo spoluk'un fiziksel ve kimyasal gücü. Halojenlerin mediko-biyolojik önemi.
· Bir eczacı, sodyum klorür, sodyum bromür ve sodyum iyodür bazlı ilaçların geçerliliğini gözden geçirir.
Yönetici.
- Bu amaçlar için, eczacılık ve tıpta viskoz tuzlar kullanılır.
- Vikonaty, anyon Cl-, Br-, J-'ye tepki vermez.
- Ekşi klorun fiziksel ve kimyasal gücü. Otrimannya. Zastosuvannya.
· Farmasötik amaçlarla iyotun çıkarılmasının endüstriyel yöntemlerinden biri de sondaj sularından iyot elde etme işlemidir. Sondaj sularına yakın olan iyodür, şemaya göre oksitlenir:
NaJ + NaNO 2 + H 2 SO 4 → J 2 + Na 2 SO 4 + NO + H 2 O
22. Yönetici.
- İyot nasıl hazırlanır ve tıpta nasıl kullanılır.
- İyot takıntısının altında yatan reaksiyonu reaksiyon yöntemiyle araştırın.
- Kalkojenlerin kritik bir özelliği. Güç ekşi ve yogo yarısı. Ekşiliğin mediko-biyolojik önemi.
· Eczacı, sodyum, potasyum ve kalsiyum klorür preparatlarının doğruluğunu belirler.
Yönetici.
- Bu amaçlar için, farmasötik müstahzarlarda vicorists kullanılır.
- Vikonati reaksiyonları Bu tuzların tanımlanması.
- Su ile yarı ekşi. Suyun fiziksel ve kimyasal güçleri. Su peroksit, baskınlık, tıpta tıkanıklık. Organizmaların yaşamında suyun önemi.
· Zі spoluk halogenіv z, dezenfektan olarak tıbbın ilgisini çekmek için daha az hipoklorit ekşi.
Yönetici.
- Dezenfeksiyon günü hipokloritlerin hangi gücü üzerine kurulmuştur? rіvnyannya іdpovіdnyh reaksiyonlarını yazın.
- Razrahuvati, otrimannya 2 litre aktif klor için skіlki gramіv klor banyosu alınmalıdır.
- Yerden Sirka ve її. Ücretsiz sirka'nın alotropyası. Sirka, sirkovodnya, sirkovodnya asit ve її tuzlarının fiziksel ve kimyasal gücü.
· Kabuk suyunun asitliğinin yetersiz olması durumunda, içten seyreltilmiş klorohidrik asit reçete edilir.
Yönetici.
- Asitlerle çalışmak için genel kuralları listeleyin.
- Razrahuvat,% 36.5 skіlki ml - çeşitli (ρ = 1.19g / ml) hidroklorik asit ve 100 ml hazırlanması için alınması gerekir. %8.2 - oh (p=1.040 g/ml) asit.
- Kükürt, sülfürik asit, sülfürik asit oksitlerinin fiziksel ve kimyasal gücü. Sülfit. Sülfat. Güç, saplantı, zastosuvannya.
· Eczacılıkta standart boyutlardan biri, potasyum karbonatı %30 - oktik asitte dağıtmanın bir yolu olan %33 potasyum asetattır.
Yönetici.
1. Moleküler ve iyonik görünüm için reaksiyon denklemini yazın.
- V grubunun baş alt grubunun elementlerinin önemli özelliği. Serbest azotun baskınlığı. Organizmaların yaşamında azotun değeri.
· Güçlü bazlar ve zayıf asitler olan konuşmaların reçeteleri. GFH'nin stabilizatör olarak uygulanması için, 1 litre ürün başına 4 ml'ye 0,1 n sodyum hidroksit çözeltisi eklenir.
Yönetici.
- CH3COONa tuzunun hidroliz reaksiyonunun denklemini yazın.
- Razrahuvat, skilki gram NaOH'yi 500ml 0.1n boyutunda almak için aramak gerekir. Tüm tasarımları en son güvenlik teknolojisi için hazırlayın.
- amonyak. Tuz amonyum. güç. Tıp ve eczacılıkta Zastosuvannya.
· Eczacı reçete için bir merhem hazırlar: 1 gr potasyum karbonat ve 0,5 gr sodyum tetraborat 70 ml distile su içinde karıştırılır, 10 gr stearin 15 gr vazelin yağı ile alaşımlanır ve karıştırıldığında ince bir akımla ilave edilir. karbonat için ılık su ile. .
Yönetici.
- Hangi zmishuvannya'nın ardından ne tür konuşmalar yapılır? Ortası yerleşmiş gibi ve neden? Vidpovіd eşit reaksiyonlarla onaylandı.
- Robotlar için tekno-kimyasal vag hazırlanması. Tekno-kimyasal sitelerde 1 g potasyum karbonat alın.
- Oksit nitrojen. Nitröz asit ve її tuzları. Fiziksel ve kimyasal güç. Azotun mediko-biyolojik önemi
· Boş ağız ve boğazı durulamak için eczacının %0,05 potasyum permanganatı 200 ml hacimde hazırlaması gerekir.
Yönetici.
- Potasyum permanganat hangi yetkiye dayanarak yogo likuvalna diya'da köklenir? Yakі spoluky manganez zastosovuetsya içinde sevinçli amaçlar?
- 200 ml %0.05 KMnO4 (ρ= 0.9994 g/ml) sipariş etmek için ölçekleme gram KMnO 4 eklemek gerekir. Bu tasarımı hazırlama tekniğini gösterin.
- Budov molekülleri nitrik asit. Nitrik asit ve її tuzlarının fiziksel ve kimyasal gücü. Azot ve її spoluk'un mediko-biyolojik önemi.
· Farmasötiklerde, bir antiseptik zasib olarak etkili olan cıva oksit (II), ticari bir cıva (II) tuzu üzerinde sodyum hidroksitten ayrıştırılır.
Yönetici.
1. Cıva oksit (II) için uygun bir reaksiyon yazın. Neden reaksiyonların cücelerde yapılması gerekiyor?
3. Kimyanın temel yasaları.
K 2 Cr 2 O 7 + H 2 O 2 + H 2 SO 4 = K 2 SO 4 + H 2 CrO 6 + H 2 O
Cioma ile eriyen perkromik asit, H 2 CrO 6 mavi renktir. Mavi asit kontaminasyonu, H2O2 hazırlamanın etkinliğini doğrular.
Yönetici.
- Elektronik iyon yöntemiyle Zrivnyati tsyu reaksiyonu.
- Yakі spoluky krom oksidatif güç gösterir ve yakі - vodnovlyuvalnі?
- Fosfin, fosfor oksitler ve fosforik asitlerin baskınlığı, sahip oldukları. Fosforun mediko-biyolojik önemi
· Sumish magnezyum oksit (% 85) ve magnezyum peroksit (% 15) - mukozal-bağırsak bozukluklarında zastosovuyut olan "magnezyum peroksit" olarak bilinen bir ilaç.
Yönetici.
- Antiasit ve bakterisit ilacı açıklar. Vidpovіd eşit reaksiyonlarla onaylandı.
- Razrahuvat, bu ilacın 100 gramını hazırlamak için skilki gram MgO ve MgO 2 almanız gerekir. 10 g magnezyum oksit için tekno-kimyasal çağırın.
- Ana alt grubun IV grubunun elemanlarının karakteristik özelliği. Budova, Fiziksel güç kömürde alotroplar. Serbest kömürün kimyasal gücü.
· Durulama, gözlerin alevli rahatsızlıkları ile durulama, üst solunum yollarının mukoza zarlarında sodyum bikarbonatı (içme sodası) zastosovat'a ayrıştırın.
Yönetici.
- Antiseptik etkide, sodyum bikarbonatın hangi gücüne dayanır? Vidpovіd eşit reaksiyonlarla onaylandı. Bir antiseptik zasib sodyum tetraborat Na 2 B 4 O 7 ∙ 10H 2 Pro olarak destekleyebilir misiniz?
- Hacim 50ml (=1.036g/ml) olarak %5 NaHC03 hazırlayın.
- Budov molekülleri, odun kömüründen gelen ekşinin fiziksel ve kimyasal güçleri. Karbon ve yoganın mediko-biyolojik önemi.
В· Sodyum bikarbonatın intikamını alan antasitler müstahzarları, artan asitliğin eşlik ettiği çeşitli hastalıklarda vekaleten, tobto. asidoz.
Yönetici.
- Antasit preparatları hangi tuz gücüyle çalışır? Vidpovіd eşit reaksiyonlarla onaylandı. Bu amaçlar için başka konuşmalar kullanılabilir mi?
- Bir dönüşüm oluşturun:
NaOH→NaHC03 →Na2CO3 →NaCl→NaNO 3
Moleküler ve iyonik görünüm için reaksiyonların denklemini yazın.
Viconati reaksiyonları Na2CO3 →NaCl→NaNO3.
- Silikon ve yogo yarısı, doğa bilgisi, otrimannya, fiziksel ve kimyasal güç. Silikonun mediko-biyolojik önemi.
· AgNO 3 kontamine olduğunda dreni yıkamak için dahili olarak %2,5 NaCl solüsyonu uygulanır.
Yönetici.
1. NaCl neye dayanır? Vidpovіd eşit reaksiyonlarla onaylandı.
3. III grubunun ana alt grubunun unsurlarının ana özelliği. Güçlü orman ve yogo spoluk. Tıpta mediko-biyolojik önemi.
· Nadir tıbbi formların geliştirilmesi için, enjeksiyon için tanınan, vekaleten izotonik çeşitler.
Yönetici.
1. İzotonik çeşit nedir? Yoga neden izotonik olarak adlandırılıyor?
3. Zeminden alüminyum ve yoga, hakimiyet, otrimannya. Alüminyumun tıbbi ve biyolojik önemi.
· Etkili bir bakterisidal zasib olarak %3 sulu su peroksit zastosovuyut çözeltisi.
Yönetici.
1. Bakterisidal ve kan spinal peroksit suyunun temeli nedir. Perhidrol ile çalışırken hangi yabancı girişlerin kesilmesi gerekiyor?
2. Razrahuvati, skilki ml. 500 ml% 3'lük bir çözelti (ρ = 1.005 g / ml) almak için perhidrol (% 30 sulu H2Pro 2 çözeltisi, ρ = 1.1 g / ml) alınmalıdır. Tsey rozchin z dotrimannym tekhnіki bezpeka hazırlamak.
3. II grubunun baş alt grubunun metalleri. Zagalna karakteristiği, otrimannya, fiziksel ve kimyasal güç. Kalsiyum ve magnezyum tuzları. Su sertliği. Usunennia zhorstkostі su. II grubunun ana alt grubundaki elementlerin mediko-biyolojik önemi.
· Modern ilaç endüstrisi, toplama kampına, dağınık sistemlerin tipine, vücuda giriş yöntemine göre tıbbi preparatlar üretir.
Yönetici.
1. Hangi sistemlere dağınık denir?
Dağınık sistemler nasıl sınıflandırılır?
Dağınık sistemler tıbbi müstahzarları dağıtıyor gibi mi görünüyor? Spesifik örnekler sağlayın.
- Satıcıyı değiştirerek reçine hidrosolü çıkarın.
- Su birikintisi metallerinin karakteristik özelliği, saplantı, fiziksel ve kimyasal güç. Ay metallerinin en önemli parçaları. Su birikintisi metallerinin mediko-biyolojik önemi
· Çeşitli konuşmalarda su farklılıkları görüldüğünde, zastosovuyutsya rіdkі tıbbi formlar, karşılıklı olarak karşılıklı olabilir.
Yönetici.
- Spravzhnі rozchini, rozchinnist, nasicheniya, nenascheniya, renasistheniya rozhchiny. Ne tür katipler konuşmaları tutabilir?
- Mavi vitriol CuSO 4 ∙ 5H 2 O ile 100 ml (ρ = 1.051 g / ml) hacimli CuSO 4'ün %5'ini hazırlayın
- d - elemanlarının karakteristik özelliği. 1. grubun yan alt gruplarının metalleri ve spoluk. Tıbbi ve biyolojik önemi.
· Rusya'da, meyve suyu ve düşük meyve suyu taze ot ve yabani syrovina'nın elektro-işlenmesi vardır: meyveler, meyveler, sebzelerin kök bitkileri, meyve sularını (içeriden karıştırılmış) doğal bir görünümde görme yöntemiyle canlıların çeşitli organları. İç boşluk bir beyazlar sütunudur, nükleik asitler, karbonhidratlar, tanenler
Yönetici.
1. Ne tür farklılıklara sütunlu desenler denir? Kokular nasıl sınıflandırılır? Sütunların güçlerini numaralandırın. Nemli syrovina'dan gelen meyve sularını görmenin temelinde hangi süreç yatmaktadır?
2. Tuzlu suyun hidrosol hidroksitini (III) FeCl'nin hidrolizi ile uzaklaştırın. 3. Miselyum şemasını yazın.
- II grubunun ikincil alt gruplarının metalleri, genel özellikleri, budova, fiziksel ve kimyasal güç. Tıbbi ve biyolojik önemi.
· Kediotu kökü özüne dayalı tabletler hazırlarken, ana güçlendirici olarak vicoristate magnezyum karbonat kullanılması tavsiye edilmez, çünkü bu, çayırların infüzyonuna karşı daha hassas olan izovalerianik asit ve ruynuvannya valtrativ - rechovina'nın nötralizasyonuna neden olabilir.
Yönetici.
1. Su birikintisi gücünün magnezyum karbonata yansımasını açıklayın. Moleküler ve iyonik görünüm için reaksiyon denklemini yazın. Kediotu özü içeren tabletlerin hazırlanması için hangi hatırlatıcılar kullanılabilir?
2. Bir dönüşüm oluşturun:
MgO→MgCl 2 →MgSO 4 →Mg(OH) 2 →MgOHCl
Moleküler ve iyonik görünüm için reaksiyonların denklemini yazın.
3. Yan alt grupların VI, VII gruplarının elemanlarının genel özellikleri. Krom, manganez ve bunların parçalarının oksit öncüsü hakimiyeti. Tıbbi ve biyolojik önemi.
· Tıbbi nemli syrovin'den biyolojik olarak aktif konuşmaların çıkarılması için farmasötik üretimde karbon dioksit canlı gazın kullanılması.
Yönetici.
- Yoganın bu amaçlara hizmet etmesi karbonik asitte hangi egemenliklere dayanmaktadır?
- Bir dönüşüm oluşturun:
C→CH 4 →CO→CO 2 →BaCO 3 →Ba(HCO 3) 2 → BaCO 3 → CO 2
İyon değişim reaksiyonlarını moleküler ve iyonik formda yazınız.
- İkincil alt grubun VIII grubunun elemanlarının karakteristik karakterizasyonu. Salonun hakimiyeti ve yogo spoluk. Tıbbi ve biyolojik önemi.
Disiplinlerden sınav yemeklerinin listesi
Kimyanın temel kavramları ve yasaları. Atomun ömrüne böyle bir ayar.
Periyodik yasa ve periyodik sistem D.I. Mendeliev atomun yaşam ışığında.
Randevu, gör, anla, aydınlat, kimyasal bağın doğasını.
Randevu, aydınlanma mekanizması, kovalent bağın gücü. değerlik. Oksidasyon aşaması.
Oksidi: atama, sınıflandırma, isimlendirme, yetki ve sahip olma yöntemleri.
Asitler: atama, sınıflandırma, isimlendirme, güç ve sahip olma yöntemleri.
Kanıtlamak: atama, sınıflandırma, isimlendirme, yetki ve sahiplik yöntemleri.
Tuzlar: adlandırma, sınıflandırma, isimlendirme, yetki ve bulundurma yöntemleri.
Karmaşık dağınık: randevu, Werner'den sonra budova, tipi, isimlendirme.
Kimyasal reaksiyonun hızı. Yetkililer, scho vplyvayut swidk_st kimyasal reaksiyon.
Tersinir olmayan ve tersinir kimyasal reaksiyonlar. Kimyasal kıskanç. M. Chatelier ilkesi. Öz sermaye sabiti.
Oksit oksitleyici reaksiyonlar: en önemlileri, ana kavramlar, oksidasyon ve yenilenme günü, en önemli oksitleyici ajanlar ve reaksiyonun liderleri.
Dispersiyon sistemleri: atama, sınıflandırma. Kaba sistemler: süspansiyonlar, aerosoller, emülsiyonlar.
Koloidni razchiny: vyznachennya, hakimiyet, takıntı, budova misel.
Gerçek farklılıklar: atama, temel anlayış, farklılaşma sürecinin özü. Difüzyon. Osmoz. Ozmotik mengene.
Elektriksel ayrışma teorisinin ana hükümleri. Elektriksel ayrışma mekanizması. Ayrışma sabitine adım atın.
Asitlerin, bazların, tuzların ayrışması. pH farkının ayrışması.
Hidrolizin özü. Farklı tuz türlerinin hidrolizi. Adım hidrolizi.
VII grubunun ana alt grubunun elemanlarının karakteristik karakterizasyonu. Halojenlerin mediko-biyolojik önemi
Klor, klorlu su ve hidroklorik asit. Otrimanya, egemenlik. Klorür.
Kisnevі spoluki klor.
Kalkojenlerin kritik bir özelliği. Kisen ta yogo yarı yolda. Ekşiliğin mediko-biyolojik önemi.
Baskınlık su (su, su peroksit) ile yarı asidiktir. Tıpta Zastosuvannya H 2 Pro 2. Kurşun değeri.
Sirka. Ücretsiz sirka'nın alotropyası. Dünyanın gücünün kimyası. Çevrede gezinme. Serkovodny asit ve її tuzları.
Kükürt oksitlerin fiziksel ve kimyasal gücü, sülfürik ve sülfürik asitler, sülfürik asit tuzları, sülfürik asitler, durgunlukları.
V. Azot ve güç grubunun ana alt grubunun elemanlarının karakteristik özelliği.
Amonyak ve amonyum tuzlarının baskınlığı. Tıp ve eczacılıkta Zastosuvannya.
Oksit nitrojen. Nitröz asit ve її tuzları. Fiziksel ve kimyasal güç, stosuvannya.
Nitrik asidin fiziksel ve kimyasal gücü. harcamayın. Azot ve її spoluk'un mediko-biyolojik önemi.
15 R. Vile fosfor elementinin özellikleri: alotropi, fiziksel ve kimyasal güç, takıntı.
Fosfin. Fosfor ve fosforik asit oksitleri: güç, saplantı. Fosforun mediko-biyolojik önemi
Ana alt grubun IV grubunun elemanlarının karakteristik özelliği. Vuglets: Budova ve fiziksel baskınlık, alotropi vugletsyu, kimyasal baskınlık.
Kisnevі spoluky vugletsiu: Budova molekülleri, fiziksel ve kimyasal baskınlık. Kömür ve yoga spolukunun mediko-biyolojik önemi.
Silikon ve yogo yarısı: doğa bilgisi, erkeklik, fiziksel ve kimyasal güç. Silikonun mediko-biyolojik önemi.
ІІІ grubunun ana alt grubu: elementlerin ana özelliği. Yandan bor ve yoga: otrimannya, fiziksel ve kimyasal güç, tıpta zastosuvannya.
Alüminyum ve yoga arka planları: takıntı, fiziksel ve kimyasal güç. Alüminyumun tıbbi ve biyolojik önemi.
2. grubun baş alt grubunun metalleri: karizmatik özellikler, takıntı, fiziksel ve kimyasal güç. Kalsiyum ve magnezyum tuzları. Su sertliği. Usunennia zhorstkostі su. II grubunun ana alt grubundaki elementlerin mediko-biyolojik önemi.
Luzhnі attı: hayırsever özellik, takıntı, hakimiyet, en önemli özenti. Tıbbi ve biyolojik önemi.
d-elemanlarının karakteristik karakterizasyonu. 1. grubun ikincil alt grubunun metalleri. Pojdnannya midi, sribla. Tıbbi ve biyolojik önemi.
II grubunun yan alt gruplarının metalleri: yaşamın kritik bir özelliği, fiziksel ve kimyasal güç. Tıbbi ve biyolojik önemi.
Grubun yan alt grupları VI, VII: alt grubun elementlerinin karakteristik özelliği, krom, manganez ve bunların yarısı. Tıbbi ve biyolojik önemi.
VIII grubunun bir alt grubu: alt grubun unsurlarının genel bir özelliği, salonun gücü ve yogo spoluk. Tıbbi ve biyolojik önemi.
Yerleşme.Öğrencilerin önündeki deri masada bir ders planı, nitrik asidin metallerle etkileşimi için bir şema, bir dizi reaktif ve bükülmüş malzemeyi sabitlemek için testler var.
oksit nitrojen
Öğretmen.Azot oksitlerin formülünü tahmin edin ve yazın. Yaki oksi'ye tuzlu, yaki - tuzlu olmayan denir mi? Niye ya?
Beş nitrojen oksidinin formüllerini bağımsız olarak yazmayı öğrenin, adlandırın, kisnevy asitlerinin nitrojen buharını belirleyin ve oksitler ve asitler arasındaki reaktiviteyi belirleyin. Öğrencilerden biri dosh (masa) üzerine yazılır.
tablo
Azot oksitlerin, asitlerin ve tuzların ayarlanması
Gösteri sertifikası:
nitrojen(IV) oksidin su ile etkileşimi
Öğretmen. gemide NO 2 biraz su ekleyin ve karıştırın, ardından turnusol ile lekeleri çıkarmaya çalışın.
Ne korunuyor? Rozchin chervonіє yerleşmiş iki asit aracılığıyla.
2NO 2 + H 2 O \u003d HNO 2 + HNO 3.
Azot oksidasyon adımı NO 2 iyi şanslar +4, o zaman. +3 ile +5 arasında bir ara maddedir, rozchini stiykish'te yak, nitrojen(IV) okside iki asit verilir - nitrik nitroz.
Budova molekülünün bulunduğu depo
Öğretmen.Nitrik asidin moleküler formülünü tahtaya yazın, elementlerin moleküler ağırlığını ve oksidasyon derecesini hesaplayın. Yapısal ve elektronik formülleri katlayın.
Bu tür formüller oluşturmayı öğrenin (Şekil 1).
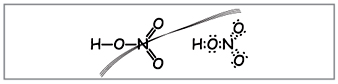
Öğretmen.Görünüşe göre, bu formüllere kadar, nitrojen etrafına on elektron sarılmıştır, ancak onu kullanamazsınız, çünkü. nitrojen başka bir periyotta bulunur ve mümkün olduğu kadar dış toplarda, yenisinde ise en yüksek elektronlardan daha azı olabilir. Bu yüzeysellik oluşturulmuştur, bu nedenle, nitrojen atomu ile bir atom arasında, verici-alıcı mekanizmasının arkasında bir kovalent bağ kurulduğunu varsayalım.(İncir. 2).
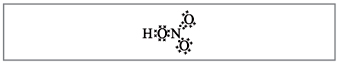
mal. 2. Nitrik asidin elektronik formülü.
Azot atomunun elektronları siyah noktalarla işaretlenmiştir.
Nitrik asidin aynı yapısal formülü aşağıdaki gibi temsil edilebilir.(Şekil 3) :
mal. 3. Nitrik asidin yapısal formülü
(oklu endikasyonların donör-alıcı bağlantısı)
Bununla birlikte, son yolla, alttaki bağlantının iki asit atomu arasında eşit olarak bölündüğü ortaya çıktı. Nitrik asitte nitrojene oksidasyon derecesi +5'tir ve değerlik (saygı vermek için) yarıdan fazladır, yüksek elektronik bahsin yarısından fazlasıdır.
Nitrik asidin fiziksel gücü
Öğretmen.Seyreltilmiş ve konsantre nitrik asit şişeleri olmadan önce. Tahmin edebileceğiniz fiziksel güçleri tanımlayın.
Su için önemli bir kaynak olan, sarımsı renkli, keskin kokulu nitrik asidi nasıl tanımlayacağınızı öğrenin. Roschin nitrik asit renksiz ve kokusuzdur.
Öğretmen. Nitrik asidin kaynama noktasının +83°C, donma noktasının -41°C, tobto olduğunu ekleyeceğim. vatanın büyük beyinleri için. Keskin bir koku ve kurtarıldığında yanmayanlar, asidin konsantre olması, düşük dirençli ve hafif olması veya ısıtıldığında genellikle genleşmesi ile açıklanır.
Asidin kimyasal gücü
Öğretmen. Tahmin et ne tür konuşmalar asitlerle etkileşime girecek?(Adını öğrenin.)
Tepki vermeden önce tepkileri listelemeye çalışın ve uyarılarınızı yazın (tepkiler TED ışığında yazılmalıdır).
Ve şimdi nitrik asidin belirli güçlerine karşı vahşiyiz.
Asidin kurtarıldığında şimdi kimyasal reaksiyonla getirildiğini dile getirdik:
4HNO 3 \u003d 2H 2 O + 4NO 2 + O 2.
(Reaksiyonun elektronik dengesini bağımsız olarak kaydedin.)
Görülen "gömme gazı"(NO2) farbuy asidi.
Özellikle asidin metale getirilerek gerçekleştirilmesi gerekmektedir. Biliyorsunuz ki, çeşitli asitlerden suyu uzaklaştırdılar, ancak nitrik asit ile etkileşime girdiğinde bu ortadan kaldırılmaz.
Çeşitli konsantrasyonlardaki asitlerin metallerle reaksiyonunda gazların nasıl görüldüğünü gösteren masanızdaki şemaya bakın.(Diyagramlı robot.)
Gösteri sertifikası:
konsantre nitrik asidin bal likörü ile etkileşimi
Nitrik asidin (kons.) midi tozu veya ince kesilmiş bal dart parçaları ile reaksiyonunun gösterilmesi daha da etkilidir:
Reaksiyonun elektronik dengesini bağımsız olarak kaydetmeyi öğrenin:
asit bulundurma
Öğretmen. Ders anlaşılmaz olacak, sanki nitrik asidin besinsel sahipliğini göremiyormuşuz gibi.
Laboratuvar yöntemi: diya nitrat üzerinde konsantre sülfürik asit (Şekil 5).
NaNO3+H2SO4=NaHSO4+HNO3.
Endüstride asit esas olarak amonyak yöntemiyle elde edilir.
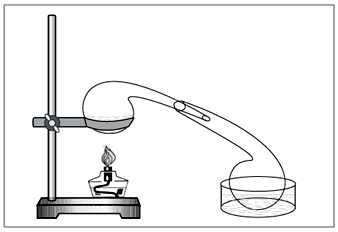
mal. 5. Laboratuar dozunda nitrik asidin geri çekilmesi için
elle dövülmüş eski kimyasal cam eşyalar - bir imbik
2000 ° C'nin üzerindeki bir sıcaklıkta (elektrik arkı) azot ve asit ile asit içerme yöntemi, herhangi bir özel genleşmeyi ortadan kaldırmadı.
Rusya'da, nitrik asidin tanıtımının tarihi, kimyager-teknoloji uzmanı Ivan Ivanovich Andreev'in (1880–1919) adıyla ilişkilidir.
yıl 1915 1917'de asidin amonyak ile indirgenmesi ve genişletme yönteminin fabrika ölçeğinde uygulanması için ilk tesisi yarattı. Donetsk yakınlarındaki buv zbudovaniya'nın ilk fabrikası.
Bu yöntem birkaç adım içerir.
1) Amonyak tozu özetinin hazırlanması.
2) Amonyak oksidasyonu platin levha üzerinde tekrar ekşidir:
4NH 3 + 5O 2 \u003d 4NO + 6H 2 O.
3) Azot(II) oksidin azot(IV) okside daha fazla oksidasyonu:
2NO + O2 = 2NO2.
4) Sulu asitte nitrojen oksit (IV) tayini:
3NO2+H2O=2HNO3+NO.
Ekşi varlığında bir ayrım yapıldığından, tüm nitrik oksit (IV) nitrik aside dönüştürülür.
5) Nitrik asidin giderilmesindeki son adım, atmosfer gibi gazların ve nitrojen oksitlerin saflaştırılmasıdır. Gazların depolanması: %98'e kadar nitrojen, %2-5 asit ve %0.02-0.15 nitrojen oksitler. (İlk etapta azot kullanılır, amonyak oksidasyonu için alınır.) Bu gazlardaki azot oksitler %0.02'den fazlaysa, azota katalitik yükseltmeler bilerek yapılır, çünkü bu oksitlerin bu kadar küçük miktarları büyük çevre sorunlarına yol açar. .
Tüm söylenenlerden sonra, gönderi beslenme: şimdi aside ihtiyacımız var mı?
asit durgunluğu
Öğretmen.Fermentasyon için vicorist'in nitrik asidi kullanılır: ilk satırda nitrik dobriv ve amino nitrat (nasıl elde edersiniz?); vibukhov konuşmaları (neden?); barvnikov; nitrativ, yaklaşan derste yakі timetsya hakkında.
Malzemeye bağlı
Ön sınıf deneyimi
– Nitrik asitte nitrojenin oksidasyon hızı neden +5, chotirinin değeri neden?
- Nitrik asit hangi metallerle reaksiyona girmez?
- Hidroklorik asit ve nitrik asidi bilmeniz gerekiyor, masada üç metal var - bakır, alüminyum ve soğuk. Nasıl ve neden suçluyorsun?
Ölçek
seçenek 1
1. Azot atomlarındaki enerji eşitleri için elektronlar arasındaki farkı gösteren sayı dizisi nedir?
1) 2, 8, 1; 2) 2, 8, 2; 3) 2, 4; 4) 2, 5.
2. Pratik reaksiyonların eşitlenmesini tamamlayın:
1) HNO3 (rozb.) + Cu…;
2) Zn + HNO3 (kons.) ...;
3) HNO3 + MgC03 ...;
4) CuO + KNO 3 ... .
3. Bana sürecin aşamalarından birini nasıl anlatacağımı söyle endüstriyel üretim Nitrik asit.
1) 4NH3 + 5O2 = 4NO + 6H20;
2) 5HNO3 + 3P + 2H20 = 3H3PO4 + 5NO;
3) N 2 + O 2 \u003d 2NO.
4. Negatif oksidasyon durumu, nitrojen ile aşağıdaki şekilde kendini gösterir:
1) N20; 2) HAYIR; 3) NO2; 4) Na3N.
5. Bakır talaşlarının konsantre nitrik asit ile sulandırılana kadar üretilecek etkileşimleri:
1) NO2; 2) HAYIR; 3) No.2; 4) NH3.
seçenek 2
1. Azot için en yüksek değerlik değeri birdir:
1) 1; 2) 2; 3) 5; 4) 4.
2. Konsantre nitrik asit ile rahatsız edici metallerin kombinasyonunu yazabilirsiniz: sodyum, alüminyum, çinko, demir, krom.
3. Nitrik asit ekstraksiyonu için syrovina gibi konuşmayı seçin:
1) nitrojen ve su;
2) amonyak, tekrarlanan su;
3) harcamak.
4. Konsantre nitrik asit aşağıdakilerle reaksiyona girmez:
1) karbon dioksit;
2) hidroklorik asit;
3) kömür;
4) baryum hidroksit.
5. Seyreltilmiş asidin magnezyum ile etkileşimi ile kurulur:
1) NO2; 2) HAYIR; 3) N20; 4) NH4NO3.
Testlerde Vіdpovіdі Seçenek 1. 1 – 4;
3 – 1; 4 – 4; 5 – 1. Seçenek 2. 1 – 4;
3 – 2; 4 – 1; 5 – 4. |
Tririvny Zalik döner tabla 11 sınıf
Başlık: " NEMETAL"
Ders formu: salon
Tsіl: öğrencilerin “Nemetaller” konusunda edindikleri bilgileri gözden geçirin; hakkında bilgi al yüksek güçїх spoluk olan metal olmayan; standart dışı ve yaşam durumlarında, bireysel ve farklılaştırıcı görevlerin zaferlerinde stosuvannya bilgisinin becerilerini şekillendirmeye devam etmek.
yönetici:
1. Bilgiyi doğrulayın ve bilim adamlarının o yarının atmayanlar hakkındaki bilgilerini pekiştirin; zihinsel düşüncenin gelişimini mantıksal olarak ve kimyasal madenin özgürlüğünü kabul etmek; farklı, uygulanabilir ve standart olmayan görevlerin yardımıyla, materyalin biçimsel - mantıksal olarak benimsenmesinden mecazi olarak mantıksal fikre geçiş.
2. İhtiyatlılık alışkanlıklarını geliştirmek, af tezahürü, günün kıymetini bilmek, vminnya müstehcenliği görmek, çarpık gerçekleri haklı çıkarmak, visnovka'nın düşüncelerini ve robiti'lerini mantıklı bir şekilde ifade etmek; rozіrkovuvati oku, robiti hayal kırıklığına uğrattı, tahmin et.
3. Öğrencilerin özgüveninin eğitimsel etkinliği ve yaratıcılığı yoluyla ana ışığı gören fikirlerin kalıplanmasını benimseyin.
4. Vikhovuvati vminnya pratsyuvati, zastosuvannyam'dan bağımsız olarak - bu karşılıklı kontrol. Ömür boyu yaşayanlar tarafından zv'yazok göster. Vzaimozv'yazku otorite ve yaşam temelinde Vihovuvati bilimsel svetoglyad.
Bu reaktife sahip olmak: test tüpleri, alkol lambaları, test tüpleri, syrniki ve diğer türler: ; ;
; ;
;
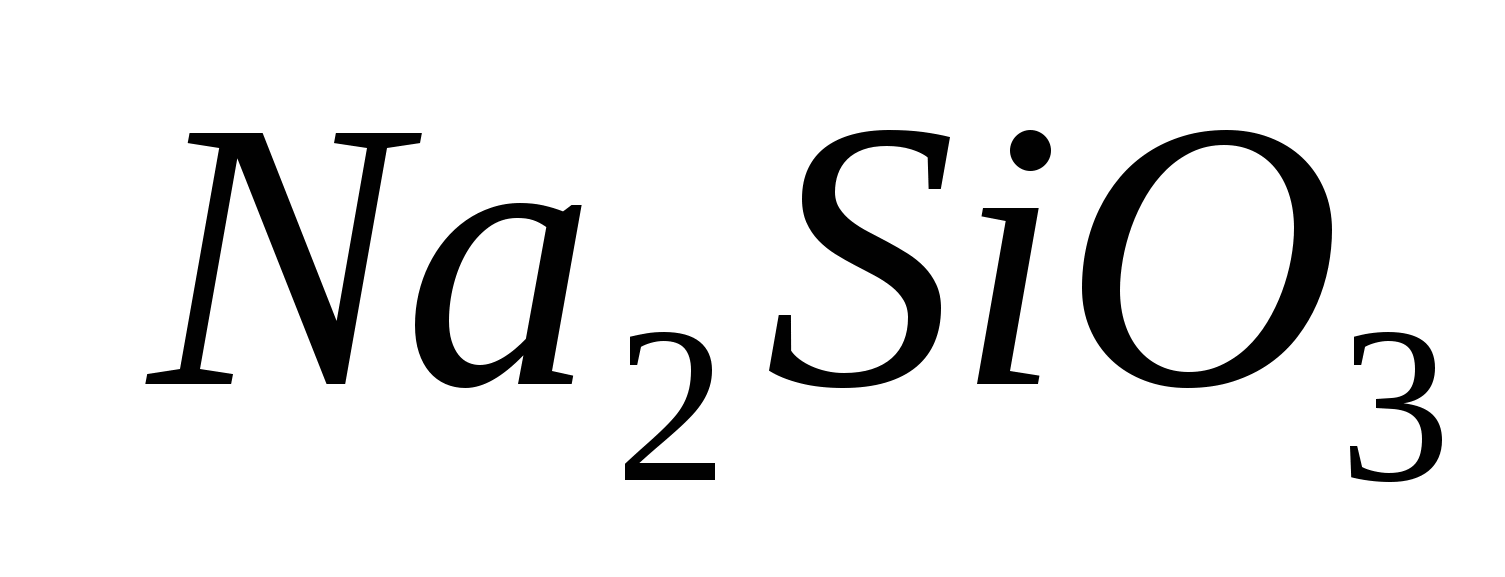 .
.
Salona hazırlanıyor.
Öğretmen, saldırgan türlerin üç eşit katının görevini hazırlar: konuşmaların dönüştürülmesi için test, teorik beslenme, yakіsnі ve rozrahunkovі zavdannya, zavdannya.
Öğretmen öğrencileri, görevi nasıl gözden geçirdiklerini hazırlar.
Ayın 1 - 2'si için ofiste kapıya kadar bilgilendirme kağıdı asılır.
Rota sayfası cilt tarafından görülebilir. Etaplardaki işin siyahlığı güzergâh sayfalarında gösterilmektedir.
GÜZERGAH TABLOSU.
F.I. öğrenme
Sahneyi adlandırma
Aşama sayısı
sipariş numarası
İnceleyenin imzası
Rosrakhun'un sorunu
Tanıma
Reenkarnasyon
Dersi sakla.
Rota sayfaları, 5 boş sayfa, bir kalemle sınıfa girmeyi ve sahneye gitmeyi, No. 1 için atamaları öğrenin. konuşmaların tanınması” deneyini geçmek.
Cilt sahnesinde, 7 - 8 tüy eklenir, yeniden kontrol edilir, rota sayfasına konur, hayır.
Puan, tüm aşamaların aritmetik ortalaması olarak belirlenir.
İLAVE
"Konuşmaların tanınması"
1 rіven
1. İyonun varlığını getirin 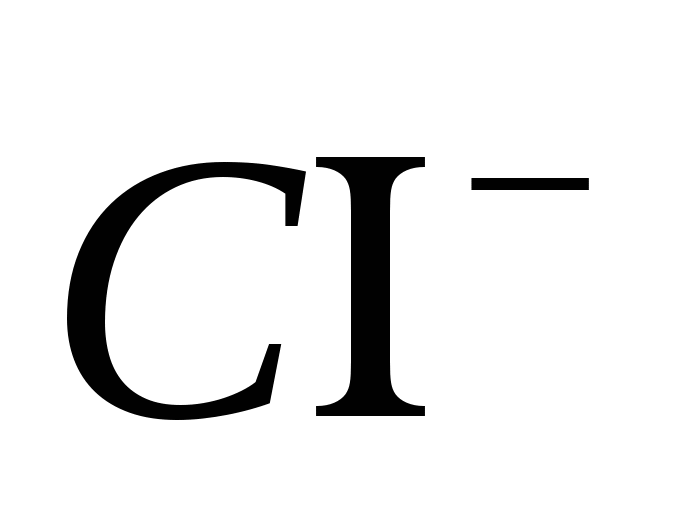
2. İyonun varlığını getirin 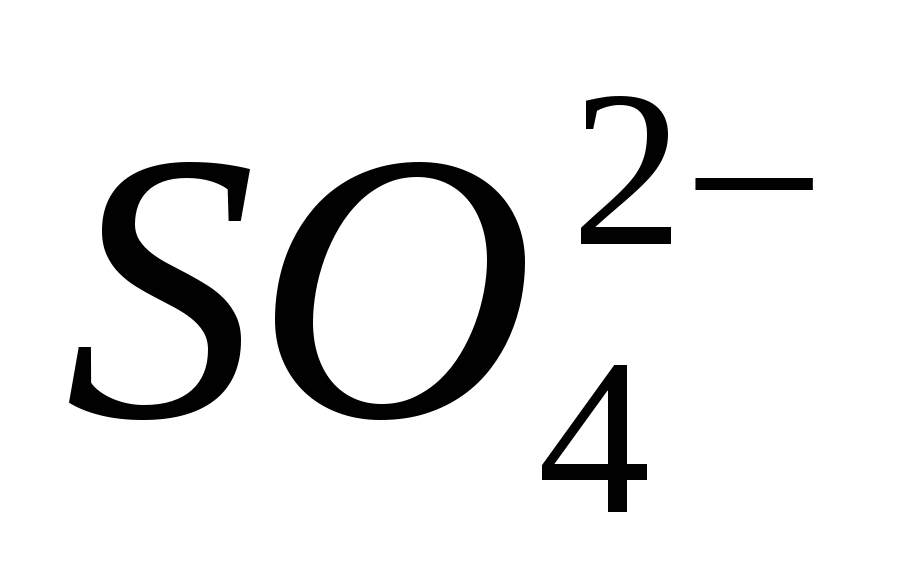
3. İyonun varlığını getirin 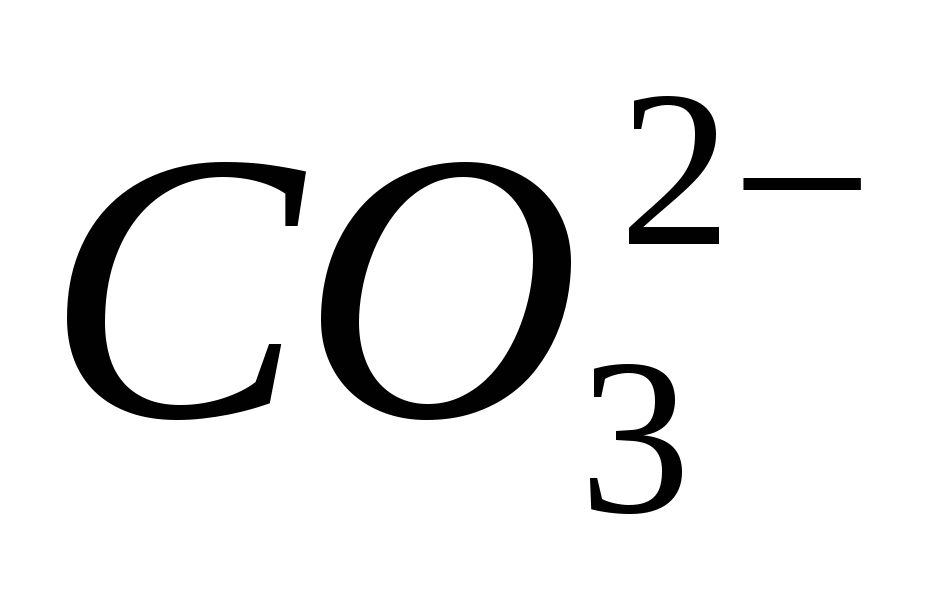
4. İyonun varlığını getirin 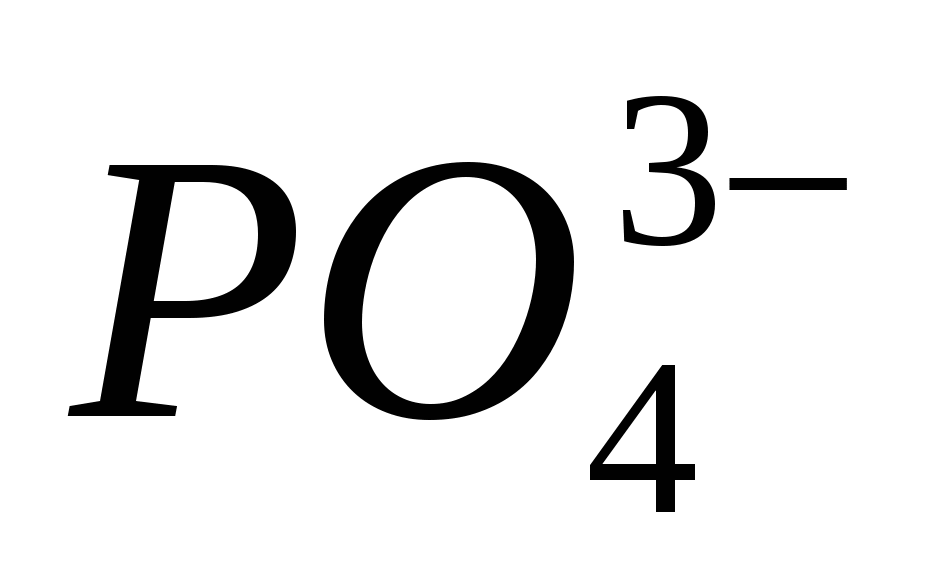
5. İyonun varlığını getirin 
2 rіven
1. Bir reaktifin yardımıyla farkı tanıyın:
2. Bir reaktifin yardımıyla farkı tanıyın:
3. Bir reaktifin yardımıyla farkı tanıyın:
4. Bir reaktifin yardımıyla farkı tanıyın: 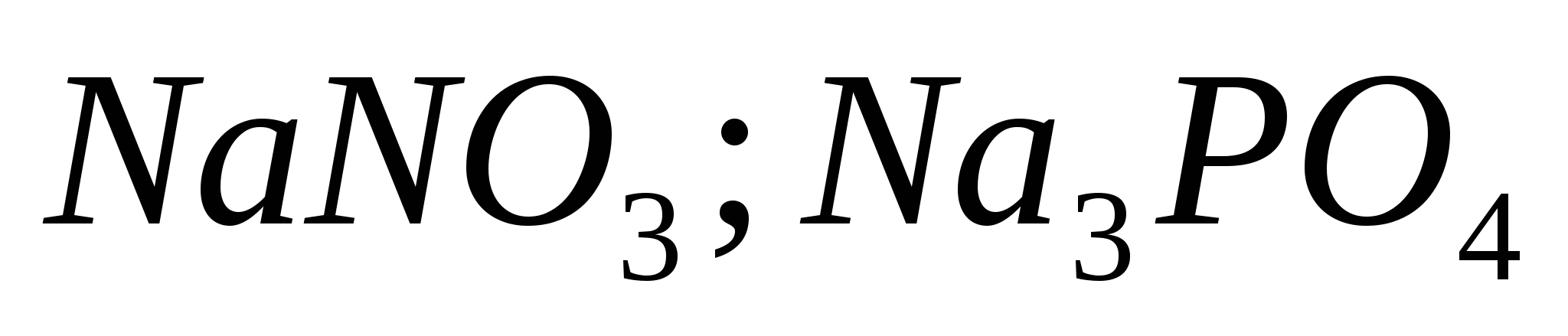 ;
;
5. Bir reaktifin yardımıyla farkı tanıyın:
3 rіven
1. Katkı maddeleri olmadan tanıma:
2. Katkı reaktifleri olmadan tanıma:
3. Katkı maddeleri olmadan tanıma:
4. Katkı maddeleri olmadan tanıma:
5. Katkı maddeleri olmadan tanıma:
Aşama "Konuşmaların dönüştürülmesi"
1 rіven
1. Reaksiyonu durdurun
2. Reaksiyonu sonlandırın
3. Reaksiyonu bitirin
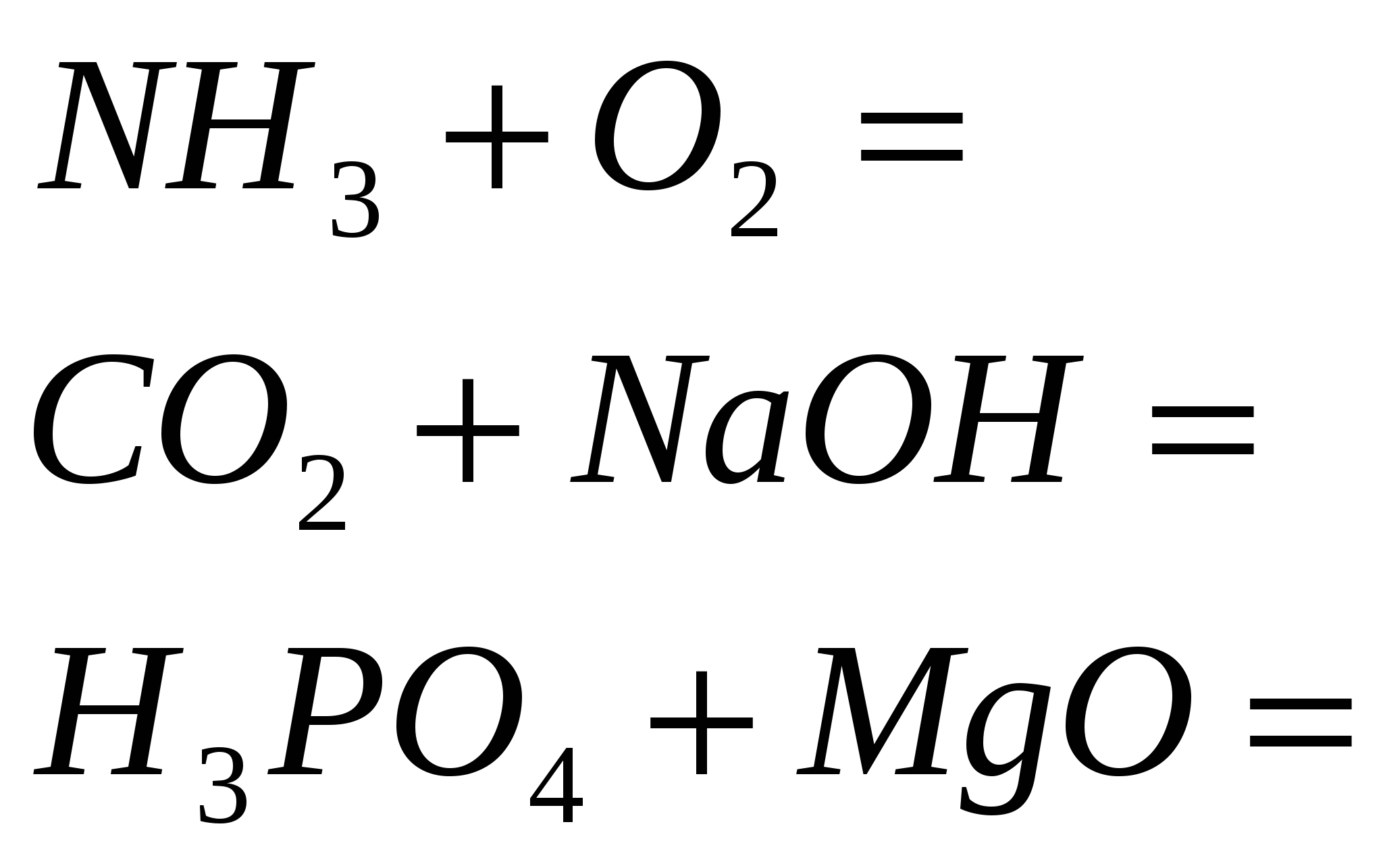
4. Reaksiyonu bitirin
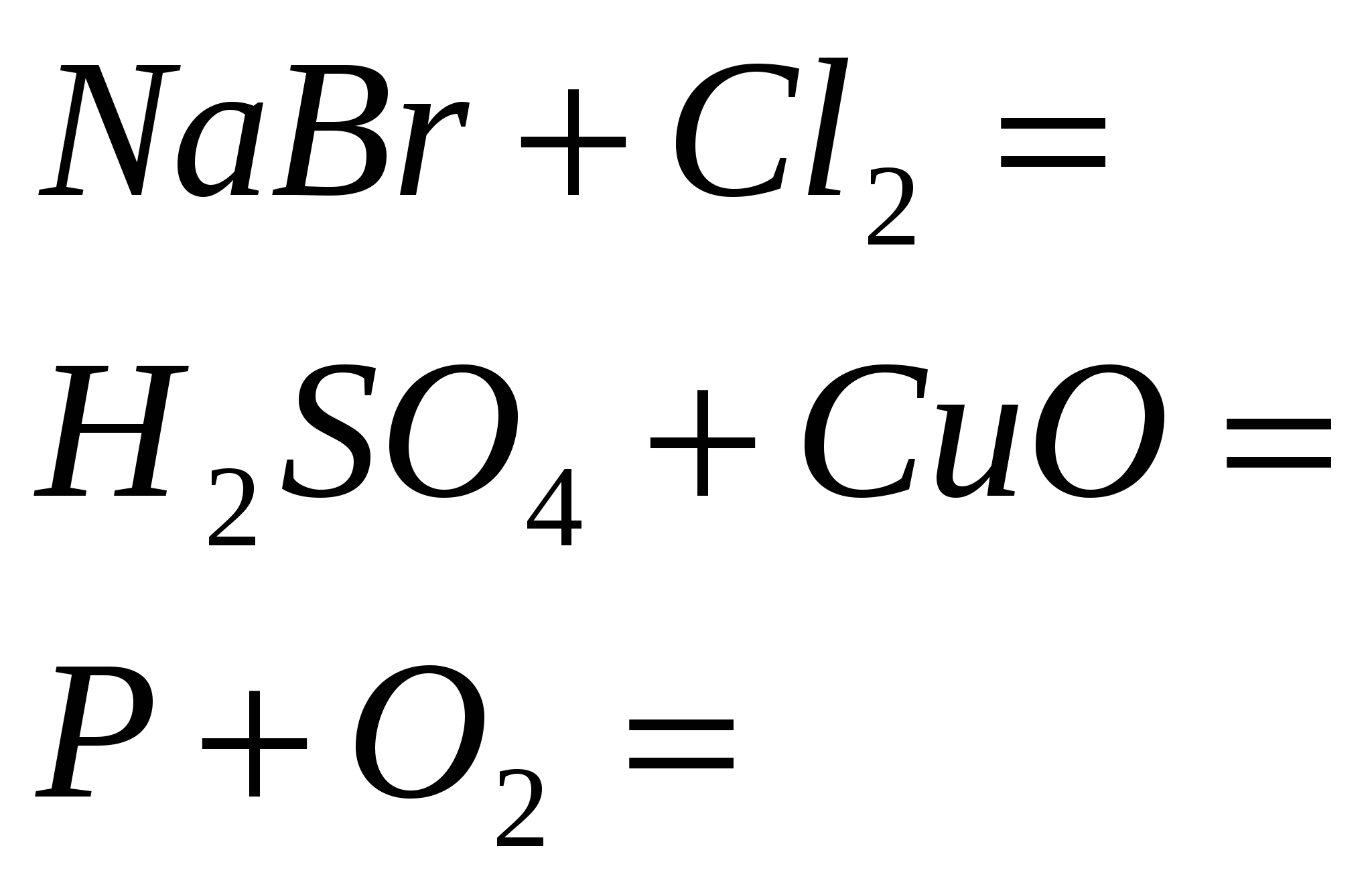
5. Reaksiyonu bitirin
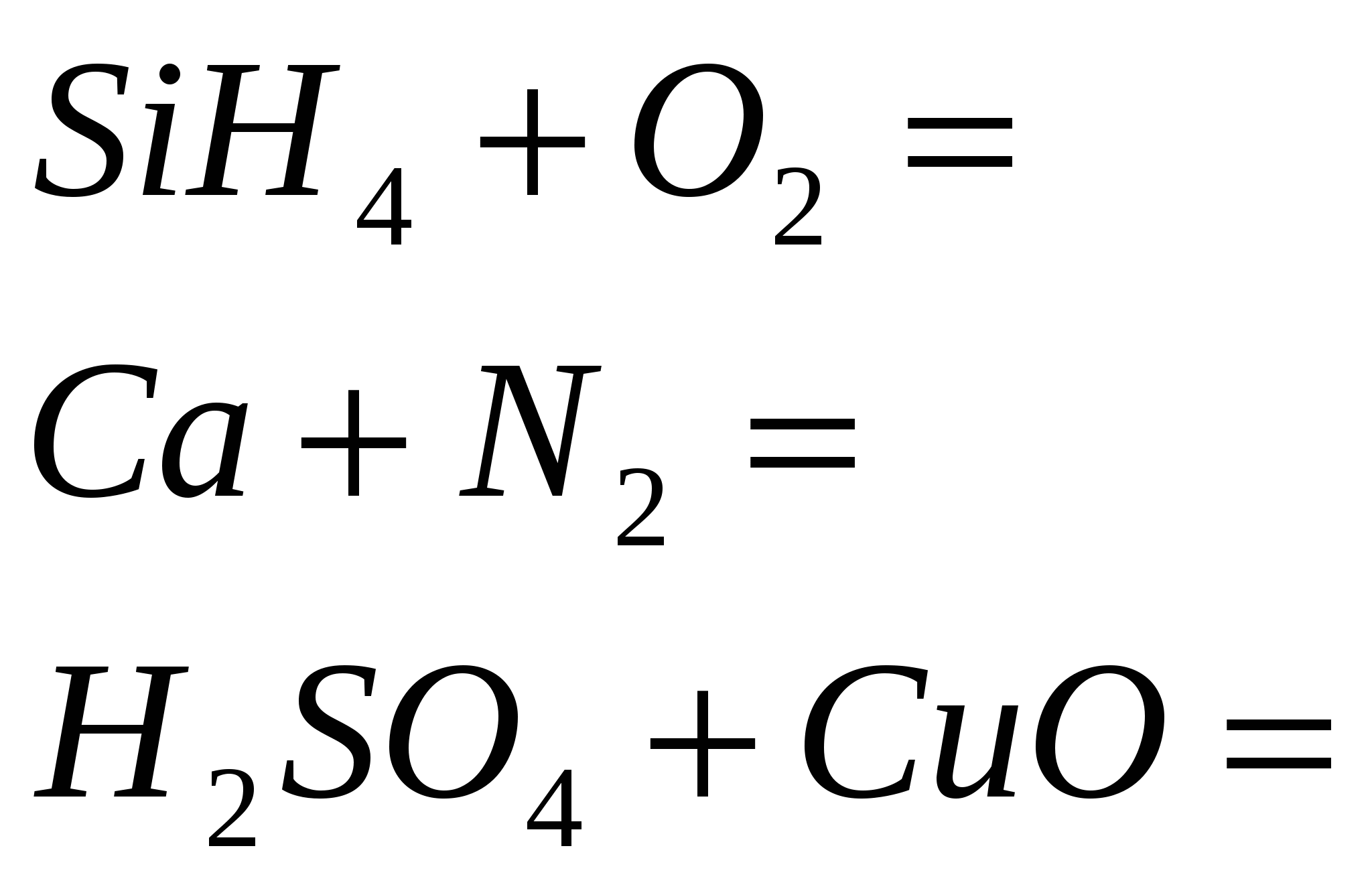
2 rіven
Bir dönüşüm oluşturun:
3rіven
Bir dönüşüm oluşturun:
3.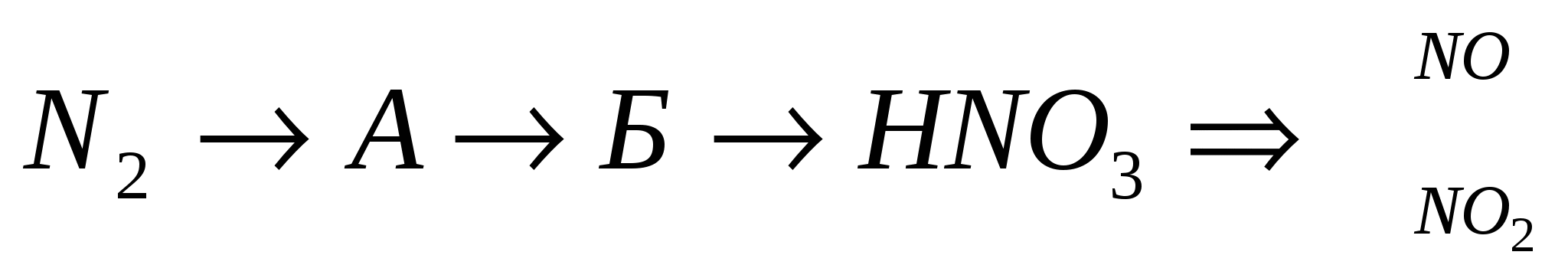
Aşama "Test"
seçenek 1
a) O, b) S, c) Cl, d) C, e) Si.
a) 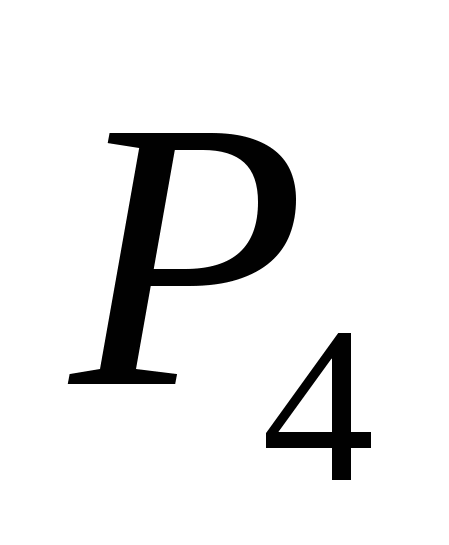 , b) C , c)
, b) C , c) 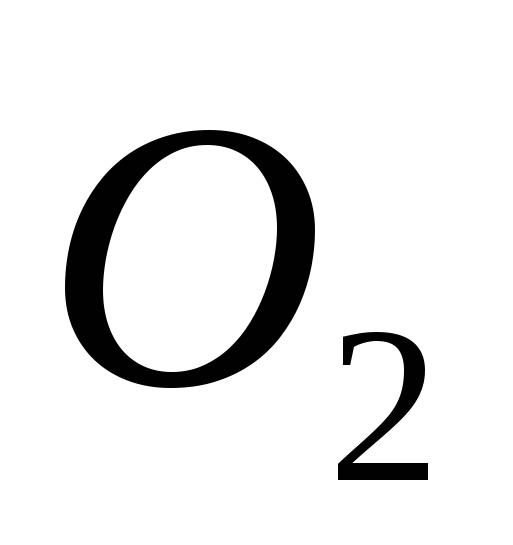 , G)
, G) 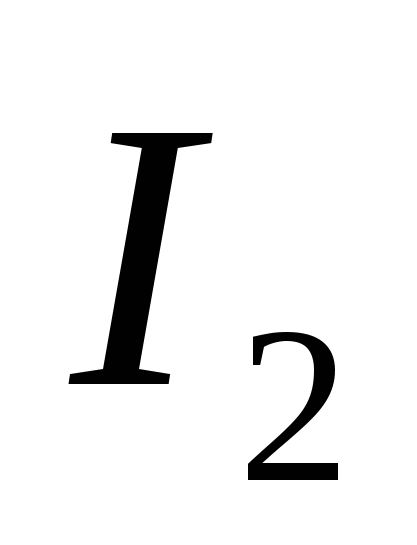 e)
e) 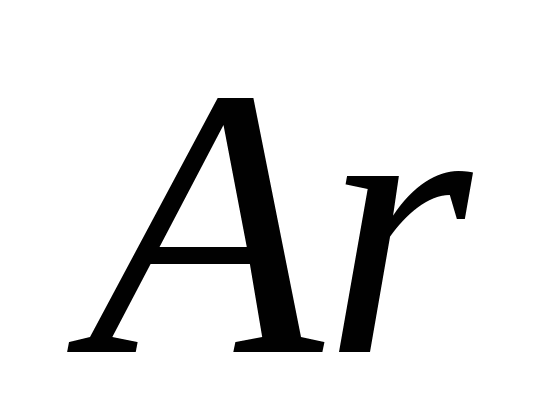 .
.
a)  , B)
, B) 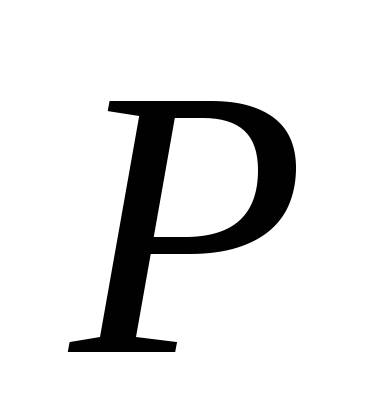 , v)
, v)  , G)
, G)  e)
e)  .
.
4. Elemanın elektronik formülü. Yogo uçan vodnev spoluk:
a)  , B)
, B)  , v)
, v)  , G)
, G)  .
.
5. Hidrohalik asitlerin gücü art arda büyür:
a) ![]()
B) 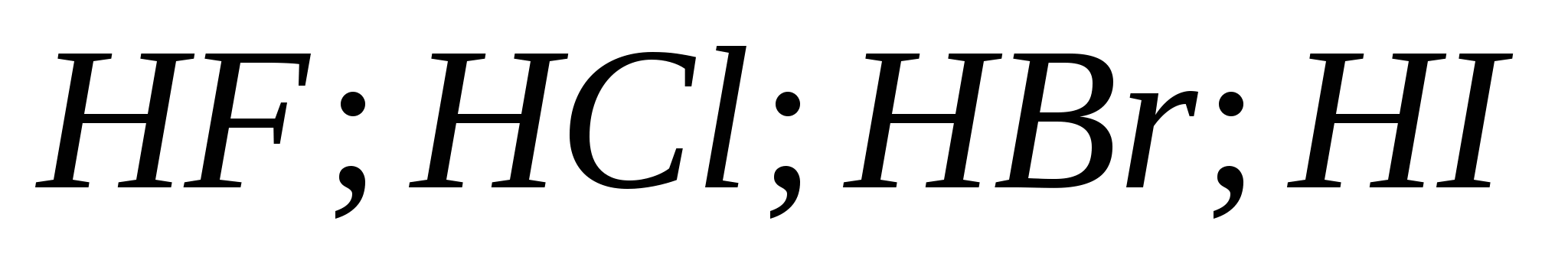
v) 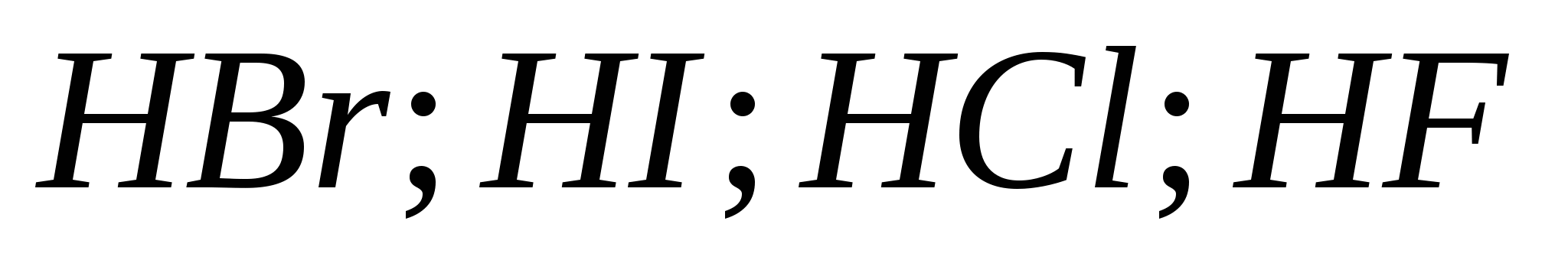
G) 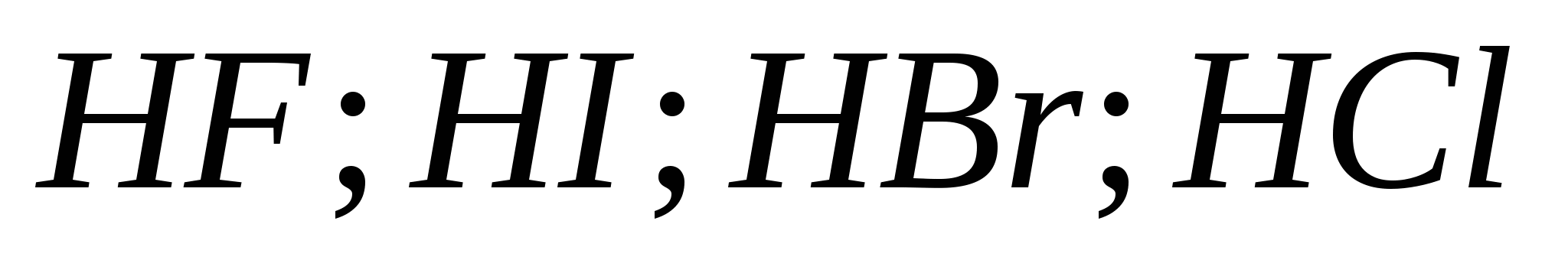
6. Halojenlerden, dövüşen çocuklarda konuşma engellendi:
a) flor; b) klor; c) iyot; d) brom.
7. Kırık sülfürik asit, atomların oranı için oksitleyici güç gösterir:
a)  , B)
, B)  , v)
, v)  .
.
8. Azot oksit V birleştirilebilir:
a) 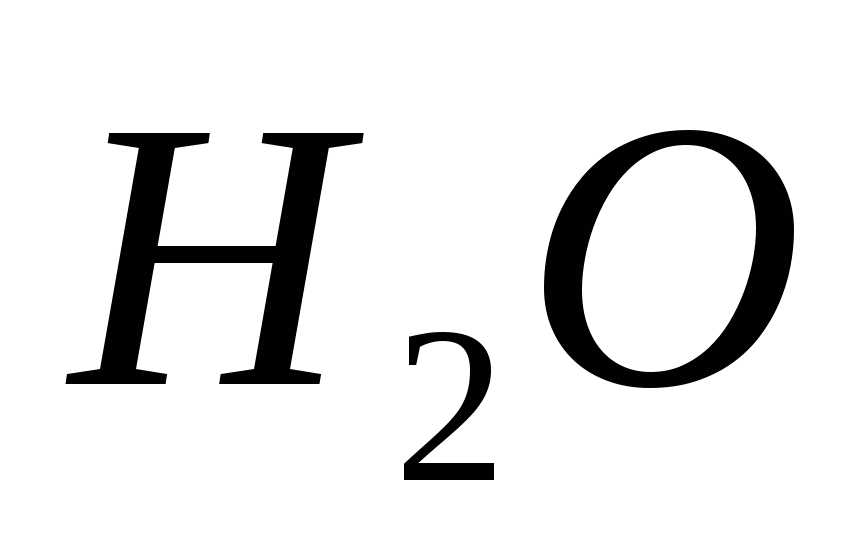 , B)
, B) 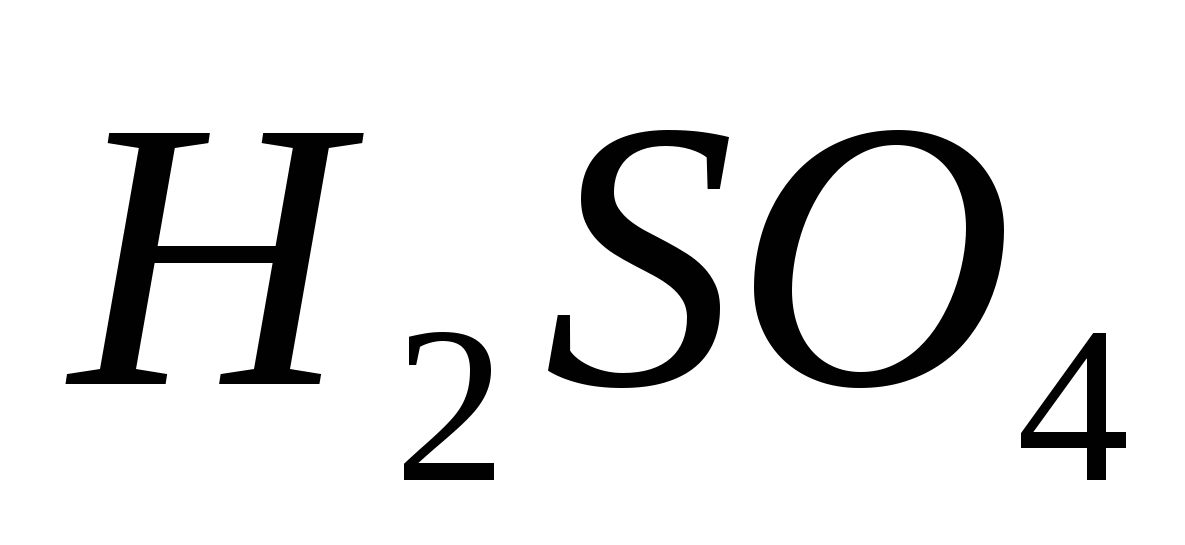 , v)
, v)  , G)
, G) 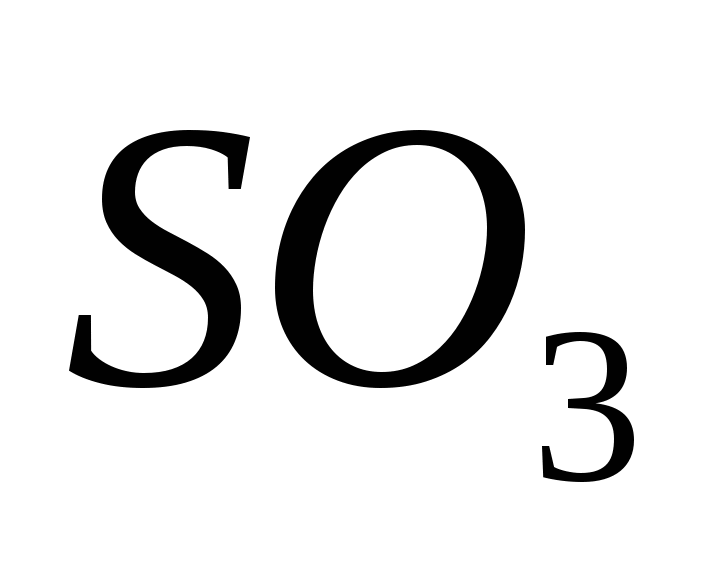 e)
e) 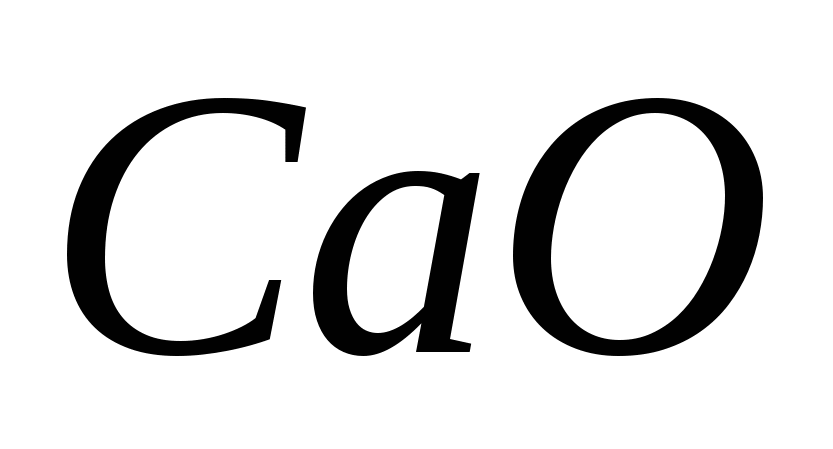 .
.
9. Tepki: amonyağa böyle bir güç getirin:
a) oksitleyici, b) fazlalık, c) asidik, d) bazik.
10. Üst üste asitlerin gücü
a) değişir, b) artar, c) yavaş yavaş artar, sonra değişir; d) yavaş düşer, sonra büyür, e) değişmez.
seçenek 2
Atomik kristal bedava basit konuşmalar, onaylandı:
a)  , B)
, B)  , v)
, v)  , G)
, G)  e)
e)  .
.
2. Normal tahliye için gazlar є:
a)  , B)
, B)  , v)
, v)  , G)
, G)  e)
e) 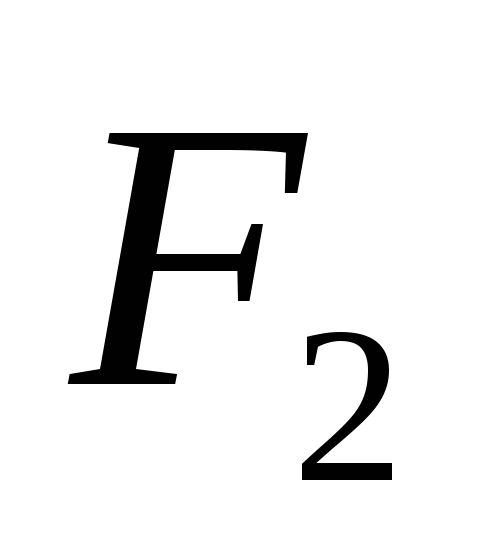 .
.
3. Alotropik modifikasyonlar aşağıdaki unsurları oluşturur:
a) 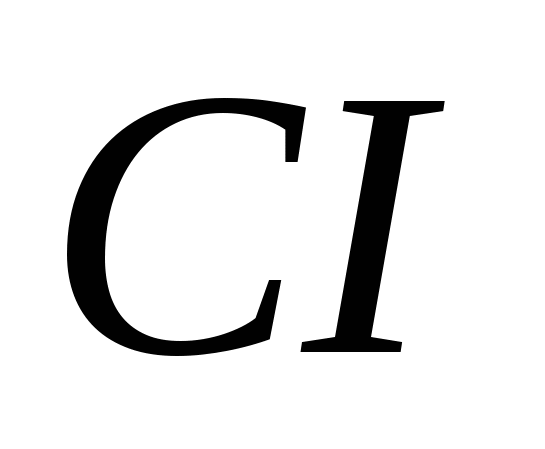 , B)
, B) 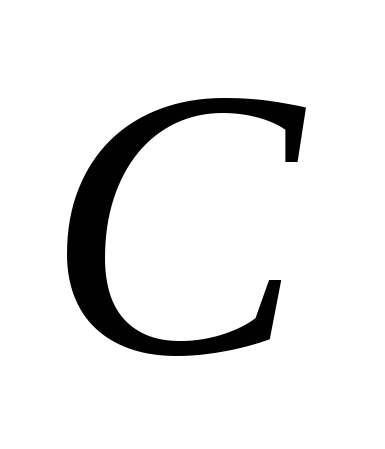 , v)
, v) 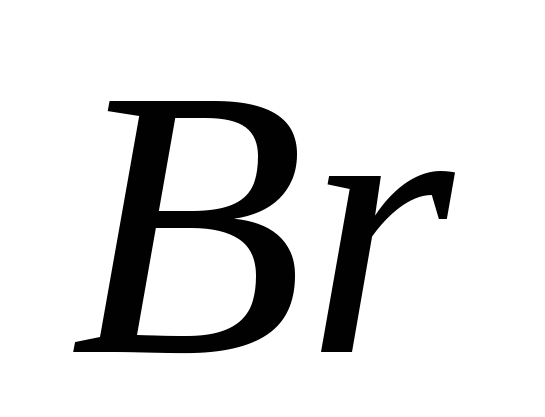 , G)
, G)  e)
e)  ,
,
4. Elemanın elektronik formülü. Yogo uçan vodnev spoluk:
a)  , B)
, B)  , v)
, v)  , G)
, G)  e)
e)  .
.
5. Yaz sularının ana gücü şu şekilde değişir:
a) 
B) 
v) 
G) 
6. Klor saklamak için farklı konsantrasyonları destekleyebilirsiniz:
a)  , B)
, B) 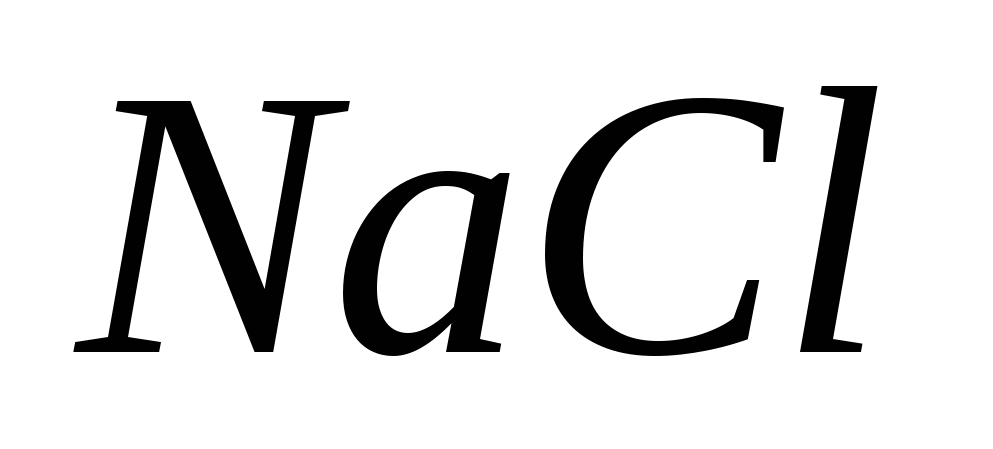 , v)
, v)  , G)
, G)  .
.
7. Konsantre sülfürik asit, atom aralığı için oksitleyici güç sergiler:
a)  , B)
, B)  , v)
, v)  .
.
NOT: 9-10 doğru cevap - "5"; 7-8-"4"; 5-6-"3"; 5-2'den az
Aşama "Teori"
Ben geldim ("3"te)
Seyreltilmiş sülfürik asidin gücünü karakterize eden reaksiyonların seviyesini yazın.
Sülfür oksidin (VI) gücünü karakterize eden reaksiyon hızını yazın.
Hidroklorik asidin gücünü karakterize eden reaksiyonların denklemini yazın.
Fosfor (V) oksidin gücünü karakterize eden reaksiyonların denklemini yazın.
Amonyağın gücünü karakterize eden eşit reaksiyonları yazın.
II rіven ("4" de)
II döneminde ametallerin yaz sularının formüllerini yazınız. Bu asidik güçlerin nasıl ve neden değiştiğini açıklayın.
III dönemindeki en yüksek metal olmayan oksitlerin formüllerini yazın. Bu asidik güçlerin nasıl ve neden değiştiğini açıklayın.
III dönemindeki elementlerin en önemli asitlerinin formüllerini yazın. Bu asidik güçlerin nasıl ve neden değiştiğini açıklayın.
VI alt grubunun metal olmayan uçucu sularının formüllerini yazın. Bu asidik güçlerin nasıl ve neden değiştiğini açıklayın.
VA alt grubunun elementlerinin en önemli asitlerinin formüllerini yazın. Bu asidik güçlerin nasıl ve neden değiştiğini açıklayın.
III rіven ("5" üzerinde)
Sülfürik ve nitrik asitlerin oksitleyici ve asidik gücünü dengeler. Vidpovid eşit tepkilerle onaylıyor.
Sülfür oksit (IV) ve karbon oksidin (IV) oksitleyici ve asidik gücünü dengeleyin. Vidpovid eşit tepkilerle onaylıyor.
Su ve florohidritin oksitleyici ve asidik gücünü dengeleyin. Vidpovid eşit tepkilerle onaylıyor.
Konsantre ve seyreltilmiş nitrik asidin oksitleyici ve asidik gücünü dengeleyin. Vidpovid eşit tepkilerle onaylıyor.
Karbon oksit (II) ve karbon oksitin (IV) oksitleyici ve asidik gücünü eşitleyin. Vidpovid eşit tepkilerle onaylıyor.
Aşama "Rozrahun'un görevi"
Ben geldim ("3"te)
II rіven ("4" de)
37 g kalsiyum hidroksit ile amonyum sülfat ile etkileşime girdiğinde, 15 g amonyak çıkarıldı. Amonyak çıkışının kütle fraksiyonunu hesaplayın.
Ekşi 62 g fosforda spalyuvanni olduğunda, 130 g fosfor (V) oksit alındı. Fosfor (V) oksit çıkışının kütle fraksiyonunu hesaplayın.
8,96 litre klorlu suyu nötralize etmek için kaç gram %10 sodyum hidroksite ihtiyacınız var?
Evlerin %20'sini kaplayacak olan 10 kg'lık buharı depolamak için birkaç litre karbondioksit kullanılabilir.
11,2 litre karbondioksiti 900 gr %10'luk baryum hidroksitten geçirmek için kuşatmanın kaç gramı yerleşmiştir?
III rіven ("5" üzerinde)
32 g midi "dağılımı" için hangi hacimde %80 nitrik asit (pl. 1.46 g/ml) gereklidir?
4 litre (N.O.) nitrik oksit (IV) almak için aşırı konsantre nitrik asit ile reaksiyon için ne kadar kütle midi gerekir, böylece yoga çıktısının hacim oranı %96 olur?
20 g altın alaşımındaki sülfürik asit konsantrasyonunda "değişken" olduğunda, 4,2 l (n.o.) kükürt oksit (IV) görüldü. Bu alaşım için kütle fraksiyonunu % midi olarak belirtin.
Potasyum iyodür dağılımından 1 litre hacimli klor ve su sumish gazları geçirildi. 5.08 r iyot gördüm. Egzoz toplamındaki klor gazının hacim oranını (%) belirleyin.
10 g kütleye sahip Sumish silikon ve vugillya, aşırı konsantre bir sodyum hidroksit çözeltisi ile işlendi. Reaksiyondan sonra 5.6 litre su (n.s.) görüldü. Bu toplam için silikonun kütle fraksiyonunu (%) belirleyin.
