28 g silikonu oksijenle bağlarken. Silikon oksijen bileşikleri
Genel karakteristik: Karbondan temel fark: Bileşiklerde p bağlarının bulunmaması Silisitler, Hidrojen (silan), oksidasyon ve hidroliz içeren bileşikler, Tetraflorür ve silikon tetraklorür, hidroliz, Heksaflorosilikatlar, Oksijen bileşikleri, Silisyum (IV). asit, Silikatlar, Çözünürlük ve hidroliz, Doğal silikatlar ve alüminosilikatlar, zeolitler, Organosilikon bileşikler, Silikonlar ve siloksanlar, Tıpta silikon bileşiklerin kullanımı.
silikon (lat. Silicium), Si, Periyodik Sistemin Grup IV'ün kimyasal elementi; atom numarası 14, atom kütlesi 28.086. Silikon ayrıca elektronik sp3 hibridizasyonu sergiler
orbitalleri. Silikon atomunun dış elektron katmanında değerlik 3d- vardır
yörüngeler (Si: 3s23p23d0),
Oksijen sonrası silikon kabuktaki en yaygın elementtir. Serbest halde karbonun aksine, silikon doğada bulunmaz. En yaygın bileşikleri silikon oksit (IV) Si02 ve silisik asit tuzları, silikatlardır. Yerkabuğunun kabuğunu oluştururlar. Silikon bileşikler bitkilerde ve hayvanlarda bulunur. Kimyasal özelliklere göre, karbon gibi silikon bir metal değildir, fakat metalik olmayışı daha az belirgindir, çünkü daha büyük bir atom yarıçapına sahiptir.
Silikon. hemen hemen tüm metalleri olan bileşikleri oluşturur - ilitsidy (sadece Bi, Tl, Pb, Hg ile bileşikler bulunamamıştır). Kompozisyonu (MeSi, MeSi2, Me5Si3, Me3Si, Me2Si, vb.) Genellikle klasik değerlere karşılık gelmeyen 250'den fazla silisit elde edildi. Silisitler, refrakterlik ve sertlikte farklılık gösterir; ferrosilikon (özel alaşımların erimesinde indirgeyici ajan, bakınız Ferroalyajlar) ve molibden silisit MoSi2 (elektrikli fırın ısıtıcılar, gaz türbin kanatları, vb.) en büyük pratik öneme sahiptir.
Silan. Silisitler üzerindeki hidroklorik asidin etkisi altında, silikonun en basit hidrojen bileşiği silan SiH4'tür:
Silan, kendiliğinden tutuşan hoş olmayan bir kokuya sahip zehirli bir gazdır. hava
Reaktifler ve güçlü indirgeyici ajanlar.
oda sıcaklığında suyla reaksiyona girer:
SiH4 + 2H2O → Si02 + 4H2;
tetraflorür Silisyum, dioksitin elemental florin ile florlanmasıyla üretilir.
Florlama işlemi, iki fazda bir alev reaktöründe gerçekleştirilir ve bu, florin fazlalığını 1. aşamadan 2. aşamaya yönlendirir.
Teknik sonuç, yüksek verim ve ürün kalitesi ile sürekli modda silikon üretimidir.
Silisyum tetraflorür SiF4, hidroflorik (hidroflorik) asidin, cam üzerindeki etkisiyle oluşur:
Na2SiO3 + 6HF® 2NaF + SiF4 + 3H2O
Silikon oksijen bileşikleri
Silisyumun en önemli oksijen bileşiği, birkaç kristal modifikasyonuna sahip olan silikon dioksit Si02 (silika) 'dır.
Düşük sıcaklık modifikasyonuna (1143 K'ye kadar) kuvars denir. Kuvars piezoelektrik özelliklere sahiptir. Doğal kuvars çeşitleri: Kaya kristali, topaz, ametist. Silika çeşitleri kalsedon, opal, akiktir. Jasper, kum.
Silika kimyasal olarak dirençlidir; sadece flor, hidroflorik asit ve alkali çözeltilerden etkilenir. Kolayca camsı bir duruma (kuvars camı) gider. Kuvars camı kırılgandır, kimyasal ve termal olarak çok dirençlidir. Karşılık gelen Si02 silisik asidi, belirli bir bileşime sahip değildir. Tipik olarak, silisik asit xH2O-ySiO2 olarak kaydedilir. Silisik asitler seçildi: H2Si03 (H20-Si02) - meta-silikon (üç-okso-silikon), H4Si04 (2H20-Si02) - orto-silikon (tetra-okso-silikon), H2Si2O5 (H20 * Si02) - dimetik silikon.
Silisik asitler, az çözünen maddelerdir. Silisyumun karbona kıyasla daha az metaloid yapısına göre elektrolit olarak H2SiO3, H2C03'ten daha zayıftır.
Silisik asitlere karşılık gelen sudaki tuzlar-silikatlar çözünmez (alkali metal silikatlar hariç). Çözünebilir silikatlar denklem ile hidrolize edilir
2Si03 - + H20 = Si2O52- + 20H-.
Çözünebilir silikatların konsantre çözeltilerine sıvı cam denir. Normal pencere camı sodyum ve kalsiyum silikat Na20-CaO-6Si02'nin bir bileşimine sahiptir. Reaksiyon ile elde edilir
Çok çeşitli silikatlar (daha doğrusu oksosilikatlar) bilinmektedir. Oksosilikatların yapısında belli bir düzenlilik gözlenir: hepsi bir oksijen atomuyla birbirine bağlanan Si04 tetrahedra'dan oluşur. Tetrahedranın en yaygın kombinasyonları, yapısal birimler olarak zincirler, kurdeleler, ağlar ve iskeletler halinde birleştirilebilen (Si2O76-), (Si3O9) 6-, (Si401) 8-, (Si6O1812-) 'dir (Şekil 4).
En önemli doğal silikatlar örneğin talk (3MgO * H20-4Si02) ve asbesttir (SmgO * H20 * Si02). Si02 ile olduğu gibi, camsı (şekilsiz) durum silikatların karakteristiğidir. Camın kontrollü kristalleşmesiyle, ince kristal halini (sitalls) elde etmek mümkündür. Sitalls kuvvet artışıyla karakterize edilir.
Silikatlara ek olarak, alüminosilikatlar doğada yaygındır. Alüminosilikatlar - silikon atomlarının bir kısmının üç değerli Al ile değiştirildiği çerçeve oksosilikatlar; örneğin, Na12 [(Si, Al) 04] 12.
Silisik asit için, H2SiO3 asidinin tuzları derhal etkilenmediğinde kolloidal bir durum karakteristiktir. Belirli koşullar altında (örneğin, ısıtıldığında) silisik asidin (sollar) kolloidal çözeltileri, silisik asidin saydam, homojen bir jel benzeri kütle jeline dönüştürülebilir. Jeller, Si02 molekülleri tarafından oluşturulan, boşlukları H20 molekülleri ile doldurulmuş, uzamsal, çok gevşek bir yapıya sahip, yüksek moleküler bileşiklerdir. Silika jeli kuruturken silika jeli elde edilir - yüksek adsorpsiyon kapasitesine sahip gözenekli bir ürün.
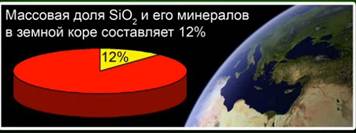
Silisyum oksit (IV) (silika) - yer kabuğunda en yaygın bileşik olup, kütlesinin% 12'sini çeşitli mineraller formunda yapar. Kristalin ve amorf silika arasındaki farkı ayırt eder. Silisyum oksit (IV) için en basit formül Si02'dir. Atom kafesinde kristalleşir.
1) Kristalin silika - bir kuvars minerali ve çeşitleri (kaya kristali, kalsedon, akik, jasper, çakmaktaşı); kuvars inşaat ve silikat endüstrisinde yaygın olarak kullanılan kuvars kumlarının temelini oluşturur.
2) Amorf silika - opal mineral bileşimi Si02 nH2O formunda; amorf silisin toprak formları, diatomit, Tripoli'dir (infüzyona ait topraklar); Yapay amorf susuz silika örneği, sodyum metasilikattan elde edilen silika jeldir:
Na2Si03 + 2HCl = 2NaCl + H2SiO3
Silika jel, nemi iyi emdiği için gelişmiş bir yüzeye sahiptir.
Silika jel pH\u003e 5-6 olan süper doymamış silisik asit çözeltilerinden (nSi02, mH20) oluşan kuru bir jeldir. Katı hidrofilik sorbent.
resepsiyon
Alkali metal silikat çözeltilerinin asitleştirilmesiyle elde edilir, ardından oluşan jelin yıkanması ve kurutulması ile elde edilir:
Silisik asit Si02, bir dizi silisik asidin anhidritidir.
Silisik asit, tetrahedral yapısal birimlerden oluşur (her bir birimde, silikon atomu tetrahedronun merkezindedir ve oksijen atomları üstlerde bulunur). Zincirlerde birleşen yapısal bağlantılar daha kararlı polisilik asitler oluşturur:
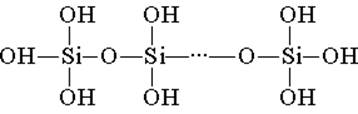
Böyle bir bileşiğin bileşimi, formül (H2SiO3) n ile ifade edilebilir. Bununla birlikte, silisik asit genellikle H2Si03 formülüyle temsil edilir. H2SiO3 - asit çok zayıf, suda az çözünür. Isıtıldığında, karbonik asitle aynı şekilde kolayca ayrışır:
Tüm silisik asitler çok zayıftır (kömürden daha zayıftır).
silikatlar. Tüm silisik asitlerin tuzlarına silikatlar denir, ancak kural olarak, eğitim literatüründe silikatlar metasristalik asit tuzlarını ima eder. Bileşimleri, genellikle, formül oksitlerle, elementlerin oksit bileşikleri formunda temsil edilir. Örneğin, kalsiyum silikat CaSiO3 şu şekilde ifade edilebilir: CaO × SiO2.
R2O'nun sodyum veya potasyum oksitler olduğu R2O x nSiO2 bileşiminin silikatları, çözünür cam olarak adlandırılır ve konsantre sulu çözeltileri, sıvı cam olarak adlandırılır. En önemlisi sodyumda çözünür camdır.
Havada dururken silikatların çözeltileri bulanıklaşır, çünkü havadaki karbondioksit (IV) silisik asidi tuzlarından uzaklaştırır:
Silisik asit, suda pratik olarak çözünmez - bu özellik, iyon SiO32- ye nitel bir reaksiyon olarak kullanılır.
Silikatlar, silisin alkaliler veya karbonatlarla kaynaştırılmasıyla elde edilir:
Silisik asit çözünürlüğü ve çözünme hızı, en önemlisi, alınan silikon dioksitin modifikasyonu, dağılım derecesine ve sıcaklığa sahip olduğu birkaç faktöre bağlıdır. Silika jeli suyla çalkalarken, çözünürlük dengesi birkaç saat içinde kurulur, kuvars durumunda, aylarca hatta yıllara ihtiyaç vardır.
DOĞAL SİLİKALAR (Latin. silex cinsinden, cins. silis vakası - çakmaktaşı * a. doğal silikatlar; N. naturliche Silikat; F. naturelleri silikat; ve. silikatos natulatları) - bir mineral sınıfı, silisik, izo ve heteropolikristalin tuzları. Doğal silikatların payı, yer kabuğunun kütlesinin% 75'ine ve mineral türlerinin yaklaşık% 25'ine karşılık gelir. Doğada, en önemli kaya oluşturan mineralleri (feldspatlar, piroksenler, amfiboller, mikrofonlar, vb.) İçeren 700'den fazla doğal silikat bilinmektedir.
alüminosilikatlar - karmaşık anyonları silikon ve alüminyum içeren bir doğal ve sentetik silikat grubu. Kompleks anyon örnekleri: -, -, 2 -. Na +, K +, Mg2 +, Ca2 + ve bazen Ba2 + ve Li + katyon olarak işlev görür.
Doğal alüminosilikatlar en yaygın minerallerdir, yer kabuğunun kütlesinin% 50'sini oluştururlar. Bunlara feldspatlar (albit, ortoklaz, anortit), kil mineralleri ve mika dahildir.
zeolitler - Bunlar kalsiyum, sodyum, potasyum, baryum ve diğer bazı elementlerin sulu alüminosilikatlarıdır. Zeolit grubu, bileşimde (özellikle kristal hidrattaki su molekülü sayısında) ve tabii ki fiziksel ve kimyasal özelliklerde farklı olan kırktan fazla mineral içerir. Ancak bu mineral grubunun hemen hemen tüm temsilcileri ortak bir özelliğe sahiptir - bunlar iyi sorbentlerdir, iyon değişim özelliklerine sahiptirler, bireysel iyonların hareketliliğini değiştirebilirler ve moleküler elekler olarak çalışırlar. Ve nispeten yakın zamanda, bu mineraller tamamen beklenmedik bir kullanım bulmuşlardır - tarımda kullanılmaya başlanmıştır.
Organosilikon bileşikleri - Moleküllerinin silikon ve karbon atomları arasında bir bağ olduğu bileşikler. Organosilikon bileşiklerine bazen, Latin silikon adıyla "silikon" adında silikon denir. Organosilikon bileşikleri yağlayıcılar, polimerler, lastikler, lastikler, silikon sıvıları ve emülsiyonları üretmek için kullanılır. Organosilikon bileşikleri kozmetiklerde, ev kimyasallarında, boyalarda ve verniklerde, deterjanlarda kullanılır. Yaygın organik bileşiklere dayanan ürünlerden organosilikon bileşiklerine dayanan ürünlerin ayırt edici bir özelliği, bir kural olarak, insan kullanımının güvenliğinin yanı sıra daha yüksek performans özellikleri ve özellikleridir. Silikon polimerler pişirme işleminde kalıp yapımında kullanılabilir. Organosilikon bileşiklerinin ve sızdırmazlık maddelerinin polimerizasyonu insanlar için güvenlidir ve ekstraksiyon gerektirmez.
siloksan - bir molekülde değişken silikon ve oksijen atomları içeren bileşikler. En yüksek molekül ağırlıklı siloksanlar - polyorganosiloksanlar; bkz. Silikon polimerler.
silikonlar (polyorganosiloksanlar) - n formülüne sahip oksijenli, yüksek moleküler ağırlıklı organosilikon bileşikleri, ki burada R = organik grup (metil, etil veya fenil). Şimdi bu tanım nadiren uygulanır ve polyorganosiloksanlara (örneğin, PMS tipi silikon yağları, NGL tipi su iticileri veya düşük moleküler ağırlıklı SKTN kauçukları) ve hatta organosilikon monomerleri (çeşitli silanlar), "silikonlar" ve "arasındaki ayrımı silerek birleştirilir. silikon. "
Metalik silikon  Kristal Silikon
Kristal Silikon
silikon (Si). Bu kimyasal element, yer kabuğunun bileşiminin 1 / 4'üdür. Kuvars, kaya kristali, kum, kil, granit, mika, asbest - tüm bunlar silikonun kimyasal bileşikleri
Silikon bir ara elementtir (amfoterik) ve hem metalik hem de metalik olmayan özellikler gösterebilir. Hem metal hem de metal olmayan kimyasal bileşikler oluşturabilir.
Saf silikon - Gri renkli, sert, refrakter ve kırılgan kimyasal olarak basit bir madde. Kristal Silikon Metalik bir parlaklığa sahiptir ve yarı iletken endüstrisinde yaygın olarak kullanılır (yarı iletkendir).
Silisyum kristal halde olduğu gibi gerilebilir ( kristalin silikon) ve amorf durumda ( şekilsiz silikon). Kristalimsi silikon, bir amorf silikon çözeltisinin erimiş bir metal içinde soğutulmasıyla oluşturulur. Sonuçta, kristalimsi silikon çok kırılgan bir malzemedir ve kolayca şekilsiz bir toza ezilir. Böylece, şekilsiz silikon kristalin silisyum kristallerinin bir parçasıdır.
Serbest durumda, silikon elde etmek oldukça zordur. Endüstriyel üretimi, kimyasal formülü Si02 olan kuvarsın geri kazanılmasıyla ilişkilidir, indirgeme reaksiyonu sıcak kok (karbon) ile üretilir.
Si02 + C → C02 + Si
Laboratuvarda, saf silikon, aşağıdaki reaksiyon kullanılarak metalik magnezyum ile silika kumundan indirgenir:
Si02 + 2Mg → Si + 2MgO.
Bu reaksiyon sırasında, kahverengi bir şekilsiz silikon tozu oluşur. Isıtıldığında, toz konsantre alkali çözeltileri ile yavaş yavaş reaksiyona girebilir (örneğin, sodyum hidroksit NaOH)
Si + 2NaOH + H20 → Na2 SiO3 + 2H2, - elde edilen kompleks madde - aynı zamanda sıvı cam olarak da adlandırılır.
Silikonun kimyasal aktivitesinin kristallerinin boyutuna bağlı olması ilginçtir. Eş-kristalli silikon, şekilsiz olandan daha az kimyasal olarak aktiftir. Sonuncusu, normal sıcaklıkta bile flor ile kolayca reaksiyona girer ve 400 - 600 ° C'lik bir sıcaklıkta, karşılık gelen kimyasal bileşikleri oluşturmak için oksijen, klor, brom, kükürt ile reaksiyona girer. Çok yüksek sıcaklıklarda, silikon, nitrat ve silisyum karbürü oluşturmak için sırasıyla nitrojen ve karbon ile reaksiyona girer.
Silikonu bir hidroflorik HF (hidroflorik) ve nitrik HNO3 asit karışımı içinde çözmeyi denerseniz, o zaman reaksiyon devam etmez. Ancak bir alkali ile, örneğin potasyum hidroksit ile kimyasal bir reaksiyon yaparsanız, reaksiyon silisik asit tuzunun oluşumu ile gerçekleşir.
Si + KOH → K2 SiO3 + H2
Fırın silikasında (kum) kokain ile kalsine edilirse, çok katı kristalli bir madde ortaya çıkar. korindon SiC
SiO 2 + 3C → SiC + 2CO
korindon - çok sert ve refrakter madde. Sanayide, bu özelliklerinden dolayı büyük miktarlarda üretilir. İlginç bir şekilde, karborundum kristal kafes, en sert maddenin - elmasın kafesine benzer, ancak içinde tek tek karbon atomları homojen olarak silikon atomları ile değiştirilir.
Yüksek sıcaklıklarda ve ayrıca asitlerin silikonlu metal bileşikler üzerindeki etkisi altında kimyasal reaksiyonlar sırasında, silan SiH4.
Cilan - Kendiliğinden tutuşan renksiz bir gazdır. Silika ve su oluşturmak için havada tutuşabilir.
SiH4 + 2O2\u003e → Si02 + 2H2O
Silisyum oksit Si02, bir klor akışında karbon varlığında ısıtılırsa, silikon klorür oluşumu ile kimyasal bir reaksiyon meydana gelir.
Si02 + 2C + 2 Cl2 → SiCl4 + 2CO
Silikon klorür - kaynama sıcaklığı sadece 54 ° C olan bir sıvıdır. Silisyum ve hidroklorik: silisik ve hidroklorik çözelti oluşumu ile silikon klorür suda kolayca çözülür
SiCl4 + H20 → H2 SiO3 + HC1
Bu kimyasal reaksiyon nemli bir hava atmosferinde ilerlerse, iki asit oluşumu sırasında kalın duman ortaya çıkacaktır.
Silikon florür SiF 4 - hidroflorik asit ve silikon oksitin kimyasal reaksiyonu sonucu oluşan
Si02 + 4HF → SiF 4 + 2H20
Silikon florür, "güçlü" bir kokuya sahip renksiz bir gazdır. Silisyum kloridin yanı sıra, su içinde bu gaz iki asit oluşturur: silisyum ve hidroflorik. Ancak ilginç bir şekilde, silikon florür, oluşturmak üzere hidroflorik asit ile etkileşime girebilir heksaflorosilik asit kimyasal formülü H2 SiF6'dır. Tuzları ve asidin kendisi zehirlidir.
silikon
Baz metaller ve metal olmayanlar
Bu derste "Silikon" konusunu inceleyeceksiniz. Silisyum hakkında bilgi edinin: silisyumun doğasında bulunduğu elektronik yapısı, silisyum allotropisini inceleyin, fiziksel ve kimyasal özelliklerini açıklayın. Silisyumun endüstride ve diğer alanlarda nerede kullanıldığını, nasıl üretildiğini öğrenin. Silikalar, silisik asit ve bunun tuzları - silikatlar ile tanışacaksınız.
Konu: Baz metaller ve metal olmayanlar
Ders: Silikon. Soy gazlar
Silikon, yer kabuğunda en yaygın kimyasal elementlerden biridir. İçeriği neredeyse% 30'dur. Doğada, çoğunlukla çeşitli silikon dioksit formları, silikatlar ve alüminosilikatlar şeklinde bulunur.
Silisyum hemen hemen bütün bileşiklerinde dört değerlidir. Bu durumda, silikon atomları uyarılmış durumdadır. Şek. 1.
Bu duruma geçmek için, 3s elektronlarından biri 3p orbitalleri üzerinde boş bir yer tutmaktadır. Bu durumda, zemin durumundaki 2 eşlenmemiş elektron yerine, uyarılmış durumdaki silikon atomunun 4 eşlenmemiş elektronu olacaktır. Değişim mekanizması ile 4 kovalent bağ oluşturabilecektir.


Silikon atomları çoklu bağların oluşumuna eğilimli değildir, ancak tek bağ-Si-O- içeren bileşikler oluşturur. Silisyum, karbonun aksine, allotropinin tipik bir örneği değildir.
Biri allotropik modifikasyon kristalin silikondurher bir silikon atomunun sp3 hibridizasyonunda olduğu. Şek. Kristalin silikon, metalik bir parlaklığa sahip koyu gri bir katı, dirençli ve dayanıklı kristalimsi maddedir. Normal şartlar altında - yarı iletken. Bazen, şekilsiz silikon, silikonun başka bir allotropik modifikasyonu olarak da salınır. Kristalin silikondan daha kimyasal olarak aktif koyu kahverengi bir tozdur. Allotropik bir modifikasyon olup olmadığı bir tartışma noktasıdır.
Silisyumun kimyasal özellikleri
1. Halojenlerle etkileşim
Si + 2F 2 → SiF 4
2. Isıtıldığında silikon oksijende yanar, silika (IV) oluşur.
Si + O 2 → SiO 2
3. Yüksek sıcaklıklarda, silikon azot veya karbon ile etkileşime girer.
3Si + 2N 2 → Si 3 N 4
4. Silikon, sulu asit çözeltileriyle reaksiyona girmez. Ancak alkalilerde çözünür.
Si + 2NaOH + H20 → Na2 SiO3 + 2H2
5. Silisyum metallerle birleştiğinde silisitler oluşur.
Si + 2Mg → Mg2Si
6. Silisyum doğrudan hidrojenle etkileşime girmez, ancak silisyumların suyla etkileşimi ile silisyum hidrojen bileşikleri elde edilebilir.
Mg2Si + 4H20 → 2Mg (OH) 2 + SiH4 (silan)
Silanlar yapı olarak alkanlara benzer, ancak oldukça reaktifdir. En kararlı monosilan havada yanıcıdır.
SiH 4 + 2 O 2 → SiO 2 + 2H 2 O
Silikon almak
Silisyum oksitten (IV) indirgenerek silikon elde edilir.
SiO 2 + 2Mg → Si + 2MgO
Görevlerden biri yüksek saflıkta silikon elde etmektir. Bu amaçla, teknik silikon silikon tetraklorüre aktarılır. Elde edilen tetraklorür silan'a indirgenir ve silan ısıtıldığında silikon ve hidrojene ayrıştırır.
Silisyum iki oksit oluşturabilir: Si02 - silisyum oksit (IV) ve Si02 - silisyum oksit (II).
siO - silikon oksit (II) - bu, silisyumun silisyum oksitle (IV) etkileşimi sonucu oluşan şekilsiz koyu kahverengi bir maddedir.
si + SiO 2 → 2 SiO.
Kararlılığına rağmen, bu madde neredeyse hiç kullanılmıyor.
siO 2 - silikon oksit (IV)


Bu madde yer kabuğunun% 12'sini oluşturur. Şek. 4. Kaya kristali, kuvars, ametist, sitrin, jasper, kalsedon gibi minerallerle temsil edilir. Şek. 5.
Si02 - silikon oksit (IV) - moleküler olmayan bir yapı maddesidir.
Kristal kafesi atomiktir. Şek. 6. Si02 kristalleri, oksijen atomları ile birbirine bağlanmış bir tetrahedron formuna sahiptir. (Si02) n molekülünün formülü daha doğru olacaktır. Si02, bir atomik yapı maddesi ve moleküler bir yapının C02 - 'yi oluşturduğundan, özelliklerindeki fark açıktır. C02 bir gazdır ve Si02 suda çözünmeyen ve refrakter bir katı şeffaf kristalimsi maddedir.
Kimyasal özelliklerisiYaklaşık 2
1. Silisyum oksit (IV) Si02 bir asit oksittir. Su ile reaksiyona girmez. Silisik asit, Si02'nin hidrasyonu ile elde edilemez. Tuzları, silikatları, Si02'nin sıcak alkali çözeltileri ile reaksiyona sokulmasıyla elde edilebilir.
Si02 + 2NaOH Na2Si3 + H20
2. Alkali ve toprak alkali metallerin karbonatlarıyla reaksiyona girer.
CaCO 3 + SiO 2 CaSiO 3 + CO 2
3. Metallerle etkileşime girer.
SiO 2 + 2Mg → Si + 2MgO
4. Hidroflorik asit ile reaksiyon.
Si02 + 4HF → SiF 4 + 2H20
SiF 4 + 2HF → H 2
Silisik asit ve silikatların kimyasal özellikleri
Silisik asit almak
Silisik asit, polimerik bir bileşik olarak çökelir. Silisik Asit Formülleri -
H2 SiO3 (meta form) ve H4 SiO4 (orto form) - elementlerin oranını yansıtır, fakat gerçek kompozisyonu yansıtmaz. Geleneksel olarak, düzlemde, silisik asit bileşimi Şekil l'de tasvir edilmiştir. 7.
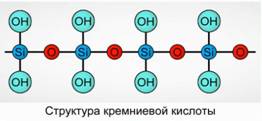
Silisik asit için, H2 Si03 formülü her zaman kullanılır.
1. 'H 2 SiO 3 ısıtıldığında ayrışır
H 2 SiO3H20 + SiO2 (silika jeli)
2. Alkali çözeltilerle etkileşime girer
H 2 SiO3 + 2NaOH Na2Sio3 + 2H20
Silisik asit tuzları - silikatlar - İyonik bileşiklere bakın. Bunlar katı renksiz maddelerdir. Sadece alkali metal silikatlar, lityum hariç, suda çözünürler.
1. Çözünebilir silikatlar anyon ile hidrolize edilir
Na2Sio3 + H20 ⇆ NaHSio3 + NaOH
2. Çözünebilir silikatlar güçlü asitlerle etkileşime girer.
Na2 SiO3 + 2HCl → H2 SiO3 ↓ + 2NaCl
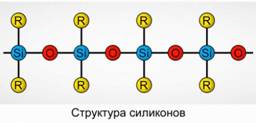
Polyorganosiloksanlar (silikonlar)
Polyorganosiloksanlar (silikonlar) oksijenli, yüksek moleküler ağırlıklı organosilikon bileşiklerdir.
R, 2 [ SiO] n
R bir organik gruptur (metil, etil veya fenil). Siloksanların yapısının temeli, değişen silikon atomları ve oksijen zinciridir. Şekil 8,. Zincir ve organik grupların uzunluğu değiştirilerek, farklı özelliklere sahip silikonlar elde edilebilir. Polimerizasyon koşullarını değiştirerek, farklı uzunluklarda moleküller elde edebilirsiniz.


Kısa zincirli polimerler sıvıdır, daha uzun olanlar değerli yağlayıcılardır. Şek. 9, özelliklerini çok geniş bir sıcaklık aralığında tutar.
100 0 to ile + 300 С arasındadır. Uzun moleküller düşük sıcaklıklarda esnekliğini kaybetmeyen kauçuklar oluşturur. Yıpranmaya karşı yüksek direnç gösterir, kimyasal olarak etkisizdir. Şek. 10. Uygulamalarının çeşitli değişkenlerine neden olur. Yapay kalp veya böbrek makineleri oluşturmak için kullanılabilirler ve ayakkabılar için ayakkabı olarak kullanılabilirler. Siloksan polimerler tıpta çeşitli yumuşak doku implantları oluşturmak için kullanılır, çünkü bu polimerler kimyasal olarak inert ve vücut tarafından reddedilmez. Su ile nemlendirilmezler. Kremlerde kullanılır. Bu kremi ellerine uygularken lastik eldivenlerin yerini alacak.
İnorganik Bahçe
Sodyum silikatla doldurulmuş şeffaf bir beherde renkli tuzların kristallerini, örneğin bakır sülfatı daldırın. Bir süre sonra, çözünmeyen silikatlardan oluşan kristallerden oluşan ince oyuk tüplerin görülebildiği görülmektedir. Şek. 11.

"Aptal" macun alıyorum
Eşit miktarda sodyum silikat ve tıbbi alkol karıştırılır. Çökelti, alkol damlatılmaması için filtrelenir ve sıkılır. Bu macun. Şek. 12. İsmi, pencereler için macun olarak kullanılması planlandığı için adlandırılmıştır. Ancak, amaçlanan amaç için kullanılamadığı özelliklere sahip olduğu ortaya çıktı. Topu yuvarlar ve yere atarsanız, bir lastik top gibi zıplar. Masaya konulursa, sıvı gibi yayılır. Katı bir nesneye çarparsanız, katı bir gövde gibi paramparça olur. Bir süre sonra, alkol kuruduğunda, bu macun parçalanacaktır.
![]()
Dersi özetliyor
Bu derste, "Silikon" konusunu okudunuz. Silisyum hakkındaki bilgileri inceledik: silisyumun doğada bulunduğu elektronik yapısı silisyumun allotropisini inceledi, fiziksel ve kimyasal özelliklerini açıkladı. Sanayinin ve diğer alanlarda silisyumun nerede kullanıldığını, nasıl üretildiğini öğrendiler. Silikalarla, silisik asitlerle ve tuzlarıyla tanışmıştınız.
Referanslar
1. Rudzitis G.E. Kimya. Genel kimyanın temelleri. 11. Sınıf: Eğitim kurumları için ders kitabı: temel seviye / G.E. Rudzitis, F.G. Feldman. - 14. baskı - M: Aydınlanma, 2012.
2. Popel P.P. Kimya: 8 cl .: Ortaokullar için ders kitabı / PP. Popel, L.S. - Yay.: “Akademi”, 2008. - 240 s .: Hasta.
3. Gabrielyan O.S. Kimya. 11. sınıf Temel seviye 2. baskı, Sr. - M: Drofa, 2007. - 220 s.
ödev
1. -2-4 (s. 138) Rudzitis G.E. Kimya. Genel kimyanın temelleri. 11. Sınıf: Eğitim kurumları için ders kitabı: temel seviye / G.E. Rudzitis, F.G. Feldman. - 14. baskı - M: Aydınlanma, 2012.
2. Polyorganosiloksanların uygulamaları nelerdir.
3. Silisyumun allotropik modifikasyonlarının özelliklerini karşılaştırın.
