Seritë gjenetike të shembujve jo-metale. Marrëdhëniet gjenetike midis klasave të substancave - Hipermarketi i njohurive
Ekziston një lidhje gjenetike midis substancave të thjeshta, oksideve, bazave, acideve dhe kriprave, përkatësisht mundësinë e tranzicionit të tyre të ndërsjellë (transformim).
Për shembull, një substancë e thjeshtë - kalciumi si rezultat i ndërveprimit me oksigjenin kthehet në oksid: 2Ca + O 2 = 2CaO.
Oksid kalciumi, kur bashkëvepron me ujin, formon hidroksid kalciumi CaO + H2O = Ca (OH) 2, dhe ky i fundit, kur bashkëveproon me acidin, kthehet në një kripë: Ca (OH) 2 + H2SO4 = CaSO4 + 2H2O.
Këto transformime mund të përfaqësohen nga skema:
Ca → CaO → Ca (OH) 2 → CaSO 4
Një skemë e ngjashme mund të shkruhet për jo metal, për shembull, squfur:
S → SO 3 → H 2 SO 4 → CaSO 4
Pra, e njëjta kripë është marrë në mënyra të ndryshme.
Kalimi i kundërt nga kripërat në klasa të tjera të përbërjeve inorganike dhe substancave të thjeshta është gjithashtu e mundur:
CuSO 4 → Cu (OH) 2 CuO Cu
CuSO 4 + 2NaOH = Cu (OH) 2 ↓ + Na2SO4
Cu (OH) 2 = CuO + H2O
CuO + H2 = Cu + H2O (reduktimi i bakrit)
Një marrëdhënie e ngjashme midis klasave të përbërësve inorganikë, bazuar në prodhimin e substancave të një klase nga substancat e një tjetri, quhet gjenetik.
Vetitë e komponimeve komplekse reflektohen në skemën gjenetike të klasave kryesore të përbërjeve inorganike (shih figurën). Ajo pasqyron fazat e zhvillimit të lëndës inorganike përgjatë dy linjave kryesore, nga metale tipike tek ato jo-metale tipike me vetitë e kundërta.
Metale, pasuria kimike e të cilit është një atom, është aftësia për të dhuruar elektronet dhe jo-metale, prania kimike kryesore e të cilave është aftësia e atomeve të tyre për të bashkangjitur elektronet të kundërta me njëri-tjetrin në vetitë. Me ndërlikimin e përbërjes së substancave, këto tendenca kundërshtare vazhdojnë të shfaqen.
Metalet tipike dhe elementet e tranzicionit në gjendjen më të ulët të oksidimit formojnë oksidet bazë, ndërsa jo-metale tipike dhe elementët e tranzicionit në gjendje të lartë oksidimi formojnë oksidet e kundërta.
Substanca të thjeshta
amphoteric
Jo-metale
Oksidet themelore
amphoteric
acid
arsyet
amphoteric
hydroxides
Skema gjenetike e klasave kryesore të përbërjeve inorganike
Me ndërlikime të mëtejshme të përbërjes së substancave formohen hidrokside, oksidet bazë që korrespondojnë me bazën, dhe oksidet acid që korrespondojnë me acidin. Bazat e kundërta në pronat dhe acid reagojnë në mënyrë aktive me njëri-tjetrin, duke formuar kripëra. Ndërveprimi i të kundërtave është forca shtytëse e reagimit. Prandaj, oksidet, bazat dhe acidet themelore dhe acide në mënyrë aktive bashkëveprojnë me njëri-tjetrin dhe dy okside acid ose dy okside bazë nuk ndërveprojnë, pasi që pronat e tyre janë të ngushta.
Kështu, vetitë e një kompleksi kompleks përcaktohen në bazë të vetive të elementeve përbërëse të tij. Ligjet kryesore të ndryshimit të këtyre pronave përmblidhen në aplikimet e mëposhtme (Tabela 6).
1. Në periudhat me një rritje në numrin e sekuencës, vetitë e elementeve ndryshojnë nga metalet në jo metalet. Numri i elektroneve në nivelin e jashtëm rritet, shkalla e oksidimit të elementit rritet, rrezja e atomit dhe joneve zvogëlohet, energjia e jonizimit dhe afiniteti për rritjen e elektronit. Në përputhje me këtë, zvogëlimet bazë dhe vetitë acidike të oksideve dhe hidroksideve rriten.
2. Në nëngrupet kryesore, vetitë themelore të oksideve dhe hidroksideve rriten me rritjen e numrit atomik. Për elementët e grupeve anësore me një rritje në numrin e rendit, është karakteristikë një ndryshim më kompleks në pronat. Së pari, pronat metalike rriten dhe pastaj reduktohen.
3. Metale aktive korrespondojnë me oksidet dhe hidroksidet me pronat themelore të theksuara fort. Metale më aktive janë alkali dhe toka alkaline. Ato formojnë okside të tretshme në ujë dhe baza të fortë të tretshëm - alkaline.
4. Metale me aktivitet të ulët (të gjithë por tokë alkaline dhe alkaline) formojnë baza të dobëta që janë të vështira për t'u shpërndarë në ujë:
Cu (OH) 2, Fe (OH) 3.
5. Oksidet dhe hidroksidet me pronat e theksuara fort të acidit korrespondojnë me jo-metale aktive.
6. Metalet amfoterike formojnë okside dhe hidrokside amfoterike.
7. Nëse një element shfaq shkallë të ndryshme të oksidimit, atëherë oksidet dhe hidroksidet me vetitë e ndryshme korrespondojnë me të.
Tema: Lidhje gjenetike mes metaleve dhe jo-metaleve dhe përbërjeve të tyre. Klasa e 9-të
Objektivat: edukimi: konsolidimi i konceptit të "serisë gjenetike", "lidhjes gjenetike"; mësojnë se si të bëjnë seri gjenetike të elementeve (metale dhe jo-metale), për të kompletuar ekuacionet e reagimit që korrespondojnë me serinë gjenetike; kontrolloni se si është mësuar dija kimike oksidet, acidet, kripërat, bazat, zhvillimi: për të zhvilluar aftësinë për të analizuar, krahasuar, përmbledhur dhe nxjerrë përfundime, përbëjnë ekuacionet e reaksioneve kimike; edukative: për të promovuar formimin e një botëkuptimi shkencor.
Sigurimi i klasave: tabelat "Sistem periodik", "Tabela e tretshmërisë", "Seria e aktiviteteve të metaleve", udhëzime për studentët, detyra për testimin e njohurive.
Progresi: 1) Org. momenti
2) Kontrolloni d / s
3) Studioni materiale të reja
4) Mbërthimi
5) D / C
1) Org. momenti. Mirëpritur.
2) Kontrolloni d / s.
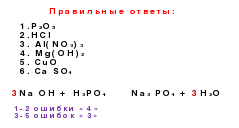
Lidhjet gjenetike janë lidhjet mes klasave të ndryshme bazuar në ndërkonversionet e tyre.
Duke ditur klasat e substancave inorganike, është e mundur të kompletohet seria gjenetike e metaleve dhe jo-metale. Baza e këtyre serive është e njëjta element.
Midis metaleve ekzistojnë dy lloje rreshta:
1
. Një seri gjenetike në të cilën alkali vepron si një bazë. Kjo seri mund të përfaqësohet duke përdorur transformimet e mëposhtme:metal → oksid bazë → alkali → kripë
Për shembull, K → K
2 O → KOH → KCl2
. Seria gjenetike, ku baza është një bazë e pazgjidhshme, atëherë seria mund të përfaqësohet si një zinxhir transformimesh:metal → oksid bazë → kripë → bazë pazgjidhshëm →
→oksidi bazë → metal
Për shembull, Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu
1
. Seria gjenetike e jo-metale, ku acid i tretshëm vepron si një lidhje në seri. Zinxhiri i transformimeve mund të përfaqësohet si vijon:jo-metal → oksid acid → acid i tretshëm → kripë
Për shembull, P → P
2 O 5 → H 3 PO 4 → Na 3 PO 42
. Seria gjenetike e jo-metale, ku acidi i pazgjidhshëm vepron si një lidhje në seri:jo-metal → oksid acid → kripë → acid →
→oksid acid → jo-metal
Për shembull
si→ Sio 2 → na 2 Sio 3 → H 2 Sio 3 → Sio 2 → si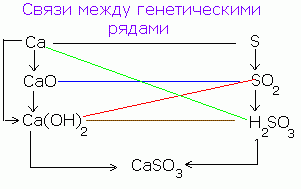
Biseda frontale në:
Cila është lidhja gjenetike Lidhjet gjenetike janë lidhjet midis klasave të ndryshme bazuar në ndërkonversionet e tyre. Çfarë është një seri gjenetike?
Seritë gjenetike - një sërë substancash - përfaqësues të klasave të ndryshme, të cilat janë komponimet e një elementi kimik, të lidhura me ndërkonversione dhe duke pasqyruar transformimet e këtyre substancave. Baza e këtyre serive është e njëjta element.
Cilat lloje të serive gjenetike mund të dallohen? Në mesin e metaleve, mund të dallohen dy lloje të serive:
a) Një seri gjenetike në të cilën alkali vepron si një bazë. Kjo seri mund të përfaqësohet duke përdorur transformimet e mëposhtme:
metal → oksid bazë → alkali → kripë
për shembull, seritë gjenetike të kaliumit K → K
2 O → KOH → KClb) Seria gjenetike, ku baza është një bazë e pazgjidhshme, atëherë seria mund të përfaqësohet si një zinxhir transformimesh:
metal → oksid bazë → kripë → bazë pazgjidhshëm → oksid bazë → metal
për shembull: Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → CuMidis jo-metaleve është gjithashtu e mundur të dallohen dy lloje rreshta:
a) Seritë gjenetike të jo-metale, ku acid i tretshëm vepron si një lidhje në seri. Zinxhiri i transformimeve mund të përfaqësohet si vijon: jo-metal → oksid acid → acid i tretshëm → kripë.
Për shembull: P → P
2 O 5 → H 3 PO 4 → Na 3 PO 4b) Rreshti gjenetik i jo-metale, ku acid i pazgjidhshëm: jo-metal → oksid acid → kripë → acid → oksid acid → jo-metal vepron si një lidhje në seri
Për shembull: Si → SiO
2 → Na 2 Sio 3 → H 2 Sio 3 → SiO 2 → SiEkzekutimi i detyrave për opsionet:
1. Zgjidhni formulat e oksidit në versionin tuaj, shpjegoni zgjedhjen tuaj, bazuar në njohjen e karakteristikave të përbërjes së kësaj klase përbërësish. Thirrni ato.
2. Në kolonën e formulës të variantit tuaj, gjeni formula të acidit dhe shpjegoni zgjedhjen tuaj bazuar në analizën e përbërjes së këtyre përbërjeve.
3. Përcaktoni valencat e mbetjeve acide në përbërjen acid.
4. Zgjidhni formulat e kripës dhe emërtoni ato.
5. Bëni formulat e kripërave, të cilat mund të formohen me magnez dhe acide të variantit tuaj. Shkruani ato, emërtoni atë.
6. Në kolonën e formulës së variantit tuaj, gjeni formula bazë dhe shpjegoni zgjedhjen tuaj bazuar në analizën e përbërjes së këtyre përbërjeve.
7. Në variantin tuaj, zgjidhni formulat e substancave me të cilat mund të reagojë një zgjidhje e acidit ortofosforik (klorhidrik, sulfurik). Bëni ekuacionet e përshtatshme të reagimit.
9. Në mesin e formulat e opsionit tuaj, zgjidhni formulat e substancave që mund të ndërveprojnë me njëri-tjetrin. Bëni ekuacionet e përshtatshme të reagimit.
10. Bëni një zinxhir të lidhjeve gjenetike të përbërjeve inorganike, të cilat do të përfshijnë një substancë, formula e së cilës jepet në versionin tuaj në numrin një.
Opsioni 1
Opsioni 2
CaO
HNO
3Fe (OH)
3N
2 OZn (NO
3 ) 2Cr (OH)
3H
2 SO 3H
2 SPbO
LiOH
Ag
3 PO 4P
2 O 5NaOH
ZnO
CO
2BaCl
2HCl
H
2 CO 3H
2 SO 4CuSO
4Nga këto substanca të bëjë një linjë gjenetike duke përdorur të gjitha formulat. Shkruani ekuacionet e reagimit me të cilat mund të arrini këtë zinxhir transformimesh:
Opsioni I: ZnSO
4, Zn, ZnO, Zn, Zn (OH) 2 : II opsioni:na 2 SO 4, NaOH, na, na 2 O 2 , na 2 O4) Mbërthimi1.
Al→ Al 2 O 3 → ALCL 3 → Al( OH) 3 → Al 2 O 32.
P→ P 2 O 5 → H 3 PO 4 → na 3 PO 4 → Ca 3 ( PO 4 ) 23. Zn → ZnCl
2 → Zn (OH) 2 → ZnO → Zn (NO 3 ) 24. Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu5.N
2 O 5 → HNO 3 → Fe (NO 3 ) 2 → Fe (OH) 2 → FeS → FeSO 45) Detyrat e shtëpisë:
tregoni një kalim gradual nga kalciumi në karbonat kalciumi dhe përgatitni një raport mbi përdorimin e ndonjë kripe në mjekësi (duke përdorur literaturë shtesë).

Midis metaleve, mund të dallohen dy lloje rreshta: 1. Seritë gjenetike, në të cilat alkali vepron si bazë. Kjo seri mund të përfaqësohet nga transformimet e mëposhtme: metali - oksidi bazë - alkali - kripë, për shembull, seritë gjenetike të kaliumit K - K 2 O - KOH - KCl.

2. Një seri gjenetike, ku një bazë e pazgjidhshme vepron si një bazë, atëherë seria mund të përfaqësohet si një zinxhir transformimesh: metal - oksid bazë - bazë kripë - pazgjidhshëm - oksid bazë - metal. Cu - CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e Cu seri gjenetike e bakrit "\u003e Cu është një seri gjenetike bakri"\u003e "title =" (! LANG: 2. Seritë gjenetike, ku baza është një bazë e pazgjidhshme, atëherë seritë mund të përfaqësohen si një zinxhir transformimesh: metal - bazë oksid - baza e pazgjidhshme e kripës - oksidi kryesor është metal Cu - CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e"> title="2. Një seri gjenetike, ku një bazë e pazgjidhshme vepron si një bazë, atëherë seria mund të përfaqësohet si një zinxhir transformimesh: metal - oksid bazë - bazë kripë - pazgjidhshëm - oksid bazë - metal. Cu - CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e"> !}
Në mesin e jo-metaleve është gjithashtu e mundur të dallohen dy lloje rreshta: 1. Seria gjenetike e jo-metale, ku acid i tretshëm vepron si një lidhje në seri. Zinxhiri i transformimeve mund të përfaqësohet si më poshtë: acid jo-metalik-acid i tretshëm - -sol. P - P 2 O 5 - H 3 PO 4 - Na 3 PO 4. Fosfori Gjenetik Gjenetik

Ekziston një lidhje gjenetike midis klasave të përbërjeve inorganike. Nga substanca të thjeshta ju mund të merrni komplekse dhe anasjelltas. Nga komponimet e një klase, ju mund të merrni komponimet e një klase tjetër.
Marrëdhënia gjenetike e thjeshtuar mes klasave të përbërësve inorganikë mund të përfaqësohet nga skema e mëposhtme:
Sekuenca e transformimeve të tilla për jo-metale mund të përfaqësohet nga skema e mëposhtme: CANPO 4
Р → Р 2 О 5 → Н 3 РО 4 → Са 3 (РО 4) 2
(Saon) 3 PO 4
Për metalet tipike mund të bëni zinxhirin transformues të mëposhtëm:
Ba → BaO → Ba (OH) 2 → BaSO 4
Për metalet e të cilëve oksidet dhe hidroksidet janë amfoterike (semimetale), transformimet e mëposhtme mund të kryhen:
Al → Al2O3 → Al (OH) 3 → Na → AlCl3 → AlOHCl2 → Al (OH) 3 → Al2O3.
Lidhjet midis klasave:
1. Metale, jo-metale→ kripe.
Me ndërveprimin e drejtpërdrejtë të metaleve dhe jo-metale, formohen kripërat e acideve (halide, sulfide) pa oksigjen:
2Na + C1 2 = 2NaCl
Këto komponime janë të qëndrueshme dhe nuk treten kur nxehen.
2. Oksidet themelore, oksidet acid→ kripe.
CaO + CO 2 = CaCO3;
Na2O + SO3 = Na2SO4.
3. Bazat, acidet→ kripe.
Ajo kryhet nëpërmjet një reagimi neutralizimi:
2NaOH + H2SO4 = Na2S04 + 2H20,
HE - + H + → H 2 O;
Mg (OH) 2 + 2HC1 = MgCl2 + 2H20,
Mg (OH) 2 + 2H + → Mg 2+ + 2H 2 O.
4. Metale→ oksidet bazë.
Shumica e metaleve ndërveprojnë me oksigjen për të formuar okside:
2Ca + O2 = 2CaO;
4A1 + 3O 2 = 2A1 2 O 3.
Ari, argjendi, platini dhe metalet e tjera fisnike nuk ndërveprojnë me oksigjen, oksidet e metaleve të tilla merren indirekt.
5. Jo metalet→ okside acid.
Jo metalet (me përjashtim të halogjeneve dhe gazeve fisnike) ndërveprojnë me oksigjenin, duke formuar okside:
4P + 5O2 = 2P 2 O 5;
S + O 2 = SO 2.
6. Oksidet themelore→ bazë.
Ndërveprimi i drejtpërdrejtë me ujin mund të merret vetëm hidroksidet e metaleve alkaline dhe alkaline (alkali):
Na2O + H2O = 2NaOH;
CaO + H2O = Ca (OH) 2.
Baza e mbetur merret në mënyrë indirekte.
7. Oksidet acide→ acid.
Oksidet acide reagojnë me ujë për të formuar acidet përkatëse:
SO3 + H2O = H2SO4;
₂O 5 + 3H 2 O = 2H 3 PO 4.
Përjashtim është SiO 2, i cili nuk reagon me ujë.
8. Bazat, oksidet acid→ kripe.
Alkalet ndërveprojnë me okside acidike për të formuar kripërat:
2NaOH + SO3 = Na2S04 + H2O,
2OH - + SO3 = SO4 2- + H2O;
Ca (OH) 2 + SO 2 = CaCO 3 ↓ + Н 2 O,
Ca 2+ + 2OH - + CO 2 → CaCO 3 ↓ + H 2 O.
9. Acidet, oksidet bazë→ kripe.
Oksidet metalike shpërndahen në acide, duke formuar kripëra:
CuO + H2SO4 = CuSO4 + H2O,
CuO + 2H + = Cu2 + + H20;
Na2O + 2HS1 = 2NaCl + H2O,
Na2O + 2H + = 2Na + + H2O.
10. Baza→ oksidet bazë.
Bazat e pazgjidhura dhe LiOH dekompozohen kur nxehet:
2LiOH = Li 2 O + H 2 O;
Cu (OH) 2 = CuO + H2O.
11. Acidet→ okside acid.
Acidet e paqëndrueshme të oksigjenit treten kur nxehen (H 2 SiO 3) dhe madje edhe pa ngrohje (H2CO3, HClO). Në të njëjtën kohë, një numër i acideve janë rezistente ndaj ngrohjes (H2SO4, H3PO4).
H 2 SiO 3 = H 2 O + SiO 2;
H2CO3 = H2O + CO2.
12. Oksidet e metaleve→ metale.
Disa okside të metaleve të rënda mund të treten në metal dhe oksigjen:
2HgO = 2Hg + O2.
Gjithashtu, metalet merren nga oksidet përkatëse me ndihmën e agjentëve reduktues:
3MnO 2 + 4Al = 3Mn + 2Al 2 O 3;
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O.
13. Oksidet acide→ jo-metale.
Shumica e oksideve jo metalike nuk treten kur nxehen. Jo-metali dhe oksigjeni treten vetëm disa okside të paqëndrueshme (okside halogjeni).
Disa jo-metale merren me reduktim nga oksidet përkatëse:
SiO 2 + 2Mg = 2MgO + Si.
14. Kripërat, bazat → bazat.
Bazat e pazgjidhura merren nga veprimi i alkaleve në zgjidhjet e acideve përkatëse:
CuSO 4 + 2NaOH = Cu (OH) 2 ↓ + Na2SO4,
Cu 2+ + 2OH - → Cu (OH) 2 ↓;
FeCl2 + 2KOH = Fe (OH) 2 ↓ + 2KCl,
Fe 2+ + 2OH - = Fe (OH) 2 ↓.
15. Kripërat, acidet → acidet.
Kripërat e tretshme reagojnë me acide (në përputhje me serinë presion) nëse rezultati është një acid i dobët ose i paqëndrueshëm:
Na 2 SiO 3 + 2HCl = 2NaCl + H 2 SiO 3 ↓,
SiO 3 2- + 2H + → H 2 SiO 3 ↓;
NaCl (s.) + H2SO4 (k) = NaHSO4 + HCl.
16. Sallat→ oksidet bazë, oksidet acid.
Kripërat e disa acideve që përmbajnë oksigjen (nitratet, karbonatet) treten kur nxehet:
CaCO3 = CaO + CO2;
2Cu (NO3) 2 = 2CuO + 4NO2 + O2.
SHKOLLAT PËR PUNË TË PAVARUR MBI TOPIC "Lidhje gjenetike mes klasave të përbërësve inorganikë"
1. Emërtoni substancat e listuara më poshtë, shpërndajini ato në klasat e përbërjeve inorganike: Na 3 PO 4, H 2 SiO 3, NO, B 2 O 3, MgS, BaI 2, Ca (OH) 2, KNO 3, HNO 2, Cl 2 O 7, Fe (OH) 2, P 2 O 5, HF, MnO 2.
2. Nga substancat e listuara më poshtë është e mundur të sigurohet hidroksid (acid ose bazë) në një fazë: bakër, oksid hekuri (P), oksid barium, oksid azoti (P), oksid azoti (V), oksid silikoni, sulfat bakri, , kalium, karbonat magneziumi.
3. Nga lista e mësipërme shkruani formulat e substancave që lidhen me: 1) oksidet; 2) baza; 3) acide; 4) kripërat:
CO 2, NaOH, HCl, SO3, CuSO4, NaNO3, KCl, H2SO4, Ca (OH) 2, P2O5, HNO3, Al (OH) 3.
4. Emërtoni substancat: Zn (OH) 2, MgO, P2O3, NaHCO3, H3 PO3, Fe2 (SO4) 3, KOH, (AlOH) 3 (PO 4) 2, Ba (MnO4 ) 2, CO, HI. Tregoni se cila klasë i takon çdo substancë.
5. Shkruani formulat molekulare të substancave vijuese dhe tregoni cilën klasë secila substancë i përket:
1) bakër (II) hidroksokarbonat;
2) oksid azoti (V);
3) nikel (II) hidroksid;
4) barium hidrogjeni fosfat;
5) acid perklorik;
6) kromi (III) hidroksid;
7) klorati i kaliumit;
8) acid sulfid hidrogjen;
9) zinkat natriumi.
6. Jepni shembuj të reagimeve të lidhjes midis:
1) substanca të thjeshta - jo metalet;
2) substancë e thjeshtë dhe oksid;
3) okside;
4) substanca komplekse që nuk janë okside;
5) metal dhe jo-metal;
6) tre substanca.
7. Cila nga substancat e mëposhtme mund të reagojë:
1) monoksidi i karbonit (IV): HCl, O2, NO2, KOH, H20;
2) oksid magnezi: Ba (OH) 2, HCl, CO 2, O 2, HNO 3;
3) hekur (II) hidroksid: KCl, HCl, KOH, O2, H2O, HNO3;
4) klorid hidrogjeni: Zn, MgO, ZnCl2, HN03, Ca (OH) 2, Cu, (ZnOH) Cl.
8. A është e mundshme ndërveprimi ndërmjet substancave të mëposhtme?
1) monoksid karboni (IV) dhe hidroksid kaliumi;
2) hidrosulfat i kaliumit dhe hidroksid kalciumi;
3) fosfat kalciumi dhe acid sulfurik;
4) hidroksid kalciumi dhe oksidi squfuri (IV);
5) acid sulfurik dhe hidroksid kaliumi;
6) bikarbonat kalciumi dhe acid fosforik;
7) silicë dhe acid sulfurik;
8) oksidi i zinkut dhe oksidi i fosforit (V).
Shkruani ekuacionet e reagimeve të mundshme, specifikoni kushtet në të cilat ato ndodhin. Nëse reagimet mund të çojnë në substanca të ndryshme, atëherë tregoni se çfarë dallimi në kushtet e zbatimit të tyre.
9. Jepni ekuacionet e reagimeve për marrjen e substancave të mëposhtme: ortofosfat natriumi (4 mënyra), sulfati i kaliumit (7 mënyra), hidroksid zinku.
10. Një nga metodat për prodhimin e sodës (karbonat natriumi) është veprimi i ujit dhe monoksidit të karbonit (IV) në aluminat natriumi. Bëni ekuacionet e reagimit.
11. Ai ndryshon koeficientët, shkruan produktet e reagimit:
1) MgO + 2H2SO4 →
2) 2SO 2 + Ba (OH) 2 →
3) 3N 2 O 5 + 2Al (OH) 3 →
4) P 2 O 5 + 4NaOH →
5) P 2 O 5 + 6NaOH →
6) P 2 O 5 + 2NaOH →
12. Bëni ekuacionet e reagimeve për marrjen e llojeve të ndryshme të kripërave:
1) SO 2 + Ba (OH) 2 → (kripëra të mesme dhe acide),
2) A1 2 O 3 + H 2 O + HNO 3 → (kripëra e mesme, kripëra bazë),
3) Na2O + H2S → (kripëra të mesme dhe acide),
4) SO3 + Sa (OH) 2 → (kripera te mesme dhe baze),
5) CaO + H 2 O + P 2 O 5 → (kripë bazë, kripëra acid).
13. Plotësoni ekuacionet e reagimit:
CaO + A1 2O3 → CaHPO 4 + Ca (OH) 2 →
Cr2O3 + H2SO4 → AlOHSO4 + NaOH →
Cr 2 O 3 + NaOH → CaCO 3 + CO 2 + H 2 O →
A1 2 O 3 + HClO 4 → Ca (HCO 3) 2 + HCl →
Mn 2 O 7 + KOH → ZnS + H 2 S →
NO 2 + Ca (OH) 2 → CaSO 4 + H 2 SO 4 →
Zn (OH) 2 + NaOH → (ZnOH) Cl + HCl →
Zn (OH) 2 + HNO3 → Bi (OH) 3 + H2SO4 (i pamjaftueshëm) →
AlCl3 + NaOH (i mangët) → (FeOH) Cl + NaHS →
A1Cl3 + NaOH → Na2 ZnO2 + H2SO4 (e tepërt) →
AlCl3 + NaOH (e tepërt) → Ca (AlO2) 2 + HCl (e tepërt) →
14. Shkruani ekuacionet e reagimit me të cilat mund të kryeni transformimet e mëposhtme:
1) Cu → CuO → CuSO 4 → Cu (OH) 2 → CuC1 2 → Cu (JO 3) 2
2) Zn → ZnO → ZnSO4 → Zn (OH) 2 → Na2 ZnO2 → ZnCl2
3) Є → 2 0 5 → Н 3 РО 4 → 3 Д 4 Ш 3 (РО 4) 2 → Н 3 РО 4
4) Mg → MgO → MgCl2 → Mg (OH) 2 → Mg (HSO4) 2 → MgSO4
5) Ca → CaO → Ca (OH) 2 → CaCO3 → Ca (HCO3) 2 → CO 2
6) Cr → Cr2 (SO4) 3 → Cr (OH) 3 → NaSrO2 → Cr2O3 → K
7) P → P 2 O 5 → HPO 3 → H 3 PO 4 → NaH 2 PO 4 → Na 3 PO 4
8) CuS → CuO → CuSO4 → Cu (OH) 2 → CuO → Cu
9) Al → Al 2 O 3 → Al 2 (SO 4) 3 → Al (HSO 4) 3 → Al (OH) 3 → K
10) S → SO 2 → SO 3 → NaHSO 4 → Na 2 SO 4 → BaSO 4
11) Zn → ZnO → ZnCl2 → Zn → Na 2
12) Zn → ZnSO4 → ZnCl2 → Zn (OH) 2 → Na2 → Zn (NO3) 2
13) Ca → CaCl2 → CaCO3 → Ca (HCO3) 2 → Ca (NO3) 2
14) Ca → Ca (OH) 2 → CaCO3 → CaCl2 → CaCO3 → Ca (NO3) 2
15) CuO → CuCl2 → Cu (NO3) 2 → CuO → CuSO4 → Cu
16) CaO → Ca (OH) 2 → Ca (NO3) 2 → Ca (NO2) 2 → HNO2 → NaNO2
17) MgO → MgSO4 → MgCl2 → Mg (NO3) 2 → Mg (OH) 2 → MgO
18) SO 2 → H 2 SO 3 → KHSO 3 → K 2 SO 3 → KHSO 3 → SO 2
19) P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2 → Ca (H 2 PO 4) 2 → CaHPO 4
20) CO 2 → Ca (HCO3) 2 → CaCO3 → CaCl2 → Ca (NO3) 2 → CaSO4
21) PbO → Pb (NO3) 2 → PbO → Na2 PbO2 → Pb (OH) 2 → PbCl2
22) ZnO → ZnSO4 → Zn (OH) 2 → Na2 ZnO2 → Zn (OH) 2 → K 2
23) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → Al (OH) 3 → K
24) ZnSO4 → Zn (OH) 2 → ZnCl2 → Zn → ZnO → Zn (NO3) 2
25) AlCl3 → Al (NO3) 3 → Al (OH) 3 → NaAlO2 → A1C1 3 → Al
26) Pb (NO3) 2 → Pb (OH) 2 → PbO → Na2 PbO2 → Pb (OH) 2 → PbSO4
27) Fe 2 (SO 4) 3 FeCl 3 Fe (OH) 3 FeOH (NO 3) 2 Fe (NO 3) 3 Fe 2 O 3
28) K → KOH → KHSO 4 → K 2 SO 4 → KCl → KNO 3
29) Cu (OH) 2 CuOHNO 3 Cu (NO3) 2 CuSO4 CuCl2 Cu (NO3) 2
30) CaCl2 → Ca → Ca (OH) 2 → CaCl2 → Ca (NO3) 2 → CaSO4
31) Cu → Cu (NO3) 2 → Cu (OH) 2 → CuSO4 → Al2 (SO4) 3 → A1C1 3
32) Mg → MgSO4 → MgCl2 → MgOHC1 → Mg (OH) 2 → MgOHNO 3
33) CuSO4 → CuCl2 → ZnCl2 → Zn (OH) 2 → Na2 ZnO2 → Zn (OH) 2
34) Hg (NO3) 2 → Al (NO3) 3 → Al2O3 → NaAlO2 → Al (OH) 3 → AlOHCl2
35) ZnSO4 → Zn (OH) 2 → ZnCl2 → A1Cl3 → Al (OH) 3 → A1 2 O 3
36) CuCl2 → Cu (OH) 2 → CuSO4 → ZnSO4 → Zn (OH) 2 → Na2 ZnO2
37) Fe (NO3) 3 → FeOH (NO3) 2 → Fe (OH) 3 → FeCl3 → Fe (NO3) 3 → Fe
38) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → NaNO 3 → HNO 3
39) Mg (OH) 2 → MgSO4 → MgCl2 → Mg (NO3) 2 → Mg (OH) 2 → MgO
40) sulfat alumini → klorid alumini → nitrat alumini → oksid alumini → aluminat kaliumi → hidroksid alumini → hidroksid alumini → klorid alumini.
41) Na → NaOH → Na 3 PO 4 → NaNO 3 → HNO 3 → N 2 O 5
42) BaCO 3 → Ba (HCO 3) 2 → BaCO 3 → (BaOH) 2 CO 3 → BaO → BaSO 4
43) Cu → CuSO 4 → (CuOH) 2 SO4 → Cu (OH) 2 → Cu (HSO4) 2 → CuSO 4
44) barium → hidroksid barium → bikarbonat barium → klorid barium → karbonat barium → klorid barium → hidroksid barium
45) P → P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → CaHPO 4 → Ca 3 (PO 4) 2
46) Cr → CrO → Cr 2 O 3 → NaCrO 2 → CrCl 3 → Cr (OH) 3 → Cr 2 O 3 → Cr
47) Cr2O3 → CrCl3 → Cr (OH) 3 → Na3 → Cr2 (SO4) 3 → CrCl3
48) K → KOH → KCl → KOH → K 2 SO 4 → KNO 3 → KNO 2
49) S → FeS → H2S → SO2 → S → ZnS → ZnO → ZnCl2 → Zn (OH) 2 → K 2
50) C → CO 2 → CO → CO 2 → Ca (HCO3) 2 → CaCO3 → CaCl2
51) С → CO 2 → NaHCO 3 → Na 2 CO 3 → CO 2
52) S → SO 2 → K 2 SO 3 → KHSO 3 → K 2 SO 3
53) Cu → Cu (OH) 2 → Cu (NO3) 2 → CuO → Cu
54) 2 O 5 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2
55) Fe → FeCl2 → Fe (OH) 2 → FeSO4 → Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (NO3) 2 → ZnO
57) CuS → SO 2 → KHSO3 → CaSO3 → SO 2
58) SO 2 → H 2 SO 4 → CuSO 4 → CuO → Cu (JO 3) 2
59) KHSO3 → CaSO3 → Ca (HSO3) 2 → SO2 → K2SO4
60) SO 2 → CaSO 3 → SO 2 → NaHSO 3 → SO 2
61) NaHCO3 → Na2C03 → NaCl → NaHSO4 → Na2SO4
62) K → KOH → KCl → KNO 3 → K 2 SO 4 → KCl
63) NaCl → Na → NaOH → Na2SO4 → NaCl
64) Al → AlCl3 → Al (OH) 3 → A1 2 O 3 → Al (OH) 3
65) CuO → Cu → CuCl2 → CuSO4 → CuS
66) Fe → FeSO4 → Fe (OH) 2 → Fe → Fe (OH) 3
67) Fe → Fe (OH) 2 → FeCl2 → Fe (NO3) 2 → Fe
68) Fe (NO3) 3 → Fe2O3 → FeCl3 → Fe (NO3) 3 → Fe
69) CuO → CuSO 4 → Cu (OH) 2 CuO Cu
70) MgCO3 → MgO → MgCl2 → Mg (OH) 2 → Mg (NO3) 2
71) Mg → Mg (OH) 2 → MgSO4 → MgCO3 → Mg (HCO3) 2
72) CaO → Ca (OH) 2 → CaCl2 → CaCO3 → CO 2
73) CaCO3 → Ca (HCO3) 2 → CaCl2 → Ca (NO3) 2 → O2
74) FeS → Fe 2 O 3 → Fe (OH) 3 → Fe 2 (SO 4) 3 → FeCl 3
75) KS1 → K 2 SO 4 → KOH → K 2 CO 3 → KOH
76) CuS → CuO → Cu (OH) 2 → CuSO 4 → Cu
77) Fe → Fe (OH) 3 → Fe (NO3) 3 → FeCl3 → Fe2 (SO4) 3
78) CuSO 4 → CuO → Cu (NO3) 2 → CuO → CuS
79) ZnS → H2S → SO2 → Na2SO4 → NaOH
80) Al → Al (OH) 3 → A1 2 (SO 4) 3 → A1 2 O 3 → Al (OH) 3
81) CaCl2 → CaCO3 → Ca (HCO3) 2 → CaCO3 → CaSiO 3
82) S → ZnS → H2S → Ca (HSO3) 2 → SO2
83) Na2SO4 → NaCl → HCl → CaCl2 → Ca (NO3) 2
84) Na2SO3 → SO2 → H2SO4 → HCl → FeCl2
85) С → Na 2 CO 3 → CaCO 3 → CaSiO 3 → H 2 SiO 3
86) P → P 2 O 5 → Ca (H 2 PO 4) 2 → CaHPO 4 → H 3 PO 4
87) Al → A1 2 O 3 → Al (OH) 3 → A1C1 3 → A1 (JO 3) 3
88) HCl → CuCl2 → Cl2 → HCl → H 2
89) P 2 O 5 → Na 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4
90) NH 3 → NH 4 C1 → NH 3 ∙ H 2 O → NH 4 HCO 3 → NH 3
91) NH 4 C1 → KC1 → HCl → CuCl2 → Cu (OH) 2
92) NH 3 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → NH 3 → NH 4 JO 3
93) KOH → KHCO 3 → K 2 CO 3 → CO 2 → Ca (HCO 3) 2
94) Na → NaOH → NaHCO3 → Na2SO4 → NaOH
95) KNO 3 → K 2 SO 4 → KC1 → KNO 3 → KNO 2
96) Cl2 → KC1 → K 2 SO 4 → KNO 3 → KHSO 4
97) FeSO 4 → FeS → SO 2 → KHSO 3 → K 2 SO 4
98) KOH → Cu (OH) 2 → CuSO4 → Cu (OH) 2 → Cu
99) Fe 2 O 3 → FeCl 3 → Fe (OH) 3 → Fe (NO 3) 3 → Fe 2 O 3
100) Al → A1 2 O 3 → A1 (JO 3) 3 → A1 2 O 3 → Al (OH) 3
101) CaO → CaCO3 → CaSiO3 → Ca (NO3) 2 → O2
102) Cu → Cu (OH) 2 → Cu → CuSO 4 → CuCl2
103) H2S → SO2 → ZnSO4 → ZnS → ZnO
104) Cl 2 → NaCl → HCl → CuCl2 → CuO
105) Cl 2 → FeCl 3 → Fe 2 O 3 → Fe (OH) 3 → Fe (NO 3) 3
106) P 2 O 5 → Ca 3 (PO 4) 2 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2
107) ZnS → ZnO → Zn → ZnCl2 → Zn (NO3) 2
108) ZnO → ZnSO4 → Zn (NO3) 2 → ZnO → Zn (OH) 2
109) H 3 PO 4 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2
110) CaCO 3 → Na 2 CO 3 → Na 3 PO 4 → NaH 2 PO 4 → Ca 3 (PO 4) 2
111) CaCl2 → CaSO3 → Ca (OH) 2 → CaCl2 → Ca (NO3) 2
112) NaOH → Na2CO3 → NaHSO4 → NaNO3 → NaHSO4
113) Na 2 SiO 3 → Na 2 CO 3 → Na 2 SO 4 → NaCl → Na 2 SO 4
114) KNO 3 → KHSO 4 → K 2 SO 4 → KCl → Na 2 SO 4
115) SiO 2 → K 2 SiO 3 → H 2 SiO 3 → SiO 2 → CaSiO 3
116) Cu → CuCl2 → Cu (NO3) 2 → JO2 → HNO3
117) Ca (NO3) 2 → O2 → SiO2 → H2 SiO3 → SiO2
118) P → H 3 PO 4 → Ca 3 (PO 4) 2 → CaHPO 4 → Ca (H 2 PO 4) 2
119) CuSO 4 → Cu → CuS → CuO → CuCl2
120) Al → A1 2 (SO 4) 3 → Al (OH) 3 → A1C1 3 → A1 (JO 3) 3
121) S → SO 3 → H 2 SO 4 → KHSO 4 → BaSO 4
122) N 2 O 5 → HNO 3 → Cu (NO 3) 2 → CuO → Cu (OH) 2
123) Al → A1 2 O 3 → Al (OH) 3 → A1 2 (SO 4) 3 → A1 (JO 3) 3
124) Ca → Ca (OH) 2 → Ca (HCO3) 2 → CaO → CaCl2
125) NH3 ∙ H2O → NH4C1 → NH3 → NH4HCO3 → (NH4) 2C03
126) Cu (OH) 2 → H 2 O → HNO 3 → Fe (NO 3) 3 → Fe
127) SO 2 → Ca (HSO3) 2 → CaCl2 → Ca (OH) 2 → Ca (HCO3) 2
128) NH 3 ∙ H 2 O → NH 4 HCO 3 → CaCO 3 → CaSiO 3 → CaCl 2
129) CuSO 4 → Cu → CuO → Cu (OH) 2 → Cu
130) Fe (OH) 3 → Fe → FeCl3 → Fe (NO3) 3 → Fe
131) Zn → Zn (OH) 2 → Na2 → Zn (OH) 2 → Na2 ZnO2 → Zn
132) Zn → ZnO → Na2 ZnO2 → Zn (OH) 2 → Na2 → ZnCl2
133) Zn → K2 ZnO2 → ZnSO4 → K2 → Zn (NO3) 2 → ZnO
134) ZnO → Zn (OH) 2 → K2 ZnO2 → ZnSO4 → ZnCl2 → ZnO
135) Zn → Na2 → Na2 ZnO2 → Zn (NO3) 2 → ZnO → Zn
136) Al → K 3 → Al (OH) 3 → Na 3 → A1C1 3 → Al (OH) 3
137) Al 2 O 3 → KAlO 2 → Al (OH) 3 → Al 2 O 3 → Na 3 → Al 2 O 3
138) Al (OH) 3 → A1 2 O 3 → K 3 → Al 2 (SO 4) 3 → A1 (JO 3) 3
139) A1C1 3 → K 3 → Al (NO 3) 3 → NaAlO 2 → Al 2 O 3
140) Të jetë → Na 2 → Be (OH) 2 → Na 2 BeO 2 → BaBeO 2
EKSPERIENCA EKSPERIENTE NË TEMA "KLASAT THEMELORE TË KOMPONENTEVE INORGANIKE"
EKSPERIENCA 1.Reaksionet e neutralizimit.
a) Ndërveprimi i një acidi të fortë dhe një baze të fortë.
Hidh 5 ml 2N zgjidhje hidroklorik acid në një pjatë prej porcelani dhe shtoni 2 n hidroksid natriumi zgjidhje cepër në të. Përzieni zgjidhjen me një shufër qelqi dhe provo efektin e saj në litmus, duke transferuar një pikë të zgjidhjes në testin e lakmimit. Është e nevojshme për të arritur një reagim neutral (letër blu dhe të kuqe lakmus nuk ndryshon ngjyrën). Pastrojeni solucionin që rezulton në thatësi. Çfarë u formua? Shkruani ekuacionet molekulare dhe jonike të reagimit.
b) Ndërveprimi i një acidi të dobët dhe një baze të fortë.
Hidheni në një tub provë 2 ml zgjidhje alkali 2N dhe shtoni një zgjidhje të acidit acetik derisa zgjidhja të jetë neutrale. Shkruani ekuacionet molekulare dhe jonike të reagimit. Shpjegoni pse reagimi i joneve të ekuilibrit, në të cilin një elektrolit i dobët (acidi acetik) merr pjesë, shkon drejt formimit të molekulave të ujit.
EKSPERIENCA 2. Hidroksidet amfoterike.
Nga reagentët në dispozicion në laborator, të merrni një precipitate të hidroksidit të zinkut. Shkundni precipitatin e marrë dhe derdhni sasi të vogla të tij në 2 tuba. Në një nga tubat shtoni një zgjidhje të acidit klorhidrik, në të tjera - një zgjidhje e hidroksid natriumi (e tepërt). Çfarë është vërejtur? Shkruani ekuacionet e reagimeve përkatëse në formë molekulare dhe jonike.
EKSPERIENCA 3.Vetitë kimike të kripërave.
a) Ndërveprimi i zgjidhjeve të kripës me formimin e një substance të dobët të tretshme.
Hidh 2 ml zgjidhje karbonat natriumi në tub dhe shtoni barium chloride zgjidhje derisa të shfaqet një precipitim i bardhë. Shkruani ekuacionin e reagimit kimik në formë jonike dhe molekulare. Precipitati ndahet në dy pjesë. Hidhni acidin sulfurik në një nga tubat dhe hidroksid natriumi në tjetrin. Bëni një përfundim për tretshmërinë e precipituar në acide dhe alkaline.
b) Ndërveprimi i zgjidhjes së kripës me acide për të formuar një përbërës të paqëndrueshëm.
Hidh 2 ml zgjidhje karbonat natriumi në tub dhe shtoni një vëllim të vogël të tretësirës së acidit hidroklorik. Çfarë është vërejtur? Shkruani ekuacionet e reagimit kimik në formë jonike dhe molekulare.
c) Ndërveprimi i solucioneve të kripës me alkalet me formimin e një komponimi të paqëndrueshëm.
Hidh një zgjidhje pak të kripës së amonit në tub, shtoni 1-2 ml zgjidhje hidroksid natriumi dhe ngrohni në vlim. Në një tub provë me përzierjen e reagimit për të bërë një provë të lakmisë të kuqe të kuqe. Çfarë është vërejtur? Jepni një shpjegim. Shkruani ekuacionet e reagimit.
g ) Ndërveprimet e kripërave me metale më aktive sesa metali që është pjesë e kripës.
Pastroni gozhdën e hekurit (çeliku) me letër zmerile të imët. Pastaj dip atë në solucion bakrit zgjidhje. Pas disa kohësh, vëzhgoni lirimin e bakrit në sipërfaqen e gozhdës. Shkruani ekuacionin përkatës të reagimit në formë jonike dhe molekulare.
EKSPERIENCA 4.Marrja e kripërave bazë dhe acid.
a) Përgatitja e hidroksokarbonatit të plumbit.
Shto një plumb pak plumbi (II) oksid në plumb (II) acetate zgjidhje dhe vlim përzierje për disa minuta. Zgjidhja e ftohur është drenazhuar nga precipitati dhe një rrjedhë e dioksidit të karbonit kalon nëpër të. Çfarë është vërejtur? Filtroni precipitimin dhe thani në mes të fletëve të letrës së filtrit. Shënoni ngjyrën dhe natyrën e precipitatit rezultues të hidroksikarbonatit të plumbit. Shkruani ekuacionet e reagimit. Bëni një formulë grafike të kripës së marrë.
b) Përgatitja e bikarbonatit të magnezit.
Për një zgjidhje tepër të holluar të disa kripës së magnezit shtoni pak zgjidhje të karbonatit të natriumit. Cila substancë precipiton? Solucion i ngopur me precipituar me dioksid karboni. Vini re shpërbërjen graduale të precipitatit. Pse ndodh kjo? Shkruani ekuacionet e reagimit.
EKSPERIENCA 5.Marrja e kriprave komplekse
a) Formimi i komponimeve me kation kompleks.
Shto një zgjidhje të amoniakut dropwise në një tub me 2-3 ml solucion bakri (II) deri në formimin e një precipitimi të hidroksidit të bakrit (II) dhe pastaj shtoni një tepërt të solucionit të amoniakut për të shpërndarë precipitatin. Krahasoni ngjyrën e joneve Cu 2+ me ngjyrën e zgjidhjes që rezulton. Çfarë jonësh janë të pranishëm në zgjidhje? Shkruani ekuacionin e reagimit për marrjen e një kompleksi kompleks.
b) Formimi i komponimeve me anion kompleks.
Për një solucion prej 1-2 ml të nitratit të merkurit (II) shtoni dropwise një solucion të holluar të jodidit të kaliumit për të formuar një precipitate të HgI2. Pastaj derdhni një tepricë të zgjidhjes së jodidit të kaliumit derisa precipitati të shpërbëhet. Shkruani reagimet e marrjes së një kripe komplekse.
EKSPERIENCA 6.Përgatitja e kripërave të dyfishta (alumini i kaliumit).
Peshoni 7.5 g Al 2 (SO 4) 3 ∙ 18H 2 O dhe shpërndahuni në 50 ml ujë, duke marrë një gjellë mjaft të madhe prej porcelani për këtë qëllim. Llogaritni ekuacionin e reagimit dhe peshoni masën e sulfatit të kaliumit të nevojshëm për reagimin. Përgatitni një solucion të ngopur të nxehtë të sulfatit të kaliumit dhe derdheni në një pjatë prej porcelani me një solucion sulfate alumini me nxitje. Vëzhgoni pas një kohe reshjet e kristaleve alum alumini kalium. Pas ftohjes dhe kristalizimit, derdhni lëngun amë, thajni kristalet e aluminit midis fletëve të letrës së filtrit dhe peshoni kristalet që rezultojnë. Llogaritni përqindjen e fitimit.
DETYRIMET E ZBATIMIT
1. Duke kaluar një teprim të sulfidit të hidrogjenit përmes 16 g solucionit të bakrit (II) sulfat, u arrit 1,92 g precipitate. Gjeni fraksionin masiv të sulfatit të bakrit në zgjidhjen e përdorur dhe vëllimin e sulfidit të hidrogjenit të konsumuar.
2. Për reshjet e plota të bakrit në formën e sulfidit nga 291 cm3 e solucionit të bakrit (II) sulfate me një fraksion masiv prej 10%, u përdor gazi i marrë duke reaguar 17.6 g sulfide hekuri (II) me një tepricë të acidit klorhidrik. Gjeni dendësinë e solucionit origjinal të sulfatit të bakrit.
3. Gazi i lëshuar gjatë ndërveprimit të zgjidhjes së K 2 S me acid sulfurik të holluar kalon përmes një zgjidhje të tepërt të nitratit të plumbit (II). Precipitati rezulton me një masë prej 71.7 g. Gjeni volumin e tretës së reaguar të acidit sulfurik, nëse dendësia e tij është 1.176 g / cm3 dhe fraksioni masiv është 25%.
4. Në një solucion që përmban 8 g sulfate të bakrit (II), u shtua një zgjidhje që përmban 4.68 g sulfide natriumi. Precipitati u filtrua, filtrati u avullua. Përcaktoni masën e substancave në filtrat pas avullimit dhe masës së sulfurit të bakrit të precipituar.
5. Disa prej sulfide hekuri (II) u trajtuan me një tepricë të acidit klorhidrik. Gazi rezultues në reagimin me 12.5 cm3 të NaOH zgjidhje me një fraksion në masë prej 25% dhe një densitet prej 1.28 g / cm3 formuan një kripë acidi. Gjeni masën e sulfidit hekuri origjinal.
6. Sulfidi i hekurit (II) me peshë 176 g u trajtua me një tepricë të acidit klorhidrik dhe gazi rezultues u dogj në ajër të tepërt. Çfarë vëllimi i zgjidhjes KOH me një fraksion masiv prej 40% dhe një densitet prej 1.4 g / cm3 është i nevojshëm për të neutralizuar plotësisht gazin e prodhuar gjatë djegijes?
7. Kur pjekur 100 g pirite teknike, ata morën një gaz, i cili u neutralizua plotësisht me 400 cm3 të solucionit NaOH me një fraksion masiv prej 25% dhe një densitet prej 1.28 g / cm3. Përcaktoni fraksionet masive të papastërtive në pirit.
8. Në 2 g të një përzierjeje të hekurit, oksidit të hekurit (II) dhe oksidit të hekurit (III) shtohej 16 cm3 e solucionit HC1 me një fraksion masiv prej 20% dhe një dendësi prej 1.09 g / cm3. Për të neutralizuar acidin e tepërt, u desh 10.8 cm3 e zgjidhjes NaOH me një fraksion masiv me densitet 10% të 1.05 g / cm 3. Gjeni masat e substancave në përzierje nëse vëllimi i hidrogjenit është i liruar 224 cm 3 (NU).
9. Ekziston një përzierje e Ca (OH) 2, CaCO3 dhe BaSO 4 me një masë prej 10.5 g. Kur përzierja u trajtua me një tepricë të acidit klorhidrik, u lëshua 672 cm3 (IU) e gazit dhe 71.2 g acid reagoi me një masë pjesëmarrje prej 10%. Përcaktoni masën e substancave në përzierje.
10. Ka një përzierje të klorurit barium, karbonat kalciumi dhe bikarbonat natriumi. Kur 10 g të kësaj përzierje është tretur në ujë, mbetja e pazgjidhshme është e barabartë me 3.5 g. Kur calcining 20 g të përzierjes fillestare, masa e saj ul me 5.2 g. Gjeni fraksionet masive të substancave në përzierjen fillestare.
11. Ekziston një zgjidhje që përmban dy acide sulfurike dhe nitrike. Për të neutralizuar plotësisht 10 g këtë zgjidhje, 12.5 cm3 e zgjidhjes KOH konsumohet me një fraksion masiv prej 19% dhe një densitet prej 1.18 g / cm 3. Kur një tejkalim i klorurit barium shtohet në 20 g të së njëjtës përzierje të solucionit acid, 4.66 g precipitate bie. Gjeni fraksionet masive të acideve në përzierje.
12. Të gjitha klorur hidrogjeni të marra nga 100 g një përzierje të KC1 dhe KNO 3 u tretën në 71.8 cm 3 ujë. Kur calcining 100 g të njëjtën përzierje e kripërave, mbetet 93.6 g mbetje solide. Gjeni fraksion masiv të klorur hidrogjeni në ujë.
13. Duke kaluar 2 m 3 të ajrit (NU) përmes një zgjidhjeje të Ca (OH) 2, u arrit 3 g precipituar kripë acidi karbonik. Gjeni volumin dhe fraksionin masiv të CO 2 në ajër.
14. Dioksidi i karbonit kalon përmes një pezullimi që përmban 50 g CaCO3. Reagimi erdhi 8.96 dm 3 gaz (NU). Cila është masa e CaCO 3 e lënë në fazën e ngurtë?
15. Kur shtohej uji në CaO, masa e saj u rrit me 30%. Cila pjesë e KAO (në% të masës) ishte shuar?
16. Oksidi i plumbit (II) me peshë 18.47 g është ndezur në një rrymë të hidrogjenit. Pas reagimit, masa e plumbit rezultues dhe oksidi i papërpunuar ishte 18.07 g. Cila është masa e oksidit të plumbit që nuk ka reaguar?
17. Monoksidi i karbonit kalon nëpër oksid hekuri (III) kur nxehet. Masa e mbetjeve solide pas reagimit është 2 g më pak se masa fillestare e oksidit të hekurit. Çfarë vëllimi i CO bëri reagimi (a është oksidi i reduktuar plotësisht)?
18. Ka 8.96 dm 3 (NU) të një përzierjeje të N2, CO 2 dhe SO 2 me një dendësi relative të hidrogjenit 25. Pas kalimit të tij përmes një tepërt të KOH zgjidhje, vëllimi i përzierjes është ulur me 4 herë. Gjej vëllimet e gazrave në përzierjen origjinale.
19. Në dy gota ka 100 g zgjidhje HC1 me një fraksion masiv prej 2.5%. Në një gotë u shtua 10 g CaCO 3, në tjetrën - 8.4 g MgCO3. Si do të ndryshojë masa e syzeve pas reagimit?
20. Çfarë vëllimi (NU) i dyoksidit të squfurit duhet të kalojë përmes 200 cm 3 të një solucioni me një fraksion masiv prej 0.1% të NaOH dhe një densitet prej 1 g / cm 3 për të marrë një kripë acidi?
21. Cila është shuma maksimale (dioksidi i karbonit) i dioksidit të karbonit mund të thith 25 cm 3 të një solucion me një fraksion masiv 25% të NaOH dhe një densitet prej 1.1 g / cm 3?
22. Cila është vëllimi minimal i zgjidhjes me një fraksion masiv prej 20% KOH dhe një densitet prej 1.19 g / cm3 që mund të thithë të gjithë dioksidin e karbonit të prodhuar me reduktimin e plotë të 23.2 g magnetit me monoksid karboni?
23. Cila është masa minimale e KOH që duhet të reagojë me 24.5 g të acidit ortofosforik në mënyrë që vetëm fosfati i kalium dihidrogjenit të jetë produkti?
24. Cila është masa minimale e Ca (OH) 2 për të shtuar në 16 g zgjidhje bikarbonati kalciumi me një fraksion masiv të kripës prej 5% për të marrë një kripë të mesme?
25. Çfarë masash të fosfatit të hidrogjenit të kaliumit duhet të shtohet në një solucion që përmban 12.25 g H3 PO 4 në mënyrë që pas kësaj solucioni të përmbajë vetëm fosfat dihidrogjen kalium?
26. Zgjidhja përmbante 56.1 g një përzierje të karbonateve të kalciumit dhe magnezit në suspendim. Për t'i kthyer ato në hidrokarbonate, ata shpenzuan të gjithë dioksidin e karbonit të prodhuar nga djegia e 7 dm 3 (NU) të etanit. Gjeni masën e karbonatit të kalciumit në përzierjen fillestare.
27. Për të kthyer 9.5 g një përzierje të hidrogjenit dhe dihidrogjenit fosfat të natriumit në një kripë të mesme, është e nevojshme 10 cm3 e një zgjidhje me një fraksion masiv të NaOH prej 27.7% dhe një densitet prej 1.3 g / cm3. Gjeni masën e fosfatit të hidrogjenit në përzierje.
28. Me kalimin e dioksidit të karbonit përmes një solucioni që përmban 6 g NaOH, u sigurua 9.5 g një përzierje e acidit dhe kripërave të mesme. Gjeni sasinë e dioksidit të karbonit të konsumuar.
29. Pas kalimit të 11.2 dm 3 (NU) CO 2 përmes zgjidhjes KOH, u arritën 57.6 g një përzierje të acidit dhe kripërave të mesme. Gjeni masën e kripës së mesme.
30. Çfarë masash të acidit ortofosforik duhet të neutralizohet për të marrë 1.2 g dihidro- dhe 4.26 g fosfat hidrogjeni natriumi?
31. NaOH u shtua në solucionin e acidit sulfurik për të marrë 3.6 g hydrosulfate dhe 2.84 g sulfate natriumi. Përcaktoni sasitë kimike të acidit dhe alkali që kanë reaguar.
32. Pas kalimit të klorur hidrogjenit përmes 200 cm3 të solucionit NaOH me një fraksion masiv prej 10% dhe një densitet prej 1.1 g / cm3, pjesa masive e NaOH në zgjidhjen rezultuese u zvogëlua me gjysmën. Përcaktoni fraksionin masiv të NaCl në zgjidhjen që rezulton.
33. Shkrirja e 14.4 g një përzierje bakri dhe oksidit të saj (II) konsumon 48.5 g një zgjidhje me një fraksion HNO 3 në masë prej 80%. Gjeni fraksionet masive të bakrit dhe oksidit në përzierjen fillestare.
34. Sasia e oksidit të natriumit prej 6,2 g u shpërbë në 100 cm3 ujë dhe u arrit në zgjidhjen nr.1 Pastaj në këtë solucion u shtohet acid klorhidrik me një fraksion masiv prej 10% deri në marrjen e medies neutrale, dhe u arrit zgjidhja Nr.2 Përcaktoni :
1) fraksione masive të substancave në zgjidhjet nr. 1, 2;
2) masën e zgjidhjes së HC1, e cila shkoi për të neutralizuar numrin e zgjidhjes 1.
35. 3 g zinku ndërveprojnë me 18.69 cm 3 të HC1 zgjidhje me një fraksion masiv prej 14.6% dhe një densitet prej 1.07 g / cm 3. Kur nxehet, gazi rezultues kalon mbi CuO të nxehtë që peshon 4 g. Cila është masa e bakrit që është marrë?
36. Gazi lëshohet pas trajtimit të hidridit të kalciumit me ujë të tepërt, të humbura mbi FeO. Si rezultat, masa e oksidit është ulur me 8 g. Gjeni masën e CaH 2 të trajtuar me ujë.
37. Gjatë kalcinimit të mostrës CaCO3, masa e saj u zvogëlua me 35.2%. Produktet e ngurta reagimi u tretën në një tepricë të acidit klorhidrik për të marrë 0.112 dm 3 (NU) të gazit. Përcaktoni masën e mostrës origjinale të karbonatit të kalciumit.
38. Nitrat bakri u dekompozua dhe oksidi i bakrit (II) u reduktua plotësisht nga hidrogjeni. Produktet rezultuese kaluan përmes një tubi me P 2 O 5 dhe masa e tubit pas kësaj u rrit me 3.6 g. Cila është vëllimi minimal i acidit sulfurik me një fraksion masiv prej 88% dhe një dendësi prej 1.87 g / cm3 e nevojshme për shpërbërjen e marrë në eksperiment bakër dhe çfarë është masa e kripës së dekompozuar?
39. Me thithjen e oksidit nitrik (IV) nga një tepricë e KOH në të ftohtë në mungesë të oksigjenit, u arritën 40.4 g KNO 3. Cila substancë formohet ende dhe cila është masa e saj?
40. Për të neutralizuar 400 g të një solucioni që përmban klorur dhe klorur acid sulfurik, konsumuar 287 cm3 e zgjidhjes së hidroksidit të natriumit me një fraksion masiv prej 10% dhe një densitet prej 1,115 g / cm 3. Nëse një zgjidhje e tepërt e klorurit barium është shtuar në 100 g të zgjidhjes fillestare, 5.825 g precipitate do të bien jashtë. Përcaktoni fraksionet masive të acideve në zgjidhjen fillestare.
41. Pas kalimit të dyoksidit të karbonit nëpërmjet një tretësie të hidroksidit të natriumit, u arrit 13.7 g një përzierje e kripërave të mesme dhe acide. Për t'i kthyer ato në klorid natriumi nevojitet 75 g acidi klorhidrik me një fraksion masiv të HCl prej 10%. Gjeni volumin e dioksidit të karbonit të zhytur.
42. Një përzierje e acideve hidroklorike dhe sulfurike me një masë totale prej 600 g solucion me fraksione të njëjta masive të acideve u trajtua me një bikarbonat natriumi të tepërt dhe u arrit 32.1 dm 3 gaz (N). Gjeni fraksionet masive të acideve në përzierjen fillestare.
43. Për të neutralizuar 1 dm3 të solucionit NaOH, 66.66 cm3 e zgjidhjes HNO 3 është konsumuar me një fraksion në masë prej 63% dhe një dendësi prej 1.5g / cm3. Cila vëllim i tretësit të acidit sulfurik me një fraksion masiv prej 24.5% dhe një densitet prej 1.2 g / cm3 do të ishte i nevojshëm për të neutralizuar të njëjtën sasi alkali?
44. Në cilin raport vëllimi duhet të merret një zgjidhje e acidit sulfurik me një fraksion masiv prej 5% dhe një dendësi prej 1.03 g / cm3 dhe një zgjidhje të hidroksid barium me një fraksion masiv prej 5% dhe një densitet prej 1.1 g / cm3 për neutralizim të plotë? Imagjinoni përgjigjen si koeficienti i volumit të zgjidhjes së alkalit në zgjidhjen e acidit.
45. Llogaritni vëllimin minimal të zgjidhjes së amoniakut me një densitet prej 0.9 g / cm 3 dhe një fraksion masiv prej 25%, i cili është i nevojshëm për absorbimin e plotë të dioksidit të karbonit të marrë duke dekompozuar 0.5 kg gëlqerorë natyral me një fraksion masiv të karbonatit të kalciumit të barabartë me 92%.
46. Për konvertimin e plotë të 2.92 g të një përzierje të hidroksidit të natriumit dhe karbonatit të natriumit në klorid kërkohet 1.344 dm 3 klorur hidrogjeni (NU). Gjeni masën e karbonatit të natriumit në përzierje.
47. Në 25 g solucion bakri (II) sulfate me një fraksion masiv prej 16% u shtua një sasi e tretës hidroksid natriumi me një fraksion masiv prej 16%. Precipiti i formuar u filtrua, pas së cilës filtrati ishte alkalik. Për të neutralizuar plotësisht filtrat, duhej 25 cm3 e një zgjidhje të acidit sulfurik me një përqendrim molar prej 0.1 mol / dm 3 të solucionit. Llogaritni masën e zgjidhjes së shtuar të hidroksidit të natriumit.
48. Substanca e marrë me reduktimin e plotë të CuO me një masë prej 15.8 g hidrogjen me një vëllim prej 11.2 dm 3 (NU) u shpërbë me ngrohje në acid sulfurik të koncentruar. Cila është vëllimi i gazit (NU) i lëshuar si rezultat i reagimit?
49. Për neutralizimin e plotë të 50 cm3 të acidit klorhidrik me një fraksion masiv të HCl prej 20% dhe një dendësi prej 1.10 g / cm3, u përdor një zgjidhje e hidroksidit të kaliumit me një fraksion masiv të KOH prej 20%. Cila është sasia kimike e ujit që gjendet në zgjidhjen që rezulton?
50. Gazi i marrë duke kaluar një tepricë CO 2 mbi 0,84 g qymyr të nxehtë, dërgohet në reaksion me 14.0 g oksid bakri (II) të nxehtë (II). Çfarë vëllimi i një solucioni të acidit nitrik me një fraksion masiv prej 63% dhe një densitet prej 1.4 g / cm3 është i nevojshëm për të shpërndarë tërësisht substancën e marrë në reagimin e fundit?
51. Kur u kalcinua në peshë konstante të nitratit të bakrit (II), pesha e kripës u zvogëlua me 6.5 g. Çfarë peshe kripe u dekompozua?
52. Kur u përdor një tejkalim i acidit hidroklorik, u lëshua 6.72 dm 3 (NW) gaz në një përzierje prej alumini me një metal të panjohur monovalent dhe masa e përzierjes u përgjysmua. Kur trajtimi i mbetjeve me acid nitrik të holluar, 0.373 dm 3 (NU) NO u lëshua. Identifikoni metal të panjohur.
53. Masa e mostrës së shkumës është 105 g, dhe sasia kimike e elementit të oksigjenit në përbërjen e tij është 1 mol. Përcaktoni fraksionin masiv të CaCO 3 në mostrën e shkumës (oksigjeni përfshihet vetëm në përbërjen e karbonatit të kalciumit).
54. Në bashkëveprimin e oksidit të squfurit (VI) me ujë, u arrit një zgjidhje me një fraksion masiv të acidit sulfurik prej 25%. Kur kjo tejzgjitje u shtua një tejkalim i Ba (OH) 2, u depozitua një precipitate me peshë 29.13 g. Çfarë masash të SO3 dhe H20 u shpenzuan për formimin e një solucioni acid?
55. Kur kalonte SO 2 deri në 200 g një zgjidhje me një fraksion masiv të NaOH prej 16%, u formua një përzierje e kripërave, duke përfshirë 41.6 g kripë acide. Cila është masa e squfurit që përmban pesha të papastra 4.5% sipas peshës, është përdorur për të marrë SO2? Cila është pesha e kripës së mesme?
56. Bashkëveprimi me 80 g Ca (NO 3) 2 mori 50 g Na2CO3 zgjidhje. Reshjet u ndanë, ndërsa përpunimi me një tepricë të acidit klorhidrik u lëshua 2.24 dm 3 (NU) e gazit. Cilat janë fraksionet masive të kripërave në zgjidhjet fillestare? Cila është fraksioni masiv i nitratit të natriumit në zgjidhje pas ndarjes së precipitatit?
57. Kur zinku ndërvepron me acid sulfurik, formohet 10 dm 3 (NU) e një përzierjeje të SO 2 dhe H 2 S me një densitet relativ të argonit prej 1.51. Cila është sasia kimike e zinkut të tretur? Cila është fraksioni masiv i SO 2 në përzierjen e gazit?
58. Një mostër e një përzierje të zinkut dhe tallash alumini me një masë totale prej 11 g u shpërbë në një tepërt të solucionit alkali. Përcaktoni vëllimin (NU) të gazit të lëshuar, nëse pjesa masive e zinkut në përzierje është 30%.
59. Hidroksid natriumi me peshë 4.0 g u lidh me hidroksid alumini me peshë 9.8 g. Llogaritni masën e metaaluminatit të sodiumit të marrë.
60. Kur përpunohet 10 g një përzierje prej bakri dhe alumini me acid nitrik të koncentruar në temperaturën e dhomës lëshoi 2.24 dm 3 gaz (NU). Çfarë vëllimi (NU) i gazit do të lirohet kur përpunohet masa e njëjtë e përzierjes me një zgjidhje të tepërt të KOH?
61. Një aliazh prej bakri dhe alumini që peshon 20 g u trajtua me një tepricë alkali, mbetja e pazgjidhshme u tret në acid nitrik të koncentruar. Kripërat e marra u izoluan, kalcinuan në peshë konstante dhe u morën 8 g mbetje solide. Përcaktoni vëllimin e solucionit të shpenzuar NaOH me një fraksion masiv prej 40% dhe një densitet prej 1.4 g / cm3).
62. Një përzierje e oksidit të metaleve dhe oksidit metalik (II) (jo oksid amfoterik) me peshë 39 g u trajtua me një zgjidhje të tepërt të KOH, gazi i gaztë u dogj për të marrë 27 g ujë. Mbetjet e pazgjidhura u tretën plotësisht në 25.2 cm 3 të një solucioni me një fraksion masiv të HC1 prej 36.5% dhe një densitet prej 1.19 g / cm 3). Përcaktoni oksid.
63. Një përzierje e cipës së zinkut dhe bakrit u trajtua me një zgjidhje të tepërt të KOH, ndërsa u lirua një gaz prej 2.24 dm 3 (NU). Për klorinimin e plotë të mostrës së njëjtë metalike, klori me volum 8.96 dm 3 (NU) ishte i nevojshëm. Llogaritni fraksionin masiv të zinkut në mostër.
64. Një përzierje e tallash me hekur, alumin dhe magnez me një masë prej 49 g u trajtua me H2 SO4 të tepërt të holluar, duke marrë kështu 1.95 mol të gazit. Një pjesë tjetër e së njëjtës përzierje me peshë 4.9 g u trajtua me një zgjidhje të tepërt të alkalit, u arrit 1,68 dm 3 (NU) e gazit. Gjeni masën e metaleve në përzierje.
65. Cila është masa e sedimentit të formuar kur shkrirja e solucioneve që përmbajnë 10 g NaOH dhe 13.6 g ZnCl2?
66. Ka dy pjesë të përzierjes së Al, Mg, Fe, Zn, të njëjtë në përbërjen e molarit, secila peshon 7.4 g. Një pjesë është tretur në acid klorhidrik dhe 3.584 dm 3 gaz (NU) është marrë, tjetra në tretësirë alkali dhe Pranë 2.016 dm 3 gaz (NU). Dihet se në të dy përzierjet ekzistojnë 3 atome Zn për atomin A1. Gjeni masën e metaleve në përzierje.
67. Një përzierje e bakrit, magnezit dhe aluminit që peshonte 1 g u trajtua me një tepricë të acidit klorhidrik. Zgjidhja u filtrua, në filtrat u shtua një tepricë e NaOH. Precipitati u nda dhe u kalcinua në një masë konstante prej 0.2 g. Mbetja, e cila ishte e pazbutur pas trajtimit me acid klorhidrik, u kalcinua në ajër dhe u arrit të merrte 0.8 g substancë të zezë. Gjeni fraksionin masiv të aluminit në përzierje.
68. Kur nxehet në një rrymë të aliazhit të oksigjenit të zinkut, magnezit dhe bakrit, masa e përzierjes është rritur me 9.6 g. Produkti shpërbëhet pjesërisht në alkali dhe është e nevojshme 40 cm3 e një zgjidhje me një fraksion masiv të KOH 40% dhe dendësisë 1.4 g / cm 3. Për reagimin me të njëjtën pjesë të aliazhit, 0.7 mol HCl është e nevojshme. Gjeni sasi kimike të metaleve në aliazh.
69. Një aliazh bakri dhe zinku që peshon 5 g u trajtua me një tepricë të NaOH. Pastaj mbetjet solide u ndanë dhe u trajnuan me HNO3 të përqendruar, kripën e fituar në këtë mënyrë u izolua, u kalcinua në peshë konstante dhe u gjet 2.5 g mbetje solide. Përcaktoni masën e metaleve në aliazh.
70. Një aliazh bakri dhe alumini me peshë 12.8 g u trajtua me një tepricë të acidit hidroklorik. Mbetjet e pazgjidhura treteshin në acid nitrik të koncentruar, zgjidhja rezultuese u avullua, mbetjet e thata kalinuan në peshë konstante dhe u gjetën 4 g të ngurta. Përcaktoni fraksionin në masë të bakrit në aliazh.
71. Në çfarë raporti masiv duhet të marrë dy pjesë të A1, kështu që kur të shtohet në solucionin e alkalit dhe tjetri në sasi të barabarta të hidrogjenit, lëshohen në acidin klorhidrik?
72. Kur përpunimi i një përzierjeje alumini dhe bakri (II) oksid me një zgjidhje të tepërt të KOH, u lëshua 6.72 dm 3 (NU) gaz dhe duke shpërndarë të njëjtën pjesë të përzierjes në HNO 3 të koncentruar në temperaturën e dhomës, u sigurua 75.2 g kripë. Gjeni masën e përzierjes fillestare të substancave.
73. Cila masë e oksidit të bakrit (II) mund të restaurohet nga hidrogjeni i marrë duke reaguar me një tepricë prej alumini me 139.87 cm 3 të një zgjidhje me 40% NaOH dhe një densitet prej 1.43 g / cm3?
74. Me oksidimin e plotë të 7.83 g aliazh të dy metaleve, u formuan 14.23 g okside, gjatë trajtimit të të cilave një tepërt e alkali mbeti 4.03 g sedimentesh të pazgjidhura. Përcaktoni përbërjen cilësore të metaleve që formojnë aliazh, nëse kationet e tyre kanë një gjendje oksidimi prej +2 dhe +3, dhe raporti molar i oksideve është 1: 1 (supozojmë se oksidi metalik me oksidacionin +3 ka vetitë amfoterike).
75. Dy pjesë të aluminit, që kishin të njëjtën masë, u shpërndanë: një në një solucion hidroksid kaliumi, tjetri në acid klorhidrik. Si lidhen vëllimet e gazrave të shkarkuara me njëri-tjetrin?
76. Një aliazh bakri me alumin me peshë 1000 g u trajtua me një tretësirë të tepërt alkaline, precipitati i pazgjidhur u tret në acid nitrik, pastaj solucioni u avullua, mbetja u kalcinua në peshë konstante. Masa e mbetjes së re është 0.398 g. Cila është masa e metaleve në aliazh?
77. Një aliazh zinku dhe bakri me peshë 20 g u trajtua me një tepricë të NaOH me një fraksion masiv prej 30% dhe një dendësi prej 1.33 g / cm 3. Mbetja solide u izolua dhe u trajtua me një tepricë të një solucioni të koncentruar të HNO3. Kripërat e formuara gjatë këtij procesi janë izoluar dhe kalcinuar në peshë konstante. Masa e mbetjeve solide ishte 10.016 g. Llogaritni fraksionet masive të metaleve në aliazh dhe vëllimin e solucionit alkalik të konsumuar.
78. Një aliazh prej bakri dhe alumini me peshë 2 g u trajtua me një tretësirë të tepërt alkali. Mbetjet u filtruan, lanë, u shpërndanë në HN03, zgjidhja u avullua dhe u kalcinua në peshë konstante. Masa e mbetjes pas kalcinimit ishte 0.736 g. Llogaritni fraksionet masive të metaleve në aliazh.
79. Klorina e një përzierjeje prej hekuri, bakri dhe alumini kërkon 8.96 dm 3 të klorit (NU), dhe ndërveprimi i mostrës së njëjtë me klorid hidrogjeni kërkon 5.6 dm 3 (NU). Kur bashkëveprojmë me të njëjtën masë të një përzierje metali me alkali, lëshohet 1.68 dm 3 (NU) e gazit. Gjeni sasi kimike të metaleve në përzierje.
80. Hidridi i kaliumit me peshë 5,0 g u tretur në ujë me volum 80 cm3 dhe uji i peshuar 0,81 g u shtua në zgjidhjen rezultuese. Gjeni fraksionet masive të substancave në zgjidhjen që rezulton me një saktësi deri në njëmijë përqind.
LISTA E LITERATURËS
1. Barannik, V.P. Nomenklatura moderne ruse e komponimeve inorganike / V.P. Barannik // Gazeta e Shoqërisë Kimike të Bashkimit. DI Mendeleev. - 1983. - Vol. XXVIII. - f. 9-16.
2. Wroblewski, A.I. Simulator i kimisë / A.I. Wroblewski. - 2 ed., Pererab. dhe shto. - Minsk: Krasiko-Print, 2007. - 624 f.
3. Glinka, N.L. Detyrat dhe ushtrimet në kimi të përgjithshme: studime. manual për universitete / ed. VA Rabinovich dhe H.M. Rubina. - M .: Integral-Press, 2004. - 240 f.
4. Lidin, R.A. Detyrat në kimi të përgjithshme dhe inorganike: studime. manual për studentët e lartë. Proc. institucionet / R.A. Lidin, V.A. Qumësht, L.L. Andreev; nga ed. RA Lidin. - M .: VLADOS, 2004. - 383 f.
5. Lidin, R.A. Bazat e nomenklaturës së substancave inorganike / R.А. Lidin [et al.]; nga ed. BD Stepin. - M .: Chemistry, 1983. - 112 f.
6. Stepin, B.D. Zbatimi i rregullave IUPAC mbi nomenklaturën e komponimeve inorganike në rusisht / B.D. Stepin, R.A. Lidin // Gazeta e Shoqërisë Kimike të Bashkimit. DI Mendeleev. - 1983. - Vol. XXVIII. - f. 17-20.
| Hyrje .............................................................................. Rregullat e përgjithshme për gamën e substancave inorganike ............ .. Oksidet ....................................... .................................... Oksidet bazë .................................................................. ... Oksidet e acidit ....................................... ............................ Okside amfoterike ............................................................... .. Marrja e oksideve .................................................................. Ushtrime për punë të pavarur në Tema "Oksidet" ................................................................... Acidet ............................................................................... Ushtrime për punë të pavarur me temën "Acids" .................................................................. Baza ............................................................ ......... .. Ushtrime për punë të pavarur në temën "Fondacionet" ................................................................ Kripërat ..................................................................................... Ushtrime për punë të pavarur me temën "Sallat" .......................................................... Marrëdhëniet gjenetike midis klasave të përbërjeve inorganike ......................................... ............... .. Ushtrime për punë të pavarur me temën "Lidhja gjenetike ndërmjet klasave të përbërjeve inorganike" ...................................................... Eksperimentet eksperimentale me temën "Klasat kryesore të përbërjeve inorganike ............... ......... .. Detyrat e shlyerjes ..................................................................... Referencat ............................................................ |
edukimi: për të rregulluar konceptin "seri gjenetike", "lidhje gjenetike"; mësojnë se si të bëjnë seri gjenetike të elementeve (metale dhe jo-metale), për të kompletuar ekuacionet e reagimit që korrespondojnë me serinë gjenetike; kontrolloni se si asimilohet njohuria e vetive kimike të oksideve, acideve, kripave, bazave;
zhvillim: zhvillojnë aftësinë për të analizuar, krahasuar, përmbledhur dhe nxjerrë përfundime, përbëjnë ekuacionet e reaksioneve kimike;
arsimor : promovojnë formimin e një botëkuptimi shkencor.
2. Sigurimi i klasave: tabelat "Sistemi Periodik", "Tabela e tretshmërisë", "Seri e aktivitetit të metaleve", udhëzime për studentët, detyra për testimin e njohurive.
3. Rendi i performancës:
3.1. Sondazhi frontal.
3.2. Zgjidhja e detyrave.
3.3. Kryen punë verifikimi për opsionet.
4. Plani i raportimit:
4.1. Shkruani temën dhe objektivat e mësimit praktik.
4.2. Zgjidhja e zgjidhjes së problemeve.
4.3. Zgjidhni versionin tuaj të punës së pavarur, vendimin për të shkruar në një fletore dhe kaloni tek mësuesi për shqyrtim.
Përparimi i punës
1. Biseda frontale në:
Cila është lidhja gjenetike?
Lidhjet gjenetike - këto janë lidhje midis klasave të ndryshme bazuar në ndërkonversionet e tyre.
Cila është një seri gjenetike?
Rreshti gjenetik - një sërë substancash - përfaqësues të klasave të ndryshme, të cilat janë komponimet e një elementi kimik, të lidhur me ndërkonversione dhe duke reflektuar transformimet e këtyre substancave. Baza e këtyre serive është e njëjta element.
Cilat lloje të serive gjenetike zakonisht ndahen?
Midis metaleve ekzistojnë dy lloje rreshta:
a) Një seri gjenetike në të cilën alkali vepron si një bazë. Kjo seri mund të përfaqësohet duke përdorur transformimet e mëposhtme:
metal → oksid bazë → alkali → kripë
për shembull, seritë gjenetike të kaliumit K → K 2 O → KOH → KCl
b) Seria gjenetike, ku baza është një bazë e pazgjidhshme, atëherë seria mund të përfaqësohet si një zinxhir transformimesh:
metal → oksid bazë → kripë → bazë pazgjidhshëm → oksid bazë → metal
për shembull: Cu → CuO → CuCl2 → Cu (OH) 2 → CuO → Cu
Midis jo-metaleve është gjithashtu e mundur të dallohen dy lloje rreshta:
a) Seritë gjenetike të jo-metale, ku acid i tretshëm vepron si një lidhje në seri. Zinxhiri i transformimeve mund të përfaqësohet si vijon: jo-metal → oksid acid → acid i tretshëm → kripë.
Për shembull: P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
b) Rreshti gjenetik i jo-metale, ku acid i pazgjidhshëm: jo-metal → oksid acid → kripë → acid → oksid acid → jo-metal vepron si një lidhje në seri
Për shembull: Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Ekzekutimi i detyrave për opsionet:
| Opsioni 1 | Opsioni 2 |
|
Opsioni I: ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2
Opsioni II: Na2SO4, NaOH, Na, Na2O2, Na2O
Detyrat e shtëpisë: tregoni një kalim gradual nga kalciumi në karbonat kalciumi dhe përgatitni një raport mbi përdorimin e ndonjë kripe në mjekësi (duke përdorur literaturë shtesë).
Udhëzime për mësimin praktik
Marrëdhëniet gjenetike midis klasave kryesore të substancave inorganike.
objektivat: për të rregulluar konceptin "seri gjenetike", "lidhje gjenetike"; mësojnë të bëjnë seri gjenetike të elementeve (metalet dhe jo-metale), për të formuar ekuacionet e reagimit që korrespondojnë me serinë gjenetike; përsëritni vetitë e oksideve, acideve, kripërave, bazave.
Përparimi i punës
Shkruani përkufizimet e koncepteve:
Marrëdhënie gjenetike - __________________________________________
Rreshti gjenetik - ___________________________________________
Një seri gjenetike e metaleve në të cilat alkali vepron si një bazë. mund të përfaqësohen në përgjithësi: metal → oksid bazë → alkali → kripë. Bëni këtë seri duke përdorur kalium. Shkruani ekuacionet e reagimeve, me ndihmën e të cilëve mund të arrini këtë zinxhir transformimesh.
Seria gjenetike e jo-metale, ku acid i tretshëm vepron si një lidhje në seri mund të përfaqësohen si më poshtë: jo-metal → oksid acid → acid i tretshëm → kripë. Bëni këtë seri duke përdorur fosfor. Shkruani ekuacionet e reagimeve, me ndihmën e të cilëve mund të arrini këtë zinxhir transformimesh.
Rreshti gjenetik, ku baza është baza e pazgjidhshme mund të përfaqësohet nga zinxhiri i transformimeve: metal → oksid bazë → kripë → bazë pazgjidhshëm → oksid bazë → metal. Ndërtoni këtë seri duke përdorur bakër. Shkruani ekuacionet e reagimeve, me ndihmën e të cilëve mund të arrini këtë zinxhir transformimesh.
Seria gjenetike e jo-metale, ku acid i pazgjidhshëm vepron si një lidhje në seri mund të përfaqësohet nga zinxhiri i transformimeve: jo-metal → oksid acid → kripë → acid → oksid acid → jo-metal. Ndërtoni këtë seri duke përdorur silikon. Shkruani ekuacionet e reagimeve, me ndihmën e të cilëve mund të arrini këtë zinxhir transformimesh.
Kryen detyra për opsionet:
| Opsioni 1 | Opsioni 2 |
|
1. Zgjidhni formulat e oksidit në versionin tuaj, shpjegoni zgjedhjen tuaj, bazuar në njohjen e karakteristikave të përbërjes së kësaj klase përbërësish. Thirrni ato.
2. Në kolonën e formulës të variantit tuaj, gjeni formula të acidit dhe shpjegoni zgjedhjen tuaj bazuar në analizën e përbërjes së këtyre përbërjeve.
3. Përcaktoni valencat e mbetjeve acide në përbërjen acid.
4. Zgjidhni formulat e kripës dhe emërtoni ato.
5. Bëni formulat e kripërave, të cilat mund të formohen me magnez dhe acide të variantit tuaj. Shkruani ato, emërtoni atë.
6. Në kolonën e formulës së variantit tuaj, gjeni formula bazë dhe shpjegoni zgjedhjen tuaj bazuar në analizën e përbërjes së këtyre përbërjeve.
7. Në variantin tuaj, zgjidhni formulat e substancave me të cilat mund të reagojë një zgjidhje e acidit ortofosforik (klorhidrik, sulfurik). Bëni ekuacionet e përshtatshme të reagimit.
9. Në mesin e formulat e opsionit tuaj, zgjidhni formulat e substancave që mund të ndërveprojnë me njëri-tjetrin. Bëni ekuacionet e përshtatshme të reagimit.
10. Bëni një zinxhir të lidhjeve gjenetike të përbërjeve inorganike, të cilat do të përfshijnë një substancë, formula e së cilës jepet në versionin tuaj në numrin një.
Nga këto substanca të bëjë një linjë gjenetike duke përdorur të gjitha formulat. Shkruani ekuacionet e reagimit me të cilat mund të arrini këtë zinxhir transformimesh:
unë opsioni: ZnSO4, Zn, ZnO, Zn, Zn (OH) 2
IIalternativë: Na2SO4, NaOH, Na, Na2O2, Na2O
Detyrat e shtëpisë: tregoni një kalim gradual nga kalciumi në karbonat kalciumi dhe përgatitni një raport mbi përdorimin e ndonjë kripe në mjekësi (duke përdorur literaturë shtesë).
