Schema structurii siliciului. Structura coajelor electronice
Structura atomică Poziția în PS: Perioada III; grupa IV, lider; Capacitatea nucleului: +14 Si; Masa atomică relativă: Ar (Si) = 28 Structura atomică: p = 14, e = 14, n = = 14 Formula electronică: +14 Si 2e; 8e; 4e; +14 Si 1s 2 2s 2 2p 6 3s 2 3p Si 1s 2 2s 2 2p 6 3s 2 3p 2 Nemetall;
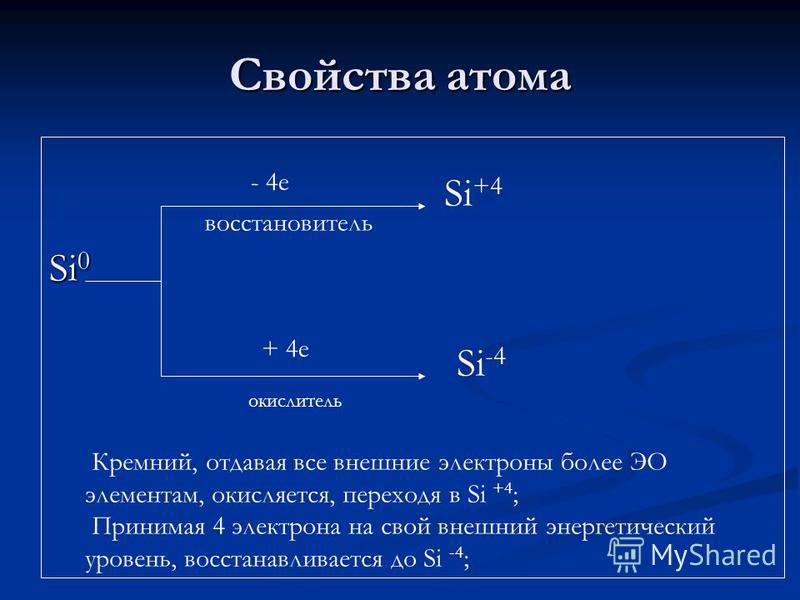
Proprietati atomice Si e agent de reducere + 4 e oxidant Si + 4 Si -4 Silicon, dand tuturor electronilor externi mai multe elemente EO, este oxidat, trecand in Si + 4; Luând 4 electroni la nivelul energiei externe, este redus la Si-4;

Proprietățile fizice ale siliciului Siliconul este un metal nemodificat, există într-o stare cristalină și amorfă. Siliciul cristalin este o substanță din oțel cenușiu, cu un luciu metalic, foarte tare, dar fragilă. Pudră amorfă siliconică - brună. p = 2,33 g / cm3; t pl. = C; t kip. = C;

Structura cristalelor de siliciu O latură de cristal de siliciu este un tip cubic de tip diamant centrat pe față. Dar datorită lungimii lungi a legăturii dintre Si Si, duritatea siliciului este semnificativ mai mică decât cea a diamantului. Siliciul este fragil, numai când este încălzit peste C.

electro proprietățile fizice Silicon element Siliconul elementar este un semiconductor tipic. semiconductor tipic. Proprietățile electrofizice ale siliciului cristalin sunt influențate în mare măsură de impuritățile urmate de acesta. Pentru a obține singurele cristale de siliciu cu conductivitate de tip p, se introduc în siliciu aditivi ai elementelor din grupa a treia de bor, aluminiu, galiu și indiu, cu conductivitatea electronică a aditivului elemente V fosfor, arsen sau grupuri de antimoni.


Flint Flint, acest Flint, această piatră urâtă și foarte urâtă și foarte durabilă, piatră durabilă, a pus bazele unui început de piatră al epocii de piatră - secolul - secolul de unelte de lucru cu pietre. instrumente de flint. Există două motive: - prevalența și disponibilitatea siliciului; - prevalența și disponibilitatea siliciului; - capacitatea de a forma muchii tăietoare ascuțite atunci când sunt cioplite; - capacitatea de a forma muchii tăietoare ascuțite atunci când sunt cioplite;




Știți asta ... Metoda de obținere a siliciului în forma sa pură a fost dezvoltată de Nikolai Nikolaevich Beketov. Siliciul din Rusia este produs în fabrici: Kamensk - Uralsky (Regiunea Sverdlovsk). Kamensk - Uralsky (regiunea Sverdlovsk) Shelekh (regiunea Irkutsk). Shelekh (regiunea Irkutsk).

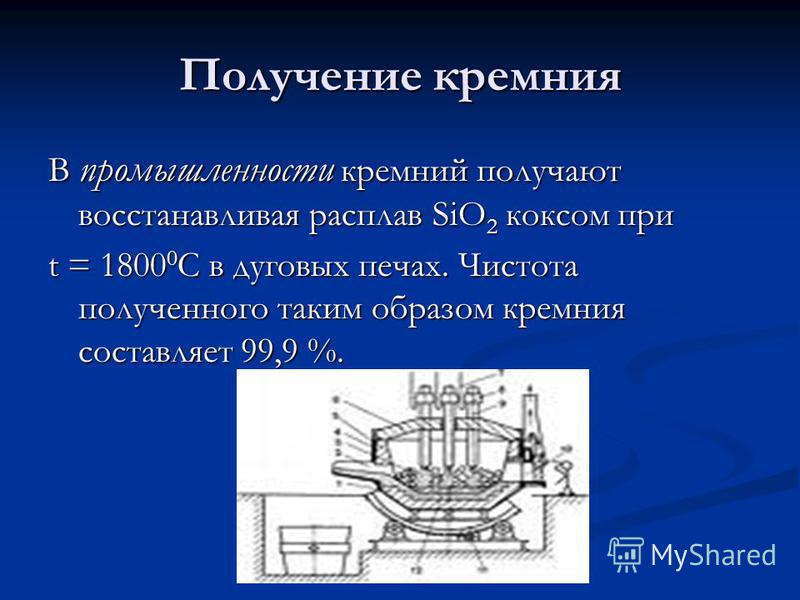
Producția de siliciu În industrie, siliciul este obținut prin reducerea topiturii de SiO 2 cu cocs la t = C în cuptoare cu arc. Puritatea siliciului astfel obținut este de 99,9%.
Obținerea siliciului Metoda de producție de laborator: SiOg Mg 2MgO + Si SiOg 2MgO + Si


Proprietățile chimice ale siliciului Când se încălzește la 400 ° C, siliciul reacționează cu oxigenul pentru a forma dioxid de siliciu: Si + O 2 SiO 2 Si + O 2 SiO 2



![]()
Proprietăți ale oxidului de carbon CO 2 oxid de siliciu oxid de oxizi Rețeta de cristal moleculară Atomic Gaz incolor. Cristalin, solid, refractar. Proprietăți chimice chimice H 2 O + CO 2 = H 2 CO 3 Nu reacționează CO 2 + CaO = CaCO 3 SiO 2 + CaO = CaSiO 3 CO 2 + Ca (OH) 2 = CaCO 3 + H 2 O SiO 2 + NaOH = 2 SiO 3 + H 2 O C02 + 2Mg = 2MgO + C SiO 2 + 2C = 2MgO + Si C + C02 = 2CO SiO2 + 2C = Si + 2CO
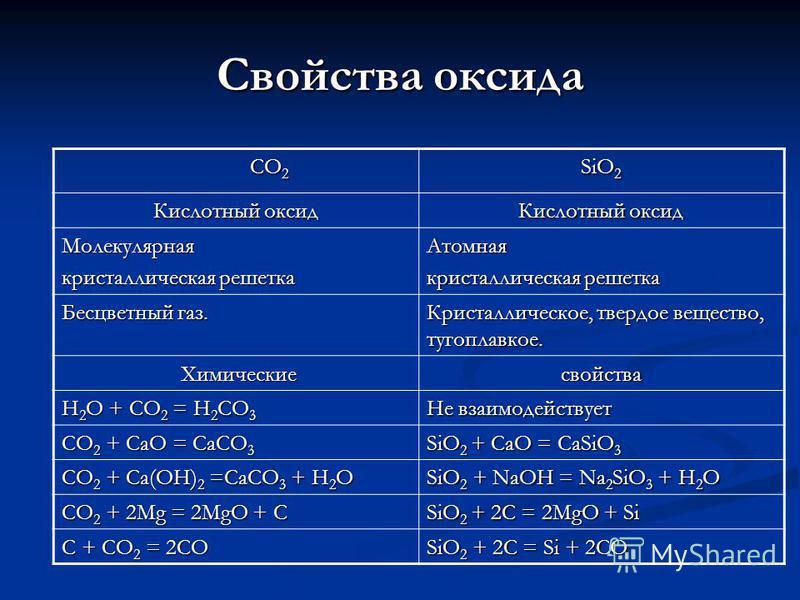
Proprietăți ale acizilor H 2 CO 3 H 2 SiO 3 Dibazic, cu conținut de oxigen, slab, fragil, deoarece liliac. Dibazic, care conține oxigen, slab, insolubil în apă. Primirea: CO 2 + H 2 O = H 2 CO 3 Primirea: SiO 2 + H 2 O = nu poate fi instabilă, fragilă se descompune atunci când este în picioare sau încălzită: H 2 CO 3 = CO 2 + H 2 O Nu poate fi izolată în forma sa pură deoarece se descompune când este încălzit: H 2 SiO 3 = SiO 2 + H 2 O Zn + H 2 CO 3 = ZnCO 3 + H 2 Evoluția gazelor minore __________

Acid sulfuric acid carbonic - carbonați; - hidrocarburi; - silicați; - silicați; Carbonații au toate proprietățile sărurilor, sunt electroliți puternici, disociați complet în ioni (solubili în apă). Numai sărurile de metale alcaline sunt solubile, celelalte formează insolubile sau nu formează deloc săruri (Al +3, Cr +3, Ag +).
![]()



Rolul biologic Cel mai important compus siliciu, SiO 2, este esențial pentru viața plantelor și a animalelor. Multumita lui, stuf, stuf. Datorita lui, stufurile, stufii si coarda stau ferm ca baionetele. iar coapsele stau strânse, ca baionetele. Frunzele ascuțite se taie ca niște frunze ascuțite, tăiate ca niște cuțite, cu miriște pe niște cuțite de câmp, cu miriște pe niște cioburi ca un ace, iar tulpinile de cereale se lipesc ca acele și tulpinile de cereale sunt atât de puternice încât nu permit atât de puternice încât nu permiteți ca terenul din câmpuri să cadă din ploaie și câmpul de vânt din câmpuri pentru a ieși din ploaie și vânt


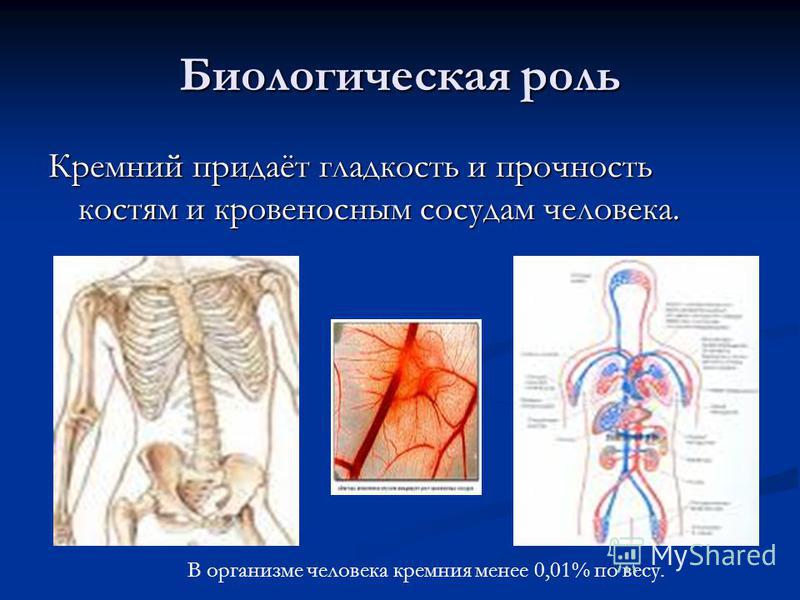
Siliconul este un oligoelement care este în mod constant conținut în corpul uman. Cea mai mare cantitate este conținută în ganglionii limfatici, țesutul conjunctiv al aortei, trahee, păr și piele. Siliciul este necesar pentru a construi celulele epiteliale. Siliconul este un oligoelement care este în mod constant conținut în corpul uman. Cea mai mare cantitate este conținută în ganglionii limfatici, țesutul conjunctiv al aortei, trahee, păr și piele. Siliciul este necesar pentru a construi celulele epiteliale. Siliconul joacă un rol important în procesul de mineralizare a oaselor; necesar pentru a menține elasticitatea peretelui arterial, are un efect pozitiv asupra sistemului imunitar și încetinește procesul de îmbătrânire în țesuturile corpului uman. Conținutul mediu de siliciu din sânge este de 8,25 mg / zi. Odată cu vârsta, nivelul acesteia în organism scade, astfel încât la vârstnici, nevoia de siliciu tinde să crească. Îmbunătățirea absorbției de siliciu de către organism prezența de calciu, magneziu, mangan și potasiu. Siliconul joacă un rol important în procesul de mineralizare a oaselor; necesar pentru a menține elasticitatea peretelui arterial, are un efect pozitiv asupra sistemului imunitar și încetinește procesul de îmbătrânire în țesuturile corpului uman. Conținutul mediu de siliciu din sânge este de 8,25 mg / zi. Odată cu vârsta, nivelul acesteia în organism scade, astfel încât la vârstnici, nevoia de siliciu tinde să crească. Îmbunătățirea absorbției de siliciu de către organism prezența de calciu, magneziu, mangan și potasiu.

Rolul biologic al siliciului este, de asemenea, inclus în compoziția organismelor vii inferioare - diatome și radiolarieni - cele mai delicate bucăți de materie vie, care creează scheleturile lor de frumusețe de neegalat din silice. Siliciul este, de asemenea, parte din organismele vii inferioare - diatome și radiolarieni - cele mai delicate bucăți de materie vie, care creează frumusețea lor de neegalat a scheletelor de silice. Diatome Radiolaria Auto-control 1. Care este locul de siliciu în sistemul periodic: a) 2 perioadă, 4 og. b) 3 perioade, 3 gr. capitol. c) 3 perioade, 4 gr. capitol) 2 perioadă, 4 gr. b) 3 perioade, 3 gr. capitol. c) 3 perioade, 4 gr. capitol. 2. Zăbrele de siliciu: a) ionice; b) atomic; c) moleculară; a) ionic; b) atomic; c) moleculară; 3. În funcție de prevalența în natură a siliciului ... element: a) primul; b) al doilea; c) al treilea; a) primul; b) al doilea; c) al treilea; 4. Siliconul reacționează cu: a) metale, hidrogen, halogeni; a) metale, hidrogen, halogeni; b) metale, halogeni, ușor solubili în alcalii; b) metale, halogeni, ușor solubili în alcalii; c) oxizi, acizi, nemetale. c) oxizi, acizi, nemetale. 5. Săruri de acid silicic: a) silicide; b) hidrosilicate; c) silicați; a) silicide; b) hidrosilicate; c) silicați;

Silicon.
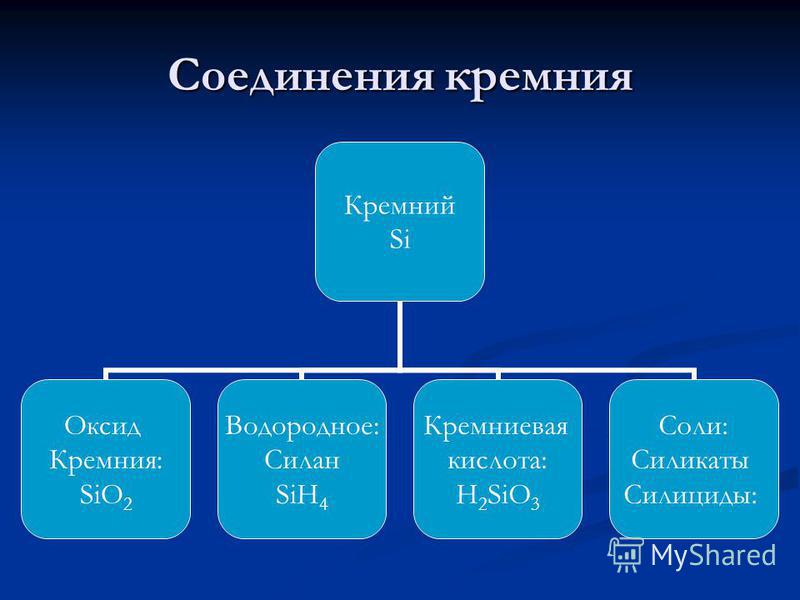
siliciu - un element al principalului subgrup IV al grupului din a treia perioadă a sistemului periodic de elemente chimice DI Mendeleev, cu numărul atomic 14, masa atomică: 28,0855. În compuși, el prezintă de obicei un grad de oxidare de +4 (valența IV) și foarte rar +3, +2 și +1 (valențele, respectiv, III, II și I). În tabelul periodic, siliciul Mendeleev este situat în grupul IVA (A-indică faptul că acesta este principalul subgrup) (în grupul de carbon), în a treia perioadă. non-metalice . Notată cu simbolul si(lat. Siliciu). În formă liberă - pulbere brună sau material compact gri deschis, cu un luciu metalic. Structura laturilor: cubic, diamant.
Starea principală: + 14 Si 14 e 1s 2s 2p 2s 6 3s 2 3p 2, p-element.
2. Proprietăți fizice.
Silicul cristalin este o substanță gri închis cu o luciu de oțel. Structura siliciului este similară cu structura diamantului. În cristalul său, fiecare atom este înconjurat de patru tetraedezi și este legat de ele printr-o legătură covalentă, care este mult mai slabă decât între atomii de carbon dintr-un diamant. Într-un cristal de siliciu, chiar și în condiții normale, unele dintre legăturile covalente sunt distruse. Prin urmare, are electroni liberi, care cauzează o mică conductivitate electrică. Când iluminatul și încălzirea sporesc numărul de legături rupte, ceea ce înseamnă că crește numărul de electroni liberi și crește conductivitatea electrică. Deci, ar trebui să explice proprietățile semiconductoare ale siliciului.
Siliciul este foarte fragil, densitatea acestuia fiind de 2,33 g / cm3. Ca și cărbune, se referă la substanțe refractare.
Siliconul constă din trei izotopi stabili: 2814Si (92,27%), 2914Si (4,68%) și 3014Si (3,05%).
3. Fiind în natură.
Cel mai adesea în natură, siliciul se găsește sub formă silice - compuși pe bază de dioxid de siliciu (IV) SiO2 (aproximativ 12% din masa crustă a pământului). Principalele minerale și roci formate din dioxid de siliciu sunt nisip (râu și cuarț), cuarț și cuarțit, flint și feldspat. Silicatele naturale au o compoziție și o structură complexă. Iată compoziția unor silicați naturali:
ü Feldspar K 2 O × Al 2 O 3 × 6SiO 2,
ü azbest 3MgO × 2SiO 2 × 2H2O,
ü mica K 2 O × 3Al 2 O 3 × 6SiO 2 × 2H 2 O,
ü caolinit 3Al 2O 3 × 2SiO 2 × 2H 2 O.
Cel de-al doilea grup cel mai comun în natura compușilor de siliciu este silicați și alumino-silicați.
Sunt remarcate fapte singulare despre găsirea siliciului pur în forma nativă.
4. Proprietăți chimice ale siliciului și ale compușilor săi.
pe chimice siliciul, cum ar fi carbonul, este un metal nemetalic, dar al său nemetalic este mai puțin pronunțat, deoarece are o rază atomică mai mare. Deoarece atomii de siliciu au 4 electroni la nivelul energiei exterioare, starea de oxidare a parametrilor -4 și +4 este caracteristică siliciului (este cunoscut un compus de siliciu, unde gradul său de oxidare este +2).
Siliconul în condiții normale este destul de inert, ceea ce ar trebui explicat prin rezistența cristalului său. Interacționează direct numai cu fluor:
acizi (cu excepția amestecului de HF fluorhidric și HNO3 nitric)siliciul nu acționează. Cu toate acestea, se dizolvă în hidroxizi de metale alcaline, formând silicat și hidrogen:
Dintre cele două modificări alotropice ale siliciului, cristalinului și amorfului, siliciul amorf este mai activ chimic. El reacționează cu cu oxigen când se încălzește, formând Si02:
precum și cu toți halogenide exemplu:
![]()
La temperaturi ridicate siliciul se conectează cu carbonformarea carboxilului SiC:
Carborundum are o latură de cristal asemănătoare diamantului, în care fiecare atom de siliciu este înconjurat de patru atomi de carbon și invers, iar legăturile covalente sunt foarte puternice, ca în diamant. Prin urmare, în duritate este aproape de diamant. Pietrele de șlefuit și roțile de șlefuit sunt realizate din carbură de siliciu.
Siliciu de magneziu. În reacțiile cu metale active, care au loc cu formarea de silicide, Siliconul acționează ca agent de oxidare:
La temperaturi ridicate, siliciul recuperează multe metale din oxizi lor (!!!)
Silan. Sub acțiunea acidului clorhidric pe silicide, cel mai simplu compus hidrogenic de siliciu este silanul SiH 4:
Silanul este un gaz otrăvitor, cu un miros neplăcut, auto-aprins în aer (!!!):
Oxidul de siliciu (IV).Oxidul de siliciu (IV) este, de asemenea, numit silice. Este o substanță solidă refractară. (punctul de topire 1700 ° C) răspândită în natură în două forme:
1) silice cristalină - sub formă de minerale de cuarț și varietățile sale (cristal de rocă, calcedonie, agat, jaspis, pietre); cuarțul formează baza nisipurilor de cuarț utilizate pe scară largă în construcții și industria silicat;
2) silice amorfă - sub formă de compoziție minerală opală SiO 2 × n H20; formele de pământ de silice amorfă sunt diatomit, tripoli (pământ infuzional); Un exemplu de silice artificială amorfă anhidră este silica gel, care este obținut din metasilicat de sodiu:
Silicagelul are o suprafață dezvoltată și, prin urmare, absoarbe bine umiditatea. .
La 1710 ° se topesc cuarț. Se formează răcirea rapidă a masei topite cuarț de sticlă . Are un coeficient de extindere foarte scăzut, astfel încât sticla fierbinte din cuarț nu se sparge când apa se răcește rapid. Sticlăria de laborator și instrumentele de cercetare științifică sunt realizate din sticlă de cuarț.
Formula cea mai simplă de oxid de siliciu (IV) SO2 este similară cu formula de monoxid de carbon (IV) CO 2. Între timp, proprietățile lor fizice sunt foarte diferite (SiO 2 - solid, CO 2 - gaz). Această diferență se explică prin structura laturilor cristaline. C0 2 cristalizează în rețeaua moleculară, SiO2 - în atomic. Structura de SiO2 într-o imagine plană poate fi reprezentată după cum urmează:
Numărul de coordonare al unui atom de carbon în CO 2 solid este de 2, iar siliciul în Si02 este 4. Fiecare atom de siliciu este închis într-un tetraedru de 4 atomi de oxigen. În același timp, atomul de siliciu este în centru, iar atomii de oxigen sunt localizați la vârfurile tetraedrului . Întreaga bucată de silice poate fi considerată ca un cristal a cărui formulă este (SiO2) n. Această structură de oxid de siliciu (IV) determină duritatea ridicată și refractarea .
Proprietățile chimice ale oxidului de siliciu (IV) SiO 2 se referă la oxizii de acid. Atunci când se topesc cu alcalii solide, se formează oxizi de bază și carbonați, se formează săruri de acid silicic:
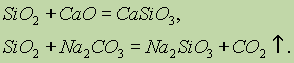
Doar acidul fluorhidric interacționează cu oxidul de siliciu (IV):
Această reacție este utilizată pentru a etanșa sticla. .
Siliconul (IV) nu se dizolvă în apă și nu interacționează chimic cu ea. (!!!) Prin urmare, acidul silicic se obține indirect prin acțiunea cu un acid pe o soluție de silicat de potasiu sau de sodiu:
În acest caz, acidul silicic (în funcție de concentrația soluțiilor inițiale de sare și acid) poate fi obținut atât sub forma unei mase gelatinoase conținând apă, cât și sub forma unei soluții coloidale (sol).
Acid silicic. SiO2 este anhidrida unui număr de acizi siliciici, a căror compoziție poate fi exprimată prin formula generală: xSiO 2 × yH 2 O, unde x și y - numere întregi:
1) x = 1, y = 1: Si02 x H20, adică H2Si03 - acid metasilicic;
2) x = 1, y = 2: Si02 x 2H20, adică H4Si04 - acid ortosilicic;
3) x = 2, y = 1: 2Si02xH20, adică H2Si205 - acid bimetacrynic.
Acidul silicic este construit din unități structurale tetraedrice (în fiecare astfel de unitate, atomul de siliciu se află în centrul tetraedrului și în vârfuri există atomi de oxigen). Legăturile structurale, unite în lanțuri, formează acizi polistilici mai stabili:
Compoziția acestor compuși poate fi exprimată prin formula (H2S03) n. Cu toate acestea, de obicei, acidul silicic este reprezentat de formula H 2 SiO 3. H 2 SiO 3 - acidul este foarte slab, puțin solubil în apă. Când se încălzește cu ușurință se descompune cum ar fi acidul carbonic:
Toți acizii siliciici sunt foarte slabi (mai slabi decât cărbunele).
Silicații. Sărurile tuturor acizilor siliciici sunt chemațisilicați, deși, de regulă, în literatura de specialitate, silicații implică săruri ale acidului metacicicic. Compoziția lor este, de obicei, reprezentată de formula sub formă de compuși ai oxizilor elementelor. De exemplu, silicatul de calciu CaSiO 3 poate fi exprimat ca: CaO × SiO 2.
Silicații compoziției R20xnSi02, în care R20-oxizii de sodiu sau potasiu , sunt numite sticlă solubilă , și soluțiile apoase concentrate - sticlă lichidă . Soda de sodiu este cel mai important..
Când stau în aer, soluțiile de silicate cresc tulbure, deoarece dioxidul de carbon (IV) în aer deplasează acidul silicic din sărurile sale:
Acidul silicic este practic insolubil în apă - această proprietate este folosit ca o reacție calitativă la ionul de SiO3 2-.
Silicatele se obțin prin topirea silicei cu alcalii sau carbonați:
5. Descoperirea ionului SiO 3 2. (Nu gasesc nimic ...)
6. Rolul compușilor de siliciu în formarea solului și în silvicultură.
Pietrele igienice sunt destul de stabile în compoziția lor și conțin în principal compuși de siliciu, aluminiu, fier, alcali, magneziu și calciu. În funcție de conținutul de Si02, rocile igienice sunt împărțite în patru grupe: acid (\u003e 65%), mediu (52-65%), bazic (40-52%) și ultrabazic<40 %). Наиболее представительны две большие группы: кислые и основные породы. Как будет видно в дальнейшем, при характеристике многих типов почв именно этот фактор приуроченности почв к кислым или основным магматическим почвообразующим породам является решающим в отношении генезиса, эволюции и свойств почв.
Pietre igienice acide- granit, pegmatiți, rizoliți, daciți și alții - de obicei au o culoare deschisă și maronie, cu cristale pronunțate de cuart, feldspat, mica. Conținutul de SiO2 din ele este ridicat (mai mult de 65%), cu o cantitate semnificativă de potasiu și sodiu. În același timp, fierul mic și calciu și magneziu sunt neglijabile. Solurile pe rocile acide igneous, de exemplu, pe granit, diferă în stadiile incipiente ale intemperiilor prin friabilitate, caracterul pietriș al materialului sursă. Când se învecinează în condiții umede, ele pierd cu ușurință elemente alcalino-pământoase, rezultând că solul pe aceste substraturi erodate (eluviu de roci) este extrem de sărac, slab fertil.
Principalele roci ignifuge -bazalt, gabbro etc., de regulă, au o culoare întunecată (până la negru). Acestea sunt caracterizate printr-un conținut de SiO2 mai mic comparativ cu rocile acide. Principalele roci igneous sunt relativ bogate în compuși de fier, mangan, crom, cobalt, zinc, titan, nichel, cupru. Produsele din atmosfera lor dobândesc destul de rapid un caracter de argilă, păstrează o reacție alcalină și neutră pentru o lungă perioadă de timp și se disting printr-un conținut crescut de humus și minerale din argilă. Solul de pe aceste pietre este mai fertil.
Pe lângă speciile acide și de bază se găsesc adesea roci igienice de tip tranzitoriu(medii) - roci intruzive ale grupului diorit și omologii lor efuzivi - andeziți. În consecință, solurile de pe aceste roci dobândesc caracteristici similare cu cele limitate la roci acide sau de bază. Mult mai puțin comună rase ultrabasice:peridotiți și picriți, care au cel mai mic conținut de SiO2.
Pietre metamorfice -tranziție între pietrele cristaline și sedimentare masive. Stâncile antice sedimentare sub scufundări, presiuni ridicate și temperaturi sunt metamorfozate, formând gneisses, serpentinite, marmură, cuarțite, șisturi. Gneisses sunt deosebit de similare în compoziție cu granit. Solurile care formează pe aceste roci au caracteristici similare cu solurile de pe rocile acide igneous.
Clor.
1. Poziția aluminiului în tabelul D. I. Mendeleev. Structura atomului, gradul de oxidare manifestat.
clor - un element al subgrupului principal al grupului VII, a 3-a perioadă, cu numărul atomic 17. Este notat cu simbolul Cl (lățimea Chlorum). Activitate chimică non-metalice . Inclus în grupul de halogen .
Simplă substanță clor în condiții normale - gazul verde, galben-verzui, este mai greu decât aerul, cu miros puternic . Molecula de clor diatomic (formula Cl 2).
Starea principală: +17 CI 17e1s 2s 2p 2p 6 3s 2 3p 5, p-element. Art.: -1 +1 +3 +5 +7.
Structura carcasei electronice.
La nivelul de valență a atomului de clor conține 1 electron nepărsat : 1 s 2 2s 2 2p 6 3s 2 3p 5, deci valența de 1 pentru un atom de clor este foarte stabilă. Datorită prezenței în atomul de clor a orbitalilor d-subblelu neocupați, atomul de clor poate prezenta alte grade de oxidare. Schema de formare a stărilor excitate ale atomului:
Sunt cunoscuți, de asemenea, compuși ai clorului în care atomul de clor prezintă în mod formal valența 4 și 6, de exemplu Cl02 și Cl206. Cu toate acestea, acești compuși sunt radicali, adică au un electron neparat.
2. Proprietăți fizice.
În condiții normale, clorul este un gaz galben-verde cu miros sufocant. Unele proprietăți fizice sunt prezentate mai jos.
Densitate: 3.214 g / l, lichid - la -35 ° C - 1.557, TV. la -105 ° C - 1,9 g / cm3.
Punct de topire: 172,2 K
Punct de fierbere: 238,6 K
Căldura de fuziune: 6,41 kJ / mol
Căldura de evaporare: 20,41 kJ / mol.
Gazul de clor este relativ ușor de lichefiere. Începând cu o presiune de 0,8 MPa (8 atmosfere), clorul va fi lichid deja la temperatura camerei. Când se răcește la o temperatură de -34 ° C, clorul devine, de asemenea, lichid la presiune atmosferică normală. Clorul lichid este un lichid galben-verde cu efect coroziv foarte mare (datorită unei concentrații ridicate de molecule). Prin creșterea presiunii, puteți obține existența clorului lichid până la o temperatură de +144 ° C (temperatură critică) la o presiune critică de 7,6 MPa. În ceea ce privește conductivitatea electrică, clorul lichid are loc printre cei mai puternici izolatori: conduce de aproape un miliard de ori mai rău decât apa distilată și 10 de 22 de ori mai rău decât argintul. Viteza sunetului în clor este de aproximativ o dată și jumătate mai mică decât în aer.
3. Fiind în natură.
În natură, există două izotopi de clor 35CI și 37C1. Clorul este cel mai comun halogen din scoarța pământului. . Clorul este foarte activ - se conectează direct cu aproape toate elementele sistemului periodic. Prin urmare, în natură, se găsește doar sub formă de compuși în compoziția mineralelor:
ü halit NaCl,
ü sylvina KCl,
ü silvinită KCl · NaCl,
ü Bischofite MgCl2 · 6H2O,
ü carnalit KCI · MgCl2 · 6H2O,
ü Cainit KCI · MgS04 · 3H2O.
Cele mai mari rezerve de clor sunt conținute în săruri, ape, mări și oceane (conținutul în apa de mare este de 19 g / l). Clorul reprezintă 0,024% din numărul total de atomi din scoarța pământului; numărul clarke (numerele care exprimă conținutul mediu al elementelor chimice din scoarța pământului, hidrosferă, Pământ, corpuri spațiale, sisteme geochimice sau cosmochimice etc., raportat la masa totală a acestui sistem, exprimată în% sau g / kg). clor - 0,017%. Corpul uman conține ioni de clor 0,25% în greutate. La oameni și animale, clorul se găsește în principal în fluidele intercelulare (inclusiv sângele) și joacă un rol important în reglarea proceselor osmotice, precum și în procesele asociate cu activitatea celulelor nervoase.
4. Proprietățile chimice ale clorului și ale compușilor săi. Obținerea clorului.
Structura atomului de siliciu. Si. 14. Starea excitat. E. 3d. 3p. 3s. E. 3d. 3p. 3s. 1s 2s 2p 3s 3p. 2e 8e 4e. 2. 2. 6. 2. 2.
Imaginea 3 a prezentării "Silicon" la lecții de chimie pe tema "siliciu"Dimensiuni: 960 x 720 pixeli, format: jpg. Pentru a descărca o imagine gratuită pentru o lecție de chimie, faceți clic dreapta pe imagine și faceți clic pe "Salvați imaginea ca ...". Pentru a arăta imaginile în lecție, puteți descărca gratuit și gratuit prezentarea "Silicon.ppt" cu toate imaginile dintr-o arhivă zip. Dimensiunea arhivei - 562 KB.
Descărcați prezentareasiliciu
"Silicon și compușii săi" - Structura și proprietățile atomilor. Semiconductor. t topit (Si) = 1415 ° C, topit (diamant) = 3730 ° C Obținerea siliciului. Descoperirea siliciului. Este inclusă și în compoziția plantelor și a animalelor. Proprietățile fizice ale siliciului. Prin urmare, cărămida este ceramică, iar dalele și fragmentele amforei grecești antice sunt, de asemenea, ceramică. Obiective: Proprietățile chimice ale siliciului.
"Compuși de siliciu" - Silicon și compușii săi. Proprietăți chimice ale SiO2. Silan. Obținerea acidului silicic. Proprietăți de siliciu. Oxidul de siliciu. Silicați naturali. Starea de oxidare Stras. Topaz. Obținerea de siliciu în laborator. Fiind în natură. Grile de cristal. Descoperirea siliciului. Ametist. Obținerea siliciului.
"Izotopi de siliciu" - Separarea izotopilor de siliciu. Producția de siliciu policristalin. Perspective de utilizare a siliciului monoizotopic. Dilatarea izotopică la creșterea unui singur cristal dintr-un creuzet cu cuarț. Producția de semințe de cristal. Dependența poziției maximului benzii Raman pe masa atomică.
"Lecția siliconică" - Care dintre cele mai importante elemente chimice în natură și non-viață? Oxizi de carbon și siliciu. Substanța este transparentă. Cu privire la manifestarea proprietatilor nemetalice si metalice. Rezumă reflecția. Testarea finală. Oxizi de carbon și hidroxizi de siliciu? Starea de agregare: a) lichid, b) gaz, c) solid.
Silicon - Siliconul este o substanță simplă. Proprietăți fizice. Oxidul de siliciu (IV). Siliciuri. Înțeles pentru organismele vii. Interacțiunea cu metalele. Interacțiunea cu nemetalele. Carbid de siliciu. Silicon în natură. Silicon. Produse din industria silicatului. Una dintre tipurile de compuși de siliciu natural este silicatul.
"Carbon și siliciu" - oxid de siliciu (IV). Elemente din grupa IV a subgrupului principal. Toxicitate. 7. Interesant despre carbon. Silicații. Slip la atingere. Diamond este cea mai grea substanță naturală. Proprietăți chimice Mai mult de 99% din carbonul din atmosferă are forma dioxidului de carbon. Carburilor. 6. Aplicație. Una dintre cele mai moi dintre solide.
Sunt 6 prezentări în total.
