Formula chimică a acidului sulfuric. Acid sulfuric: proprietăți chimice, preparare
H2S03, acid dibazic slab. Într-o formă liberă nu este alocată, există în soluții de apă. Acid sulfuric sulfuric ... Dictionar encyclopedic mare
Acid sulfuric - (H2S03) acid slab dibazic. Există numai în soluții apoase. Sare de la S. la. Aplicată în industria hârtiei și industriei alimentare. Vezi deasemenea acizii și anhidridele ... Enciclopedie rusă privind protecția muncii
acid sulfuric - - [A.S. Goldberg. Engleză rusă dicționar de energie. 2006] Subiecte de energie în general EN acid sulfuros ... Ghidul Traducătorului Tehnic
H2S03, acid dibazic slab. Într-o formă liberă nu este alocată, există în soluții de apă. Acid sulfuric sulfit. * * * Acid sulfuric, acid sulfuric, H2SO3, acid dibazic slab. Gratuitul nu este selectat, ... ... Dicționar encyclopedic
acid sulfuric - sulfito rūgštis statusas T sritis chemija formulė H2SO3 atitikmenys: angl. acid sulfuric rus. acid sulfuric ryšiai: sinonimas - vandenilio trioksosulfatas (2-) ... Chemijos terminų aiškinamasis žodynas
H2SO3, acid slab dibazic, corespunzând gradului de oxidare a sulfului +4. Cunoscută numai în soluții apoase diluate. Constantele de disociere: K1 = 1,6 · 10 2, K2 = 1,0 · 107 (18 ° C). Se dă două rânduri de săruri: sulfuri normale și acru ... ... Marea Enciclopedie Sovietică
H2S03, acid dibazic slab. În forma liberă nu este evidențiată, există în ape. p rah. Săruri S. k. Sulfite ... Stiinta naturii. Dicționar encyclopedic
Vedeți Sulfur ... Dicționar encyclopedic al FA Brockhaus și I.A. Efron
Dioxidul de sulf (dioxidul) se formează prin arderea de sulf în aer sau oxigen. De asemenea, se obține prin calcinarea sulfurilor metalice în aer ("ardere"), de exemplu, a piriților de fier:
Conform acestei reacții, dioxidul de sulf este obținut de obicei în industrie (pentru alte metode industriale de obținere a cm, 9 § 131).
Dioxidul de sulf este un gaz incolor ("dioxid de sulf"), cu o epașă ascuțită de sulf fierbinte. Se condensează destul de ușor într-un lichid incolor care fierbe. Când lichidul se evaporă, există o scădere puternică a temperaturii (înainte).
Dioxidul de sulf este foarte solubil în apă (aproximativ 40 de volume în 1 volum de apă la); în același timp, reacționează cu apă parțial și se formează acid sulfuric:
Astfel, dioxidul de sulf este anhidrida acidului sulfuric. Când este încălzit, solubilitatea scade și echilibrul se deplasează spre stânga; treptat, tot dioxidul de sulf este eliberat din soluție.
Molecula este construită în mod similar cu molecula de ozon. Nucleul atomilor constituenți formează un triunghi isoscel:
Aici, atomul de sulf, ca și atomul central de oxigen din molecula de ozon, este în starea α-hibridizare și unghiul este aproape de. Orientat perpendicular pe planul moleculei, orbitalul atomului de sulf nu participă la hibridizare. Datorită orbitalilor și orbitalilor orientați în mod similar cu atomii de oxigen, se formează o legătură tri-centrală; perechea de electroni care o transportă aparține tuturor celor trei atomi ai moleculei.
Dioxidul de sulf este utilizat pentru producerea acidului sulfuric și, de asemenea, în cantități mult mai mici pentru înlăturarea paielor, a lânii, a mătăsii și a dezinfectantului (pentru distrugerea ciupercilor de mucegai în subsoluri, pivnițe, butoaie de vin, rezervoare de fermentație).
Acidul sulfuric este un compus foarte fragil. Este cunoscut numai în soluții apoase. Când se încearcă izolarea acidului sulfuros, acesta se dezintegrează în apă. De exemplu, atunci când acidul sulfuric concentrat acționează asupra sulfitului de sodiu, dioxidul de sulf este eliberat în locul acidului sulfuric:
Soluția de acid sulfuric trebuie protejată de aer, în caz contrar absorbția oxigenului din aer se oxidează lent la acidul sulfuric:
Acidul sulfuric este un bun agent reducător. De exemplu, halogenurile libere sunt restaurate de acesta la halogenuri de hidrogen:
![]()
Totuși, atunci când interacționează cu agenți reducători puternici, acidul sulfuric poate juca rolul unui agent de oxidare. Deci, reacția sa cu hidrogen sulfurat se desfășoară în principal conform ecuației:
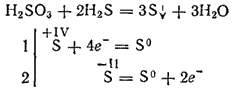
Fiind acid dibazic, acidul sulfuric formează două rânduri de săruri. Sărurile sale medii se numesc sulfuri, săruri acide - hidrosulfuri.
Ca și acid, sulfiții și hidrosulfurile sunt agenți reducători. Când sunt oxidați, se obțin săruri de acid sulfuric.
Sulfiticii celor mai activi metale în timpul calcinării se descompun prin formarea de sulfuri și sulfați (reacție de autooxidare - auto-reducere):
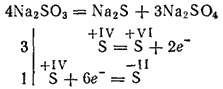
Sulfurile de potasiu și sodiu sunt utilizate pentru albirea unor materiale din industria textilă pentru vopsirea țesăturilor, în fotografie. Soluția (această sare există numai în soluție) este utilizată pentru prelucrarea lemnului în așa numita pastă de sulfit, din care se obține apoi hârtia.
Acidul sulfuric este capabil să reacționeze cu oxigenul. Aceasta formează acid sulfuric. Această reacție durează foarte mult și este posibilă numai dacă regulile de stocare sunt încălcate. Acidul sulfuric are atât proprietăți oxidante, cât și proprietăți de reducere. Cu ajutorul acestuia puteți obține acizi halogeni. O soluție apoasă când reacționează cu clorul formează acid clorhidric și acid sulfuric.
Când reacționează cu agenți reducători puternici, acidul sulfuric joacă rolul unui agent de oxidare. Una dintre aceste substanțe este hidrogenul sulfurat, un gaz cu un miros foarte neplăcut. Interacționează cu o soluție apoasă de acid sulfuric, formând sulf și apă. Sărurile de acid sulfuric au de asemenea proprietăți de reducere. Ele sunt împărțite în sulfuri și hidrosulfuri. Reacțiile de oxidare ale acestor săruri produc acid sulfuric.
Producția de acid sulfuric
Acidul sulfuric se formează numai prin interacțiunea dioxidului de sulf și a apei. Necesitatea de a obține gaz acru. Acest lucru se poate face cu cupru și acid sulfuric. Vărsați ușor acidul sulfuric concentrat în tub și aruncați o bucată de cupru în el. Încălziți tubul cu o lampă de duș.
Ca rezultat al încălzirii, se formează sulfat de cupru (sulfat de cupru), apă și dioxid de sulf, care, cu ajutorul unui tub special, trebuie adus în con cu apă curată. În acest mod, se poate obține acid sulfuric.
Amintiți-vă că dioxidul de sulf este dăunător oamenilor. Cauzează lezarea căilor respiratorii, pierderea poftei de mâncare și durerea de cap. Inhalarea prelungită poate provoca leșin. Când lucrați cu el, aveți nevoie de prudență.
Utilizarea acidului sulfuric
Acidul sulfuric are proprietăți antiseptice. Se folosește la dezinfecția suprafețelor, fermentarea boabelor. Poate fi folosit pentru înălbirea unor substanțe care se descompun când reacționează cu oxidanți puternici (de exemplu, clor). Astfel de substanțe includ lână, mătase, hârtie și altele. Proprietățile sale antibacteriene sunt folosite pentru a preveni fermentarea vinului în butoaie. Astfel, băutura nobilă poate fi păstrată pentru o perioadă lungă de timp, obținând un gust nobil și o aromă unică.
Acidul sulfuric este utilizat în fabricarea hârtiei. Adăugarea acestui acid este inclusă în tehnologia producției de pulbere de sulfit. Apoi, se tratează cu o soluție de hidroxid de calciu pentru a lega fibrele împreună.
