Proprietățile fizice ale sio2. Compuși de oxigen. Silicon (II) SiO
Oxid de siliciu (II) SiO. În natură, nu se produce, ci se poate obține prin reacție:
SiO2 + Si\u003e 2 SiO.
Sub presiune normală, sublimarea monoxidului de siliciu începe la aproximativ 1200 ° C (când materiile prime în sine practic nu se evaporă încă). În perechi, SiO este un compus individual. Energia de disociere a elementelor este de 789 kJ / mol. Conversia la o stare solidă poate fi realizată numai prin răcirea rapidă ("stingerea") a fazei gazoase. Altfel, dismutația prin ecuație are timp să treacă:
2 SiO = Si02 + Si.
Monoxidul de siliciu este oxidat încet de oxigenul atmosferic și se dizolvă rapid în alcalii pentru a forma săruri de acid silicic și eliberarea de hidrogen. Este ușor de electrificat prin frecare, obținând o încărcare negativă puternică.
Oxidul de siliciu (IV) SiO2.Oxidul de siliciu (IV) este denumit și silice. Este o substanță solidă refractară. (punct de topire 1700 ° C)răspândită în natură în două forme: 1) silice cristalină - sub formă de minerale de cuarț și varietățile sale (cristal de rocă, calcedonie, agat, jaspis, pietre); cuarțul formează baza nisipurilor de cuart utilizate pe scară largă în construcții și în industria silicatului; 2) silice amorfă - sub formă de compoziție de opal mineral SiO2 nH20; formele de pământ de silice amorfă sunt diatomit, tripoli (pământ infuzional); Un exemplu de silice artificială amorfă anhidră este silica gel, care este obținut din metasilicat de sodiu:
Silica gel are o suprafață dezvoltată și, prin urmare, absoarbe bine umiditatea.
La 1710 ° se topesc cuarț. Cu răcirea rapidă a masei topite se formează sticlă de cuarț. Are un coeficient de extindere foarte scăzut, astfel încât sticla fierbinte din cuarț nu se sparge când apa se răcește rapid. Sticlăria de laborator și instrumentele de cercetare științifică sunt realizate din sticlă de cuarț.
Structura de SiO2 într-o imagine plană poate fi reprezentată după cum urmează:
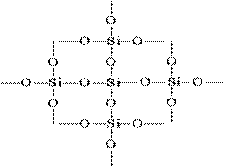
Fiecare atom de siliciu este închis într-un tetraedru de 4 atomi de oxigen. În acest caz, atomul de siliciu este situat în centru, iar atomii de oxigen sunt localizați pe vârfurile tetraedrului. Întreaga bucată de silice poate fi considerată ca un cristal a cărui formulă este (SiO2) n. O astfel de structură de oxid de siliciu (IV) determină duritatea ridicată și refractarea.
Proprietățile chimice ale oxidului de siliciu (IV) SiO 2 se referă la oxizii de acid. Atunci când se topesc cu alcalii solide, se formează oxizi de bază și carbonați, se formează săruri de acid silicic:
Doar acidul fluorhidric interacționează cu oxidul de siliciu (IV) (gravura de sticlă):
SiO2 + HF - SiF4 + H20
Oxidul de siliciu (IV) nu se dizolvă în apă și nu interacționează chimic cu acesta. Prin urmare, acidul silicic este obținut indirect, de exemplu, prin hidroliză:
SiS 2 + H 2 O ↔ H 2 S + H 4 SiO 4 acid ortosilic.
H4SiO4 este solubil, atunci când este încălzit sau în picioare, un proces de polimerizare este în curs de desfășurare:
2 H 4 SiO 4 → H 2 O + H 6 Si 2 O 7 acid diortocerminic.
2 H 6 Si 2 O 7 → H 2 O + H 10 Si 4 O 13 acid tetraorotremilicic.
Ea închide inelul:
H 10 Si 4O 13 → H 2 O + (H 2 SiO 3) 4 acid tetrametacicicic.
În acest caz, acidul silicic (în funcție de concentrația soluțiilor inițiale de sare și acid) poate fi obținut atât sub forma unei mase gelatinoase conținând apă, cât și sub forma unei soluții coloidale (sol). Compoziția acidului silicic obținut depinde de materiile prime și de condițiile de preparare. Toți acizii siliciici sunt foarte slabi (mai slabi decât cărbunele).
Dacă acidul carbonic într-o soluție eliberează acidul silicic din sărurile sale, atunci reacția inversă are loc în timpul calcinării. Primul se datorează rezistenței inferioare (grad de disociere) a acidului silicic, al doilea - volatilitatea mai scăzută atunci când este încălzită.
Când se încălzesc acizii polisilicici și deshidratarea lor treptată se poate obține SiO2 fin, care se numește silicagel . Ea absoarbe bine apa, am plasat-o in dispozitive pentru a preveni oxidarea elementelor scumpe.
Germania subgrupă
Ge (+4) Sn (+2, +4) Pb(+2) - stări de oxidare rezistente
Germaniul a fost prezis de DI Mendeleev în 1871 și a fost descoperit în 1886. Tin și plumb aparțin elementelor cele mai cunoscute omenirii de mult timp: egiptenii au reușit să le miroase din minereuri mai mult de 3000 de ani î.Hr. e. În India, plumbul a devenit cunoscut în jur de 2500 de ani, iar în 1500 de ani î.Hr. e. Tăietor de tocat produs în China antică.
Noțiuni de bază.Compușii naturali de germaniu sunt transformați în GeO2 și reduși cu hidrogen:
GeO 2 + H 2 t → Ge + H 2 O la temperaturi de aproximativ 1000 ° C
Stratul este obținut din minerale naturale cassiterite(Sn02):
SnO 2 + C → Sn + CO.
Cea mai simplă schemă de reducere a plumbului industrial se bazează pe două reacții succesive:
PbS + O 2 → SO 2 + PbO Galena(PbS) este ars și apoi redus cu cărbune:
PbO + C → CO + Pb.
Aplicație.Toate cele trei elemente sunt foarte importante pentru tehnologia modernă. Unele compuși de staniu și plumb sunt, de asemenea, de o utilizare considerabilă. Derivații de plumb sunt foarte toxici.
Germanium este un tipic semiconductor (n-tip cu o lățime de bandgap de 0.75 eV) și găsește diverse utilizări în ingineria electrică. Este cel mai utilizat pentru fabricarea redresoarelor de curent alternativ.. Această aplicație se bazează pe conductivitatea unipolară care rezultă din contactul dintre germaniul pur și aliajul de germaniu cu indiu. Curentul (fluxul de electroni) trece într-o astfel de instalație practic numai din germaniu în aliaj, dar nu invers. Redresoarele de germaniu se caracterizează printr-o eficiență extrem de ridicată (circa 98%) și o durată de funcționare foarte mare (cu funcționarea corespunzătoare). Principalul dezavantaj al acestor redresoare este sensibilitatea lor la încălzire - peste 70 ° C, eficiența lor scade rapid.
Domeniu important de utilizare germania este o optică în infraroșu, deoarece razele cu o lungime de undă mai mare de 2 microni, el practic nu întârzie. Dimpotrivă, în lumina și în apropierea acestuia (0,2 - 2 microni), germaniul absoarbe intens energia. Dacă o suprafață metalică lucioasă (care stochează căldură bine, dar nu se încălzește bine) este acoperită cu film de germaniu, atunci suprafața se încălzește mult mai mult decât fără un film. Sa raportat că într-un butoi preparat în acest fel sub acțiunea razelor soarelui se poate obține apă fiartă.
Tin este utilizat în principal pentru a fi pregătit pentru a fi protejat de rugină. (tablă de tablă pentru industria de conserve). Grosimea acestor acoperiri de tablă este foarte mică - de ordinul micronilor. Sub formă de foi subțiri (așa-numitele Stanniole) se consumă staniu pentru fabricarea condensatoarelor din industria electrică . Plumbul este utilizat pentru fabricarea plăcilor de baterii, a plăcilor de cabluri electrice, a gloanțelor și a împușcăturilor, pentru a proteja împotriva razelor X și a razelor g, precum și în industria chimică (conducte etc.). Cantități foarte mari de staniu și plumb sunt cheltuite pentru fabricarea unui număr de aliaje importante din punct de vedere tehnic.
Cele mai importante dintre acestea sunt bronzurile diverse (aliajele Cu și Sn), aliajele pentru rulmenți (babbite, de obicei făcute pe bază de Pb sau Sn și conținând de asemenea Sb și Cu), aliaje tipografice (5-30% Sn, 10-20% Sb, restul este Pb) și de lipire uzuală "moale" (30-70% Sn, 70-30% Pb). Acesta poate fi adesea înlocuit cu un aliaj mai ieftin de 90% Pb, 6% Sn, 4% Sb. De mare importanță sunt aliajele pentru rulmenți cu o compoziție aproximativă de 98% Pb, 1% Ca, 1% Na.
Silica (silice, silice) este o substanță formată din cristale incolore, cu o rezistență ridicată, duritate și refractare. Dioxidul de siliciu este rezistent la acizi și nu interacționează cu apa. Cu o creștere a temperaturii de reacție, substanța interacționează cu alcalii, se dizolvă în acid fluorhidric, este un dielectric excelent.
În natură, dioxidul de siliciu este distribuit pe scară largă: oxidul de siliciu cristalin este reprezentat de minerale cum ar fi jasper, agate (compuși ai dioxidului de siliciu cristalin), cristal de rock (cristale mari de materie), cuarț (dioxid de siliciu liber), calcedon, ametist, morion, topaz dioxid de siliciu).
În condiții normale (la temperatura și presiunea naturală ambientală), există trei modificări cristaline ale dioxidului de siliciu - tridiit, cuarț și cristobalit. Când crește temperatura, dioxidul de siliciu se transformă mai întâi în coezit, apoi în stishovite (un mineral găsit în 1962 într-un crater de meteorit). Potrivit studiilor, este stishovit, un derivat al dioxidului de siliciu, care controlează o mare parte a mantalei Pământului.
Formula chimică a substanței - SiO 2
Prepararea silicei
Dioxidul de bioxid de siliciu se produce industrial la fabricile de cuarț care produc concentrat de cuart pur, care este apoi utilizat în industria chimică și electronică, în fabricarea de optică, umpluturi de cauciuc și vopsele și lacuri, fabricarea bijuteriilor etc. Dioxidul de siliciu natural, altfel numit siliciu, este utilizat pe scară largă în construcții (materiale de izolare din beton, nisip, fonic și termoizolant).
Sinteza dioxidului de siliciu prin metoda sintetică se realizează prin acțiunea acizilor pe silicat de sodiu, în unele cazuri pe alte silicate solubile sau prin metoda coagulării silicei coloidale sub influența ionilor. În plus, dioxidul de siliciu este produs prin oxidarea siliciului cu oxigen la o temperatură de aproximativ 500 de grade Celsius.
Aplicarea dioxidului de siliciu
Materialele care conțin siliciu sunt utilizate pe scară largă atât în domeniul tehnologiilor avansate, cât și în viața de zi cu zi. Dioxidul de siliciu se folosește la fabricarea sticlei, a ceramicii, a produselor din beton, a materialelor abrazive, precum și în domeniul radiotehnicii, instalațiilor ultrasonice, brichetelor etc. În combinație cu un număr de ingrediente, silicele este utilizat la fabricarea cablurilor cu fibră optică.
Dioxidul de siliciu amorf neporos este de asemenea utilizat în industria alimentară ca aditiv, înregistrat sub numărul E551, împiedicând aglomerarea și aglomerarea produsului principal. bioxid  siliciul alimentar este utilizat în industria farmaceutică ca enterosorbent de droguri, în fabricarea de paste de dinți. Substanța se găsește în chipsuri, biscuiți, bastoane de porumb, cafea instant, etc.
siliciul alimentar este utilizat în industria farmaceutică ca enterosorbent de droguri, în fabricarea de paste de dinți. Substanța se găsește în chipsuri, biscuiți, bastoane de porumb, cafea instant, etc.
Silica Harm
A confirmat oficial că substanța dioxidului de siliciu trece prin tractul gastrointestinal neschimbată, după care este complet eliminată din organism. Potrivit unui studiu de 15 ani efectuat de experții francezi, consumul de alcool bogat în apă potabilă reduce riscul de apariție a bolii Alzheimer cu 10%.
Astfel, informațiile despre pericolele dioxidului de siliciu, care este o substanță inertă chimic, sunt false: suplimentul alimentar E551, ingerat oral, este complet sigur pentru sănătate.
Oxidul de siliciu SiO2 este o substanță solidă, foarte refractară (cu punct de topire mai mare de 1700 ° C), distribuită pe scară largă în natură, unde se găsește în principal sub formă de minerale de cuarț, precum și cristobalit și tridymit.
La temperaturile obișnuite, cuarțul este o modificare stabilă, cu temperaturi în creștere, se observă transformări polimorfe:
Nu există silice a tuturor modificărilor sub formă de monomer; este întotdeauna polimeric și "construit" de tetraedru care formează o lattică foarte puternică atomică
Fiecare atom de siliciu din cristalele (SiO2) n este înconjurat tetraedral de patru atomi de oxigen, fiecare fiind legat de punți. Prin intermediul unui atom de oxigen obișnuit, tetraedrele în diferite unghiuri se leagă una de cealaltă, formând o rețea tridimensională continuă; aranjamentul reciproc al tetraedrelor în spațiu determină una sau alta modificare a silicei.
În diferite modificări ale puterii legăturilor cu silice variază. Aceasta afectează magnitudinea unghiurilor Si-O-Si și distanțele Si-O, de exemplu, unghiul de legătură Si-O-Si în diverse modificări ale silicei variază de la 120 la 180 °. Transitions quartz-tridymite-cristobalite sunt însoțite de ruperea și transformarea legăturilor, care pot apărea numai la temperaturi ridicate.
Quartz. Adesea găsită în natură sub formă de cristale extrem de bine formate, uneori de dimensiuni considerabile. Cristalele sunt formate din tetraedru dispus în formă de spirală în jurul axei centrale, sub forma unei spirale. În același cristal, direcția spiralei poate fi opusă. Astfel de cristale sunt izomeri optici. Ele rotesc planul polarizării luminii și pot fi atât drepte, cât și stângaci. Acestea și alte cristale diferă ca subiect dintr-o imagine în oglindă.
Cuartul este folosit în diferite domenii ale științei și tehnologiei, iar cristalele sale sunt adesea cultivate în mod artificial. Unele tipuri de cuarț au nume speciale. Cristalele incolore transparente se numesc cristal de rock. Există, de asemenea, varietăți colorate de cuarț: cuart de trandafir, violet (ametist), maro închis (topaz fumător), verde (crisoprază) etc. Modificarea cristalină a cuarțului cu adaosuri de alte substanțe se numește calcedonie. Soiurile de chalcedon sunt agate, jaspis și altele. Catedra de cristal și varietăți colorate de cuart sunt folosite ca pietre prețioase și semiprețioase.
Tridimitul apare în roci vulcanice, dar în cantități foarte mici. Cunoscută origine tridymite și meteorit.
Cristobalitul în natură se găsește uneori sub formă de mici cristale încorporate în lavă, cum ar fi tridimita. Tridimitul și cristobalitul au o structură mai "liberă" decât cuarțul. Astfel, densitatea cristobalitei, tridymitului și cuarțului este de 2,32; 2,26 și respectiv 2,65 g / cm3.
Siliciul topit cu răcire lentă formează cu ușurință sticlă amorfă de cuarț. Siliciul sub formă de sticlă se găsește și în natură. Densitatea sticlei amorfe este de 2,20 g / cm3 - mai mică decât cea a tuturor modificărilor cristaline. Sticla de cuarț are un ușor coeficient de temperatură de expansiune, prin urmare, este utilizat pentru a pregăti sticla de laborator rezistentă la schimbări bruște de temperatură.
Toate modificările de silice în apă sunt practic insolubile (la o temperatură de 25 ° C, solubilitatea cuarțului este 7, cristobalit - 12, tridymit - 16, sticlă de cuarț - 83 mg / l). Prin urmare, în condiții normale, numai soluțiile alcaline și acidul fluorhidric acționează asupra lor:
Si02 + 2KO = K2Si03 + H20, (1)
Si02 + 4HF = SiF4 + 2H20. (2)
Ultima reacție este utilizată în "gravarea" sticlei.
Oxidul de siliciu adăugat reacționează cu oxizi de bază, baze (reacția (1)) și carbonați pentru a forma silicați:
Si02 + CaO = CaSi03, (3)
Si02 + Na2C03 = Na2Si03 + C02. (4)
Reacțiile (3) și (4) stau la baza producției industriale de diverse tipuri de sticlă, precum și a cimentului. Astfel, compoziția sticlei obișnuite (de exemplu, fereastra, pentru fabricarea vesela) este exprimată prin formula Na2O. CaO. 6Si02. Astfel de sticlă este produsă prin topirea unui amestec de sifon, nisip și calcar. Procesul se desfășoară la o temperatură de ~ 1400 ° C până la eliminarea completă a gazelor:
Na2C03 + CaC03 + 6Si02 = Na2O. CaO. 6Si02 + 2CO2.
Pentru clasele speciale de sticlă - refractar, "incasabil" - atunci când gătiți, adăugați oxizi de bariu, plumb, bor. Pentru a obține ochelari colorați, se introduc de asemenea și alți aditivi, de exemplu, adăugarea de oxid de cobalt Co 2 O 3 dă o culoare albastră, oxid de crom Cr 2 O 3 - verde, dioxid de mangan MnO 2 - roz.
Oxidul de oxid de siliciu este o anhidridă a unui număr de acizi siliciici, a căror compoziție poate fi exprimată prin formula generală xSiO2 · yH2O, unde x și y sunt numere întregi: 1) x = 1, y = 1: SiO2. H 2 Oh, adică H2Si03 - acid metasilicic; 1) x = 1, y = 2: Si02. 2H20, adică acid ortosilicic; 1) x = 2, y = 1: 2Si02. H 2 Oh, adică H 2 Si 2 O 5 - acid bilietlic de siliciu.
Acizii ale căror molecule conțin mai mult de o moleculă de SiO2 fac parte din polisiliciu.
Cel mai simplu dintre acizii siliciu este H 2 SiO 3, care este adesea numit simplu siliciu, iar sărurile sale sunt silicate. Din silicați, numai silicații de sodiu și potasiu sunt solubili în apă, silicații rămași fiind substanțe refractare, insolubile în apă.
Soluțiile silicatelor cresc tulbure când stau în aer, deoarece CO 2 conținută în acesta îndepărtează acidul silicic din sărurile sale (H 2 SiO 3 este mai slab decât acidul carbonic, constanta de disociere a H 2 SiO 3 în prima etapă este K 1 = 2,2. ).
H 2 SiO 3 este practic insolubil în apă - această proprietate este utilizată ca reacție calitativă pentru detectarea ionilor de silicat:
Na2SiO3 + C02 + H20 = Na2CO3 + H2SiO3 ↓.
Silicatele sunt obținute prin fuziunea SiO 2 cu alcalii sau carbonați.
Soluțiile concentrate de silicat de sodiu și potasiu se numesc sticlă lichidă, au o reacție puternic alcalină datorită faptului că ele sunt foarte hidrolizate:
K 2 SiO 3 + H 2 O 2KON + H 2 SiO 3 ↓.
Sticla lichidă este utilizată, de exemplu, pentru fabricarea de lipici, țesături impermeabile.
Cimentul este folosit foarte mult în construcții ca liant, care, atunci când este amestecat cu apă, se întărește. În mod obișnuit, cimentul este produs în cuptoare rotative mari, în care diferite silicate sunt prăjite și măcinate (la o temperatură de -1000 ° C).
Există mai multe tipuri de ciment, cu toate acestea, este posibil să se distingă în mod condiționat două tipuri de ciment în conformitate cu principiul "rulajului" lor - ciment obișnuit și ciment Portland. Procesul de "așezare" a cimentului convențional constând din silicat de calciu apare datorită formării carbonatului de calciu din cauza dioxidului de carbon din aer:
CaO. SiO 2 + C02 + H 2 O = CaCO 3 ↓ + H 2 SiO 3 ↓.
La fixarea cimentului Portland, dioxidul de carbon nu este implicat în proces, iar hidroliza silicatelor are loc cu formarea ulterioară a hidraților cristalini insolubili:
Ca3SiO5 + H20 = Ca2Si04 + Ca (OH) 2,
Ca2SiO4 + 4H2O = Ca2SiO4. 4H2O ↓.
· Carbide și silicide
· Componentele de carbon și siliciu cu metale - carburi și silicide, în plus față de reacțiile considerate, sunt obținute și prin interacțiunea siliciului cu hidrurile metalice, de exemplu:
· 2CaH2 + Si = Ca2Si + 2H2.
· Toate aceste reacții au loc la temperaturi ridicate. Printre carburi se emit așa-numitele "metanide" și "acetilene". Primele sunt considerate ca derivați de metan conținând carbon în stare de oxidare -4 (Be2C, Al4C3), al doilea - ca derivați de acetilenă cu un grad de oxidare a carbonului -1 (Li2C2, Ag2C2, Cu2C2 , CAC 2). Acetilidele de argint și cupru (I) pot fi ușor obținute prin trecerea acetilenei printr-o soluție de amoniac de oxid de argint sau clorură de cupru (I). Cele mai multe metanide și acetilide reacționează activ cu apa (în special cu acizii), eliberând hidrocarburile corespunzătoare:
· СаС2 + 2Н2О = Са (ОН) 2 + C2H2,
· Al4C3 + 12H20 = 4Al (OH) 3 ↓ + 3CH4,
· Ag2C2 + 2HCI = 2AgCl ↓ + C2H2.
· Spre deosebire de carburi, numai siliciurile metalelor alcaline sau alcalino-pământoase interacționează cu apă și acizi, producând cel mai simplu compozit de hidrogen monosilan de siliciu, denumit adesea pur și simplu silan SiH 4:
· Ca2Si + 4HCI = 2CaCl2 + SiH4.
· Silanul este un gaz incolor care are mirosul de mucegai, inflamabil spontan în aer, ars la SiO 2 și apă:
· SiH4 + 202 = Si02 + 2H20.
· Alcalinele se descompun cu ușurință silan prin ecuația:
· SiH4 + 2KON + H20 = K2Si03 + 4H2,
· De asemenea, apa hidrolizează silanul, dar mult mai lent:
· SiH4 + 2H20 = Si02 + 4H2.
· Când este încălzit peste 400 ° C fără acces la aer, silanul se descompune în siliciu și hidrogen (una dintre metodele de producere a siliciului):
· SiH4 = Si + 2H2.
· Pe lângă monosilan, sunt cunoscute și disilan Si 2 H 6, trisilan Si 3 H 8, tetrasilan Si 4 H 10, etc. În starea individuală, compușii au fost izolați numai până la Si6H14 inclusiv. Toți acești compuși aparțin seriei omoloage de silani, la care corespunde formula generală SinH2 + 2. Ca alcanii, silanele sunt incolore, primele elemente ale seriei omoloage sunt gazoase în condiții normale, următoarele sunt lichide. Activitatea chimică a silanelor și a hidrocarburilor este diferită: spre deosebire de alcani suficient de inerți, silanul este reactiv. Aceasta se datorează afinității mai scăzute a siliciului pentru hidrogen în comparație cu carbonul și afinității foarte înalte a siliciului pentru oxigen. Mai mult, legăturile Si-Si sunt mai puțin durabile decât legăturile C-C. Spre deosebire de legătura C - H, legătura Si - H are un caracter mai ionic.
· Energia obligațiunilor Si-E și CE.
· Rezistența scăzută a legăturii Si-Si se datorează limitei seriei omogene de silani.
· Printre carburi și silicide, un loc special este ocupat de carborundul SiC, care poate fi numit atât carbură de siliciu, cât și siliciu de carbon. Carborundum are un punct de topire ridicat datorită structurii sale asemănătoare diamantului; duritatea sa este aproape de cea a diamantului. Din punct de vedere chimic, SiC este foarte stabil.
· Conceptul de soluții coloidale
În natură și tehnologie, se găsesc deseori sisteme dispersate în care o substanță este distribuită uniform ca particule în interiorul unei alte substanțe.
În sistemele dispersate, există o fază dispersată - o substanță fin divizată și un mediu de dispersie - o substanță omogenă în care este distribuită faza dispersată. Sistemele dispersate includ soluții obișnuite (adevărate), soluții coloidale, precum și suspensii și emulsii. Ele diferă una de cealaltă în principal în dimensiunile particulelor, adică gradul de dispersie (fragmentare).
Sistemele cu o dimensiune a particulelor mai mică de 1 nm sunt soluții reale care constau în molecule solubile sau ioni. Acestea ar trebui considerate un sistem cu o singură fază. Sistemele cu dimensiuni ale particulelor mai mari de 100 nm sunt sisteme dispersate grosier - suspensii și emulsii.
Suspensiile sunt sisteme dispersate în care faza dispersată este solidă și mediul de dispersie este un lichid și solidul este practic insolubil în lichid.
Emulsiile sunt sisteme dispersate în care atât faza dispersată cât și mediul de dispersie sunt lichide care nu sunt reciproc miscibile. Un exemplu de emulsie este laptele, în care bile mici de grăsime plutesc într-un lichid.
Suspensiile și emulsiile sunt sisteme bifazice.
Soluțiile coloidale sunt sisteme cu două faze înalt dispersate, constând dintr-un mediu de dispersie și o fază dispersată, iar dimensiunile liniare ale particulelor acestuia din urmă se situează în intervalul de la 1 la 100 nm. După cum se poate observa, soluțiile coloidale prin dimensiunea particulelor sunt intermediare între soluțiile și suspensiile și emulsiile reale. Particulele coloidale constau, de obicei, dintr-un număr mare de molecule sau ioni.
Soluțiile coloidale sunt numite și soluri. Ele sunt obținute prin metode de dispersie și de condensare. Dispersarea este cel mai adesea efectuată folosind "mori de coloizi" speciale. În metoda de condensare, particulele coloidale se formează prin combinarea atomilor sau a moleculelor în agregate. În timpul mai multor reacții chimice, apare condensarea și se formează sisteme înalt dispersate (precipitare, hidroliză, reacții de reducere a oxidării etc.).
1 nm - nanometru (1 nm = 10-9 m).
Spre deosebire de soluțiile reale, sindrile sunt caracterizate prin efectul Tyndall, adică împrăștierea luminii prin particule coloidale. Când un con de lumină apare printr-o rază de lumină, apare într-o cameră întunecată. 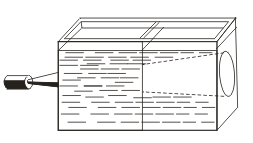 . Deci, puteți recunoaște dacă această soluție este coloidală sau adevărată.
. Deci, puteți recunoaște dacă această soluție este coloidală sau adevărată.
Una dintre proprietățile importante ale soluțiilor este că particulele lor au încărcături electrice de același semn. Din acest motiv, nu se îmbină în particule mai mari și nu precipită. În același timp, particulele unor soluri, de exemplu, metale, sulfuri, acizi siliciu și staniu, au o încărcătură negativă, în timp ce altele, de exemplu hidroxizii, oxizii metalici, au o încărcătură pozitivă. Apariția unei încărcări se explică prin adsorbția ionilor din soluție prin particule coloidale.
Pentru a precipita un sol, este necesar ca particulele să se îmbină în agregate mai mari. Combinația de particule în agregate mai mari se numește coagulare, iar sedimentarea lor sub influența gravitației se numește sedimentare.
De obicei, coagularea apare atunci când se adaugă solurilor: 1) electrolit, 2) un alt sol al cărui particule au o încărcătură opusă și 3) când este încălzit.
