Sulf. Hidrogen sulfurat și sulfuri
4.doc
240Sulf. Hidrogen sulfurat, sulfuri, hidrosulfuri. Oxizi de sulf (IV) și (VI). Acid sulfuric și acid sulfuric și sărurile lor. Esteri ai acidului sulfuric. Tiosulfat de sodiu
4.1. sulf
Sulful este unul dintre putinele elemente chimice pe care oamenii le-au folosit de mai multe milenii. Este larg răspândită în natură și se găsește atât în stare liberă (sulf nativ), cât și în compuși. Mineralele care conțin sulf pot fi împărțite în două grupe - sulfuri (piriți, sclipici, manechine) și sulfați. Sulful nativ se găsește în cantități mari în Italia (insula Sicilia) și în SUA. În CSI, depozitele de sulf nativ se găsesc în regiunea Volga, în statele din Asia Centrală, în Crimeea și în alte zone.
Mineralele din primul grup includ strălucirea plumbului PbS, strălucirea cuprului Cu 2 S, strălucirea argintului - Ag 2 S, zgârietul de zinc - ZnS, cada cadmiului - CdS, pirita sau fierul de fier - FeS 2, chalcopirit - CuFeS 2, cinnabar - HgS.
Mineralele din al doilea grup includ gipsul CaSO4 2H20, mirabilitul (sarea lui Glauber) - Na2S0410H2O și kizerite - MgS04H2O.
Sulful se găsește în animale și plante, ca parte a moleculelor de proteine. Compușii organici de sulf se găsesc în petrol.
recepție
1. Când sulful este obținut din compuși naturali, de exemplu, din sulf piritic, acesta este încălzit la temperaturi ridicate. Pirita de sulf se descompune pentru a forma sulfura de fier (II) si sulf:
2. Sulful poate fi obținut prin oxidarea hidrogenului sulfurat prin lipsa de oxigen prin reacție:
2H2S02 = 2S 2H20
3. În ziua de azi, recuperarea sulfului prin reducerea dioxidului de sulf SO2 prin reducerea dioxidului de carbon este un produs secundar obișnuit în topirea metalelor din minereurile de sulf:
SO2C = C02S
4. Gazele reziduale ale cuptoarelor metalurgice și de cocs cuprind un amestec de dioxid de sulf și hidrogen sulfurat. Acest amestec este trecut la o temperatură ridicată peste catalizator:
H2S02 = 2H203S
^ Proprietăți fizice
Sulful este o culoare galbenă de lămâie tare și fragilă. Este practic insolubil în apă, dar este bine solubil în CS2 anilină în disulfură de carbon și alți solvenți.
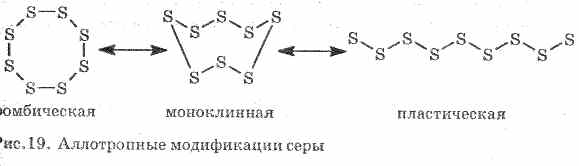
Săraci conduc căldură și curent electric. Sulful formează mai multe modificări alotrope:
1 . ^ Sulf sulfic (cele mai stabile), cristalele au forma de octaedra.
Când se încălzește sulful, se schimbă culoarea și vâscozitatea: mai întâi se formează galben deschis și apoi, pe măsură ce temperatura crește, devine mai întunecată și devine atât de vâscoasă încât nu mai curge din tub, încălzind în continuare, vâscozitatea scade din nou, iar la 444, .
2. ^ Sulf monoclinic - modificarea sub formă de ace galbene închise, obținute prin răcirea lentă a sulfului topit.
3. Sulf de sulfformată în cazul în care sulful încălzit până la fierbere este turnat în apă rece. Ușor întinse ca cauciuc (vezi fig. 19).
Sulful natural constă dintr-un amestec de patru izotopi stabili: 32 16 S, 33 16 S, 34 16 S, 36 16 S.
^ Proprietăți chimice
Un atom de sulf, având un nivel de energie extern incomplet, poate atașa doi electroni și poate prezenta un grad
Oxidarea -2. Sulful prezintă o astfel de stare de oxidare în compuși cu metale și hidrogen (Na2S, H2S). Atunci când reculul sau epuizarea electronilor la atomul elementului mai electronegativ, gradul de oxidare a sulfului poate fi 2, 4, 6.
Sulful este relativ inert în frig, dar cu temperaturi în creștere, reactivitatea crește. 1. Cu metalele, sulful prezintă proprietăți oxidante. Când aceste reacții formează sulfuri (cu aur, platină și iridiu nu reacționează): Fe S = FeS
2. În condiții normale, sulful nu reacționează cu hidrogenul și la 150-200 ° C apare o reacție reversibilă:
3. În reacțiile cu metalele și cu hidrogenul, sulful se comportă ca agent tipic de oxidare și în prezența agenților puternici de oxidare prezintă proprietăți de reducere.
S 3F 2 = SF 6 (nu reacționează cu iod)
4. Arderea sulfului în oxigen are loc la 280 ° C și în aer la 360 ° C. Acesta formează un amestec de SO2 și SO3:
S02 = SO2 2S3O2 = 2S03
5. Când este încălzit fără aer, sulful se combină direct cu fosforul, carbonul, care prezintă proprietăți oxidante:
2P 3S = P2S3 2SC = CS2
6. Când interacționează cu substanțe complexe, sulful se comportă în principal ca agent reducător:
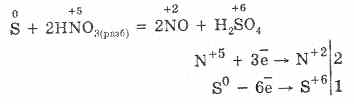
7. Sulful este capabil de reacții de disproporție. Deci, atunci când pulberea de sulf de fierbere cu alcalii, sulfuri și sulfuri se formează:
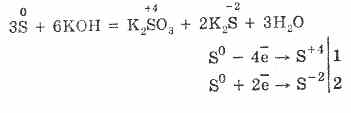
cerere
Sulful este utilizat pe scară largă în industrie și agricultură. Aproximativ jumătate din producția sa este consumată pentru a produce acid sulfuric. Sulful este utilizat pentru vulcanizarea cauciucului: în acest caz, cauciucul este transformat în cauciuc.
Sub formă de sulf (pulbere fină), sulful este utilizat pentru combaterea bolilor vieții și a bumbacului. Este folosit pentru a obține praf de pușcă, meciuri, compoziții luminoase. În medicină, unguent de sulf preparat pentru tratamentul bolilor de piele.
4.2. Hidrogen sulfurat, sulfuri, hidrosulfuri
Hidrogenul sulfurat este un analog al apei. Formula sa electronică
Aceasta arată că doi p-electroni ai nivelului exterior al atomului de sulf sunt implicați în formarea legăturilor H-S-H. Molecula H 2 S are o formă unghiulară, deci este polară.
^ Fiind în natură
Hidrogenul sulfurat se găsește în natură în gazele vulcanice și în apele unor surse minerale, cum ar fi Pyatigorsk, Matsesta. Se formează prin degradarea substanțelor organice cu conținut de sulf din diferite reziduuri animale și vegetale. Acest lucru explică mirosul caracteristic neplăcut al apelor reziduale, al caselor și depozitelor de deșeuri.
recepție
1. Sulfura de hidrogen poate fi obținută prin conectarea directă a sulfului cu hidrogen prin încălzire:
2. De obicei se obține prin acțiunea acidului clorhidric sau sulfuric diluat pe sulfură de fier (III):
2HCl FeS = FeCl2H2Sisten 2H FeS = Fe2H2S Această reacție este deseori efectuată în aparatul Kipp.
^ Proprietăți fizice
În condiții normale, hidrogenul sulfurat este un gaz incolor cu un miros caracteristic puternic al ouălor stricate. Foarte otrăvitor, inhalarea se leagă de hemoglobină, provocând paralizie, care este nesănătoasă.
Ko duce la moarte. În concentrații scăzute, mai puțin periculoase. Este necesar să lucrați cu el în dulapurile de evacuare sau cu dispozitive închise ermetic. Conținutul permis de H2S în spațiile de producție este de 0,01 mg pe 1 litru de aer.
Hidrogenul sulfurat este relativ bine solubil în apă (la 20 ° C se dizolvă 2,5 volume de hidrogen sulfurat în 1 volum de apă).
O soluție de hidrogen sulfurat în apă se numește acid sulfuric sau hidrogen sulfurat (detectează proprietățile unui acid slab).
^ Proprietăți chimice
1, când este puternic încălzit, hidrogenul sulfurat se descompune aproape complet pentru a forma sulf și hidrogen.
2. hidrogen sulfurat gazos ars în aer cu o flacără albastră cu formarea de oxid de sulf (IV) și apă:
2H2S3O2 = 2S02H2O
Cu o lipsă de oxigen, se formează sulf și apă: 2H2SO2 = 2S 2H2O
3. Hidrogenul sulfurat este un agent reducător destul de puternic. Această proprietate chimică importantă poate fi explicată după cum urmează. Într-o soluție de H2S, este relativ ușor de donat electroni moleculelor de oxigen din aer:
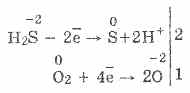
În același timp, oxigenul din aer oxidează hidrogen sulfurat la sulf, ceea ce face ca apa sulfurică să fie turbidă:
2H2S02 = 2SnS 2H2O
Acest lucru explică faptul că hidrogenul sulfurat nu se acumulează în cantități foarte mari în natură atunci când materia organică se descompune - oxigenul din aer îl oxidează la sulf liber.
4, Hidrogenul sulfurat reacționează puternic cu soluții de halogen, de exemplu:
H 2 S I 2 = 2HI Sintre Sulful se eliberează și soluția de iod devine decolorată.
5. Diferiți oxidanți reacționează energic cu hidrogen sulfurat: sub acțiunea acidului azotic se formează sulf liber.
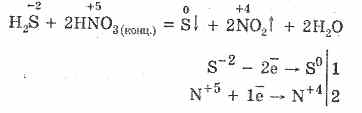
6. O soluție de hidrogen sulfurat este acidă din cauza disocierii:
H 2 S H HS - HS - H H S -2
Prima etapă predomină de obicei. Este un acid foarte slab: mai slab decât acidul de cărbune, care de obicei înlocuiește H2S din sulfuri.
Sulfuri și hidrosulfuri
Acidul fluorhidric, ca dibazic, formează două rânduri de săruri:
Sulfuri medii (Na2S);
Acid - hidrosulfuri (NaHS).
Aceste săruri pot fi obținute: prin interacțiunea hidroxidurilor cu hidrogen sulfurat: 2NaOHH2S = Na2S2H20
Interacțiunea directă a sulfului cu metalele:
Reacția de schimb de săruri cu H2S sau între săruri:
Pb (N03) 2Na2S = PbS ^ 2NaNO3
CuSO4H2S = CuS ^ H2S04 Cu2H2S = CuS ^ 2H
Hidrosulfurile sunt aproape toate solubile în apă.
Sulfurile metalelor alcaline și alcalino-pământoase sunt de asemenea ușor solubile în apă, incolore.
Sulfurile metalice grele sunt practic insolubile sau ușor solubile în apă (FeS, MnS, ZnS); Unele dintre ele nu se dizolvă în acizii diluați (CuS, PbS, HgS).
Ca săruri ale unui acid slab, sulfurile în soluții apoase sunt foarte hidrolizate. De exemplu, sulfurile de metale alcaline, atunci când sunt dizolvate în apă, au o reacție alcalină:
Na2SNOHN NaOH
Toate sulfurile, ca și hidrogenul sulfurat, sunt agenți reducători energici:
3PbS-2 8HN 5O 3 (par.) = 3PbS 6O 4 4H 2 O 8N 2 O
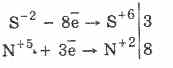
Unele sulfuri au o culoare caracteristică: CuS și PbS - negru, CdS - galben, ZnS - alb, MnS - roz, SnS - maro, Al 2 S 3 - portocaliu. Analiza calitativă a cationilor se bazează pe solubilitățile diferite ale sulfurilor și diferitele culori ale multor dintre ele.
^ 4.3. Oxidul de sulf (IV) și acidul sulfuric
Oxidul de sulf (IV) sau dioxidul de sulf, în condiții normale, este un gaz incolor cu un miros ascuțit ascuțit. Când se răcește la -10 ° C, se lichefiază într-un lichid incolor.
recepție
1. În condiții de laborator, oxidul de sulf (IV) se obține din săruri de acid sulfuros prin acțiunea acizilor tari pe ei:
Na2S03H2S04 = Na2S04S02 H2O2NaHSO3H2SO4 = Na2SO4S02 2H2O2HSO - 3 2H = 2SO2 2H2O
2. De asemenea, dioxidul de sulf se formează prin interacțiunea dintre acidul sulfuric concentrat când se încălzește cu metale puțin active:
Cu 2H2S04 = CuSO4S02 2H20
Cu 4H 2SO 2-4 = Cu2S02-4S02 2H20
3. Oxidul de sulf (IV) este de asemenea format atunci când sulful este ars în aer sau oxigen:
4. In conditii industriale, SO 2 se obtine prin prinderea piritului cu FeS 2 sau minereuri de sulf din metale neferoase (amestec de zinc ZnS, luciu de plumb PbS etc.):
4FeS 2 11O 2 = 2Fe 2 O 3 8SO 2
Formula structurală a moleculei SO2:
Patru atomi de sulf și patru electroni de la doi atomi de oxigen iau parte la formarea legăturilor în molecula de SO2. Repulsia reciprocă a perechilor de electroni de legătură și singura pereche electron de sulf dă moleculei o formă unghiulară.
Proprietăți chimice
1. Oxidul de sulf (IV) prezintă toate proprietățile oxizilor de acid:
Interacțiunea apei
Interacțiunea cu alcalii,
Interacțiunea cu oxizii de bază.
2. Oxidul de sulf (IV) este caracterizat prin proprietăți de reducere:
(În prezența unui catalizator, când este încălzit)
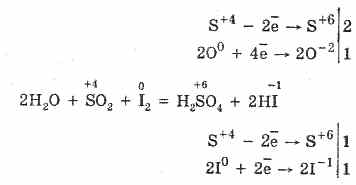
Dar, în prezența agenților reducători puternici, SO2 se comportă ca agent de oxidare:
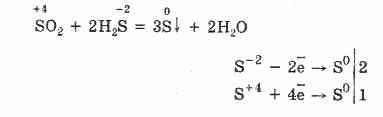
Dualitatea redox a oxidului de sulf (IV) se explică prin faptul că sulful are o stare de oxidare de 4 în el și prin urmare, poate renunța la 2 electroni, să fie oxidat la S6 și prin luarea a 4 electroni, el poate fi redus la S °. Manifestarea acestor sau a altor proprietăți depinde de natura componentei reactive.
Oxidul de sulf (IV) este foarte solubil în apă (40 volume de SO2 se dizolvă în 1 volum la 20 ° C). În acest caz se formează acid sulfuric existent numai în soluție apoasă:
SO2H2OgH2S03
Reacția este reversibilă. În soluția apoasă, oxidul de sulf (IV) și acidul sulfuros sunt în echilibru chimic, care pot fi deplasate. Prin legarea H2SO3 (neutralizarea acidului
Tu) reacția se desfășoară în direcția formării acidului sulfuros; atunci când se îndepărtează SO2 (suflare printr-o soluție de azot sau încălzire), reacția continuă spre materiile prime. Soluția de acid sulfuric conține întotdeauna oxid de sulf (IV), care îi conferă un miros ascuțit.
Acidul sulfuric are toate proprietățile acizilor. În soluție se disociază în pași:
H 2 SO 3 H HSO-3 HSO-3 H H SO 2- 3
Din punct de vedere termic instabil, volatil. Acidul sulfuric, ca dibazic, formează două tipuri de săruri:
Middle - sulfiti (Na2SO3);
Acid - hidrosulfit (NaHSO3).
Sulfurile se formează atunci când alcalinele sunt complet neutralizate de acid:
H 2 SO 3 2NaOH = Na2S03 2H2O
Se obțin hidrosulfiți cu o lipsă de alcalii:
H2S03 NaOH = NaHS03H20
Acidul sulfuric și sărurile sale au proprietăți de oxidare și de reducere, determinate de natura partenerului de reacție.
1. Deci, sub acțiunea sulfitului de oxigen sunt oxidați la sulfați:
2Na2S4O3O02 = 2Na2S6O -24
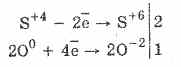
Oxidarea acidului sulfuric cu brom și permanganat de potasiu se realizează și mai ușor:
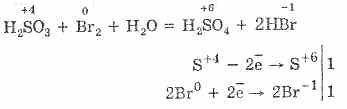
5H2S4O3 2KMn7O4 = 2H2S6O4 2Mn2S6O4K2S6O4 3H2O
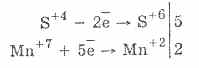
2. În prezența agenților reducători mai viguroși, sulfiții prezintă proprietăți oxidative:
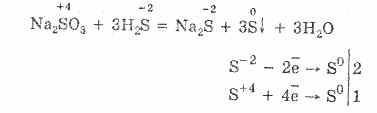
Aproape toți hidrosulfiticii și sulfiții de metale alcaline se dizolvă din sărurile acidului sulfuric.
3. Deoarece H2S03 este un acid slab, acțiunea acizilor pe sulfuri și hidrosulfuri are ca rezultat eliberarea de SO2. Această metodă este folosită de obicei atunci când se obține SO2 în condiții de laborator:
NaHSO3H2S04 = Na2S04S02 H2O
4. Sulfitidele solubile în apă se supun cu ușurință hidrolizei, în urma căreia concentrația de ioni de OH crește în soluție:
Na2S03NaNaHS03 NaOH
cerere
Oxidul de sulf (IV) și acidul sulfuric decolorizează multe coloranți, formând împreună cu aceștia compuși incolora. Acesta din urmă se poate descompune din nou atunci când este încălzit sau în lumină, în urma căruia culoarea este restabilită. Prin urmare, efectul de albire al SO2 și H2SO3 este diferit de efectul de albire al clorului. De obicei, sulfura (IV) rxid lână de albire, mătase și paie.
Oxidul de sulf (IV) ucide multe microorganisme. Prin urmare, pentru a distruge ciupercile de mucegai, ele fumighează pivnițe, pivnițe, butoaie de vinuri etc. Este de asemenea utilizat în transportul și depozitarea fructelor și fructelor de pădure. În cantități mari, oxidul de sulf IV) este utilizat pentru a produce acid sulfuric.
O aplicație importantă este soluția hidroxidului de calciu CaHSO 3 (lichid de sulfit), care se utilizează pentru tratarea lemnului și a pastei de hârtie.
^ 4.4. Oxid de sulf (VI). Acid sulfuric
Oxidul de sulf (VI) (vezi tabelul 20) este un lichid incolor care se solidifică la o temperatură de 16,8 ° C la o masă cristalină solidă. Acesta absoarbe umezeala foarte puternic, formând acid sulfuric: SO 3 H 2 O = H 2 SO 4
Tabelul 20. Proprietățile oxizilor de sulf
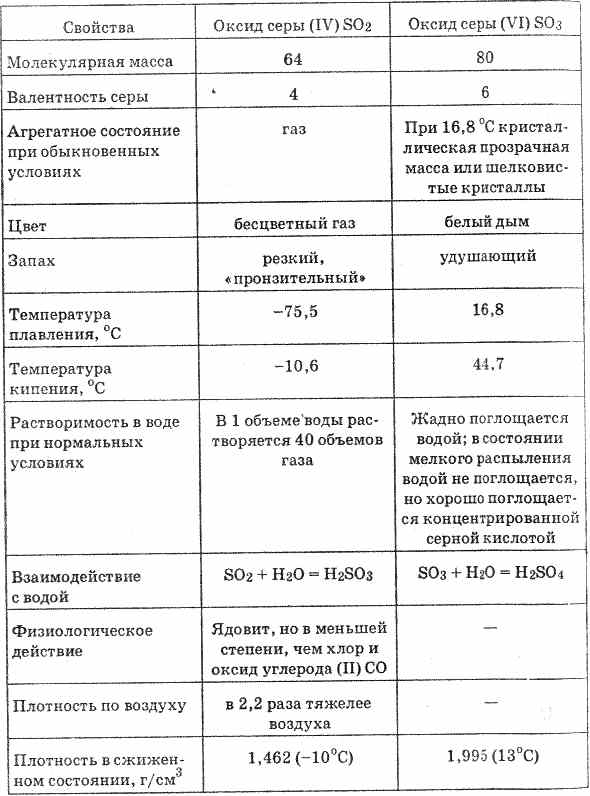
Dizolvarea oxizilor de sulf (VI) în apă este însoțită de eliberarea unei cantități semnificative de căldură.
Oxidul de sulf (VI) este foarte solubil în acid sulfuric concentrat. O soluție de SO3 într-un acid anhidru este numită oleum. Oleumurile pot conține până la 70% SO 3.
recepție
1. Oxidul de sulf (VI) este obținut prin oxidarea dioxidului de sulf cu oxigen în prezența catalizatorilor la o temperatură de 450 ° C (vezi Producția de acid sulfuric):
2SO2O2 = 2S03
2. O altă metodă de oxidare a SO2 la SO 3 este utilizarea oxidului nitric (IV) ca agent de oxidare:
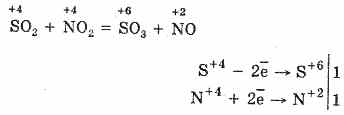
Oxidul nitric rezultat (II) atunci când interacționează cu oxigenul atmosferic se transformă ușor și rapid în oxid nitric (IV): 2NO2 = 2NO2
Care poate fi din nou utilizat în oxidarea SO2. Prin urmare, NO 2 acționează ca un purtător de oxigen. Această metodă de oxidare a SO 2 la SO 3 se numește azot. Molecula de SO 3 are forma unui triunghi, în centrul căruia
Atomul de sulf este localizat:
O astfel de structură se datorează repulsiei reciproce a perechilor de electroni de legătură. Un atom de sulf a furnizat șase electroni externi pentru formarea lor.
Proprietăți chimice
1. SO3 este un oxid tipic tipic.
2. Oxidul de sulf (VI) are proprietățile unui agent puternic de oxidare.
cerere
Oxidul de sulf (VI) este utilizat pentru a produce acid sulfuric. Cea mai importantă este metoda de contact pentru obținere
Acid sulfuric. Prin această metodă, puteți obține H 2 SO 4 de orice concentrație, precum și oleum. Procesul constă în trei etape: obținerea SO 2; oxidarea SO2 la S03; obtinerea H 2 SO 4.
SO 2 se obține prin arderea FeS 2 de pirită în cuptoare speciale: 4FeS 2 11O 2 = 2Fe 2 O 3 8SO 2
Pentru a accelera frigerea, pirita este pre-măcinată, iar pentru arderea mai completă a sulfului, se injectează semnificativ mai mult aer (oxigen) decât este necesar de reacție. Gazul care iese din cuptor este alcătuit din oxid de sulf (IV), oxigen, azot, compuși de arsen (din impurități în piriți) și vapori de apă. Se numește gaz de prăjire.
Gazul de prăjire este supus unei curățiri minuțioase, deoarece chiar și un mic conținut de compuși de arsen, precum și praf și umiditate, otrăvesc catalizatorul. Gazul este curățat de compușii de arsen și de praf, trecându-l prin precipitatoare electrostatice speciale și un turn de spălare; umiditatea este absorbită de acidul sulfuric concentrat într-un turn de uscare. Gazul purificat care conține oxigen este încălzit într-un schimbător de căldură până la 450 ° C și intră în aparatul de contact. În interiorul aparatului de contact sunt rafturile de zăbrele umplute cu catalizator.
Anterior, drept catalizator s-a folosit platina metalica fin zdrobita. Ulterior, a fost înlocuit cu compuși de vanadiu - oxid de vanadiu (V) V 2 O 5 sau vanadil sulfat VOSO 4, care este mai ieftin decât platina și mai otrăvit încet.
Reacția de oxidare a SO2 la SO3 este reversibilă:
S02S02S03
O creștere a conținutului de oxigen din gazul de calcinare crește randamentul oxidului de sulf (VI): la o temperatură de 450 ° C, acesta ajunge de obicei la 95% sau mai mult.
Oxidul de sulf format (VI) este apoi alimentat printr-o metodă contra-curentă într-un turn de absorbție, unde este absorbit de acidul sulfuric concentrat. Pe măsură ce se saturează, se formează mai întâi acid sulfuric anhidru și apoi oleum. În viitor, oleumul se diluează până la 98% acid sulfuric și se livrează consumatorilor.
Formula structurală a acidului sulfuric:
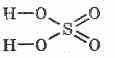
^ Proprietăți fizice
Acidul sulfuric este un lichid uleios greu, incolor, care cristalizează la 10,4 ° C, aproape dublu ( = 1,83 g / cm3) este mai greu decât apa, inodor, nevolatil. Extrem de higroscopic. Umiditatea se absoarbe prin eliberarea unor cantități mari de căldură, astfel încât să nu puteți turna apă cu acidul sulfuric concentrat - va exista o stropire de acid. Pentru
Acidul sulfuric trebuie adăugat în apă în porții mici.
Acidul sulfuric anhidru dizolvă până la 70% oxid de sulf (VI). Când se încălzește, se îndepărtează SO 3 până când se formează o soluție cu o fracție de masă de H2S04 de 98,3%. H 2 SO 4 anhidru aproape nu conduce curent electric.
^ Proprietăți chimice
1. Se amestecă cu apă în orice proporție și formează hidrați de diferite compoziții:
H 2SO 4H 2O, H2S04 2H20, H2S04H20, H2S04H20, H2S04,5,5H20
2. Acidul sulfuric concentrat carbonizează materia organică - zahăr, hârtie, lemn, fibre, îndepărtându-le de elementele de apă:
C12H22O11H2S04 = 12CH2S0411H20
Cărbunele formată parțial interacționează cu acidul:
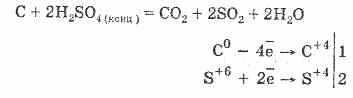
Deshidratarea gazelor se bazează pe absorbția apei prin acid sulfuric.
Ca un acid puternic volatil, H 2 SO 4 înlocuiește alți acizi din săruri uscate:
NaNO3H2S04 = NaHS04HNO3
Cu toate acestea, dacă H 2 SO 4 este adăugat la soluțiile de sare, nu are loc deplasarea acidului.
H 2 SO 4 - acid dibazic puternic: H 2 SO 4 H HSO - 4 HSO - 4 H H SO 2 - 4
Are toate proprietățile acizilor puternici nevolatili.
Acidul sulfuric diluat este caracterizat de toate proprietățile acizilor neoxidanți. Anume: interacționează cu metalele care se află în seria electrochimică a tensiunii metalelor până la hidrogen:
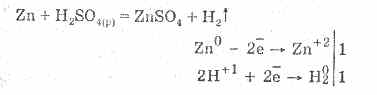
Interacțiunea cu metalele se datorează reducerii ionilor de hidrogen.
6. Acidul sulfuric concentrat este un agent de oxidare energetic. Când este încălzit, oxidizează majoritatea metalelor, inclusiv cele din seria electrochimică de solicitări după hidrogen, nu reacționează numai cu platină și aur. În funcție de activitatea metalului, produsele de reducere pot fi S -2, S ° și S 4.
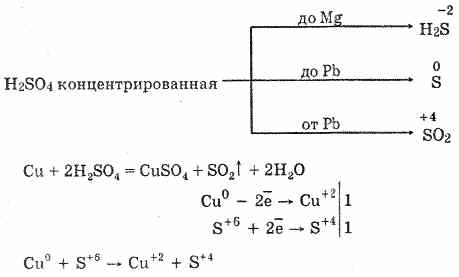
În frig, acidul sulfuric concentrat nu interacționează cu metale atât de puternice ca aluminiu, fier și crom. Acest lucru se datorează pasivării metalelor. Această caracteristică este utilizată pe scară largă atunci când este transportată într-un container de fier.
Cu toate acestea, atunci când este încălzit:
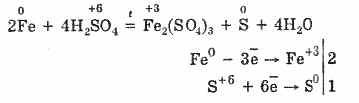
Astfel, acidul sulfuric concentrat interacționează cu metalele datorită reducerii atomilor care formează acid.
O reacție calitativă la ionul sulfat SO2-4 este formarea unui precipitat cristalin alb de BaS04, insolubil în apă și acizi:
SO 2 4 Ba 2 BaSO 4
cerere
Acidul sulfuric este cel mai important produs al industriei chimice principale implicat în producția de produse non-
Acizi organici, alcalii, săruri, îngrășăminte minerale și clor.
Pentru o varietate de aplicații, acidul sulfuric se clasează pe primul loc printre acizi. Cea mai mare cantitate din acesta este consumată pentru a obține îngrășăminte fosfatice și azotate. Fiind non-volatile, acidul sulfuric este utilizat pentru a produce alți acizi - acid clorhidric, fluorhidric, fosforic și acetic.
O mare parte din aceasta se referă la purificarea produselor petroliere - benzină, kerosen, uleiuri lubrifiante - din impurități nocive. În ingineria mecanică, acidul sulfuric curăță suprafața metalului de oxizi înainte de acoperire (placare cu nichel, cromare, etc.). Acidul sulfuric este utilizat în fabricarea de explozivi, fibre artificiale, coloranți, materiale plastice și multe altele. Se folosește pentru a umple bateriile.
Sărurile de acid sulfuric sunt importante.
^ Sulfat de sodiuNa2S04 cristalizează din soluții apoase sub formă de hidrat de Na2S0410H2O, care se numește sarea lui Glauber. Este utilizat în medicină ca laxativ. Sulfatul de sodiu anhidru este utilizat în fabricarea sifonului și a sticlei.
^ Sulfat de amoniu(NH4) 2S04 - îngrășământ azotat.
Sulfat de potasiuK 2 SO 4 - îngrășământ de potasiu.
Sulfat de calciu CaS04 se găsește în natură sub formă de CaSO4 minerale de gips, 2H2O. Când este încălzit la 150 ° C, acesta pierde o parte din apă și intră într-un hidrat de 2CaS04H20, denumit gips ars, sau alabastru. Când se amestecă cu apă într-o masă pastă, alabastrul se întărește din nou după un timp, transformându-se în CaSO4 2H2O. Gipsul este utilizat pe scară largă în construcții (tencuieli).
Sulfat de magneziuMgS04 se găsește în apa de mare, provocând gustul său amar. Hidratul hidratat, numit sarea amară, este folosit ca laxativ.
vitriol- denumirea tehnică a hidraților cristalini ai sulfurilor metalice Fe, Cu, Zn, Ni, Co (sărurile deshidratate nu sunt vitriale). Sulfat de cupruCuSO4 5H2O este o substanță toxică albastră. Plantele sunt pulverizate cu o soluție diluată și semințele sunt semănate înainte de însămânțare. Vitriol de fierFeSO 4 7H 2 O este o substanță verde deschis. Folosit pentru combaterea dăunătorilor de plante, cerneluri, vopsele minerale etc. Sulfat de zincZnSO4 7H2O este utilizat în producția de cerneluri minerale, în sitoprechatanii, medicină.
^ 4.5. Esteri ai acidului sulfuric. Tiosulfat de sodiu
Esterii acidului sulfuric includ sulfații de dialchil (RO2) S02. Acestea sunt lichide cu punct de fierbere ridicat; mai puțin solubil în apă; în prezența alcaliilor, se formează alcoolul și sărurile acidului sulfuric. Sulfații de dialchil inferiori sunt agenți de alchilare.
Sulfat de dietil(C2H5) 2S04. Punct de topire -26 ° C, punct de fierbere 210 ° C, solubil în alcooli, insolubil în apă. Obținut prin interacțiunea dintre acidul sulfuric și etanol. Este agentul de etilare în sinteza organică. Penetrează pielea.
Sulfat de dimetil(CH3) 2S04. Punct de topire -26,8 ° C, punct de fierbere 188,5 ° C. Solubil în alcooli, rău - în apă. Reacționează cu amoniac în absența solventului (cu explozie); Sulf anumiți compuși aromatici, cum ar fi esteri de fenol. Se obține prin interacțiunea dintre oleum 60% și metanol la 150 ° C. Este un agent de metilare în sinteza organică. Carcinogenic, afectează ochii, pielea, organele respiratorii.
^ Tiosulfat de sodiu Na2S2O3
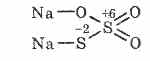
Sarea acidului tiosulfuric în care doi atomi de sulf au diferite stări de oxidare: 6 și -2. Substanță cristalină, bine solubilă în apă. Disponibil sub formă de cristalină Na2S2O3 5H2O, denumită în mod obișnuit hiposulfit. Obținut prin interacțiunea sulfit de sodiu cu sulf în timpul fierbe:
Na2S03S = Na2S203
Ca acid tiosulfuric, este un agent reducător puternic, fiind ușor oxidat de clor până la acid sulfuric:
Na2S2O3 4CI2 5H2O = 2H2S04 2NaCl6HCI
Utilizarea tiosulfatului de sodiu pentru absorbția clorului (în primele măști de gaz) sa bazat pe această reacție.
O oxidare puțin diferită are loc prin agenții oxidanți slabi ai tiosulfatului de sodiu. Aceasta formează săruri ale acidului tetrathionic, de exemplu:
2Na2S2O3I2 = Na2S4O6 2NaI
Tiosulfatul de sodiu este un produs secundar în producția de NaHSO 3, coloranți de sulf, în purificarea gazelor industriale din sulf. Se utilizează pentru a îndepărta urmele de clor după albirea materialelor, pentru a extrage argintul din minereuri; este un fixativ în fotografie, un reactiv în iodometrie, un antidot pentru otrăvire cu compuși de arsen, mercur, un agent antiinflamator.
Elementul chimic sulf este situat în grupul VIA, perioadă 3 PSCE. Pe stratul de electroni exterior al atomului de sulf există 6 electroni. Arătând proprietățile agentului de oxidare în formarea de substanțe cu metale și hidrogen, sulful dobândește starea de oxidare -2 (ia doi electroni).
În compoziția compușilor care conțin oxigen, sulful prezintă starea de oxidare +4 și +6. Astfel, sulful este caracterizat prin stările de oxidare -2; 0; 4; 6.
În natură, sulful se găsește în starea sa natală și în compoziția mineralelor. De exemplu, sulful conține luciu de plumb (componenta principală este sulfura de plumb PbS) și luciu de cupru (componenta principală este sulfura de cupru Cu 2 S).
Sulful formează câteva substanțe simple - modificări alotropice. Sulful sulfamic este cel mai stabil la temperatura camerei (Figura 1). Această substanță constă din molecule S8. Sulful sulfamic este galben și se topește la o temperatură de + 112,8 ° C.
Fig. 1. Modificarea chimică a sulfului
Când este încălzit, sulful rombic se transformă treptat într-o masă vâscoasă maro închis. Aceasta este o altă modificare alotropică a sulfului din plastic sulfuric. Sulful din plastic constă din molecule de sulf liniar S n.
Sulful în reacțiile chimice cu metale și hidrogen joacă rolul unui agent de oxidare. Gradul său de oxidare scade de la 0 la -2. În reacția cu oxigenul, sulful acționează ca agent reducător, crescând gradul său de oxidare de la 0 la +4.
Luați în considerare exemple de interacțiuni care implică sulf.
Când sulful interacționează cu hidrogenul, se formează hidrogen sulfurat:
Când zincul interacționează cu sulful, se formează sulfura de zinc:
Sulful arde în oxigen cu formarea oxidului de sulf (IV) (figura 2):

Fig. 2. Arderea de sulf în oxigen
Luați în considerare proprietățile compușilor de sulf cu starea de oxidare "-2". Astfel de compuși includ hidrogen sulfurat și sulfuri - săruri ale acidului hidrogen sulfurat.
Hidrogenul sulfurat este un gaz cu miros de ouă putrede. Arde în aer. Mai mult, cu o lipsă și un exces de oxigen, combustia are loc diferit.
Într-un exces de oxigen, hidrogenul sulfurat se arde pentru a forma oxid de sulf (IV) și apă:
2H2S + 302 = 2S02 + 2H20.
Cu o lipsă de oxigen, se produce arderea incompletă a hidrogenului sulfurat cu eliberarea de sulf: 2H2S + 02 = 2S + 2H20.
Hidrogenul sulfurat este foarte solubil în apă. Soluția rezultată este un acid slab hidrogen sulfurat. Sărurile de sulfuri de hidrogen sunt numite sulfuri. Acidul fluorhidric și sulfurile solubile în apă intră în reacții de schimb.
Interacțiunea dintre acidul hidrogen sulfurat și clorura de cupru (II) formează sulfură de cupru (II) insolubilă și acid clorhidric: H2S + CuCI2 = CuS + 2HCl.
Când sulfura de potasiu interacționează cu azotatul de zinc, precipită sulfura de zinc și se formează nitrat de potasiu: K 2 S + Zn (NO 3) 2 = ZnS + 2 KNO 3.
Referințe
- Orzhekovsky P.A. Colectarea de sarcini și exerciții în chimie: clasa a IX-a: la manualul P.A. Orzhekovsky și alții. "Chimia. Gradul 9 / P.A. Orzhekovsky, N.A. Titov, F.F. Hegel. - M .: AST: Astrel, 2007. (pag. 91-97)
- Orzhekovsky P.A. Chimie: clasa a IX-a: studii. pentru imagine generală. stabilită. / P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak. - M .: AST: Astrel, 2007. (§ 34)
- Orzhekovsky P.A. Chimie: clasa a IX-a: studii pentru general. stabilită. / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova. - M .: Astrel, 2013. (§§ 20, 21)
- Rudzitis G.E. Chimie: neorgan. chimie. Autoritatea. Chimie: studii. pentru 9 cl. / G.E. Rudzitis, F.G. Feldman. - M .: Educație, Manualul de la Moscova OJSC, 2009.
- Khomchenko I.D. Colectarea de sarcini și exerciții în chimie pentru liceu. - M .: RIA "New Wave": Editura Umerenkov, 2008.
- Enciclopedie pentru copii. Volumul 17. Chimia / Capitolul. Ed. VA Volodin, Ved. științifice. Ed. I. Leenson. - M .: Avanta +, 2003.
- O singură colecție de resurse educaționale digitale (experiențe video pe această temă) ().
- Versiunea electronică a revistei "Chimie și viață" ().
teme pentru acasă
- a. 136 Nr. 3; p.140 №№ 2-4 din manualul P.A. Orzhekovsky "Chimie: clasa a IX-a" / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashova. - M .: Astrel, 2013.
sulfurilor (de la sulf sulf, sulf - sulf)
compușii sulfului cu mai multe elemente electropositive; pot fi considerate ca săruri ale acidului hidrogen sulfurat (a se vedea Acidul hidrogen sulfurat) H 2 S. Există două serii C: media (normală) cu formula generală M 2 S și acidul (hidrosulfurile) cu formula generală MHS, în care M este un metal monovalent. C. Metalele alcaline sunt incolore, solubile în apă. Soluțiile lor apoase sunt foarte hidrolizate și alcaline. Sub acțiunea acizilor diluați emit H2S C. Metalele alcalino-pământoase sunt incolore, puțin solubile în apă. H 2 S este emis în aer umed. Alte proprietăți sunt similare cu metalele alcaline S. Atât cei, cât și ceilalți S. sunt ușor de oxidat la sulfați. C. Metalele grele sunt practic insolubile în apă. Aproape toate sunt negru sau negru-maroniu (cu excepția ZnS alb, MnS roz, CdS galben, portocaliu-roșu Sb 2 S 3, galben SnS 2). Raportul inegal dintre C. la acizi și C. amoniu este folosit în analiza chimică. I.K Malina.
Marea Enciclopedie Sovietică. - M .: Enciclopedie sovietică. 1969-1978 .
Vedeți ce sunt "sulphide" în alte dicționare:
Compuși de sulf cu metale și unele nemetale. Sulfurile metalice sunt sărurile H2S acidului hidrogen sulfurat: mediu (de exemplu, Na2S) și acidul sau hidrosulfurile (NaHS). Prin arderea sulfurilor naturale, se obțin metale neferoase și SO2. Sulfurile fosforice și ... ... Dictionar encyclopedic mare
Enciclopedie modernă
sulfurilor - SULFIDE, sulfuri anorganice ale compușilor de sulf cu metale și unele nemetale. Inclus în minereurile de sulfuri; utilizate ca fosfor (de exemplu, CdS, ZnS). Sulfură de molibden, lubrifianți solizi din titan. Sulfuri de fosfor ... ... Dicționar encyclopedic ilustrat
- (nou lat, din sulful latin de sulf). Compuși ai unui corp cu sulf, corespunzători oxizilor sau acizilor. Dicționar de cuvinte străine incluse în limba rusă. Chudinov, AN, 1910. SULFIDES Novolatinsk., Din Lat. sulf, sulf. Conectare ... ... Dicționar de cuvinte străine în limba rusă
1. Compuși naturali de sulf ai metalelor și unele nemetale. În chimicale relațiile sunt considerate ca săruri ale H2S acidului hidrogen sulfurat. Un număr de elemente formează polisulfuri cu sulf, care sunt săruri ale acidului polisulfuros H2Sx. Principalul ... ... Enciclopedie geologică
sulfurilor - - compuși de sulf cu metale și unele nemetale; sulfuri de sulf de sulfuri de acid H2S acid. [Dicționar terminologic pentru beton și beton armat. FSUE "SIC" Construcție "NIIZHB și stația de metrou A. A. Gvozdeva, Moscova, 2007. 110 p.] ... ... Enciclopedie de termeni, definiții și explicații ale materialelor de construcție
SULFURI, s. U sulfură, un soț (Spec.). Compuși chimici ai sulfului cu metale și anumite nemetale. Organic cu Natural s. | adj. sulfură, oh, oh. Dicționar Ozhegova. SI Ozhegov, N.Yu. Shvedova. 1949 1992 ... Dicționar Ozhegova
Sulfurile, R2S (radicalul aromatic R), se obțin cel mai ușor prin adăugarea în picături a unei soluții de diazo-săruri la 60 ... Enciclopedia lui Brockhaus și Efron
Sulfurile - (1) în chimia anorganică, acești compuși ai elementelor cu sulf, în care atomii de sulf au o stare de oxidare de 2. În chimic. relația sunt considerate ca săruri ale acidului slab hidrogen sulfurat (soluție apoasă de H2S). Multe S. sunt naturale ... ... Enciclopedie mare de politehnică
s; pl. (unități de sulfură, și m.). [de la lat. sulf sulf] Chem. Compuși de sulf cu metale și unele nemetale. C. titan. Organic cu Natural s. (clasa de minerale). ◁ Sulfură, th, oh. Cu amestecuri mixte. Din minereu de minereu. * * * sulfuri ale compușilor de sulf ... Dicționar encyclopedic
- (din sulful lat de sulf) o clasă de compuși chimici care sunt compuși de metal (precum și un număr de nemetalii B, Si, P, As) cu sulf (S), unde are o stare de oxidare de -2. Pot fi considerate ca săruri de hidrogen sulfurat ... ... Wikipedia
cărți
- Depozitele de uraniu de tipul dezacordului în fanerozoic, Andrei Borisovici Khalefov. Caracteristicile depozitelor de uraniu în structurile râului paleo-vale pe suprafețele de dezacord structural și stratigrafic sunt considerate pe exemplul a trei regiuni din regiunea Ural cu diferite ...
sulf - Elementul perioadei a treia și grupul VIA al sistemului periodic, numărul de ordine 16, se referă la calcogen. Formula electronică a atomului [10 Ne] 3s 2 3p 4, stările caracteristice de oxidare 0, -II, + IV și + VI, starea S VI este considerată stabilă.
Scala de oxidare a sulfului:
Electronegativitatea sulfului este de 2,60, fiind caracterizată de proprietăți nemetalice. În compușii cu hidrogen și oxigen este conținut în diferiți anioni, formează acizi care conțin oxigen și sărurile lor, compuși binari.
În natură - cincisprezecelea elementul de prevalență chimică (cel de-al șaptelea dintre nemetalii). Se găsește în forma liberă (nativă) și în legătură cu aceasta. Un element vital pentru organismele superioare.
Sulphur S. Substanță simplă. Galben cristalină (a-rombică și beta-monoclinică,
la 95,5 ° C) sau amorf (plastic). În locurile de zăbrere există molecule S8 (cicluri tip "corona" neplanară), sulf amorf constă din lanțuri S n. Substanța cu punct de topire scăzut, vâscozitatea lichidului trece printr-un maxim la 200 ° C (spațiul dintre moleculele S 8, intercalarea lanțurilor S n) Într-o pereche - moleculele S8, S6, S4, S2. La 1500 ° C, apare sulful monoatomic (în ecuațiile chimice pentru simplitate, orice sulf este reprezentat ca S).
Sulful nu se dizolvă în apă și în condiții normale nu reacționează cu acesta, este bine solubil în disulfura de carbon CS 2.
Sulful, în special pulverulent, are o activitate mare atunci când este încălzit. Reacționează ca agent de oxidare cu metale și nemetale:
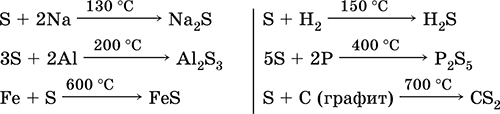
ce zici agent de reducere - cu fluor, oxigen și acizi (la fierbere):
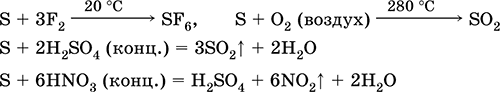
Sulful suferă dismutarea în soluții alcaline:
3S0 + 6KOH (conc) = 2K2S-II + K2SVV03 + 3H20
La temperaturi ridicate (400 ° C), sulful înlocuiește iodul din iodură de hidrogen:
S + 2HI (g) = I2 + H2S,
dar în soluție reacția merge în sens opus:
I 2 + H 2 S (p) = 2 HI + S ↓
recepție: în industrie topite din depozite naturale de sulf nativ (folosind vapori de apă), eliberate în timpul desulfurizării produselor de gazificare a cărbunelui.
Sulful este utilizat pentru a sintetiza disulfura de carbon, acid sulfuric, coloranți sulfuroși (vat), în vulcanizarea cauciucului, ca mijloc de protejare a plantelor de mucegaiul praf și de tratare a bolilor de piele.
Hidrogen sulfurat H 2 S. Acid liber de oxigen. Gaz incolor cu un miros sufocant, mai greu decât aerul. Molecula are structura unui tetraedru dublu-incomplet [:: S (H) 2]
(sp 3 - hibridizare, unghiul cilindrului H - S - H este departe de tetraedru). Instabil când este încălzit la o temperatură mai mare de 400 ° C Este puțin solubil în apă (2,6 l / 1 l H20 la 20 ° C), o soluție saturată este decimolară (0,1 M "apă sulfurat de hidrogen"). Un acid foarte slab în soluție practic nu disocia în faza a doua a ionilor S 2 (concentrația maximă de S 2 -1 este egală cu 1 10-13 mol / l). Când stați în aer, soluția devine tulbure (inhibitor - zaharoză). Este neutralizat de alcaline, nu complet - de hidrat de amoniac. Agent de reducere puternic. Intră în reacțiile de schimb ionic. Agentul sulfid precipită dintr-o soluție de sulfuri colorate diferit, cu o solubilitate foarte scăzută.
Reacții calitative - sedimentarea sulfurilor, precum și arderea incompletă a H2S cu formarea unei depuneri de sulf galben pe un obiect rece introdus în flacără (spatulă din porțelan). Un produs secundar de rafinare a petrolului, gaz natural și cocs.
Se utilizează în producerea de compuși cu conținut de sulf, anorganici și organici, ca un reactiv analitic. Extrem de otrăvitor. Ecuațiile celor mai importante reacții:
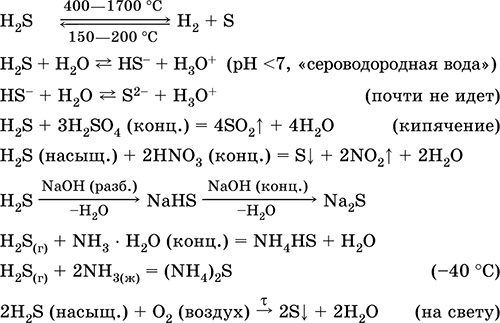

recepție: în industrie - sinteza directă:
H2 + S = H 2S(150-200 ° C)
sau prin încălzirea sulfului cu parafină;
în laborator - deplasarea sulfurilor cu acizi tari
FeS + 2HCI (conc.) = FeCI2 + H 2S
sau hidroliza completă a compușilor binari:
Al2S3 + 6H20 = 2Al (OH) 3 ↓ + 3 H 2S
Sulfură de sodiu Na 2 S. Sare fără oxigen. Alb, foarte higroscopic. Se topește fără descompunere, stabilă termic. Este bine solubil în apă, hidrolizat de anion, creează un mediu puternic alcalin în soluție. Când se află în aer, soluția devine tulbure (sulf coloidal) și devine galben (vopsea polisulfură). Agent de reducere tipic. Se atașează sulf. Intră în reacțiile de schimb ionic.
Reacții calitative pe ionul S 2 - depunerea de sulfuri metalice diferite colorate, din care MnS, FeS, ZnS sunt descompuse în HCI.
Se folosește la producerea coloranților de sulf și a celulozei, pentru îndepărtarea părului de piele în timpul tăbăcirii pieii, ca reactiv în chimia analitică.
Ecuațiile celor mai importante reacții:
Na2S + 2HCI (dec.) = 2NaCI + H2S
Na2S + 3H2S04 (conc) = SO2 + S ↓ + 2H20 + 2NaHSO4 (până la 50 ° C)
Na2S + 4HNO3 (conc) = 2NO + S ↓ + 2H20 + 2NaNO3 (60 ° C)
Na2S + H2S (saturat) = 2NaHS
Na2S (t) + 202 = Na2S04 (peste 400 ° C)
Na2S + 4H2O2 (conc) = Na2S04 + 4H2O
S2 + M2 + = MnS (corporal) ↓; FeS (negru) ↓; ZnS (alb) ↓
S2 + 2Ag + = Ag2S (negru) ↓
S2 + M2 + = CdS (galben) ↓; PbS, CuS, HgS (negru) ↓
3S2 + 2Bi3 + = Bi2S3 (corr. - negru) ↓
3S2 + 6H20 + 2M3 + = 3H2S + 2M (OH) 3 ↓ (M = Al, Cr)
recepție în industrie - calcinarea mineralelor mirabilită Na2S0410H2O în prezența agenților reducători:
Na2S04 + 4H2 = Na2S + 4H20 (500 ° C, cat. Fe203)
Na2S04 + 4C (cocs) = Na2S + 4CO (800-1000 ° C)
Na2S04 + 4CO = Na2S + 4C02 (600-700 ° C)
Sulfura de aluminiu Al2S3. Sare fără oxigen. White, legătura Al - S este predominant covalentă. Se topește fără descompunere sub presiunea excesivă de N 2, este ușor sublimată. Se oxidează în aer când se calcinează. Fully hidrolizat cu apă, nu precipită din soluție. Descompus de acizi puternici. Se utilizează ca o sursă solidă de hidrogen sulfurat pur. Ecuațiile celor mai importante reacții:
Al2S3 + 6H20 = 2Al (OH) 3 ↓ + 3H2S (pur)
Al2S3 + 6HCI (dec.) = 2AlC13 + 3H2S
Al2S3 + 24HNO3 (conc) = Al2 (SO4) 3 + 24NO2 + 12H20 (100 ° C)
2Al2S3 + 9O2 (aer) = 2Al2O3 + 6SO2 (700-800oC)
recepție: interacțiunea aluminiului cu sulful topit în absența oxigenului și a umidității:
2Al + 3S = AL 2 S 3(150-200 ° C)
Sulfura de fier (II) FeS. Sare fără oxigen. Negru și gri, cu o nuanță verde, refractar, se descompune când este încălzit într-un vid. În stare umedă este sensibil la oxigen în aer. Insolubil în apă. Nu precipită după saturarea soluțiilor de săruri de fier (II) cu hidrogen sulfurat. Descompus de acizi. Se utilizează ca materie primă pentru producerea fierului, o sursă solidă de hidrogen sulfurat.
Compusul compusului de fier (III) al Fe2S3 nu este cunoscut (nu este primit).
Ecuațiile celor mai importante reacții:
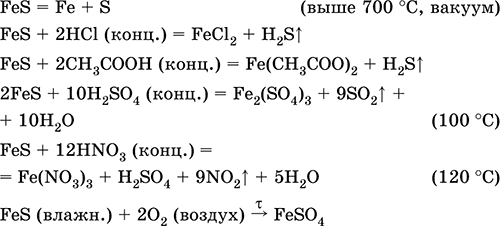
Primirea:
Fe + S = FeS (600 ° C)
Fe2O3 + H2 + 2H2S = 9 FeS + 3H20 (700-1000 ° C)
FeCl2 + 2NH4 HS (g) = FeS ↓ + 2NH4CI + H2S
FeS2 disulfură de fier. Conexiune binară. Are structura ionică Fe 2+ (-S-S-) 2-. Culoarea galbenă, stabilă termic, se descompune la aprindere. Insolubil în apă, nu reacționează cu acizii diluați, cu alcalii. Se descompune prin agenți de oxidare acidă, prăjiți în aer. Se utilizează ca materie primă pentru producerea de fier, sulf și acid sulfuric, un catalizator în sinteza organică. În natură - minereuri minerale pirită și marcasite.
Ecuațiile celor mai importante reacții:
FeS2 = FeS + S (peste 1170 ° C, vid)
2FeS 2 + 14H2SO4 (conc., Munții) = Fe2 (SO4) 3 + 15S02 + 14H2O
FeS2 + 18HNO3 (conc.) = Fe (NO3) 3 + 2H2S04 + 15NO2 + 7H20
4FeS 2 + 11O 2 (aer) = 8SO 2 + 2Fe 2 O 3 (800 ° C, prăjire)
Hidrosulfură de amoniu NH4 HS. Sare acidă fără oxigen. Alb, topit sub presiune. Extrem de volatil, instabil din punct de vedere termic. Se oxidează pe aer. Este bine solubil în apă, hidrolizat de cation și anion (predomină), creează un mediu alcalin. Soluția devine galbenă în aer. Se descompune prin acizi, într-o soluție saturată adaugă sulf. Alcalinele nu sunt neutralizate, sarea de mijloc (NH4) 2S nu există în soluție (pentru condițiile de obținere a sarei medii, a se vedea titlul "H 2 S") Se folosește ca o componentă a dezvoltatorilor de fotografii, ca un reactiv analitic (precipitator de sulfuri).
Ecuațiile celor mai importante reacții:
NH4 HS = NH3 + H2S (peste 20 ° C)
NH4 HS + HCI (dec.) = NH4CI + H2S
NH4 HS + 3HN03 (conc) = S ↓ + 2N02 + NH4N03 + 2H20
2NH4 HS (saturat H2S) + 2CuS04 = (NH4) 2S04 + H2S04 + 2CuS ↓
recepție: saturarea soluției concentrate de NH3 cu hidrogen sulfurat:
NH3H2O (conc.) + H2S (g) = NH 4 HS + H20
În chimia analitică, o soluție care conține cantități egale de NH4 HS și NH3H20 este convențional considerată ca o soluție de (NH4) 2S și formula de sare medie este utilizată în scrierea ecuațiilor de reacție, deși sulfura de amoniu este hidrolizată complet în apă până la NH4 HS și NH 3 H20.
Dioxidul de sulf. sulfiți
Dioxid de sulf SO2. Acid oxid. Gaz incolor, cu un miros înțepător. Molecula are structura unui triunghi incomplet [: S (O) 2] (sp2 - hibridizare), conține σ, π - legături S = O. Ușor lichefiat, stabil din punct de vedere termic. Este solubil în apă (~ 40 l / 1 l H20 la 20 ° C). Formează un polihidrat cu proprietățile unui acid slab, produsele de disociere - ioni HSO3 - și SO3 2-. Ion HSO 3 - are două forme tautomere - simetric (neacidă) cu structura tetraedrului (sp3 - hibridizare), care predomină în amestec și asimetric (acid) cu structura unui tetraedru incomplet [: S (O) 2 (OH)] (sp3 - hibridizare). Ionul SO3 2- este de asemenea tetraedric [: S (O) 3].
Reacționează cu alcalii, hidrat de amoniu. Agent de reducere tipic, agent slab de oxidare.
Reacție calitativă - decolorarea "iodului de apă" galben-maroniu. Intermediar în producția de sulfuri și acid sulfuric.
Se folosește pentru înălbirea lânii, mătăsii și paielor, conservarea și depozitarea fructelor, ca dezinfectant, antioxidant, lichid de răcire. Toxic.
Compusul de H2S03 (acid sulfuros) nu este cunoscut (nu există).
Ecuațiile celor mai importante reacții:
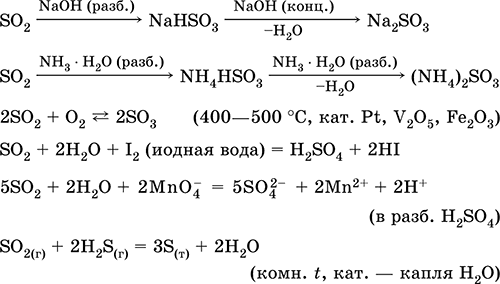
Dizolvare în apă și proprietăți acide:
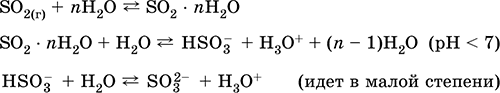
recepție: în industrie - arderea sulfului în aer îmbogățit cu oxigen și, într-o mai mică măsură, prăjirea minereurilor de sulfuri (gaz asociat SO2 în timpul prăjirii piritului):
S + O2 = SO 2(280-360 ° C)
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8 SO 2(800 ° C, prăjire)
în laborator - deplasarea sulfitilor cu acid sulfuric:
BaSO3 (t) + H2S04 (conc) = BaS04 + S02 + H20
Sulfit de sodiu Na 2 SO 3. Oksosol. Alb. Când se încălzește în aer se descompune fără topire, se topește sub presiune de argon. În stare umedă și în soluție sensibilă la oxigen în aer. Este solubil în apă, hidrolizat cu anion. Descompus de acizi. Agent de reducere tipic.
Reacție calitativă pe ionul SO3 2- - formarea unui precipitat alb de sulfit de bariu, care este transferat în soluție cu acizi tari (HCl, HNO3).
Este folosit ca un reactiv în chimia analitică, o componentă a soluțiilor fotografice, un neutralizator de clor în procesul de albire a țesăturilor.
Ecuațiile celor mai importante reacții:
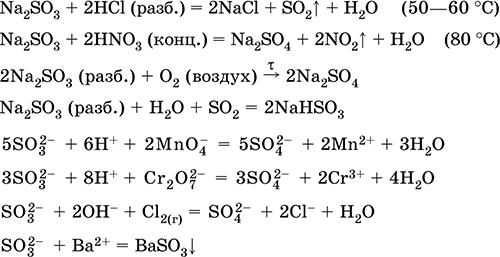
Primirea:
Na2C03 (conc) + SO2 = Na2S03 + CO 2
Acid sulfuric. sulfați
Acid sulfuric H2S04. Acid oxic. Lichid incolor, foarte vâscos (uleios), foarte higroscopic. Molecula are o structură tetraedrică distorsionată (sp 3 gib), conține legăturile covalente S - OH și sp - legături S = O. Ionul SO4 2- are o structură corectă - tetraedrică. Are o gamă largă de temperatură a stării lichide (~ 300 de grade). Când este încălzit peste 296 ° C, se descompune parțial. Este distilat ca un amestec azeotropic cu apă (fracțiunea de masă a acidului este 98,3%, punctul de fierbere este 296-340 ° C), se descompune complet cu o încălzire mai puternică. Amestecuri nelimitate cu apă (cu exo-effect). Acid puternic în soluție, neutralizat de alcaline și hidrat de amoniac. Conform metalelor la sulfați (cu un exces de acid concentrat în condiții normale, se formează hidrosulfați solubili), metalele Be, Bi, Co, Fe, Mg și Nb sunt pasivate în acidul concentrat și nu reacționează cu acesta. Reacționează cu oxizi și hidroxizi de bază, descompune săruri ale acizilor slabi. Oxidant slab în soluție diluată (datorită lui HI), puternic - într-o soluție concentrată (datorită S VI). Ei bine dizolvă SO 3 și reacționează cu el (se formează un lichid uleios greu - oleum, conține H2S2O7).
Reacție calitativă pe ionul de SO4 2 - precipitarea sulfatului de bariu alb BaSO 4 (precipitatul nu este transformat într-o soluție de acizi clorhidric și azotic, spre deosebire de precipitatul alb BaSO 3).
Se utilizează în producția de sulfați și alți compuși ai sulfului, îngrășăminte minerale, explozivi, coloranți și medicamente, în sinteza organică, pentru "deschiderea" (prima etapă de prelucrare) a minereurilor și mineralelor importante industriale, în rafinarea produselor petroliere, electroliza apelor, . Poisonous, provoacă arsuri ale pielii. Ecuațiile celor mai importante reacții:
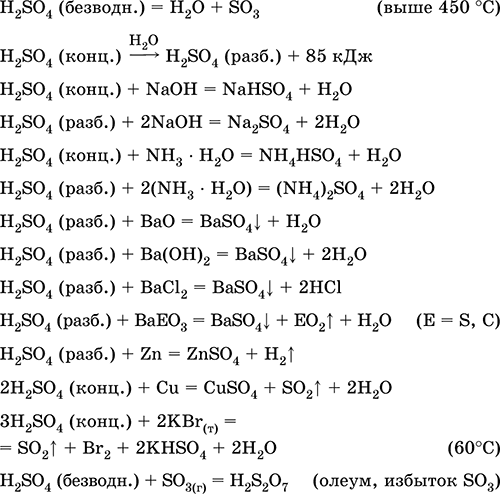
recepție în industrie:
a) sinteza SO2 din minereuri de sulf, minereuri sulfuroase, minereuri sulfuroase si sulfatate:
S + O 2 (aer) = SO 2(280-360 ° C)
4FeS 2 + 11O 2 (aer) = 8 SO 2 + 2Fe2O3 (800 ° C, prăjire)
2H2S + 3O2 (g) = 2 SO 2 + 2H20 (250-300 ° C)
CaS04 + C (cocs) = CaO + SO 2 + CO (1300-1500 ° C)
b) conversia S02 în S03 în aparatul de contact:
c) sinteza acidului sulfuric concentrat și anhidru:
H20 (Col. H2S04) + S03 = H2S04(concentrat, anhidru)
(nu se realizează absorbția de SO 3 în apă pură cu producerea de H2S04 datorită încălzirii puternice a amestecului și descompunerii reversibile a H2S04, vezi mai sus);
d) sinteza oleum - un amestec de H2S04 anhidru, acid disaric H2S2O7 și exces de SO3. Soluția SO 3 dizolvată asigură o apă fără apă (H 2 SO 4 se formează imediat când apa intră), ceea ce permite transportul în condiții de siguranță în rezervoarele de oțel.
Sulfat de sodiu Na2SO4. Oksosol. Alb, higroscopic. Se topește și se fierbe fără descompunere. Formează hidrat cristalin (mineral mirabilită) pierzând ușor apă; nume tehnic Sarea lui Glauber. Este solubil în apă, nehidrolizat. Reacționează cu H2S04 (conc.), SO3. Reconstituit de hidrogen, cocsul este încălzit. Intră în reacțiile de schimb ionic.
Se utilizează în fabricarea vopselelor din sticlă, celuloză și minerală, ca medicament. Conținut în saramură de lacuri sărate, în special în Golful Kara-Bogaz-Gol al Mării Caspice.
Ecuațiile celor mai importante reacții:
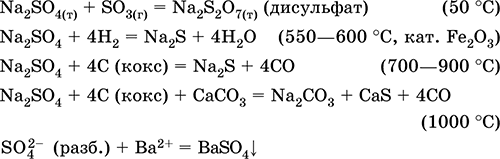
Hidrohidrat de hidroxid de potasiu KHSO 4. Sare de oxol acru. Alb, higroscopic, dar nu formează hidrați cristalini. Când se încălzește și se descompune. Este bine solubil în apă, anionul suferă o disociere în soluție, mediul de soluție este puternic acid. Este neutralizat cu alcalii.
Se utilizează ca o componentă a fluxurilor în metalurgie, parte integrantă a îngrășămintelor minerale.
Ecuațiile celor mai importante reacții:
2KHSO4 = K2S04 + H2S04 (până la 240 ° C)
2KHSO4 = K2S2O7 + H20 (320-340 ° C)
KHSO 4 (dil.) + KOH (conc.) = K2S04 + H20 KHS04 + KCI = K2S04 + HCI (450-700 ° C)
6KHSO4 + M2O3 = 2KM (SO4) 2 + 2K2S04 + 3H20 (350-500 ° C, M = Al, Cr)
recepție: tratarea sulfatului de potasiu în frig (cu mai mult de 60%) acid sulfuric
K2S04 + H2S04 (conc.) = 2 KHSO 4
Sulfat de calciu CaSO4. Oksosol. Alb, foarte higroscopic, refractar, se descompune când este calcinat. CaSO4 natural se găsește sub forma unui mineral foarte comun gips CaSO4 2H2O. La 130 ° C, gipsul pierde o parte din apă și intră arderea arsurilor2CaSO4H2O (denumire tehnică Alabaster). Ghipsul complet deshidratat (200 ° C) răspunde la minerale anhidritCaS04. Este ușor solubil în apă (0,206 g / 100 g H20 la 20 ° C), solubilitatea scăzând atunci când este încălzită. Reacționează cu H2S04 (conc.). Recuperat de cocs în timpul fuziunii. Definește cea mai mare parte a durității "constante" a apei proaspete (pentru mai multe detalii, a se vedea 9.2).
Ecuațiile reacțiilor cele mai importante: 100-128 ° C
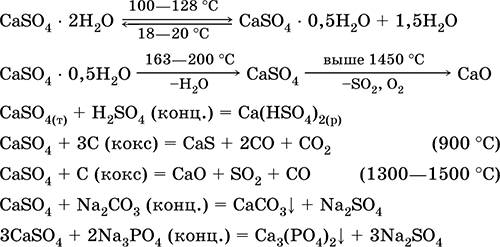
Se utilizează ca materie primă pentru producerea de SO2, H2S04 și (NH4) 2S04, ca flux în metalurgie, umplutură de hârtie. Mortarul de legare preparat din gips ars "setează" mai repede decât amestecul bazat pe Ca (OH) 2. Încălzirea este asigurată prin legarea apei, formarea de gips în formă de masă de piatră. Gipsul turnat este utilizat pentru a produce ghipsuri, forme și produse arhitecturale și decorative, pereți despărțitori și panouri și podele din piatră.
Sulfat de potasiu aluminiu KAl (SO4) 2. Sare dublă cu oxol. Alb, higroscopic. Cu căldură puternică se descompune. Formează hidrat cristalin - alumină aluminiu de potasiu. Moderat solubil în apă, hidrolizat cu cation de aluminiu. Reacționează cu alcalii, hidrat de amoniu.
Este folosit ca mordant în țesăturile de vopsire, piele de bronzare, coagulantul în purificarea apei proaspete, o componentă a compozițiilor de dimensionare a hârtiei și un agent hemostatic extern în medicină și cosmetologie. Se formează prin co-cristalizarea sulfatului de aluminiu și de potasiu.
Ecuațiile celor mai importante reacții:
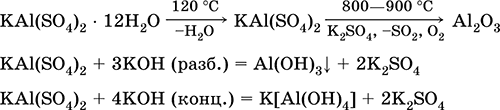
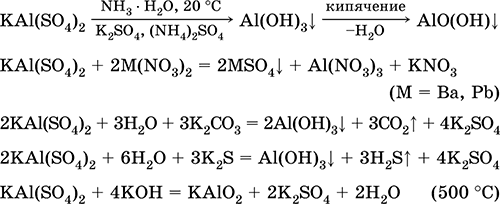
Sulfat de crom (III) - potasiu KCr (SO4) 2. Sare dublă cu oxol. Roșu (hidrat violet închis, denumire tehnică aluminiu de potasiu). Când se încălzește se descompune fără a se topi. Este ușor de solubil în apă (culoarea gri-albastră a soluției corespunde cu aquacomplexul 3+), este hidrolizată de cationul de crom (III). Reacționează cu alcalii, hidrat de amoniu. Oxidant slab și agent de reducere. Intră în reacțiile de schimb ionic.
Reacții calitative la reducerea ionilor de Cr 3+ la Cr 2+ sau oxidarea la galben CrO4 2-.
Se folosește ca agent de bronzare pentru piele, un mordant în țesăturile de vopsire, un reactiv pe o fotografie. Se formează prin co-cristalizarea cromului (III) și a sulfatului de potasiu. Ecuațiile celor mai importante reacții:
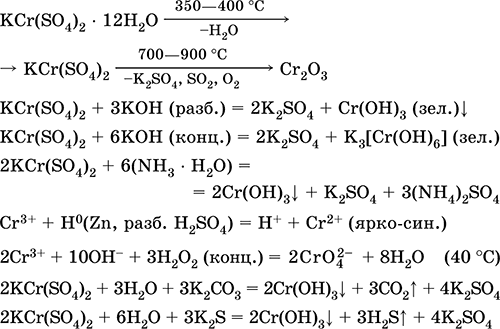
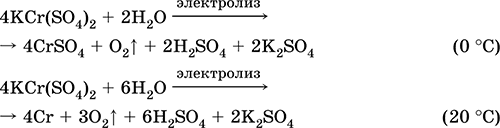
Sulfat de mangan (II) MnS04. Oksosol. Alb, când este calcinat, se topește și se descompune. Hidrat cristalin MnSO 4 5H 2 O - roșu - roz, denumire tehnică manganul vitriol. Este solubil în apă, culoarea roz deschisă (aproape incoloră) a soluției corespunde cu aquacomplex 2+; hidrolizat de cation. Reacționează cu alcalii, hidrat de amoniu. Agentul de reducere slab reacționează cu agenții de oxidare tipici (puternici).
Reacții calitative la ionul Mn 2+ - o conducție cu ionul MnO 4 și dispariția culorii violete a acestuia, oxidarea Mn 2+ la MnO 4 și apariția unei culori violete.
Se utilizează pentru a obține Mn, MnO2 și alți compuși ai manganului, ca reactivi micronutrienți și analitici.
Ecuațiile celor mai importante reacții:
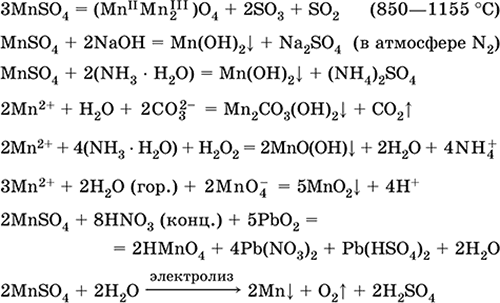
Primirea:
2Mn02 + 2H2S04 (conc) = 2 MnS04 + 02 + 2H20 (100 ° C)
Sulfat de fier (II) FeSO4. Oksosol. Alb (hidrat ușor verde, denumire tehnică fier vitriol),higroscopice. Se descompune când este încălzit. Este solubil în apă, într-o mică măsură hidrolizat de cation. Este rapid oxidat în soluție de oxigen în aer (soluția devine galben și devine tulbure). Reacționează cu agenți de oxidare a acidului, alcalii, hidrat de amoniac. Agent de reducere tipic.
Se folosește ca o componentă a vopselelor minerale, electroliților în galvanizare, conservant de lemn, fungicid, medicament anti-anemie. În laborator, mai des este luată ca sare dublă Fe (NH4) 2 (SO4) 2 6H2O ( sare mora) mai rezistent la aer.
Ecuațiile celor mai importante reacții:
![]()
Primirea:
Fe + H2S04 (dec.) = FeS04+ H2
FeCO3 + H 2 SO 4 (par.) = FeS04 + C02 + H20
7.4. VA-grup nemetalici
Azot. amoniac
azot - un element al celei de-a doua perioade și grupul VA al sistemului periodic, numărul de serie 7. Formula electronică atomică [2 He] 2s 2 2p 3, stări caracteristice de oxidare 0, -III, + III și + V, mai puțin adesea + II, + IV și etc.; Starea N este considerată relativ stabilă.
Nivelul de oxidare a azotului:
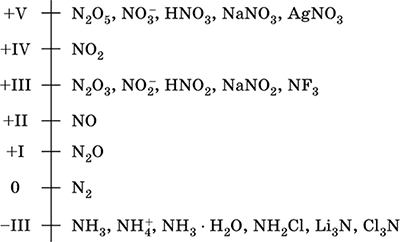
Azotul are o mare electronegativitate (3,07), al treilea după F și O. Afișează proprietăți tipice nemetalice (acide). Formează diferiți acizi cu conținut de oxigen, săruri și compuși binari, precum și cationul de amoniu NH4 + și sărurile sale.
În natură - șaptesprezecelea elementul de prevalență chimică (al nouălea printre nemetale). Un element vital pentru toate organismele.
Azot N2. Substanță simplă. Se compune din molecule nepolar cu o legătură foarte stabilă σππ N ≡ N, ceea ce explică inerția chimică a azotului în condiții normale. Un gaz incolor, inodor care condensează într-un lichid incolor (spre deosebire de O 2).
Componenta principală a aerului: 78,09% în volume, 75,52% în greutate. Din aerul lichid, azotul se fierbe peste oxigenul O2. Este puțin solubil în apă (15,4 ml / 1 l H20 la 20 ° C), solubilitatea azotului este mai mică decât cea a oxigenului.
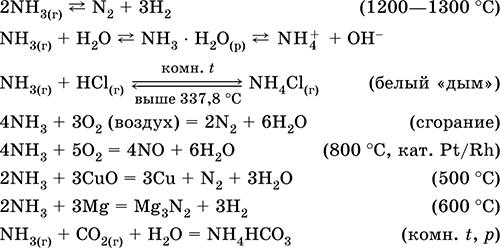
La temperatura camerei, N2 reacționează numai cu litiu (într-o atmosferă umedă), formând nitrură de litiu Li3N, nitridiile altor elemente sunt sintetizate cu încălzire puternică:
N2 + 3Mg = Mg3N2 (800 ° C)
Într-o descărcare electrică, N2 reacționează cu fluor și într-o mică măsură cu oxigen:
O reacție reversibilă pentru producerea amoniacului are loc la 500 ° C, sub presiune până la 350 atm și în mod necesar în prezența unui catalizator (Fe / F2O3 / FeO, în laboratorul Pt):
În conformitate cu principiul Le Chatelier, o creștere a randamentului de amoniac ar trebui să aibă loc cu o creștere a presiunii și o scădere a temperaturii. Cu toate acestea, viteza de reacție la temperaturi scăzute este foarte scăzută, astfel că procesul este efectuat la 450-500 ° C, atingând un randament de 15% amoniac. N2 și H2 nereacționate se întorc în reactor și cresc astfel gradul de reacție.
Azotul este pasiv chimic în ceea ce privește acizii și alcalinele, nu susține arderea.
recepție în industrie - distilarea fracționată a aerului lichid sau îndepărtarea oxigenului din aer prin mijloace chimice, de exemplu prin reacția 2C (cocs) + 02 = 2CO prin încălzire. În aceste cazuri, se produce azot, care conține, de asemenea, impurități de gaze nobile (în principal argon).
laborator cantități mici de azot chimic pur pot fi obținute printr-o reacție combinată cu încălzire moderată:
N-lllH4Nll02 (t) = N20 + 2H20 (60-70 ° C)
NH4CI (p) + KNO2 (p) = N2O + KCI + 2H20 (100 ° C)
Se utilizează pentru sinteza amoniacului, a acidului azotic și a altor produse care conțin azot, ca mediu inert pentru procesele chimice și metalurgice și pentru depozitarea substanțelor inflamabile.
Amoniac NH3. Compusul binar, gradul de oxidare a azotului este - III. Gaz incolor cu un miros caracteristic ascuțit. Molecula are structura unui tetraedru incomplet [: N (H) 3]] (sp 3 gib-hibridizare). Prezența azotului în molecula NH3 a unei perechi de donori de electroni într-o orbitală sp 3 - hibrid determină o reacție de adăugare caracteristică a cationului de hidrogen, cu formarea unui cation amoniu NH4 +. Se lichefiază sub presiune la temperatura camerei. În stare lichidă este asociată datorită legăturilor de hidrogen. Din punct de vedere termic instabil. Este solubil în apă (mai mult de 700 l / l de H20 la 20 ° C); proporția din soluția saturată este = 34% în masă și = 99% în volum, pH = 11,8.
Foarte reactiv, predispus la reacții de adiție. Se produce în oxigen, reacționează cu acizi. Ea prezintă proprietăți de reducere (datorită N-III) și oxidare (datorită proprietăților HI). Uscat numai cu oxid de calciu.
Reacții calitative - formarea unui "fum alb" în contact cu HCl gazos, înnegrirea hârtiei umezite cu o soluție de Hg2 (NO3) 2.
Produs intermediar în sinteza sărurilor de HNO3 și săruri de amoniu. Utilizate în fabricarea de sodă, îngrășăminte azotate, coloranți, explozivi; amoniacul lichid este un lichid de răcire. Toxic.
Ecuațiile celor mai importante reacții:
recepție: în laborator - deplasarea amoniacului din sărurile de amoniu atunci când este încălzit cu sodă de sodiu (NaOH + CaO):
sau fierberea unei soluții apoase de amoniac, urmată de uscarea gazului.
industrie amoniacul este sintetizat din azot (vezi) cu hidrogen. Produs de industrie fie sub formă lichefiată, fie sub formă de soluție apoasă concentrată sub denumirea tehnică apa de amoniac.
Hidrat de amoniu NH3H2O. Compus intermolecular. Alb, în rețeaua de cristal sunt molecule de NH3 și H2O, legat de o legătură slabă de hidrogen H3N ... HON. Prezentă într-o soluție apoasă de amoniac, o bază slabă (produsele de disociere - cationul NH4 - și anionul OH -). Cationul de amoniu are o structură regulată π-tetraedrică (sp 3 - hibridizare). Din punct de vedere termic instabil, complet descompus prin fierberea soluției. Neutralizat de acizi puternici. Afișează proprietăți de reducere (datorită lui N III) într-o soluție concentrată. Intră în reacția schimbului de ioni și a complexării.
Reacție calitativă - formarea unui "fum" alb în contact cu HCl gazos.
Se utilizează pentru a crea un mediu slab alcalin în soluție, în timpul precipitării hidroxidurilor amfoterice.
Soluția de amoniac 1M conține în principal hidrat de NH3H2O și numai 0,4% ioni de NH4 + și OH - (datorită disocierii hidratului); astfel, "hidroxidul de amoniu NH4OH" ionic nu este practic conținut în soluție, nu există un astfel de compus în hidratul solid. Ecuațiile celor mai importante reacții:
NH3H2O (conc) = NH3 + H20 (fierbere cu NaOH)
NH3H2O + HCI (dec.) = NH4CI + H20
3 (NH3H2O) (conc) + CrCI3 = Cr (OH) 3 ↓ + 3NH4Cl
8 (NH3H20) (conc) + 3Br2 (p) = N2 + 6NH4Br + 8H20 (40-50 ° C)
2 (NH3H2O) (conc) + 2KMnO4 = N2 + 2MnO2 ↓ + 4H2O + 2KON
4 (NH3H20) (conc) + Ag2O = 2OH + 3H20
4 (NH3H20) (conc) + Cu (OH) 2 + (OH) 2 + 4H20
6 (NH3H2O) (conc) + NiCI2 = Cl2 + 6H20
S-a numit adesea soluția de amoniac diluată (3-10% - timpul) amoniac lichid (numele a fost inventat de alchimiști), iar soluția concentrată (18,5-25%) apa de amoniac (produse de industrie).
