Pe silice amorfă. Dioxid de siliciu.
DIOXID DE SILIC (silice) Si02, bestsv. cristalină, substanță amorfă sau sticlosă.
Structura. DIOXID DE SILICA d. Există mai multe modificări polimorfe (a se vedea tabelul). Temperatura de tranziție la presiune normală: a-cuarț Db -quartz 575 ° C (tranziție DHO 0,41 kJ / mol), p-cristal D p-cristobalit 927 ° C (2,26 kJ / mol) Dg-tridymit 867 ° C (0,50 kJ / mol), a-tridmită Db-tridymit 115 ° C (0,27 kJ / mol), b -tridymit Dg-tridymit 160 ° C / mol), d-ditimit D b-cristobalit 1470 ° C (0,21 kJ / mol), a-cristobalit D b-cristobalit 270 ° C. Punctul de topire al cuarțului p este 1610 ° C (Dh 0 mp 8,53 kJ / mol), g-tridymit 1680 ° C, b-cristobalit 1723 ° C (D H 0 pl 9,6 kJ / mol). Cvartul polimorfic transformat, tridymit și cristobalitul sunt însoțite de o schimbare a volumului. Formele cristaline ale DIOXIDULUI SILICON sunt construite din tetraedru de SiO4, iar formele a și b se disting printr-o ușoară deplasare și rotație a tetraedrului. Pentru tridymiții cu temperatură scăzută, sunt date și date pentru alte cristale cristaline. modificările, totuși, toate conțin b -tremită ca principală unitate structurală, dar sunt diferit distorsionate. De exemplu, sunt descrise tridymiții triclinici și monoclinici. În natură, de asemenea, găsit cub. Modificarea SiO2 - melanflogit (a = 1,3402 nm, z = 48, grup spațial Pt3p). La presiuni mari se formează balene (80-130 MPa, 400-500 ° C), coezite (1,5-4 GPa, 300-1700 ° C), stishovite (16-18 GPa, 1200-1400 ° C). Stishovit este singura modificare a DIOXIDULUI SILICON, construit din SiO 6 octaedra. Stabilitatea tridimitului este probabil determinată de impuritățile Na și Al. Forma instabilă de siliciu DIOXIDd. - "silice fibroasă" rombo-dipyramidă. În plus față de cristalele cristaline, dioxidul de siliciu poate avea și alte forme de existență. Cristalul ascuns forme (chalcedonie) sunt similare în structură cu cuarț. Când se extrag cationii din anumite silicate cu acid, se obține un hidrat. silice cristalină. Ei moștenesc textura mineralelor sursă, formând structuri fibroase, scalabile (lepidoide) și foi de tip stratificat. Sunt cunoscute formațiuni anizotropice și izotropice (opale), silice naturale fine (tripoli, silice coloidală sintetică și pulberi de silice). Hidratate. silicea amorfă precipitată din soluții de silicat de sodiu, etc., polimerizată în sferic. particule cu un diametru mai mic de 100 nm, de obicei 2-3 nm. S-a obținut silice amorfă sub formă de foițe, panglici și fibre (vezi gel de silice). La temperaturi ridicate, pulberile fine de silice pirogenică anhidră - Aerosil și altele - sunt eliberate din faza gazoasă. Despre silicea vitroasă, a se vedea sticla de cuarț.
Proprietăți. Presiunea de vapori de SILICON DIOXIDE, 13,3-133 Pa, în apropierea punctului de topire. SILICA DIOXIDATĂ. - dielectric, r 10 12 Ohm * m (20 ° C), 9 * 10-1 Ohm * m (1600 ° C). A-cristalele cu cristale unice au o structură chirală, care determină activitatea lor optică și piezoelectrică. proprietăți. Cuarțul este transparent pentru razele UV și parțial IR.
Imaginea clinică a silicozei acute este caracterizată prin scurtarea respirației, care se înrăutățește rapid, cașexia, semnele cronice ale inimii pulmonare și prezența proteinozei alveolare histologice. În silicoza acută nu este necesară fibroza pulmonară. Raza X detectează umplerea spațiului aerian în grade diferite, ceea ce face ca imaginea de "condens" sau "sticlă mată", care este adecvată pentru diagnosticul diferențial al proteinozei alveolare idiopatice, alveolită radiologică, alveolită hemoragică, pneumonie, edem pulmonar acut.
* Indicii de refracție: N g - mai mult, N p - mai puțin. ** A și b-quartz-ul au două spații. grupuri, deoarece pentru ambele forme sunt posibile izomerii optici din stânga și din dreapta. *** b-120 ° C.
Solubilitatea α-cuarțului în apă este de 10-3% în greutate (25 ° C), formele amorfe de silice sunt 0,007-0,015% (pentru soluțiile apoase de SiO2, vezi Acizii Silici). Solubilitatea SILICON DIOXIDE în mediu acid și alcalin este determinată de natura solventului. DIOXID DE SILICA d. Insolubil în majoritatea solvenților organici. Reacționează cu acid fluorhidric pentru a forma acid fluorosilicic. La 250-400 ° C, interacțiunea cu HF, F2 gazos (dând SiF4), la 200-250 ° C - cu NH4HF2. Într-un amestec cu cărbune reacționează cu CI2 când este încălzit, formând SiCl4. Silicea amorfă este lentă solubilă în soluții apoase de alcalii, Na2C03 (dând silicați) și NH4F (formând fluorosilicați), viteza de dizolvare crește odată cu creșterea presiunii și a temperaturii. Atunci când se încălzesc amestecuri de dioxid de siliciu sub formă de pulbere cu oxizi diferiți, se formează silicați și când se topesc cu Na2C03 și Na2S04 este silicatul de sodiu solubil în apă (a se vedea și sticla solubilă).
Distribuția în natură. Conținut fără dioxid de siliciu în crusta terestră 12%; este de asemenea inclus în roci sub formă de diferite silicate sau sub formă de amestecuri cu alte minerale (granit). Cuartul este unul dintre cele mai frecvente minerale: tridymit, cristobalite, lschatelit (sticlă naturală de cuarț), calcedon, opalii sunt mult mai puțin frecvente. Cristalele de cuarț mici, orientate diferit formează un cuarț "gangă". Odată cu distrugerea rocilor, apar nisipuri de cuarț, compactarea cărora duce la formarea de gresii și cuarțite. Haib. cuarțul pur este un cristal de rocă, cristalele acestuia putând ajunge la câțiva metri și cântăresc zeci de tone. Cristalele simple de cuart sunt transparente, incolore (cristal de rocă) sau colorate cu impurități în culori violete (ametist), negru (marion), galben (citrin), fumuri (rauch-topaz). Tipuri de criptocristaline. forme de cuarț: carnelian roz-roșu, safirină albăstrui, crizopază verde măr, agate bandă și onixe, jaspis de culoare fină, siliciu și carpen. Wiikalen opal "nobil" amorf, format din particule coloidale omogene cu un diametru de 0,1-0,3 μm, ambalate strâns în aglomerate comandate; conținutul său de apă este mai mic de 1% din masă (pentru cele mai multe opale obișnuite, 4-9%). La p. silicele se formează de asemenea tripoli, diatomit etc. Cojile de diatome și schelete ale unor bureți sunt construite din silice; întărește tulpinile plantelor - coada, bambusul, trestia, este conținută în paie. Dioxidul de siliciu este responsabil pentru silicificarea formelor de organisme de plante vii. Concentrația de silice în sânge și plasmă umană este de 0,001% în greutate.
Noțiuni de bază. Sintetic. Dioxidul de siliciu d. Primeste: actiunea acizilor (H 2 SO 4, HCl, CO 2) pe silicat de Na, mai putin pe alte silicati solubili (principalul mod de productie in tarile capitaliste); din silice coloidală prin coagulare sub acțiunea ionilor Na +, NH4, F - sau prin înghețare; hidroliza SiCl 4, SiF 4, (NH4) 2SiF6, (C2H5O) 4Si în soluții apoase, amoniac-apă (uneori cu adaos de etanol sau baze organice) și în fază gazoasă. DIOXID DE SILIC DIPLOM AMORF D. Este de asemenea obținut din tripoli și din pământ de diatomee prin arderea cojilor de orez și prin măcinarea nisipului de cuart topit. Pulberile anhidre de dioxid de siliciu cu o suprafață specifică ridicată sunt obținute prin depunerea chimică a vaporilor prin arderea vaporilor de SiCl4 într-un amestec de H2 și O2 (aerosil, în SUA - Cabosil), oxidarea și hidrolizarea vaporilor de esteri Si de asemenea SiF4 (fluosil). Particulele condensate inițial de SILICON DIOXIDE, cu diametrul de 1 nm, sunt ambalate dens în conglomerate secundare, combinate într-o structură liberă cu o suprafață specifică de 200-400 m2 / g. A-cristalele cu cristale A sunt crescute din soluții alcaline de SILICON DIOXID în autoclave de înaltă presiune (35-120 MPa) la 300-420 ° C (vezi procesele hidrotermale). În producția de materiale utilizate în tehnica pe bază de SILICON DIOXIDE, se utilizează următoarele procedee:
- depunerea chimică din faza gazoasă în timpul arderii la temperatură înaltă a SiCl4, purificată anterior prin distilare. Se precipită particule de SILICON DIOXID, formate într-o flacără sau plasmă de oxigen-hidrogen, dând sticlă masivă de cuarț sau straturi de preforme din fibre optice;
- oxidarea de suprafață cu un singur cristal. Si cu formarea heterostructurilor (în fabricarea circuitelor integrate);
- sinterizarea dioxidului de siliciu fin în ceramica cuarțului (a se vedea și Ceramica);
- procedeul sol-gel, incluzând hidroliza compusului organic S, deshidratarea lentă a gelului format și încălzirea moderată. Se folosește pentru a produce sticlă cu cuarț și sticlă înaltă;
- obținerea de Dioxid de siliciu cu puritate înaltă și a paharelor poroase (tip Vicore) prin tratarea termodinamică a sticlei borosilicate de conducere, a leșiei cu acid și spălarea cadrului de silice.
La p. Silica este folosită la fabricarea paharelor din silicat, a porțelanului și a ceramicii, a materialelor abrazive, a betonului, a cărămizilor din silicat, a dinaselor și a ceramicii. Sintetic. DIOXID DE SILIC d. ("Funingine albă") - umplutură în producția de cauciuc (până la 70% din produsul SILICON DIOXIDE d.). Am câștigat. utilizați hidrat precipitat. silice (conținând 85-95% SiO2) cu o suprafață specifică de 60-300 m2 / g, într-o măsură mai mică - silice anhidră de tip aerosil. Aerosil este, de asemenea, un adsorbant în cromatografie, un agent de îngroșare a lubrifianților, adezivilor, vopselelor. Monocristalele de cuarț sunt utilizate în radiotehnie (piezoelectrice, stabilizatori de frecvență, filtre, rezonatori etc), acoustooptics și acoustoelectronics spectrografe, monocromatoare, lentile pentru optica UV etc.), in bijuterii (soiuri transparente, frumos colorate - pietre semipretioase). Gelurile de gel cu un diametru eficient al porilor de 2-15 nm sunt folosite ca balonuri. sorbenți și purtători de catalizatori. Sintetic. DIOXIDUL DE SILIC ȘI cristalul de rocă sunt materia primă pentru producerea cristalelor singulare de cuarț, sticlă de cuarț, ceramică și fibre de cuarț. Cuarț de sticlă și ceramică - construcții. material în aviats. industria (de exemplu, pentru ferestrele și husele pentru ferestre ale aeronavelor), în optică (pentru ferestre de intrare, dispozitive optice din gama UV și IK), în electronică (linii de întârziere) etc. Tesatura din cuarț este un material termoizolant. Fibrele din cuarț sunt utilizate pentru a crea linii de comunicații cu fibră optică (ghidaj de lumină) și sisteme de transmitere a informațiilor. Producție sintetică Dioxidul de siliciu d. În capitalistich. țări 600-700 mii tone / an (1980). Când DIOXIDUL SILICON intră în țesutul viu, granuloamele se dezvoltă încet. Praful de praf provoacă o iritare superioară. dyhat. căile și bronhiile, o boală a tractului gastrointestinal, cu inhalare prelungită - o boală gravă - silicoză a plămânilor. MPC la conținutul de SiO 2 în praful Sf. 70% - 1 mg / m3, 10-70% - 2 mg / m3, 2-10% - 4 mg / m3.
Funcția pulmonară: Disfuncție restrictivă, transfer alveolokapilimarogo modificat. Se face diagnosticul diferențial al silicozei acute: proteinoterapie alveolară, alveolită hemoragică idiopatică, pneumonie, edem pulmonar. Legătura dintre silicoză și tuberculoză necesită un proces activ tuberculos.
Bronchopneumopatia obstructivă cronică. Cea mai obișnuită legătură între silicoză și artrita reumatoidă este asocierea care definește sindromul Kaplan. Sindromul Erasmus este o asociere a silicozei-sclerodermiei. Neoplasm ușor. Silicoză complicații complicații ale infecțiilor respiratorii, bronșită cronică, emfizem, pneumotorax, insuficiență respiratorie, boală cardiacă pulmonară cronică.
Proprietățile fizice și chimice ale aerosilului (dioxid de siliciu)
aeroforces (din cuvântul latin - Aerosilum), oxilii (din cuvântul latin - Oxylum) dioxid de siliciu, Dioxid de siliciu coloidal (USP), dioxid de siliciu coloidal anhidru (BP), silice (CAS nr. 7631-86-9) - dioxid de siliciu coloidal (Eur. anhidră silice amorfă, aparține grupului de umpluturi minerale foarte dispersate activ sintetice. În farmacie, Aerosil (dioxid de siliciu) este utilizat ca substanță auxiliară, stabilizator, agent de gelifiere, adsorbant, îmbunătățește fluiditatea tabletelor, unguentului, gelului și a altor amestecuri. Uneori, dioxidul de siliciu este utilizat ca ingredient activ farmacologic (are proprietăți antibacteriene, detoxifiant, sorbent).
Radiografiile sunt un standard pentru comitetele de legare pulmonară. Pneumoconioza este organizată în clinici de boli profesionale. Tratamentul simptomatic: manifestările clinice sunt absente în stadiile incipiente, așa că tratamentul simptomatic este utilizat la sfârșitul începutului, complex și include tratamentul cu antibiotice, bronhodilatatoare, GCS, spută fluidizată și expectorantă, expectorant, tuberculoză, diuretice, agenți inotropici și digitali, vasodilatatoare cu canal de calciu.
Prevenirea complicațiilor infecțioase: tratamentul chirurgical al infecțiilor respiratorii acute; Chimoprofilaxia TB este utilă pentru prevenirea tuberculozei și prevenirea recidivei la un pacient cu silicoză de imunizare a tuberculozei, gripei și polizaharidelor pneumococice.
obține dioxid de siliciu prin hidroliza vaporilor de tetraclorură de siliciu într-o flacără de hidrogen la o temperatură\u003e 1000 ° C (1100-1400 ° C). Produsul rezultat este pulbere albă, amorfă, neporoasă, pulverizată indiferentă, conține 99,3% Si02; are o dispersie mare (diametrul particulelor 4-40 microni, are o formă sferică sau aproape sferică), suprafața specifică de adsorbție este de 50-450 m2 / g; volumul în vrac este de aproximativ 50 g / l, densitatea - 2,36 g / cm3; pH-ul suspensiei apoase este de 4,0; indicele de refracție n20D = 1,46. Aerosil nu se dizolvă în apă, acizi și alcalii diluate. La o concentrație de Aerosil în apă într-o cantitate de 10-12%, se formează o suspensie fluidă cu viscozitate scăzută, la 17% - o masă semi-rigidă, la 20% - o masă grosieră care, atunci când este frecat, se transformă într-o masă omogenă cu unguent. Datorită afinității mari pentru apă, aerosilul este denumit substanțe hidrofilice. Dar dioxidul de siliciu (aerosil) marca R972 are proprietăți hidrofobe.
Alte măsuri benefice sunt vindecate, fumatul nu este recomandat, reducerea aportului de sare, o dietă bogată în proteine. Hunter Veche, București. Este în stare solidă și este una dintre cele mai abundente minerale de pe Pământ, care este componenta principală a nisipului. Silica poate exista în formă cristalină sau amorfă. Formele de dioxid de siliciu se răspândesc de obicei ca lava vulcanică. Formele cristaline de silice cu contracție cu forme amorfe au o rezistență mult mai scăzută la impurități.
Sunt mai multe mărci comerciale ale Aerosil (dioxid de siliciu)care diferă în principal de suprafața specifică, de gradul de hidrofilitate sau de hidrofobicitate, precum și de prezența altor substanțe de umplutură. Conform definiției comisiei pentru nomenclatură, dioxidul de siliciu amorf se numește oxid. În Ucraina, o uzină chimică și metalurgică autorizată de Degussa produce aerosil standard nemodificat de 175 de grade; 300 380 cu o suprafață hidrofilă; Metil Arosil AM-1/175 și AM-1/300, dimetildiclorosilan modificat; organosilicul eter al mărcilor ADEG-175 și ADEG-300, modificat cu etilenglicol și dietilenglicol și AM-2, modificat cu aminoalcooli. În Statele Unite se produce aerosil modificat - organosil și kebosil (Cabot), în Rusia, butosil, aerosil-K, care este o combinație de silice 85% și amidon 15%, aerosil COK-84, coagulant de silice 85% și 14% oxid de amoniu. În Germania, compania "Degussa" produce branduri hidratate de aerosoliconținând apă legată (durosil, vulcasin, sifloks, ultrasil etc.) care diferă în conținutul de SiO2, diametrul particulelor, densitatea și proprietățile), aerosil sub formă de suspensii (K-314, conține 14% A., K-328, 28% A.). În Japonia, microsilul este produs și purtat, în Franța - Francil, în Anglia - Manosil. Pentru produsele cosmetice pot fi făcute sub formă de pastă. Recent, aerosilul a fost introdus în farmacopeea diferitelor țări (Ungaria, Danemarca, Austria, etc.). În SUA, dioxidul de siliciu (aerosil) este de asemenea permis ca aditiv la produsele alimentare în cantitate de 2%.
Oxidul de siliciu organic și mineral apare în organismul uman în forma sa naturală și este conținut în cantități diferite în legume, plante și cereale crude. Are duritate ridicată. Adesea: forma amorfă a dioxidului de siliciu este dizolvată în alcalii. Aventurina - Rosiatik. Datorită impurităților: citrina este galbenă. Forma cristalină este o componentă foarte importantă a unei cantități foarte mari de minerale și pietre prețioase. 9 - Deoarece are un coeficient de expansiune termică scăzut. Este pură și albă sub formă de pulbere.
Este foarte rezistent la schimbările de temperatură și poate fi utilizat în părți care sunt expuse atât la cald, cât și la rece. În laboratoarele din sticlă de cuarț aproape indispensabile. Obiectele artei. Și pentru toate problemele de piele, aceasta este soluția potrivită. Producția de detergenți. Sau filtrați radiațiile ultraviolete. Importanța: Andy Silice sintetică este utilizat în fabricarea vopselelor. Silica acționează asupra tuturor proceselor inflamatorii. Ca un izolator electric.
aeroforces atribuită teoriei substanțelor "pure" care eliberează ingredientele active fără costuri energetice. Studiile microscopice electronice au arătat că fiecare particulă de aerosoli de bază constă din patru straturi separate (figura). Miezul acestei particule este un polimer tridimensional de elemente de SiO2. Având grupuri Silane Si-OH și siloxan Si-O-Si pe suprafața particulelor, Aerosil este capabil să creeze un cadru asemănător modelului datorat legăturilor de hidrogen, ceea ce permite limitarea expansiunii termice a lichidului gelatat. Grupările siloxan și silan în aerosil sunt funcționale, iar legătura silicon-oxigen este caracterizată prin rezistență ridicată (ajunge la 372,5 J / mol), ceea ce se explică prin polaritatea sa, datorită căruia legătura covalentă se apropie de legătura ionică.
Este, de asemenea, utilizat în industria cosmetică. lac. În metalurgie. Obținerea siliciului Dioxid de siliciu cu diferiți agenți reducători. Se obține astfel siliciu necurat. Reacția este foarte exotermă. Utilizează un cuptor electric cu electrozi de grafit. Siliciul rezultat este astfel rafinat sau triclor silanic. Siliciul brut sau ferosiliciul este transformat. Siliciul rezultat este dizolvat într-un exces de aluminiu topit contaminat cu siliciu de magneziu. Prin acest proces, impuritățile sunt colectate la un capăt al scoarței de silicon care trebuie tratată.
Tabel - Principalele proprietăți ale dioxidului de siliciu (Aerosil)
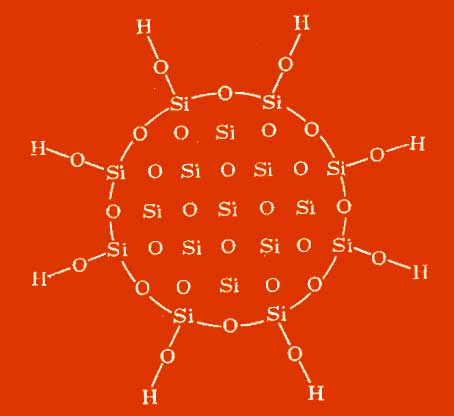
Figura. Structura rețelei spațiale a Aerosil în hidrogel
Grupurile silanolice sunt distribuite inegal. Există grupări de silan de suprafață care pot fi libere sau legate de punți de hidrogen și grupări silanol din moleculă, care pot fi interconectate și prin punți de hidrogen. Ca rezultat, se creează o structură vrac ramificată, rezultând că aerosilul este denumit polimer anorganic. Grupările siloxanice au proprietăți hidrofobe, sunt stabile (grupările OH silanol desprinse la o temperatură\u003e 300 ° C), provoacă o reacție acidă; au grupări hidroxil atât pe suprafață, cât și pe interior molecule de aerosil. Cu o distribuție uniformă, fiecare al doilea atom de siliciu are o grupă hidroxil la suprafață.
Electroliza apei se efectuează prin introducerea bazei în apă. Instalația utilizată pentru electroliză este numită electricianul Coleman. O instalație de electroliză a apei constă din: - electroliza în care are loc electroliza. - electroliții de grafit, care au nume speciale: electrod anodic sau pozitiv și electrod catodic sau negativ. După sfârșitul lanțului, este un acid sau un electrolit sau electrolizor. - bună soluție conductivă electrică. Nu trece prin apă pură, alcaline sau sare, dar nu participă la reacție.
În fabricarea sticlei se utilizează dioxid de siliciu. Chiar și oxigenul este produs la anod. Electroliza este proprietatea anumitor substanțe care se descompun prin intermediul unui curent electric care acționează ca un catalizator. Dar cu mult înainte de apariție. Cercetătorii au reușit să recupereze datele. Descoperirea oxigenului: oxigenul a fost descoperit de Karl Wilhelm Scheele și Joseph Priestley. Obținerea probelor de oxigen primar poate ajuta cercetătorii să determine modul în care organismele celeste au evoluat în moduri diferite. Oxigenul-17 și oxigenul - după ce capsula ființei sa prăbușit în deșertul Utah.
Acest lucru cauzează trei tipuri de interacțiuni aerosoli: adsorbția fizică, adsorbția chimică (formarea punților de hidrogen prin grupări silanol cu apă, alcooli, acizi și alte substanțe) și reacții chimice pe suprafața moleculei. Astfel, grupările silanol interacționează cu alcoolii pentru a forma eteri.
Aerosil (dioxid de siliciu) are proprietăți bune de sorbție, absoarbe între 15 și 60% din diferite lichide în funcție de natura lor, fără a schimba aspectul și fluiditatea pulberii. Primul strat de apă este absorbit de aerosoli datorită creării de poduri de hidrogen (adsorbție chimică), iar straturile ulterioare se datorează adsorbției fizice. Apa absorbită fizic este eliberată la o temperatură de 25-150 ° C, în timp ce apa adsorbită chimic este eliberată la 800 ° C.
Astfel, cuvântul "oxigen" înseamnă un producător de acizi. Descoperirea este foarte importantă pentru a restabili evoluția corpurilor cerești în vecinătatea Pământului. Dar cauza modificărilor în diferite părți ale sistemului solar nu este cunoscută. Becher dezvăluie că silicele conține pământ nou și apoi siliciu. Numele sugerat de Lavoisier vine din greșeala marelui chimist care credea că toți acizii conțin oxigen. Antoine Lavoisier dă aerului purificat un nou nume. El a detectat prezența gazului. Proprietăți chimice: Ricky 6 miliarde de ani.
În anul, independent unul de celălalt. H. considerat pierdut. Colectarea probelor de oxigen din periferia sistemului nostru solar. Luna și meteoriții au trei izotopi diferiți. De la începutul civilizației umane, silicatele au fost folosite în ceramică. Focalizarea cu lentilele solare. Silica este practic insolubilă în apă sau acizi, cu excepția reacției acidului fluorhidric, în care este eliberată tetrafluorura de siliciu cu formula. În particular, forma amorfă a dioxidului de siliciu este solubilă în alcalii.
Aerosil, care este utilizat pentru producerea de medicamente, trebuie să aibă o puritate ridicată. Tabelul 1 prezintă compoziția chimică a diferitelor mărci comerciale ale aerosilului, care pot avea anumite impurități formate în timpul proceselor de producție, de exemplu, urme de acid clorhidric, care determină un pH de 4% dintr-o suspensie apoasă a polimerului (3,6-4,3). Deci, Aerosil (silice) se comportă ca un acid slab.
Formează aer numai la temperaturi extrem de ridicate. Silicul este acoperit cu un strat protector. La temperatura normală, siliciul nu reacționează cu aerul. Formarea silicatului de sodiu. Silicul este în iarbă. Cu alte cuvinte, să fiu informat în mod corespunzător, nu doar informat.
Poate că ar fi mai ușor să înțelegem să începem, ce fel de material de construcție. Iată rezultatele cercetării aici. Să le găsim împreună. Suntem în mijlocul verii, așa că dorim ca zilele fierbinți să fie mai ușor de suportat. Răcire simplă și gratuită cu aer intern.
Tabelul 1 - Compoziția chimică a diferitelor tipuri de aerosoli (în termeni de substanță uscată, conform MM Astrakhanov)
| Conținut,% | Marca Aerosil, compoziția,% | ||||
| 200; 300; 380 | 0 | SOK84 | R972 | combinate | |
| SiO2 | >99,87 | >99,8 | 82–86 | >98,3 | 85 |
| Al2O2 | 14–18 | – | |||
| Fe2O3 | – | ||||
| TiO2 | – | 0,03 | – | ||
| Na2O | – | – | – | – | |
| ca | – | – | – | – | |
| B2O3 | – | – | – | – | |
| Bi2O3 | – | – | – | – | |
| P2O5 | – | – | – | – | |
| HCI | – | 0,05 | |||
| amidon | – | – | – | – | – |
Tabelul 2 prezintă cele mai importante proprietăți fizico-chimice ale diferitelor mărci de aerosolicare sunt utilizate pe scară largă în fabricarea medicamentelor
Sperăm că toate informațiile de mai sus vor fi utile atunci când vă decideți să construiți o casă și veți fi în curs de alegere a materialelor. Ceea ce este interesant în acest caz este că acest efect de dezinfectare este cauzat și chiar datat de bacterii. Diagrama arată efectul auto-dezinfectant al nanoparticulelor de argint și al fosfatului de calciu depus pe un film de plastic.
Din acest motiv, familiile bogate au folosit tacâmuri de argint de argint cu efect anti-bacterian, iar lumea mai săracă a folosit o metodă de introducere a monedelor de argint într-un bol de lapte. Timp de două secole, argintul a fost folosit în medicină înainte ca antibioticele să își ia locul și de mult timp au fost utilizate numai în medicina alternativă. De la începutul erei nanotehnologiei, acest metal prețios se confruntă cu o adevărată renaștere în medicină. Echipamentele medicale și protezele, mobilierul spitalicesc sau chiar mobilierul spitalicesc sunt îmbrăcați, înfășurate sau îmbogățite cu ele.
Tabelul 2. Proprietățile fizice și chimice ale diferitelor mărci de aerosoli
| indicator | Timbre de aerosoli | |||||
| 200 | 300 | 380 | 0 | SOK-84 | R-972 | |
| Suprafață specifică, m2 / g | 200 ± 25 | 300 ± 30 | 380 ± 30 | 200 ± 25 | 170 ± 30 | 120 ± 30 |
| Pierderi în timpul aprinderii,% | 1 | 2 | 2,5 | 1 | 1 | 2 |
| Dimensiunea medie a particulelor | 12 | 7 | 7 | 12 | – | 16 |
| Conținutul de umiditate,% (uscat la 105 ° C) | – | 1,5 | 1,5 | 1,5 | 0,5 | 2,5 |
| Greutate saturată, g / l, presată standard (ne-presată) | ≈60≈120 | |||||
| porozitate | poros | neporos | ||||
| pH 4% apă dispersie | 3,6–4,3 | – | – | 3,6–4,3 3,5-4,1 (în metanol) |
||
fabricarea de medicamente Aerosil utilizat ca stabilizator pentru garniturile de ulei de suspensie. Are o abilitate ridicată de a adsorbi diverse lichide. Adăugarea aerosilului la compoziția uleiului și a alcoolului de apă-alcool-glicerol sporește sedimentarea, agregarea și stabilitatea agregată a acestor sisteme, creând o structură spațială suficient de puternică capabilă să rețină faza lichidă imobilizată cu particule suspendate de substanțe farmaceutice în celule. În suspensiile apoase și alcoolice apoase, efectul stabilizator al aerosilului se datorează în principal forțelor electrostatice. Sedimentarea particulelor din faza solidă în suspensii apoase-alcoolice stabilizate are loc de 3 ori mai lent decât în sistemele instabile. Efectul stabilizator al Aerosil crește în prezența unei cantități mici de surfactant, de exemplu, Tween-80. Prezența aerosilului (într-o concentrație de 1,0-5,0%) în emulsii și suspensii crește stabilitatea lor, capacitatea de fixare mai bună pe piele și eficiența acțiunii terapeutice. Cu apă și alcool dioxid de siliciu la o concentrație de 3% creează suspensii tulbure, ale căror acțiuni au o taxă negativă.
Suportul de alimentare activează mecanismul. La momentul acestei comunicări științifice, era imposibil să se folosească un metal nobil punctual și dozat. Factorul crucial este ca bacteriile folosesc calciu pentru a-si sustine metabolismul. Particulele de fosfat de calciu în intervalul 20-50 nanometri sunt absorbite de microorganisme ca alimente și, prin urmare, se descompun. În acest proces, sunt emise mii de particule mici de argint de la 1 la 2 nanometri, care au fost aplicate de cercetători pe bază de nutrienți de calciu.
Din câte știm, nanoparticulele de argint acționează diferit asupra bacteriilor: acestea împiedică transferul de nutrienți în celulă, atacă membrana celulară și perturba diviziunea celulară și, implicit, germinarea. Testele care utilizează fosfat de calciu și dioxid de siliciu, fiecare dintre acestea acoperit cu argint, au prezentat diferite efecte asupra diferitelor tulpini de bacterii în cadrul testelor. Suportul fosfatului de calciu a dat până la 1000 de ori mai intens decât silicea. Întrucât consumul de fosfat de calciu, potrivit cercetătorilor, a hrănit și bacteriile - fără a crește cantitatea de argint în decurs de 24 de ore cu un factor de o mie - argintul ar trebui să lupte nu numai cu bacteriile existente, ci și cu New Formed. "Acesta este motivul pentru care efectul este cu atât mai izbitoare", spune Wendelin Stark.
Una dintre proprietățile lui Aerosil este capacitatea sa de îngroșare (îngroșător) (tabelul 3).
Tabelul 3. Efectul de îngroșare al Aerosil-200
Această proprietate este utilizată pentru a obține geluri conținând aerosoli și baze de unguent, care includ aerosil. Ca fază lichidă pentru compozițiile lor, se utilizează un lichid de polietilsiloxan sub denumirea Esilon-5 sau Esilon-4, ulei de pește, PEG-400, ulei de ricin, uleiuri grase și altele asemenea. Esilon-5 a îngroșat 16% din Aerosil cunoscut sub numele de vaselină KV-E / 16, nu irită pielea și nu împiedică absorbția substanțelor active. Ca o fază lichidă de îngroșare este utilizată aerosil (dioxid de siliciu) în valoare de 8-16%. Gelurile rezultate au o consistență de plastic moale, sunt bine distribuite și fixate pe piele. Aceștia au o stabilitate coloidală bună la temperaturi ridicate (≥40 ° C), păstrează consistența necesară, care nu se modifică chiar la 100 ° C și, prin urmare, gelurile și unguentele care conțin aerosoli pot fi utilizate în climatul tropical. Conform proprietăților structurale și mecanice ale gelurilor, care includ aerosil, constituie sisteme termostabile din plastic tixotrop și prezintă rezistență antimicrobiană. Conținutul cantitativ al Aerosil în sistem afectează proprietățile reologice și biofarmaceutice ale gelurilor. Creșterea dioxidului de siliciu în compoziția gelurilor conduce la o creștere a viscozității lor plastice și a proprietăților tixotropice, în timp ce în mod semnificativ se încetinește eliberarea ingredientului farmacologic activ.
Datorită unui nou produs, grupul condus de domnul Starck a reușit să dezvolte un medicament eficace împotriva unui număr de bacterii patogene active în dozele potrivite și corecte numai dacă există o bacterie. Fosfatul de calciu, care este oxidat de fosfat de calciu, va fi eliberat numai într-o cantitate adecvată, pe care bacteria o consumă din fosfatul de calciu. Această metodă economisește costurile, arată eficiența și este mai puțin exigentă pentru corpul uman. Filmul poate fi folosit, de exemplu, în spitale, în puncte non-violete din punctul de vedere al transferului embrionului.
Utilizarea aerosilului (dioxid de siliciu) în industria farmaceutică medicală și veterinară
Aerosil se utilizează la fabricarea tabletelor. într-o concentrație de 0,1-0,5% ca substanță de alunecare și degresare (0,1-2,0%), care reduce timpul de dezintegrare, facilitează procesul de granulare, îmbunătățește fluiditatea masei tabletei. Proprietățile de adsorbție ale Aerosil sunt utilizate în producția de pulberi, extracte și alte preparate farmaceutice.
O ușă, un pat sau o încăpere sanitară în care este atașată o peliculă auto dezinfectantă poate ajuta pacienții cu microbi patogeni teribili și periculoși în spitale, ceea ce poate duce la complicații ale intervenției operatorului. Ele trebuie înlocuite la intervale regulate, deoarece bacteriile consumă calciu și, prin urmare, folia nu are un efect nelimitat.
Cele mai multe instrumente de evaluare a vulnerabilității iau pur și simplu scanerele de rețea actuale și indică o infrastructură wireless. Această abordare nu vă oferă informații care sunt unice pentru rețelele fără fir. În plus, în timp ce scanerele tradiționale pot enumera vulnerabilitățile unei anumite destinații, ei nu pot evalua dacă un dispozitiv de înmuiere este instalat pe țintă sau în mediu.
Numeroase studii farmacologice, toxicologice și biofarmaceutice au confirmat că, atunci când sunt utilizate pe plan intern, aerosilul este indiferent, bine tolerat de către pacienți, are proprietăți de vindecare pentru afecțiunile tractului gastro-intestinal și alte procese inflamatorii și poate fi o sursă de aprovizionare cu siliciu în organism. Există dovezi că aerosil (dioxid de siliciu) poate contribui la reducerea mușchilor netezi și a vaselor de sânge și, de asemenea, are proprietăți antibacteriene.
Sistemele farmaceutice care conțin aerosil nu prezintă efecte iritante și toxice. Aceleași proprietăți sunt inerente la unguente atunci când se utilizează epsilon și aerosil ca bază (compoziția epsilon-5, îngroșată cu aerosil 15% în fabricarea de unguente cu antibiotice și corticosteroizi). Unguente cu Aerosil (silice) ușor stoarse din tuburi, bine fixate pe piele, au un efect prelungit.
literatură
Zhoglo F., Wozniak V., Popovich V., Bogdan J. Substanțe auxiliare și utilizarea lor în tehnologia formelor medicinale. - Lviv, 1996; Pertsev I.M., Kotenko A.M., Chueshov A.V., Khaleeva E.L. Aspectele farmaceutice și biologice ale unguentelor: monografie. - H., 2003; Pechkovskaya K.A. Umplerea cauciucului. În cartea: Enciclopedia de polimeri. În 3 tone - M., 1974.
