Կալցիումի եւ մագնեզիումի միացություններ
Այնպես որ, երեկ որոշել է, թե որքան կալցիում կա մանրացված ձվաբջիջում, հարց է առաջացել, «խմել կամ խմել»: Մարդկանց մեծամասնության նման ես գիտական տեսանկյունից ամեն ինչ եմ արել եւ մինչեւ որ ես տեսնում եմ այն, պարզեմ, ստուգեք, զգացեք մի կնոջ համար: Հետեւաբար, իմ մտքերը կիսում եմ ձվաբջջի եւ կալցիումի մասին տեղեկությունների հիման վրա:
Ինտերնետում հավաքագրված տեղեկությունները, որ ձվի շերտը որպես սննդի հավելում ավելի քան մեկ անգամ բժիշկների քննադատական նկատառումներն են, այն է, որ ձվաբջիջում պարունակվող կալցիումի կարբոնատը ջրի մեջ անլուծելի է, ուստի չի կարող ներծծվել մարմնի կողմից:
Ավելին, իմ ընկերուհու ամուսնու պատմությունը հիշեցրեց, որ հղիության ընթացքում նա պատմում է իր բժշկին, ով նկատել էր, որ նա ընկնում է ձվի կեղեւը, բժիշկը խեղաթյուրում է եւ որոշակի կալցիում պարունակող համալիր է սահմանել:
Որտեղ է ճշմարտությունը:
Իրոք, CaCO3- ի կալցիումի կարբոնատը (այս տեսակի մեջ, կալցիումի մեջ է ձվաբջիջներում) անլուծելի է ջրի եւ ալկոհոլի մեջ:
Կալցիումի կլանման համար իսկապես անհրաժեշտ նախապայման է նրա ջրային լուծույթը:
Բայց հիշեք, որ մեր մարսողության հիմքը ստամոքսի մեջ արտածված հիդրոքլորային թթու է:
Եվ դա այն է, ինչ տեղի է ունենում մեր ստամոքսում:
СaCO3 + 2HCl (hydrochloric acid) = СаCl2 (կալցիումի քլորիդ) + Co2 + H20
Սակայն կալցիումի քլորիդը հիանալի լուծելի է ջրի մեջ: Այս ձեւն է, որ կալցիումը կլանված է:
Չգիտեք բժիշկները: Կամ նրանք պարզապես խորամանկ են եւ վաճառում մեզ դեղամիջոցներ:
Ընդ որում, այս ռեակցիայի ժամանակ տեղի է ունենում ստամոքսի թթվայնության նվազում: Ինչ կարեւոր է բարձր թթվայնության տառապող մարդկանց համար:
Օրինակ `իմ կինը, նա բարձր թթվայնություն ունի, եւ ամեն օր մի քիչ մանրացված ձվաբջի է առնում, եւ դա միանգամից լուծում է երկու խնդիրը եւ փոխհատուցում է կալցիումի բացակայությունը եւ նվազեցնում է թթվայնությունը: Բայց ձվի կրող փոշիները մարեցին կիտրոնի հյութ չի կարող խմել, կա սրտխառնոց: Եվ հիմա հասկանում եմ, թե ինչու:
Ինչպես տեսանք վերը, կալցիումի կլանումը կալցիումի կարբոնատից պահանջում է բարձր թթվայնության ստամոքսային հյութ:
Իրական կյանքում շատ հաճախ իրավիճակ է առաջանում, երբ ստամոքսի թթվությունը ցածր է կամ զրո: Այս իրավիճակը հատկապես բնորոշ է տարեց մարդկանց, երբ կալցիումի անհրաժեշտությունը հատկապես բարձր է, կանխելու օստեոպորոզը: Օրինակ, 50 տարվա ընթացքում ցածր թթվայնությունը տեղի է ունենում մարդկանց մոտ 40% -ով: Այս պայմաններում կալցիումի կարբոնատի կլանումը, որը պահանջում է հանքային քլորիդ թթվին ստամոքսում լուծելու համար, կաթված է մինչեւ 2%:
Թերեւս սա է պատճառը, թե ինչու ավելի տարեց մարդիկ ավելի հավանական է տառապում կալցիումի բացակայության հետ կապված հիվանդություններից, նրանք պարզապես չեն կարողանում սովորական ձեւով օսմանացնել:
Այժմ մտածեք, թե ինչու են մանրացված ձվաբջջի ստանալու համար շատ բաղադրատոմսեր առաջարկվում է կիտրոնի հյութով լվանալ:
Երբ մենք կիտրոնի թթու կիտրոնի հյութ ենք լցնում, կալցիումի կարբոնատը (CaCo3) արձագանքում է կիտրոնաթթվի (C6H8O7) եւ մենք ստանում ենք կալցիումի ցիտրատ (Ca3 (C6H5O7) 2):
2C6H8O7 + 3CaCO3 = Ca3 (C6H5O7) 2 + 3CO2 + 3H2O
Այստեղ է: Իսկ կալցիումի ցիտրատի կլանումը, որը չի պահանջում ստամոքսի հիդրոքլորային թթու, կազմում է 44%: Արդյունքում, ցածր թթվայնության պայմաններում, կալցիումի ցիտրատը մտնում է մարմինը 11 անգամ ավելի շատ կալցիում, քան կարբոնատից:
Իսկ կալցիումի ցիտրատը արդեն հայտնի դեղ է, որը վաճառվում է մեզ փողի համար: Եվ դա անում են, միայն նրանք օգտագործում են ոչ թե կիտրոնի հյութ, այլ կիտրոնաթթու:
Ի դեպ, կալցիումի կարբոնատը (մեր shredded ձվաբջիջը) գրանցված սննդային հավելումը: E170, իսկ կալցիումի ցիտրատը (կիտրոնի հյութով լցված մեր փաթաթված ձվաբջջը) գրանցված սննդային հավելումը: E333!! Եվ դրանք ավելացվում են բազմաթիվ սննդամթերքի, հատկապես կաթնամթերքի, այդ թվում `կաթը, կալցիումի տոկոսը բարձրացնելու համար:
Ուրեմն ինչու ավելի շատ վճարեք:
Եզրակացություն, եթե դուք ունեք բարձր թթվայնություն, հավանաբար ավելի լավ է օգտագործել միայն shredded ձվի խցիկները, եթե թթվայնությունը ցածր է, հավանաբար ավելի լավ է ջնջել ձվի ընկույզի փոշու կիտրոնի հյութով:
Եվ ավելին,
Գիշերը, օրգանիզմից հանքային աղերի արագացված արձակումը (ոսկրային ռեորստրիվ պրոցեսների շրջանառության արագացում) կա: Հետեւաբար կալցիումի պատրաստուկները պետք է ընդունվեն ճաշից հետո եւ երեկոյան:Դա կխոչընդոտի գիշերվա երկրորդ կեսին կալցիումի արագացված կորուստը, հատկապես աղի մեջ նվազեցված մակարդակի (կամ բացակայության) դեպքում: Նշվում է նաեւ կալցիումի ֆարմակոթերապեւտիկ գործունեության բացասական դոզային կախվածությունը. ցածր դոզաներում այս biometall- ը կլանում է ավելի լավ, քան բարձր.
Այս կապակցությամբ օրվա ընթացքում մի քանի անգամ թմրանյութ ընդունելու ավելի ռացիոնալ:
Կարդում ենք, քննարկում ենք: Ստորեւ բերված են մի քանի հոդվածներ այս թեմայի վերաբերյալ:
__________________________________________________________________________________________________________
Կալցիումի ցիտրատն ընդդեմ կալցիումի կարբոնատի
Աղբյուրը< http://www.ortho.ru/77_KMD/Ca_Sravni.htm >
_________________________________________________________________________________________________________
Կալցիումի ցիտրատ:
Կալցիումի ցիտրատը կլանված կալցիումի հիանալի աղբյուր է, որը մարմնում շատ կարեւոր դեր է կատարում, քանի որ այն ազդում է շատ ֆերմենտային պրոցեսների եւ արյան հյուսվածքի վրա: Կալցիումի անբավարարությունը հանգեցնում է ոսկրային ֆրածուցիայի եւ օստեոպորոզի: Երեխաների համար լավ է ստոմատոլոգիական առողջության համար, մեծահասակները պետք է կանոնավոր կալցիումի ընդունում `արյան ճնշման կայունացման համար:
Ըստ ԱՄՆ-ի Ազգային քաղցկեղի ինստիտուտի, E-333 հավելվածը կարող է կանխարգելել քաղցկեղի քաղցկեղը եւ այլ քաղցկեղերը: Բացի այդ, կալցիումի ցիտրատները բժշկության մեջ օգտագործվում են մարմնի ծանր մետաղները հեռացնելու համար:
Քանի որ կալցիումի ցիտրատը մարդու օրգանիզմում կալցիումի կարեւորագույն տրանսպորտային ձեւերից մեկն է, այն օգտագործվում է բժշկության մեջ `կալցիումի կարբոնատով (E-170 հավելում) եւ մարմնի մեջ կալցիումի պաշարների ավելացման համար: Նույն պատճառով էլ կալցիումի ցիտրատը օգտագործվում է դիետիկ հավելումների տեսքով (դիետիկ հավելումներ):
Սննդի արդյունաբերության մեջ E-333 հավելումը օգտագործվում է որպես կայունացուցիչ, կոնսերվանտ, թթվայնության կարգավորիչ, գունային ամրացնող:
Որպես կայունացուցիչ, E-333 սննդային հավելումը օգտագործվում է խտացրած կաթի, կրեմի, սերուցքի պանրի արտադրության մեջ: Ջեմերում, ժելե եւ պահածոյացված միրգ, E-333 հավելույթն օգտագործվում է որպես թթվայնության կարգավորիչ: Կալցիումի ցիտրատները նույնպես լայնորեն օգտագործվում են կաթի եւ կաթնամթերքի կալցիումի, հացաբուլկեղենի եւ ալյուրի եւ ալկոհոլային խմիչքների հարստացման համար:
Արտաքին տեսքով, կալցիումի ցիտրատը սպիտակ փոշի է, որն արտահայտված է թթու համով: Ջրի մեջ լվանալ: Կալցիումի ցիտրատի մոլեկուլյար բանաձեւը `Ca3 (C6H5O7) 2: Ստացեք E-333 կիտրոնաթթվի փոխազդեցությունը կալցիումի հիդրոքսիդով:
Հատկություններ եւ տեխնոլոգիական գործառույթներ.
Սննդային հավելումների հնարավոր անունները.
- E-333
- E-333
- Կալցիումի ցիտրատ
- Կալցիումի ցիտրատներ
- Մոնոկալցիումի ցիտրատ
- Dicalcium ցիտրատը
- Tricalcium citrate
_____________________________________________________________________________________________
Կալցիումի ցիտրատ
Քսաներորդ դարի կեսերին: սկսվել է բիոքիմիկոսներ, ֆիզիոլոգներ, կենսաֆիզիկոսներ, դեղագետներ եւ կլինիկաներ, որոնք սկսեցին ավելի մեծ հետաքրքրություն ցուցաբերել օրգանների եւ մարմնի համակարգերի գործունեությունը կարգավորող կալցիումի դերի ուսումնասիրման համար: Կալցիումի իոնները հայտնաբերվել են մկանային բջիջների շարժման եւ ներթափանցման, բջջային թաղանթների թափանցելիության կարգավորման, միջերկրային փոխազդեցությունների, արյան կոագուլյացիայի, հորմոնալ սեկրեցության, միջնորդների, էնզիմների, իրականացնում է բջջային մտնող ազդանշանային փոխարկիչի գործառույթը, մասնակցում է միջուկային նյութափոխանակության կարգավորման գործընթացներին, ներառյալ էներգիան: Cardiomyocytes- ի մեմբրանի մակերեւույթում եւ ազատ կալցիումի իոնների անոթները 1000 անգամ ավելի են, քան բջիջների ցիտոսոլում: Արտազատվող տարածությունից նրանք ներթափանցում են ցիտոպլազմին հատուկ կալցիումային ալիքների միջոցով `ազդելով տարբեր ֆիզիոլոգիական պրոցեսների եւ գործառույթների բոլոր օրգանների բջիջների, անոթային տոնով, սիստոլի ինտենսիվության, դիաստոլի վրա:
Կալցիումը կարեւոր դեր է խաղում ոսկրային հյուսվածքի ձեւավորման եւ նորմալ կառուցվածքի եւ ֆունկցիայի պահպանման գործում: Հատուկ սպիտակուցների հետ միասին, կալցիումի иոնները ապահովում են ոսկրային կարծրություն եւ առաձգականություն:
Այս ամենը ծառայել է որպես տեսական հիմք `դրա աղերի հիման վրա կալցիումի պատրաստուկների մշակման եւ ներդրման համար, բժշկական պրակտիկայում: Ներկայումս բժշկական պրակտիկայում օգտագործվում են այնպիսի կալցիումի աղեր, ինչպիսիք են գլիցերիֆոսֆատը, գլյուկոնատը, կարբոնատը, լակտատը, ցիտրատը, քլորիդը, ֆոսֆատը եւ այլն:
CALCIUM CITRATE դեղորայքի դեղաչափը ունի իր առանձնահատկությունները: Կալցիումը կլանում է աղիից լուծվող, իոնացված ձեւով: Դեղերի լուծարումը ավելի լավ է տեղի ունենում ստամոքսի թթվային միջավայրում: Լուծվող իոնացված կալցիումը լավ է ներթափանցում բոլոր հյուսվածքների մեջ, թափանցում է պլանտենցի արգելքը, անցնում է կրծքի կաթ: Ենթադրվում է հիմնականում փխրուն, մոտ 20% -ը `մեզով: Կալցիումի ցիտրատի կարեւոր առանձնահատկությունը երիկամների քարերի ձեւավորման ցածր կարողությունն է, որը կարեւոր է այս աղի երկարատեւ օգտագործմամբ: Դա պայմանավորված է այն հանգամանքով, որ ցիտրատի աղը նվազեցնում է մեզի մեջ օքսալատի քանակությունը:
Կենսունակությունը որոշվում է արագությամբ եւ չափով ակտիվ բաղադրիչ կլանված դեղաչափի ձեւից, այն դառնում է մատչելի թերապեւտիկ գործողությունների վայրում:
Գիշերը, օրգանիզմից հանքային աղերի արագացված արձակումը (ոսկրային ռեորստրիվ պրոցեսների շրջանառության արագացում) կա: Հետեւաբար, կալցիումի պատրաստուկները պետք է ընդունվեն ճաշից հետո եւ երեկոյան, ինչը թույլ չի տա գիշերվա երկրորդ կեսին կալցիումի արագացված կորուստը, հատկապես աղի մեջ կրճատված մակարդակի (կամ բացակայության) դեպքում: Նշվում է կալցիումի ֆարմակոթերապեւտիկ գործունեության բացասական դոզա-կախյալ ազդեցությունը. Այս բիոմետալը ավելի լավ է կլանում ավելի ցածր դոզաներում, քան բարձր դոզաներում: Այս առումով, օրվա ընթացքում մի քանի անգամ թմրամիջոցներ կիրառելը ավելի ռացիոնալ է: Տարբեր տարիքային խմբերի համար կան կալցիումի ընդունման տարբեր ֆիզիոլոգիական նորմեր (աղյուսակ):
Աղյուսակ
Կալցիումի ընդունման առաջարկվող մակարդակը տարբեր տարիքի մարդկանց մեջ
(ըստ Կանադայի հասարակության osteoporosis)
Վիտամին D, հիդրոքլորային թթու, լակտոզա, կիտրոնաթթու, սննդի, ֆոսֆորի, մագնեզիումի, ինչպես նաեւ կարագի, ձվի, կաթի, ձկների, կոդի, կաղամբի եւ այլն որոշ սննդամթերքներ, նպաստում են կալցիումի իոնների կլանմանը:
Կալցիումի կլանումը վատթարանում է. Սննդամթերքի սպիտակուցի պակասը, բուսակերների դիետայի խստիվ պահպանումը, մագնեզիումի բացակայությունը, ֆոսֆորը, ոսկրային թթուով հարուստ սննդամթերքը (փխրուն, խավարածին, սպանախ):
Կալցիումի կլանումը դանդաղեցնում է մարսողական օրգանների հիվանդությունների (գաստրիտ, մոլեկուլ, կոլիտ, պեպտիկ խոց), ենթաստամոքսային գեղձի հիվանդությունների (շաքարախտ, պանկրիտիտ), այլ էնդոկրին օրգանների պաթոլոգիաներում:
Պետք է ընդգծել, որ որոշ դեղամիջոցներ, մասնավորապես գլյուկոկորտիկոիդները, համակարգային օգտագործման համար հորմոնալ հակաբեղմնավորիչ դեղերը, լեվոթյոզինը նաեւ կլանում են կալցիումի իոնների կլանումը:
Գիտական հետազոտությունների արդյունքների համաձայն (Կանադայի հասարակության osteoporosis- ի տվյալները) չկան համոզիչ վկայություններ, որոնց հիման վրա osteoporosis- ի կանխարգելման կամ բուժման համար կարող են առաջարկվել այլ հանքանյութերի լրացուցիչ սպառումը (մագնեզիում, ցինկ, պղինձ եւ այլն):
Ուկրաինայում եւ այլ երկրներում կատարված կլինիկական հետազոտությունների արդյունքները հաստատվել են այս դեղի բարձր արդյունավետությունը `բազմաթիվ հիվանդությունների բուժման մեջ: Կալցիումի ցիտրատը նույնպես օգտագործվում է տարբեր հիվանդությունների կանխարգելիչ նպատակով:
Օստեոպորոզով տարեց մարդկանց, osteomalacia CALCIUM CITRATE- ը սահմանվում է օրական 2-6 հաբեր, բաժանելով օրական դոզան `3-4 դոզան: Դեղը տեւում է ճաշից առաջ, կամ ճաշից հետո 1-1,5 ժամ հետո, 3 ամսվա ընթացքում: Նման հիվանդներին պետք է նաեւ օրվա ընթացքում 400-800 ՄԻ-ի վիտամին D3 սահմանելը, ինչպես նաեւ դիետայում ներառում նավթը, կաթը, ձուկը եւ ձվերը:
CALCIUM CITRATE- ը կալցիումի օպտիմալ դոզային ձեւն է ոչ միայն մեծահասակների, այլեւ երեխաների համար, ինչպես նաեւ դեռահասների համար, քանի որ այն օգնում է բարձրացնել ոսկրային հանքային խտությունը, բարձրացնել ոսկրային զանգվածը, ամրացնել դենտինը եւ ատամնափառը: 6 ամսվա երեխաները սահմանվում են 1/2 դեղահատ (250 մգ) (մանրացված, լուծված փոքր կաթով), 6-12 ամիս տարիքում `օրական 1 անգամ 2 անգամ, 1 տարեկանում` 10 տարի - 1-2 դեղահատ, 10-18 տարեկան - օրական 2-3 պլաստիկ:
Կալցիումի ցիտրատի նշանակման ցուցանիշներն են `
տարբեր ծագման արյունահոսության հետեւանքով, ինչպես նաեւ հղիության եւ լակտացիայի ժամանակ վնասվածքների պատճառով հիպոկալցիա `ավելացնելու մարմնի կալցիումի իոնների կարիքը.
երիկամների եւ աղիքների միջոցով կալցիումի ներթափանցման մակարդակի բարձրացում եւ մարսողական համակարգի խանգարումների ժամանակ կալցիումի կլանման խախտում.
հիպոպարատիրոիզմը, տարբեր ծագման օրգանիզմի ջրազրկելը, ալերգիկ հիվանդությունները եւ ալերգիկ բարդությունները, դեղորայք ընդունելով, ավելցուկային պատի թափանցելիության բարձրացում, արյան հյուսվածքի նվազում:
CALCIUM CITRATE- ը պետք է սահմանվի, երբ ընդունում են գլյուկոկորտիկոիդներ, բանավոր հակաբեղմնավորիչներ, լեվիտրոռին: Վերջին երեք դեպքերում, դեղամիջոցը օրվա ընթացքում ստացվում է 1 դեղահատ 6 անգամ:
Կալցիումի ցիտրատը, որպես կանոն, լավ տհաճ է, երբեմն դիսպեպտիկ ախտանիշներ (փորկապություն կամ փորլուծություն, սրտխառնոց, փսխում, ախորժակի կորուստ, որովայնի ցավ), կարող են առաջանալ պոլիուրիան:
CALCIUM CITRATE- ի միաժամանակյա օգտագործումը ալկոհոլի պարունակությունը antasids- ի հետ խորհուրդ չի տրվում `դրանց արդյունավետության նվազման պատճառով: Անհրաժեշտ է միաժամանակ այլ կալցիումի պատրաստուկների հետ միասին որոշել:
Վերջում կարելի է նշել CALCIUM CITRATE- ի դրական դեղաբանական հատկությունները.
ցիտրատ կալցիումի աղը լավ լուծարված է եւ ներծծվում է մարսողական համակարգի մեջ, ինչը հանգեցնում է մարմնի կալցիումի լավ կլանմանը եւ, համապատասխանաբար, դեղերի արդյունավետությունը իր պրոֆիլակտիկ կամ թերապեւտիկ կիրառումըինչը հաստատվում է բազմաթիվ կլինիկական հետազոտությունների արդյունքներով:
Քաղցկեղի քաղցկեղի առաջացման ռիսկը երիկամներում թմրամիջոցների ներթափանցման ժամանակ մեծացնում է կալցիումի սուլֆատի արժեքը երկարատեւ օգտագործման համար:
Ի.Ս. Չեքմանը, դեղագործության ֆակուլտետի ղեկավարը, Ազգային բժշկական համալսարանի կլինիկական ֆարմակոլոգիայի դասընթացը, Գիտությունների ազգային ակադեմիայի թղթակից անդամ եւ Ուկրաինայի բժշկական գիտությունների ակադեմիա, գիտության եւ տեխնոլոգիայի վաստակավոր գործիչ, պրոֆեսոր
Էջ 1
Կարբոնատների հետ թթուների արձագանքը կարող է օգտագործվել որպես կարբոնատների նմուշ: Կարբոնատը շատ թույլ եւ անկայուն թթու է: Այն կարող է սեղմվել իր աղերից `պակաս տատանվող եւ ուժեղ թթուների գործողությամբ:
Նմանապես, կալցիումի կարբոնատի թթուների հետ կապված ռեակցիաները շարունակվում են:
Կարբոնատի հիդրոքլորիդային թթվի արձագանքը տալիս է կալցիումի քլորիդ եւ մագնեզիումի քլորիդ, որը ջրի մեջ լուծվում է եւ շարունակում է մնալ տարբեր կոնցենտրացիաների լուծման ձեւ: Այս տեսակի կոլեկտորների ռեակցիայի արագությունը կախված է հիմնականում ճնշման եւ ջերմաստիճանի վրա:
Կարծրացրած կարբոնատի ռեակցիայի արդյունքում հիդրոկլորիդով կալցիումի քլորիդ եւ մագնեզիում, լավ լուծվող ջրի մեջ եւ մնացին տարբեր կոնցենտրացիաների լուծման ձեւով:
Ոչ-չորացրած նատրիումի կարբոնատի ներմուծումը ռեակցիայի մեջ պահանջում է ավելի բարձր ճնշում եւ կատալիզատորի քանակի ավելացում:
Ցուցանշված կամ դիտարկվող երեւույթների բացատրությունը. Ինչու կալցիումի կարբոնատի հետ կրկնակի ծծմբաթթվի հետ արձագանքը սկսվում է բուռն կերպով, ապա դադարում: Ինչու է ջեռուցված չոր ամոնիումի կարբոնատային նյութը անհետանում է խողովակի մեջ:
Կալցիումի կարբոնատի օգտակար ազդեցությունը Portland ցեմենտի կայունության վրա կարելի է բացատրել ալ կարբոնատի ալյումինե պարունակող կլիմինային հանքանյութերի հետ: Այսպիսով, ցեմենտի քարի ալյումինե բաղադրիչը քիմիականորեն կապված է մինչեւ այն շրջակա միջավայրի սուլֆատների հետ շփման մեջ:
Բարարիումի կարբոնատի որոշ դիմումները հիմնված են բարիումի սուլֆատի գործնական անլուծելիության վրա, որը ձեւավորվում է բարիում կարբոնատի կողմից սուլֆատային իոններ պարունակող նյութերով: Այսպիսով, երբ այրվում է աղյուսի չորացումը, սպիտակ ծաղկումը հայտնվում է իր մակերեւույթում, որը առաջացնում է գիպսի կամ մագնեզիումի սուլֆատի բյուրեղացում `կավի մեջ: Որպեսզի դա տեղի ունենա, բարիում կարբոնատը ավելացվում է կավի մեջ, որը առաջացնում է ծծմբի իոնների տեղադրում:
Քիմի քիմիայի մեջ Հիթվալը, որպես տեսականորեն հնարավոր ռեակցիայի օրինակ, հանգեցնում է կալիումի կարբոնատի SiO2- ի արձագանքին, ինչը հանգեցնում է կալցիումի սիլիկատի ձեւավորմանը: Նա ուղեկցում է այս օրինակը, նշելով, որ այսպես կոչված, երկրաջերմային մետամորֆոզներով, սովորական ջերմաստիճանը բավարար չէ, քանի որ կալցիումի կարբոնատի եւ սիլիկիկ թթու միջեւ արձագանքը կարող է դիտվել լաբորատոր պայմաններում միայն 500 վրկ ջերմաստիճանում:
Այս գործընթացում աղիների ձեւավորման արժեքի նվազեցման համար Klima եւ Ward- ը առաջարկել է օգտագործել ամոնիումի կարբոնատային լուծույթը (ամոնիումի նիտրատի փոխարեն) եւ ստեղծել լորձաթաղանթ `հարստացված ամոնիումի կարբոնատի կրաքարի հետ:
Քանի որ ջերմաստիճանը բարձրանում է, ռեակցիան անցնում է ավելի ալկալային սիլիկատի ձեւավորման ուղղությամբ: Գիբսոնը եւ Ուորդը նատրիումի կարբոնատի հետ քվոտայի արձագանքման վրա, ազոտի հոսքի 726-ից 805 ջերմաստիճանի պայմաններում, ցույց տվեցին, որ ortho-սիլիկատը ձեւավորվում է բավարար քանակությամբ նատրիումի կարբոնատի ներկայությամբ: Ռեակցիայի մակարդակը կախված է նմուշի չափից, նմուշի չափից, գազի հոսքի արագությունից եւ ռեակցիայի խառնուրդի կազմից: Գիբսոնը եւ Ուարդը պնդում են, որ կան միջանկյալ նատրիումի սիլիկատներ:
Ավելորդ նատրիումի կարբոնատը թթվածացված է հիդրոկլորիթով: Վերլուծված արտադրանքի ծծմբի քանակը հաշվարկվում է նատրիումի կարբոնատի քանակով:
Իսկ կալցիումի կարբոնատը եւ ինչպես են այդ քիմիական բաղադրությունները փոխազդում:
Կալցիումի կարբոնատ
CaCO₃ կալցիումի կարբոնատային խառնուրդըCaCO₃- ը աշխարհի շատ տարածված բաղադրիչ է, բաղկացած է կավիճից, կրաքարից, մարմարից եւ այլն: Հետեւաբար, հարկ է նշել, որ մարդկանց համար այս նյութի դերը շատ կարեւոր է, քանի որ կալցիումի կարբոնատը լայնորեն օգտագործվում է սննդի արդյունաբերության մեջ որպես բնական սպիտակ ներկ: CaCO₃- ը նաեւ օգտագործվում է թղթի, պլաստմասեների, շինարարության եւ շատ այլ ոլորտներում արտադրության մեջ:
Կալցիումի կարբոնատը սպիտակ նյութ է (ամուր բյուրեղներ) փոշի կամ ամուր ձեւով: Նա կարողանում է ջրի հետ արձագանքել, բայց ոչ լիովին լուծարված: Հետեւաբար, ջուրն աղտոտվում է, եւ դրա մեջ կա սպիտակ աղակալում: Բայց եթե ջրի հետ արձագանքը տեղի ունենա ներկայությամբ, ապա մենք կստանանք լուծելի թթու աղ, կալցիումի երկարբոնատ:
CaCO₃ + CO₂ + H₂O → Ca (HCO₃)
Տեսնենք, թե ինչպես է պատրաստվում կալցիումի կարբոնատը:
Կալցիումի կարբոնատի մեծ մասը ձեռք է բերվում բնական աղբյուրներից: Այսպիսով, ստացվող կալցիումի կարբոնատը, որպես կանոն, օգտագործում է մաքուր աղբյուր, հաճախ մարմար:
 Դեյվիդի մարմար արձանը, Միքելանջելո Բուոնարրուին
Դեյվիդի մարմար արձանը, Միքելանջելո Բուոնարրուին
Սակայն լաբորատոր պայմաններում կալցիումի կարբոնատը կարելի է ձեռք բերել կալցիումի կալցիումի օքսիդով: Հալեցումը վերաբերում է այրման ընդհանուր եզրակացությանը, որի արդյունքում քիմիական նյութերը ձեռք են բերում նոր հատկություններ: Կրակումը կատարվում է բավականաչափ բարձր ջերմաստիճանում, չհասնելով հալման:
Ջուրը խառնվում է արդյունահանվող կալցիումի օքսիդի հետ, ռեակցիան արտադրում է հիդրոքսիդ: Այնուհետեւ տեխնիկները ստանում են ածխածնի երկօքսիդ, որն անցնում է նախկինում ստացված լուծույթով: Ձուլված օրգանիզմը կալցիումի կարբոնատ է.
CaO + H₂O = Ca (OH);
Ca (OH) + CO₂ = CaCO₃ + H₂O
Եթե մենք ջերմացնում ենք ածխաթթուների եւ կալցիումի աղը բարձր ջերմաստիճանի (900 - 1000 ° C), ապա քիմիական գործընթացի արդյունքում մենք կստանանք ածխածնի երկօքսիդ (ածխածնի երկօքսիդ), ինչպես նաեւ կալցիումի օքսիդ CaO -
CaCO₃ = CaO + CO₂
Եթե ջերմաստիճանը ավելի բարձր է (1500 ° C), ապա ռեակցիաների արտադրանքը կլինի կալցիումի կարբիդը եւ ածխածնի երկօքսիդը:
Հիդրոքլորի թթու
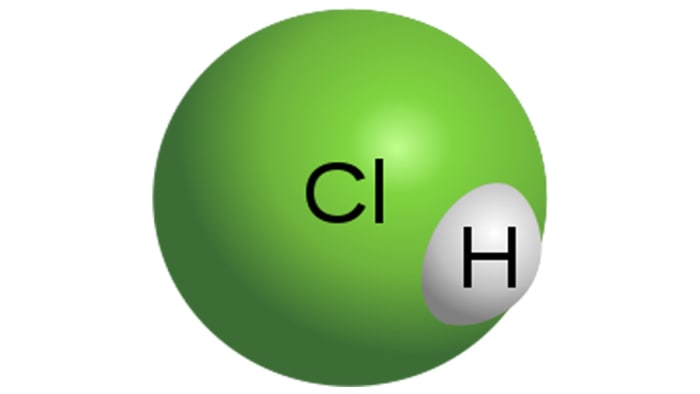 Հիդրոքլորիդային մոլեկուլ
Հիդրոքլորիդային մոլեկուլ
HCl- ն ուժեղ մոնոբացային թթու է, որը ստացվում է ջրի մեջ ջրածնի քլորիդը լուծելու միջոցով: Այն անգույն հեղուկ է, չնայած տեխնիկական թթվին կարող է ունենալ դեղին երանգ, օրինակ, երկաթի խառնուրդի պատճառով: HCl- ի հատկությունները ուղղակիորեն կախված են լուծման մեջ ջրածնի քլորիդի կոնցենտրացիան:
Հիդրոքլորիդ թթվի կոչվում են քլորիդներ: Այս նյութը շատ քաղցր է, հետեւաբար, պահանջում է մանրակրկիտ բեռնաթափում. Նույնիսկ եթե մանր կաթիլը ընկնում է մաշկի վրա, ապա ուժեղ քիմիական այրումը չի կարելի խուսափել: Ուստի, երբ ուժեղ թթուների հետ աշխատելը, ցանկալի է միշտ անցկացնել չեզոքացուցիչներ ձեզ հետ. Թույլ ալկալային լուծույթներ (խմորի սոդա) եւ այլն: Հարկ է հիշել, որ կոնցենտրացիան բացելիս կենտրոնացված թթուով HCl գոլորշիներով կազմավորվում է, ինչը բացասաբար է անդրադառնում աչքերի եւ շնչառական համակարգի վրա: Հետեւաբար, քիմիական փորձերի ժամանակ լավագույնն է օգտագործելու շնչող եւ ակնոցներ:
Հիդրոքլորիդային թթու ստացում
Ջրածնի քլորիդ գազը լուծարվում է ջրի մեջ: Ջրածնի քլորիդը իրենից ստացվում է հետեւյալ կերպ. Քլորում այրվում է ջրածինը, դրանով իսկ ստանալով սինթետիկ թթու: Alternatively, hydrochloric թթու կարելի է ձեռք բերել կողմնակի գազերի միջոցով, որոնք ձեռք են բերվում մի շարք քիմիական փորձերի մեջ, օրինակ, երբ քլորացված ածխաջրածինները քլորացված են: Այս եղանակով ստացված թթուն կոչվում է աբգազական:
Դիմել հիդրոքլորիդային թթունքը բժշկության մեջ, արդյունաբերությունում, ինչպես նաեւ քիմիական ռեակցիաների համար:
Գունավոր թթու, ջրածնի քլորիդի խիստ հոտով, լավ է արձագանքում մետաղների հետ: The redox արձագանքը տեղի է ունենում: Ռեակցիաների գործընթացում նվազեցնող նյութերը մետաղական ատոմներ են, եւ օքսիդացող նյութերը ջրածնային կալիում են:
Հիմնականում քիմիական ռեակցիաները մետաղների հետ ուղեկցվում են ջրածնի թողունակությամբ: Փոխազդեցության ինտենսիվությունը կախված է մետաղի ակտիվությունից, օրինակ, ալկալիական մետաղական լիթիումը բռնկվում է, մինչդեռ ալյումինի հետ ռեակցիան թույլ է, քանի որ այս տարրերի ուժեղ օքսիդ ֆիլմը:
Հիդրոքլորիդային թթու եւ ցինկ:
2HCl + Zn = ZnCl2 + H₂
Հիդրոքլորիթ եւ երկաթ:
2HCl + Fe = FeCl2 + H₂
Հիդրոքլորիդային թթու եւ մագնեզիում.
2HCl + Mg = MgCl2 + H₂
 Մագնեզիումի քլորիդը, որն օգտագործվում էր սառույցից ճանապարհները մաքրելու համար
Մագնեզիումի քլորիդը, որն օգտագործվում էր սառույցից ճանապարհները մաքրելու համար
Մետաղական օքսիդներով, թթվային ձեւով աղ եւ ջուր:
CuO + 2HCl = CuCl2 + H₂O
Հիդրոքլորական թթվի եւ կալցիումի կարբոնատի ռեակցիան
Փորձի համար անհրաժեշտ է.
փորձարկման խողովակ;
քիմիական խողովակաշար;
ամուր կալցիումի կարբոնատ (մարմար);
Հիդրոքլորիդային թթու;
ձեռնոցներ;
ռեզերվատոր:
Ուշադրություն. Մի փորձեք ինքներդ ձեզ փորձել:
Փորձեք անցկացնել լավ օդափոխվող տարածքում, զգուշորեն օգտագործել հանքային քլորիդ թթվով:
Արկղին մի քանի կտոր մարմարե ավելացրեք եւ խնձորի թթվային խյուսը միացրեք: Որպես հետեւանք, կլինեն ակնթարթային ռեակցիա փուչիկների ձեւավորման հետ `ածխածնի երկօքսիդը: Սա փոխանակման ռեակցիա է, որի արտադրանքներն են `թույլ եւ անկայուն բարդ, ածխածնի թթու, որը բաժանվում է ածխաթթու գազի եւ ջրի մեջ: Կալցիումի կարբոնատի լուծույթում հիդրոքլորիդային թթվի լուծույթի արձագանքը:
CaCO₃ + 2HCl (լեզու) → CaCl₂ + CO₂ + H₂O
- մագնեզիումի տարրերի բնութագրիչ. էլեկտրոնային կառուցվածքը, հնարավոր օքսիդացման վիճակները, հիմնական միացությունները `օքսիդ, հիդրոքսիդ, աղեր: Որն է կլանացվածացումը եւ ինչն է դրա շինարարության դերը:
MgCO 3 = MgO + CO 2
Դիմում:
Արդյունաբերությունում օգտագործվում է refractories, cements եւ նավթամթերքի մաքրում, որպես ռետինե արտադրության լցահարթիչ: Ուլտրա-թեթեւ մագնեզիումի օքսիդը օգտագործվում է որպես մաքուր մակերեւույթների մաքրման համար շատ հստակ, մասնավորապես, էլեկտրոնիկայի ոլորտում:
Բժշկության մեջ այն օգտագործվում է ստաստիային հյութի թթվայնության դեպքում, քանի որ այն առաջացնում է հիդրոքլորային թթվի ավելորդ բովանդակություն: Burnt magnesia- ն նույնպես ընդունվում է, երբ թթվածին պատահաբար ազատվում է ստամոքսի մեջ:
Սննդի արդյունաբերությունում այն գրանցվում է որպես E530 սննդային հավելում:
Բացարձակ ռեֆլեկտոր է `մի ընդարձակ սպեկտրալ խմբի մեջ ընդգրկված արտացոլողական գործակից ունեցող նյութ: Կարող է օգտագործվել որպես սպիտակ ստանդարտ:
Մագնեզիումի հիդրոքսիդ - Հիմնական մետաղական հիդրոկայան մագնեզիումն է: Թույլ անլուծելի բազան:
Ստանդարտ պայմաններում մագնեզիումի հիդրոօքսիդը անգույն վեցանկյուն գոտի է: 350 ° C- ից բարձր ջերմաստիճանում ցրվում է մագնեզիումի օքսիդի եւ ջրի մեջ: Ածխածնի երկօքսիդի եւ ջրի օդը խթանում է հիմնական մագնեզիումի կարբոնատը ձեւավորելու համար: Magnesium hydroxide- ը գրեթե անլուծելի է ջրի մեջ, բայց լուծելի է ամոնիումային աղերի մեջ: Դա թույլ բազա է: Այն տեղի է ունենում բնույթով, հանքային բրուտի ձեւով:
Ստացական:
Լուծվող մագնեզիումային աղերի փոխհարաբերությունը alkalis- ով:
Ընդհանուր առմամբ `
Mg 2+ + 2OH - = Mg (OH) 2 ¯
Օրինակներ `
MgCl 2 + 2NaOH = Mg (OH) 2 ¯ + 2NaCl
Mg (NO 3) 2 + 2KOH = Mg (OH) 2 ¯ + 2KNO 3
Մագնեզիումի քլորիդի լուծույթի փոխազդեցությունը այրված dolomite- ի հետ.
MgCl 2 + CaO × MgO + 2H 2 O = 2 Մգ (OH) 2 ¯ CaCl 2
Մետաղական մագնեզիումի ջրի գոլորշու փոխազդեցություն.
Mg + 2H 2 O = Mg (OH) 2 ¯ + H 2 -
Քիմիական հատկություններ
Մագնեզիումի հիդրօքսիդի նման բոլոր թույլ հիմքերի պես, ջերմային անկայուն է: Decomposes, երբ ջեռուցվում է 350 ° C:
Քաղցկեղի հետ փոխկապակցում է աղի եւ ջրի (չեզոքացման ռեակցիա) ձեւավորումը.
Mg (OH) 2 + 2HCl = MgCl 2 + 2H 2 O
Mg (OH) 2 + H 2 SO 4 = MgSO 4 + 2H 2 O
Ձիթապտղի օքսիդների հետ փոխազդեցություն աղի եւ ջրի ձեւավորման համար.
Mg (OH) 2 + SO 3 = MgSO 4 + H 2 O
Հիդրոքսիմաղնետների ձեւավորման հետ խառնուրդների տաքացման կենտրոնացված լուծումների հետ փոխազդեցություն.
Mg (OH) 2 + 2NaOH = Na 2
Mg (OH) 2 + Sr (OH) 2 = Sr
Դիմում:
մագնեզիում հիդրօքսիդ համար օգտագործվում է պարտավորեցնող ծծմբի երկօքսիդ, որպես flocculant համար կեղտաջրերի մաքրման, որպես Ֆլեյմի retardant ի thermoplastic պոլիմերների (polyolefins եւ ՊՎՔ), որպես հավելում է լվացող միջոցների համար մագնեզիումի օքսիդի, շաքարի վերամշակման, որպես բաղադրիչ ատամի մածուկ:
Բժշկության մեջ այն օգտագործվում է որպես դեղ, ստամոքսի թթվի չեզոքացման համար, ինչպես նաեւ շատ ուժեղ ճարպակալում:
Եվրոպական միությունում մագնեզիումի հիդրոօքսիդը գրանցվում է որպես E528 սննդային հավելում:
Մագնեզիումի աղեր:
Մագնեզիումի մեծամասնությունը մեծ ջրում է ջրում: Ion Mg 2+- ը լուծումներ է տալիս դառը համ: Մագնեզիումի հալոգենները, բացառությամբ MgF2- ի, բարձր հիգրոսկոպիկ են, նրանք օդում արյուն են փչում:
Մագնեզիումի քլորիդ MgCl 2 (մագնեզիումի քլորիդ) անջուր հալում `718 °: Ջրի հետքերի առկայության դեպքում այն «ծխում է» օդում, այն decomposes into HCl եւ MgO: 1, 2, 4, 6, 8 եւ 12 ջրային մոլեկուլներով գունավոր բյուրեղային հիդրոթյունները ազատվում են ջրային լուծույթից: -3,4-ից մինչեւ 116,7 ° ջերմաստիճանում, MgCl 2 × 6H 2 0 բյուրեղային հիդրատը կայուն է, որը բնականաբար ձեւավորվում է որպես բիսկֆիտի հանքային եւ մեծ քանակությամբ ստացվում է ծովի ծխի գոլորշիացման միջոցով: Մագնեզիումի քլորիդը կրկնակի աղեր է ստեղծում, որոնցից շատ կարեւոր է հանքային carnallite KCl × MgCl 2 × 6H 2 O- մագնեզիումի եւ կալիումի քլորիդի աղբյուրը:
Դիմում:
1. Մագնեզիումի քլորիդը հիմնականում օգտագործվում է մագնեզիումի մետաղների արտադրության մեջ, MgCl 2 × 6H 2 0 օգտագործվում է մագնեզիումային ցեմենտերի ձեռքբերման համար:
2. Սառույցի եւ ձյան ծածկույթի մշակման համար օգտագործվում է որպես հավելում: Ձյան հետ արձագանքի արդյունքում այն առաջացնում է հալեցում: Այն ունի 3-րդ վտանգի դաս (չափավոր վտանգավոր նյութեր) եւ ագրեսիվ քայքայիչ հատկություններ:
Մագնեզիում բիկարբոնատ - Mg (HCO 3) 2 բանաձեւով մագնեզիումի եւ ածխաթթուների թթու աղը գոյություն ունի միայն ջրային լուծույթներում:
Ստացական:
Մագնեզիումի կարբոնատի կասեցման միջոցով ածխածնի երկօքսիդի փոխանցումը.
MgCO 3 + CO 2 + H 2 O = Mg (HCO 3) 2
Ֆիզիկական հատկություններ:
Մագնեզիումի բիկարբոնատը գոյություն ունի միայն ջրային լուծույթներում:
Ջրի մագնեզիումի երկօքսիդի պարունակությունը առաջացնում է ժամանակավոր կոշտություն:
Քիմիական հատկություններ
Երբ լուծման կենտրոնացումը մագնեզիումի բիկարբոնատը քայքայվում է.
Mg (HCO 3) 2 = MgCO 3 + CO 2 - + H 2 O
Մագնեզիումի հիդրոֆոսֆատ (երկակի փոխարինված մագնեզիում ֆոսֆատ) - մագնեզիումի եւ ֆոսֆորական թթվի աղը `MgHPO 4 բանաձեւով, որը փոքր-ինչ լուծելի է ջրի մեջ, ձեւավորում է բյուրեղային հիդրատեր:
Ստացական:
Օրֆֆոսֆորի թթու ազդեցությունը մագնեզիումի օքսիդի կամ մագնեզիումի կարբոնատի վրա.
MgO + H 3 PO 4 = MgHPO 4 + H 2 O
MgCO 3 + H 3 PO 4 = MgHPO 4 + CO 2 - + H 2 O
Մագնեզիումի քլորիդում վիժեցված նատրիումի orthophosphate- ի ակցիան.
MgCl 2 + 2Na 2 HPO 4 = MgHPO 4 + 2NaCl
Dihydrogen ֆոսֆատ մագնեզիումի տարրը `
Mg (H 2 PO 4) 2 = MgHPO 4 + H 3 PO 4
Ֆիզիկական հատկություններ.
Մագնեզիումի ջրածնի ֆոսֆատը ձեւավորում է սպիտակ բյուրեղներ, որոնք բյուրեղային հիդրատեր են `մինչեւ 225 ° C ջերմաստիճանում, կազմվում է MgHPO4 մոնոհիդատ: H 2 O, խտությունը 2.32 գ / սմ3, 36 ° C ջերմաստիճանում, MgHPO4 trihydrate- ը ձեւավորվում է: 3H 2 O, խտություն 2.10 գ / սմ, հետ սենյակի ջերմաստիճանը MgHPO4 heptahydrate- ը ձեւավորվում է: 7H 2 O.
Քիմիական հատկություններ.
Երբ ջեռուցվում է պիրոֆոսֆատ:
Դիմում:
Օգտագործվում է սննդի հավելված E343- ում:
Magnesium dihydrogen fosphate - մագնեզիումի եւ orthophosphoric թթու մետաղի թթու աղը Mg (H 2 PO 4) 2 բանաձեւով, գունավոր գիգոսկոպիկ բյուրեղներ, ջրի մեջ լուծվող, ձեւավորում է բյուրեղային հիդրոդեր:
Ստացական:
Միջին ֆոսֆորական թթվի հիդրօքսիդի կամ մագնեզիումի օքսիդի լուծույթ.
Ֆիզիկական հատկություններ.
Magnesium dihydrogen fosphate- ը գունավոր բյուրեղներ է ձեւավորում:
Մգ (H 2 PO 4) 2 ձեւավորված բյուրեղային հիդրո կազմվածք: nH 2 O, որտեղ n = 2, 4, 6:
Մագնեզիումի կարբիդ - մագնեզիումի եւ ածխածնի երկային անօրգանական միացություններ `MgS 2 բանաձեւով: Նաեւ հայտնի է մագնեզիումի կարբիդ Mg 2 C բանաձեւով:
Ստացական:
Sintering մագնեզիում ֆտորիդ եւ կալցիումի կարբիդ:
Մագնեզիումի փոշիով ացետիլեն ծծող:
Պենտանը մագնեզիումի փոշու հետ 650 ° C- ով վերականգնելու միջոցով կարելի է ձեռք բերել ավելի բարդ carbide Mg 2 C 3:
Քիմիական հատկություններ.
Երբ ջեռուցվում է խտացված Mg2C3 միջանկյալ կարբիդի ձեւավորման հետ `
Փոխկապակցված ջրով.
Մագնեզիումի կարբոնատ, մագնեզիումի կարբոնատ, MgCO 3 - մագնեզիումի ածխաթթու գազ:
Հատկություններ
Սպիտակ բյուրեղներ, խտություն 3,037 գ / սմ ³: 500 ° C- ում այն նկատելի է, եւ 650 ° C- ում այն ամբողջությամբ բաժանվում է MgO եւ CO2: Ջրի մեջ մագնեզիումի կարբոնատի ողողունակությունը աննշան է (22 մգ / լ 25 ° C) եւ նվազում է ջերմաստիճանի բարձրացման հետ: Երբ է հագեցած CO 2 նստվածքային կասեցումը Վերջինիս լուծարվեց MgCO 3 շնորհիվ ձեւավորման ջրածնի Mg (HCO 3) 2. Ջրային լուծումներից CO2- ի ավելցուկի բացակայության դեպքում հիմնական մագնեզիումի կարբոնատներ են արտանետվում: Մի շարք մետաղների կարբոնատներով մագնեզիումի կարբոնատը ձեւավորում է կրկնակի աղեր, որոնք ներառում են բնական հանքային dolomite MgCO 3 · CaCO 3:
Տարածվածությունը բնության մեջ.
Մագնեզիումի կարբոնատը լայնորեն տարածվում է բնույթով, հանքային magnesite ձեւով:
Դիմում:
Հիմնական մագնեզիումի կարբոնատ 3MgCO 3 · Մգ (OH) 2 · 3H 2 O (այսպես կոչված, սպիտակ մագնեզիումի), որն օգտագործվում է որպես filler ռետինե խառնուրդների համար արտադրության մեկուսիչ նյութերի.
Մագնեզիումի կարբոնատը անհրաժեշտ է ապակու, ցեմենտի, աղյուսների արտադրության մեջ:
Մագնեզիումի նիտրատ Mg (NO 3) 2 - գունավոր գիգոսկոպիկ բյուրեղներ մեկ խորանարդային ցանցով; հալեցման կետ 426 ° C (տարրալուծմամբ): Ջրի մեջ ողողունակություն (g 100 գ): 73.3 (20 ° C), 81.2 (40 ° C), 91.9 (60 ° C): Նաեւ լուծվող էթանոլում, մետանոլով, հեղուկ NH3- ով: Կախված կոնցենտրացիայից, nona-, hexa- եւ dihydrates crystallize է ջրային լուծումներից:
Բարդ պարարտանյութերի բաղադրիչը, քանի որ մագնեզիումը մասն է կազմում քլորիֆիլին, որը անհրաժեշտ է ֆոտոսինթեզի համար, մեծացնում է բազմաթիվ ֆերմենտների ակտիվությունը եւ հանդես է գալիս որպես ֆոսֆորի փոխադրիչ: Բարձր լուծունակությունը եւ ցածր էլեկտրական հաղորդակցությունը դարձնում են արտադրանքը չափազանց հարմար է սաղմնային կերակրման եւ ֆերտինգի համար, հատկապես այն դեպքում, երբ ոռոգման ջրերը օգտագործվում են աղի համակենտրոնացման բարձր մակարդակով: Պարարտանյութը օգտագործվում է բանջարեղենի, հատապտուղների, միրգ մշակաբույսերի, խաղողի արմատն ու տերեւային սնուցման համար: օքսիդիչ է պիրոտեխնիկական ստեղծագործություններում:
Կարբոնացում- ցանկացած լուծույթի հագեցում ածխածնի երկօքսիդի հետ: Օգտագործվում է շինարարության մեջ:
Հանքային ածխաջրածնությունը `սիլիկաթթուների սիլիկոնաթթու փոխարինված է կարբոնաթթուներով, ձեւավորելու կարբոնատներ: Քարբոնատներից, քայքայված ժայռերի ռոք-ձեւավորող հանքաքարն է, կալկիտ (CaCO3): Մագնեզիտ - MgCO3 եւ dolomite - CaMg (CO3) 2 պակաս տարածված են: Ի մաքուր ջուր, չհաշված ածխածնի թթու, կալցիդը փոքր քանակությամբ լուծվում է (0,03 գ մեկ լիտր ջուր); Մագնեզիտը գրեթե անլուծելի է: Եթե ջուրը պարունակում է ածխածնի երկօքսիդ, ապա կալցիտը հեշտությամբ լուծվում է թթու կալցիումի կարբոնատի ձեւավորման հետ, որը լուծելի է ջրում `Ca (HCO3) 2:
Carbonization- ը փոփոխություն է, որը տեղի է ունենում կոնտեյներով Portland ցեմենտի վրա, երբ ենթարկվում է C0 2 օդ: Կալցիումի հիդրօքսիդ Ca (OH) 2 խոնավության առկայության դեպքում հատկապես տուժում է: Կալցիումի հիդրոքսիդը փոխակերպվում է կալցիումի կարբոնատ, երբ ներծծում է ածխաթթու գազը: Կալցիումի կարբոնատը ջրի մեջ թույլ լուծելի է, եւ արդյունքում հակված է հերմետիկորեն փակել բետոնի մակերեւույթը (նշանակում է խիտ, անջրանցիկ բետոն):
Սովորաբար, բետոնի խտացված ջրի pH- ն սահմանում է 10.5-ից մինչեւ 11.5: Եթե կլանման արդյունքում այն նվազում է մինչեւ 9 եւ ցածր, ապա հնարավոր է ամրապնդման կորոզիա: Հետեւաբար, carbonized շերտի հաստությունը կարեւոր գործոն է ամրապնդումը պաշտպանելու համար. Ավելի խորը կոմբինացիա, այնքան մեծ է պողպատի կորոզիայի վտանգը: Գազօջախի խորությունը կարելի է որոշել բետոնի բուժումը ֆենոլֆտալալինով: Ֆենոլֆթալինի գործողությամբ ալկալային հատկությունների առկայությունը վկայում է վարդագույն գույնի տեսքով, իսկ գազավորված կոնկրետը պահպանում է իր սկզբնական գույնը:
Բարձրորակ խիտ կոնստրուկցիան շատ դանդաղ է մթնում carbonization- ով: Հնարավոր չէ, որ 50 տարվա ընթացքում շահագործումից հետո նույնիսկ 5-10 մմ խորության վրա կլանումը կլրացվի: Մյուս կողմից, ցածր ուժով անցնող բետոնի կոմբայնացման խորությունը կարող է հասնել 25 մմ-ից 10 տարուց պակաս: Փորձը ցույց է տալիս, որ ցածրորակ բետոնային ապրանքները հատկապես ընկալվում են carbonization- ին:
- կալցիումի տարրերի բնութագրիչ. էլեկտրոնային կառուցվածքը, հնարավոր օքսիդացման վիճակները, հիմնական միացությունները `օքսիդ, հիդրոքսիդ, աղեր:
Կալցիում - երկրորդ խմբի հիմնական ենթախմբի տարրը, քիմիական տարրերի Դ.Ի. Մենդելեեւի պարբերական աղյուսակի չորրորդ ժամանակահատվածը, ատոմային թիվ 20-ով: Այն նշվում է Ca (lat. Կալցիում) նշումով: Էլեկտրոնային կառուցվածքը 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 = [18 Ar] 4s 2, օքսիդացման վիճակ +2, 0, վերաբերում է ալկալիային մետաղների:
Պարզ նյութը կալցիում է փափուկ, քիմիական ակտիվ ալկալային մետաղի արծաթագույն-սպիտակ գույն: Արդյունաբերական արտադրություն. Հալեցված կալցիումի քլորիդի էլեկտրոլիզացում:
Կալցիումի օքսիդ CaO - հիմնական օքսիդ, ցնցուղ: Սպիտակ, hygroscopic. Հրակայուն, ջերմային անկայուն, անկայուն, բռնկման ժամանակ: Ակնհայտորեն արձագանքում է ջրով (բարձր էկզոֆեկտով), ձեւավորում է խիստ ալկալային լուծույթ, գործընթացը կոչվում է կրաքարի քայքայման: Reacts թթուների, մետաղական օքսիդների, ոչ մետաղների. Այն օգտագործվում է սինթեզավորում այլ կալցիումի միացություններ, շինարարության մեջ պարտադիր նյութերի բաղադրիչ:
Արտադրության արդյունաբերություն `կրաքարային կրակոց (900-1200 o C)
Կալցիումի հիդրօքսիդ Ca (OH) 2 - խոնավացված կրաքարի, հիմնական հիդրոկայուն: Տարրական ջեռուցման մեջ: Սպիտակ, hygroscopic. Օդի մեջ խոնավության եւ ածխաթթու գազի խցանումը: Մի փոքրորեն լուծելի է սառը: ջուր, նույնիսկ ավելի քիչ, եռացող ջրի մեջ: Հստակ լուծումը (կրաքարի ջուրը) արագորեն դառնում է ամպամած, պայմանավորված հիդրոքսիդի տեղակայմամբ (կասեցումը կոչվում է կրաքարի կաթ): Որակական ռեակցիան է ածխածնի երկօքսիդի կրաքարի ջրով փոխանցումը CaCO3 ծագման տեսքով եւ դրա լուծմանն անցնելու միջոցով: Reacts թթուների եւ թթվային օքսիդների, մտնում է ion փոխանակման ռեակցիաների.
Օգտագործվում է շինարարության նախապատրաստման համար կրաքարի հավանգ (ավազի + կրաքարի չմարեց + ջուր) ծառայելով որպես պարտադիր նյութ քար եւ որմնադրությանը, հղկում (Սվաղային) պատերը եւ այլ շինարարական նպատակներով. Նման լուծումների ամրությունը պայմանավորված է օդում CO2 կլանման պատճառով:
Ca (OH) 2 + CO 2 → CaCO 3 ↓ + H 2 O
Ca (OH) 2 + H 2 SO 4 → CaSO 4 + 2H 2 O,
Reacts հետ աղերի, եթե աղը ձեւավորվում:
Ca (OH) 2 + Na 2 SO 3 → CaSO 3 ↓ + 2NaOH
Կալցիումի աղեր:
Կալցիումի սուլֆատ (CaSO 4) - անօրգանական բարդ, ծծմբաթթվի կալցիումի աղ:
Բնության մեջ հայտնաբերված է CaSO 4 dihydrate: 2H 2 O (գիպս, սելենիտ) եւ անջուր վիճակում `անխիդիտ:
Կալցիումի քլորիդ, CaCl2 - հիդրոկլորիդային կալցիումի աղը:
Բարձր հիգրոսկոպիկ հատկություններ ունեն: Լուծելիություն (g 100 գ H2O) `74 (20 ° C) եւ 159 (100 ° C): Կալցիում քլորիդ ջրային լուծույթները սառեցնում են ցածր ջերմաստիճաններում (20% -18.57 ° C, 30% -48 ° C):
Պատրաստում է CaCl2 · 6H2O խառնուրդ, կայուն մինչեւ 29.8 ° C; բարձր ջերմաստիճաններում, 4, 2 եւ 1 H2O մոլեկուլներով բյուրեղային հիդրոթյունները ընկնում են հագեցած լուծույթից: Երբ CaCl2 * 6H2O (58.8%) խառնվում է ձյան կամ սառույցի (41.2%), ջերմաստիճանը կնվազի մինչեւ -55 ° C (ծծմբի կետ):
Կալցիումի քլորիդը ձեռք է բերվում որպես սոդա արտադրության արտադրանք:
Քիմիական լաբորատորիայում կալցիումի քլորիդը օգտագործվում է որպես չորացման խողովակների լցահարթիչ, որը կոչվում է կալցիումի քլորիդ, որը նախատեսված է մթնոլորտային ջրի գոլորշիայից եւ չորացման գազերից նյութեր մեկուսացնելուց:
Կալցիումի քլորիդը նույնպես օգտագործվում է որպես ցեմենտի պարունակության արագացուցիչ:
Կալցիումի կարբոնատ (կալցիումի կարբոնատ) - անօրգանական քիմիական բաղադրություն, ածխաթթուի աղ եւ կալցիում: Քիմիական բանաձեւ -CaCO 3. Բնության մեջ այն հայտնաբերվում է հանքանյութերի տեսքով `կալկիտ, aragonite եւ vaterite, հիմնական բաղադրիչը կրաքար, մարմար, կավիճ, մի մասը shell մասին ձու. Անլուծելի է ջրի եւ էթանոլի մեջ:
Ծեփամածիկ, տարբեր սոսինձներ, բոլորը պարունակում են զգալի քանակությամբ կալցիումի կարբոնատ: Կալցիումի կարբոնատը կենցաղային քիմիական նյութերի արտադրության կարեւոր բաղադրիչներից մեկն է:
Կալցիումի կարբոնատը լայնորեն կիրառվում է մաքրման համակարգերում, որպես շրջակա միջավայրի աղտոտման դեմ պայքարի միջոց, եւ կալցիումի կարբոնատի միջոցով վերականգնվել է հողի թթվային բազային հավասարակշռությունը:
- Կառուցվածքներում կալցիումի եւ մագնեզիումի օքսիդների եւ հիդրոկիդների օգտագործման օրինակները:
Կալցիումի օքսիդ եւ հիդրոքսիդ:
Երբ սենյակները սպիտակում են:
Երբ փայտե ցանկապատերը եւ բծահանող ծածկոցները սպիտակեցնելու դեպքում `պաշտպանելու հրդեհից եւ հրդեհից:
Լիմի հավանգի պատրաստման համար: Լայմը օգտագործվել է քարե կառուցման համար հին ժամանակներից: Այս խառնուրդը սովորաբար պատրաստվում է այս համամասնությամբ. Երեք կամ չորս մասերը ավազի (ըստ կշռի) ավելացվում են կալցիումի հիդրոքսիդի (խոնավացված կրաքարի) եւ ջրի խառնուրդի մի մաս: Երբ դա տեղի ունենա, խառնուրդը կարծրացնում է ռեակցիան. Ca (OH) 2 + CO 2 → CaCO3 ↓ + H2O: Սա էկզոտերմիկ ռեակցիա է, էներգիայի թողարկումն է 27 կկալ (113 կՋ):
Ինչպես երեւում է արձագանքից, դրա ընթացքում ջուրը ազատվում է: Սա բացասական գործոն է, քանի որ կրաքարի հավանգով կառուցված սենյակներում երկար ժամանակ պահպանվում է բարձր խոնավությունը: Այս առումով, ինչպես նաեւ կալցիումի հիդրօքսիդի նկատմամբ մի շարք այլ առավելությունների շնորհիվ, ցեմենտի գործնականում այն փոխարինել է որպես լուծիչի լուծարման համար: Ավելին, այն նաեւ անընդունելի է վառարանների տեղադրման ժամանակ օգտագործելու համար, քանի որ բարձր ջերմաստիճանի ազդեցության տակ թողարկվում է ածխածնի երկօքսիդը:
Սիլիկատային բետոնի պատրաստման համար: Սիլիկատային բետոնի կազմը նույնական է կրաքարի հավասարության հետ, սակայն այն պատրաստվում է մեկ այլ մեթոդով `կալցիումի օքսիդի եւ քվարցի ավազի խառնուրդը ջրի հետ չի լուծվում, սակայն ավտոկլավի ջերմաստիճանը գերակշռում է (174.5-197.4 ° C) 9-15 մթնոլորտային ճնշման տակ:
Սիլիկատային աղյուսների արտադրություն:
Օքսիդ եւ մագնեզիումի հիդրոքսիդ:
հրակայուն նյութերի համակցված համակարգերի (մագնեզիումի շինարարական վահանակներ) արտադրության համար, ցեմենտերի արտադրության համար: Մագնեզիումի օքսիդը (կեղեվ մագնեզինիտ) օգտագործվում է որպես կապար, որը, երբ խառնվում է MgCl2 լուծույթով, կարող է արագորեն ամրացնել եւ ուժեղանալ օդի մեջ:
- բնական ջրերի կարծրություն. սահմանում, կարծրության տեսակներ, ջրի կարծրության հեռացման մեթոդներ. ֆիզիկական, քիմիական (ռեակցիայի հավասարումներ), ֆիզիկաքիմիական:
Բնական ջուրը, որը պարունակում է մեծ քանակությամբ կալցիումի կամ մագնեզիումի աղի լուծույթ, կոչվում է կոշտ ջուր, ի տարբերություն մանրագույն ջրի, որը պարունակում է քիչ կամ ոչ կալցիումի եւ մագնեզիումի աղեր:
Դրանցից առաջինը պայմանավորված է կալցիումի եւ մագնեզիումի բիկարբոնատների առկայությամբ, երկրորդը `ուժեղ թթուների, սուլֆատների կամ կալցիումի եւ մագնեզիումի աղերի ներկայությունը: Ջրի երկարատեւ եռացման հետ կարբոնատային կարծրությունով, դրա մեջ հայտնվում է մի precipitate, հիմնականում CaCO3- ից, եւ միաժամանակ CO2- ը ազատվում է:
Երկու նյութերը հայտնվում են կալցիումի կարբոնատի տարրալուծման արդյունքում.
Հետեւաբար, կարբոնատային խստությունը կոչվում է ժամանակավոր խստություն: Քանակականորեն, ժամանակավոր կոշտությունը բնութագրվում է ջրի բիկարբոնատների բովանդակությամբ, երբ այն եռում է մեկ ժամով: Այդպիսի եռումից հետո մնացած կարծրությունը կոչվում է մշտական խստություն:
Ջրի կարծրությունը արտահայտվում է ջրի մեջ պարունակվող կալցիումի եւ մագնեզիումի իոնների միլիոնատիվերի քանակով: Հաստության մեկ հարմարանք համապատասխանում է 20,04 մգ / լ կամ 12,16 մգ / լ բետոնի պարունակությանը:
Բնական ջրերի կարծրությունը լայնորեն տարբերվում է: Այն տարբեր է տարբեր ջրամբարներում, եւ նույն գետում տարբերվում է տարվա ընթացքում (նվազագույնը ջրհեղեղի ժամանակ): Ծովի ջրերի կարծրությունը շատ ավելի բարձր է, քան գետերն ու լճերը: Այսպիսով Սեւ ծովի ջուրը ունի 65,5 մեգ / լ ընդհանուր կարծրություն: Համաշխարհային օվկիանոսի ջրի կարծրության միջին արժեքը 130,5 մեգ / լ է (ներառյալ 22,5 մեգ / լ / ժ / ժ):
Կալցիումի կամ մագնեզիումի աղի զգալի քանակի ջրի ներկայությունը շատ տեխնիկական նպատակներով համարժեք է ջրի համար: Այսպիսով, ծանր ջուրով գոլորշու կաթսաների երկարատեւ կերակրման շնորհիվ նրանց պատերը աստիճանաբար ծածկվում են նակիիի խիտ բյուրեղներով: Նման խառնուրդը արդեն շերտի հաստությամբ էապես նվազեցնում է ջեռուցման փոխանցումը կաթսայի պատերի կողմից եւ, հետեւաբար, հանգեցնում է վառելիքի սպառման ավելացմանը: Բացի այդ, դա կարող է առաջացնել blistering եւ cracking թե ջեռուցման խողովակների եւ պատերի մեջ ինքնին.
Կոշտ ջուրը օճառով փրփուր չի տալիս, քանի որ օճառով պարունակվող ճարպային թթուների լուծվող նատրիումի աղերը վերածվում են նույն թթուների լուծելի կալցիումի աղեր:
Hard water- ը չի կարող օգտագործվել որոշ տեխնոլոգիական գործընթացների իրականացման ժամանակ, օրինակ `ներկում:
Ջրի մշտական կոշտությունը պայմանավորված է նրա հիմնականում սուլֆատների եւ կալցիումի եւ մագնեզիումի քլորիդներով եւ չի վերացվում եռալով: Ժամանակավոր (շարժական) եւ անընդհատ կարծրության գումարը ջրի ընդհանուր կարծրություն է:
Կտրուկության որոշման տարբեր եղանակներ կան:
Նրանցից երկուսը դիտեք.
1) հիդրոքլորական թթվի տիտրած լուծույթ օգտագործելով ժամանակային կոշտության որոշումը
2) ընդհանուր կոշտության որոշման համալիրային մեթոդ:
Մեթրի նարնջի ներկայությամբ ջրային քլորիդ թթվի ջրերի նմուշի տիտրացման ժամանակ, բիկարբոնատների տարրալուծումը տեղի է ունենում, ինչը հանգեցնում է ժամանակավոր կոշտության:
Վճռի մեթոդ. Հաշվի կոնաձեւ կոլբայի հետ կաթոցիկով կամ ավարտել գլան է 100 մլ test հեղուկ ավելացրել էր 2-3 կաթիլ մեթիլ նարնջագույն եւ 0.1 եւ titrated: HCl լուծումը մինչեւ նարնջի գույնը:
Հաշվարկման արդյունքների վերլուծություն: 1 մլ 0.1 ն. HCl լուծումը համապատասխանում է 0.1 / 1000 գ-ի կամ 0.1 մգ-ի CA2 + մակարդակի: V (HCl) համապատասխանում է 0.1 V (HCl) / 1000 g-eq կամ 0.1 V (HCl) mg-eq Ca 2+: 0.1 V (HCl) mEq- ը V- ի ծավալում է: 1 լ ջրի դիմաց քրտինքի արտահայտություն արտահայտելու համար անհրաժեշտ է բաժանել V A- ի արժեքը եւ բազմապատկել այն 1000-ով, այսինքն `ուսումնասիրվող ջրի կարծրությունը հավասար է`
![]()
Վերացման մեթոդները.
Ջերմային մեղմացում: Հիման վրա ջրի եռացող, արդյունքում ջերմային անկայուն կալցիումի եւ մագնեզիում բիկարբոնատների քայքայվել է ձեւավորման սանդղակի:
Ca (HCO3) 2 → CaCO3 ↓ + CO2 + H2O:
Աղալը հեռացնում է միայն ժամանակավոր (կարբոնատ) կարծրություն: Գտում է կիրառումը կյանքում:
Reagent softening. Մեթոդը հիմնված է ջրի մեջ սոդայի մոխրի Na2CO3 կամ hydrated կրաքարի Ca (OH) 2 ավելացման վրա: Միեւնույն ժամանակ, կալցիումի եւ մագնեզիումի աղերը անցնում են չլուծվող միացությունների եւ արդյունքում թաղում են:
Օրինակ, hydrated lime- ի ավելացումը բերում է կալցիումի աղերի փոխարկմանը `չլուծվող կարբոնատ:
Ca (HCO3) 2 + Ca (OH) 2 → 2CaCO3 ↓ + 2H2O
Ջրի ընդհանուր կարծրության վերացման լավագույն ռեագենտը նատրիումի orthophosphate Na3PO4 է, որը հանդիսանում է կենցաղային եւ արդյունաբերական արտադրանքի մեծ մաս:
3Ca (HCO3) 2 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 6NaHCO3
3MgSO4 + 2Na3PO4 → Mg3 (PO4) 2 ↓ + 3Na2SO4
Կալցիումի եւ մագնեզիումի orthophosphates- ը շատ ցածր են լուծելի ջրի մեջ, եւ, հետեւաբար, հեշտությամբ բաժանվում են մեխանիկական ֆիլտրացիան: Այս մեթոդը հիմնավորված է համեմատաբար բարձր ջրի սպառման վրա, քանի որ այն ներառում է մի շարք կոնկրետ խնդիրների լուծում. Նստվածքների ֆիլտրում, ճշգրիտ ռեագենտային դոզան:
Կարիիզացիա: Մեթոդը հիմնված է ion փոխանակման հատիկավոր բեռնվածքի օգտագործման վրա (հաճախ ion փոխանակման խեժեր): Ջրի հետ կապված նման բեռը ներծծվում է կարծրության աղերի (կալցիումի եւ մագնեզիումի, երկաթի եւ մանգանի) բորբոքման մեջ: Փոխարենը, կախված իոնիկ ձեւից, այն տալիս է նատրիումի կամ ջրածնի իոններ: Այս մեթոդները համապատասխանաբար կոչվում են Na-cationization եւ H-cationization: Պատշաճ ընտրված իոն փոխանակման բեռնմամբ, ջրի կարծրությունը նվազեցնում է միակողմանի նատրիումի cationisation- ով մինչեւ 0.05-0.1 ° W, երկու փուլով բեռնվածությամբ `մինչեւ 0.01 ° W: Արդյունաբերության մեջ ion փոխանակման ֆիլտրերը փոխարինում են կալցիումի եւ մագնեզիումի իոնների հետ `նատրիումի եւ կալիումի իոնների հետ` արտադրելով փափուկ ջուր:
Հակադարձ osmosis. Մեթոդը հիմնված է ջրի ընդունման վրա կիսաթափանցելի մեմբրանով (սովորաբար պոլիամիդ): Քաղցկեղի աղերի հետ միասին, հանվում են այլ աղերի մեծ մասը: Մաքրման արդյունավետությունը կարող է հասնել 99.9% -ի:
Կան նանֆիլտրացիան (մեմբրանի անցքերի անվանական տրամագիծը հավասար է նանոմետրերի միավորներին) եւ picofiltration- ը (մեմբրանի անցքերի անվանական տրամագիծը հավասար է picometers- ի միավորներին):
Քանի որ այս մեթոդի թերությունները պետք է նշել.
Հակադարձ osmosis մեմբրանին մատակարարված ջրի նախնական բուժման անհրաժեշտությունը;
Արտադրված 1 լիտր ջրի համեմատաբար բարձր արժեքը (թանկարժեք սարքավորումներ, թանկարժեք մեմբրաններ);
Արտադրված ջրի ցածր հանքայնացում (հատկապես picofiltration): Ջուրը գրեթե թափվում է:
Էլեկտրոդիալիզ Այն հիմնված է էլեկտրական դաշտի գործողությունների վրա ջրից աղերի հեռացման վրա: Լուծվող նյութերի իոնների հեռացումը տեղի է ունենում հատուկ թաղանթների շնորհիվ: Ճիշտ ինչպես հակադարձ osmosis տեխնոլոգիայի կիրառմամբ, այլ աղերի հեռացումը, բացի կարծրություն իոններից, տեղի է ունենում:
Ամբողջովին մաքուր ջուրը, կարծրության աղերից, կարող է թորվել:
