Συστατικά ασβεστίου και μαγνησίου
Έτσι, έχοντας διαπιστώσει χθες πόσο ασβέστιο περιέχεται στο θρυμματισμένο κέλυφος των αυγών, προέκυψε το ερώτημα "να πίνεις ή να μην πιεις;". Όπως και οι περισσότεροι άντρες, έρχομαι με τα πάντα από επιστημονική άποψη και μέχρι να το δω μόνος μου, να μάθω, να ελέγξω, να αισθανθώ μια λέξη για μια γυναίκα. Ως εκ τούτου, θα μοιραστώ τις σκέψεις μου με βάση τις πληροφορίες που βρέθηκαν για το κέλυφος των αυγών και το ασβέστιο.
Η συλλογή πληροφοριών στο Διαδίκτυο σχετικά με τη χρήση του κελύφους αυγών ως πρόσθετο τροφίμων πέρασε από τις κρίσιμες παρατηρήσεις των γιατρών ότι το ανθρακικό ασβέστιο που περιέχεται στο κέλυφος αυγών είναι αδιάλυτο στο νερό και ως εκ τούτου δεν μπορεί να απορροφηθεί από το σώμα.
Επιπλέον, η ιστορία του συζύγου του φίλου μου υπενθυμίστηκε ότι κατά τη διάρκεια της εγκυμοσύνης, είπε στον γιατρό της, ο οποίος είχε παρατηρήσει ότι έβγαζε κομματιασμένα αυγά - ο γιατρός την αποθάρρυνε και συνταγογράφησε κάποιο είδος συμπλόκου που περιέχει ασβέστιο.
Πού είναι η αλήθεια;
Πράγματι, το ανθρακικό ασβέστιο CaCO3 (ακριβώς σε αυτόν τον τύπο, το ασβέστιο βρίσκεται στο κέλυφος των αυγών) είναι αδιάλυτο σε νερό και αλκοόλ.
Μια πραγματικά απαραίτητη προϋπόθεση για την απορρόφηση ασβεστίου είναι η υδατοδιαλυτότητα.
Αλλά θυμηθείτε ότι η βάση της πέψης μας είναι το υδροχλωρικό οξύ που εκκρίνεται στο στομάχι.
Και αυτό συμβαίνει στο στομάχι μας:
CaC03 + 2HCl (υδροχλωρικό οξύ) = CaCI2 (χλωριούχο ασβέστιο) + Co2 + Η20
Αλλά το χλωριούχο ασβέστιο είναι απόλυτα διαλυτό στο νερό !!! Είναι σε αυτή τη μορφή ότι το ασβέστιο απορροφάται!
Δεν γνωρίζω τους γιατρούς; Ή είναι απλά πονηρά και μας πουλούν φάρμακα!
Επιπλέον, κατά τη διάρκεια αυτής της αντίδρασης, παρατηρείται μείωση της γαστρικής οξύτητας. Αυτό που είναι σημαντικό για τους ανθρώπους που πάσχουν από υψηλή οξύτητα.
Ένα παράδειγμα είναι η σύζυγός μου, έχει υψηλή οξύτητα και παίρνει ένα μικρό θρυμματισμένο κέλυφος κάθε μέρα και αυτό λύει δύο προβλήματα ταυτόχρονα και αντισταθμίζει την έλλειψη ασβεστίου και μειώνει την οξύτητά της. Αλλά η σκόνη του κελύφους αυγού σβήστηκε χυμό λεμονιού δεν μπορεί να πίνει - υπάρχει ναυτία! Και τώρα καταλαβαίνω γιατί.
Όπως είδαμε παραπάνω, η απορρόφηση ασβεστίου από ανθρακικό ασβέστιο απαιτεί γαστρικό χυμό με υψηλή οξύτητα.
Στην πραγματική ζωή, πολύ συχνά συμβαίνει μια κατάσταση όταν η οξύτητα του στομάχου είναι χαμηλή ή μηδενική. Αυτή η κατάσταση είναι ιδιαίτερα χαρακτηριστική για τους ηλικιωμένους, όταν η ανάγκη για ασβέστιο είναι ιδιαίτερα υψηλή για την πρόληψη της οστεοπόρωσης. Για παράδειγμα, μετά από 50 χρόνια, η χαμηλή οξύτητα εμφανίζεται σε περίπου 40% των ανθρώπων. Υπό αυτές τις συνθήκες, η απορρόφηση του ανθρακικού ασβεστίου, που απαιτεί τη διάλυση του υδροχλωρικού οξέος στο στόμαχο, πέφτει στο 2%.
Ίσως αυτή να είναι η απάντηση γιατί οι ηλικιωμένοι είναι πιο πιθανό να υποφέρουν από ασθένειες που συνδέονται με έλλειψη ασβεστίου - απλώς δεν μπορούν να τις αφομοιωθούν με τη συνήθη μορφή τους.
Τώρα εξετάστε γιατί πολλές συνταγές για τη λήψη θρυμματισμένο κέλυφος των αυγών συνιστάται να το σβήσετε με χυμό λεμονιού.
Όταν προσθέτουμε χυμό λεμονιού στο θρυμματισμένο κιτρικό οξύ, το ανθρακικό ασβέστιο (CaCo3) αντιδρά με κιτρικό οξύ (C6H8O7) και παίρνουμε κιτρικό ασβέστιο (Ca3 (C6H5O7) 2):
2C6H8O7 + 3CaCO3 = Ca3 (C6H5O7) 2 + 3CO2 + 3Η2Ο
Εδώ είναι. Και η απορρόφηση του κιτρικού ασβεστίου, που δεν απαιτεί υδροχλωρικό οξύ στο στομάχι, είναι 44%. Ως αποτέλεσμα, υπό συνθήκες χαμηλής οξύτητας, το κιτρικό ασβέστιο εισέρχεται στο σώμα σε 11 φορές περισσότερο ασβέστιο απ 'ότι από το ανθρακικό!
Και το κιτρικό ασβέστιο είναι ήδη ένα γνωστό φάρμακο που μας πωλείται για χρήματα! Και το κάνουν, μόνο που δεν χρησιμοποιούν χυμό λεμονιού, αλλά κιτρικό οξύ!
Παρεμπιπτόντως, το ανθρακικό ασβέστιο (τεμαχισμένο κέλυφος) είναι ένα καταχωρισμένο πρόσθετο τροφίμων. E170, και το κιτρικό ασβέστιο (τεμαχισμένο κέλυφος αυγού χυμένο με χυμό λεμονιού) είναι ένα καταχωρισμένο πρόσθετο τροφίμων. Ε333! Και προστίθενται σε πολλά τρόφιμα, ειδικά γαλακτοκομικά προϊόντα, συμπεριλαμβανομένου του γάλακτος, για την αύξηση του ποσοστού ασβεστίου!
Γιατί λοιπόν να πληρώσετε περισσότερα!
Συμπέρασμα, εάν έχετε υψηλή οξύτητα - ίσως είναι καλύτερο να χρησιμοποιήσετε απλά τεμαχισμένα κοχύλια αυγών, εάν η οξύτητα είναι χαμηλότερη, είναι πιθανό καλύτερα να σβήσετε την κέλυφος αυγού με χυμό λεμονιού.
Και περισσότερο,
Τη νύχτα, υπάρχει επιταχυνόμενη απελευθέρωση μεταλλικών αλάτων από το σώμα (κιρκαδική επιτάχυνση των απορροφητικών διεργασιών στο οστούν). Επομένως, τα παρασκευάσματα ασβεστίου πρέπει να ληφθούν μετά το μεσημεριανό γεύμα και το βράδυΑυτό θα αποτρέψει την επιταχυνόμενη απώλεια ασβεστίου στο δεύτερο μισό της νύχτας, ειδικά με το μειωμένο επίπεδο (ή απουσία) στο έντερο. Επισημαίνεται επίσης η αρνητική δοσοεξαρτώμενη επίδραση της φαρμακοθεραπευτικής δράσης του ασβεστίου: σε χαμηλές δόσεις αυτό το biometall απορροφάται καλύτερα από το υψηλό.
Σε σχέση με αυτό πιο λογικό να πάρει το φάρμακο αρκετές φορές την ημέρα.
Διαβάζουμε, συζητάμε. Ακολουθούν μερικά άρθρα σχετικά με αυτό το θέμα.
__________________________________________________________________________________________________________
Κιτρικό ασβέστιο έναντι ανθρακικού ασβεστίου
Πηγή του< http://www.ortho.ru/77_KMD/Ca_Sravni.htm >
_________________________________________________________________________________________________________
Κιτρικό ασβέστιο.
Το κιτρικό ασβέστιο είναι μια εξαιρετική πηγή απορροφημένου ασβεστίου, το οποίο παίζει πολύ σημαντικό ρόλο στο σώμα, επειδή επηρεάζει πολλές ενζυματικές διεργασίες και πήξη αίματος. Η ανεπάρκεια ασβεστίου οδηγεί σε εύθραυστα οστά και οστεοπόρωση. Για τα μικρά παιδιά, είναι καλό για την οδοντική υγεία · οι ενήλικες χρειάζονται τακτική πρόσληψη ασβεστίου για να σταθεροποιήσουν την αρτηριακή πίεση.
Σύμφωνα με το Εθνικό Ινστιτούτο Καρκίνου (ΗΠΑ), το συμπλήρωμα Ε-333 μπορεί δυνητικά να αποτρέψει τον καρκίνο του παχέος εντέρου και άλλους καρκίνους. Επιπλέον, τα κιτρικά ασβέστιο χρησιμοποιούνται στην ιατρική για την απομάκρυνση βαρέων μετάλλων από το σώμα.
Δεδομένου ότι το κιτρικό ασβέστιο είναι μία από τις σημαντικότερες μορφές μεταφοράς του ασβεστίου στο ανθρώπινο σώμα, χρησιμοποιείται στην ιατρική μαζί με λιγότερο αποτελεσματικό ανθρακικό ασβέστιο (πρόσθετο Ε-170) για την αναπλήρωση των αποθεμάτων ασβεστίου στο σώμα. Για τον ίδιο λόγο, το κιτρικό ασβέστιο χρησιμοποιείται με τη μορφή συμπληρωμάτων διατροφής (συμπληρώματα διατροφής).
Στη βιομηχανία τροφίμων, το πρόσθετο E-333 χρησιμοποιείται ως σταθεροποιητής, συντηρητικό, ρυθμιστής οξύτητας, σταθεροποιητής χρώματος.
Ως σταθεροποιητής, το πρόσθετο τροφίμων Ε-333 χρησιμοποιείται στην παρασκευή συμπυκνωμένου γάλακτος, κρέμας, τυριού κρέμας. Στις μαρμελάδες, τα ζελέ και τα κονσερβοποιημένα φρούτα, το πρόσθετο E-333 χρησιμοποιείται ως ρυθμιστής οξύτητας. Τα κιτρικά ασβέστιο χρησιμοποιούνται επίσης ευρέως για τον εμπλουτισμό του ασβεστίου στο γάλα και τα γαλακτοκομικά προϊόντα, τα προϊόντα αρτοποιίας και αλευριού και τα αναψυκτικά.
Στην εμφάνιση, το κιτρικό ασβέστιο είναι μια λευκή σκόνη με έντονη ξινή γεύση. Διαλυτό στο νερό. Μοριακός τύπος κιτρικού ασβεστίου: Ca3 (C6H5O7) 2. Πάρτε E-333 από την αλληλεπίδραση του κιτρικού οξέος με υδροξείδιο του ασβεστίου.
Ιδιότητες και τεχνολογικές λειτουργίες:
Πιθανά ονόματα συμπληρωμάτων διατροφής:
- Ε-333
- Ε-333
- Κιτρικό ασβέστιο
- Κιτρικό ασβέστιο
- Κιτρικό μονοκαρβονικό
- Κιτρικό νάτριο
- Κιτρικό τριασβέστιο
_____________________________________________________________________________________________
Το κιτρικό ασβέστιο
Στα μέσα του εικοστού αιώνα. ξεκίνησε ένα είδος "έκρηξης": βιοχημικοί, φυσιολόγοι, βιοφυσικοί, φαρμακολόγοι και κλινικοί γιατροί άρχισαν να δείχνουν αυξημένο ενδιαφέρον για τη μελέτη του ρόλου του ασβεστίου στη ρύθμιση της δραστηριότητας των οργάνων και των συστημάτων του σώματος. Τα ιόντα ασβεστίου έχουν βρεθεί ότι εμπλέκονται στη διέγερση και συστολή μυϊκών κυττάρων, στην ρύθμιση της διαπερατότητας των κυτταρικών μεμβρανών, στις ενδοκυτταρικές αλληλεπιδράσεις, στην πήξη του αίματος, στην έκκριση ορμονών, στους μεσολαβητές, στα ένζυμα. εκτελούν τη λειτουργία ενός μετατροπέα σήματος που εισέρχεται στο κύτταρο, συμμετέχουν στις διαδικασίες ρύθμισης του ενδοκυτταρικού μεταβολισμού, συμπεριλαμβανομένης της ενέργειας. Στην επιφάνεια της μεμβράνης των καρδιομυοκυττάρων και των αγγείων των ελεύθερων ιόντων ασβεστίου είναι 1000 φορές περισσότερο από ό, τι στο κυτοσόλιο των κυττάρων. Από τον εξωκυτταρικό χώρο διεισδύουν στο κυτταρόπλασμα μέσω ειδικών διαύλων ασβεστίου, επηρεάζοντας διάφορες φυσιολογικές διεργασίες και λειτουργίες των κυττάρων όλων των οργάνων, τον αγγειακό τόνο, την ένταση της συστολής, τη διάσταση.
Το ασβέστιο διαδραματίζει σημαντικό ρόλο στο σχηματισμό του οστικού ιστού και στη διατήρηση της κανονικής δομής και λειτουργίας του. Μαζί με ειδικές πρωτεΐνες, τα ιόντα ασβεστίου παρέχουν σκληρότητα και ελαστικότητα οστών.
Όλα αυτά χρησίμευαν ως θεωρητικό υπόβαθρο για την ανάπτυξη και εισαγωγή παρασκευασμάτων ασβεστίου με βάση τα άλατά τους στην ιατρική πρακτική. Σήμερα, στην ιατρική πρακτική, χρησιμοποιούνται άλατα ασβεστίου όπως γλυκεροφωσφορικό, γλυκονικό, ανθρακικό, γαλακτικό, κιτρικό, χλωριούχο, φωσφορικό και πολλά άλλα.
Η φαρμακοκινητική του φαρμάκου CALCIUM CITRATE έχει τα δικά του χαρακτηριστικά. Το ασβέστιο απορροφάται από το έντερο σε διαλυτή, ιονισμένη μορφή. Η διάλυση του φαρμάκου εμφανίζεται καλύτερα στο όξινο περιβάλλον του στομάχου. Το διαλυμένο ιονισμένο ασβέστιο διεισδύει καλά σε όλους τους ιστούς, διεισδύει στο φραγμό του πλακούντα, διέρχεται στο μητρικό γάλα. Εκκρίνεται κυρίως στα κόπρανα, περίπου το 20% - με τα ούρα. Ένα σημαντικό χαρακτηριστικό του κιτρικού ασβεστίου είναι η χαμηλή ικανότητα σχηματισμού λίθων νεφρών, η οποία είναι σημαντική με τη μακροπρόθεσμη χρήση αυτού του αλατιού. Αυτό οφείλεται στο γεγονός ότι το κιτρικό άλας μειώνει την ποσότητα του οξαλικού στα ούρα.
Η βιοδιαθεσιμότητα καθορίζεται από την ταχύτητα και την έκταση στην οποία δραστικό συστατικό που απορροφάται από τη μορφή δοσολογίας, καθίσταται διαθέσιμη στη θέση της προβλεπόμενης θεραπευτικής δράσης.
Τη νύχτα, υπάρχει επιταχυνόμενη απελευθέρωση μεταλλικών αλάτων από το σώμα (κιρκαδική επιτάχυνση των απορροφητικών διεργασιών στο οστούν). Επομένως, τα παρασκευάσματα ασβεστίου θα πρέπει να ληφθούν μετά το μεσημεριανό γεύμα και το βράδυ, πράγμα που θα αποτρέψει την επιταχυνόμενη απώλεια ασβεστίου στο δεύτερο μισό της νύχτας, ειδικά με το μειωμένο επίπεδο (ή απουσία) στο έντερο. Αναγνωρίζεται η αρνητική δοσοεξαρτώμενη επίδραση της φαρμακοθεραπευτικής δραστηριότητας του ασβεστίου: αυτό το βιομερές απορροφάται καλύτερα σε χαμηλές δόσεις σε σχέση με τις υψηλές δόσεις. Από αυτή την άποψη, είναι πιο λογικό να παίρνετε το φάρμακο πολλές φορές την ημέρα. Για διαφορετικές ηλικιακές ομάδες υπάρχουν διαφορετικοί φυσιολογικοί κανόνες πρόσληψης ασβεστίου (πίνακας).
Πίνακας
Η συνιστώμενη δόση πρόσληψης ασβεστίου σε άτομα διαφορετικών ηλικιών
(σύμφωνα με την Καναδική Εταιρεία Οστεοπόρωσης)
Η βιταμίνη D, το υδροχλωρικό οξύ, η λακτόζη, το κιτρικό οξύ, η παρουσία πρωτεΐνης στα τρόφιμα, ο φώσφορος, το μαγνήσιο, καθώς και ορισμένα τρόφιμα όπως το βούτυρο, τα αυγά, το γάλα, τα ψάρια, το λίπος γάδου, το λάχανο κ.λπ., συμβάλλουν στην απορρόφηση ιόντων ασβεστίου.
Η απορρόφηση ασβεστίου επιδεινώνεται: η έλλειψη πρωτεϊνών στα τρόφιμα, η αυστηρή τήρηση της χορτοφαγικής διατροφής, η έλλειψη μαγνησίου, ο φώσφορος, τα τρόφιμα πλούσια σε οξαλικό οξύ (κόνδυλος, ραβέντι, σπανάκι).
Η απορρόφηση ασβεστίου επιβραδύνεται στις ασθένειες των πεπτικών οργάνων (γαστρίτιδα, εντερίτιδα, κολίτιδα, πεπτικό έλκος), πάγκρεας (διαβήτης, παγκρεατίτιδα), παθολογίες άλλων ενδοκρινικών οργάνων.
Θα πρέπει να τονιστεί ότι ορισμένα φάρμακα, ειδικά τα γλυκοκορτικοειδή, τα ορμονικά αντισυλληπτικά φάρμακα για συστηματική χρήση, η λεβοθυροξίνη επιδεινώνουν επίσης την απορρόφηση των ιόντων ασβεστίου.
Σύμφωνα με τα αποτελέσματα της επιστημονικής έρευνας (στοιχεία της καναδικής κοινωνίας για την οστεοπόρωση), δεν υπάρχουν πειστικά στοιχεία βάσει των οποίων μπορεί να συνιστάται η πρόσθετη κατανάλωση άλλων ορυκτών (μαγνήσιο, ψευδάργυρος, χαλκός κλπ.) Για την πρόληψη ή τη θεραπεία της οστεοπόρωσης.
Τα αποτελέσματα των κλινικών μελετών που πραγματοποιήθηκαν στην Ουκρανία και σε άλλες χώρες επιβεβαίωσαν την υψηλή αποτελεσματικότητα αυτού του φαρμάκου στη θεραπεία πολλών ασθενειών. Το κιτρικό ασβέστιο χρησιμοποιείται επίσης για προφυλακτικούς σκοπούς σε διάφορες ασθένειες.
Με την οστεοπόρωση στους ηλικιωμένους, οστεομαλάκτωση CALCIUM CITRATE συνταγογραφείται 2-6 δισκία ημερησίως, διαιρώντας την ημερήσια δόση σε 3-4 δόσεις. Το φάρμακο λαμβάνεται πριν από τα γεύματα ή 1-1,5 ώρες μετά το γεύμα, για 3 μήνες. Σε αυτούς τους ασθενείς θα πρέπει επίσης να συνταγογραφείται βιταμίνη D3 400-800 IU ανά ημέρα και επίσης να συμπεριλαμβάνει λάδι, γάλα, ψάρι και αυγά στη διατροφή.
Το CITRATE CALCIUM είναι η βέλτιστη μορφή δοσολογίας για την παροχή ασβεστίου όχι μόνο για ενήλικες, αλλά και για παιδιά και εφήβους, καθώς βοηθά στην αύξηση της οστικής πυκνότητας, στην αύξηση της οστικής μάζας, στην ενίσχυση της οδοντίνης και του σμάλτου των δοντιών. Τα παιδιά κάτω των 6 μηνών συνταγογραφούνται 1/2 δισκία (250 mg) (θρυμματισμένα, διαλυμένα σε μικρή ποσότητα γάλακτος), σε ηλικία 6-12 μηνών - επίσης 1/2 δισκία 2 φορές την ημέρα, σε ηλικία 1 έτους - 10 έτη - 1-2 δισκία ηλικίας 10-18 ετών - 2-3 δισκία ημερησίως.
Ενδείξεις για το διορισμό Το κιτρικό ασβέστιο είναι:
υπασβεστιαιμία λόγω αιμορραγίας διαφορετικής προέλευσης, καθώς και κατά τη διάρκεια της εγκυμοσύνης και της γαλουχίας, με τραυματισμούς - για την κάλυψη της αυξημένης ανάγκης του σώματος για ιόντα ασβεστίου.
παραβίαση της απορρόφησης ασβεστίου σε ασθένειες της πεπτικής οδού και αυξημένο επίπεδο έκλυσης ασβεστίου μέσω των νεφρών και των εντέρων.
υποαθυρεοειδισμό, αφυδάτωση ενός οργανισμού διαφορετικής γένεσης, αλλεργικές παθήσεις και αλλεργικές επιπλοκές κατά τη λήψη φαρμάκων, αυξημένη διαπερατότητα των αγγειακών τοιχωμάτων, μειωμένη πήξη του αίματος.
Το CITRATE CALCIUM πρέπει να συνταγογραφείται όταν λαμβάνετε γλυκοκορτικοειδή, από του στόματος αντισυλληπτικά, λεβοθυροξίνη. Στις τρεις τελευταίες περιπτώσεις, το φάρμακο λαμβάνεται 1 δισκίο 6 φορές την ημέρα μετά τα γεύματα.
Το κιτρικό ασβέστιο, κατά κανόνα, είναι καλά ανεκτό, μερικές φορές δυσπεπτικά συμπτώματα (δυσκοιλιότητα ή διάρροια, ναυτία, έμετος, απώλεια όρεξης, κοιλιακό άλγος), μπορεί να εμφανιστεί πολυουρία.
Η ταυτόχρονη χρήση του CALCIUM CITRATE με αντιόξινα που περιέχουν αλουμίνιο δεν συνιστάται λόγω της μείωσης της αποτελεσματικότητάς τους. Δεν είναι επιθυμητό να συνταγογραφείται ταυτόχρονα με άλλα παρασκευάσματα ασβεστίου.
Συμπερασματικά, μπορούμε να σημειώσουμε τις θετικές φαρμακολογικές ιδιότητες του CITRATE CALCIUM:
το κιτρικό άλας ασβεστίου διαλύεται καλά και απορροφάται στο πεπτικό σύστημα, πράγμα που οδηγεί σε καλή απορρόφηση του ασβεστίου στο σώμα και, συνεπώς, στην αποτελεσματικότητα του φαρμάκου στην προφυλακτική ή θεραπευτική εφαρμογήγεγονός που επιβεβαιώνεται από τα αποτελέσματα πολλών κλινικών μελετών.
Ο χαμηλός κίνδυνος σχηματισμού λίθων στους νεφρούς κατά τη λήψη του φαρμάκου αυξάνει την τιμή του θειικού ασβεστίου με παρατεταμένη χρήση.
I.S. Chekman, Επικεφαλής του Τμήματος Φαρμακολογίας με την πορεία της Κλινικής Φαρμακολογίας του Εθνικού Ιατρικού Πανεπιστημίου, Ανώτατο Μέλος της Εθνικής Ακαδημίας Επιστημών και της Ακαδημίας Ιατρικών Επιστημών της Ουκρανίας, Επίτιμος Εργάτης Επιστήμης και Τεχνολογίας, Καθηγητής
Σελίδα 1
Η αντίδραση ανθρακικών με οξέα μπορεί να χρησιμοποιηθεί ως δείγμα ανθρακικών αλάτων. Το ανθρακικό οξύ είναι ένα πολύ αδύναμο και ασταθές οξύ. Μπορεί να αφαιρεθεί από τα άλατά της με τη δράση λιγότερο ασταθών και ισχυρότερων οξέων.
Παρομοίως, οι αντιδράσεις ανθρακικού ασβεστίου με οξέα προχωρούν.
Η αντίδραση του ανθρακικού με υδροχλωρικό οξύ δίνει χλωριούχο ασβέστιο και χλωριούχο μαγνήσιο, τα οποία διαλύονται καλά στο νερό και παραμένουν στη μορφή διαλύματος διαφορετικών συγκεντρώσεων. Ο ρυθμός αντίδρασης στους συλλέκτες αυτού του τύπου εξαρτάται κυρίως από την πίεση και τη θερμοκρασία.
Ως αποτέλεσμα της αντίδρασης ανθρακικού με υδροχλωρικό οξύ χλωριούχου ασβεστίου και μαγνήσιο, καλά διαλυτό στο νερό και παραμένοντας στη μορφή διαλύματος διαφορετικών συγκεντρώσεων.
Η εισαγωγή μη ξηραμένου ανθρακικού νατρίου στην αντίδραση απαιτεί υψηλότερη πίεση και αύξηση της ποσότητας του καταλύτη.
Επεξήγηση των αναφερόμενων ή παρατηρηθέντων φαινομένων: γιατί η αντίδραση ανθρακικού ασβεστίου με θειικό οξύ ξεκινά από την αρχή βίαια και στη συνέχεια σταματά. Γιατί όταν εξατμιστεί από το σωλήνα θερμαινόμενη ξηρή ουσία ανθρακικού αμμωνίου.
Η ευεργετική επίδραση του ανθρακικού ασβεστίου στη σταθερότητα του τσιμέντου Portland μπορεί να εξηγηθεί από την αντίδραση του ανθρακικού άλατος με μεταλλεύματα κλίνκερ που περιέχουν αλουμίνιο. Έτσι, το συστατικό αργιλικού άλατος της πέτρας τσιμέντου δεσμεύεται χημικά πριν έρθει σε επαφή με τα θειικά του περιβάλλοντος.
Ορισμένες εφαρμογές ανθρακικού βαρίου βασίζονται στην πρακτική αδιαλυτότητα του θειικού βαρίου, που σχηματίζεται από την αντίδραση ανθρακικού βαρίου με ουσίες που περιέχουν θειικά ιόντα. Έτσι, όταν ξήρανση ενός τούβλου πριν από την καύση, λευκή άνθιση εμφανίζεται στην επιφάνεια του, που προκαλείται από την κρυστάλλωση του γύψου ή θειικού μαγνησίου που περιέχονται στον πηλό. Για να αποφευχθεί αυτό, το ανθρακικό βάριο προστίθεται στον πηλό, πράγμα που προκαλεί καθίζηση του θειικού ιόντος.
Στην εισαγωγή του στην χημεία των στερεών, Hedwal, ως παράδειγμα μιας θεωρητικά πιθανής αντίδρασης, έχει ως αποτέλεσμα την αντίδραση του ανθρακικού ασβεστίου με SiO2, που έχει ως αποτέλεσμα τον σχηματισμό πυριτικού ασβεστίου. Συνοδεύει αυτό το παράδειγμα επισημαίνοντας ότι με τις αποκαλούμενες γεωθερμικές μεταμορφώσεις η συνηθισμένη θερμοκρασία δεν είναι αρκετή, αφού η αντίδραση μεταξύ ανθρακικού ασβεστίου και πυριτικού οξέος μπορεί να παρατηρηθεί σε εργαστηριακές συνθήκες μόνο σε θερμοκρασίες 500 C.
Για να μειωθεί το κόστος του σχηματισμού φλέγματος σε αυτή τη διαδικασία, οι Klima και Ward πρότειναν να χρησιμοποιηθούν διαλύματα ανθρακικού αμμωνίου (αντί νιτρικού αμμωνίου) και να δημιουργηθεί φλύγμα εξαιτίας της αντίδρασης εμπλουτισμένου ανθρακικού αμμωνίου με ασβέστη.
Καθώς αυξάνεται η θερμοκρασία, η αντίδραση μετατοπίζεται προς το σχηματισμό ενός περισσότερο αλκαλικού πυριτικού άλατος. Gibson και Ward11 για την αντίδραση ανθρακικού νατρίου με χαλαζία σε θερμοκρασία από 726 έως 805 ° C σε ρεύμα αζώτου έδειξε ότι σχηματίζεται ορθο-πυριτικό με την παρουσία επαρκούς ποσότητας ανθρακικού νατρίου. Ο ρυθμός αντίδρασης εξαρτάται από τον χρόνο, το μέγεθος του δείγματος, την ταχύτητα ροής αερίου και τη σύνθεση του μίγματος αντίδρασης. Οι Gibson και Ward υποστηρίζουν ότι υπάρχουν πυριτικά άλατα μεσαίου βαθμού.
Η περίσσεια ανθρακικού νατρίου τιτλοδοτείται με υδροχλωρικό οξύ. Η ποσότητα θείου στο προϊόν που αναλύεται υπολογίζεται με την ποσότητα ανθρακικού νατρίου που αντιδρά.
Και ανθρακικό ασβέστιο και πώς αυτές οι χημικές ενώσεις αλληλεπιδρούν.
Ανθρακικό ασβέστιο
CaCO3 πλέγμα ανθρακικού ασβεστίουΤο CaCO3 είναι ένα πολύ συνηθισμένο μίγμα στον κόσμο που αποτελείται από: κιμωλία, ασβεστόλιθο, μάρμαρο, κλπ. Ως εκ τούτου, αξίζει να σημειωθεί ότι ο ρόλος αυτής της ουσίας για τους ανθρώπους είναι πολύ σημαντικός, επειδή το ανθρακικό ασβέστιο χρησιμοποιείται ευρέως στη βιομηχανία τροφίμων, ως φυσική λευκή βαφή. Το CaCO3 χρησιμοποιείται επίσης στην κατασκευή χαρτιού, πλαστικών, στην κατασκευή και σε πολλές άλλες περιοχές.
Το ανθρακικό ασβέστιο είναι μια λευκή ουσία (στερεοί κρύσταλλοι) σε σκόνη ή στερεά μορφή. Είναι σε θέση να αντιδράσει με το νερό, αλλά όχι εντελώς διαλυμένο σε αυτό. Ως εκ τούτου, το νερό γίνεται θολό, και υπάρχει ένα λευκό ίζημα σε αυτό. Αλλά αν η αντίδραση με νερό θα λάβει χώρα παρουσία, τότε θα έχουμε ένα διαλυτό όξινο άλας, όξινο ανθρακικό ασβέστιο:
CaCO3 + C02 + H20 - Ca (HCO3)
Εξετάστε πώς γίνεται το ανθρακικό ασβέστιο.
Το μεγαλύτερο μέρος του ανθρακικού ασβεστίου λαμβάνεται από φυσικές πηγές. Έτσι, για να πάρει το ανθρακικό ασβέστιο για, κατά κανόνα, χρησιμοποιούν μια καθαρή πηγή, συχνά μάρμαρο.
 Το μαρμάρινο άγαλμα του Δαβίδ από τον Μιχαήλ Αγγέλο Μπουναρότι
Το μαρμάρινο άγαλμα του Δαβίδ από τον Μιχαήλ Αγγέλο Μπουναρότι
Αλλά σε εργαστηριακές συνθήκες, το ανθρακικό ασβέστιο μπορεί να ληφθεί με την πύρωση του οξειδίου του ασβεστίου. Η φρύξη αναφέρεται στην γενικευμένη έννοια της καύσης, με αποτέλεσμα οι χημικές ουσίες να αποκτούν νέες ιδιότητες. Η πυρκαγιά εκτελείται σε επαρκώς υψηλή θερμοκρασία, χωρίς να φτάνει σε τήξη.
Το νερό αναμιγνύεται με το προκύπτον οξείδιο του ασβεστίου, η αντίδραση παράγει υδροξείδιο. Στη συνέχεια, οι τεχνικοί παίρνουν το διοξείδιο του άνθρακα, το οποίο περνά μέσα από το προηγουμένως ληφθέν διάλυμα. Το σχηματισθέν ίζημα είναι ανθρακικό ασβέστιο:
CaO + Η2Ο = Ca (ΟΗ);
Ca (OH) + C02 = CaC03 + Η2Ο
Εάν θερμάνουμε το αλάτι του ανθρακικού οξέος και του ασβεστίου σε υψηλή θερμοκρασία (900 - 1000 ° C), τότε ως αποτέλεσμα της χημικής διαδικασίας θα πάρουμε το διοξείδιο του άνθρακα (διοξείδιο του άνθρακα), καθώς και το οξείδιο του ασβεστίου CaO -
CaCO3 = CaO + C02
Αν η θερμοκρασία είναι ακόμα υψηλότερη (1500 ° C), τότε τα προϊόντα αντίδρασης θα είναι καρβίδιο ασβεστίου και μονοξείδιο του άνθρακα.
Υδροχλωρικό οξύ
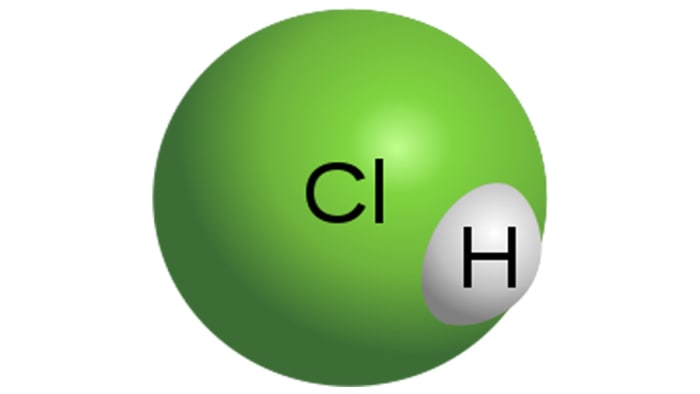 Μόριο υδροχλωρικού οξέος
Μόριο υδροχλωρικού οξέος
Το HCl είναι ένα ισχυρό μονοβασικό οξύ, το οποίο λαμβάνεται με διάλυση υδροχλωρίου σε νερό. Είναι ένα άχρωμο υγρό, αν και το τεχνικό οξύ μπορεί να έχει κίτρινη απόχρωση, για παράδειγμα, λόγω της ακαθαρσίας του σιδήρου. Οι ιδιότητες του HCl εξαρτώνται άμεσα από τη συγκέντρωση του υδροχλωρίου στο διάλυμα.
Τα άλατα του υδροχλωρικού οξέος ονομάζονται χλωρίδια. Αυτή η ουσία είναι πολύ καυστική, συνεπώς, απαιτεί προσεκτικό χειρισμό: ακόμα και αν πέσει μικρή ποσότητα σταγόνα στο δέρμα, τότε δεν μπορεί να αποφευχθεί ένα ισχυρό χημικό έγκαυμα. Επομένως, όταν εργάζεστε με ισχυρά οξέα, συνιστάται πάντα να μεταφέρετε μαζί σας τα εξουδετερωτικά: αδύναμα αλκαλικά διαλύματα, (σόδα ψησίματος) κ.λπ. Αξίζει να θυμηθούμε ότι όταν ανοίγουμε ένα δοχείο με συμπυκνωμένο όξινο HCl, σχηματίζονται ατμοί οι οποίοι επηρεάζουν δυσμενώς τα μάτια και το αναπνευστικό σύστημα. Ως εκ τούτου, σε χημικά πειράματα, θα ήταν καλύτερο να χρησιμοποιήσετε έναν αναπνευστήρα και γυαλιά.
Λήψη υδροχλωρικού οξέος
Το αέριο υδροχλώριο διαλύεται σε νερό. Το ίδιο το υδρογόνο λαμβάνεται ως εξής: το υδρογόνο καίγεται σε χλώριο, λαμβάνοντας έτσι ένα συνθετικό οξύ. Εναλλακτικά, μπορεί να ληφθεί υδροχλωρικό οξύ χρησιμοποιώντας πλευρικά αέρια, τα οποία λαμβάνονται σε έναν αριθμό χημικών πειραμάτων, για παράδειγμα, όταν οι χλωριωμένοι υδρογονάνθρακες είναι χλωριωμένοι. Το οξύ που λαμβάνεται κατ 'αυτόν τον τρόπο ονομάζεται αγκαθιστικό.
Εφαρμόστε υδροχλωρικό οξύ στην ιατρική, τη βιομηχανία και επίσης για τις χημικές αντιδράσεις.
Το άχρωμο οξύ με έντονη οσμή υδροχλωρίου αντιδρά καλά με μέταλλα. Η αντίδραση οξειδοαναγωγής λαμβάνει χώρα. Οι αναγωγικοί παράγοντες στη διαδικασία της αντίδρασης είναι άτομα μετάλλων και οι οξειδωτικοί παράγοντες είναι κατιόντα υδρογόνου.
Κυρίως χημικές αντιδράσεις με μέταλλα συνοδεύονται από την απελευθέρωση υδρογόνου. Η ένταση της αλληλεπίδρασης εξαρτάται από τη δραστηριότητα του μετάλλου, για παράδειγμα, το αλκαλιμέταλλο λιθίου αντιδρά βίαια, ενώ η αντίδραση με το αργίλιο είναι ασθενής λόγω του ισχυρού φιλμ οξειδίου αυτού του στοιχείου.
Υδροχλωρικό οξύ και ψευδάργυρος:
2HCl + Zn = ZnCl2 + Η2
Υδροχλωρικό οξύ και σίδηρος:
2HCl + Fe = FeCl2 + Η2
Υδροχλωρικό οξύ και μαγνήσιο:
2HCl + Mg = MgCl2 + Η2
 Χλωριούχο μαγνήσιο, που χρησιμοποιείται για τον καθαρισμό των δρόμων από τον πάγο
Χλωριούχο μαγνήσιο, που χρησιμοποιείται για τον καθαρισμό των δρόμων από τον πάγο
Με οξείδια μετάλλων, το οξύ σχηματίζει άλας και νερό:
CuO + 2ΗCl = CuCl2 + Η2Ο
Αντίδραση υδροχλωρικού οξέος και ανθρακικού ασβεστίου
Για το πείραμα θα χρειαστεί:
δοκιμαστικό σωλήνα.
χημική πιπέτα.
στερεό ανθρακικό ασβέστιο (μάρμαρο);
υδροχλωρικό οξύ.
γάντια.
αναπνευστήρα.
Προσοχή! Μην δοκιμάσετε μόνοι σας αυτήν την εμπειρία!
Πραγματοποιήστε το πείραμα σε καλά αεριζόμενο χώρο, προσέξτε όταν εργάζεστε με υδροχλωρικό οξύ.
Προσθέστε μερικά κομμάτια μαρμάρου στο δοχείο και πιπέτα με λίγο υδροχλωρικό οξύ. Ως αποτέλεσμα, θα υπάρξει μια άμεση αντίδραση με το σχηματισμό φυσαλίδων - το διοξείδιο του άνθρακα απελευθερώνεται. Πρόκειται για μια αντίδραση ανταλλαγής, τα προϊόντα των οποίων είναι: μια ασθενής και ασταθής ένωση, ανθρακικό οξύ, το οποίο αποσυντίθεται σε διοξείδιο του άνθρακα και νερό. Η εξίσωση της αντίδρασης της διάλυσης ανθρακικού ασβεστίου σε υδροχλωρικό οξύ:
CaCO3 + 2ΗCl (αρ.) → CaCl2 + C02 + Η2Ο
- χαρακτηριστικό στοιχείο μαγνησίου: ηλεκτρονική δομή, πιθανές καταστάσεις οξείδωσης, βασικές ενώσεις: οξείδιο, υδροξείδιο, άλατα. Τι είναι ο άνθρακας και ποιος είναι ο ρόλος του στην κατασκευή.
MgCO3 = MgO + C02
Εφαρμογή.
Στη βιομηχανία χρησιμοποιείται για την παραγωγή πυρίμαχων υλικών, τσιμέντων και καθαρισμού των προϊόντων πετρελαίου, ως πληρωτικό στην παραγωγή καουτσούκ. Το εξαιρετικά ελαφρύ οξείδιο του μαγνησίου χρησιμοποιείται ως πολύ λεπτό λειαντικό για καθαρισμό επιφανειών, ιδιαίτερα στη βιομηχανία ηλεκτρονικών.
Στην ιατρική, χρησιμοποιείται σε περίπτωση αυξημένης οξύτητας του γαστρικού υγρού, καθώς προκαλείται από υπερβολική περιεκτικότητα σε υδροχλωρικό οξύ. Η καμένη μαγνησία λαμβάνεται επίσης όταν το οξύ απελευθερώνεται τυχαία στο στομάχι.
Στη βιομηχανία τροφίμων καταχωρείται ως πρόσθετο τροφίμων E530.
Είναι ένας απόλυτος ανακλαστήρας - μια ουσία με συντελεστή ανάκλασης ίσο με έναν σε μια ευρεία φασματική ζώνη. Μπορεί να χρησιμοποιηθεί ως διαθέσιμο λευκό πρότυπο.
Υδροξείδιο του μαγνησίου - Το κύριο μεταλλικό υδροξείδιο είναι το μαγνήσιο. Αδύναμη αδιάλυτη βάση.
Υπό κανονικές συνθήκες, το υδροξείδιο του μαγνησίου είναι ένα άχρωμο εξαγωνικό πλέγμα. Σε θερμοκρασίες άνω των 350 ° C αποσυντίθεται σε οξείδιο του μαγνησίου και νερό. Απορροφά διοξείδιο του άνθρακα και νερό από τον αέρα για να σχηματίσει το κύριο ανθρακικό μαγνήσιο. Το υδροξείδιο του μαγνησίου είναι πρακτικά αδιάλυτο στο νερό, αλλά είναι διαλυτό σε άλατα αμμωνίου. Είναι μια αδύναμη βάση. Εμφανίζεται στη φύση με τη μορφή του ορυκτού brucite.
Παραλαβή.
Αλληλεπίδραση διαλυτών αλάτων μαγνησίου με αλκάλια:
Γενικά:
Mg2 + + 2ΟΗ - = Mg (ΟΗ) 2 "
Παραδείγματα:
MgCl2 + 2NaOH = Mg (ΟΗ) 2 + 2ΝaCl
Mg (ΝΟ3) 2 + 2ΚΟΗ = Mg (ΟΗ) 2 + 2ΚΝΟ3
Η αλληλεπίδραση του διαλύματος χλωριούχου μαγνησίου με καμμένο δολομίτη:
MgCl2 + CaOxMgO + 2Η2O = 2Mg (ΟΗ) 2 + + CaCl2
Αλληλεπίδραση μεταλλικού μαγνησίου με υδρατμούς:
Mg + 2Η2Ο = Mg (ΟΗ) 2 + Η2 -
Χημικές ιδιότητες
Όπως όλες οι αδύναμες βάσεις, το υδροξείδιο του μαγνησίου είναι θερμικά ασταθές. Αποσυντίθεται όταν θερμαίνεται στους 350 ° C:
Αλληλεπίδραση με οξέα για σχηματισμό αλατιού και νερού (αντίδραση εξουδετέρωσης):
Mg (ΟΗ) 2 + 2ΗCl = MgCl2 + 2Η2Ο
Mg (ΟΗ) 2 + Η2SΟ4 = MgS04 + 2Η2Ο
Αλληλεπίδραση με οξέα οξείδια για να σχηματίσουν άλας και νερό:
Mg (ΟΗ) 2 + SO3 = MgS04 + Η2Ο
Αλληλεπίδραση με θερμά συμπυκνωμένα διαλύματα αλκαλίων με σχηματισμό υδροξυμαγγενικών:
Mg (ΟΗ) 2 + 2ΝaΟΗ = Na2
Mg (ΟΗ) 2 + Sr (ΟΗ) 2 = Sr
Εφαρμογή.
υδροξείδιο του μαγνησίου χρησιμοποιείται για τη δέσμευση του διοξειδίου του θείου ως κροκιδωτικό για την επεξεργασία λυμάτων, ως επιβραδυντικό φλόγας σε θερμοπλαστικά πολυμερή (πολυολεφίνες και PVC), ως πρόσθετο σε απορρυπαντικά, για το οξείδιο του μαγνησίου, τη διύλιση της ζάχαρης, ως συστατικό της οδοντόπαστας.
Στην ιατρική, χρησιμοποιείται ως φάρμακο για να εξουδετερώνει το οξύ στο στομάχι, καθώς και ένα πολύ ισχυρό καθαρτικό.
Στην Ευρωπαϊκή Ένωση, το υδροξείδιο του μαγνησίου καταχωρείται ως πρόσθετο τροφίμων E528.
Άλατα μαγνησίου.
Τα περισσότερα άλατα μαγνησίου είναι ιδιαίτερα διαλυτά στο νερό. Το Ion Mg 2+ δίνει στα διαλύματα πικρή γεύση. Τα αλογονίδια του μαγνησίου, με εξαίρεση το MgF2, είναι εξαιρετικά υγροσκοπικά - αιμορραγούν στον αέρα.
Μαγνήσιο χλωριούχο MgCl2 (άνυδρο χλωριούχο μαγνήσιο) τήκεται στους 718 °. Παρουσιάζει ίχνη νερού "καπνίζει" στον αέρα - αποσυντίθεται σε HCl και MgO. Οι άχρωμες κρυσταλλικές ένυδρες μορφές με μόρια νερού 1, 2, 4, 6, 8 και 12 απελευθερώνονται από το υδατικό διάλυμα. Στην περιοχή θερμοκρασιών από 3,4 έως 116,7 ° σταθερές κρυσταλλικές ΜαΟΙ2 × 6Η 2 0, η οποία εμφανίζεται στη φύση ως το ορυκτό Bishofit, και σε μεγάλες ποσότητες λαμβάνεται με εξάτμιση του θαλασσινού άλμης. Το χλωριούχο μαγνήσιο σχηματίζει διπλά άλατα, εκ των οποίων το ορυκτό καρναλίτη KCl × MgCl2 × 6H2O - η πηγή μαγνησίου και χλωριούχου καλίου - είναι εξαιρετικά σημαντικό.
Εφαρμογή.
1. Το χλωριούχο μαγνήσιο χρησιμοποιείται κυρίως στην παραγωγή μεταλλικού μαγνησίου, το MgCl2 × 6H20 χρησιμοποιείται για τη λήψη τσιμέντων μαγνησίας.
2. Χρησιμοποιείται για την επεξεργασία του πάγου και του καλύμματος χιονιού ως πρόσθετο. Ως αποτέλεσμα της αντίδρασης με το χιόνι, προκαλεί τήξη. Έχει μια τρίτη τάξη κινδύνου (μέτρια επικίνδυνες ουσίες) και επιθετικές διαβρωτικές ιδιότητες.
Διττανθρακικό μαγνήσιο - όξινο άλας μαγνησίου και ανθρακικού οξέος με τον τύπο Mg (HCO3) 2, υπάρχει μόνο σε υδατικά διαλύματα.
Παραλαβή.
Μετάδοση διοξειδίου του άνθρακα μέσω εναιωρήματος ανθρακικού μαγνησίου:
MgCO3 + C02 + Η2Ο = Mg (HCO3) 2
Φυσικές ιδιότητες.
Το διττανθρακικό μαγνήσιο υπάρχει μόνο σε υδατικά διαλύματα.
Η παρουσία διττανθρακικού μαγνησίου στο νερό προκαλεί την προσωρινή ακαμψία του.
Χημικές ιδιότητες
Όταν συμπυκνώνεται το διάλυμα, το διττανθρακικό μαγνήσιο αποσυντίθεται:
Mg (HCO3) 2 = MgCO3 + C02 - + Η2Ο
Υδροφωσφορικό μαγνήσιο (δισυποκατεστημένο φωσφορικό μαγνήσιο) - ένα όξινο άλας μαγνησίου και φωσφορικού οξέος με τον τύπο MgHPO4, ελαφρώς διαλυτό στο νερό, σχηματίζει κρυσταλλικά ένυδρα άλατα.
Παραλαβή.
Η επίδραση του ορθοφωσφορικού οξέος σε οξείδιο του μαγνησίου ή ανθρακικό μαγνήσιο:
MgO + Η3ΡΟ4 = MgHP04 + Η2Ο
MgCO3 + Η3ΡΟ4 = MgHP04 + C02 - + Η2Ο
Η δράση διϋποκατεστημένου ορθοφωσφορικού νατρίου επί χλωριούχου μαγνησίου:
MgCl2 + 2Na2HP04 = MgHPO4 + 2NaCl
Η αποσύνθεση του δισόξινο φωσφορικό μαγνήσιο:
Mg (Η2ΡΟ4) 2 = MgHPO4 + Η3ΡΟ4
Φυσικές ιδιότητες.
Το όξινο φωσφορικό μαγνήσιο σχηματίζει λευκούς κρυστάλλους, οι οποίοι είναι κρυσταλλικοί ένυδροι: σε θερμοκρασίες μέχρι 225 ° C, σχηματίζεται μονοένυδρο MgHPO4. Η2Ο, πυκνότητα 2,32 g / cm3, σε θερμοκρασία 36 ° C, σχηματίζεται τριένυδρο MgHP04. 3Η2Ο, πυκνότητα 2,10 g / cm3, με θερμοκρασία δωματίου Προστέθηκε επταϋδρίτης MgHPO4. 7Η2Ο.
Χημικές ιδιότητες.
Όταν θερμαίνεται πηγαίνει σε πυροφωσφορικό:
Εφαρμογή.
Χρησιμοποιείται στο συμπλήρωμα διατροφής E343.
Διόξινο φωσφορικό μαγνήσιο - όξινο άλας του μετάλλου μαγνησίου και ορθοφωσφορικού οξέος με τον τύπο Mg (H2PO4) 2, άχρωμοι υγροσκοπικοί κρύσταλλοι, διαλυτοί στο νερό, σχηματίζουν κρυσταλλικά υδρίδια.
Παραλαβή.
Διάλυση υδροξειδίου ή οξειδίου του μαγνησίου στο ορθοφωσφορικό οξύ:
Φυσικές ιδιότητες.
Το δισόξινο φωσφορικό μαγνήσιο σχηματίζει άχρωμους κρυστάλλους.
Σχηματισμένη σύνθεση κρυσταλλικής ένυδρης μορφής Mg (H2PO4) 2. nH20, όπου η = 2, 4, 6.
Καρβίδιο μαγνησίου - δυαδική ανόργανη ένωση μαγνησίου και άνθρακα με τον τύπο MgC2. Επίσης γνωστό καρβίδιο μαγνησίου με τον τύπο Mg2C.
Παραλαβή.
Συσσωμάτωση φθοριούχου μαγνησίου και καρβιδίου ασβεστίου:
Ροή ακετυλενίου σε σκόνη μαγνησίου:
Με την αποκατάσταση του πεντανίου με σκόνη μαγνησίου στους 650 ° C, μπορεί να ληφθεί περισσότερο πολύπλοκο καρβίδιο Mg2C3.
Χημικές ιδιότητες.
Όταν θερμαίνεται αποσυντίθεται με το σχηματισμό ενδιάμεσου καρβιδίου Mg2C3:
Αλληλεπιδρά με το νερό:
Ανθρακικό μαγνήσιο, ανθρακικό μαγνήσιο, MgCO3 - άλας μαγνησίου του ανθρακικού οξέος.
Ιδιότητες
Λευκοί κρύσταλλοι, πυκνότητα 3,037 g / cm³. Στους 500 ° C παρατηρείται και στους 650 ° C αποσυντίθεται εντελώς σε MgO και CO2. Η διαλυτότητα του ανθρακικού μαγνησίου στο νερό είναι ασήμαντη (22 mg / l στους 25 ° C) και μειώνεται με την αύξηση της θερμοκρασίας. Όταν το C02 είναι κορεσμένο με ένα υδατικό αιώρημα MgCO3, το τελευταίο διαλύεται λόγω του σχηματισμού δισανθρακικού Mg (HCO3) 2. Από υδατικά διαλύματα απουσία περίσσειας CO2, εκπέμπονται βασικά ανθρακικά μαγνησίου. Με τα ανθρακικά άλατα ενός μεγάλου αριθμού μετάλλων, το ανθρακικό μαγνήσιο σχηματίζει διπλά άλατα, τα οποία περιλαμβάνουν το φυσικό μεταλλικό δολομίτη MgCO3 · CaCO3.
Επικράτηση στη φύση.
Το ανθρακικό μαγνήσιο κατανέμεται ευρέως στη φύση με τη μορφή του μεταλλικού μαγνησίτη.
Εφαρμογή.
Το βασικό ανθρακικό μαγνήσιο 3MgCO3 · Mg (OH) 2 · 3H2O (η αποκαλούμενη άσπρη μαγνησία) χρησιμοποιείται ως πληρωτικό σε ενώσεις καουτσούκ για την κατασκευή θερμομονωτικών υλικών.
Το ανθρακικό μαγνήσιο είναι απαραίτητο για την παραγωγή γυαλιού, τσιμέντου, τούβλων.
Νιτρικό μαγνήσιο Mg (NO3) 2 - άχρωμοι υγροσκοπικοί κρύσταλλοι με κυβικό πλέγμα. σημείο τήξεως 426 ° C (με αποσύνθεση). Διαλυτότητα σε νερό (g ανά 100 g): 73,3 (20 ° C), 81,2 (40 ° C), 91,9 (60 ° C). Επίσης διαλυτό σε αιθανόλη, μεθανόλη, υγρό NH3. Ανάλογα με τη συγκέντρωση, τα μη-, εξα- και διϋδρικά κρυσταλλώνονται από υδατικά διαλύματα.
Συστατικό σύνθετων λιπασμάτων, δεδομένου ότι το μαγνήσιο είναι μέρος της χλωροφύλλης, το οποίο είναι απαραίτητο για τη φωτοσύνθεση, αυξάνει τη δραστηριότητα πολλών ενζύμων και δρα ως φορέας φωσφόρου. Η υψηλή διαλυτότητα και η χαμηλή ηλεκτρική αγωγιμότητα καθιστούν το προϊόν εξαιρετικά κατάλληλο για σίτιση και λίπανση των φύλλων, ειδικά όταν χρησιμοποιούνται νερά ποτίσματος με υψηλή περιεκτικότητα σε αλάτι. Το λίπασμα χρησιμοποιείται για τη διατροφή των φυτών και των φυλλώματος λαχανικών, μούρων, φρούτων, σταφυλιών. οξειδωτή σε πυροτεχνικές συνθέσεις.
Ανθρακούχο- κορεσμός οποιουδήποτε διαλύματος με διοξείδιο του άνθρακα. Χρησιμοποιείται στην κατασκευή.
Ο ανθρακωρύχηση ορυκτών - πυριτικό οξύ σε πυριτικά αντικαθίσταται από ανθρακικό οξύ για σχηματισμό ανθρακικών αλάτων. Από ανθρακικά άλατα, το ορυκτό που σχηματίζει πετρώματα στα ιζηματογενή πετρώματα είναι ο ασβεστίτης (ασβέστης ασβεστίου) CaCO3. Μαγνησίτης - MgCO3 και δολομίτης - CaMg (CO3) 2 είναι λιγότερο συχνές. Στο καθαρό νερό, που δεν περιέχει ανθρακικό οξύ, ο ασβεστίτης διαλύεται σε μικρή ποσότητα (0,03 g ανά λίτρο νερού). ο μαγνησίτης είναι πρακτικά αδιάλυτος. Εάν το νερό περιέχει διοξείδιο του άνθρακα, ο ασβεστίτης διαλύεται εύκολα με το σχηματισμό όξινου ανθρακικού ασβεστίου, διαλυτό στο νερό - Ca (HCO3) 2.
Η ενανθράκωση είναι μια αλλαγή που εμφανίζεται σε σκυρόδεμα στο τσιμέντο Portland όταν εκτίθεται στον αέρα C02. Το υδροξείδιο του ασβεστίου Ca (OH) 2 παρουσία υγρασίας επηρεάζεται ιδιαίτερα. Το υδροξείδιο του ασβεστίου μετατρέπεται σε ανθρακικό ασβέστιο όταν απορροφά διοξείδιο του άνθρακα. Το ανθρακικό ασβέστιο είναι ελάχιστα διαλυτό στο νερό και ως αποτέλεσμα τείνει να κλείνει ερμητικά τους πόρους στην επιφάνεια του σκυροδέματος (δηλαδή πυκνό, αδιάβροχο σκυρόδεμα).
Τυπικά, το pH του νερού των πόρων στο σκυρόδεμα κυμαίνεται από 10,5 έως 11,5. Αν λόγω της αποικοδόμησης μειώνεται στο 9 και κάτω, τότε είναι δυνατή η διάβρωση του οπλισμού. Επομένως, το πάχος του ανθρακούχου στρώματος είναι ένας σημαντικός παράγοντας για την προστασία του οπλισμού: όσο βαθύτερα ο άνθρακας, τόσο μεγαλύτερος είναι ο κίνδυνος διάβρωσης του χάλυβα. Το βάθος της ενανθράκωσης μπορεί να προσδιοριστεί με επεξεργασία του σκυροδέματος με φαινολοφθαλεΐνη. Η παρουσία αλκαλικών ιδιοτήτων υπό τη δράση της φαινολοφθαλεΐνης υποδεικνύεται από την εμφάνιση ροζ χρώματος, ενώ το ανθρακούχο σκυρόδεμα διατηρεί το αρχικό του χρώμα.
Το πυκνό σκυρόδεμα υψηλής ποιότητας υφίσταται πολύ αργό άνθρακα. Είναι απίθανο ο άνθρακας να παρατηρηθεί σε βάθος μεγαλύτερο από 5-10 mm, ακόμη και μετά τη λειτουργία για 50 χρόνια. Από την άλλη πλευρά, το βάθος του άνθρακα στο διαπερατό σκυρόδεμα χαμηλής αντοχής μπορεί να φθάσει τα 25 mm σε λιγότερο από 10 χρόνια. Η εμπειρία δείχνει ότι τα προϊόντα από σκυρόδεμα χαμηλής ποιότητας είναι ιδιαίτερα ευαίσθητα στην αποικοδόμηση του άνθρακα.
- χαρακτηριστικό στοιχείο ασβεστίου: ηλεκτρονική δομή, πιθανές καταστάσεις οξείδωσης, κύριες ενώσεις: οξείδιο, υδροξείδιο, άλατα.
Ασβέστιο - ένα στοιχείο της κύριας υποομάδας της δεύτερης ομάδας, η τέταρτη περίοδος του περιοδικού πίνακα χημικών στοιχείων DI Mendeleev, με ατομικό αριθμό 20. Σημειώνεται με το σύμβολο Ca (lat. Calcium). Ηλεκτρονική δομή 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 = [18 Ar] 4s 2, κατάσταση οξείδωσης +2, 0. Αναφέρεται στα μέταλλα αλκαλικών γαιών.
Η απλή ουσία ασβεστίου είναι ένα μαλακό, χημικά ενεργό μέταλλο αλκαλικής γαίας ασήμι-λευκό χρώμα. Βιομηχανική παραγωγή: ηλεκτρόλυση τετηγμένου χλωριούχου ασβεστίου.
Οξείδιο του ασβεστίου CaO - βασικό οξείδιο, ασβέστιο. Λευκό, υγροσκοπικό. Πυρίμαχο, θερμικά ασταθές, πτητικό κατά την ανάφλεξη. Δυσαρεστικός αντιδρά με νερό (με υψηλό αποτέλεσμα εξώσεως), σχηματίζει έντονα αλκαλικό διάλυμα, η διαδικασία ονομάζεται ασβέστιο. Αντιδρά με οξέα, οξείδια μετάλλων, μη μέταλλα. Χρησιμοποιείται για τη σύνθεση άλλων ενώσεων ασβεστίου, ενός συστατικού συνδετικών υλικών στην κατασκευή.
Παραγωγή στη βιομηχανία - καύση ασβεστόλιθου (900 - 1200 o C)
Υδροξείδιο ασβεστίου Ca (OH) 2 - ένυδρη άσβεστος, βασικό υδροξείδιο. Αποσυντίθεται με μέτρια θέρμανση. Λευκό, υγροσκοπικό. Απορροφά την υγρασία και το διοξείδιο του άνθρακα από τον αέρα. Ελαφρώς διαλυτό στο κρύο. νερό, ακόμη λιγότερο - σε βραστό νερό. Ένα διαυγές διάλυμα (ασβέστης) γίνεται σύντομα θολό λόγω της καθίζησης του υδροξειδίου (το αιώρημα ονομάζεται γάλα ασβέστη). Ποιοτική αντίδραση είναι η μετάδοση του διοξειδίου του άνθρακα μέσω ασβέστου με την εμφάνιση ιζήματος CaCO3 και τη μετάβασή του σε διάλυμα. Αντιδρά με οξέα και οξείδια του οξέος, εισέρχεται σε αντιδράσεις ανταλλαγής ιόντων.
Χρησιμοποιείται στην κατασκευή για την παρασκευή ασβεστοκονιάματος (άμμος + σβήσιμο ασβέστη + νερό), που χρησιμεύει ως υλικό συγκόλλησης για πέτρα και πλινθοδομή, τοίχοι τελειώματος (σοβάτισμα) και άλλοι κατασκευαστικοί σκοποί. Η στερεοποίηση τέτοιων διαλυμάτων οφείλεται στην απορρόφηση του CO2 από τον αέρα.
Ca (ΟΗ) 2 + C02- CaC03 ↓ + Η2Ο
Ca (OH) 2 + H2S04- CaS04 + 2Η2Ο,
Αντιδρά με τα άλατα εάν σχηματίζεται ένα ίζημα:
Ca (ΟΗ) 2 + Na2SO3 - CaS03 + + 2ΝaΟΗ
Άλατα ασβεστίου.
Θειικό ασβέστιο (CaSO4) - ανόργανη ένωση, άλας ασβεστίου θειικού οξέος.
Βρίσκεται στη φύση ως διένυδρο CaSO4; 2H 2 O (γύψος, σεληνίτης) και στην άνυδρη κατάσταση - ανυδρίτης.
Χλωριούχο ασβέστιο, CaCl2 - άλας ασβεστίου του υδροχλωρικού οξέος.
Έχει υψηλές υγροσκοπικές ιδιότητες. Διαλυτότητα (g ανά 100 g Η2Ο): 74 (20 ° C) και 159 (100 ° C). Τα υδατικά διαλύματα χλωριούχου ασβεστίου καταψύχονται σε χαμηλές θερμοκρασίες (20% στους -18,57 ° C, 30% στους -48 ° C).
Δημιουργεί ένυδρο άλας CaCl2 · 6H2O, σταθερό έως 29,8 ° C. σε υψηλότερες θερμοκρασίες, οι κρυσταλλικές ένυδρες μορφές με μόρια 4, 2 και 1 Η2 εξέρχονται από το κεκορεσμένο διάλυμα. Όταν το CaCl2 * 6H2O (58,8%) αναμειγνύεται με χιόνι ή πάγο (41,2%), η θερμοκρασία πέφτει στους -55 ° C (σημείο κρυοϋδρίτη).
Το χλωριούχο ασβέστιο λαμβάνεται ως παραπροϊόν στην παραγωγή σόδας.
Στο χημικό εργαστήριο, το χλωριούχο ασβέστιο χρησιμοποιείται ως πληρωτικό για ξηραντικούς σωλήνες, που ονομάζεται επίσης χλωριούχο ασβέστιο και προορίζεται για την απομόνωση ουσιών στο δοχείο από ατμοσφαιρικούς υδρατμούς και αέρια ξήρανσης.
Το χλωριούχο ασβέστιο χρησιμοποιείται επίσης ως επιταχυντής για τη ρύθμιση του τσιμέντου.
Ανθρακικό ασβέστιο (ανθρακικό ασβέστιο) - ανόργανη χημική ένωση, άλας ανθρακικού οξέος και ασβέστιο. Χημικός τύπος -CaCO3. Στη φύση, βρίσκεται υπό μορφή ορυκτών - ασβεστίτης, αραγωνίτης και vaterite, είναι το κύριο συστατικό του ασβεστόλιθου, του μαρμάρου, της κιμωλίας, είναι μέρος του κελύφους των αυγών. Αδιάλυτο σε νερό και αιθανόλη.
Χαρτί, διάφορα σφραγιστικά - όλα περιέχουν ανθρακικό ασβέστιο σε σημαντικές ποσότητες. Επίσης, το ανθρακικό ασβέστιο αποτελεί βασικό συστατικό στην παραγωγή οικιακών χημικών ουσιών.
Το ανθρακικό ασβέστιο χρησιμοποιείται επίσης ευρέως στα συστήματα καθαρισμού, ως μέσο για την καταπολέμηση της ρύπανσης του περιβάλλοντος, και με τη βοήθεια του ανθρακικού ασβεστίου, αποκαθίσταται η ισορροπία όξινου-βάσης του εδάφους.
- Παραδείγματα που απεικονίζουν τη χρήση οξειδίων και υδροξειδίων του ασβεστίου και του μαγνησίου στην κατασκευή.
Οξείδιο και υδροξείδιο του ασβεστίου:
Όταν τα ασβεστωμένα δωμάτια.
Όταν ξαπλώνετε ξύλινους φράχτες και κεραμίδια - για προστασία από την σήψη και τη φωτιά.
Για την παρασκευή ασβεστοκονιάματος. Το ασβέστη έχει χρησιμοποιηθεί για την κατασκευή τοιχοποιίας από την αρχαιότητα. Το μείγμα συνήθως παρασκευάζεται σε αυτή την αναλογία: προστίθενται τρία ή τέσσερα μέρη άμμου (κατά βάρος) σε ένα μέρος ενός μείγματος υδροξειδίου του ασβεστίου (ένυδρου ασβέστη) και νερού. Όταν συμβεί αυτό, το μείγμα σκληραίνει με την αντίδραση: Ca (OH) 2 + CO2 → CaCO3 ↓ + H2O. Αυτή είναι μια εξώθερμη αντίδραση, η απελευθέρωση ενέργειας είναι 27 kcal (113 kJ).
Όπως μπορεί να φανεί από την αντίδραση, το νερό απελευθερώνεται κατά τη διάρκεια αυτής. Αυτός είναι ένας αρνητικός παράγοντας, καθώς σε χώρους που έχουν κατασκευαστεί με ασβέστη, η υψηλή υγρασία παραμένει για μεγάλο χρονικό διάστημα. Από την άποψη αυτή, καθώς και λόγω πολλών άλλων πλεονεκτημάτων έναντι του υδροξειδίου του ασβεστίου, το τσιμέντο το έχει ουσιαστικά αντικαταστήσει ως συνδετικό υλικό για τα δομικά διαλύματα. Επιπλέον, είναι επίσης απαράδεκτο για χρήση κατά την τοποθέτηση σόμπων, επειδή υπό την επίδραση των υψηλών θερμοκρασιών, ασφυκτική διοξείδιο του άνθρακα απελευθερώνεται.
Για την παρασκευή πυριτικού σκυροδέματος. Η σύνθεση του πυριτικού σκυροδέματος είναι πανομοιότυπη με τη σύνθεση του ασβεστοκονιάματος · ωστόσο, παρασκευάζεται με άλλη μέθοδο - ένα μείγμα οξειδίου του ασβεστίου και χαλαζιακής άμμου δεν υφίσταται επεξεργασία με νερό, αλλά με υπερθερμασμένους (174,5-197,4 ° C) υδρατμούς σε αυτόκλειστο σε πίεση 9-15 ατμοσφαιρών.
Στην κατασκευή πυριτικών τούβλων.
Οξείδιο και υδροξείδιο του μαγνησίου:
για την παραγωγή συνδυασμένων συστημάτων πυρίμαχων υλικών (σανίδες κατασκευής μαγνησίτη), για την παραγωγή τσιμέντου. Το οξείδιο του μαγνησίου (καυστικός μαγνησίτης) χρησιμοποιείται ως συνδετικό υλικό, το οποίο, όταν αναμιγνύεται με διάλυμα MgCl2, μπορεί να σκληρύνει γρήγορα και να αποκτήσει αντοχή στον αέρα.
- σκληρότητα των φυσικών υδάτων: ορισμός, τύποι σκληρότητας, μέθοδοι για την αφαίρεση της σκληρότητας του νερού: φυσικές, χημικές (εξισώσεις αντίδρασης), φυσικοχημικές.
Το φυσικό νερό που περιέχει μια μεγάλη ποσότητα αλάτων ασβεστίου ή μαγνησίου σε ένα διάλυμα ονομάζεται σκληρό νερό σε αντίθεση με το μαλακό νερό που περιέχει ελάχιστα ή καθόλου άλατα ασβεστίου και μαγνησίου.
Η πρώτη από αυτές οφείλεται στην παρουσία δισανθρακικών ασβεστίου και μαγνησίου, η δεύτερη στην παρουσία αλάτων ισχυρών οξέων, θειικών αλάτων ή χλωριούχων αλάτων ασβεστίου και μαγνησίου. Με παρατεταμένο βρασμό ύδατος με ανθρακική σκληρότητα, εμφανίζεται ένα ίζημα, το οποίο αποτελείται κυρίως από CaC03 και ταυτόχρονα απελευθερώνεται CO2.
Και οι δύο αυτές ουσίες εμφανίζονται ως αποτέλεσμα της αποσύνθεσης του ανθρακικού ασβεστίου:
Επομένως, η ακαμψία ανθρακικών αλάτων ονομάζεται επίσης προσωρινή δυσκαμψία. Ποσοτικά, η προσωρινή ακαμψία χαρακτηρίζεται από την περιεκτικότητα των δισανθρακικών αλάτων που απομακρύνονται από το νερό όταν βρασθεί επί μία ώρα. Η ακαμψία που απομένει μετά το βρασμό αυτό ονομάζεται σταθερή ακαμψία.
Η σκληρότητα του νερού εκφράζεται με το άθροισμα των χιλιοστοϊσοδύναμων ιόντων ασβεστίου και μαγνησίου που περιέχονται στο νερό. Ένα χιλιοστοϊσοδύναμο δυσκαμψίας αντιστοιχεί σε περιεκτικότητα 20,04 mg / l ή 12,16 mg / l.
Η σκληρότητα των φυσικών υδάτων ποικίλλει ευρέως. Είναι διαφορετικό σε διαφορετικές δεξαμενές, και στον ίδιο ποταμό ποικίλλει όλο το χρόνο (ελάχιστο κατά τη διάρκεια της πλημμύρας). Η σκληρότητα των υδάτων των θαλασσών είναι πολύ μεγαλύτερη από τα ποτάμια και τις λίμνες. Έτσι, το νερό της Μαύρης Θάλασσας έχει συνολική σκληρότητα 65,5 meq / l. Η μέση τιμή της σκληρότητας του νερού του παγκόσμιου ωκεανού είναι 130,5 meq / l (συμπεριλαμβανομένων 22,5 meq / l ανά meq / l).
Η παρουσία σε νερό σημαντικής ποσότητας αλάτων ασβεστίου ή μαγνησίου καθιστά το νερό ακατάλληλο για πολλούς τεχνικούς σκοπούς. Έτσι, με την παρατεταμένη τροφοδοσία των ατμολέβητων με σκληρό νερό, τα τοιχώματα τους σταδιακά καλύπτονται με πυκνή κρούστα nakiii. Μια τέτοια κρούστα ήδη σε πάχος στρώματος μειώνει σημαντικά τη μεταφορά θερμότητας από τα τοιχώματα του λέβητα και κατά συνέπεια οδηγεί σε αύξηση της κατανάλωσης καυσίμου. Επιπλέον, μπορεί να προκαλέσει φουσκάλες και ρωγμές τόσο στους σωλήνες θέρμανσης όσο και στους τοίχους του ίδιου του λέβητα.
Το σκληρό νερό δεν δίνει αφρό με σαπούνι, καθώς τα διαλυτά άλατα νατρίου των λιπαρών οξέων - παλμιτικών και στεατικών - που περιέχονται στο σαπούνι μετατρέπονται σε αδιάλυτα άλατα ασβεστίου των ίδιων οξέων:
Το σκληρό νερό δεν μπορεί να χρησιμοποιηθεί κατά τη διεξαγωγή ορισμένων τεχνολογικών διαδικασιών, για παράδειγμα, όταν βαφεί.
Η σταθερή σκληρότητα του νερού οφείλεται στην παρουσία σε αυτό κυρίως θειικών αλάτων και χλωριούχων αλάτων ασβεστίου και μαγνησίου και δεν εξαλείφεται με βρασμό. Το άθροισμα της προσωρινής (αφαιρούμενης) και σταθερής σκληρότητας είναι η συνολική σκληρότητα του νερού.
Υπάρχουν διάφοροι τρόποι προσδιορισμού της ακαμψίας.
Εξετάστε δύο από αυτές:
1) προσδιορισμός της χρονικής ακαμψίας χρησιμοποιώντας ένα τιτλοδοτημένο διάλυμα υδροχλωρικού οξέος
2) Συμπλοκομετρική μέθοδος για τον προσδιορισμό της ολικής ακαμψίας.
Κατά τη διάρκεια της τιτλοδότησης ενός δείγματος νερού με υδροχλωρικό οξύ παρουσία πορτοκαλιού μεθύλ, προκύπτει η αποσύνθεση των δισανθρακικών ενώσεων, προκαλώντας προσωρινή ακαμψία:
Μέθοδος προσδιορισμού. 100 ml του ύδατος δοκιμής λαμβάνονται σε κωνική φιάλη με πιπέτα ή κύλινδρο μέτρησης, προστίθενται 2-3 σταγόνες πορτοκαλί μεθύλιο και τιτλοδοτούνται με 0,1 και. Διάλυμα HCl έως ότου εμφανιστεί πορτοκαλί χρώμα.
Ανάλυση αποτελεσμάτων υπολογισμού. 1 ml 0,1 n. Το διάλυμα HCl αντιστοιχεί σε 0,1 / 1000 g-eq ή 0,1 mg-eq Ca2 +. Το V (HCl) αντιστοιχεί σε 0,1 V (HCl) / 1000 g-eq ή 0,1 V (HCl) mg-eq Ca2 +. 0,1 V (HCl) mEq είναι στον όγκο του VA. Για να εκφράσετε την ακαμψία σε ισοδύναμα χιλιοστογράμματος ανά 1 λίτρο νερού, πρέπει να διαιρέσετε την τιμή που βρέθηκε από το V A και να τον πολλαπλασιάσετε κατά 1000, δηλ. Η σκληρότητα του υπό μελέτη νερού είναι ίση με:
![]()
Μέθοδοι εξάλειψης.
Θερμική μαλάκυνση. Με βάση το βρασμό ύδατος, ως αποτέλεσμα των θερμικά ασταθών διττανθρακικών ασβεστίου και μαγνησίου αποσυντίθενται με το σχηματισμό της κλίμακας:
Ca (HCO3) 2 → CaC03 ↓ + CO2 + Η2Ο.
Η βρασμός αφαιρεί μόνο την προσωρινή (ανθρακική) σκληρότητα. Βρίσκει εφαρμογή στη ζωή.
Μαλακτικό αντιδραστηρίου. Η μέθοδος βασίζεται στην προσθήκη ανθρακικού νατρίου Na2CO3 ή ενυδατωμένου ασβεστίου Ca (OH) 2 στο νερό. Ταυτόχρονα, τα άλατα ασβεστίου και μαγνησίου περνούν σε αδιάλυτες ενώσεις και ως αποτέλεσμα, καθιζάνουν.
Για παράδειγμα, η προσθήκη ενυδατωμένου ασβέστου οδηγεί στη μετατροπή των αλάτων ασβεστίου σε αδιάλυτο ανθρακικό άλας:
Ca (HCO3) 2 + Ca (OH) 2 → 2CaCO3 ↓ + 2H2O
Το καλύτερο αντιδραστήριο για την εξάλειψη της συνολικής σκληρότητας του νερού είναι το ορθοφωσφορικό νάτριο Na3PO4, το οποίο αποτελεί μέρος των περισσότερων οικιακών και βιομηχανικών προϊόντων:
3Ca (HCO3) 2 + 2Na3P04 → Ca3 (PO4) 2 ↓ + 6NaHCO3
3MgS04 + 2Na3P04 → Mg3 (PO4) 2 ↓ + 3Na2S04
Τα ορθοφωσφορικά ασβέστιο και μαγνήσιο είναι πολύ κακώς διαλυτά στο νερό και επομένως διαχωρίζονται εύκολα με μηχανική διήθηση. Αυτή η μέθοδος δικαιολογείται σε σχετικά υψηλή κατανάλωση νερού, αφού περιλαμβάνει την επίλυση ορισμένων ειδικών προβλημάτων: διήθηση ιζημάτων, ακριβή δοσολογία αντιδραστηρίου.
Κατιοντοποίηση. Η μέθοδος βασίζεται στη χρήση κοκκώδους φορτίου ιοντοανταλλαγής (συνηθέστερα ρητίνες ανταλλαγής ιόντων). Ένα τέτοιο φορτίο σε επαφή με το νερό απορροφά κατιόντα από άλατα σκληρότητας (ασβέστιο και μαγνήσιο, σίδηρο και μαγγάνιο). Αντ 'αυτού, ανάλογα με την ιοντική μορφή, αποδίδει ιόντα νατρίου ή υδρογόνου. Αυτές οι μέθοδοι καλούνται αντιστοίχως Να-κατιοντοποίηση και Η-κατιοντοποίηση. Με σωστά επιλεγμένη φόρτιση ανταλλαγής ιόντων, η σκληρότητα του νερού μειώνεται με ένα κατιονισμό νατρίου ενός σταδίου σε 0,05-0,1 ° W, με φόρτιση δύο σταδίων - σε 0,01 ° W. Στη βιομηχανία, τα φίλτρα ανταλλαγής ιόντων αντικαθιστούν τα ιόντα ασβεστίου και μαγνησίου με ιόντα νατρίου και καλίου, παράγοντας μαλακό νερό.
Αντίστροφη όσμωση. Η μέθοδος βασίζεται στη διέλευση του νερού μέσω μιας ημιπερατής μεμβράνης (συνήθως πολυαμιδίου). Μαζί με τα άλατα σκληρότητας, τα περισσότερα από τα άλλα άλατα απομακρύνονται. Η απόδοση καθαρισμού μπορεί να φτάσει το 99,9%.
Υπάρχουν νανοδιήθηση (η ονομαστική διάμετρος των οπών της μεμβράνης είναι ίση με τις μονάδες των νανομέτρων) και η πικο-διήθηση (η ονομαστική διάμετρος των οπών της μεμβράνης είναι ίση με τις μονάδες των πικομέτρων).
Ως μειονεκτήματα αυτής της μεθόδου θα πρέπει να σημειωθεί:
Η ανάγκη προκαταρκτικής επεξεργασίας του νερού που τροφοδοτείται στην μεμβράνη αντίστροφης όσμωσης.
Το σχετικά υψηλό κόστος του 1 λίτρου νερού που παράγεται (ακριβός εξοπλισμός, δαπανηρές μεμβράνες).
Χαμηλή ανοργανοποίηση του παραγόμενου νερού (ιδιαίτερα όταν πρόκειται για picofiltration). Το νερό σχεδόν αποστάζεται.
Ηλεκτροδιάλυση Βασίζεται στην αφαίρεση αλάτων από το νερό υπό τη δράση ενός ηλεκτρικού πεδίου. Η απομάκρυνση των ιόντων διαλυμένων ουσιών συμβαίνει λόγω ειδικών μεμβρανών. Όπως και με τη χρήση της τεχνολογίας αντίστροφης όσμωσης, συμβαίνει και η αφαίρεση άλλων αλάτων, εκτός από τα ιόντα σκληρότητας.
Πλήρως καθαρό νερό από τα άλατα σκληρότητας μπορεί να αποσταχθεί.
