Еднакви реакции, които характеризират силата на разтворената сярна киселина. Списък с изпитни ястия от дисциплини
Почерняването на повърхността на стари картини, изписани с маслинови фарби, в чийто склад влиза оловно бяло (PbCO3), е свързано с черни оловни (II) сулфидни разтвори чрез наличието на циркулираща вода в атмосферата. Ако оцветите повърхността с вода с пероксид, тогава се наблюдава реакцията на разтвора на оловен (II) сулфат с бял цвят:
PbS + 4H2O2 = PbSO4 + 4H2O.
По този начин те възстановяват почернели стари картини, рисувани с маслинови фарби.
Zastosuvannya кисел и sirki
Областите на стагнация на киселинността са представени от малкото 61.
позволяват vicoristovuvati yogo за инфекция пия водатози извор на промишлени отпадъчни води; като дезинфектант zasib в медицината. Озонът е победител и як vidbіlyuyuchiy zasib.
Syrka використ за производството на сярна киселина, приготвянето на сирникови, бенгалски огньове, борбата срещу шкидниците на силната държава и за внушаване на екзалтация на такива заболявания. Serka знаят zastosuvannya по време на производството на дъвка, barniki и пигменти, парче влакна, луминофори и други.
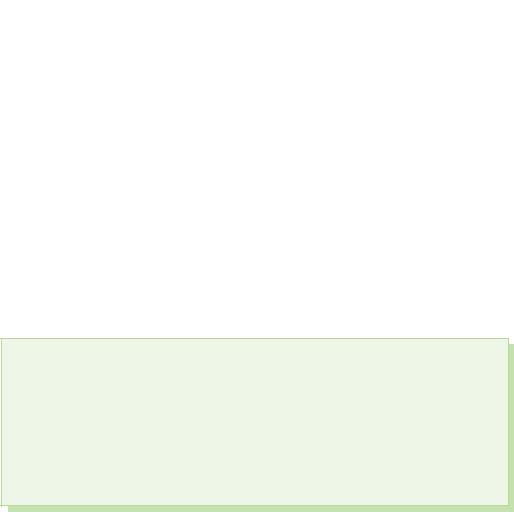
Мал 61. Целувка

За киселите в изпражненията, които са сред най-малките елементи, най-характерна е степента на окисление -2, атомите на сяра, селен и телурий показват степен на окисление -2, +2, +4 и +6.
Оксидите на киселото и сярата се проявяват в техните реакции с метали, вода и други неметали.
Запитване и задача
1. Сгънете формули с киселинност с калий, калций и алуминий. Посочете етапа на окисление на кожния елемент и назовете заболяването.
2. Razrahuyte масовата част на sirka в алуминиев сулфид.
3. Името "кисен" -оксигениум означава "който генерира киселини". Записвам химични формуливи донасят киселини, в чийто склад да сложите елемента. Назовете киселини.
4. Знаете ли какви алотропни модификации на кисело и кисело? Защо миришат един по един?
5. Кисен, който се вдишва от човешкото същество, се издига от хемоглобина на кръвта. Изглежда, че хемоглобинът с тегло 1 g идва с обем (n.a.) от 1,35 cm3 3 . Количеството хемоглобин в кръвта на здрави хора е 140 g/dm3. Общият обем на кръвта е 6 dm3. Razrahuyte khіmіchnu kіlkіst kіlіkіst кисело, вие mаzhe opinetytsya іn в кръвта і хората.
6. Определете масовата част на sirkovodnoy киселина в термини, свалени в случай на отделен sirvodnyu обем (n.a.) 8,96 dm 3 във вода с маса 500 g.
7. Разширете коефициентите в офанзивните схемиоксидни реакции:
а) H2S + Cl2 + H2O → H2SO4 + HCl; б) H2S + Br2 → S + HBr;
в) H2 S + O2 → S + H2 O.
В кожната реакция показва окислител.
§ 39. Kisnevmisnі spoluki sirka
В z'ednannyah с кисела sirka показва етапа на окисление+4 и +6.
Сирка(IV) оксид. Сярна киселина
Оксид (IV) - SO2 (сирхист газ) - е газ без варел с остра характерна миризма, която излиза, когато въздухът е горещ:
S + O2 = tSO2.

Един от най-новите застосувани на сирка беше обвързан с фумигацията на сирка на живота, която трябва да гори. Както пише древният историк Плиний-старши през 1 век пр.н.е. д., "миризмите на огнището на сирка могат да предпазят от всякакви прелести и да прогонят всички зли духове." Дезинфектантите и бактерицидните свойства на серен оксид (IV) са заместващи и заразни. Серният газ се загрява при обработката на зеленчуци, плодове и плодове, за да се предотврати тяхното загниване.
Отделяне на серен газ в близост до вода (до 40 обема SO2 на 1 обем вода) - без петна, с двойна основа сярна киселинакато се предлага само на дребно:
SO2 + H2 O H2 SO3.
Сярната киселина е слаба киселина, във водни разтвори тя се дисоциира на етапи често с разтвори на хидросулфит- и сулфит-йони:
H+ + HSO – , | – H+ + SO2–. |
||||
Сярната киселина проявява химическо доминиране, сярна за киселините: взаимодейства с основни оксиди, основи, реагира с обмена на соли на други киселини, зокрема, вискозна слаба въглеродна киселина от соли:
Na2CO3+H2SO3=Na2SO3+H2O+CO2.
Сирка(VI) оксид
Оксид (VI) притежава окисляващ оксид (IV) в присъствието на катализатор при температура от около 500 С:
т, кат.
2SO + O −−−−−← 2SO .
2 2 ←−−−−−3
За най-големите умове серен оксид (VI) SO3 е киселина без ядки, която при температури под 17 ° C се превръща в бяла кристална реч. Ce е типичен кисел оксид, който взаимодейства с вода, образувайки силна сярна киселина:
SO3 + H2O = H2SO4.
Сирханова киселина
Графичната формула и моделът на молекулата на сярната киселина е насочена към малкото 62.
Мал 62. Графична формула и модел на молекулата на сярната киселина
В развъдни кръгове сярна киселинае силен електролит,
і нейната дисоциация се изразява по следния начин:
H2 SO4 → 2Н+ + SO4 2– .
Физическа сила на сярната киселина
Сярна киселина - ваза (якост 1,83 g/cm3), мазна, без мирис, без мирис. Тя ще отиде до водата в някакви бутилки за вода.
Процесът на разпределяне на H2SO4 до химично количество от 1 mol е придружен от 92 kJ топлина, което може да се сравни с величините на топлинните ефекти в химичните реакции. Виждането на голямо количество топлина при взаимодействието на сярна киселина с вода е доказателство за установяването на минерални кълнове между две реки от хидратационен тип H2SO4 n H2O.
Например, H2SO4 H2O; H2SO4 2H2O; H2SO4 3H2O и така нататък.
без ї киселини и хидрати позволяват вискозитет її като силен водоотблъскващ агент, например за изсушаване на газове.
Поръсването на сумиши с различна сярна киселина във вода може да бъде придружено от пръскане. Спомнете си какво не можете да наливате вода, за да вкиснете
Lotі, плъзгане с непрекъснато ремиксиране, изсипете киселина във водата.
Химическа силасярна киселина. Сулфати
Сулфати. Разтворена сярна киселина разкрива всички характерни особености на доминиращите киселини: взаимодействие с метали, което трябва да бъде активно до един ден; с основни и амфотерни оксиди, с основи и соли. Чии соли са уредени: средно -сулфат, например K 2 SO 4 i кисел -
хидросулфат, например KНSO4.
По-голямата част от сулфатите и хидросулфатите се отличават добре с вода, богата на тях кристална. Deyakі кристалоидни соли на сярна киселина и се наричат витриол: midny vitriol CuSO4 ∙5H2 O, назален витриол FeSO4 ∙7H2 O и в.
За киселинното проявление на сярната киселина и нейните соли във водните рози се използват бариеви соли:
Ba(NO3)2 + Na2SO4 = BaSO4 ↓ + 2NaNO3;
Ba2+ + SO4 2– = BaSO4 ↓.
В резултат на реакцията се установява бяло утаяване на бариев сулфат.
Лабораторен сертификат 6
Проследяване на химическите сили на разредената сярна киселина
Имайте под поглед пет епруветки: метал (цинк или друг метал по избор на четеца), основен оксид, натриев хидроксид, натриев карбонат, бариев хлорид. Добавете няколко капки фенолфталеин към количеството натриев хидроксид и променете дозата. Добавете 1-2 cm3 разредена сярна киселина към кожната епруветка. (Внимание! Ако реакцията с основния оксид протича правилно, ускорете прегряването с половин алкохолна баня.)
какво пазиш? Какви са признаците, които трябва да разкажете за претоварването на химичните реакции? За съхраняване на еднакви химични реакции в молекулярна и йонна форма. Каква реакция направихте? За събиране на visnovok за химическата сила на разтворената сярна киселина.
Концентрирана сярна киселинае силен окислител, по-ниско разреден. При взаимодействие с концентрирана сярна киселина
вода не се вижда с метали.
У метали, които стоят до вода (крито злато и платина), реакцията протича със серен оксид (IV) SO 2 :
Cu + 2H2 SO4 (конц) = t CuSO4 + SO2 + 2H2O.
При реакцията с метали, които са в обхвата на активност до вода, концентрираната сярна киселина може да се редуцира до серен оксид (IV) SO2, сяра S или вода H2 S се отлага в дейността на метала и ума по време на реакция. Например:
4Zn + 5H2 SO4(кинети) = t 4ZnSO4 + H2S+ 4H2O.
Да гадаем, студено е, алуминий и други дякони, за най-големите умове, минават през концентрирана сярна киселина.
Сярната киселина се концентрира при взаимодействие с прости говорни неметали, например със сяра:
S + 2H2SO4 = t3SO2 + 2H2O.
Оксидиращ богато сгъваем органични кълнове, сярна киселина изгаря хартия, плат, дърво, дрехи и shkir. Затова внимавайте с концентрираната сярна киселина.
Сярната киселина се концентрира за отстраняване на други, летливи киселини и техните соли. Например:
NaCl (tv) + H2SO4 (конц.) = t NaНSO4 + HCl.
В Република Беларус сирийската киселина се вибрира от БАТ „Гомелски химически завод“, БАТ „Гродно Азот“.
Области на стагнация на сярна киселина
Смърдите представят малкия 63.
Мал 63. Застой на сярна киселина
Сярната киселина H2SO4 е мазна, мазна родина без мирис.
Сярната киселина се разтваря при взаимодействие с метали, така че може да бъде активна до един ден; с метални оксиди; с основите; от соли.
При взаимодействието на концентрирана сярна киселина с метали вода не се вижда.
За киселинното проявление на сярна киселина и її соли във водните рози се използват бариеви соли.
Запитване и задача
1. Запишете формулите за вашите оксиди и циснови киселини. Посочете степента на окисление на атомите на сирка в тях.
2. Vznachete masu s_rki, scho изгори в кисело, yakshcho в баща видя 29,69 kJ топлина. С какво е химичното количество серен оксид (VI), уреден с? Топлинният ефект от реакцията на горещия въздух става 296,9 kJ/mol.
3. Koristuyuchis таблица rozchinnosti соли, киселини и основи във вода, съхранявайте 2 равни реакции разредена сярна киселина със соли. Напишете съвпадение
v молекулен и йонен вид.
4. Разрешете масата и химичното количество бариев сулфат, който се разтваря при разреждане със сярна киселина на базата на бариев нитрат с маса 200 g, масова част на Ba (NO 3 )2 имат цена от 10%.
5. Копирайте от текста на параграфа равни реакции, които характеризират химическата сила на концентрираната сярна киселина. Определете степента на окисляване на атомите в сирка в нейните spolukah. Кожната реакция показва окислител.
6. Всеки обем концентрирана сярна киселина (= 1,83 g/cm 3) с масова част H2SO4 98% от необходимото разпределение на средната маса 6,4 r?
7. Дайте коефициентите за схемите за изравняване на настъпването на окислително-окислителни реакции:
а) HBr + H2SO4 → Br2 + SO2 + H2O; б) CaSO4 → CaO + SO2 + O2;
в) K2S + HClO → K2SO4 + HCl.
Кожната реакция показва окислител.
§ 40. Разбиране за изхода на продукт от химическа реакция
Chemіchnі rіvnyannya, skladі z urakhuvannymi mіchіchnі vіlkії mаsi rіchіvіn, позволяват razrahunki, zоkrema count masu, сhіmіchnu kіlkіst kіlkіst і в реакционния продукт. На практика много реакции се обръщат, част от речта се използва в резултат на изпаряване, отделяне или приемане на странични продукти. За този продукт реакцията трябва да е по-малка, по-ниска, би било по-малко вероятно да се случи, докато реакцията е равномерна. По този начин, ако теоретично се приеме като безрисково за еднаква реакция на масата, или химическото количество на продукта е 100%, то в реалния процес продукцията на продукта ще бъде по-малка от 100%.
Той се обозначава в продукта на реакцията с буквата на гръцката азбука (tsya) и се появява в части от единичния чи vіdsotkah.
Излишна химична реакция към продукта - стойността, която добавя към количеството тегло (обем, химическо количество), действително отстранено от продукта, към теглото (обсягу, химическо количество) на продукта, изчислено за еднаква реакция:
Във всички тези варианти ще намерите една и съща стойност за изхода на продукта от химическата реакция. Например, както обикновено, за реакцията на окисляване на серен оксид (IV) до серен оксид (VI)
2SO2 + O2 2SO3
vihіd стават 80% (или 0,8), tse означава, че със серен(IV) оксид с тегло 64 g (обем 22,4 dm3, химично количество 1 mol) обем 22,4 dm3, химическо количество 1 mol) и маса 80 g ∙ 0,8 = g (обем 17,9 dm3, хим. количество
От величината на продукцията на стоките в реалния производствен процес, бързайте да vysnovok за povnotі perevorennya syrovini, vitratah energії, nebhіdnіst въвеждане на допълнителни операции и іn.
Нека да разгледаме няколко примера за rozrahunkiv от концепцията за „извън продукта на реакцията“.
дупе 1. В резултат на попарване на сирка с маса 48 g се извади сирка(IV) оксид с обем (n.a.) 28,6 dm3. Определете срока на годност на реакционния продукт.
m(S) = 48 g | 1. Значително химично количество сирка, |
||||
V практика (SO2) = 28,6 dm3 | реагира: | ||||
Госпожица) | |||||
(SO2)=? | n(S) | ||||
ГОСПОЖИЦА) | 32 g/mol |
||||
2. Сравнително еднаква реакция със серен оксид (IV): S + O2 = SO2.
3. Знаем теоретичното количество серен оксид (IV):
1 mol S - 1 mol SO2;
1,5 mol S-1,5 mol SO2.
Разбиране на продукта от химическа реакция |
4. Знаем теоретичната стойност на серен(IV) оксид:
V теория (SO2) \u003d n теория (SO2) V m = 1,5 mol 22,4 mol / dm3 = 33,6 dm3.
5. Разрахуймо от реакционния продукт:
Vidpovіd: vyhіd към реакцията на лекарството dorіvnyuє 85%.
Пример 2. Изберете масата на пирит FeS2, която е необходима за жизненост, за да вземете оксида (IV) с обем (n.a.) 8,96 dm3, така че изходът на реакционния продукт да стане 90%.
V(SO2) = 8,96 dm3 | 1. Значителна теоретична стойност на серен(IV) оксид: |
|||||||||||
(SO2) = 90% | V практичен | V практичен | ||||||||||
m (FeS2) =? | Теория на звездите V = | |||||||||||
V теория | ||||||||||||
Vтеор (SO2) = | V практически (SO 2) | 8,96 dm 3 | 9,56 dm3. |
||||||||||
2. Знаем теоретичното химично количество на серен оксид (IV): |
||||||||||||
n теория (SO 2) | V теория (SO 2) | 9,56 dm3 | ||||||||||
22,4 dm3/mol |
||||||||||||
3. Сравнително равно на реакцията на серен(IV) оксид и химичното количество пирит, което е необходимо за випала:
x mol 0,4 mol
4FeS2 + 11O2 = 8SO2 + 2Fe2 O3, 4 mol 8 mol
x = 0,2 mol.
3. Значително масу пирит, който е необходим за получаване на випал: m (FeS2) = 0,2 mol 120 g/mol = 24 g.
Индикация: за притежаване на серен оксид (IV) е необходим пирит с маса 24 g.

Излишна химическа реакция към продукта - стойността, която увеличава количеството тегло (obsyagu, химическо количество), действително отстранено от продукта, до масата (obsyagu, химическо количество) на продукта, изчислено за еднаква реакция. Появява се на части от един и няколкостотин.
Запитване и задача
1. Защо практическият резултат от реакционния продукт трябва да звучи по-малко, теоретично по-малко от цената на равната реакция?
2. При реакцията на sirka с водно химично изчисление от 1 mol, sirkovodny се разтваря с химическо изчисление от 0,85 mol. Определете срока на годност на реакционния продукт.
3. В резултат на това взаимодействието на бариев хлорид с маса 200 g от сярна киселина се утаява с бариев сулфат с маса 100 g.
4. Определете обема (n.a.) на това химично количество серен(IV) оксид, който, след като е бил разтворен при изгаряне на сярата, с тегло 64 g, което означава, че продуктът от реакцията е 75% по-здравословен.
5. Изчислете масата на изгорялата сирка, както и пропуснете сирка (IV) оксид, обем (n.a.) 89,6 dm3 3 да стане 80% от теоретично възможното.
6. Очевидно, шо се отделя до серния оксид (VI), който е отстранен по време на окисляването на серния оксид (IV),
по-скъпи с 85%. Определете масата, обема (n.a.) и химичното количество на серен(IV) оксид, който, след като е влязъл в реакцията, отстранява по този начин серния(VI) оксид по обем (n.a.) 2,24 dm3.
7. Изберете масовата част на солта в състава, която се отстранява в случай на разпределение на midi, с маса 3,2 g и сярна киселина с маса 192 g, така че добивът на реакционния продукт да стане 85% .
§ 41. Азот и фосфор
Азот N и фосфор Р се смесват в група VA на периодичната система. Mish'yak As, антимон Sb и бисмут Bi могат да се видят преди групата на периодичната система. Азотът и фосфорът са неметали, мишъяк и антимон се довеждат до napіvmetalіv, а висмутът лежи в металите.
Будова атоми този етап на окисление
Атомите на елементите от групата VA имат по 5 електрона на външно енергийно ниво, електронната конфигурация на тяхното външно енергийно ниво ns 2 np 3 например: азот - 2s 2 2p 3 фосфор - 3s 2 3p 3.
7N↓ | 15p↓ |
Мениджър.
- Защо viklikana е такава промяна? На какво господство на бихромат се основава животът на хромовите сумиши за прибори за ръкавици?
- Налейте 5-6 капки калиев дихромат и 3 капки сярна киселина в епруветка. Добавете 2 капки калиев йодид и разредете епруветката с 10 капки вода. Прехвърлете с пипета в друга епруветка част от нея и добавете капка нишесте. Какво се промени за нишестето? Защо? Сгъване на ОВР и звняти по електронно-йонния метод.
- Значителна характеристика на елемент 15 R. Доминиране на алотропни модификации на фосфора. Взаимодействие на фосфора с прости и сгъваеми речи.
Във фармацевтиката живачен оксид (II) се застосова като по-нисък антисептичен засиб за приготвяне мехлеми за очи, як притежават разреден разтвор на натриев хидроксид върху търговска сол на живак.Всички операции се извършват на тъмно.
Мениджър.
1. Напишете подходяща реакция към живачен оксид (II). Обяснете защо е необходимо да се извършват операции в тъмнината?
3. Основни закони на химията.
Vikoristannya с цинк в медицината се основава на йога тарт, антисептично действие. 0,25% цинков сулфат е викор за приготвянето на офталмологични капки заедно с 2% борна киселина.
Мениджър.
- Приготвя се 0,25% разтвор на цинков сулфат в обем от 100 ml (ρ = 1,02 g/ml).
- Създайте трансформация
Zn→ZnCl 2 →ZnSO 4 →Zn(NO 3) 2 →Zn(OH) 2 →Na 2 →NaCl
- Ковалентна връзка, назначение, виждате ли, механизмът на просветлението, силата. Валентност. Етап на окисляване.
· Фармацевтът трябва да контролира вискозитета на физиологичния препарат по метода на перманганатометрията.
Мениджър.
1. Напишете подобна реакция и сравнение с помощта на електронно-йонния метод.
2. Изчислете количеството от 0,5% (ρ = 1,004 g/ml) количество натриев хидроксид, необходимо за реакцията с 0,1 M количество хлорид (III) от 20 ml.
3. Периодичен закон периодична системапри светлина vchennya за живота на атома.
· Zalіzo, vіdnovlene, scho stosovuєtsya vnutrіshno yak protianemіchne zasіb, maє но vilno vіd vіd domіshok sulfіdіv midi, vugіllya, силициева киселина, mish'yaku.
Мениджър.
1. Поискайте начин за обезопасяване на входа на къщата. Obguruntuvati vіdpovіd.
3. Основният тип химическа връзка. Природата ще направи химическа връзка.
· За организма на перманганат є otrastami, їkh zneshkodzhennya прекарват z vokoristannyam 3% воден разтвор на H 2 Pro 2 подкиселена очна киселина.
Мениджър.
1. Напишете подобен отговор. Изследвайте реакцията по електронно-йонния метод
- Оксиди, назначаване, класификация, номенклатура, власт и методи на притежание.
· Анализът на речта при приготвянето на слюнка се извършва по метода на перманганатометрията, базиран на способността на Fe2+ да се окислява до Fe3+. Долната част на вдишвания въздух се отделя от сярната киселина при нагряване и след охлаждане се титрува с 0,1 N калиев перманганат.
Мениджър.
1. Напишете равните реакции, които са в основата на определението.
2. Пригответе 200 ml 0,1 N KMnO 4 (коефициентът на еквивалентност зависи от реакцията).
3. Киселинност, наименование, класификация, номенклатура, авторитет, методи на притежание.
· Фармакопейното лекарство нитратът е отстранен от следващия ранг: медно-сребърната сплав се отделя от азотната киселина, за да се пречисти отстраняването на нитратите от къщите, тя се утаява със солна киселина. Обсадата, която е вийшов, се възстановява с цинк в киселата среда и се сбръчква, звилене в къщите, отново се напръсква в азотна киселина.
Мениджър.
- Напишете реакциите rіvnyannya іdpovіdnyh.
- Vikonaty akіsnі реакции на Cl-, Br-, J anioni с различни нитрати srіbla, които са в основата на потвърждението на правилността на препарати от хлориди, йодиди, калиеви бромиди.
- Обосноваване, назначаване, класифициране, номенклатура, авторитет, методи на притежание.
9. Нитрат srіbla zastosovuєtsya zvnіshno при erozіyah, vyrazkah, гострома конюнктивит в viglyadі 2,5 и 10% водоснабдяване.
Мениджър.
- Приготвя се 2% разтвор на AgNO 3 с обем 50 ml (ρ= 1,015 g/ml). Какви умове са необходими, за да се грижим за този rozchin?
- Създайте трансформация
Ag→AgNO 3 →AgCl→ AgNO 3 →Ag
- Сол, обозначение, класификация, номенклатура, авторитет, методи на притежание.
· Фармацевтът трябва да извърши идентификацията на фармакопейното лекарство бариев сулфат.
Мениджър.
1. Какъв е методът на бариевия сулфат в медицината? Защо бариевият сулфат се легира с натриев карбонат преди идентификационните реакции? Vidpovіd потвърдено от равни реакции.
2. Реакции на Виконати и идентифициране на соли BaSO4, CaSO4, Na2SO4.
3. Комплексни сполуки, обозначение, будов за А. Вернер, естеството на химическата връзка, класификация, номенклатура, дисоциация. Zastosuvannya комплекс spoluk в медицината и химичния анализ.
· Фармацевт, при работа с концентрация на амоняк, допуснал груба повреда на предпазното оборудване - извършил работата по оцветения гардероб без повишено сцепление.
Мениджър.
- Какви са последствията, които могат да бъдат използвани при работа с концентрация на амоняк без допълнителни предпазни средства? Yaku pershu медицинска помощ е необходимо да се приложи в случай на отровни пари на амоняк.
- Създайте такава трансформация.
(NH 4) 3 PO 4 →NH 3 →NH 4 NO 2 →N 2 →NO→ NO 2 →HNO 3 →Hg(NO 3) 2 →NO 2
Напишете уравнението на реакциите за молекулярния и йонния вид, а за OVR - погледнете по метода на електронния баланс.
- Химическа кинетика. Скоростта на химическата реакция. Влиянието на различни фактори върху скоростта на химичните реакции.
· Zі spoluk азот в медицината zastosovuyutsya амоняк във вода, сол, амоний, динитрогенен оксид и натриев нитрит.
Мениджър.
- Какъв е методът за победно отдаване на азот? Напишете формулите на тези речи и равни реакции, които характеризират основните сили.
- Напишете равната реакция на натриев нитрат с калиев перманганат в киселинната среда. Изследвайте реакцията по метода nap_reactions
- Необратими и върколаци химична реакция. Химически ревностен. Масов закон за равни системи. Константа на собствения капитал. Принципът на Льо Шателие.
· Фармацевтът трябва да извърши идентифициране на соли на натриев сулфат, натриев хлорид, натриев бикарбонат.
Мениджър.
- Vikonaty akіsnі реакции към йони SO 4 2-, Cl-, HCO 3-.
- Razrahuvati, skіlki gram_v кристалохидрат Na 2 SO 4 10H 2 O е необходимо фармацевтът да запари във вода с маса 500 g, за да вземе 5% Na 2 SO 4 ?
- Реакции оксид-вода. Основните положения на електронната теория на реакциите, стимулиращи окислението. Най-важните окислители и водачи. Zrivnyannya оксидно-водни реакции по метода на електронен баланс и йонно-електронен метод.
Силата на калия на сярната киселина изглежда е богата на чужди за тялото лекарства (ксенобиотици) - лекарствени препаратитези метаболити с разтворите на някои малки речи - конюгати, които лесно се отделят от тялото.
Мениджър.
- Отстранете силата на калия на сярната киселина по различен начин, заместен на реактивната маса. Напишете реакциите rіvnyannya іdpovіdnyh.
- Съберете молекулярните равенства на реакциите, които се изразяват с такива бързи йонни равенства:
S 2- + H 2 S → 2HS -
S 2- + 2H + → H 2 S
HS - + OH - → S 2– + H 2 O
· Дисперсионни системи, обозначение, класификация. Суспензии, аерозоли, емулсии. Избор на грубодисперсни системи в медицината и фармацията.
Фармацевтът трябва да вземе 5% сярна киселина.
Мениджър.
- Какъв е депозитът на окислителното свойство на аниона SO 4 2 в концентрацията на киселина? Напишете уравнението на реакциите, които характеризират мощността на разтворената и концентрирана киселина.
- Приготвя се 5% разтвор на сярна киселина, като се промиват 50 ml сярна киселина с масова част H2SO4 30%.
- Колоидни разчини, класификация, обозначение, молекулярна кинетикаче оптична сила, otrimannya. Стабилността на колоните. Коагулация. Пептизация. Будова мицел. Диализа.
· Сирка, която влиза в склада на аминокиселини, се окислява в организмите. При ендогенната сярна киселина участва в екзогенните спори - фенол, крезол и индол.
Мениджър.
- Опишете силата на сярната киселина и отменете правилата за работа с киселини.
- За да се разтвори какъв обем сярна киселина с масова част H 2 SO 4 25% и дебелина 1,18 g / ml трябва да се вземе за неутрализация с калиев хидроксид, обем 50 ml, с масова част от KOH 12% и дебелина 1,1 g/ml
- Истинската разлика, обозначение, основно разбиране, същност на процеса на диференциация. Дифузия. Осмоза. Осмотично менгеме.
· В индустриалните зони, където има много вугиля, често падат кисели гори.
Мениджър.
- от какво си химически склад acid dosch близо до tsikh райони? Как правиш вино? Напишете еднакви реакции.
- Сгънете молекулярните и краткотрайните йони, равни на хидролизата на напредващите соли:
K 2 S, Na 2 SO 4, Na 2 SO 3, Al 2 (SO 4) 3, Cr 2 S 3
Околосветското плаване е установено в природата в страхотни числаза rahunok биохимични процеси и отмъщение в pro sirchanih минерални води.
Мениджър.
- Силата на деня.
- Създайте трансформация:
H 2 S → SO 2 → H 2 SO 3 → NaHSO 3 → Na 2 SO 3
Напишете уравнението на реакциите за молекулярния и йонния вид.
- Дисоциация на киселини, основи, соли, вода. Киселинно-основни равни в rozchinah. Ionny dobutok вода, pH-определяне.
· Официален лекарствен препарат от сирка є сирка, облицована с (Sulphur praecipitafum).
Мениджър.
- Опишете силата на свободната сирка и алотропните модификации на сирка.
- Създайте трансформация:
Зривняти реакции по метода на електронния баланс.
- Хидролиза. Същността на процеса на хидролиза. Хидролиза на различни видове соли. Етапна хидролиза. Приток на различни фактори на етапа на хидролиза.
· Фармацевтът провежда реакцията на идентифициране на 3% разтвор на воден пероксид: до 1 ml от крайния разтвор се добавят 1 ml разредена сярна киселина, 1 ml етер и 0,5 ml калиев дихромат, в резултат на което се получава топката от етерът се превръща в син цвят в присъствието на киселина 6
Мениджър.
- Vikonaty реакция іdentifіkatsії vodny пероксид.
- Напишете еднаква идентификация на водния пероксид и баланса по метода на електронния баланс.
- Характерна характеристика на елементите на главната подгрупа от VII група и на тяхната половина. медицински биологично значениехалогени.
· Кисен е фармацевтичен препарат и описания в GF. Yogo zastosovuyut за вдишване за различни видове киселинно гладуване.
20. Мениджър.
- Напишете равните реакции на разкритите къщи CO, 2, NO, NO2.
- Напишете равните реакции, които са в основата на лабораторния метод за отстраняване на киселина. Индукция на реакцията по метода на електронния баланс
- Хлор, хлорна вода, солна киселина, хлорид. Физическа и химична сила на хлора и його сполук. Медико-биологично значение на халогените.
· Фармацевт преглежда валидността на лекарства на базата на натриев хлорид, натриев бромид и натриев йодид.
Мениджър.
- За такива цели в фармацията и медицината се използват викорни соли.
- Vikonaty akіsnі реакции към анион Cl-, Br-, J-.
- Физическа и химична сила на киселия хлор. Otrimannya. Zastosuvannya.
· Един от индустриалните методи за извличане на йод за фармацевтични цели е процесът на получаване на йод от сондажни води. Йодидът, който се намира в близост до сондажни води, се окислява по схемата:
NaJ + NaNO 2 + H 2 SO 4 → J 2 + Na 2 SO 4 + NO + H 2 O
22. Мениджър.
- Как се приготвя йод и как да се използва в медицината.
- Изследвайте реакцията, която е в основата на манията по йод, чрез метода на реакцията.
- Критична характеристика на халкогените. Мощност кисел и його наполовина. Медико-биологично значение на киселостта.
· Фармацевтът определя правилността на препарати от натриев, калиев и калциев хлорид.
Мениджър.
- За такива цели використите се използват във фармацевтичните препарати.
- Реакции на Виконати _идентификация на тези соли.
- Наполовина кисел с вода. Физически и химични сили на водата. Воден пероксид, господство, задръствания в медицината. Значение на водата в живота на организмите.
· Zі spoluk halogenіv z кисел по-малко хипохлорит, за да представлява интерес за медицината като дезинфектант.
Мениджър.
- На каква мощност на хипохлоритите се основава денят за дезинфекция? Напишете реакциите rіvnyannya іdpovіdnyh.
- Razrahuvati, skіlki gramіv хлорна баня трябва да се вземат за otrimannya 2 литра активен хлор.
- Сирка и її от пода. Алотропия на свободната сирка. Физическа и химична сила на сирка, сирководня, сирководня киселина и її соли.
· При недостатъчна киселинност на сока от черупките се предписва вътрешно разредена хлороводородна киселина.
Мениджър.
- Избройте общите правила за работа с киселини.
- Razrahuvat, skіlki ml от 36,5% - разнообразие (ρ = 1,19 g / ml) солна киселина и е необходимо да се вземат за приготвянето на 100 ml. 8,2% - ох (ρ=1,040 g/ml) киселина.
- Физическа и химична сила на оксиди на сяра, сярна киселина, сярна киселина. сулфит. Сулфати. Сила, мания, застосуване.
· Във фармацията един от стандартните размери е 33% калиев ацетат, което е начин за разпределяне на калиев карбонат в 30% - октова киселина.
Мениджър.
1. Напишете уравнението на реакцията за молекулярния и йонния вид.
- Значителна характеристика на елементите на главната подгрупа от група V. Доминирането на свободния азот. Стойността на азота в живота на организмите.
· Предписания на речи, които са силни основи и слаби киселини. За прилагането на GFH като стабилизатор се добавя 0,1 n разтвор на натриев хидроксид към 4 ml на 1 литър продукт.
Мениджър.
- Напишете уравнението за реакцията на хидролиза на сол CH3COONa.
- Razrahuvat, skilki грама NaOH е необходимо да се обади, за да се вземат 500ml 0.1n размер. Подгответе всички проекти за най-новата технология за безопасност.
- амоняк. Амониева сол. мощност. Zastosuvannya в медицината и фармацията.
· Фармацевт приготвя мехлем по рецепта: 1 g калиев карбонат и 0,5 g натриев тетраборат се смесват в 70 ml дестилирана вода, 10 g стеарин се слива с 15 g вазелиново масло и се добавя на тънка струйка при смесване с топла вода до карбонат. .
Мениджър.
- Какви речи се уреждат след кое смешване? Като средата е уредена и защо? Vidpovіd потвърдено от равни реакции.
- Подготовка на техно-химичен vag за роботи. Вземете 1 g калиев карбонат на техно-химични обекти.
- Оксиден азот. Азотна киселина и її соли. Физическа и химическа сила. Медико-биологично значение на азота
· Необходимо е фармацевт да приготви 0,05% калиев перманганат в обем 200 ml за изплакване на празна уста и гърло.
Мениджър.
- На каква основа се корени калиевият перманганат в йога ликувална дия? Yakі spoluky манган zastosovuetsya в ликуващи цели?
- За да поръчате 200 ml 0,05% KMnO 4 (ρ= 0,9994 g/ml), е необходимо да се добавят скалирани грамове KMnO 4 . Демонстрирайте техниката на изготвяне на този дизайн.
- Будов молекули на азотна киселина. Физическа и химична сила на азотната киселина и нейните соли. Медико-биологично значение на азота и ее сполук.
· Във фармацевтичните продукти, живачен оксид (II), който е викозен като антисептичен засиб, се отделя от натриевия хидроксид върху търговска сол на живак (II).
Мениджър.
1. Напишете подходяща реакция към живачен оксид (II). Защо реакциите трябва да се провеждат при джуджета?
3. Основни закони на химията.
K 2 Cr 2 O 7 + H 2 O 2 + H 2 SO 4 = K 2 SO 4 + H 2 CrO 6 + H 2 O
Перхромната киселина, която се разтваря с циома, H 2 CrO 6 е синият цвят. Замърсяването със синя киселина потвърждава ефективността на подготовката на H2O2.
Мениджър.
- Zrivnyati tsyu реакция по електронно-йонен метод.
- Yakі spoluky хром показват окислителна сила, и yakі - vodnovlyuvalnі?
- Доминирането на фосфин, фосфорни оксиди и фосфорни киселини, тяхното притежание. Медико-биологично значение на фосфора
· Sumish магнезиев оксид (85%) и магнезиев пероксид (15%) - лекарство, известно като "магнезиев пероксид", което zastosovuyut при лигавично-чревни нарушения.
Мениджър.
- Обяснете антиацидно и бактерицидно лекарство. Vidpovіd потвърдено от равни реакции.
- Razrahuvat, skilki грама MgO и MgO 2 трябва да вземете, за да приготвите 100 g от това лекарство. Обадете се на техно-химичен терес 10 g магнезиев оксид.
- Характерната характеристика на елементите от IV група на основната подгрупа. Будова, Физическа силаалотропи във въглищата. Химическа сила на свободните въглища.
· Разградете натриевия бикарбонат (сода за пиене), за да застосвате при вида на изплакване, изплакване с пламтящи заболявания на очите, лигавиците на горните дихателни пътища.
Мениджър.
- На каква сила на натриевия бикарбонат се корени в антисептично действие? Vidpovіd потвърдено от равни реакции. Можете ли да викорирате като антисептик zasib натриев тетраборат Na 2 B 4 O 7 ∙ 10H 2 Pro?
- Приготвя се 5% NaHCO3 в обем 50 ml (=1.036 g/ml).
- Молекули на Будов, физични и химични сили на киселото от въглен. Медико-биологично значение на въглерода и йога.
· Антиацидни препарати, които отмъщават на натриевия бикарбонат, заместник в случай на различни заболявания, които са придружени от повишена киселинност, tobto. ацидоза.
Мениджър.
- На каква сила на сол действат антиацидните препарати? Vidpovіd потвърдено от равни реакции. Могат ли да се използват други речи за тези цели?
- Създайте трансформация:
NaOH→NaHCO3 →Na2CO3 →NaCl→NaNO3
Напишете уравнението на реакциите за молекулярния и йонния вид.
Реакции на Виконати Na 2 CO 3 →NaCl→NaNO3.
- Силиций и його половина, знание за природата, отримания, физическа и химическа сила. Медико-биологично значение на силиция.
· 2,5% разтвор на NaCl се прилага вътрешно за промиване на дренажа, когато AgNO 3 е замърсен.
Мениджър.
1. На какво се основава NaCl? Vidpovіd потвърдено от равни реакции.
3. Основна характеристика на елементите на основната подгрупа от III група. Мощна гора и його сполук. Медико-биологично значение в медицината.
· За разработването на редки лекарствени форми, признати за инжекции, заместни изотонични разновидности.
Мениджър.
1. Какво е изотоничен сорт? Защо йога се нарича изотонична?
3. Алуминий и йога от пода, доминион, отримания. Медицинско и биологично значение на алуминия.
· 3% воден разтвор на воден пероксид zastosovuyut като ефективен бактерициден zasib.
Мениджър.
1. Каква е основата на бактерицидната и кръвната гръбначна пероксидна вода. Какви чужди вписвания е необходимо да бъдат изрязани при работа с перхидрол?
2. Разрахуват, скилки мл. перхидрол (30% воден разтвор на H 2 Pro 2, ρ = 1,1 g / ml) трябва да се вземе за приемане на 500 ml от 3% разтвор (ρ = 1,005 g / ml). За да се подготви tsey rozchin z dotrimannym tehnіki bezpeka.
3. Метали от главната подгрупа от II група. Zagalna характеристика, otrimannya, физическа и химическа мощност. Соли на калций и магнезий. Твърдостта на водата. Usunennia zhorstkostі вода. Медико-биологично значение на елементите в основната подгрупа на II група.
· Съвременната фармацевтична индустрия произвежда лекарствени препарати според агрегатния лагер, вида на дисперсните системи, начина на въвеждане в организма.
Мениджър.
1. Кои системи се наричат дисперсни?
Как се класифицират дисперсните системи?
Изглеждат ли като диспергирани системи, разпределящи лекарствени препарати? Дайте конкретни примери.
- Отстранете хидрозола на колофона, като смените търговеца на дребно.
- Характерна характеристика на локвите метали, мания, физическа и химическа сила. Най-важните части от лунните метали. Медико-биологично значение на локвите метали
· При вида на водните разлики в различни речи, zastosovuyutsya rіdkі лекарствени форми, които могат да бъдат взаимно взаимни.
Мениджър.
- Spravzhnі rozchini, rozchinnist, nasicheniya, nenascheniya, renasistheniya rozhchiny. Какви служители могат да държат речи?
- Приготвя се 5% CuSO 4 с обем 100 ml (ρ = 1,051 g / ml) със син витриол CuSO 4 ∙ 5H 2 O
- Характеристика на d - елементите. Метали от странични подгрупи от 1-ва група и сполук. Медицинско и биологично значение.
· В Русия има електрообработка на сок и пресни билки с ниско съдържание на сок и дива сировина: горски плодове, плодове, кореноплодни зеленчуци, различни органи на същества с метода за виждане на сокове (вътрешно смесени) в роден вид. Вътрешното пространство е колона от бели, нуклеинова киселина, въглехидрати, танини
Мениджър.
1. Какъв вид разлики се наричат колонни модели? Как се класифицират миризмите? Избройте мощностите на колоните. Какъв процес лежи в основата на виждането на сокове от росна сировина?
2. Отстранете хидрозолния хидроксид на физиологичен разтвор (III) чрез хидролиза на FeCl 3. Напишете схемата на мицела.
- Метали от вторични подгрупи от II група, обща характеристика, структура, физична и химична мощност. Медицинско и биологично значение.
· При приготвяне на таблетки на базата на екстракт от корен на валериана не се препоръчва използването на використат магнезиев карбонат като основен бустер, тъй като може да предизвика неутрализиране на изовалерианова киселина и ruynuvannya valtrativ - rechovina, още по-чувствителна към инфузия на ливади.
Мениджър.
1. Обяснете проявата на силата на локви на магнезиев карбонат. Напишете уравнението на реакцията за молекулярния и йонния вид. Какви напомняния може да се използва використ за приготвяне на таблетки с екстракт от валериана?
2. Създайте трансформация:
MgO→MgCl 2 →MgSO 4 →Mg(OH) 2 →MgOHCl
Напишете уравнението на реакциите за молекулярния и йонния вид.
3. Обща характеристика на елементи от VI, VII групи от странични подгрупи. Оксидно доминиране на хром, манган и техните части. Медицинско и биологично значение.
· Използването на въглероден диоксид във фармацевтичното производство за извличане на биологично активни речи от лекарствен росен сировин.
Мениджър.
- Върху какви господства във въглеродната киселина е поддържането на йога за тези цели?
- Създайте трансформация:
C→CH 4 →CO→CO 2 →BaCO3 →Ba(HCO3) 2 → BaCO3 → CO2
Напишете йонообменните реакции в молекулярна и йонна форма.
- Характерна характеристика на елементите от VIII група на вторичната подгрупа. Доминионът на залата и його сполук. Медицинско и биологично значение.
Списък с изпитни ястия от дисциплини
Основни понятия и закони на химията. Такава настройка на живота на атома.
Периодичен закон и периодична система D.I. Менделиев в светлината на живота на атома.
Назначаване, вижте, разберете, просветете, естеството на химическата връзка.
Назначаване, механизъм на просветление, сила на ковалентната връзка. Валентност. Етап на окисляване.
Оксиди: назначаване, класификация, номенклатура, власт и методи на притежание.
Киселини: обозначение, класификация, номенклатура, сила и методи на притежание.
Обосноваване: назначаване, класификация, номенклатура, власт и методи на притежание.
Соли: обозначение, класификация, номенклатура, авторитет и методи на притежание.
Комплекс spoluky: назначение, budova след Werner, tipi, номенклатура.
Скоростта на химическата реакция. Длъжностни лица, scho vplyvayut swidk_st химическа реакция.
Необратими и обратими химични реакции. Химически ревностен. Принципът на М. Шателие. Константа на собствения капитал.
Оксидно-окислителни реакции: най-важните, основните понятия, деня на окисление и обновяване, най-важните окислители и лидерите на реакцията.
Дисперсионни системи: обозначение, класификация. Груби системи: суспензии, аерозоли, емулсии.
Koloidni razchiny: vyznachennya, dominion, obsession, budova mycel.
Истински разлики: обозначение, основно разбиране, същност на процеса на диференциация. Дифузия. Осмоза. Осмотично менгеме.
Основните положения на теорията на електрическата дисоциация. Механизмът на електрическата дисоциация. Стъпка тази константа на дисоциация.
Дисоциация на киселини, основи, соли. Дисоциация на разликата в pH.
Същността на хидролизата. Хидролиза на различни видове соли. Етапна хидролиза.
Характерна характеристика на елементите от основната подгрупа на VII група. Медико-биологично значение на халогените
Хлор, хлорна вода и солна киселина. Отриманя, владение. хлорид.
Kisnevі spolukiхлор.
Критична характеристика на халкогените. Кисен та його наполовина. Медико-биологично значение на киселостта.
Доминирането е наполовина кисело с вода (вода, воден пероксид). Zastosuvannya H 2 Pro 2 в медицината. Оловна стойност.
Сирка. Алотропия на свободната сирка. Химия на силата на света. Околосветско плаване. Серководна киселина и соли.
Физическа и химична сила на серни оксиди, сярна и сярна киселини, соли на сярна киселина, сярни киселини, тяхната стагнация.
Характерната особеност на елементите от основната подгрупа на група V. Азот и мощност.
Доминирането на амоняка и амониеви соли. Zastosuvannya в медицината и фармацията.
Оксиден азот. Азотна киселина и її соли. Физическа и химическа сила, stosuvannya.
Физическа и химична сила на азотната киселина. не харчи. Медико-биологично значение на азота и ее сполук.
Характеристики на елемент 15 R. Vile фосфор: алотропия, физическа и химична сила, мания.
Фосфин. Оксиди на фосфор и фосфорна киселина: сила, мания. Медико-биологично значение на фосфора
Характерната характеристика на елементите от IV група на основната подгрупа. Vuglets: Будова и физическо господство, алотропия vugletyu, химическо господство.
Kisnevі spoluky vugletsiu: Будова молекули, физическо и химическо доминиране. Медико-биологично значение на въглищата и йога сполук.
Силиций и його половина: познания за природата, мъжество, физическа и химическа сила. Медико-биологично значение на силиция.
Основна подгрупа от ІІІ група: основна характеристика на елементите. Бор и йога отстрани: отримване, физическа и химическа сила, застосуване в медицината.
Алуминий и йога фон: мания, физическа и химическа сила. Медицинско и биологично значение на алуминия.
Метали от главната подгрупа от 2-ра група: харизматични характеристики, мания, физическа и химическа сила. Соли на калций и магнезий. Твърдостта на водата. Usunennia zhorstkostі вода. Медико-биологично значение на елементите в основната подгрупа на II група.
Luzhnі хвърли: благотворителна характеристика, мания, господство, най-важното spoluchy. Медицинско и биологично значение.
Характеристика на d-елементите. Метали от вторичната подгрупа на 1-ва група. Pojdnannya midi, sribla. Медицинско и биологично значение.
Метали от страничните подгрупи от II група: критична характеристика на живота, физическа и химическа сила. Медицинско и биологично значение.
Странични подгрупи VI, VII от групата: характерната характеристика на елементите от подгрупата, доминирането на хром, манган и тяхната половина. Медицинско и биологично значение.
Подгрупа от VIII група: обща характеристика на елементите на подгрупата, силата на залата и його сполук. Медицинско и биологично значение.
Уреждане.На масата на кожата пред учениците има план на урока, схема за взаимодействие на азотната киселина с метали, набор от реактиви и тестове за фиксиране на усукания материал.
Оксиден азот
учител.Познайте и напишете формулата за азотни оксиди. Яки окси се наричат физиологичен разтвор, яки - нефизиологичен разтвор? Защо?
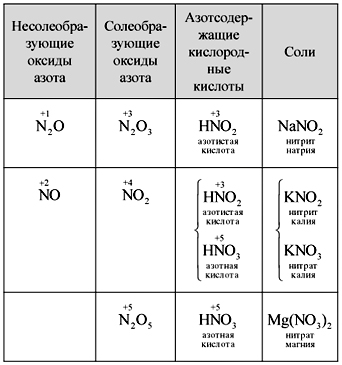
Научете се самостоятелно да записвате формулите на пет азотни оксида, да ги назовавате, да определяте азотната мъгла на кисневите киселини и да установявате реактивността между оксиди и киселини. Един от учениците е изписан на дош (таблица).
маса
Установяване на азотни оксиди, киселини и соли
Демонстрационен сертификат:
взаимодействие на азотен(IV) оксид с вода
учител. На плавателния съдНЕ 2 добавете малко вода и разбъркайте, след което опитайте да премахнете петната с лакмус.
Какво се пази? Rozchin chervonіє през две киселини, които са се утаили.
2NO 2 + H 2 O \u003d HNO 2 + HNO 3.
Етап на окисление на азотаНЕ 2 успех +4 тогава. то е междинно между +3 и +5, яки в розчини стийкиш, че на азотния(IV) оксид се дават две киселини - азотна азотна.
Склад, че Будова молекула
учител.Запишете молекулната формула на азотната киселина на дъската, изчислете молекулното тегло и степента на окисление на елементите. Сгънете структурни и електронни формули.
Научете се да създавате такива формули (фиг. 1).
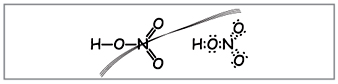
учител.Очевидно до тези формули десет електрона са увити около азота, но не можете да го използвате, т.к. азотът се намира в друг период и доколкото е възможно на външната топка, в новия, може да има по-малко от най-високите електрони. Тази повърхностност е установена, така че нека се приеме, че между азотния атом и единия атом, зад механизма донор-акцептор е установена ковалентна връзка(фиг. 2).
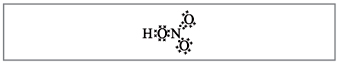
Мал 2. Електронна формула на азотната киселина.
Електроните на азотния атом са маркирани с черни точки
Същата структурна формула на азотната киселина може да бъде представена по следния начин(фиг. 3) :
Мал 3. Структурна формула на азотната киселина
(донор-акцепторна връзка на индикации със стрелка)
Въпреки това, от последния път се установи, че основната връзка е равномерно разделена между два атома на киселинността. Степента на окисление до азот в азотната киселина е +5, а валентността (за уважение) е повече от половината, повече от половината от високия електронен залог.
Физическа сила на азотната киселина
учител.Пред вас са бутилки с разредена и концентрирана азотна киселина. Опишете физическите сили, които можете да предвидите.
Научете се да описвате азотната киселина като важен източник за вода, жълтеникав цвят, с остър мирис. Азотна киселина Roschin без цвят и мирис.
учител. Ще добавя, че точката на кипене на азотната киселина е +83 ° C, точката на замръзване е -41 ° C, tobto. за великите умове на родината. Острата миризма и тези, които при запазване няма да изгорят, се обясняват с това, че киселината е концентрирана, слабо устойчива и е лека, или при нагряване често се разширява.
Химическа сила на киселината
учител. Познайте какъв вид речи да взаимодействате с киселини?(Научете се да назовете.)
Преди да реагирате, опитайте се да изброите реакциите и да запишете вашите предупреждения (реакциите трябва да бъдат записани в светлината на TED).
И сега сме дивашки спрямо специфичните сили на азотната киселина.
Ние казахме, че киселината, когато се спаси, сега се довежда от химическата реакция:
4HNO 3 \u003d 2H 2 O + 4NO 2 + O 2.
(Изследвайте самостоятелно електронния баланс на реакцията.)
„Зарови газ“, което се вижда(NO2) farbuy киселина.
Особено е необходимо да се извърши киселина, като се приведе до метал. Знаете, че са премахвали вода от различни киселини, но при взаимодействие с азотна киселина това не се отстранява.
Погледнете диаграмата на бюрото си, която показва как се виждат газовете при реакцията на киселини с различни концентрации с метали.(Робот с диаграма.)
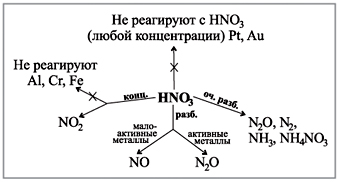
Демонстрационен сертификат:
взаимодействие на концентрирана азотна киселина с медовина
Още по-ефективно е демонстрирането на реакцията на азотна киселина (конц.) с миди прах или фино нарязани парченца медена стрела:
Научете се да записвате самостоятелно електронния баланс на реакцията:
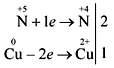
Притежание на киселина
учител. Урокът ще бъде неразбираем, сякаш не можем да видим хранителното притежание на азотна киселина.
Лабораторен метод: дия концентрирана сярна киселина върху нитрат (фиг. 5).
NaNO3+H2SO4=NaHSO4+HNO3.
В индустрията киселината се получава основно по амонячен метод.
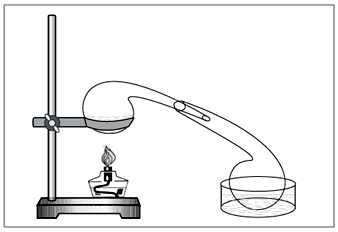
Мал 5. За изтегляне на азотна киселина в лабораторни дос
ръчно разбити стари химически стъклени съдове - реторта
Методът за задържане на киселина с азот и киселина при температура над 2000 ° C (електрическа дъга) не отстранява никакво специално разширение.
В Русия историята на въвеждането на азотна киселина е свързана с името на химика-технолог Иван Иванович Андреев (1880–1919).
Вин и 1915г като създава първата инсталация за редуциране на киселина с амоняк и внедряването на метода на разширяване в заводски мащаб през 1917 г. Първата фабрика за строителство близо до Донецк.
Този метод включва няколко стъпки.
1) Приготвяне на смес от амоняк на прах.
2) Окислението на амоняка отново е кисело върху платинен лист:
4NH 3 + 5O 2 \u003d 4NO + 6H 2 O.
3) По-нататъшно окисление до азотен (II) оксид до азотен (IV) оксид:
2NO + O2 = 2NO2.
4) Определяне на азотен оксид (IV) във водна киселина:
3NO2+H2O=2HNO3+NO.
Като се прави разлика в присъствието на кисело, целият азотен оксид (IV) се превръща в азотна киселина.
5) Последната стъпка в отстраняването на азотната киселина е пречистването на газове, като атмосферата, и азотните оксиди. Съхранение на газове: до 98% азот, 2-5% киселина и 0,02-0,15% азотни оксиди. (На първо място се използва азотът, взет за окисляване на амоняк.) Ако азотните оксиди в тези газове са повече от 0,02%, тогава каталитични надстройки до азот се извършват нарочно, тъй като такива малки количества от тези оксиди водят до големи екологични проблеми .
След всичко казано, постът е хранителен: имаме ли нужда от киселина сега?
Киселинна стагнация
учител.За ферментация се използва азотна киселина на викорис: азотен добрив и аминонитрат на първи ред (как се получава?); вибуховски речи (защо?); barvnikov; nitrativ, за yakі timetsya на предстоящия урок.
Прикрепен към материала
Фронтален клас опит
– Защо степента на окисление на азота в азотната киселина е +5, а валентността на chotiri?
- С какви метали азотната киселина не влиза в реакцията?
- Трябва да знаете солна киселина и азотна киселина, на масата има три метала - мед, алуминий и студен. Как обвинявате и защо?
Тест
Опция 1
1. Коя серия от числа показва разликата между електроните за енергия, равна на азотни атоми?
1) 2, 8, 1; 2) 2, 8, 2; 3) 2, 4; 4) 2, 5.
2. Завършете изравняването на практическите реакции:
1) HNO 3 (розб.) + Cu …;
2) Zn + HNO 3 (конц.) ...;
3) HNO3 + MgCO3 ...;
4) CuO + KNO 3 ... .
3. Кажете ми как да илюстрирам един от етапите на процеса промишлено производствоазотна киселина.
1) 4NH3 + 5O2 = 4NO + 6H2O;
2) 5HNO3 + 3P + 2H2O = 3H3PO4 + 5NO;
3) N 2 + O 2 \u003d 2NO.
4. Отрицателното окислително състояние се проявява от азота в следното:
1) N2O; 2) НЕ; 3) NO2; 4) Na3N.
5. Взаимодействия на медни стърготини с концентрирана азотна киселина за получаване до угасване:
1) NO2; 2) НЕ; 3) No 2; 4) NH3.
Вариант 2
1. Стойността на най-високата валентност за азот е една:
1) 1; 2) 2; 3) 5; 4) 4.
2. Можете да запишете комбинацията от концентрирана азотна киселина с агресивни метали: натрий, алуминий, цинк, желязо, хром.
3. Изберете реч, като сировина за извличане на азотна киселина:
1) азот и вода;
2) амоняк, многократна вода;
3) харчи.
4. Концентрираната азотна киселина не реагира с:
1) въглероден диоксид;
2) солна киселина;
3) въглища;
4) бариев хидроксид.
5. При взаимодействието на разредена киселина с магнезий се установява:
1) NO2; 2) НЕ; 3) N20; 4) NH4NO3.
Vіdpovіdі на тестове Опция 1. 1 – 4;
3 – 1; 4 – 4; 5 – 1. Вариант 2. 1 – 4;
3 – 2; 4 – 1; 5 – 4. |
Грамофон Tririvny Zalik 11 клас
Тема: " НЕМЕТАЛ"
Форма на урока:зала
Tsіl: преглед на придобитите знания на учениците по тема: “Неметали”; Научете повече за голяма мощнеметални, които са сполук; да продължи да формира уменията за стосуване на знания в нестандартни и житейски ситуации, в победи на индивидуални и диференциращи задачи.
мениджър:
1. Проверете знанията и затвърдете знанията на учените за нехвърлянето на тази половина; приемете развитието на умствената мисъл логично и свободата на химическата мина; преходът от формално - логическото усвояване на материала от тези към образно логическата идея с помощта на различни, изпълними и нестандартни задачи.
2. Да се развият навици за предпазливост, проява на помилване, скъпоценност на деня, умение да се види смъртта, да се оправдаят изкривените факти, да се изразят логически мислите и робитите на висновката; прочетете rozіrkovuvati, robiti разочаровам, предсказване.
3. Приемане на формирането на основните светогледни идеи чрез учебната дейност и творчеството на самостоятелността на учениците.
4. Vikhovuvati vminnya pratsyuvati независимо от zastosuvannyam самостоятелно, че взаимен контрол. Покажи zv'yazok от тези, които живеят за цял живот. Vihovuvati научен svetoglyad въз основа на vzaimozv'yazku власт и живот.
Притежавайки този реактивен:епруветки, алкохолни лампи, епруветки, сирники и други видове: ; ;
; ;
;
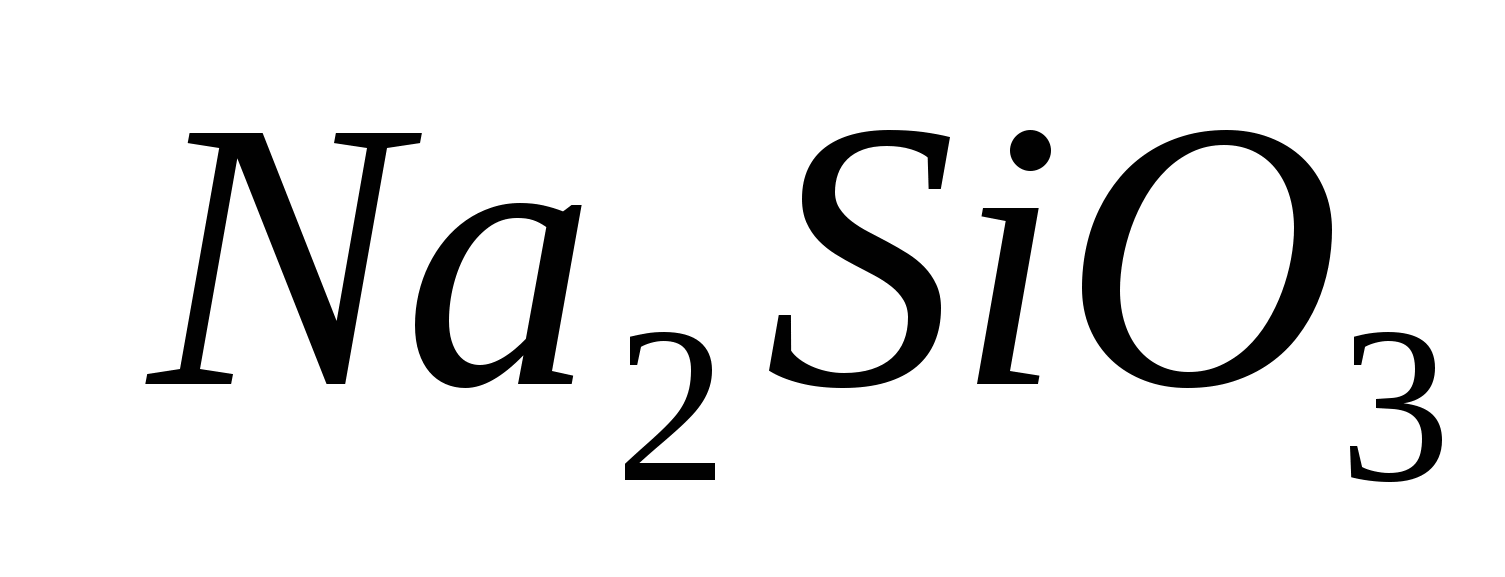 .
.
Подготовка за залата.
Учителят подготвя задачата от три равни гънки на обидните видове: тест, теоретично хранене, yakіsnі и rozrahunkovі zavdannya, zavdannya за трансформиране на речи.
Учителят подготвя учениците, как те преработват задачата.
За 1-2-ри от месеца в офиса до вратата се поставя информационен лист.
Маршрутният лист се вижда от кожата. Чернотата на работата на етапите е показана на маршрутните листове.
МАРШРУТЕН ЛИСТ.
Ф.И. изучаване на
Именуване на сцената
Броят на етапите
Номер на поръчка
Подпис на рецензента
Проблемът на Росрахун
Признание
Реинкарнация
Скрит урок.
Научете се да влизате в класа с маршрутни листи, 5 празни листа, с химикал и отидете на сцената, обозначения за № 1. Научете се да ограбвате задачата за равно сгъване и гарантирайте за новата буква chi us, на етап „ разпознаване на речи” преминават експеримента.
На скин етап се добавят 7 - 8 перца, проверяват се отново, поставят се в маршрутния лист rіven, бр.
Резултатът се определя като средноаритметично от всички етапи.
ДОПЪЛНЕНИЕ
"Разпознаване на речи"
1 rіven
1. Донесете присъствието на йона 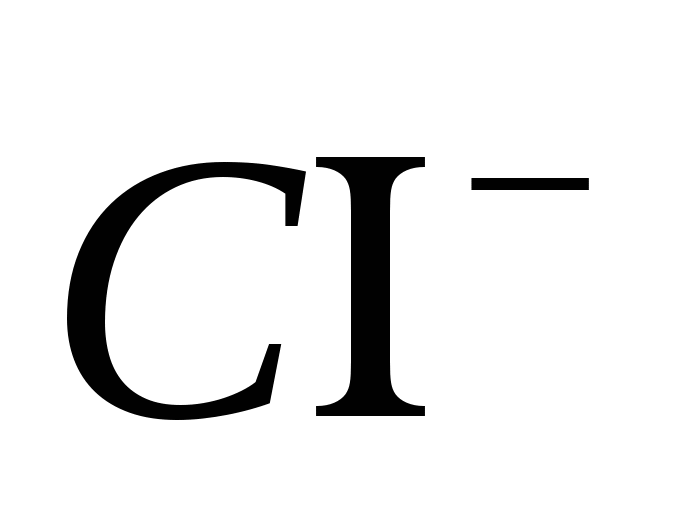
2. Донесете присъствието на йона 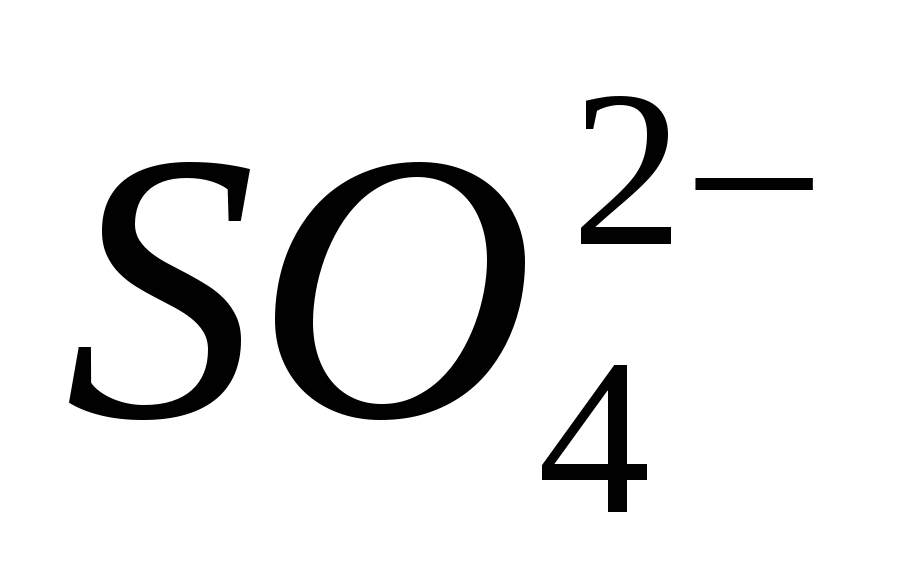
3. Донесете присъствието на йона 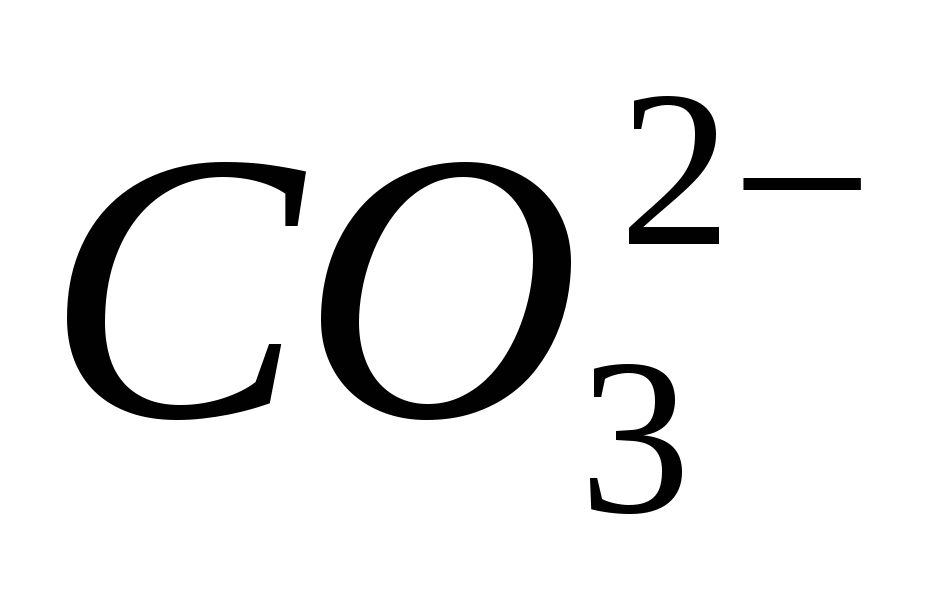
4. Донесете присъствието на йона 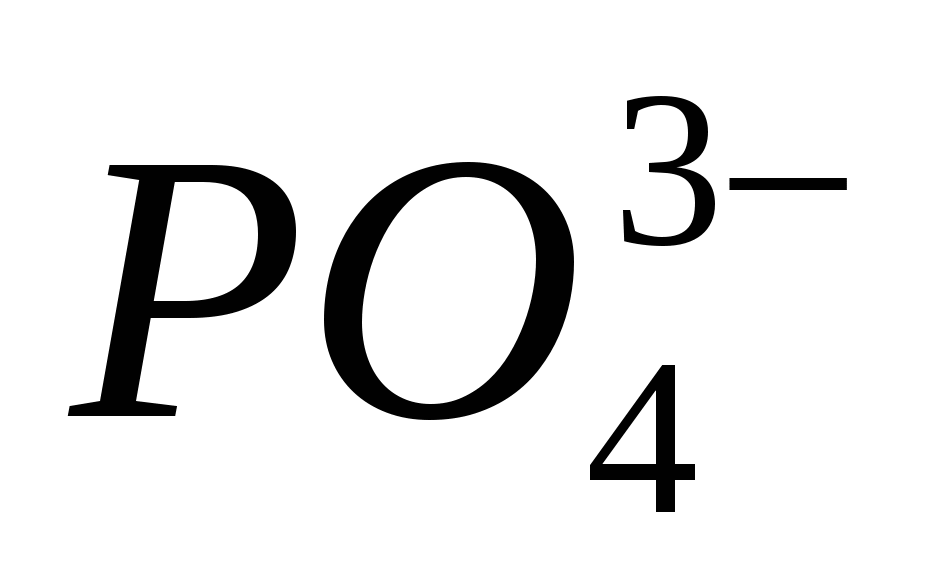
5. Донесете присъствието на йона 
2 rіven
1. Разпознайте разликата с помощта на един реагент:
2. Разпознайте разликата с помощта на един реагент:
3. Разпознайте разликата с помощта на един реагент:
4. Разпознайте разликата с помощта на един реагент: 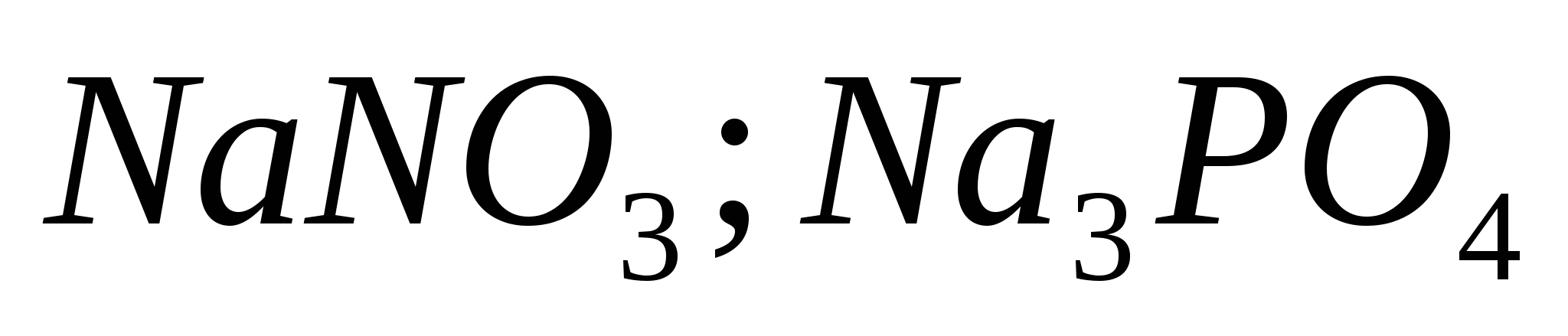 ;
;
5. Разпознайте разликата с помощта на един реагент:
3 rіven
1. Разпознаване без добавки на реагенти:
2. Разпознаване без добавки реагенти:
3. Разпознаване без добавки реагенти:
4. Разпознаване без добавки реагенти:
5. Разпознаване без добавки реагенти:
Етап "Преобразуване на речи"
1 rіven
1. Спрете реакцията
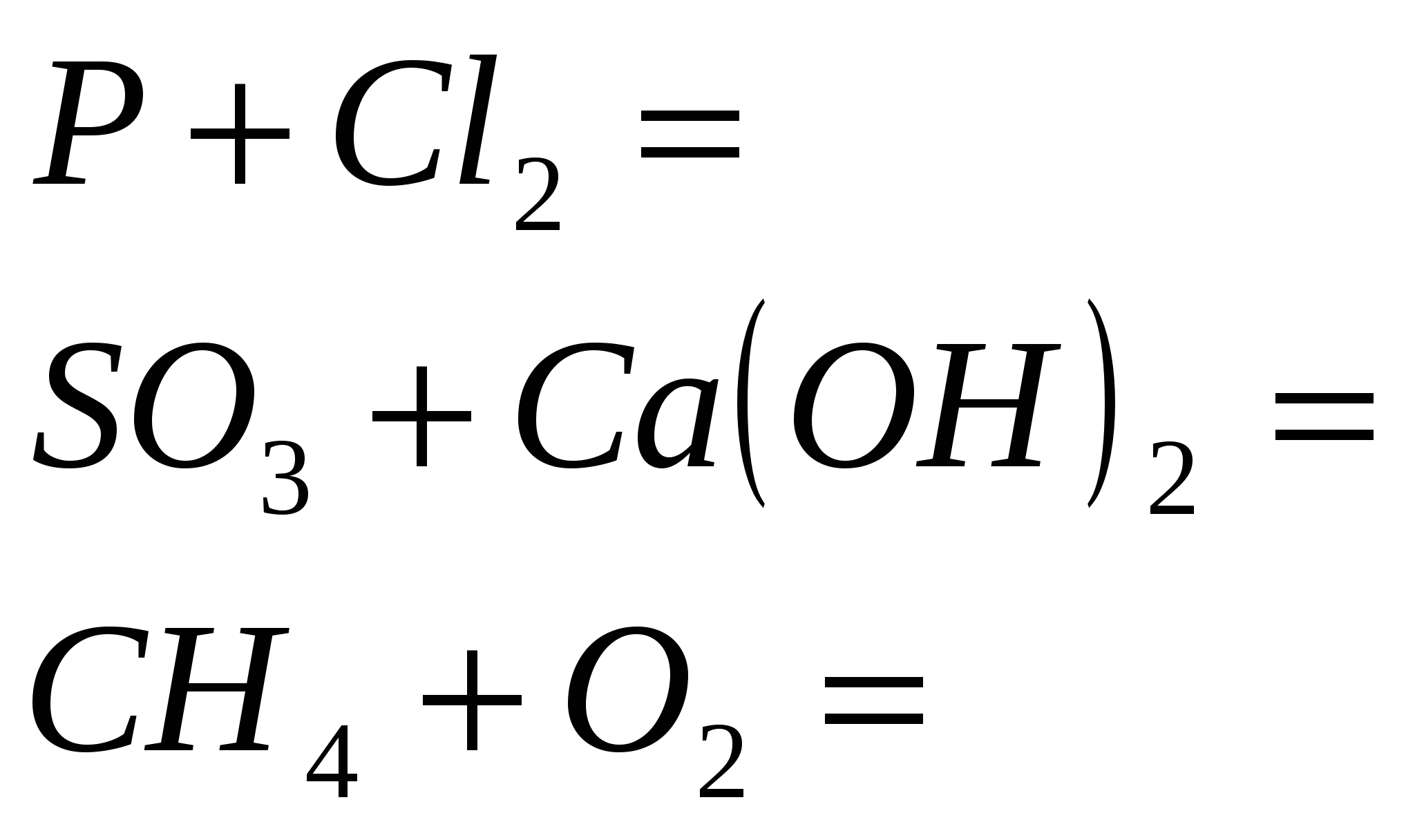
2. Прекратете реакцията
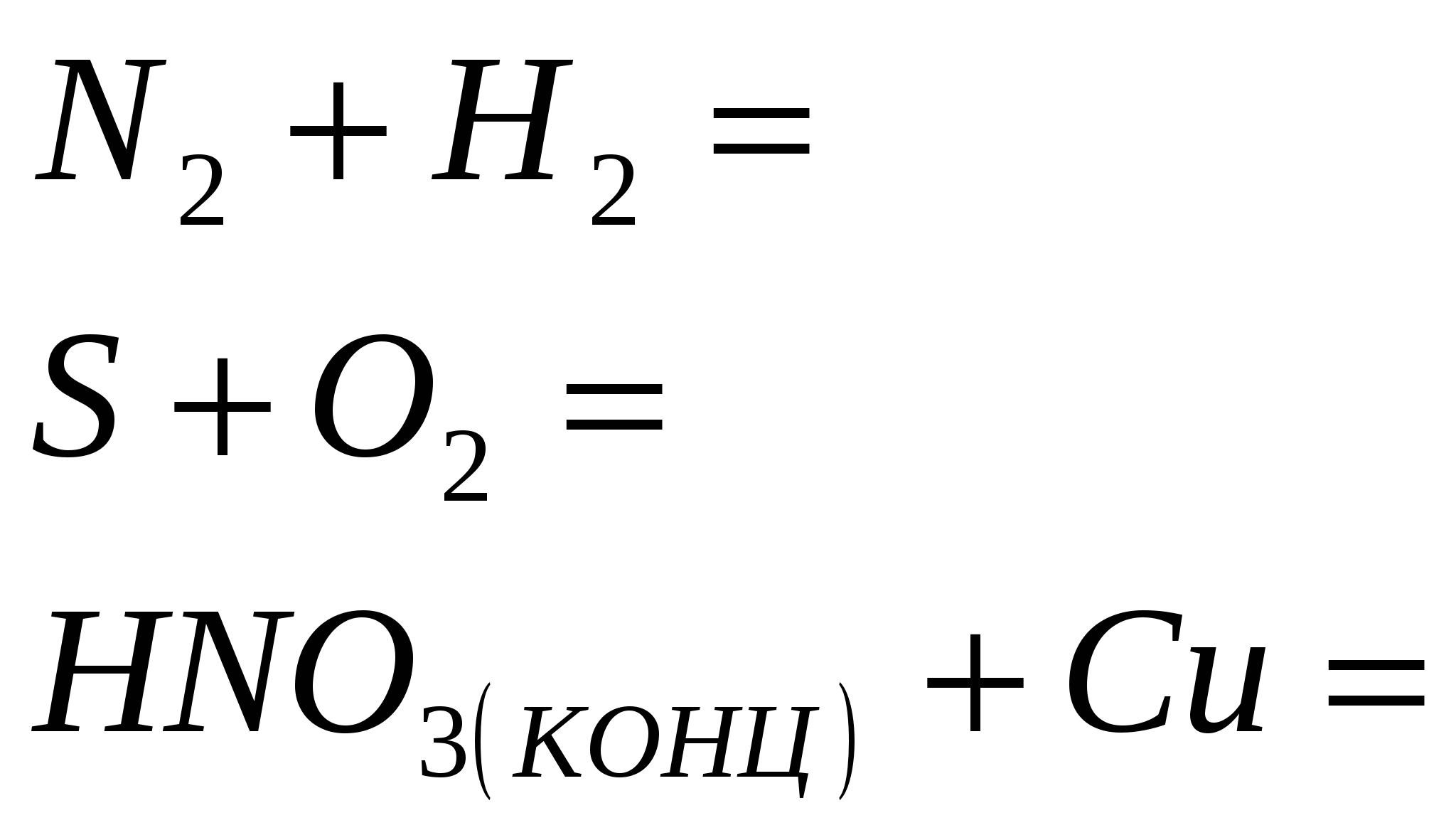
3. Завършете реакцията
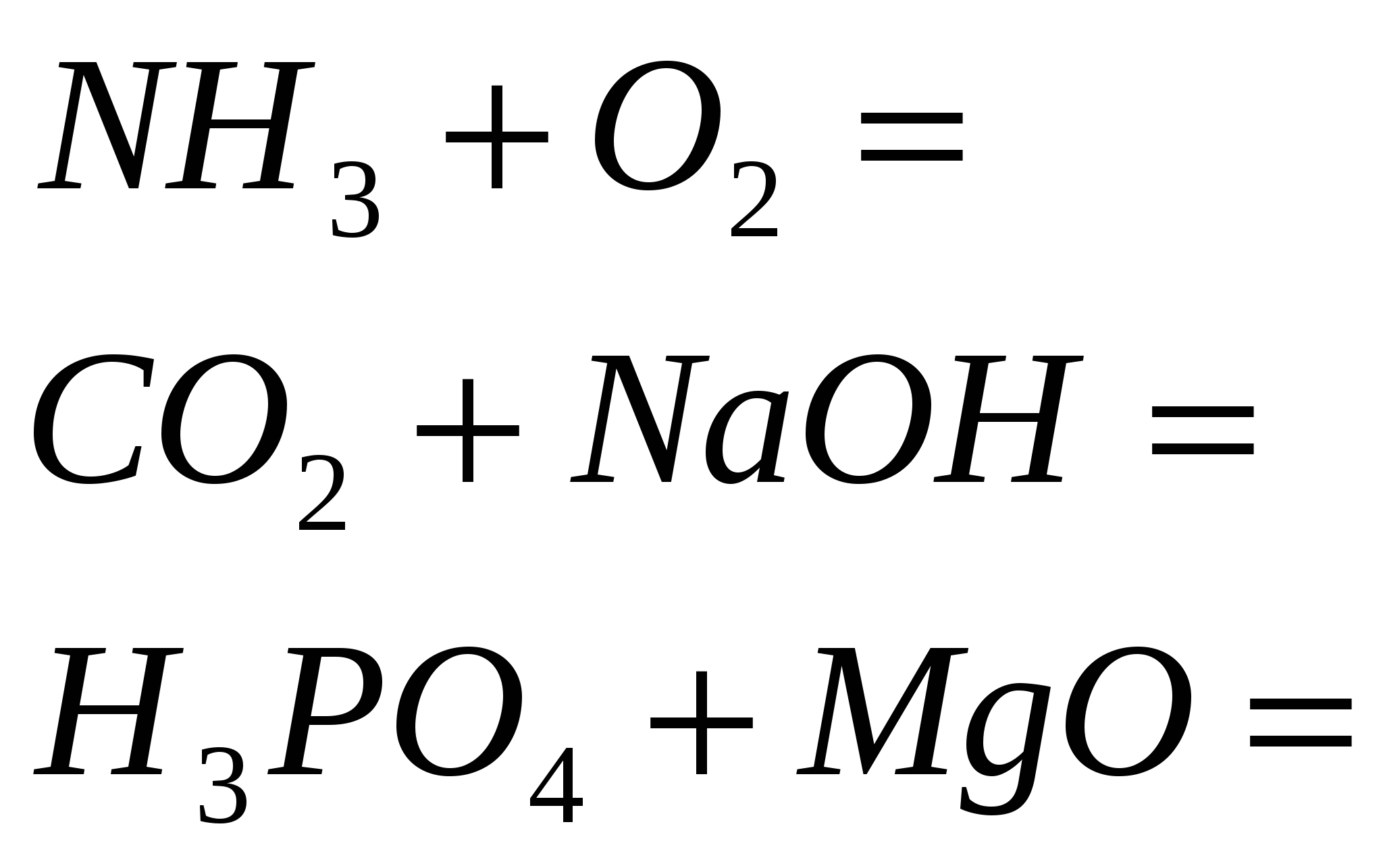
4. Завършете реакцията
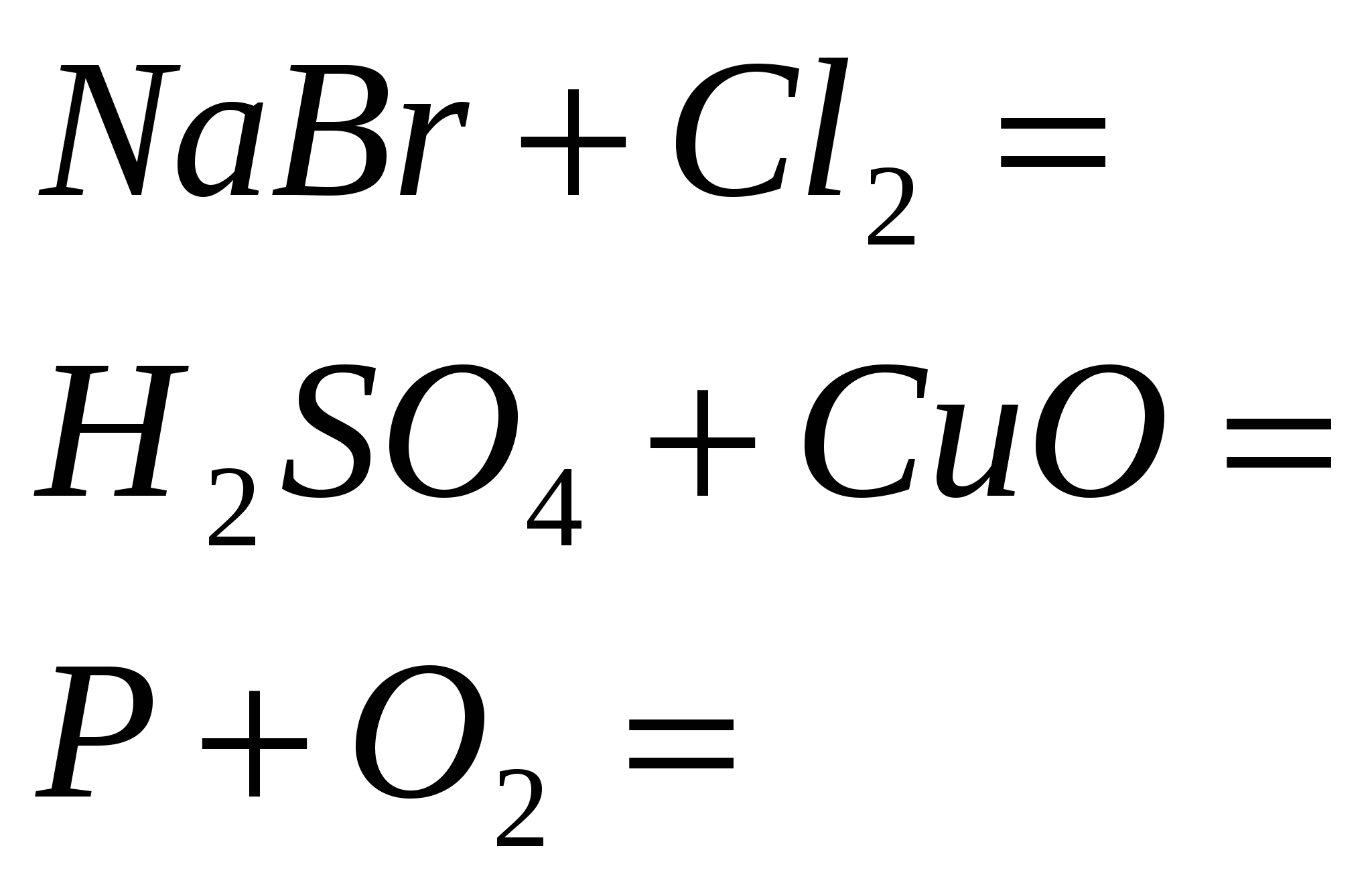
5. Завършете реакцията
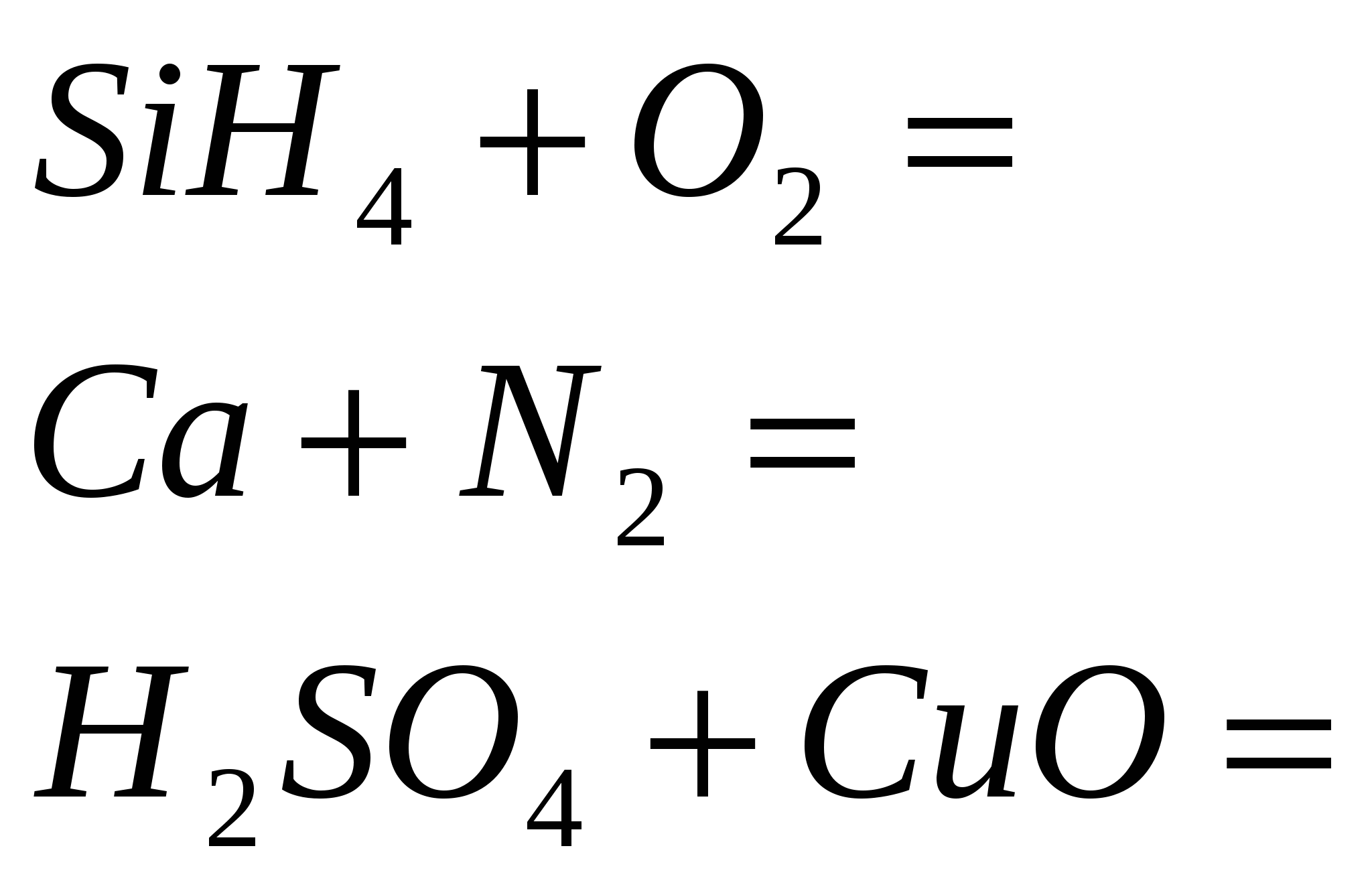
2 rіven
Създайте трансформация:
3rіven
Създайте трансформация:
3.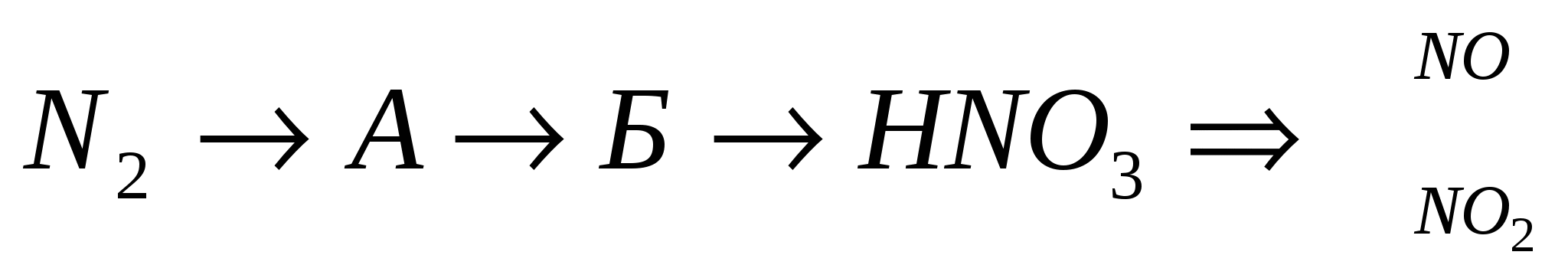
Етап "тест"
Опция 1
а) О, б) S, в) Cl, г) С, д) Si.
а) 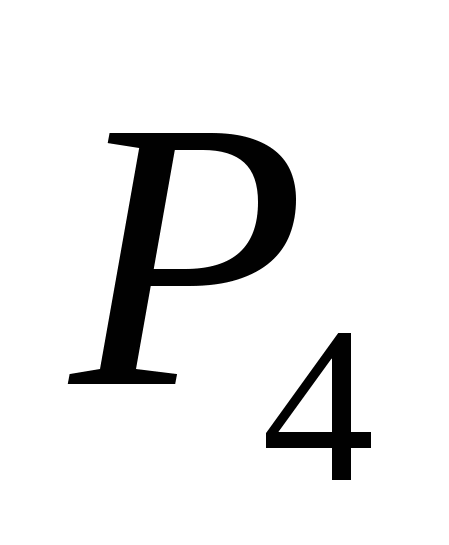 , б) В , в)
, б) В , в) 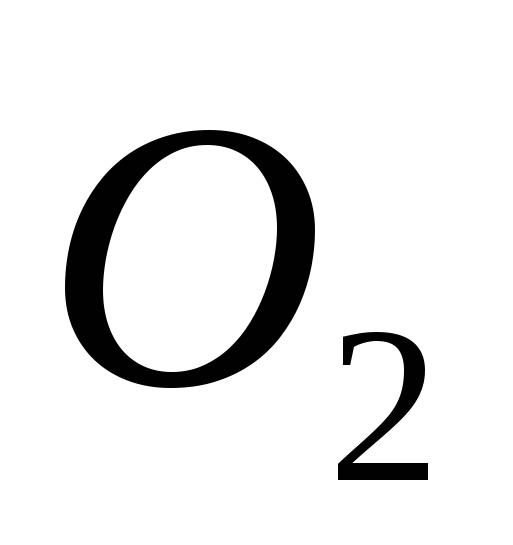 , G)
, G) 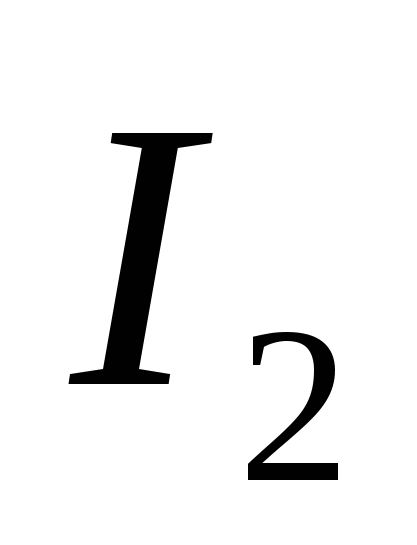 д)
д) 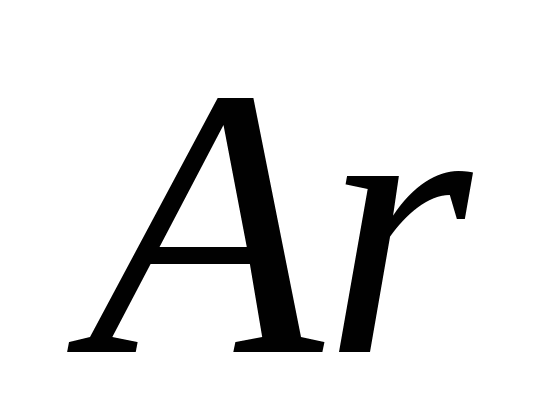 .
.
а)  , б)
, б)  , v)
, v)  , G)
, G)  д)
д)  .
.
4. Електронна формула на елемента. Yog flying vodnev spoluk:
а)  , б)
, б)  , v)
, v)  , G)
, G)  .
.
5. Силата на халогеноводните киселини нараства последователно:
а) ![]()
б) 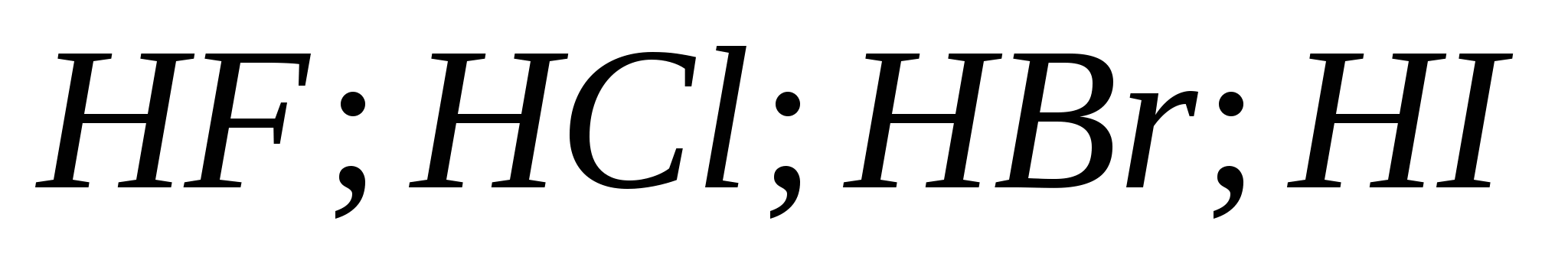
v) 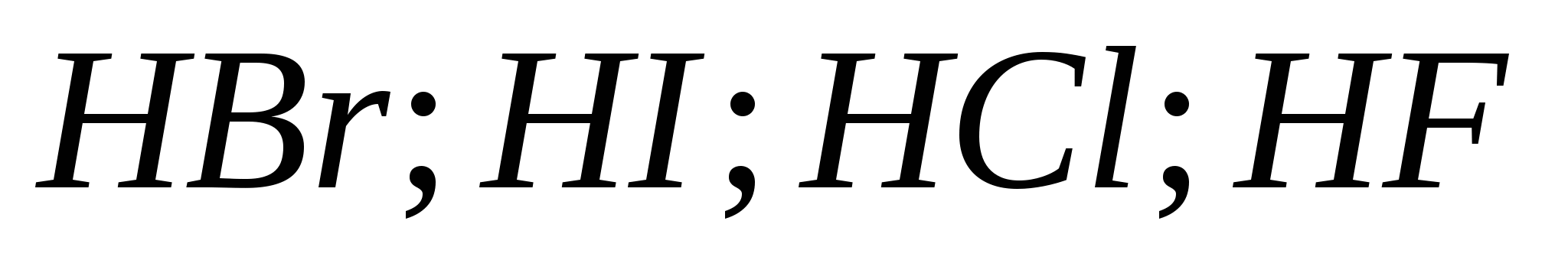
ж) 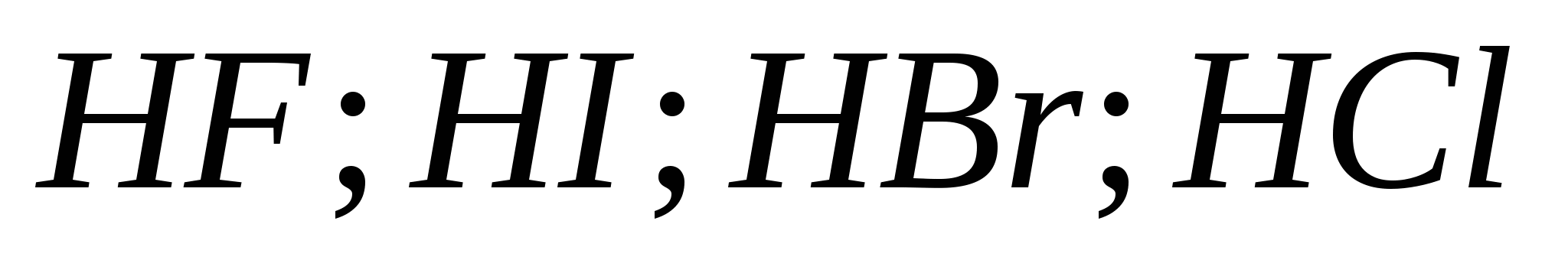
6. От халогените говорът беше блокиран в биещите се деца:
а) флуор; б) хлор; в) йод; г) бром.
7. Разбитата сярна киселина показва окислителна сила за съотношението на атомите:
а)  , б)
, б)  , v)
, v)  .
.
8. Азотният оксид V може да се комбинира:
а)  , б)
, б)  , v)
, v)  , G)
, G)  д)
д)  .
.
9. Реакция: донесе такава мощност на амоняка:
а) окисляващи, б) излишни, в) кисели, г) основни.
10. Силата на киселините в ред
а) промяна, б) увеличаване, в) постепенно увеличаване, след това промяна; г) пада бавно, след това расте, д) не се променя.
Вариант 2
Безплатни атомни кристали прости речи, одобрени:
а)  , б)
, б)  , v)
, v)  , G)
, G)  д)
д)  .
.
2. Газове за нормални дренажи е:
а)  , б)
, б)  , v)
, v)  , G)
, G)  д)
д) 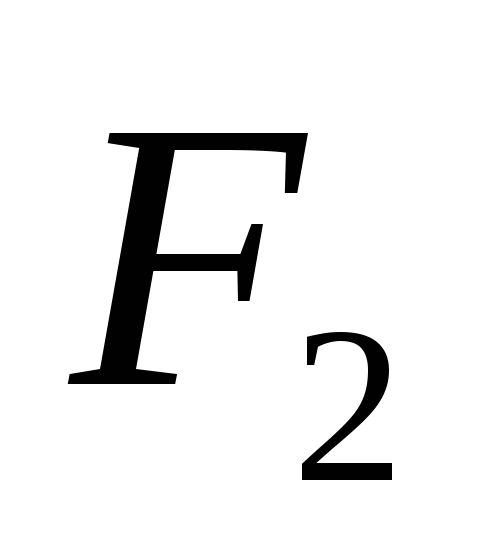 .
.
3. Алотропните модификации съставляват следните елементи:
а) 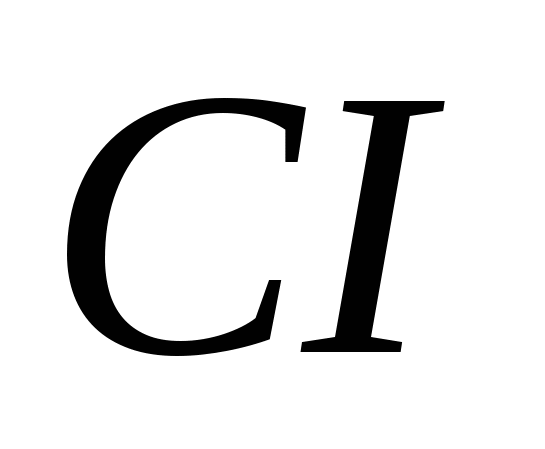 , б)
, б) 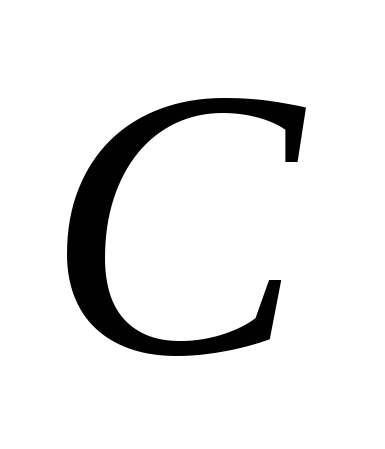 , v)
, v) 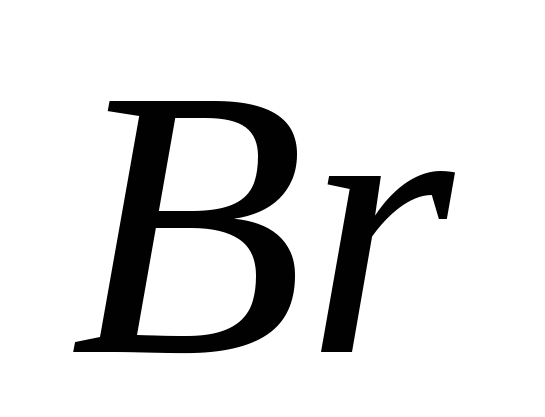 , G)
, G)  д)
д)  ,
,
4. Електронна формула на елемента. Yog flying vodnev spoluk:
а)  , б)
, б)  , v)
, v)  , G)
, G)  д)
д)  .
.
5. Основната сила на летните води се променя в поредицата:
а) 
б) 
v) 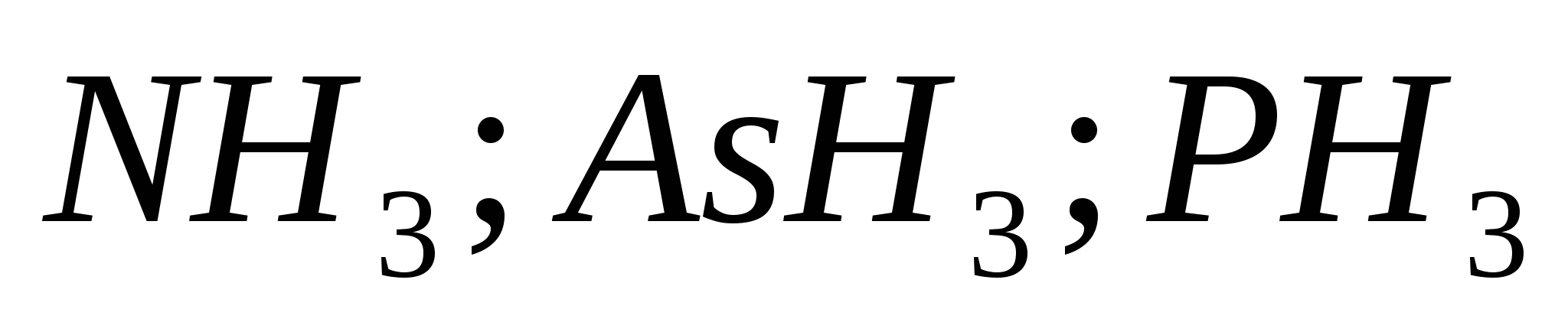
ж) 
6. За заливане на хлор можете да използвате различни концентрации:
а)  , б)
, б) 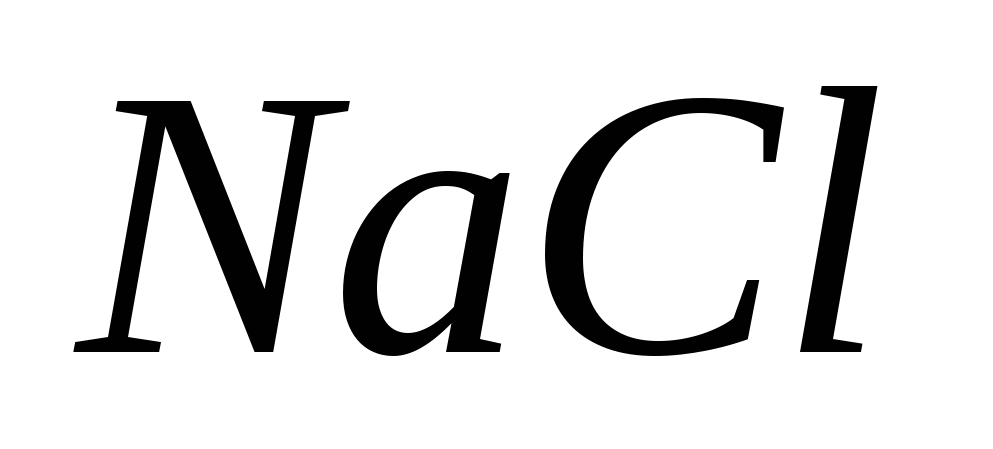 , v)
, v)  , G)
, G)  .
.
7. Концентрираната сярна киселина проявява окислителна сила за редица атоми:
а)  , б)
, б)  , v)
, v)  .
.
ЗАБЕЛЕЖКА: 9-10 верни отговора - "5"; 7-8-"4"; 5-6-"3"; по-малко от 5-2
етап "Теория"
I rіven (на "3")
Напишете нивото на реакциите, които характеризират силата на разредената сярна киселина.
Напишете скоростта на реакцията, която характеризира мощността на серен оксид (VI).
Напишете уравнението на реакциите, които характеризират силата на солната киселина.
Напишете уравнението на реакциите, които характеризират мощността на фосфорния (V) оксид.
Напишете равни реакции, които характеризират силата на амоняка.
II rіven (на "4")
Запишете формулите на летните води на неметали през II период. Обяснете как и защо се променят тези киселинни сили.
Запишете формулите на най-високите оксиди на неметалите през III период. Обяснете как и защо се променят тези киселинни сили.
Запишете формулите на най-важните киселини на елементите в III период. Обяснете как и защо се променят тези киселинни сили.
Запишете формулите на летливите води на неметали от VI подгрупа. Обяснете как и защо се променят тези киселинни сили.
Напишете формулите на най-важните киселини от елементите от подгрупата VA. Обяснете как и защо се променят тези киселинни сили.
III ред (на "5")
Балансирайте окислителната и киселинната сила на сярната и азотната киселини. Vidpovid потвърждават с еднакви реакции.
Балансирайте окислителната и киселинната сила на серен оксид (IV) и въглероден оксид (IV). Vidpovid потвърждават с еднакви реакции.
Балансирайте окислителната и киселинната сила на водата и флуорхидрида. Vidpovid потвърждават с еднакви реакции.
Балансирайте окислителната и киселинната сила на концентрирана и разредена азотна киселина. Vidpovid потвърждават с еднакви реакции.
Изравняване на окислителната и киселинната сила на въглеродния оксид (II) и въглеродния оксид (IV). Vidpovid потвърждават с еднакви реакции.
Етап "Задача на Розрахун"
I rіven (на "3")
II rіven (на "4")
При взаимодействие с 37 g калциев хидроксид с амониев сулфат се отстраняват 15 g амоняк. Изчислете масовата част на изхода на амоняк.
При спалюване в кисели 62 г фосфор се отделят 130 г фосфорен (V) оксид. Изчислете масовата част на изхода на фосфорен (V) оксид.
Колко грама 10% натриев хидроксид са ви необходими, за да неутрализирате 8,96 литра хлорна вода?
Няколко литра въглероден диоксид могат да се използват за съхраняване на 10 кг вейп, което ще покрие 20% от къщите.
Колко грама от обсадата са уредени за преминаване на 11,2 литра въглероден диоксид през 900 g 10% бариев хидроксид?
III ред (на "5")
Какъв обем 80% азотна киселина (пл. 1,46 g/ml) е необходим за „разпределението“ на 32 g midi?
Колко маса midi ще е необходима, за да може реакцията с прекалено концентрирана азотна киселина да вземе 4 литра (N.O.) азотен оксид (IV), така че обемната част на йога продукцията да стане 96%?
Когато се „променя“ концентрацията на сярна киселина в 20 g златна сплав, се наблюдават 4,2 l (n.o.) серен оксид (IV). Посочете масовата част в % midi за тази сплав.
През разпределението на калиев йодид се пропускат сумирани газове от хлор и вода с обем 1 литър. Виждал съм 5,08 r йод. Определете обемната част (%) на хлорния газ в сумата на отработените газове.
Сумиш силиций и вугилия с маса 10 g бяха обработени с прекалено концентриран разтвор на натриев хидроксид. След реакцията се виждат 5,6 литра вода (n.s.). Определете масовата част на силиция (%) за тази сума.
