سلسلة وراثية من أمثلة غير المعادن. العلاقة الوراثية بين فئات المواد - هايبر ماركت المعرفة
هناك علاقة وراثية بين مواد بسيطة ، أكاسيد ، قواعد ، أحماض وأملاح ، وهي إمكانية الانتقال المتبادل (التحول).
على سبيل المثال ، مادة بسيطة - الكالسيوم نتيجة للتفاعل مع الأوكسجين يتحول إلى أوكسيد: 2Ca + O 2 = 2CaO.
يشكل أكسيد الكالسيوم عند التفاعل مع الماء هيدروكسيد الكالسيوم CaO + H 2 O = Ca (OH) 2 ، ويتحول الأخير ، عند تفاعله مع الحمض ، إلى ملح: Ca (OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O.
يمكن تمثيل هذه التحولات بالنظام:
Ca ← CaO → Ca (OH) 2 → CaSO 4
يمكن كتابة مخطط مماثل لغير المعادن ، على سبيل المثال ، الكبريت:
S → SO 3 → H 2 SO 4 → CaSO 4
لذلك ، يتم الحصول على نفس الملح بطرق مختلفة.
يمكن أيضًا الانتقال العكسي من الملح إلى فئات أخرى من المركبات غير العضوية والمواد البسيطة:
CuSO 4 → Cu (OH) 2 → CuO → Cu
CuSO 4 + 2NaOH = Cu (OH) 2 ↓ + Na 2 SO 4
Cu (OH) 2 = CuO + H 2 O
CuO + H 2 = Cu + H 2 O (تخفيض النحاس)
وتسمى العلاقة المتشابهة بين فئات المركبات غير العضوية ، القائمة على إنتاج مواد من صنف واحد من مواد أخرى ، بالوراثة.
تنعكس خصائص المركبات المعقدة في المخطط الوراثي للفئات الرئيسية للمركبات غير العضوية (انظر الشكل). ويعكس مراحل تطور المادة غير العضوية على طول خطين رئيسيين ، من المعادن النموذجية إلى المعادن غير التقليدية ذات الخصائص المعاكسة.
المعادن التي تكون خصائصها الكيميائية للذرة هي القدرة على التبرع بالالكترونات ، وغير المعادن ، والخاصية الكيميائية الرئيسية التي تتمثل في قدرة ذراتها على إرفاق إلكترونات عكس بعضها البعض في الخصائص. مع تعقيد تركيبة المواد ، تستمر هذه الاتجاهات المعارضة في الظهور.
وتشكل المعادن النموذجية والعناصر الانتقالية في حالة التأكسد الأدنى الأكاسيد الأساسية ، بينما تشكل العناصر غير الفلزية النموذجية والعناصر الانتقالية في حالة الأكسدة العالية أكاسيد الحمض المعاكس.
مواد بسيطة
مذبذب
المواد غير المعدنية
أكاسيد أساسية
مذبذب
الحمضية
أساس
مذبذب
هيدروكسيدات
مخطط جيني للفئات الرئيسية للمركبات غير العضوية
مع مزيد من التعقيد لتركيب المواد ، يتم تكوين هيدروكسيدات ، أكاسيد القاعدة المقابلة للقاعدة ، وأكاسيد الحمض المقابلة للحمض. تتفاعل القواعد والأحماض المعاكسة في الخصائص مع بعضها البعض ، مما يشكل الأملاح. تفاعل الأضداد هو القوة الدافعة للتفاعل. لذلك ، تتفاعل أكاسيد وقواعد وأحماض أساسية وحمضية مع بعضها البعض بشكل نشط ، ولا تتفاعل أكاسيد حمضية أو أكاسيدتان أساسيتان ، لأن خصائصها قريبة.
وبالتالي ، يتم تحديد خصائص مركب مركب على أساس خصائص العناصر المكونة له. يتم تلخيص القوانين الأساسية لتغيير هذه الخصائص في التطبيقات التالية (الجدول 6).
1. في الفترات التي تشهد زيادة في رقم التسلسل ، تتغير خصائص العناصر من فلزي إلى غير معدني. يزداد عدد الإلكترونات على المستوى الخارجي ، وتتزايد درجة أكسدة العنصر ، ويقلل نصف قطر الذرة والأيون ، وطاقة التأين ، والألفة لزيادة الإلكترون. وفقا لهذا ، فإن الانخفاضات الأساسية والخصائص الحمضية للأكسيدات والهيدروكسيدات تزيد.
2. في المجموعات الفرعية الرئيسية ، تزيد الخواص الأساسية للأكسيدات والهيدروكسيدات مع زيادة العدد الذري. بالنسبة لعناصر المجموعات الجانبية مع زيادة في رقم التسلسل ، فإن التغير الأكثر تعقيدًا في الخصائص هو خاصية مميزة. أولا ، يتم تحسين الخصائص المعدنية ومن ثم خفضها.
3. المعادن النسبية تتوافق مع الأكاسيد والهيدروكسيدات ذات الخصائص الأساسية القوية. المعادن الأكثر نشاطا هي القلوية والأرض القلوية. أنها تشكل أكاسيد قابلة للذوبان في الماء وقواعد قابلة للذوبان قوية - القلويات.
4. تشكل المعادن قليلة النشاط (كلها باستثناء القلوية والقلوية-الأرض) قواعد ضعيفة يصعب تذويبها في الماء:
Cu (OH) 2، Fe (OH) 3.
5. تتوافق الأكاسيد و الهيدروكسيدات مع الخصائص الحمضية التي لها وضوح شديد مع المعادن غير النشطة.
6. تشكل المعادن الامفوترية أكاسيد amphoteric وهيدروكسيدات.
7. إذا كان العنصر يحمل درجات مختلفة من الأكسدة ، فإن أكاسيد وهيدروكسيدات ذات خصائص مختلفة تتوافق معها.
الموضوع: التوصيل الوراثي بين المعادن وغير المعادن ومركباتها. الصف التاسع
الأهداف: التعليمية: لتعزيز مفهوم "السلسلة الجينية" ، "الارتباط الجيني" ؛ تعليم كيفية صنع سلسلة جينية من العناصر (المعادن وغير المعادن) ، لتكوين معادلات التفاعل المقابلة للسلسلة الجينية ؛ تحقق كيف يتم تعلم المعرفة الخصائص الكيميائية الأكاسيد والأحماض والأملاح والقواعد ؛ النامية: لتطوير القدرة على تحليل ومقارنة وتلخيص واستنتاج الاستنتاجات ، تشكل معادلات التفاعلات الكيميائية. التعليمية: لتعزيز تشكيل وجهة نظر علمية.
توفير الفصول الدراسية: جداول "النظام الدوري" ، "جدول الذوبان" ، "سلسلة نشاط المعادن" ، تعليمات للطلاب ، مهام اختبار المعرفة.
التقدم: 1) المؤسسة. اللحظة
2) تحقق د / ث
3) دراسة المواد الجديدة
4) الربط
5) D / C
1) المؤسسة. اللحظة. أهلا وسهلا بك.
2) تحقق د / ث.
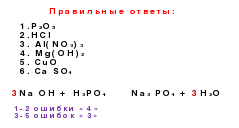
الروابط الوراثية هي صلات بين فئات مختلفة مبنية على تداخلها الداخلي.
معرفة فئات المواد غير العضوية ، فمن الممكن لتشكيل سلسلة الوراثية من المعادن وغير المعادن. أساس هذه السلسلة هو نفس العنصر.
بين المعادن هناك نوعان من الصفوف:
1
. سلسلة جينية تعمل فيها القلويات كقاعدة. يمكن تمثيل هذه السلسلة باستخدام التحويلات التالية:معدن ← أوكسيد أساسي ← قلوي ← ملح
على سبيل المثال ، K → K
2 O → KOH → KCl2
. السلسلة الوراثية ، حيث القاعدة هي قاعدة غير قابلة للذوبان ، ثم يمكن تمثيل السلسلة كسلسلة من التحولات:المعادن → قاعدة أكسيد → الملح → قاعدة غير قابلة للذوبان ←
→أكسيد الأساسية → المعادن
على سبيل المثال ، Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu
1
. السلسلة الوراثية من غير المعادن ، حيث يعمل الحمض الذائب كحلقة في السلسلة. يمكن تمثيل سلسلة التحويلات كما يلي:غير المعادن → أكسيد الحديد ← حمض قابل للذوبان ← ملح
على سبيل المثال ، P → P
2 O 5 → H 3 PO 4 → نا 3 PO 42
. السلسلة الوراثية من غير المعادن ، حيث يعمل الحمض غير الذائب كحلقة في السلسلة:غير المعادن → أكسيد الحديد → الملح → حمض →
→أكسيد الحديد → غير معدنية
على سبيل المثال
سي→ شافي 2 → نا 2 شافي 3 → H 2 شافي 3 → شافي 2 → سي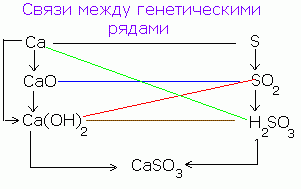
محادثة أمامية على:
ما هو الارتباط الجيني؟ الروابط الوراثية هي صلات بين فئات مختلفة مبنية على تداخلها البيني ما هي سلسلة وراثية؟
السلسلة الوراثية - سلسلة من المواد - ممثلين من فئات مختلفة ، وهي مركبات لعنصر كيميائي واحد ، موصولة بواسطة interconversions وتعكس تحولات هذه المواد. أساس هذه السلسلة هو نفس العنصر.
ما أنواع السلسة الجينية التي يمكن تمييزها؟ من بين المعادن ، يمكن تمييز نوعين من السلسلة:
أ) سلسلة جينية تعمل فيها القلويات كقاعدة. يمكن تمثيل هذه السلسلة باستخدام التحويلات التالية:
معدن ← أوكسيد أساسي ← قلوي ← ملح
على سبيل المثال ، السلسلة الوراثية للبوتاسيوم K → K
2 O → KOH → KClب) السلسلة الوراثية ، حيث القاعدة هي قاعدة غير قابلة للذوبان ، ثم يمكن تمثيل السلسلة كسلسلة من التحولات:
المعادن → قاعدة أكسيد → الملح → قاعدة غير قابلة للذوبان → قاعدة أكسيد → المعادن
على سبيل المثال: Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cuمن بين غير الفلزات ، من الممكن أيضًا التمييز بين نوعين من الصفوف:
أ) السلسلة الوراثية من غير المعادن ، حيث يعمل الحمض الذائب كحلقة وصل في السلسلة. يمكن تمثيل سلسلة التحولات كما يلي: غير المعدني ← أوكسيد الحمض ← حمض قابل للذوبان ← ملح.
على سبيل المثال: P → P
2 O 5 → H 3 PO 4 → نا 3 PO 4ب) الصف الوراثي من غير المعادن ، حيث حمض غير قابل للذوبان: غير المعدني ← أوكسيد الحمض ← ملح ← حمض ← أوكسيد حامض ← أعمال غير معدنية كحلقة في السلسلة
على سبيل المثال: Si → SiO
2 → نا 2 شافي 3 → H 2 شافي 3 → SiO 2 → سيتنفيذ المهام للخيارات:
1. اختر صيغ الأكسيد في نسختك ، واشرح اختيارك ، بناء على معرفة خصائص تكوين هذه الفئة من المركبات. اتصل بهم.
2. في عمود الصيغة الخاص بك ، ابحث عن الصيغ الحمضية واشرح اختيارك بناءًا على تحليل تركيبة هذه المركبات.
3. تحديد تباينات بقايا الحمض في تركيبة الحمض.
4. حدد صيغ الملح واسمها.
5. تشكل صيغ الأملاح ، والتي يمكن تشكيلها مع المغنيسيوم والأحماض من البديل الخاص بك. اكتبها واسمها.
6. في عمود الصيغة الخاص بك ، ابحث عن الصيغ الأساسية واشرح اختيارك بناءً على تحليل تركيبة هذه المركبات.
7. في صيغة الخاص بك ، واختيار الصيغ من المواد التي يمكن أن تتفاعل مع حل من حامض orthophosphoric (الهيدروكلوريك ، الكبريتيك). جعل معادلات رد الفعل المناسبة.
9. من بين صيغ خيارك ، حدد صيغ المواد التي يمكن أن تتفاعل مع بعضها البعض. جعل معادلات رد الفعل المناسبة.
10. قم بعمل سلسلة من الروابط الوراثية للمركبات غير العضوية ، والتي ستحتوي على مادة ، معطى الصيغة في نسختك في رقم واحد.
الخيار 1
الخيار الثاني
تساو
HNO
3Fe (OH)
3N
2 Oزد (لا
3 ) 2الكروم (OH)
3H
2 SO 3H
2 Sمنع الرشوة
LiOH
حج
3 PO 4P
2 O 5هيدروكسيد الصوديوم
أكسيد الزنك
CO
2بووتون
2حمض الهيدروكلوريك
H
2 CO 3H
2 SO 4كبريتات النحاس
4من هذه المواد جعل خط جيني باستخدام جميع الصيغ. اكتب معادلات التفاعل التي يمكنك من خلالها إنجاز هذه السلسلة من التحولات:
أنا الخيار: ZnSO
4, Zn، ZnO، Zn، Zn (OH) 2 : II الخيار:نا 2 SO 4, هيدروكسيد الصوديوم, نا, نا 2 O 2 , نا 2 O4) التثبيت 1.
شركة→ شركة 2 O 3 → AlCl 3 → شركة( OH) 3 → شركة 2 O 32.
P→ P 2 O 5 → H 3 PO 4 → نا 3 PO 4 → كاليفورنيا 3 ( PO 4 ) 23. Zn → ZnCl
2 → Zn (OH) 2 → ZnO → Zn (لا 3 ) 24. Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu5.N
2 O 5 → HNO 3 → Fe (لا 3 ) 2 → Fe (OH) 2 ← FeS ← FeSO 45) الواجبات المنزلية:
الرسم البياني الانتقال التدريجي من الكالسيوم إلى كربونات الكالسيوم وإعداد تقرير عن استخدام أي ملح في الطب (باستخدام الأدب إضافية).

بين المعادن ، يمكن تمييز نوعين من الصفوف: 1. السلسلة الوراثية ، التي تعمل فيها القلويات كقاعدة. يمكن تمثيل هذه السلسلة بالتحولات التالية: المعادن - الأكسيد الأساسي - القلوي - الملح ، على سبيل المثال ، السلسلة الوراثية للبوتاسيوم K - K 2 O - KOH - KCl.

2. سلسلة جينية ، حيث تعمل قاعدة غير قابلة للذوبان كقاعدة ، ثم يمكن تمثيل السلسلة كسلسلة من التحولات: المعادن - أكسيد الأساسية - الملح - قاعدة غير قابلة للذوبان - أكسيد الأساسية - المعادن. Cu - CuO - CuCl 2 - Cu (OH) 2 - CuO -\u003e Cu gen genetic series of copper "\u003e النحاس الجيني سلسلة من النحاس"\u003e "العنوان =" (! لانغ: 2. سلسلة الوراثية ، حيث القاعدة هي قاعدة غير قابلة للذوبان ، ثم يمكن تمثيل سلسلة من سلسلة من التحولات: المعادن - أكسيد الأساسية - الملح - قاعدة غير قابلة للذوبان - الأكسيد الرئيسي هو معدن Cu - CuO - CuCl 2 - Cu (OH) 2 - CuO -\u003e"> title="2. سلسلة جينية ، حيث تعمل قاعدة غير قابلة للذوبان كقاعدة ، ثم يمكن تمثيل السلسلة كسلسلة من التحولات: المعادن - أكسيد الأساسية - الملح - قاعدة غير قابلة للذوبان - أكسيد الأساسية - المعادن. Cu - CuO - CuCl 2 - Cu (OH) 2 - CuO -\u003e"> !}
ومن بين غير الفلزات ، يمكن أيضًا التمييز بين نوعين من الصفوف: 1. السلسلة الوراثية غير المعدنية ، حيث يعمل الحمض الذائب كحلقة في السلسلة. يمكن تمثيل سلسلة التحولات كما يلي: أكسيد غير حامضي - حامض قابل للذوبان - سول. P - P 2 O 5 - H 3 PO 4 - Na 3 PO 4. Phosphorus Genetic Range

هناك ارتباط وراثي بين فئات المركبات غير العضوية. من مواد بسيطة يمكنك الحصول على معقدة والعكس بالعكس. من مركبات فئة واحدة ، يمكنك الحصول على مركبات لفئة أخرى.
يمكن تمثيل العلاقة الوراثية المبسطة بين فئات المركبات غير العضوية بالمخطط التالي:
يمكن تمثيل تسلسل مثل هذه التحولات بالنسبة لغير المعادن بالمخطط التالي: CANPO 4
Р → Р 2 О 5 → Н 3 РО 4 → Са 3 (РО 4) 2
(Saon) 3 PO 4
بالنسبة للمعادن العادية ، يمكنك إجراء سلسلة التحويلات التالية:
با → باو → با (أوهايو) 2 → BaSO 4
بالنسبة للمعادن التي تحتوي أكاسيدها وهيدروكسيداتها على amphoteric (semimetals) ، يمكن إجراء التحويلات التالية:
Al → O 3 → Al (OH) 3 → Na → AlCl 3 → AlOHCl 2 → Al (OH) 3 → Al 2 O 3.
الروابط بين الطبقات:
1. المعادن ، غير المعادن→ الملح.
مع التفاعل المباشر للمعادن وغير المعادن ، يتم تشكيل أملاح الأحماض الخالية من الأكسجين (هاليدات ، كبريتيدات):
2Na + C1 2 = 2NaCl
هذه المركبات مستقرة ولا تتحلل عند تسخينها.
2. أكاسيد أساسية ، أكاسيد حمض→ الملح.
CaO + CO 2 = CaCO 3؛
Na 2 O + SO 3 = Na 2 SO 4.
3. القواعد والأحماض→ الملح.
يتم من خلال رد فعل معادلة:
2NaOH + H 2 SO 4 = Na 2 SO 4 + 2H 2 O ،
HE - + H + → H 2 O؛
Mg (OH) 2 + 2HC1 = MgCl 2 + 2H 2 O ،
Mg (OH) 2 + 2H + → Mg 2+ + 2H 2 O.
4. المعادن→ أكاسيد أساسية.
تتفاعل معظم المعادن مع الأكسجين لتشكيل أكاسيد:
2Ca + O 2 = 2CaO؛
4A1 + 3O 2 = 2A1 2 O 3.
الذهب والفضة والبلاتين وغيرها من المعادن النبيلة لا تتفاعل مع الأكسجين ، ويتم الحصول على أكاسيد مثل هذه المعادن بشكل غير مباشر.
5. غير المعادن→ أكاسيد حمض.
تتفاعل غير المعادن (باستثناء الهالوجينات والغازات النبيلة) مع الأكسجين ، وتشكيل أكاسيد:
4P + 5O 2 = 2P 2 O 5؛
S + O 2 = SO 2.
6. الأكاسيد الأساسية→ القاعدة.
يمكن الحصول على تفاعل مباشر مع الماء فقط من الهيدروكسيدات القلوية والفلزات الأرضية القلوية (القلوية):
Na 2 O + H 2 O = 2NaOH؛
CaO + H 2 O = Ca (OH) 2.
يتم الحصول على الأسباب المتبقية بشكل غير مباشر.
7. أكاسيد الحمض→ حامض.
تتفاعل أكاسيد الحمض مع الماء لتشكيل الأحماض المناظرة:
SO 3 + H 2 O = H 2 SO 4؛
Р 2 O 5 + 3H 2 O = 2H 3 PO 4.
الاستثناء هو SiO 2 ، والذي لا يتفاعل مع الماء.
8. القواعد ، أكاسيد الحمض→ الملح.
تتفاعل القلويات مع الأكاسيد الحمضية لتشكيل الأملاح:
2NaOH + SO 3 = Na 2 SO 4 + H 2 O،
2OH - + SO 3 = SO 4 2- + H 2 O؛
Ca (OH) 2 + СO 2 = CaCO 3 ↓ + Н 2 O،
Ca 2+ + 2OH - + CO 2 → CaCO 3 ↓ + H 2 O.
9. الأحماض ، الأكاسيد الأساسية→ الملح.
أكاسيد المعادن تذوب في الأحماض ، وتشكل الأملاح:
CuO + H 2 SO 4 = CuSO 4 + H 2 O،
CuO + 2H + = Cu 2+ + H 2 O؛
Na 2 O + 2HS1 = 2NaCl + H 2 O،
Na 2 O + 2H + = 2Na + + H 2 O.
10. أسباب→ أكاسيد أساسية.
تتحلل القواعد غير القابلة للذوبان و LiOH عند تسخينها:
2LiOH = Li 2 O + H 2 O؛
Cu (OH) 2 = CuO + H 2 O.
11. الأحماض→ أكاسيد حمض.
تتحلل الأحماض المحتوية على أكسجين غير مستقر عند تسخينها (H 2 SiO 3) وحتى بدون تسخين (H 2 CO 3، HClO). في نفس الوقت ، هناك عدد من الأحماض مقاومة للتدفئة (H 2 SO 4، H 3 PO 4).
H 2 SiO 3 = H 2 O + SiO 2؛
H 2 CO 3 = H 2 O + CO 2.
12. أكاسيد المعادن→ المعادن.
بعض أكاسيد المعادن الثقيلة يمكن أن تتحلل إلى المعادن والأكسجين:
2HgO = 2Hg + O 2.
أيضا ، يتم الحصول على المعادن من أكاسيد المقابلة بمساعدة وكلاء الاختزال:
3MnO 2 + 4Al = 3Mn + 2Al 2 O 3؛
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O.
13. أكاسيد الحمض→ غير المعادن.
معظم الأكاسيد غير المعدنية لا تتحلل عند تسخينها. غير المعادن والأكسجين تتحلل فقط بعض أكاسيد غير مستقرة (أكاسيد الهالوجين).
يتم الحصول على بعض المعادن غير المعدنية بالتخفيض من الأكاسيد المقابلة:
SiO 2 + 2Mg = 2MgO + Si.
14. الأملاح ، قواعد → القواعد.
يتم الحصول على قواعد غير قابلة للذوبان عن طريق عمل القلويات على حلول الأحماض المقابلة:
CuSO 4 + 2NaOH = Cu (OH) 2 ↓ + Na 2 SO 4،
Cu 2+ + 2OH - → Cu (OH) 2 ↓؛
FeCl 2 + 2KOH = Fe (OH) 2 ↓ + 2KCl،
Fe 2+ + 2OH - = Fe (OH) 2 ↓.
15. الأملاح والأحماض → الأحماض.
تتفاعل الأملاح القابلة للذوبان مع الأحماض (وفقًا لسلسلة الضغط) إذا كانت النتيجة حمضًا ضعيفًا أو متطايرًا:
Na 2 SiO 3 + 2HCl = 2NaCl + H 2 SiO 3 ↓،
SiO 3 2- + 2H + → H 2 SiO 3 ↓؛
NaCl (s.) + H 2 SO 4 (k) = NaHSO 4 + HCl.
16. الأملاح→ أكاسيد أساسية ، أكاسيد حمض.
تتحلل أملاح بعض الأحماض المحتوية على الأكسجين (مثل النترات والكربونات) عند تسخينها:
CaCO 3 = CaO + CO 2؛
2Cu (NO 3) 2 = 2CuO + 4NO 2 + O 2.
تمرينات للعمل المستقل حول موضوع "الارتباط الجيني بين فئات المركبات غير العضوية"
1. قم بتسمية المواد المدرجة أدناه ، وزعها في فئات المركبات غير العضوية: Na 3 PO 4، H 2 SiO 3، NO، B 2 O 3، MgS، BaI 2، Ca (OH) 2، KNO 3، HNO 2، Cl 2 O 7، Fe (OH) 2، P 2 O 5، HF، MnO 2.
2. من أي المواد المذكورة أدناه يمكن الحصول على هيدروكسيد (حامض أو قاعدة) في مرحلة واحدة: النحاس ، أكسيد الحديد (P) ، أكسيد الباريوم ، أكسيد النيتروجين (P) ، أكسيد النيتروجين (V) ، أكسيد السيليكون ، كبريتات النحاس ، كلوريد البوتاسيوم والبوتاسيوم وكربونات المغنيسيوم.
3. من القائمة أعلاه اكتب معادلات المواد المتعلقة بما يلي: 1) أكاسيد ؛ 2) أسس ؛ 3) الأحماض. 4) الأملاح:
CO 2، NaOH، HCl، SO 3، CuSO 4، NaNO 3، KCl، H 2 SO 4، Ca (OH) 2، P 2 O 5، HNO 3، Al (OH) 3.
4. اسم المواد: Zn (OH) 2 ، MgO ، P 2 O 3 ، NaHCO 3 ، H 3 PO 3 ، Fe 2 (SO 4) 3 ، KOH ، (AlOH) 3 (PO 4) 2 ، Ba (MnO 4) ) 2 ، أول أكسيد الكربون ، مرحبا. حدد الفئة التي تنتمي إليها كل مادة.
5- اكتب المعادلات الجزيئية للمواد التالية ، واذكر الفئة التي تنتمي إليها كل مادة:
1) النحاس (الثاني) hydroxocarbonate.
2) أكسيد النتروجين (V) ؛
3) هيدروكسيد النيكل (الثاني) ؛
4) فوسفات الباريوم الهيدروجين.
5) حمض بيركلوريك.
6) الكروم (ثالثا) هيدروكسيد.
7) كلورات البوتاسيوم.
8) حمض كبريتيد الهيدروجين.
9) الزنك الصوديوم.
6. أعط أمثلة عن ردود الفعل للعلاقة بين:
1) مواد بسيطة غير المعادن.
2) مادة بسيطة وأكسيد.
3) أكاسيد
4) المواد المعقدة التي ليست أكاسيد ؛
5) المعادن وغير المعدنية.
6) ثلاث مواد.
7. أي من المواد التالية يمكن أن تتفاعل:
1) أول أكسيد الكربون (IV): حمض الهيدروكلوريك ، O 2 ، NO 2 ، KOH ، H 2 O ؛
2) أكسيد المغنيسيوم: Ba (OH) 2، HCl، CO 2، O 2، HNO 3؛
3) الحديد (II) هيدروكسيد: KCl، HCl، KOH، O 2، H 2 O، HNO 3؛
4) كلوريد الهيدروجين: Zn، MgO، ZnCl 2، HNO 3، Ca (OH) 2، Cu، (ZnOH) Cl.
8. هل التفاعل بين المواد التالية ممكن؟
1) أول أكسيد الكربون (IV) وهيدروكسيد البوتاسيوم ؛
2) هيدروسلفات البوتاسيوم وهيدروكسيد الكالسيوم ؛
3) فوسفات الكالسيوم وحامض الكبريتيك.
4) هيدروكسيد الكالسيوم وأكسيد الكبريت (IV) ؛
5) حامض الكبريتيك وهيدروكسيد البوتاسيوم.
6) بيكربونات الكالسيوم وحمض الفوسفوريك.
7) السيليكا وحمض الكبريتيك.
8) أكسيد الزنك وأكسيد الفوسفور (V).
اكتب معادلات التفاعلات الممكنة ، وحدد الظروف التي تحدث فيها. إذا كانت التفاعلات يمكن أن تؤدي إلى مواد مختلفة ، فعندئذ أشر إلى الفرق في شروط تنفيذها.
9. أعط معادلات التفاعلات للحصول على المواد التالية: orthophosphate الصوديوم (4 طرق) ، كبريتات البوتاسيوم (7 طرق) ، هيدروكسيد الزنك.
10. إحدى طرق إنتاج الصودا (كربونات الصوديوم) هي عمل الماء وأول أكسيد الكربون (IV) على ألومينات الصوديوم. تشكل معادلات التفاعل.
11. انه تغيير المعاملات ، وكتابة منتجات التفاعل:
1) MgO + 2H 2 SO 4 →
2) 2SO 2 + Ba (OH) 2 →
3) 3N 2 O 5 + 2Al (OH) 3 →
4) P 2 O 5 + 4NaOH →
5) P 2 O 5 + 6NaOH →
6) P 2 O 5 + 2NaOH →
12. جعل معادلات التفاعلات لتلقي أنواع مختلفة من الأملاح:
1) SO 2 + Ba (OH) 2 → (أملاح متوسطة وأحماض) ،
2) A1 2 O 3 + H 2 O + HNO 3 → (ملح متوسط ، أملاح أساسية) ،
3) Na 2 O + H 2 S → (أملاح متوسطة وأحماض) ،
4) SO 3 + Sa (OH) 2 → (الأملاح المتوسطة والأساسية) ،
5) CaO + H 2 O + P 2 O 5 → (ملح أساسي ، أملاح حامضية).
13. أكمل معادلات التفاعل:
CaO + A1 2 O 3 → CaHPO 4 + Ca (OH) 2 →
Cr 2 O 3 + H 2 SO 4 → AlOHSO 4 + NaOH →
Cr 2 O 3 + NaOH → CaCO 3 + CO 2 + H 2 O →
A1 2 O 3 + HClO 4 → Ca (HCO 3) 2 + HCl →
Mn 2 O 7 + KOH → ZnS + H 2 S →
NO 2 + Ca (OH) 2 → CaSO 4 + H 2 SO 4 →
Zn (OH) 2 + NaOH → (ZnOH) Cl + HCl →
Zn (OH) 2 + HNO 3 → Bi (OH) 3 + H 2 SO 4 (غير كافية) →
AlCl 3 + NaOH (ناقص) → (FeOH) Cl + NaHS →
AlCl 3 + NaOH → Na 2 ZnO 2 + H 2 SO 4 (excess) →
AlC1 3 + NaOH (excess.) → Ca (AlO 2) 2 + HCl (excess) →
اكتب معادلات التفاعل التي يمكنك من خلالها إجراء التحويلات التالية:
1) Cu → CuO → CuSO 4 → Cu (OH) 2 → CuC1 2 → Cu (NO 3) 2
2) Zn → ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → ZnCl 2
3) Р → Р 2 O 5 → Н 3 РО 4 → Р 3 РО 4 → Са 3 (РО 4) 2 → Н 3 РО 4
4) Mg → MgO → MgCl 2 → Mg (OH) 2 → Mg (HSO 4) 2 → MgSO 4
5) Ca → CaO → Ca (OH) 2 → CaCO 3 → Ca (HCO 3) 2 → CO 2
6) Cr → Cr 2 (SO 4) 3 → Cr (OH) 3 → NaСrO 2 → Cr 2 O 3 → K
7) P → P 2 O 5 → HPO 3 → H 3 PO 4 → NaH 2 PO 4 → Na 3 PO 4
8) CuS → CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
9) Al → Al 2 O 3 → Al 2 (SO 4) 3 → Al (HSO 4) 3 → Al (OH) 3 → K
10) S → SO 2 → SO 3 → NaHSO 4 → Na 2 SO 4 → BaSO 4
11) Zn → ZnO → ZnCl 2 → Zn → Na 2
12) Zn → ZnSO 4 → ZnCl 2 → Zn (OH) 2 → Na 2 → Zn (NO 3) 2
13) Ca → CaCl 2 → CaCO 3 → Ca (HCO 3) 2 → Ca (NO 3) 2
14) Ca → Ca (OH) 2 → CaCO 3 → CaCl 2 → CaCO 3 → Ca (NO 3) 2
15) CuO → CuCl 2 → Cu (NO 3) 2 → CuO → CuSO 4 → Cu
16) CaO → Ca (OH) 2 → Ca (NO 3) 2 → Ca (NO 2) 2 → HNO 2 → NaNO 2
17) MgO → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
18) SO 2 → H 2 SO 3 → KHSO 3 → K 2 SO 3 → KHSO 3 → SO 2
19) P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2 → Ca (H 2 PO 4) 2 → CaHPO 4
20) CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
21) PbO → Pb (NO 3) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbCl 2
22) ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2 → K 2
23) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → Al (OH) 3 → K
24) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → Zn → ZnO → Zn (NO 3) 2
25) AlCl 3 → Al (NO 3) 3 → Al (OH) 3 → NaAlO 2 → A1C1 3 → Al
26) Pb (NO 3) 2 → Pb (OH) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbSO 4
27) Fe 2 (SO 4) 3 → FeCl 3 → Fe (OH) 3 → FeOH (NO 3) 2 → Fe (NO 3) 3 → Fe 2 O 3
28) K → KOH → KHSO 4 → K 2 SO 4 → KCl → KNO 3
29) Cu (OH) 2 → CuOHNO 3 → Cu (NO 3) 2 → CuSO 4 → CuCl 2 → Cu (NO 3) 2
30) CaCl 2 → Ca → Ca (OH) 2 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
31) Cu → Cu (NO 3) 2 → Cu (OH) 2 → CuSO 4 → Al 2 (SO 4) 3 → A1C1 3
32) Mg → MgSO 4 → MgCl 2 → MgOHCl → Mg (OH) 2 → MgOHNO 3
33) CuSO 4 → CuCl 2 → ZnCl 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2
34) Hg (NO 3) 2 → Al (NO 3) 3 → Al 2 O 3 → NaAlO 2 → Al (OH) 3 → AlOHCl 2
35) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → AlCl 3 → Al (OH) 3 → A1 2 O 3
36) CuCl 2 → Cu (OH) 2 → CuSO 4 → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2
37) Fe (NO 3) 3 → FeOH (NO 3) 2 → Fe (OH) 3 → FeCl 3 → Fe (NO 3) 3 → Fe
38) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → NaNO 3 → HNO 3
39) Mg (OH) 2 → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
40) كبريتات الألومنيوم ← كلوريد الألومنيوم ← نترات الألومنيوم ← أكسيد الألومنيوم ← ألومينات البوتاسيوم ← هيدروكسيد الألومنيوم ← هيدروكسيد الألومنيوم ← كلوريد الألومنيوم.
41) Na → NaOH → Na 3 PO 4 → NaNO 3 → HNO 3 → N 2 O 5
42) BaCO 3 → Ba (HCO 3) 2 → BaCO 3 → (BaOH) 2 CO 3 → BaO → BaSO 4
43) Cu → CuSO 4 → (CuOH) 2 SO 4 → Cu (OH) 2 → Cu (HSO 4) 2 → CuSO 4
44) الباريوم → هيدروكسيد الباريوم → بيكربونات الباريوم → كلوريد الباريوم → كربونات الباريوم → كلوريد الباريوم → هيدروكسيد الباريوم
45) P → P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → CaHPO 4 → Ca 3 (PO 4) 2
46) Cr → CrO → Cr 2 O 3 → NaCrO 2 → CrCl 3 → Cr (OH) 3 → Cr 2 O 3 → Cr
47) Cr 2 O 3 → CrCl 3 → Cr (OH) 3 → Na 3 → Cr 2 (SO 4) 3 → CrCl 3
48) K → KOH → KCl → KOH → K 2 SO 4 → KNO 3 → KNO 2
49) S → FeS → H 2 S → SO 2 → S → ZnS → ZnO → ZnCl 2 → Zn (OH) 2 → K 2
50) C → CO 2 → CO → CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2
51) С → CO 2 → NaHCO 3 → Na 2 CO 3 → CO 2
52) S → SO 2 → K 2 SO 3 → KHSO 3 → K 2 SO 3
53) Cu → Cu (OH) 2 → Cu (NO 3) 2 → CuO → Cu
54) Р 2 O 5 → Н 3 РО 4 → СаНРО 4 → Са (Н 2 РО 4) 2 → Са 3 (РО 4) 2
55) Fe → FeCl 2 → Fe (OH) 2 → FeSO 4 → Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (NO 3) 2 → ZnO
57) CuS → SO 2 → KHSO 3 → CaSO 3 → SO 2
58) SO 2 → H 2 SO 4 → CuSO 4 → CuO → Cu (NO 3) 2
59) KHSO 3 → CaSO 3 → Ca (HSO 3) 2 → SO 2 → K 2 SO 4
60) SO 2 → CaSO 3 → SO 2 → NaHSO 3 → SO 2
61) NaHCO 3 → Na 2 CO 3 → NaCl → NaHSO 4 → Na 2 SO 4
62) K → KOH → KCl → KNO 3 → K 2 SO 4 → KCl
63) NaCl → Na → NaOH → Na 2 SO 4 → NaCl
64) Al → AlCl 3 → Al (OH) 3 → A1 2 O 3 → Al (OH) 3
65) CuO → Cu → CuCl 2 → CuSO 4 → CuS
66) Fe → FeSO 4 → Fe (OH) 2 → Fe → Fe (OH) 3
67) Fe → Fe (OH) 2 → FeCl 2 → Fe (NO 3) 2 → Fe
68) Fe (NO 3) 3 → Fe 2 O 3 → FeCl 3 → Fe (NO 3) 3 → Fe
69) CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
70) MgCO 3 → MgO → MgCl 2 → Mg (OH) 2 → Mg (NO 3) 2
71) Mg → Mg (OH) 2 → MgSO 4 → MgCO 3 → Mg (HCO 3) 2
72) CaO → Ca (OH) 2 → CaCl 2 → CaCO 3 → CO 2
73) CaCO 3 → Ca (HCO 3) 2 → CaCl 2 → Ca (NO 3) 2 → O 2
74) FeS → Fe 2 O 3 → Fe (OH) 3 → Fe 2 (SO 4) 3 → FeCl 3
75) KS1 → K 2 SO 4 → KOH → K 2 CO 3 → KOH
76) CuS → CuO → Cu (OH) 2 → CuSO 4 → Cu
77) Fe → Fe (OH) 3 → Fe (NO 3) 3 → FeCl 3 → Fe 2 (SO 4) 3
78) CuSO 4 → CuO → Cu (NO 3) 2 → CuO → CuS
79) ZnS → H 2 S → SO 2 → Na 2 SO 4 → NaOH
80) Al → Al (OH) 3 → A1 2 (SO 4) 3 → A1 2 O 3 → Al (OH) 3
81) CaCl 2 → CaCO 3 → Ca (HCO 3) 2 → CaCO 3 → CaSiO 3
82) S → ZnS → H 2 S → Ca (HSO 3) 2 → SO 2
83) Na 2 SO 4 → NaCl → HCl → CaCl 2 → Ca (NO 3) 2
84) Na 2 SO 3 → SO 2 → H 2 SO 4 → HCl → FeCl 2
85) С → Na 2 CO 3 → CaCO 3 → CaSiO 3 → H 2 SiO 3
86) P → P 2 O 5 → Ca (H 2 PO 4) 2 → CaHPO 4 → H 3 PO 4
87) Al → A1 2 O 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
88) HCl → CuCl 2 → Cl 2 → HCl → H 2
89) P 2 O 5 → Na 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4
90) NH 3 → NH 4 C1 → NH 3 ∙ H 2 O → NH 4 HCO 3 → NH 3
91) NH 4 C1 → KC1 → HCl → CuCl 2 → Cu (OH) 2
92) NH 3 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → NH 3 → NH 4 NO 3
93) KOH → KHCO 3 → K 2 CO 3 → CO 2 → Ca (HCO 3) 2
94) Na → NaOH → NaHCO 3 → Na 2 SO 4 → NaOH
95) KNO 3 → K 2 SO 4 → KC1 → KNO 3 → KNO 2
96) Cl 2 → KC1 → K 2 SO 4 → KNO 3 → KHSO 4
97) FeSO 4 → FeS → SO 2 → KHSO 3 → K 2 SO 4
98) KOH → Cu (OH) 2 → CuSO 4 → Cu (OH) 2 → Cu
99) Fe 2 O 3 → FeCl 3 → Fe (OH) 3 → Fe (NO 3) 3 → Fe 2 O 3
100) Al → A1 2 O 3 → A1 (NO 3) 3 → A1 2 O 3 → Al (OH) 3
101) CaO → CaCO 3 → CaSiO 3 → Ca (NO 3) 2 → O 2
102) Cu → Cu (OH) 2 → Cu → CuSO 4 → CuCl 2
103) H 2 S → SO 2 → ZnSO 4 → ZnS → ZnO
104) Cl 2 → NaCl → HCl → CuCl 2 → CuO
105) Cl 2 → FeCl 3 → Fe 2 O 3 → Fe (OH) 3 → Fe (NO 3) 3
106) P 2 O 5 → Ca 3 (PO 4) 2 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2
107) ZnS → ZnO → Zn → ZnCl 2 → Zn (NO 3) 2
108) ZnO → ZnSO 4 → Zn (NO 3) 2 → ZnO → Zn (OH) 2
109) H 3 PO 4 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2
110) CaCO 3 → Na 2 CO 3 → Na 3 PO 4 → NaH 2 PO 4 → Ca 3 (PO 4) 2
111) CaCl 2 → CaSO 3 → Ca (OH) 2 → CaCl 2 → Ca (NO 3) 2
112) NaOH → Na 2 CO 3 → NaHSO 4 → NaNO 3 → NaHSO 4
113) Na 2 SiO 3 → Na 2 CO 3 → Na 2 SO 4 → NaCl → Na 2 SO 4
114) KNO 3 → KHSO 4 → K 2 SO 4 → KCl → Na 2 SO 4
115) SiO 2 → K 2 SiO 3 → H 2 SiO 3 → SiO 2 → CaSiO 3
116) Cu → CuCl 2 → Cu (NO 3) 2 → NO 2 → HNO 3
117) Ca (NO 3) 2 → O 2 → SiO 2 → H 2 SiO 3 → SiO 2
118) P → H 3 PO 4 → Ca 3 (PO 4) 2 → CaHPO 4 → Ca (H 2 PO 4) 2
119) CuSO 4 → Cu → CuS → CuO → CuCl 2
120) Al → A1 2 (SO 4) 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
121) S → SO 3 → H 2 SO 4 → KHSO 4 → BaSO 4
122) N 2 O 5 → HNO 3 → Cu (NO 3) 2 → CuO → Cu (OH) 2
123) Al → A1 2 O 3 → Al (OH) 3 → A1 2 (SO 4) 3 → A1 (NO 3) 3
124) Ca → Ca (OH) 2 → Ca (HCO 3) 2 → CaO → CaCl 2
125) NH 3 ∙ H 2 O → NH 4 C1 → NH 3 → NH 4 HCO 3 → (NH 4) 2 CO 3
126) Cu (OH) 2 → H 2 O → HNO 3 → Fe (NO 3) 3 → Fe
127) SO 2 → Ca (HSO 3) 2 → CaCl 2 → Ca (OH) 2 → Ca (HCO 3) 2
128) NH 3 ∙ H 2 O → NH 4 HCO 3 → CaCO 3 → CaSiO 3 → CaCl 2
129) CuSO 4 → Cu → CuO → Cu (OH) 2 → Cu
130) Fe (OH) 3 → Fe → FeCl 3 → Fe (NO 3) 3 → Fe
131) Zn → Zn (OH) 2 → Na 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn
132) Zn → ZnO → Na 2 ZnO 2 → Zn (OH) 2 → Na 2 → ZnCl 2
133) Zn → K 2 ZnO 2 → ZnSO 4 → K 2 → Zn (NO 3) 2 → ZnO
134) ZnO → Zn (OH) 2 → K 2 ZnO 2 → ZnSO 4 → ZnCl 2 → ZnO
135) Zn → Na 2 → Na 2 ZnO 2 → Zn (NO 3) 2 → ZnO → Zn
136) Al → K 3 → Al (OH) 3 → Na 3 → A1C1 3 → Al (OH) 3
137) Al 2 O 3 → KAlO 2 → Al (OH) 3 → Al 2 O 3 → Na 3 → Al 2 O 3
138) Al (OH) 3 → A1 2 O 3 → K 3 → Al 2 (SO 4) 3 → A1 (NO 3) 3
139) A1C1 3 → K 3 → Al (NO 3) 3 → NaAlO 2 → Al 2 O 3
140) Be → Na 2 → Be (OH) 2 → Na 2 BeO 2 → BaBeO 2
التجارب التجريبية على موضوع "الفئات الأساسية للمركبات غير العضوية"
تجربة 1.ردود فعل تحييد.
أ) تفاعل حمض قوي وقاعدة قوية.
صب 5 مل من محلول حمض الهيدروكلوريك 2N في طبق من الخزف وإضافة 2 ن محلول هيدروكسيد الصوديوم قطرة إلى ذلك. امزج المحلول بقضيب زجاجي واختبر تأثيره على عبّارة الضوء ، مع نقل قطرة من المحلول إلى اختبار عباد الشمس. من الضروري تحقيق تفاعل محايد (لا يتغير لون الورق العبسقي الأزرق والأحمر اللون). تتبخر الحل الناتج عن الجفاف. ما الذي تم تشكيله؟ اكتب معادلات تفاعل الجزيئية والأيونية.
ب) تفاعل حمض ضعيف وقاعدة قوية.
تصب في أنبوب اختبار 2 مل من محلول القلوي 2N وإضافة محلول من حمض الأسيتيك حتى يصبح المحلول محايدًا. اكتب معادلات تفاعل الجزيئية والأيونية. اشرح لماذا يتفاعل تفاعل أيون التوازن ، الذي يشارك فيه ال electroليكوليت الضعيف (حمض الأسيتيك) ، في اتجاه تكوين جزيئات الماء.
تجربة 2. هيدروكسيدات amphoteric.
من الكواشف المتاحة في المختبر ، الحصول على راسب من هيدروكسيد الزنك. هز رواسب الحصول عليها وصب كميات صغيرة منه في أنابيب 2. في أحد الأنابيب أضف محلول حمض الهيدروكلوريك ، في الآخر - محلول هيدروكسيد الصوديوم (الزائد). ما هو لوحظ؟ اكتب معادلات التفاعلات المقابلة في الشكل الجزيئي والأيوني.
تجربة 3.الخصائص الكيميائية للأملاح.
أ) تفاعل المحاليل الملحية مع تكوُّن مادة قابلة للذوبان لماما.
صب 2 مل من محلول كربونات الصوديوم في الأنبوب وأضف محلول كلوريد الباريوم حتى يظهر راسب أبيض. اكتب معادلة التفاعل الكيميائي في الشكل الأيوني والجزيئي. ينقسم الراسب إلى قسمين. صب محلول حامض الكبريتيك في واحد من الأنابيب ، وهيدروكسيد الصوديوم إلى الآخر. تقديم استنتاج حول ذوبان راسب في الأحماض والقلويات.
ب) تفاعل المحلول الملحي مع الأحماض لتشكيل مركب متطاير.
صب 2 مل من محلول كربونات الصوديوم في الأنبوب وإضافة كمية صغيرة من محلول حمض الهيدروكلوريك. ما هو لوحظ؟ اكتب معادلات التفاعل الكيميائي في الشكل الأيوني والجزيئي.
ج) تفاعل المحاليل الملحية مع القلويات مع تكوين مركب متطاير.
صب حل قليل من بعض ملح الأمونيوم في الأنبوب ، إضافة 1-2 مل من محلول هيدروكسيد الصوديوم والحرارة إلى درجة الغليان. في أنبوب اختبار مع خليط التفاعل لإجراء اختبار عبء أحمر مبلل. ما هو لوحظ؟ أعط تفسيرا. اكتب معادلات التفاعل.
ز ) تفاعلات الأملاح مع المعادن أكثر نشاطا من المعادن التي هي جزء من الملح.
تنظيف الأظافر الحديد (الصلب) مع ورق زجاج ناعم. ثم تراجع في محلول كبريتات النحاس. بعد مرور بعض الوقت ، لاحظ إطلاق النحاس على سطح الظفر. اكتب معادلة التفاعل المقابلة في الشكل الأيوني والجزيئي.
تجربة 4.الحصول على الأملاح الأساسية والأملاح.
أ) إعداد هيدروكسي كربونات الرصاص.
يُضاف القليل من أكسيد الرصاص (II) إلى محلول خلات الرصاص (II) ويُغلى الخليط لبضع دقائق. يتم تفريغ المحلول المبرد من الراسب ويتم تمرير تيار من ثاني أكسيد الكربون من خلاله. ما هو لوحظ؟ تصفية المترسب وجافة بين ورقة ورقة الترشيح. ضع علامة على لون وطبيعة المترسب الناتج عن هيدروكسي كربونات الرصاص. اكتب معادلات التفاعل. اصنع صيغة بيانية للملح الذي تم الحصول عليه.
ب) إعداد بيكربونات المغنيسيوم.
لإضافة محلول مخفف بدرجة عالية من بعض ملح المغنيسيوم ، أضف محلول قليل من كربونات الصوديوم. ما هي مادة تترسب؟ حل مشبع مع راسب مع ثاني أكسيد الكربون. مراقبة الحل التدريجي للراسب. لماذا يحدث هذا؟ اكتب معادلات التفاعل.
تجربة 5.الحصول على الأملاح المعقدة.
أ) تشكيل المركبات مع الأيونات الموجبة المعقدة.
إضافة محلول من الأمونيا إلى أنبوب يحتوي على 2-3 مل من محلول كلوريد النحاس (II) حتى يتم ترسيب هيدروكسيد النحاس (II) ، ثم إضافة فائض من محلول الأمونيا لحل الراسب. قارن لون الأيونات Cu 2+ بلون الحل الناتج. ما هي الأيونات الموجودة في الحل؟ اكتب معادلة التفاعل للحصول على مركب معقد.
ب) تشكيل المركبات مع أنيون معقدة.
إلى محلول 1-2 مل من الزئبق نترات (II) نضيف قطرة محلول مخفف من يوديد البوتاسيوم لتشكيل راسب من HgI 2. ثم صب في فائض من محلول يوديد البوتاسيوم حتى يتم حل راسب. اكتب ردود الفعل للحصول على ملح معقد.
تجربة 6.تحضير الأملاح المزدوجة (شبة البوتاسيوم).
يزن 7.5 غرام من Al 2 (SO 4) 3 ∙ 18H 2 O ويذوب في 50 مل من الماء ، مع طبق كبير من الخزف لهذا الغرض. احسب معادلة التفاعل ووزن كتلة كبريتات البوتاسيوم اللازمة للتفاعل. إعداد حل مشبع الساخنة من كبريتات البوتاسيوم وصبه في طبق من الخزف مع محلول كبريتات الألومنيوم مع التقليب. مراقبة بعد فترة من الترسيب من بلورات الألومنيوم الشب البوتاسيوم. بعد التبريد والبلورة ، صب السائل الأم ، جفف بلورات الشب بين أوراق ورق الترشيح ووزن البلورات الناتجة. حساب نسبة العائد.
مهام التسوية
1. عن طريق تمرير فائض من كبريتيد الهيدروجين خلال 16 جرام من محلول كبريتات النحاس (II) ، تم الحصول على 1.92 جرام من المترسب. العثور على جزء الشامل من كبريتات النحاس في الحل المستخدم وحجم كبريتيد الهيدروجين المستهلك.
2- بالنسبة للترسيب الكامل للنحاس على شكل كبريتيد من 291 سم 3 من محلول كبريتات النحاس (II) بكسر كبير من 10٪ ، تم استخدام الغاز المتحصل عليه باستجابة 17.6 جم من كبريتيد الحديد (II) مع فائض من حمض الهيدروكلوريك. العثور على كثافة محلول كبريتات النحاس الأصلي.
3. يتم تمرير الغاز الصادر أثناء تفاعل المحلول K 2S مع حمض الكبريتيك المخفف من خلال زيادة محلول نترات الرصاص (II). تترتب على المترسب الناتج كتلة مقدارها 71،7 غم ، أوجد حجم المحلول المتفاعل لحمض الكبريتيك ، إذا كانت كثافته 1.176 غم / سم 3 ، والجزء الضخم هو 25 ٪.
4. إلى محلول يحتوي على 8 غرام من كبريتات النحاس (II) ، تمت إضافة محلول يحتوي على 4.68 جم من sodium sulfide. ترشح الراسب ، تم تبخر الترشيح. تحديد كتلة المواد في الراشح بعد التبخر وكتل من رواسب كبريتيد النحاس.
5. تمت معالجة بعض من كبريتيد الحديد (II) باستخدام فائض من حمض الهيدروكلوريك. الغاز الناتج في التفاعل مع 12.5 سم 3 من محلول هيدروكسيد الصوديوم بجزء كبير من 25٪ وكثافة 1.28 غم / سم 3 شكل ملح حامض. العثور على كتلة من كبريتيد الحديد الأصلي.
6. تم معالجة كبريتيد الحديد (II) بوزن 176 جم مع وجود فائض من حمض الهيدروكلوريك ، وتم حرق الغاز الناتج في الهواء الزائد. ما هو حجم محلول KOH بجزء كبير من 40٪ وكثافة 1.4 g / cm 3 مطلوب لتحييد الغاز الناتج بالكامل أثناء الاحتراق؟
7. عند تحميص 100 غرام من البيريتات التقنية ، حصلوا على غاز ، تم تحييده بالكامل مع 400 سم 3 من محلول NaOH بجزء كبير من 25٪ وكثافة 1.28 جم / سم 3. تحديد جزء الشامل من الشوائب في البيريت.
8- أضيف إلى 2 جم من خليط من الحديد وأكسيد الحديد (II) وأكسيد الحديد (III) 16 سم 3 من محلول HC1 مع كسر كتلة من 20٪ وكثافة 1.09 جم / سم 3. لتحييد الحمض الزائد ، استغرق الأمر 10.8 سم 3 من محلول هيدروكسيد الصوديوم مع كسر كتلة 10٪ من 1.05 جم / سم 3. العثور على كتل المواد في الخليط إذا كان حجم الهيدروجين صدر 224 سم 3 (NU).
9. يوجد خليط من Ca (OH) 2 ، CaCO 3 و BaSO 4 بكتلة قدرها 10.5 جم ، عندما تمت معالجة الخليط مع فائض من حمض الهيدروكلوريك ، تم إطلاق 672 سم 3 (IU) من الغاز ، و تفاعل 71.2 جم من الحمض مع كتلة حصة من 10 ٪. تحديد كتلة المواد في الخليط.
10. يوجد خليط من كلوريد الباريوم وكربونات الكالسيوم وبيكربونات الصوديوم. عندما يذوب 10 جم من هذا المزيج في الماء ، يكون المتبقي غير القابل للذوبان مساوياً لـ 3.5 غم عند تحميص 20 غم من الخليط الأولي ، تنخفض كتلته بمقدار 5.2 جم ، أوجد الكسور الضخمة من المواد في الخليط الأولي.
11. يوجد محلول يحتوي على أحماض الكبريتيك و النيتريك. لتحييد 10 جرام من هذا المحلول ، يتم استهلاك 12.5 سم 3 من محلول KOH بجزء كبير من 19٪ وكثافة 1.18 جم / سم 3. عند إضافة فائض من كلوريد الباريوم إلى 20 جم من نفس الخليط من المحلول الحمضي ، تسقط 4.66 غرام من المترسب. العثور على أجزاء الشامل من الأحماض في الخليط.
12. كل ذرة هيدروجين تم الحصول عليها من 100 جم من خليط من KC1 و KNO 3 تم إذابتها في 71.8 سم 3 من الماء. عند تكليس 100 غرام من نفس الخليط من الأملاح ، يبقى 93.6 جرام من المخلفات الصلبة. العثور على جزء الشامل من كلوريد الهيدروجين في الماء.
13. عن طريق تمرير 2 م 3 من الهواء (NU) من خلال محلول Ca (OH) 2 ، تم الحصول على 3 غرام من رواسب ملح حمض الكارنيك. ابحث عن حجم وكتلة الكتلة من ثاني أكسيد الكربون في الهواء.
14. يمر ثاني أكسيد الكربون من خلال معلق يحتوي على 50 جم من CaCO 3. جاء رد الفعل 8.96 dm 3 غاز (NU). ما هي كتلة CaCO 3 المتبقية في المرحلة الصلبة؟
15. عند إضافة الماء إلى CaO ، زادت كتلته بنسبة 30٪. أي جزء من CaO (بالكتلة٪) تم إخماده؟
16. تم تسخين أكسيد الرصاص (II) بوزن 18.47 جم في تيار هيدروجين. بعد التفاعل ، كانت كتلة الرصاص الناتج والأكسيد غير المتفاعل 18.07 جرام ، ما هي كتلة أكسيد الرصاص الذي لم يتفاعل؟
يتم تمرير أول أكسيد الكربون من خلال أكسيد الحديد (III) عند تسخينه. كتلة المادة الصلبة بعد التفاعل تكون 2 غرام أقل من الكتلة الأولية لأكسيد الحديد. ما هو حجم ثاني أكسيد الكربون الذي اتبعه التفاعل (هل تم تخفيض أكسيد بالكامل)؟
18- يوجد 8.96 dm 3 (NU) لخليط من N 2 و CO 2 و SO 2 بكثافة نسبية للهيدروجين 25. بعد تمريره عبر فائض من محلول KOH ، انخفض حجم الخليط بمقدار 4 مرات. العثور على كميات من الغازات في الخليط الأصلي.
19. في نظارتين هناك 100 غرام من محلول HC1 مع كسر كتلة من 2.5 ٪. في واحد كوب أضيف 10 غرام من CaCO 3 ، في الآخر - 8.4 غرام من MgCO 3. كيف ستختلف كتلة النظارات بعد التفاعل؟
20. ما حجم (NU) من ثاني أكسيد الكبريت يجب أن يمر من خلال 200 سم 3 من محلول مع جزء من 0.1 ٪ من هيدروكسيد الصوديوم وكثافة 1 غرام / سم 3 للحصول على ملح حامض؟
21. ما هي الكمية القصوى (ثاني أكسيد الكربون) لثاني أكسيد الكربون التي يمكن أن تمتص 25 سم 3 من محلول مع 25٪ من كتلة هيدروكسيد الصوديوم وكثافة 1.1 غم / سم 3؟
22. ما هو الحد الأدنى لحجم المحلول بجزء كتلة من KOH 20 ٪ وكثافة 1.19 جم / سم 3 التي يمكن أن تمتص كل ثاني أكسيد الكربون الناتج مع التخفيض الكامل 23.2 جم من أكسيد الحديد الأسود مع أول أكسيد الكربون؟
23. ما هو الحد الأدنى لكمية KOH التي يجب أن تتفاعل مع 24.5 جم من حمض orthophosphoric بحيث يكون فوسفات هيدروجين البوتاسيوم فقط هو المنتج؟
24. ما هي الكتلة الدنيا من Ca (OH) 2 لإضافة 16 غرام من محلول بيكربونات الكالسيوم مع جزء كبير من الملح 5 ٪ للحصول على ملح متوسط؟
25. ما هي كتلة فوسفات الهيدروجين البوتاسيوم التي يجب إضافتها إلى محلول يحتوي على 12.25 جم من H3PO4 بحيث لا يحتوي المحلول بعد ذلك إلا على فوسفات هيدروجين البوتاسيوم؟
26. يحتوي المحلول على 56.1 جم من خليط من كربونات الكالسيوم والمغنيسيوم في نظام التعليق. لتحويلها إلى هيدروكربونات ، قضوا كل ثاني أكسيد الكربون الناتج عن حرق 7 ديسم 3 (NU) من الإيثان. العثور على كتلة كربونات الكالسيوم في الخليط الأولي.
27. لتحويل 9.5 غ من خليط من فوسفات هيدروجين وهيدروجين الصوديوم إلى ملح متوسط ، 10 سم 3 من محلول مع جزء كبير من هيدروكسيد الصوديوم من 27.7 ٪ وكثافة 1.3 غ / سم 3 ضروري. العثور على كتلة من فوسفات الهيدروجين في الخليط.
28. عن طريق تمرير ثاني أكسيد الكربون من خلال محلول يحتوي على 6 غرام من هيدروكسيد الصوديوم ، تم الحصول على 9.5 غرام من خليط من الأملاح الحمضية والمتوسطة. العثور على كمية ثاني أكسيد الكربون المستهلكة.
29 - وبعد اجتياز 11.2 dm 3 (CO) من ثاني أكسيد الكربون من خلال محلول KOH ، تم الحصول على 57.6 غرام من خليط من الأملاح الحمضية والمتوسطة. العثور على كتلة من الملح المتوسط.
30. ما هي كتلة حامض الفوسفوريك الذي يجب تحييده للحصول على 1.2 جم من ثنائي هيدرو و 4.26 جم من فوسفات هيدروجين الصوديوم؟
31 - أضيفت NaOH إلى محلول حامض الكبريتيك للحصول على 3.6 غرام من hydrosulfate و 2.84 غرام من sodium sulfate. حدد الكميات الكيميائية للحامض والقلويات التي تفاعلت.
32. بعد مرور كلوريد الهيدروجين من خلال 200 سم 3 من محلول هيدروكسيد الصوديوم بجزء كبير من 10٪ وكثافة 1.1 غم / سم 3 ، انخفض الجزء الهائل من NaOH في المحلول الناتج بمقدار النصف. تحديد جزء الشامل من كلوريد الصوديوم في الحل الناتج.
33- يستهلك إذابة 14،4 غرام من خليط من النحاس وأكسيده (II) 48،5 غرام من محلول مع كسر HNO 3 بكتلة نسبتها 80٪. العثور على أجزاء الشامل من النحاس والأكسيد في الخليط الأولي.
34. تمت إذابة كتلة أكسيد الصوديوم بمقدار 6.2 جم في 100 سم 3 من الماء وتم الحصول على المحلول رقم 1. ثم أضيف حمض الهيدروكلوريك بكمية كبيرة من 10٪ إلى هذا المحلول حتى أصبح الوسط محايدًا ، وتم الحصول على المحلول رقم 2. :
1) الكسور الضخمة من المواد في الحل رقم 1 و 2 ؛
2) كتلة محلول HC1 الذي ذهب لتحييد الحل رقم 1.
35. يتفاعل 3 جم من الزنك مع 18.69 سم 3 من محلول HC1 مع كسر كتلة 14.6٪ وكثافة 1.07 جم / سم 3. عند تسخينه ، يتم تمرير الغاز الناتج على CuO الساخن بوزن 4 غم. ما هي كتلة النحاس التي يتم الحصول عليها؟
36. الغاز الذي صدر بعد معالجة هيدريد الكالسيوم بالمياه الزائدة ، غاب عن FeO. ونتيجة لذلك ، انخفضت كتلة الأكسيد بمقدار 8 غم. أوجد كتلة CaH 2 المعالجة بالماء.
37. أثناء تحميص العينة CaCO 3 ، انخفضت كتلتها بنسبة 35.2 ٪. تمت إذابة منتجات التفاعل الصلب في فائض من حمض الهيدروكلوريك للحصول على 0.112 dm 3 (NU) من الغاز. تحديد كتلة العينة الأصلية لكربونات الكالسيوم.
38. كانت نترات النحاس متحللة ، وكان أكسيد النحاس (II) الناتج ينخفض بالكامل بواسطة الهيدروجين. تم تمرير المنتجات الناتجة عبر أنبوب مع P 2 O 5 ، وكتلة الأنبوب بعد ذلك زادت بمقدار 3.6 غم. ما هو الحد الأدنى لحجم حامض الكبريتيك بجزء كبير من 88٪ وكثافة 1.87 غم / سم 3 اللازمة للتفكك التي تم الحصول عليها في التجربة النحاس وما هي كتلة الملح المتحلل؟
39. عند امتصاص أكسيد النيتريك (IV) بواسطة فائض من محلول KOH في البرد في غياب الأكسجين ، تم الحصول على 40.4 جم من KNO 3. ما هي المادة التي لا تزال تتشكل وما هي كتلتها؟
40. لتحييد 400 غرام من محلول يحتوي على الهيدروكلوريك و حمض الكبريتيكتستهلك 287 سم 3 من محلول هيدروكسيد الصوديوم بكتلة جماعية تبلغ 10٪ وكثافة 1115 جم / سم 3. إذا تمت إضافة محلول فائض من كلوريد الباريوم إلى 100 غرام من المحلول الأولي ، فإن 5.825 جرام من المترسب سوف يسقط. تحديد الكسور الجماعية للأحماض في الحل الأولي.
41. بعد مرور ثاني أكسيد الكربون من خلال محلول هيدروكسيد الصوديوم ، تم الحصول على 13.7 جم من خليط من الأملاح المتوسطة والحامضية. لتحويلها إلى كلوريد صوديوم ، هناك حاجة إلى 75 غرام من حمض الهيدروكلوريك مع جزء كبير من حمض الهيدروكلوريك بنسبة 10٪. العثور على حجم ثاني أكسيد الكربون استيعابها.
42. تم معالجة خليط من أحماض الهيدروكلوريك والكبريتيك مع كتلة إجمالية قدرها 600 غرام من المحلول مع نفس الكسور الضخمة من الأحماض مع فائض من بيكربونات الصوديوم و 32.1 dm 3 من الغاز (N o.) تم الحصول عليه. العثور على جزء كبير من الأحماض في الخليط الأولي.
43. لتحييد 1 dm 3 من محلول NaOH ، تم استهلاك 66.66 سم 3 من محلول HNO بجزء كبير من 63٪ وكثافة 1.5 g / cm 3. ما حجم محاليل حامض الكبريتيك بجزء كبير من 24.5٪ وكثافة 1.2 غم / سم 3 ستكون ضرورية لتحييد نفس الكمية من القلويات؟
44. في أي نسبة حجم ينبغي للمرء أن يأخذ محلول حمض الكبريتيك بجزء كتلة من 5 ٪ وكثافة من 1.03 غ / سم 3 ومحلول من هيدروكسيد الباريوم مع كسر كتلة من 5 ٪ وكثافة 1.1 غ / سم 3 للتحييد الكامل؟ تخيل الإجابة على أنها حاصل حجم الحل القلوي على المحلول الحمضي
45- يحسب الحجم الأدنى لمحلول الأمونيا بكثافة 0.9 غم / سم 3 وكسر كتلة مقدارها 25٪ ، وهو أمر ضروري للاستيعاب الكامل لثاني أكسيد الكربون الناتج عن تحلل 0.5 كلغ من الحجر الجيري الطبيعي مع كسر كتلة من كربونات الكالسيوم تساوي 92٪.
46. بالنسبة للتحويل الكامل لـ 2.92 جم من خليط من هيدروكسيد الصوديوم وكربونات الصوديوم إلى كلوريد ، يلزم 1.344 dm 3 من كلوريد الهيدروجين (NU). العثور على كتلة من كربونات الصوديوم في الخليط.
47. تمت إضافة 25 جرام من محلول كبريتات النحاس (II) مع كسر كتلة من 16٪ كمية من محلول هيدروكسيد الصوديوم بجزء كتلة 16٪. تم ترشيح الراسب الذي تم ترشيحه ، وبعد ذلك كان المرشح هو قلوي. لتحييد الرشاح بشكل كامل ، استغرق الأمر 25 سم 3 من محلول حامض الكبريتيك بتركيز مولار 0.1 مولار / ديسيلتر 3 من المحلول. حساب الكتلة من محلول هيدروكسيد الصوديوم المضافة.
48 - تم إذابة المادة التي تم الحصول عليها بالاختزال الكامل لـ CuO بكتلة قدرها 15.8 جرام من الهيدروجين بحجم 11.2 dm 3 (NU) عن طريق التسخين في حامض الكبريتيك المركز. ما هو حجم الغاز (NU) المنطلق نتيجة للتفاعل؟
49. من أجل الإبطال التام لـ 50 سم 3 من حمض الهيدروكلوريك مع جزء كبير من حمض الهيدروكلوريك بنسبة 20٪ وكثافة 1.10 غم / سم 3 ، تم استخدام محلول هيدروكسيد البوتاسيوم مع جزء كبير من KOH 20٪. ما هي الكمية الكيميائية من الماء الموجودة في المحلول الناتج؟
50. يتم إرسال الغاز الناتج عن تمرير فائض ثاني أكسيد الكربون أكثر من 0.84 جم من الفحم الساخن إلى التفاعل مع 14.0 جم من أكسيد النحاس المسخن (II). ما هو حجم محلول حامض النيتريك بجزء كبير من 63٪ وكثافة 1.4 غم / سم 3 لتذويب المادة التي تم الحصول عليها في التفاعل الأخير؟
51. عند المكلسة للوزن الثابت لنترات النحاس (II) ، انخفض وزن الملح بمقدار 6.5 جرام ، ما هو وزن الملح المتحلل؟
52. عند استخدام فائض من حمض الهيدروكلوريك ، تم إطلاق 6.72 dm 3 (NW) من الغاز على خليط من الألومنيوم مع معدن أحادي التكافؤ غير معروف ، وتم خفض كتلة الخليط. عند معالجة الرواسب باستخدام حمض النيتريك المخفف ، تم إطلاق 0.373 dm 3 (NU) NO. تحديد المعادن غير معروفة.
53 - تبلغ كتلة عينة الطباشير 105 جم ، وتبلغ الكمية الكيميائية لعنصر الأكسجين في تركيبه 1 جزيء جرامي. تحديد جزء الشامل من CaCO 3 في عينة الطباشير (يتم تضمين الأكسجين فقط في تكوين كربونات الكالسيوم).
54. في تفاعل أكسيد الكبريت (VI) مع الماء ، تم الحصول على محلول مع جزء كبير من حامض الكبريتيك بنسبة 25٪. عندما تمت إضافة فائض من Ba (OH) 2 إلى هذا المحلول ، تم ترسيب مترسب وزنها 29.13 جم ، ما هي كتلتي SO3 و H 2 O التي تم إنفاقها على تشكيل محلول الحمض؟
55. عند تمرير SO 2 إلى 200 g من محلول مع جزء كبير من NaOH بنسبة 16٪ ، تم تكوين خليط من الأملاح ، بما في ذلك 41.6 جرام من الملح الحمضي. ما هي كتلة الكبريت التي تحتوي على 4.5٪ من الشوائب من حيث الوزن ، وقد تم استخدامها للحصول على ثاني أكسيد الكبريت؟ ما هو وزن الملح المتوسط؟
56. تناول التفاعل مع 80 جم من محلول Ca (NO 3) 2 50 جرام من محلول Na2 CO 3. تم فصل الترسيب ، بينما تم معالجته مع وجود فائض من حمض الهيدروكلوريك ، تم إطلاق 2.24 dm 3 (NU) من الغاز. ما هي الكميات الضخمة من الأملاح في الحلول الأولية؟ ما هو الجزء الكتلي من نترات الصوديوم في المحلول بعد فصل الراسب؟
57. عندما يتفاعل الزنك مع حامض الكبريتيك ، يتشكل 10 dm 3 (NU) من خليط من SO 2 و H 2S بكثافة الأرجون النسبية 1.51. ما هي الكمية الكيميائية للزنك الذائب؟ ما هو الجزء الكتلي من ثاني أكسيد الكبريت في خليط الغاز؟
58. تم تذويب عينة من خليط من نشارة الزنك والألومنيوم مع كتلة إجمالية قدرها 11 غرام في فائض محلول قلوي. تحديد حجم (NU) للغاز المنطلق ، إذا كان الجزء الأكبر من الزنك في الخليط هو 30 ٪.
59. هيدروكسيد الصوديوم بوزن 4.0 جم كان مخلوط بهيدروكسيد الألومنيوم وزنها 9.8 غم وحسب كتلة الصوديوم metaaluminate الذي تم الحصول عليه.
60. عند معالجة 10 جم من خليط من النحاس والألومنيوم مع حامض النيتريك المركز في درجة حرارة الغرفة أصدرت 2.24 dm 3 غاز (NU). ما هو حجم (NU) الغاز الذي سيتم إطلاقه عند معالجة نفس كتلة الخلطة مع وجود فائض من محلول KOH؟
61. تمت معالجة سبيكة من النحاس والألومنيوم وزنها 20 جم مع فائض من القلويات ، وتم إذابة المتبخر غير القابل للذوبان في حامض النيتريك المركز. تم عزل الملح الذي تم الحصول عليه ، وتكلس إلى وزن ثابت ، وتم الحصول على 8 غرام من بقايا صلبة. تحديد حجم محلول NaOH المستهلك مع جزء كبير من 40 ٪ وكثافة 1.4 غ / سم 3).
62 - وتمت معالجة خليط من أكسيد الألومنيوم وأكسيد المعادن (II) (أكسيد غير أمفوري) بوزن 39 غراماً مع فائض من محلول KOH ، وتم حرق الغاز المنبعث للحصول على 27 غراماً من الماء. تمت إذابة المادة المتبقية غير المحلولة تمامًا في 25.2 سم 3 من محلول مع جزء كبير من HC1 بنسبة 36.5٪ وكثافة 1.19 جم / سم 3). تحديد الأكسيد.
63. تم معالجة خليط من رقائق الزنك والنحاس مع فائض من محلول KOH ، في حين تم إطلاق غاز قدره 2.24 dm 3 (NU). وبالنسبة للكلور الكامل لعينة المعدن نفسه ، كان الكلور الذي يبلغ حجمه 8.96 dm 3 (NU) مطلوبًا. حساب جزء الشامل من الزنك في العينة.
64- تم معالجة خليط من نشارة الخشب والألمنيوم والمغنيسيوم بكتلة قدرها 49 غراماً مع زيادة مخففة H 2 SO 4 ، وبالتالي الحصول على 1.95 جزيء من الغاز. تمت معالجة جزء آخر من نفس الخليط وزنه 4.9 غ مع وجود فائض من محلول قلوي ؛ تم الحصول على 1.68 دسم 3 (NU) من الغاز. العثور على كتلة من المعادن في الخليط.
65. ما هي كتلة الرواسب المشكلة عند دمج المحاليل المحتوية على 10 جم من NaOH و 13.6 جم من ZnCl 2؟
66 - يوجد جزأين من خليط Al، Mg، Fe، Zn ، نفس التركيب في تركيبة مولارية ، كل منها يزن 7.4 جم ، وقد تمت إذابة جزء واحد في حمض الهيدروكلوريك ، وتم الحصول على 3.584 dm 3 من الغاز (NU) ، والآخر في محلول قلوي. استلمت 2.016 dm 3 غاز (NU). من المعروف أنه في كلا الخليطين هناك 3 ذرات زنك لكل ذرة A1. العثور على كتلة من المعادن في الخليط.
67 - وتمت معالجة خليط من النحاس والمغنيسيوم والألومنيوم وزنها 1 غرام مع فائض من حمض الهيدروكلوريك. تم تصفية الحل ، تم إضافة فائض من محلول هيدروكسيد الصوديوم إلى الراشح. تم فصل المادة المترسبة وتكليسها إلى كتلة ثابتة مقدارها 0.2 غم ، وتمت تلاصق المادة المتبقية التي لم تنحل بعد المعالجة بحمض الهيدروكلوريك في الهواء وتم الحصول على 0.8 غ من المادة السوداء. العثور على جزء الشامل من الألومنيوم في الخليط.
68. عند تسخينها في تيار من سبيكة الأكسجين من الزنك والمغنيسيوم والنحاس ، زادت كتلة الخليط بمقدار 9.6 غم. يذوب المنتج جزئيا في القلويات ، و 40 سم 3 من المحلول بجزء كبير من KOH 40٪ وكثافة 1.4 غ / سم ضروري للحل 3. للتفاعل مع نفس الجزء من السبائك ، هناك حاجة إلى 0.7 مول HC1. العثور على كميات كيميائية من المعادن في السبائك.
69. تمت معالجة سبيكة من النحاس والزنك بوزن 5 غ مع وجود فائض من محلول NaOH. ثم تم فصل المادة الصلبة المتبقية ومعالجتها بمركب HNO 3 ، وتم عزل الملح الذي تم الحصول عليه وبالتالي تم تكليسه إلى وزن ثابت ، وتم الحصول على 2.5 غرام من المادة الصلبة المتبقية. تحديد كتلة المعادن في السبائك.
70- تمت معالجة خليط من النحاس والألومنيوم وزنه 12،8 غرام مع فائض من حمض الهيدروكلوريك. تمت إذابة البقايا غير المحلولة في حامض النيتريك المركز ، وتم تبخر المحلول الناتج ، وتمت تسوية المخلفات الجافة إلى وزن ثابت وتم الحصول على 4 جم من المادة الصلبة. تحديد جزء الكتلة من النحاس في السبائك.
71. في أي نسبة جماعية ينبغي أن تأخذ جزأين من A1 ، بحيث عندما يُضاف واحد إلى محلول القلوي والآخر إلى كميات متساوية من الهيدروجين يتم إطلاقها في حمض الهيدروكلوريك؟
72. عند معالجة خليط من أكسيد الألومنيوم والنحاس (II) مع فائض من محلول KOH ، تم إطلاق 6.72 dm 3 (NU) من الغاز ، وبحل نفس الجزء من الخليط في HNO المركّز 3 عند درجة حرارة الغرفة ، تم الحصول على 75.2 غم من الملح. العثور على كتلة من الخليط الأولي من المواد.
73. ما هي كتلة أكسيد النحاس (II) التي يمكن استعادتها بواسطة الهيدروجين المتحصل عليها عن طريق تفاعل فائض الألمنيوم مع 139.87 سم 3 من محلول به 40٪ هيدروكسيد الصوديوم وكثافة 1.43 جم / سم 3؟
٧٤ - ومع اﻷكسدة الكاملة البالغة ٧،٨٣ غرام من سبيكة اثنين من الفلزات ، تشكلت ١٤،٢٣ غرام من أكاسيد ، خﻻل المعالجة التي ظل بها فائض من القلويات دون حل ٤،٠٣ غرام من الرسوبيات. تحديد التركيب النوعي للمعادن التي تشكل السبيكة ، إذا كانت الكاتيونات لديها حالة أكسدة +2 و +3 ، والنسبة المولية للأكسيدات هي 1: 1 (افترض أن أكسيد الفلز مع حالة الأكسدة +3 له خصائص amphoteric).
٧٥ - تم تذويب جزأين من الألومنيوم ، لهما نفس الكتلة: أحدهما في محلول هيدروكسيد البوتاسيوم ، والآخر في حمض الهيدروكلوريك. كيف ترتبط أحجام الغازات المتطورة (nos) ببعضها البعض؟
76. تمت معالجة سبيكة من النحاس مع الألومنيوم وزنها 1000 غرام مع وجود فائض من محلول قلوي ، تم إذابة الراسب غير المحلول في حامض النيتريك ، ثم تم تبخر المحلول ، تم تكليس البقايا للوزن الثابت. كتلة المادة الجديدة هي 0.398 جم ما هي كتلة المعادن في السبائك؟
77. تمت معالجة سبيكة من الزنك والنحاس وزنها 20 غ مع وجود فائض من محلول هيدروكسيد الصوديوم بجزء كبير من 30٪ وكثافة 1.33 غم / سم 3. تم عزل المخلفات الصلبة ومعالجتها باستخدام فائض محلول مركّز من HNO 3. تم عزل الملح المتكون خلال هذه العملية وتكليسه إلى وزن ثابت. كانت كتلة المخلفات الصلبة 10.016 غ تحسب الكسور الضخمة للمعادن في السبائك وحجم المحاليل القلوية المستهلكة.
78- وقد عولجت سبيكة من النحاس والألومنيوم وزنها 2 غرام مع وجود فائض من المحلول القلوي. تمت تصفية المادة المتخلفة وغسلها وتم إذابتها في HNO 3 ، وتم تبخر المحلول وتثبيته وفقًا للوزن الثابت. كانت كتلة الرواسب بعد التكلس 0.736 جم حساب الكسور الضخمة للمعادن في السبائك.
79. تتطلب المعالجة بالكلور لخليط من الحديد والنحاس والألمنيوم 8.96 dm 3 من الكلور (NU) ، ويتطلب تفاعل نفس العينة مع كلوريد الهيدروجين 5.6 ديسمتر 3 (NU). عند التفاعل مع نفس الكتلة من خليط من المعادن مع القلويات ، يتم تحرير 1.68 dm 3 (NU) من الغاز. العثور على كميات كيميائية من المعادن في الخليط.
80. تمت إذابة هيدريد البوتاسيوم بوزن 5.0 جم في ماء بحجم 80 سم 3 وتمت إضافة الألمنيوم الذي يزن 0.81 جم إلى المحلول الناتج ، وإيجاد الكسور الضخمة للمواد في المحلول الناتج بدقة تصل إلى ألف جزء من الألف.
قائمة الأدب
1. Barannik، V.P. المصطلحات الروسية الحديثة للمركبات غير العضوية / V.P. Barannik // Journal of the All-Union Chemical Society. DI مندليف. - 1983. - المجلد الثامن والعشرون. - ص 9-16.
2. Wroblewski، A.I. محاكي الكيمياء / A.I. Wroblewski. - الطبعة الثانية ، Pererab. وأضف. - Minsk: Krasiko-Print، 2007. - 624 p.
3. Glinka، N.L. المهام والتمارين في الكيمياء العامة: الدراسات. دليل للجامعات / أد. VA رابينوفيتش وه. ام. روبينا. - M .: Integral-Press، 2004. - 240 p.
4. ليدن ، ر. المهام العامة والكيمياء غير العضوية: الدراسات. دليل للطلاب العالي. بروك. مؤسسات / R.A. Lidin، V.A. الحليب ، L.L. اندرييف. بواسطة ed. RA لدين. - M .: VLADOS، 2004. - 383 p.
5. ليدن ، ر. أساسيات المواد غير العضوية nomenclature / R.А. ليدن [وآخرون] ؛ بواسطة ed. BD Stepin. - M: الكيمياء ، 1983. - 112 ص.
6. Stepin، B.D. تطبيق قواعد IUPAC على تسمية المركبات غير العضوية في اللغة الروسية / B.D. Stepin، R.A. Lidin // Journal of the All-Union Chemical Society. DI مندليف. - 1983. - المجلد الثامن والعشرون. - ص 17 - 20.
| مقدمة .............................................. القواعد العامة لمجموعة المواد غير العضوية ........... ...................................... أكاسيد أساسية ......................... ............................ أكاسيد الامفوتوريك ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………… موضوع "أوكسيدات" ...................................................... الأحماض .............................................. تمارين للعمل المستقل حول موضوع "الأحماض" ........................................................................................................................................................................................................... ……… .. تمارين العمل المستقل حول موضوع "أسس" .......................................................... الأملاح .................................................. تمارين للعمل المستقل حول موضوع "الأملاح" .................................................. العلاقة الوراثية بين فئات المركبات غير العضوية ......................................... …………… .. تمارين للعمل المستقل حول موضوع "الاتصال الجيني بين فئات المركبات غير العضوية" ................................................. .............. مهام التسوية .................................................................................................................................................................................................................................................................... المراجع .................................................................................. |
التعليم: لإصلاح مفهوم "السلسلة الجينية" ، "الارتباط الجيني" ؛ تعليم كيفية صنع سلسلة جينية من العناصر (المعادن وغير المعادن) ، لتكوين معادلات التفاعل المقابلة للسلسلة الجينية ؛ تحقق من كيفية استيعاب معرفة الخواص الكيميائية للأكاسيد والأحماض والأملاح والقواعد ؛
تطوير: تطوير القدرة على تحليل ومقارنة وتلخيص واستخلاص الاستنتاجات ، تشكل معادلات التفاعلات الكيميائية.
تربوي : تعزيز تشكيل النظرة العلمية العالمية.
2. توفير الطبقات: الجداول "النظام الدوري" ، "جدول الذوبان" ، "سلسلة نشاط المعادن" ، تعليمات للطلاب ، مهام اختبار المعرفة.
3. ترتيب الأداء:
3.1. المسح الأمامي.
3.2. حل المهام.
3.3. تنفيذ أعمال التحقق على الخيارات.
4. تخطيط التقرير:
4.1. اكتب موضوع وأهداف الدرس العملي.
4.2. سجل حل المشكلات.
4.3. قم بحل نسختك الخاصة من العمل المستقل ، وقرار الكتابة في دفتر الملاحظات ونقله إلى المعلم للمراجعة.
تقدم العمل
1. محادثة أمامية على:
ما هو الاتصال الجيني؟
اتصالات جينية - هذه هي الروابط بين الطبقات المختلفة على أساس interconversions الخاصة بهم.
ما هي السلسلة الجينية؟
الصف الجيني - سلسلة من المواد - ممثلين من فئات مختلفة ، والتي هي مركبات عنصر كيميائي واحد ، متصلا عبر interconversions وتعكس التحولات من هذه المواد. أساس هذه السلسلة هو نفس العنصر.
ما هي أنواع السلاسل الوراثية التي يتم تخصيصها عادة؟
بين المعادن هناك نوعان من الصفوف:
أ) سلسلة جينية تعمل فيها القلويات كقاعدة. يمكن تمثيل هذه السلسلة باستخدام التحويلات التالية:
معدن ← أوكسيد أساسي ← قلوي ← ملح
على سبيل المثال ، السلسلة الوراثية للبوتاسيوم K → K 2 O → KOH → KCl
ب) السلسلة الوراثية ، حيث القاعدة هي قاعدة غير قابلة للذوبان ، ثم يمكن تمثيل السلسلة كسلسلة من التحولات:
المعادن → قاعدة أكسيد → الملح → قاعدة غير قابلة للذوبان → قاعدة أكسيد → المعادن
على سبيل المثال: Cu → CuO → CuCl 2 → Cu (OH) 2 → CuO → Cu
من بين غير الفلزات ، من الممكن أيضًا التمييز بين نوعين من الصفوف:
أ) السلسلة الوراثية من غير المعادن ، حيث يعمل الحمض الذائب كحلقة وصل في السلسلة. يمكن تمثيل سلسلة التحولات كما يلي: غير المعدني ← أوكسيد الحمض ← حمض قابل للذوبان ← ملح.
على سبيل المثال: P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
ب) الصف الوراثي من غير المعادن ، حيث حمض غير قابل للذوبان: غير المعدني ← أوكسيد الحمض ← ملح ← حمض ← أوكسيد حامض ← أعمال غير معدنية كحلقة في السلسلة
على سبيل المثال: Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
تنفيذ المهام للخيارات:
| الخيار 1 | الخيار الثاني |
|
I option: ZnSO 4، Zn، ZnO، Zn، Zn (OH) 2
الخيار الثاني: Na 2 SO 4، NaOH، Na، Na 2 O 2، Na 2 O
الواجبات المنزلية: الرسم البياني الانتقال التدريجي من الكالسيوم إلى كربونات الكالسيوم وإعداد تقرير عن استخدام أي ملح في الطب (باستخدام الأدب إضافية).
تعليمات للدرس العملي
العلاقة الوراثية بين الطبقات الرئيسية للمواد غير العضوية.
الأهداف: لإصلاح مفهوم "السلسلة الجينية" ، "الارتباط الجيني" ؛ تعلم كيفية إنشاء سلسلة جينية من العناصر (المعادن وغير المعادن) ، لتكوين معادلات التفاعل المقابلة للسلسلة الجينية ؛ كرر خصائص الأكاسيد والأحماض والأملاح والقواعد.
تقدم العمل
اكتب تعريفات المفاهيم:
علاقة جينية - __________________________________________
الصف الجيني - ___________________________________________
سلسلة جينية من المعادن تعمل فيها القلويات كقاعدة. يمكن تمثيله بشكل عام: معدن ← أكسيد أساسي ← قلوي ← ملح. جعل هذه السلسلة باستخدام البوتاسيوم. اكتب معادلات التفاعلات التي يمكنك من خلالها تحقيق هذه السلسلة من التحولات.
السلسلة الوراثية من غير المعادن ، حيث يعمل الحمض الذائب كحلقة في السلسلة يمكن تمثيله على النحو التالي: غير المعدني ← أوكسيد الحمض ← حمض قابل للذوبان ← ملح. جعل هذه السلسلة باستخدام الفوسفور. اكتب معادلات التفاعلات التي يمكنك من خلالها تحقيق هذه السلسلة من التحولات.
الصف الجيني ، حيث القاعدة هي قاعدة غير قابلة للذوبان يمكن أن تمثله سلسلة التحولات: المعادن ← الأكسيد الأساسي ← الملح ← قاعدة غير قابلة للذوبان ← الأكسيد الأساسي ← المعادن. بناء هذه السلسلة باستخدام النحاس. اكتب معادلات التفاعلات التي يمكنك من خلالها تحقيق هذه السلسلة من التحولات.
السلسلة الوراثية من غير المعادن ، حيث يعمل الحمض غير الذائب كحلقة في السلسلة يمكن أن تمثلها سلسلة التحولات: غير المعدنية → أكسيد الحديد ← ملح ← حمض ← أكسيد حامض ← غير معدنية. بناء هذه السلسلة باستخدام السيليكون. اكتب معادلات التفاعلات التي يمكنك من خلالها تحقيق هذه السلسلة من التحولات.
أداء المهام للخيارات:
| الخيار 1 | الخيار الثاني |
|
1. اختر صيغ الأكسيد في نسختك ، واشرح اختيارك ، بناء على معرفة خصائص تكوين هذه الفئة من المركبات. اتصل بهم.
2. في عمود الصيغة الخاص بك ، ابحث عن الصيغ الحمضية واشرح اختيارك بناءًا على تحليل تركيبة هذه المركبات.
3. تحديد تباينات بقايا الحمض في تركيبة الحمض.
4. حدد صيغ الملح واسمها.
5. تشكل صيغ الأملاح ، والتي يمكن تشكيلها مع المغنيسيوم والأحماض من البديل الخاص بك. اكتبها واسمها.
6. في عمود الصيغة الخاص بك ، ابحث عن الصيغ الأساسية واشرح اختيارك بناءً على تحليل تركيبة هذه المركبات.
7. في صيغة الخاص بك ، واختيار الصيغ من المواد التي يمكن أن تتفاعل مع حل من حامض orthophosphoric (الهيدروكلوريك ، الكبريتيك). جعل معادلات رد الفعل المناسبة.
9. من بين صيغ خيارك ، حدد صيغ المواد التي يمكن أن تتفاعل مع بعضها البعض. جعل معادلات رد الفعل المناسبة.
10. قم بعمل سلسلة من الروابط الوراثية للمركبات غير العضوية ، والتي ستحتوي على مادة ، معطى الصيغة في نسختك في رقم واحد.
من هذه المواد جعل خط جيني باستخدام جميع الصيغ. اكتب معادلات التفاعل التي يمكنك من خلالها إنجاز هذه السلسلة من التحولات:
أنا الخيار: ZnSO 4، Zn، ZnO، Zn، Zn (OH) 2
IIخيار: Na 2 SO 4، NaOH، Na، Na 2 O 2، Na 2 O
الواجبات المنزلية: الرسم البياني الانتقال التدريجي من الكالسيوم إلى كربونات الكالسيوم وإعداد تقرير عن استخدام أي ملح في الطب (باستخدام الأدب إضافية).
