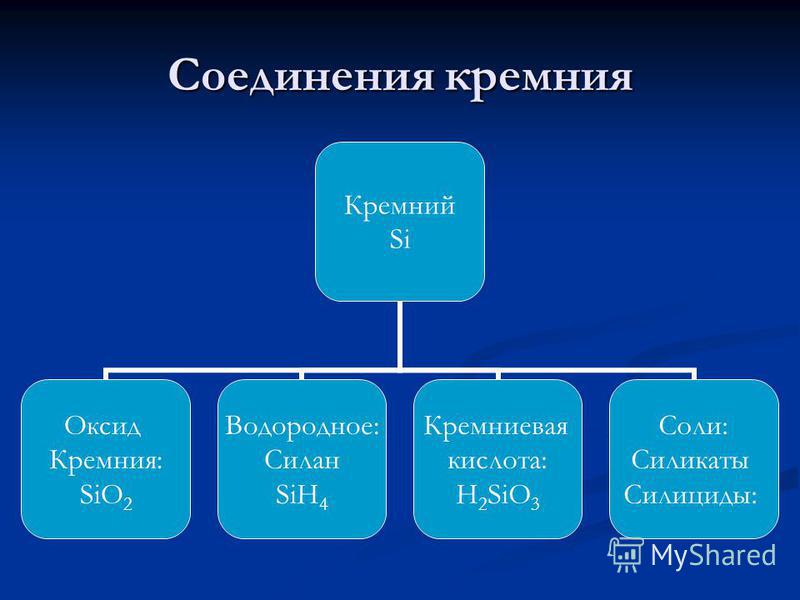
مخطط هيكل السيليكون. هيكل الإلكترون
التركيب الذري موقف في PS: الفترة الثالثة ؛ المجموعة الرابعة ، الرائدة. نواة تهمة: +14 سي. الكتلة الذرية النسبية: Ar (Si) = 28 التركيب الذري: p = 14 ، e = 14 ، n = = 14 الصيغة الإلكترونية: +14 Si 2e ؛ 8e ؛ 4e ؛ +14 Si 1s 2 2s 2 2p 6 3s 2 3p Si 1s 2 2s 2 2p 6 3s 2 3p 2 Nemetall؛
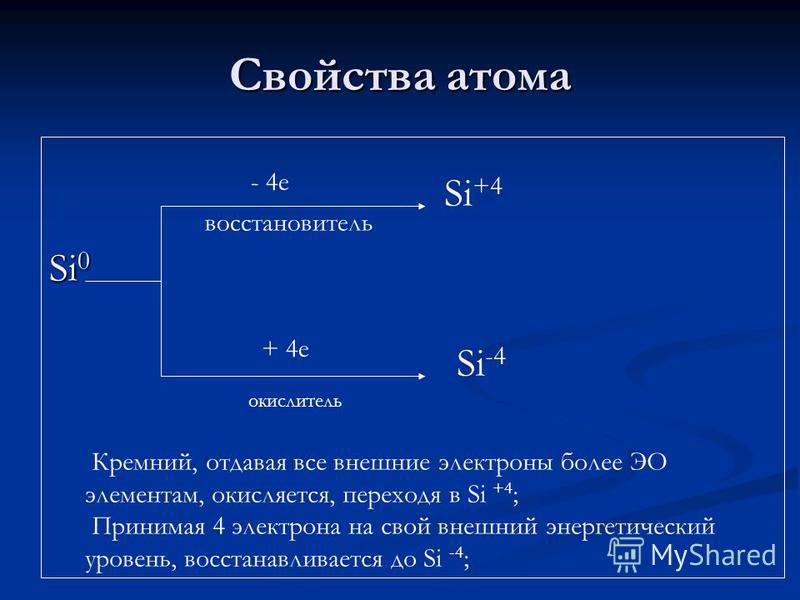
الخواص الذرية Si e مخفض عامل + 4 e مؤكسد Si + 4 Si -4 Silicon ، مما يعطي جميع الإلكترونات الخارجية لمزيد من عناصر EO ، يتأكسد ، ويمر في Si + 4 ؛ أخذ 4 إلكترونات إلى مستوى الطاقة الخارجية ، يتم تقليله إلى Si-4 ؛

الخواص الفيزيائية للسيليكون السيليكون غير معدنية ، فهي موجودة في حالة بلورية وغير متبلورة. السيليكون البلوري مادة صلبة رمادية اللون ذات بريق معدني ، صلبة للغاية ولكنها هشة. غير متبلور السيليكون - مسحوق البني. ع = 2.33 جم / سم 3 ؛ ر ر. = جيم ؛ ر كيب. = جيم ؛

التركيب البلوري للسيليكون إن الشبكة البلورية للسيليكون هي نوع من الألماس مكعب محوره الوجه. ولكن نظرًا لطول الرابطة بين Si-Si ، فإن صلابة السيليكون أقل بكثير من صلابة الماس. السيليكون هش فقط عند تسخينه فوق C.

كهرباء الخصائص الفيزيائية السيليكون عنصري السيليكون عنصري هو أشباه الموصلات نموذجي. أشباه الموصلات نموذجي. تتأثر الخصائص الكهربية الفيزيائية للسيليكون البلوري بدرجة كبيرة بالشوائب النزرة الموجودة فيه. للحصول على بلورات واحدة من السيليكون مع التوصيل من النوع p ، يتم إدخال إضافات عناصر المجموعة الثالثة من البورون والألمنيوم والغاليوم والإندوميوم ، مع التوصيل الإلكتروني للمادة المضافة ، في السيليكون العناصر الخامس مجموعات الفسفور أو الزرنيخ أو الأنتيمون.


Flint Flint ، هذا Flint ، هذا الحجر القبيح والقبيح للغاية ودائم للغاية ، الحجر المتين ، وضع الأساس لبداية حجر من العصر الحجري - القرن - قرن أدوات عمل الصوان. أدوات الصوان. هناك سببان: - انتشار السيليكون وتوافره ؛ - انتشار وتوافر السيليكون ؛ - القدرة على تشكيل حواف القطع الحادة عند التقطيع ؛ - القدرة على تشكيل حواف القطع الحادة عند التقطيع ؛




هل تعلم ذلك .. طريقة الحصول على السيليكون في شكله النقي تم تطويره بواسطة نيكولاي نيكولايفيتش بيكيتوف. يتم إنتاج السيليكون في روسيا في المصانع: كامينسك - أورالسكي (منطقة سفيردلوفسك) كامينسك - أورالسكي (منطقة سفيردلوفسك) شيليك (منطقة إيركوتسك). شيليك (منطقة إيركوتسك).

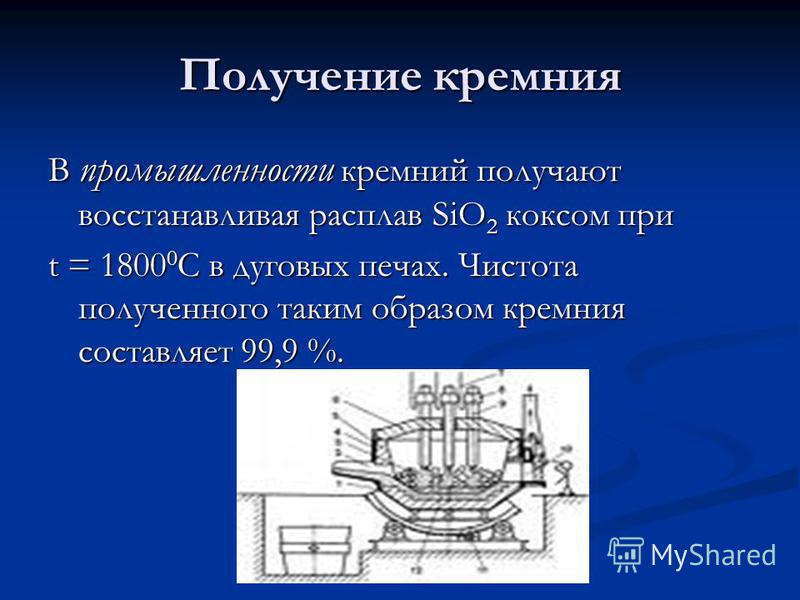
إنتاج السيليكون في الصناعة ، يتم الحصول على السيليكون عن طريق تقليل ذوبان SiO 2 عن طريق فحم الكوك في t = C في أفران القوس. نقاء السيليكون التي تم الحصول عليها وبالتالي هي 99.9 ٪.
الحصول على السيليكون طريقة إنتاج المختبر: SiO Mg 2MgO + Si SiO Mg 2MgO + Si


الخواص الكيميائية للسيليكون عند تسخينه إلى 400 درجة مئوية ، يتفاعل السيليكون مع الأكسجين لتكوين ثاني أكسيد السيليكون: Si + O 2 SiO 2 Si + O 2 SiO 2



![]()
خواص ثاني أكسيد الكربون CO 2 CO 2 SiO. بلوري ، صلب ، حراري. الخواص الكيميائية الكيميائية H 2 O + CO 2 = H 2 CO 3 لا تتفاعل CO 2 + CaO = CaCO 3 SiO 2 + CaO = CaSiO 3 CO 2 + Ca (OH) 2 = CaCO 3 + H 2 O SiO 2 + NaOH = Na 2 SiO 3 + H 2 O CO 2 + 2Mg = 2MgO + C SiO 2 + 2C = 2MgO + Si C + CO 2 = 2CO SiO 2 + 2C = Si + 2CO
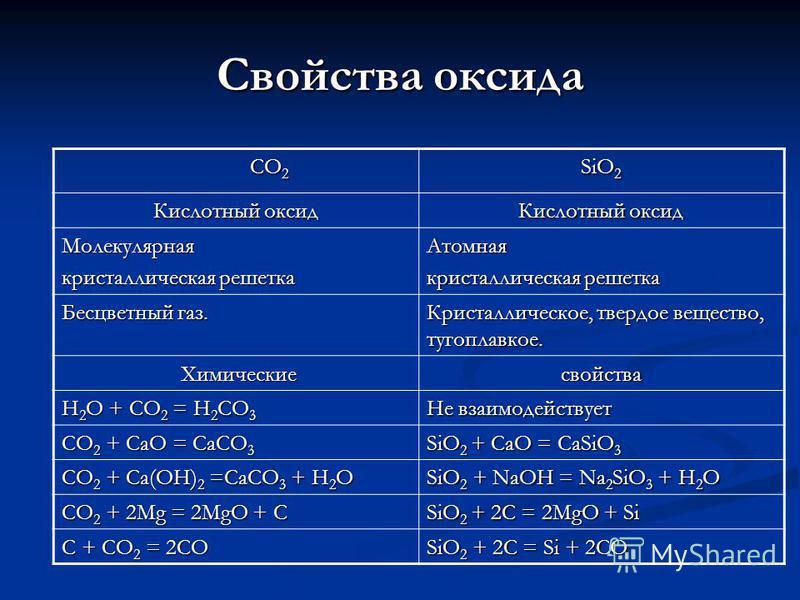
خصائص الأحماض H 2 CO 3 H 2 SiO 3 ديباسي ، تحتوي على الأكسجين ، ضعيفة ، هشة ، منذ ذلك الحين الخفافيش. ديباسي ، يحتوي على الأكسجين ، ضعيف ، غير قابل للذوبان في الماء. الاستلام: CO 2 + H 2 O = H 2 CO 3 الاستلام: SiO 2 + H 2 O = لا يمكن أن يكون غير مستقر أو هش أو يتحلل عند الوقوف أو التسخين: H 2 CO 3 = CO 2 + H 2 O لا يمكن تحديده بشكله النقي ، ل يتحلل عند التسخين: H 2 SiO 3 = SiO 2 + H 2 O Zn + H 2 CO 3 = ZnCO 3 + H 2 تطور الغاز الصغرى __________

حمض سيليكيك - أحماض كربونية - كربونات. - الهيدروكربونات ؛ - السيليكات ؛ - السيليكات ؛ تحتوي الكربونات على كل خصائص الأملاح ، وهي شوارد قوية ، تنفصل تمامًا إلى أيونات (قابلة للذوبان في الماء). الأملاح المعدنية القلوية فقط قابلة للذوبان ، والأخرى غير قابلة للذوبان أو لا تشكل أملاح على الإطلاق (Al +3، Cr +3، Ag +).
![]()



دور بيولوجي يعد مركب SiO 2 الأكثر أهمية في السليكون ضروريًا للحياة النباتية والحيوانية. بفضله ، القصب ، القصب بفضله ، تقف القصب والقصب وذيل الحصان بقوة مثل الحراب. و horsetails تقف ضيقة ، مثل الحراب. أوراق حادة شارب مقطوعة مثل أوراق شارب حادة مقطوعة مثل السكاكين ، وقش على سكاكين حقل مزروعة ، وقش في أحد الحقول المزروعة مثل الإبر ، وسيقان الحبوب تلتصق مثل الإبر ، وسيقان الحبوب قوية للغاية بحيث لا تسمح بقوتها لا تسمح للحقل في الحقول بالسقوط من المطر وحقل الرياح في الحقول للذهاب من المطر والرياح


السيليكون هو عنصر تتبع موجود باستمرار في جسم الإنسان. ويرد أكبر قدر في العقد الليمفاوية والأنسجة الضامة من الشريان الأورطي والقصبة الهوائية والشعر والجلد. هناك حاجة إلى السيليكون لبناء الخلايا الظهارية. السيليكون هو عنصر تتبع موجود باستمرار في جسم الإنسان. ويرد أكبر قدر في العقد الليمفاوية والأنسجة الضامة من الشريان الأورطي والقصبة الهوائية والشعر والجلد. هناك حاجة إلى السيليكون لبناء الخلايا الظهارية. يلعب السيليكون دورًا مهمًا في عملية تمعدن العظام ؛ ضروري للحفاظ على مرونة الجدار الشرياني ، له تأثير إيجابي على الجهاز المناعي ويبطئ عملية الشيخوخة في أنسجة الجسم البشري. متوسط محتوى السيليكون في الدم هو 8.25 ملغ / يوم. مع تقدم العمر ، يتناقص مستوى الجسم ، وكذلك عند كبار السن ، تميل الحاجة إلى السيليكون إلى الزيادة. تحسين امتصاص السيليكون من الجسم بوجود الكالسيوم والمغنيسيوم والمنغنيز والبوتاسيوم. يلعب السيليكون دورًا مهمًا في عملية تمعدن العظام ؛ ضروري للحفاظ على مرونة الجدار الشرياني ، له تأثير إيجابي على الجهاز المناعي ويبطئ عملية الشيخوخة في أنسجة الجسم البشري. متوسط محتوى السيليكون في الدم هو 8.25 ملغ / يوم. مع تقدم العمر ، يتناقص مستوى الجسم ، وكذلك عند كبار السن ، تميل الحاجة إلى السيليكون إلى الزيادة. تحسين امتصاص السيليكون من الجسم بوجود الكالسيوم والمغنيسيوم والمنغنيز والبوتاسيوم.

يتم تضمين الدور الحيوي للسيليكون أيضًا في تكوين الكائنات الحية الدنيا - الدياتومات والراديولار - أكثر الأجزاء حساسية في المادة الحية ، والتي تخلق هياكل عظمية من الجمال غير مسبوقة مصنوعة من السيليكا. يعتبر السيليكون أيضًا جزءًا من الكائنات الحية الدنيا - الدياتومات والأشعاعية - أكثر الأجزاء حساسية في المادة الحية ، والتي تخلق جمالها غير المسبوق لهياكل عظمية من السيليكا. الدياتومات Radiolaria ضبط النفس 1. ما هو مكان السيليكون في النظام الدوري: أ) 2 الفترة ، 4 و. ب) 3 الفترة ، 3 غرام. الفصل. ج) 3 فترة ، 4 غرام. الفصل) 2 الفترة ، 4 غرام. ب) 3 الفترة ، 3 غرام. الفصل. ج) 3 فترة ، 4 غرام. الفصل. 2. شعرية السيليكون: أ) الأيونية. ب) الذري ؛ ج) الجزيئية ؛ أ) الأيونية ؛ ب) الذري ؛ ج) الجزيئية ؛ 3. وفقا لانتشار في طبيعة السيليكون ... العنصر: أ) أولاً ؛ ب) الثاني ؛ ج) الثالث ؛ الأول ؛ ب) الثاني ؛ ج) الثالث ؛ 4. يتفاعل السيليكون مع: أ) المعادن ، الهيدروجين ، الهالوجينات ؛ أ) المعادن ، الهيدروجين ، الهالوجينات ؛ ب) المعادن ، الهالوجينات ، قابلة للذوبان بسهولة في القلويات ؛ ب) المعادن ، الهالوجينات ، قابلة للذوبان بسهولة في القلويات ؛ ج) الأكاسيد والأحماض غير المعدنية. ج) الأكاسيد والأحماض غير المعدنية. 5. أملاح حمض السيليك: أ) المبيدات الحشرية ؛ ب) hydrosilicates ؛ ج) السيليكات ؛ أ) المبيدات الحشرية ؛ ب) hydrosilicates ؛ ج) السيليكات ؛

السيليكون.
السيليكون - عنصر من عناصر المجموعة الفرعية الرابعة الرئيسية لمجموعة الفترة الثالثة للنظام الدوري للعناصر الكيميائية DI Mendeleev ، بالرقم الذري 14 ، الكتلة الذرية: 28.0855. في المركبات ، عادة ما تظهر درجة من أكسدة +4 (التكافؤ الرابع) ونادراً جداً +3 ، +2 ، و +1 (التكافؤ ، على التوالي ، III ، II ، I). في الجدول الدوري ، يقع منديليف السيليكون في المجموعة IVA (تشير A إلى أن هذه هي المجموعة الفرعية الرئيسية) (في مجموعة الكربون) ، في الفترة الثالثة. غير المعدنية . رمزا بالرمز سي(اللات. السليكون). في شكل حر - مسحوق بني أو مادة مدمجة بلون رمادي فاتح مع لمعان معدني. هيكل شعرية: مكعب ، الماس.
الحالة الرئيسية: + 14 سي 14 هـ 1s 2 2s 2 2p 6 3s 2 3p 2، p-element.
2. الخصائص الفيزيائية.
السيليكون البلوري هو مادة رمادية داكنة مع بريق من الصلب. هيكل السيليكون يشبه هيكل الماس. في كلٍّ منها ، يحيط بكل ذرة رباعي السطوح أربعة أخرى ويرتبط بها برابطة تساهمية ، أضعف بكثير من ذرات الكربون في الماس. في بلورة السيليكون ، حتى في ظل الظروف العادية ، يتم تدمير بعض الروابط التساهمية. لذلك ، لديها إلكترونات حرة ، والتي تسبب الموصلية الكهربائية الصغيرة. عندما تزيد الإضاءة والتدفئة من عدد الروابط المكسورة ، فهذا يعني أن عدد الإلكترونات الحرة يزداد ويزيد التوصيل الكهربائي. لذلك يجب شرح خصائص أشباه الموصلات من السيليكون.
السيليكون هش للغاية ، وكثافته 2.33 جم / سم 3. مثل الفحم ، يشير إلى المواد المقاومة للحرارة.
يتكون السيليكون من ثلاثة نظائر مستقرة: 2814Si (92.27٪) و 2914Si (4.68٪) و 3014Si (3.05٪).
3. يجري في الطبيعة.
في أغلب الأحيان في الطبيعة ، يوجد السيليكون في الشكل السيليكا - المركبات القائمة على ثاني أكسيد السيليكون (IV) SiO2 (حوالي 12 ٪ من كتلة قشرة الأرض). المعادن الرئيسية والصخور التي تشكلها ثاني أكسيد السيليكون هي الرمال (النهر والكوارتز) والكوارتز والكوارتزيت والفلينت والفلسبار. السيليكات الطبيعية لها تركيبة وبنية معقدة. هنا هو تكوين بعض السيليكات الطبيعية:
ü الفلسبار K 2 O × Al 2 O 3 × 6SiO 2 ،
ü الأسبستوس 3MgO × 2SiO 2 × 2H 2 O ،
ü ميكا K 2 O × 3Al 2 O 3 × 6SiO 2 × 2H 2 O ،
ü kaolinite 3Al 2 O 3 × 2SiO 2 × 2H 2 O.
ثاني أكثر المجموعات شيوعًا في طبيعة مركبات السيليكون هي السيليكات و alumino-السيليكات.
ويلاحظ الحقائق الفردية لإيجاد السيليكون النقي في الشكل الأصلي.
4. الخواص الكيميائية للسيليكون ومركباته.
في الخواص الكيميائية السيليكون ، مثل الكربون ، هو مادة غير معدنية ، لكن غيره أقل وضوحًا ، لأنه يحتوي على دائرة نصف قطرها الذري أكبر. نظرًا لأن ذرات السيليكون بها 4 إلكترونات على مستوى الطاقة الخارجية ، فإن حالة الأكسدة لكل من -4 و +4 هي سمة من سمات السيليكون (يُعرف مركب السيليكون ، حيث تكون درجة أكسده +2).
يعتبر السيليكون في الظروف العادية خاملًا إلى حد ما ، وهو ما يجب تفسيره بقوة شبكة شعرها البلورية. يتفاعل مباشرة فقط مع الفلور:
الأحماض (باستثناء خليط الهيدروفلوريك HF والنتريك HNO 3)السيليكون لا يعمل. ومع ذلك ، يذوب في هيدروكسيدات الفلزات القلوية ، مكونًا سيليكات وهيدروجين:
من بين التعديلين الخاملين للسيليكون ، المتبلور وغير المتبلور ، يكون السيليكون غير المتبلور أكثر نشاطًا كيميائيًا. انه يتفاعل مع أكسجين عند تسخينها ، تشكل SiO 2:
وكذلك مع الجميع الهالوجيناتعلى سبيل المثال:
![]()
في درجة حرارة عالية يربط السيليكون مع الكربونتشكيل carborundum كربيد:
يحتوي Carborundum على شعرية بلورية تشبه الماس ، حيث يحيط بكل ذرة من السيليكون أربع ذرات كربون والعكس صحيح ، والروابط التساهمية قوية جدًا ، كما في الماس. لذلك ، في صلابة أنها قريبة من الماس. مصنوعة طحن الحجارة وعجلات طحن من كربيد السيليكون.
سيليسيد المغنيسيوم. في التفاعلات مع المعادن النشطة ، التي تحدث مع تشكيل السيليسيد، يعمل السيليكون كعامل مؤكسد:
في درجات الحرارة العالية ، يستعيد السيليكون العديد من المعادن من أكاسيده. (!!!)
سيلاني. تحت تأثير حمض الهيدروكلوريك على المبيدات الحشرية ، فإن أبسط مركب هيدروجين من السيليكون هو silane SiH 4:
Silane هو غاز سام ذو رائحة كريهة ، ويشعل نفسه في الهواء (!!!):
أكسيد السيليكون (الرابع).يسمى أكسيد السيليكون (IV) أيضًا السيليكا. إنها مادة حرارية صلبة. (نقطة الانصهار 1700 درجة مئوية) على نطاق واسع في الطبيعة في شكلين:
1) السيليكا البلورية - في شكل معدن من الكوارتز وأصنافه (الكريستال الصخري ، العقيق الأبيض ، العقيق ، اليشب ، الصوان) ؛ الكوارتز يشكل أساس رمال الكوارتز المستخدمة على نطاق واسع في البناء و صناعة السيليكات;
2) غير متبلور السيليكا - في شكل تكوين أوبال المعدني SiO 2 × ن H 2 O ؛ الأشكال الترابية للسيليكا غير المتبلورة هي دياتوميت ، ترايبولي (تربة infusorial) ؛ من أمثلة السيليكا اللامائية غير المتبلرة الاصطناعية هلام السيليكا ، والذي يتم الحصول عليه من ميتاسيليكات الصوديوم:
يحتوي هلام السيليكا على سطح متطور ويمتص الرطوبة جيدًا. .
في 1710 درجة يذوب الكوارتز. مع التبريد السريع للكتلة المنصهرة زجاج الكوارتز . إنه ذو معامل تمدد منخفض للغاية ، بحيث لا يتصدع زجاج الكوارتز الساخن عندما يتم تبريد الماء بسرعة. مصنوعة من الأواني الزجاجية وأدوات مختبر للبحث العلمي من زجاج الكوارتز.
إن أبسط صيغة لأكسيد السيليكون (IV) SO 2 مشابه لصيغة أول أكسيد الكربون (IV) CO 2. وفي الوقت نفسه ، تختلف خواصها الفيزيائية اختلافًا كبيرًا (SiO 2 - صلب ، ثاني أكسيد الكربون - غاز). يرجع هذا الاختلاف إلى هيكل المشابك البلورية. تبلور C0 2 في الشبكة الجزيئية ، SiO 2 - في الذرة. يمكن تمثيل هيكل SiO 2 في صورة مستوية على النحو التالي:
رقم التنسيق لذرة الكربون في ثاني أكسيد الكربون الصلب هو 2 ، والسيليكون في SiO 2 هو 4. يتم وضع كل ذرة من السيليكون في رباعي السطوح يتكون من 4 ذرات أكسجين. في نفس الوقت ، توجد ذرة السيليكون في الوسط ، وتقع ذرات الأكسجين في رؤوس رباعي الأسطح . يمكن اعتبار قطعة السيليكا بأكملها بلورة لها الصيغة (SiO 2) n. يحدد هيكل أكسيد السيليكون (IV) صلابته العالية وانكساره .
تشير الخواص الكيميائية لأكسيد السيليكون (IV) SiO 2 إلى أكاسيد الحمض. عند دمجها مع القلويات الصلبة والأكسيدات والكربونات الأساسية ، تتشكل أملاح حمض السيليك:
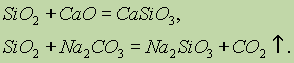
يتفاعل حمض الهيدروفلوريك فقط مع أكسيد السيليكون (IV):
يستخدم هذا التفاعل لحفر الزجاج. .
السيليكون (IV) لا يذوب في الماء ولا يتفاعل معها كيميائيا. (!!!) لذلك ، يتم الحصول على حمض السيليك بشكل غير مباشر عن طريق العمل مع حمض على محلول من البوتاسيوم أو سيليكات الصوديوم:
في هذه الحالة ، يمكن الحصول على حمض السليكيك (اعتمادًا على تركيز المحاليل الأولية من الملح والحمض) في شكل كتلة هلامية تحتوي على الماء ، وفي شكل محلول غرواني (sol).
حمض السيليك. SiO 2 هو أنهيدريد عدد من الأحماض السيليكية ، والتي يمكن التعبير عن تركيبها بالصيغة العامة: xSiO 2 × yH 2 O ، حيث x و y - الأعداد الصحيحة:
1) x = 1 ، y = 1: SiO 2 × H 2 O ، أي H 2 SiO 3 - حمض ميتاسيليك.
2) x = 1 ، y = 2: SiO 2 × 2H 2 O ، أي H 4 SiO 4 - حمض أورثوسيليك
3) س = 2 ، y = 1: 2SiO 2 × H 2 O ، أي H 2 Si 2 O 5 - حامض الثعلب.
يتكون حمض السليكيك من الوحدات الهيكلية رباعية السطوح (في كل وحدة من هذه الوحدات ، توجد ذرة السيليكون في وسط رباعي السطوح ، وتوجد ذرات أكسجين في القمم). الروابط الهيكلية ، متحدة في سلاسل ، تشكل أحماض سيليكون أكثر استقرارًا:
يمكن التعبير عن تركيبة هذه المركبات بالصيغة (H 2 SiO 3) n. ومع ذلك ، عادة ما يمثل حمض السيليك بواسطة الصيغة H 2 SiO 3. H 2 SiO 3 - الحمض ضعيف جدًا ، قليل الذوبان في الماء. عند تسخينها ، تتحلل بسهولة مثل حمض الكربونيك:
جميع الأحماض السيليكية ضعيفة للغاية (أضعف من الفحم).
السيليكات. تسمى أملاح جميع الأحماض السيليكيةالسيليكات، على الرغم من ذلك ، وكقاعدة عامة ، في الأدبيات التعليمية ، يعني السيليكات أملاح حمض الميثاسيليك. وعادة ما يتم تمثيلها من خلال الصيغة في شكل مركبات أكاسيد العناصر. على سبيل المثال ، يمكن التعبير عن سيليكات الكالسيوم CaSiO 3 على النحو التالي: CaO × SiO 2.
السيليكات المكونة R 2 O × nSiO 2 ، حيث R 2 O - أكاسيد الصوديوم أو البوتاسيوم , وتسمى زجاج قابل للذوبان , و محاليلها المائية المركزة - زجاج سائل . زجاج الصودا الصودا هو الأكثر أهمية..
عند الوقوف في الهواء ، تزداد محاليل السيليكات تعكرًا ، حيث إن ثاني أكسيد الكربون (IV) في الهواء يحل محل حمض السيليك من أملاحه:
حمض السليكيك غير قابل للذوبان عملياً في الماء - تُستخدم هذه الخاصية كرد فعل نوعي على أيون SiO 3 2-.
يتم الحصول على السيليكات عن طريق دمج السيليكا مع القلويات أو الكربونات:
5. اكتشاف أيون سيو 3 2. (لا أستطيع أن أجد أي شيء ...)
6. دور مركبات السيليكون في تكوين التربة والحراجة.
الصخور البركانية مستقرة إلى حد ما في تكوينها وتحتوي أساسا على مركبات السيليكون والألومنيوم والحديد والقلويات والمغنيسيوم والكالسيوم. وفقًا لمحتوى Si02 ، تنقسم الصخور البركانية إلى أربع مجموعات: الحمضية (\u003e 65٪) والمتوسطة (52-65٪) والأساسية (40-52٪) والموجات فوق الصوتية (<40 %). Наиболее представительны две большие группы: кислые и основные породы. Как будет видно в дальнейшем, при характеристике многих типов почв именно этот фактор приуроченности почв к кислым или основным магматическим почвообразующим породам является решающим в отношении генезиса, эволюции и свойств почв.
حمض الصخور النارية- الجرانيت ، البغماتيت ، الريوليت ، الداسيت وغيرها - عادة ما يكون لونها فاتح وبني مع بلورات واضحة من الكوارتز ، الفلسبار ، الميكا. محتوى SiO 2 فيها مرتفع (أكثر من 65 ٪) مع كمية كبيرة من البوتاسيوم والصوديوم. في الوقت نفسه ، قليل من الحديد والكالسيوم والمغنيسيوم لا يكاد يذكر. التربة على الصخور النارية الحمضية ، على سبيل المثال ، على الجرانيت ، تختلف في المراحل الأولى من التجوية عن طريق القابلية للتفتيت ، طابع الحصى للمادة المصدر. عندما تجتاز في ظروف رطبة ، فإنها تفقد بسهولة عناصر قلوية الأرض ، ونتيجة لذلك فإن التربة الموجودة على هذه الركائز الممزوجة (صخور الصخور) تكون رديئة للغاية وذات خصوبة سيئة.
الصخور النارية الرئيسية -البازلت ، والجابرو ، وما إلى ذلك ، كقاعدة عامة ، لها لون داكن (إلى الأسود). إنها تتميز بمحتوى أقل من SiO 2 مقارنة بالصخور الحمضية. الصخور النارية الرئيسية غنية نسبيًا بمركبات الحديد والمنغنيز والكروم والكوبالت والزنك والتيتانيوم والنيكل والنحاس. تكتسب منتجات التجوية الخاصة بهم بسرعة كبيرة طينًا ، وتحتفظ بفاعلية قلوية ومحايدة لفترة طويلة ، وتتميز بزيادة محتوى الدبال والمعادن الطينية. التربة على هذه الصخور هي أكثر خصوبة.
بالإضافة إلى الأنواع الحمضية والأساسية في كثير من الأحيان صخور نارية من النوع الانتقالي(متوسطة) - صخور تدخلية من مجموعة ديوريت ونظرائهم المنبثقة - أنديسايت. وفقا لذلك ، تكتسب التربة الموجودة على هذه الصخور ميزات مشابهة لتلك المحصورة في الصخور الحمضية أو الأساسية. أقل شيوعا بكثير السلالات ultrabasic:البيروتيت والبيكريت ، والتي تحتوي على أقل محتوى SiO 2.
الصخور المتحولة -الانتقال بين الصخور البلورية الضخمة والرواسب. الصخور الرسوبية القديمة تحت الغوص والضغط العالي ودرجات الحرارة يتم تحويلها ، مكونة النيسين والسربنتينيت والرخام والكوارتزيت والصخر الزيتي. Gneisses متشابهة بشكل خاص في تكوين الغرانيت. التربة التي تتشكل على هذه الصخور لها ميزات مشابهة للتربة على الصخور النارية الحمضية نفسها.
الكلور.
1. موقف الألومنيوم في الجدول DI Mendeleev. بنية الذرة ، تتجلى درجة الأكسدة.
الكلور - عنصر من عناصر المجموعة الفرعية الرئيسية للمجموعة VII ، الفترة الثالثة ، برقم ذري 17. يرمز إليه بالرمز Cl (lat. Chlorum). نشط كيميائيا غير المعدنية . المدرجة في مجموعة الهالوجين .
مادة الكلور بسيطة في ظل الظروف العادية - الغاز السام اللون الأصفر والأخضر أثقل من الهواء ، مع رائحة قوية . جزيء الكلور ثنائي الذرة (الصيغة Cl 2).
الحالة الرئيسية: +17 Cl 17e1s 2 2s 2 2p 6 3s 2 3p 5، p-element. الفن: -1 +1 +3 +5 +7.
هيكل قذيفة الإلكترون.
على مستوى التكافؤ من ذرة الكلور يحتوي على 1 إلكترون غير زوجي : 1s 2 2s 2 2p 6 3s 2 3p 5 ، وبالتالي فإن التكافؤ 1 لذرة الكلور مستقر للغاية. بسبب وجود ذرة الكلور في مدارات d-suvelvel غير المشغولة في الذرة ، يمكن لذرة الكلور أن تظهر درجات أخرى من الأكسدة. مخطط لتشكيل الدول متحمس للذرة:
تُعرف مركبات الكلور أيضًا بأن ذرة الكلور تُظهر رسميًا التكافؤ 4 و 6 ، على سبيل المثال ClO 2 و Cl 2 O 6. ومع ذلك ، فإن هذه المركبات عبارة عن جذور ، أي أنها تحتوي على إلكترون واحد غير متزاوج.
2. الخصائص الفيزيائية.
في الظروف العادية ، الكلور عبارة عن غاز أصفر-أخضر ذو رائحة خانقة. بعض خصائصه الفيزيائية معروضة أدناه.
الكثافة: 3.214 جم / لتر ، liq - عند -35 درجة مئوية - 1.557 ، تلفزيون. في -105 0 С- 1.9 جم / سم 3.
نقطة الانصهار: 172.2 ك
نقطة الغليان: 238.6 ك
حرارة الانصهار: 6.41 كيلو جول / مول
حرارة التبخر: 20.41 كيلو جول / مول.
غاز الكلور سهل التسييل نسبياً. بدءًا من ضغط يبلغ 0.8 ميجا باسكال (8 أجواء) ، سيكون الكلور سائلًا بالفعل في درجة حرارة الغرفة. عند تبريده إلى درجة حرارة 34 درجة مئوية ، يصبح الكلور سائلاً أيضًا عند الضغط الجوي العادي. الكلور السائل هو سائل أصفر - أخضر له تأثير تآكل عالٍ للغاية (بسبب تركيز عالٍ من الجزيئات). زيادة الضغط ، يمكنك تحقيق وجود الكلور السائل حتى درجة حرارة +144 درجة مئوية (درجة حرارة حرجة) عند ضغط حرج قدره 7.6 ميجا باسكال. فيما يتعلق بالتوصيل الكهربائي ، فإن الكلور السائل يحدث بين أقوى العوازل: فهو ينتج تيارًا يزيد بمقدار مليار مرة عن الماء المقطر ، و 10 22 مرة أسوأ من الفضة. إن سرعة الصوت في الكلور تقل بمقدار واحد ونصف عن سرعة الهواء.
3. يجري في الطبيعة.
في الطبيعة ، هناك نظيران من الكلور 35 Cl و 37 Cl. الكلور هو الهالوجين الأكثر شيوعًا في قشرة الأرض. . الكلور نشط للغاية - يتصل مباشرة مع جميع عناصر النظام الدوري تقريبا. لذلك ، في الطبيعة ، وجدت فقط في شكل مركبات في تكوين المعادن:
ü هاليت كلوريد الصوديوم ،
ü sylvina KCl ،
ü sylvinite KCl · كلوريد الصوديوم ،
ü bischofite MgCl 2 · 6H 2 O ،
ü carnallite KCl · MgCl 2 · 6H 2 O ،
ü Cainite KCl · MgSO 4 · 3H 2 O.
توجد أكبر احتياطيات من الكلور في الأملاح والمياه والبحار والمحيطات (المحتوى في ماء البحر هو 19 جم / لتر). يمثل الكلور 0.024 ٪ من إجمالي عدد الذرات في قشرة الأرض ؛ رقم كلارك (الأرقام التي تعبر عن متوسط محتوى العناصر الكيميائية في قشرة الأرض أو الغلاف المائي أو الأرض أو الأجسام الفضائية أو النظم الجيوكيميائية أو الكيموكيميائية وما إلى ذلك ، بالنسبة إلى إجمالي الكتلة لهذا النظام. يتم التعبير عنها بنسبة٪ أو جم / كجم). الكلور - 0.017 ٪. يحتوي جسم الإنسان على 0.25٪ أيونات الكلور بالوزن. في البشر والحيوانات ، يوجد الكلور بشكل أساسي في السوائل بين الخلايا (بما في ذلك الدم) ويلعب دورًا مهمًا في تنظيم العمليات التناضحية ، وكذلك في العمليات المرتبطة بعمل الخلايا العصبية.
4. الخواص الكيميائية للكلور ومركباته. الحصول على الكلور.
هيكل ذرة السيليكون. سي. 14. الدولة متحمس. E. 3D. 3P. 3S. E. 3D. 3P. 3S. 1s 2s 2p 3s 3p. 2e 8e 4e. 2. 2. 6. 2. 2.
صورة 3 من العرض التقديمي "السيليكون" لدروس الكيمياء حول موضوع "السيليكون"الأبعاد: 960 × 720 بكسل ، التنسيق: jpg. لتنزيل صورة مجانية لدرس الكيمياء ، انقر بزر الماوس الأيمن فوق الصورة وانقر فوق "حفظ الصورة باسم ...". لإظهار الصور في الدرس ، يمكنك أيضًا تنزيل العرض التقديمي لـ "Silicon.ppt" مجانًا مع جميع الصور الموجودة في أرشيف مضغوط. حجم الأرشيف - 562 كيلو بايت.
تحميل العرض التقديميالسيليكون
"السيليكون ومركباته" - تركيب وخصائص الذرات. أشباه الموصلات. t melt (Si) = 1415؟ C، t melt (diamond) = 3730؟ C. الحصول على السيليكون. اكتشاف السيليكون. شملت أيضا في تكوين النباتات والحيوانات. الخواص الفيزيائية للسيليكون. ومن هنا ، فإن الطوب من السيراميك ، كما أن بلاط وشظايا الأمفورا اليونانية القديمة من السيراميك. الأهداف: الخصائص الكيميائية للسيليكون.
"مركبات السيليكون" - السيليكون ومركباته. الخواص الكيميائية ل SiO2. سيلاني. الحصول على حمض السيليك. خصائص السيليكون. أكسيد السيليكون. السيليكات الطبيعية. حالة الأكسدة حجر الراين. توباز. الحصول على السيليكون في المختبر. يجري في الطبيعة. المشابك الكريستال. اكتشاف السيليكون. الجمشت. الحصول على السيليكون.
"نظائر السيليكون" - فصل نظائر السيليكون. إنتاج السيليكون متعدد الكريستالات. آفاق استخدام السيليكون أحادي النظر. تخفيف النظائر عند زراعة بلورة واحدة من بوتقة الكوارتز. إنتاج بذور الكريستال واحدة. اعتماد موقف الحد الأقصى لفرقة رامان على الكتلة الذرية.
"درس السيليكون" - أي من العناصر الكيميائية الأكثر أهمية في الطبيعة الحية وغير الحية؟ أكاسيد الكربون والسيليكون. المادة شفافة. على مظهر من مظاهر الخصائص غير المعدنية والمعدنية. تلخيص انعكاس. الاختبار النهائي. أكاسيد الكربون وهيدروكسيدات السيليكون؟ حالة التجميع: أ) السائل ، ب) الغاز ، ج) الصلبة.
"السيليكون" - السيليكون مادة بسيطة. الخصائص الفيزيائية. أكسيد السيليكون (الرابع). Silicides. معنى للكائنات الحية. التفاعل مع المعادن. التفاعل مع غير المعادن. كربيد السيليكون. السيليكون في الطبيعة. السيليكون. منتجات صناعة السيليكات. أحد أنواع مركبات السيليكون الطبيعية هو السيليكات.
"الكربون والسيليكون" - أكسيد السيليكون (IV). عناصر المجموعة الرابعة من المجموعة الفرعية الرئيسية. سمية. 7. للاهتمام حول الكربون. السيليكات. الانزلاق إلى اللمس. الماس هو أصعب مادة طبيعية. الخواص الكيميائية أكثر من 99 ٪ من الكربون في الغلاف الجوي في شكل ثاني أكسيد الكربون. كربيد. 6. التطبيق. واحدة من أنعم بين المواد الصلبة.
هناك 6 عروض في المجموع.
