الخصائص الفيزيائية لل sio2. مركبات الأكسجين. أكسيد السيليكون (II) SiO
أكسيد السيليكون (II) SiO. في الطبيعة ، لا يحدث ، ولكن يمكن الحصول عليها عن طريق التفاعل:
سيو 2 + سي → 2 سيو.
تحت الضغط العادي ، يبدأ تسام أول أكسيد السيليكون عند حوالي 1200 درجة مئوية (عندما لا تتبخر مواد البدء نفسها عمليًا بعد). في أزواج ، سيو هو مركب فردي. طاقة تفكك العناصر هي 789 كيلو جول / مول. لا يمكن تحقيق التحويل إلى الحالة الصلبة إلا عن طريق التبريد السريع ("التبريد") لمرحلة الغاز. خلاف ذلك ، فإن فك المعادلة لديه الوقت لتمرير:
2 SiO = SiO 2 + Si.
يتأكسد ببطء أول أكسيد السيليكون بواسطة الأكسجين الجوي ويذوب بسهولة في القلويات لتشكيل أملاح حمض السيليك وإطلاق الهيدروجين. مكهرب بسهولة عن طريق الاحتكاك ، والحصول على شحنة سالبة قوية.
أكسيد السيليكون (IV) SiO 2.كما يسمى أكسيد السيليكون (IV) السيليكا. إنها مادة حرارية صلبة. (نقطة انصهار 1700 درجة مئوية)على نطاق واسع في الطبيعة في شكلين: 1) السيليكا البلورية - في شكل معدن من الكوارتز وأصنافه (الكريستال الصخري ، العقيق الأبيض ، العقيق ، اليشب ، الصوان) ؛ يشكل الكوارتز أساس رمال الكوارتز المستخدمة على نطاق واسع في البناء وفي صناعة السيليكات ؛ 2) غير متبلور السيليكا - في شكل تكوين أوبال معدني SiO 2 نH 2 O ؛ الأشكال الترابية للسيليكا غير المتبلورة هي دياتوميت ، ترايبولي (تربة infusorial) ؛ من أمثلة السيليكا اللامائية غير المتبلرة الاصطناعية هلام السيليكا ، والذي يتم الحصول عليه من ميتاسيليكات الصوديوم:
يحتوي هلام السيليكا على سطح متطور ، وبالتالي يمتص الرطوبة جيدًا.
في 1710 درجة يذوب الكوارتز. مع التبريد السريع للكتلة المنصهرة ، يتم تشكيل زجاج الكوارتز. إنه ذو معامل تمدد منخفض للغاية ، بحيث لا يتصدع زجاج الكوارتز الساخن عندما يتم تبريد الماء بسرعة. مصنوعة من الأواني الزجاجية وأدوات مختبر للبحث العلمي من زجاج الكوارتز.
يمكن تمثيل هيكل SiO 2 في صورة مستوية على النحو التالي:
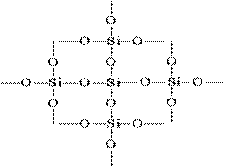
يتم وضع كل ذرة من السيليكون في رباعي السطوح يتكون من 4 ذرات أكسجين. في هذه الحالة ، توجد ذرة السيليكون في الوسط ، وتقع ذرات الأكسجين على قمم رباعي السطوح. يمكن اعتبار قطعة السيليكا بأكملها بلورة لها الصيغة (SiO 2) n. يحدد هذا التركيب لأكسيد السيليكون (IV) صلابته العالية وانكساره.
تشير الخواص الكيميائية لأكسيد السيليكون (IV) SiO 2 إلى أكاسيد الحمض. عند دمجها مع القلويات الصلبة والأكسيدات والكربونات الأساسية ، تتشكل أملاح حمض السيليك:
يتفاعل حمض الهيدروفلوريك فقط مع أكسيد السيليكون (IV) (النقش الزجاجي):
SiO 2 + HF → SiF 4 + H 2 O
لا يذوب أكسيد السيليكون (IV) في الماء ولا يتفاعل كيميائياً معه. لذلك ، يتم الحصول على حمض السيليك بشكل غير مباشر ، على سبيل المثال ، عن طريق التحلل المائي:
SiS 2 + H 2 O ↔ H 2 S + H 4 SiO 4 حامض أورثو سيليكون.
H 4 SiO 4 قابل للذوبان ، عند التسخين أو الوقوف ، تجري عملية بلمرة:
2 H 4 SiO 4 → H 2 O + H 6 Si 2 O 7 acid diorthokremnievy.
2 H 6 Si 2 O 7 → H 2 O + H 10 Si 4 O 13 tetraorotremilicic acid.
إنها تغلق الحلبة:
H 10 Si 4 O 13 → H 2 O + (H 2 SiO 3) 4 tetramethacilic acid.
في هذه الحالة ، يمكن الحصول على حمض السليكيك (اعتمادًا على تركيز المحاليل الأولية من الملح والحمض) في شكل كتلة هلامية تحتوي على الماء ، وفي شكل محلول غرواني (sol). يعتمد تكوين حمض السيليك الذي تم الحصول عليه على المواد الأولية وشروط التحضير. جميع الأحماض السيليكية ضعيفة للغاية (أضعف من الفحم).
إذا أطلق حمض الكربونيك في محلول حمض السيليك من أملاحه ، فإن رد الفعل العكسي يحدث أثناء التكليس. الأول يرجع إلى انخفاض قوة (درجة تفكك) حمض السيليك ، والثاني - تقلبه المنخفض عند تسخينه.
عندما يمكن الحصول على أحماض polysilicic ساخنة وجفافها التدريجي غرامة SiO 2 ، وهو ما يسمى هلام السيليكا . يمتص الماء جيدا ، أضعه في أجهزة لمنع أكسدة العناصر باهظة الثمن.
مجموعة فرعية ألمانيا
شركة جنرال الكتريك (+4) القصدير (+2, +4) برميل(+2) - حالات الأكسدة المقاومة
تنبأ DI Mendeleev بالجرمانيوم في عام 1871 ، واكتشف في عام 1886. ينتمي القصدير والرصاص إلى العناصر التي كانت معروفة للبشرية لفترة طويلة: كان المصريون قادرين على صهرها من الخامات لأكثر من 3000 عام قبل الميلاد. ه. في الهند ، أصبح الرصاص معروفًا بحوالي 2500 عام ، والقصدير 1500 عام قبل الميلاد. ه. صهر القصدير المنتج في الصين القديمة.
تحصل.يتم تحويل المركبات الطبيعية للجرمانيوم إلى جيو 2 وتخفيضها بالهيدروجين:
GeO 2 + H 2 t → Ge + H 2 O في درجات حرارة حوالي 1000 درجة مئوية
يتم الحصول على القصدير من المعادن الطبيعية حجر القصدير(SnO 2):
SnO 2 + C → Sn + CO.
يعتمد أبسط مخطط لتخفيض الرصاص الصناعي على تفاعلين متتاليين:
PbS + O 2 → SO 2 + PbO الغالينة كبرتيد الرصاصيتم حرق (PbS) ثم يتم تقليله باستخدام الفحم:
PbO + С → СO + Pb.
التطبيق.جميع العناصر الثلاثة مهمة جدا للتكنولوجيا الحديثة. بعض مركبات القصدير والرصاص هي أيضا ذات فائدة كبيرة. مشتقات الرصاص شديدة السمية.
الجرمانيوم هو أشباه الموصلات نموذجي (n- نوع بعرض النطاق الترددي 0.75 فولت) ويجد الاستخدامات المختلفة في الهندسة الكهربائية. يستخدم على نطاق واسع لصناعة مقومات التيار المتردد.. ويستند هذا التطبيق على الموصلية أحادية القطب الناشئة عن الاتصال بين الجرمانيوم النقي وسبائك الجرمانيوم مع الإنديوم. يمر التيار (تدفق الإلكترون) في مثل هذا التثبيت عملياً فقط من الجرمانيوم إلى السبائك ، ولكن ليس العكس. تتميز مقومات الجرمانيوم بالكفاءة العالية (حوالي 98٪) وعمر خدمة كبير جدًا (مع التشغيل السليم). العيب الرئيسي لهذه المقومات هو حساسيتها للتدفئة - فوق 70 درجة مئوية ، وسرعان ما تنخفض كفاءتها.
منطقة الاستخدام الهامة ألمانيا هي بصريات الأشعة تحت الحمراء ، نظرًا لأن الأشعة التي يبلغ طولها الموجي أكثر من 2 ميكرون ، فإنه لا يتأخر عملياً. على العكس ، في ضوء وقربه يتراوح (0.2؟ 2 ميكرون) ، الجرمانيوم يمتص الطاقة بشكل مكثف. إذا كان السطح المعدني اللامع (الذي يخزن الحرارة جيدًا ولكن لا يسخن جيدًا) مغطى بغشاء الجرمانيوم ، فإن السطح يسخن أكثر بكثير من دون فيلم. أفيد أنه في برميل تم إعداده بهذه الطريقة تحت تأثير أشعة الشمس ، يمكن الحصول على الماء المغلي.
يستخدم القصدير أساسًا في صناعة الحديد من أجل حمايته من الصدأ. (صفيح لصناعة التعليب). سمك طبقات القصدير هذه صغيرة جدًا - حسب ترتيب الميكرونات. في شكل صفائح رقيقة (ما يسمى. Stannioles) القصدير تستهلك لتصنيع المكثفات في الصناعة الكهربائية . يستخدم الرصاص لتصنيع ألواح البطاريات وألواح الكابلات الكهربائية والرصاص واللقطات ، للحماية من الأشعة السينية والأشعة السينية ، وكذلك في الصناعة الكيميائية (خطوط الأنابيب ، إلخ). يتم إنفاق كميات كبيرة جدًا من القصدير والرصاص على تصنيع عدد من السبائك المهمة تقنيًا.
وأهمها مختلف البرونز (سبائك Cu و Sn) ، سبائك للمحامل (babbits ، عادة ما تكون مصنوعة على أساس Pb أو Sn وتحتوي أيضًا على Sb و Cu) ، سبائك مطبعية (5-30٪ Sn ، 10-20٪ Sb ، الباقي هو Pb) واللحام "اللين" المعتاد (30-70٪ Sn ، 70-30٪ Pb). غالبًا ما يمكن استبداله بسبائك أرخص من 90٪ Pb و 6٪ Sn و 4٪ Sb. من الأهمية بمكان السبائك الخاصة بالمحامل بتركيب تقريبي 98٪ Pb ، 1٪ Ca ، 1٪ Na.
السيليكا (السيليكا ، السيليكا) عبارة عن مادة تتكون من بلورات عديمة اللون مع قوة عالية ، وصلابة وانكسار. ثاني أكسيد السيليكون مقاوم للأحماض ولا يتفاعل مع الماء. مع زيادة في درجة حرارة التفاعل ، تتفاعل المادة مع القلويات ، يذوب في حمض الهيدروفلوريك ، وهو عازل ممتاز.
في الطبيعة ، يتم توزيع ثاني أكسيد السيليكون على نطاق واسع: يتم تمثيل أكسيد السيليكون البلوري بمعادن مثل الجاسبر ، العقيق (مركبات ثاني أكسيد السيليكون البلورية) ، البلور الصخري (بلورات كبيرة من المادة) ، الكوارتز (ثاني أكسيد السيليكون الحر) ، العقيق الأبيض ، الجمشت ، المورون ، التوباز (البلورات الملونة) السيليكا).
في ظل الظروف العادية (عند درجة الحرارة والضغط المحيطين الطبيعيين) ، هناك ثلاثة تعديلات بلورية لثاني أكسيد السيليكون - ترايدميت وكوارتز وكريستوباليت. عندما ترتفع درجة الحرارة ، يتحول ثاني أكسيد السيليكون أولاً إلى coesite ، ثم إلى stishovite (معدن موجود في 1962 في فوهة نيزك). وفقا للدراسات ، فمن stishovit ، وهو مشتق من ثاني أكسيد السيليكون ، الذي يصطف جزءا كبيرا من عباءة الأرض.
الصيغة الكيميائية للمادة - SiO 2
تحضير السيليكا
يتم إنتاج ثاني أكسيد السيليكون صناعيًا في مصانع الكوارتز التي تنتج تركيز الكوارتز النقي ، والذي يستخدم بعد ذلك في صناعة الكيماويات والإلكترونيات ، في صناعة البصريات والمطاط وحشو الطلاء والورنيش وصناعة المجوهرات ، إلخ. يستخدم ثاني أكسيد السيليكون الطبيعي ، الذي يُطلق عليه خلاف ذلك السيليكا ، على نطاق واسع في البناء (مواد الخرسانة والرمل والصوت والمواد العازلة للحرارة).
يتم إجراء تخليق ثاني أكسيد السيليكون بطريقة تركيبية بواسطة عمل الأحماض على سيليكات الصوديوم ، وفي بعض الحالات على السيليكات القابلة للذوبان الأخرى أو عن طريق تخثر السيليكا الغروية تحت تأثير أيونات. بالإضافة إلى ذلك ، يتم إنتاج ثاني أكسيد السيليكون عن طريق أكسدة السيليكون مع الأكسجين عند درجة حرارة حوالي 500 درجة مئوية.
تطبيق ثاني أكسيد السيليكون
تستخدم المواد المحتوية على السيليكون على نطاق واسع في مجال التقنيات المتقدمة وفي الحياة اليومية. يستخدم ثاني أكسيد السيليكون في صناعة الزجاج والسيراميك والمنتجات الخرسانية والمواد الكاشطة وكذلك في هندسة الراديو والتركيبات فوق الصوتية والولاعات وما إلى ذلك. بالاقتران مع عدد من المكونات ، يتم استخدام السيليكا في تصنيع كابلات الألياف البصرية.
يستخدم ثاني أكسيد السيليكون غير المتبلور أيضًا في صناعة المواد الغذائية كمادة مضافة مسجلة تحت الرقم E551 ، مما يمنع التكتل والتكتل من المنتج الرئيسي. ثاني أكسيد  يستخدم الغذاء السيليكون في صناعة المستحضرات الصيدلانية كما enterosorbent المخدرات ، في صناعة معاجين الأسنان. تم العثور على المادة في الرقائق ، المفرقعات ، عصي الذرة ، القهوة الفورية ، إلخ.
يستخدم الغذاء السيليكون في صناعة المستحضرات الصيدلانية كما enterosorbent المخدرات ، في صناعة معاجين الأسنان. تم العثور على المادة في الرقائق ، المفرقعات ، عصي الذرة ، القهوة الفورية ، إلخ.
السيليكا الضرر
أكدت رسميا أن مادة ثاني أكسيد السيليكون تمر عبر الجهاز الهضمي دون تغيير ، وبعد ذلك يتم إزالتها تماما من الجسم. وفقًا لدراسة استمرت 15 عامًا أجراها خبراء فرنسيون ، فإن شرب ماء الشرب عالي الألومينا يقلل من خطر الإصابة بمرض الزهايمر بنسبة 10٪.
وبالتالي ، فإن المعلومات حول مخاطر ثاني أكسيد السيليكون ، وهي مادة خاملة كيميائيًا ، غير صحيحة: المكملات الغذائية E551 ، التي يتم تناولها عن طريق الفم ، آمنة تمامًا للصحة.
أكسيد السيليكون SiO 2 مادة صلبة شديدة الانكسار (نقطة انصهار تزيد عن 1700 درجة مئوية) ، موزعة على نطاق واسع في الطبيعة ، حيث توجد أساسًا في شكل معدن الكوارتز ، وكذلك cristobalite و tridymite.
في درجات الحرارة المعتادة ، يعتبر الكوارتز تعديلاً مستقرًا ، مع زيادة التحولات متعددة الأشكال لدرجة الحرارة:
السيليكا من جميع التعديلات في شكل مونومر غير موجود ؛ هو دائما البوليمرية و "بنيت" من رباعي الاسطح تشكيل شعرية ذرية قوية جدا
كل ذرة من السيليكون في بلورات (SiO 2) n محاطة رباعي السطوح بأربع ذرات أكسجين ، يتم سد كل منها. من خلال ذرة الأكسجين الشائعة ، تترابط رباعي السطوح في زوايا مختلفة مع بعضها البعض ، وتشكل شبكة شعرية ثلاثية الأبعاد مستمرة ؛ يحدد الترتيب المتبادل للرباعي الوجوه في الفضاء تعديلًا واحدًا أو آخر من السيليكا.
في تعديلات مختلفة من قوة السندات السيليكا يختلف. يؤثر هذا على حجم زوايا Si-O-Si ومسافات Si-O ، على سبيل المثال ، تختلف زاوية رابطة Si-O-Si في التعديلات المختلفة للسيليكا من 120 إلى 180 درجة. يصاحب التحولات الكوارتز-تريديميت-كريستوباليتي كسر وتحويل الروابط ، والتي يمكن أن تحدث فقط في درجات حرارة عالية.
الكوارتز. غالبًا ما توجد في الطبيعة على شكل بلورات جيدة التكوين للغاية ، وأحيانًا تكون ذات حجم كبير. تتشكل البلورات من رباعي الاسطح مرتبة بشكل حلزوني حول المحور المركزي ، في شكل لولب. في نفس البلورة ، قد يكون اتجاه اللولب معاكسًا. هذه البلورات هي الايزومرات الضوئية. أنها تدور طائرة استقطاب الضوء ، ويمكن أن يكون كل من اليد اليمنى واليسرى. وتختلف هذه البلورات وغيرها كموضوع عن صورة المرآة الخاصة بها.
يستخدم الكوارتز في مختلف مجالات العلوم والتكنولوجيا ، وغالبا ما تزرع بلوراته بشكل مصطنع. بعض أنواع الكوارتز هي أسماء خاصة. وتسمى بلورات عديمة اللون شفافة الصخور الكريستال. هناك أيضًا أنواع مختلفة من الكوارتز: الكوارتز الوردي ، والبنفسجي (الجمشت) ، والبني الداكن (التوباز الدخاني) ، والأخضر (الكريسوبراسي) ، وما إلى ذلك. يسمى التعديل البلوري للكوارتز بمزيج من مواد أخرى باسم العقيق الأبيض. أصناف العقيق الأبيض هي العقيق ، اليشب ، وغيرها ، وتستخدم الصخور الكريستالية والأصناف الملونة من الكوارتز كأحجار كريمة وشبه كريمة.
يحدث تريديميت في الصخور البركانية ، ولكن بكميات صغيرة جدا. المعروف tridymite والأصل نيزك.
توجد في بعض الأحيان Cristobalite في الطبيعة في شكل بلورات صغيرة مضمنة في الحمم البركانية ، مثل tridimite. Tridimite و cristobalite لديها بنية "فضفاضة" أكثر من الكوارتز. وبالتالي ، فإن كثافة cristobalite ، tridymite ، والكوارتز هي 2.32 ؛ 2.26 و 2.65 جم / سم 3 ، على التوالي.
ذوبان السيليكا مع التبريد البطيء يشكل بسهولة زجاج الكوارتز غير المتبلور. تم العثور على السيليكا في شكل زجاج أيضا في الطبيعة. تبلغ كثافة الزجاج غير المتبلور 2.20 جم / سم 3 - أقل من كثافة كل التعديلات البلورية. يحتوي زجاج الكوارتز على معامل تمدد طفيف في درجة الحرارة ، وبالتالي ، فهو يستخدم لإعداد الأواني الزجاجية المختبرية المقاومة للتغيرات المفاجئة في درجة الحرارة.
جميع تعديلات السيليكا في الماء غير قابلة للذوبان عملياً (عند درجة حرارة 25 درجة مئوية ، ذوبان الكوارتز هو 7 ، cristobalite - 12 ، tridymite - 16 ، زجاج الكوارتز - 83 مجم / لتر). لذلك ، في ظل الظروف العادية ، تعمل المحاليل القلوية وحمض الهيدروفلوريك فقط عليها:
SiO 2 + 2KO = K 2 SiO 3 + H 2 O ، (1)
SiO 2 + 4HF = SiF 4 + 2H 2 O. (2)
رد الفعل الأخير يستخدم ل "حفر" الزجاج.
تتفاعل السيليكا المضافة مع الأكاسيد الأساسية والقلويات (التفاعل (1)) والكربونات لتكوين السيليكات:
SiO 2 + CaO = СaSiO 3، (3)
SiO 2 + Na 2 CO 3 = Na 2 SiO 3 + CO 2. (4)
تكمن ردود الفعل (3) و (4) في الإنتاج الصناعي للنظارات المختلفة وكذلك الأسمنت. وبالتالي ، يتم التعبير عن تركيبة الزجاج العادي (على سبيل المثال ، النافذة ، لتصنيع الأطباق) من خلال الصيغة Na 2 O. CaO. 6SiO 2. يتم إنتاج هذا الزجاج عن طريق دمج مزيج من الصودا والرمل والحجر الجيري. تتم العملية عند درجة حرارة ~ 1400 درجة مئوية حتى الإزالة الكاملة للغازات:
Na 2 CO 3 + CaCO 3 + 6SiO 2 = Na 2 O. CaO. 6SiO 2 + 2CO 2.
لدرجات خاصة من الزجاج - الحرارية ، "غير قابلة للكسر" - عند الطهي ، إضافة أكاسيد الباريوم والرصاص والبورون. للحصول على نظارات ملونة ، يتم أيضًا تقديم مواد مضافة مختلفة ، على سبيل المثال ، توفر إضافة أكسيد الكوبالت Co 2 O 3 لونًا أزرق ، وأكسيد الكروم Cr 2 O 3 - ثاني أكسيد ثاني أكسيد المنغنيز MnO 2 - وردي.
أكسيد SiO 2 هو أنهيدريد لعدد من الأحماض السيليكية ، والتي يمكن التعبير عن تركيبها بالصيغة العامة xSiO 2 ∙ yH 2 O ، حيث x و y أرقام صحيحة: 1) x = 1 ، y = 1: SiO 2. ح 2 أوه ، أي H 2 SiO 3 - حمض السيليكون الفوقية ؛ 1) x = 1 ، y = 2: SiO 2. 2H 2 O ، أي حمض أورثوسيليك 1) س = 2 ، ص = 1: 2SiO 2. ح 2 أوه ، أي H 2 Si 2 O 5 - حمض السيليك bimeta.
تنتمي الأحماض التي تحتوي جزيئاتها على أكثر من جزيء SiO 2 إلى البولي سيليكون.
إن أبسط أحماض السيليك هو H 2 SiO 3 ، والتي غالباً ما تسمى ببساطة السيليكون ، وأملاحها عبارة عن سليكات. في حالة السيليكات ، تكون سليكات الصوديوم والبوتاسيوم فقط قابلة للذوبان في الماء ، أما السيليكات المتبقية فهي مواد حرارية غير قابلة للذوبان في الماء.
تنمو محاليل السيليكات عند تعبيرها في الهواء ، حيث إن ثاني أكسيد الكربون الموجود فيه يحل محل حمض السيليك من أملاحه (H 2 SiO 3 أضعف من حمض الكربونيك ؛ ثابت تفكك H 2 SiO 3 في المرحلة الأولى يساوي K 1 = 2.2. ).
H 2 SiO 3 غير قابل للذوبان عملياً في الماء - يتم استخدام هذه الخاصية كرد فعل نوعي للكشف عن أيونات السيليكات:
Na 2 SiO 3 + CO 2 + H 2 O = Na 2 CO 3 + H 2 SiO 3 ↓.
يتم الحصول على السيليكات عن طريق دمج SiO 2 مع القلويات أو الكربونات.
المحاليل المركزة لسيليكات الصوديوم والبوتاسيوم تسمى الزجاج السائل ، ولديها تفاعل قلوي قوي بسبب تحللها الشديد:
K 2 SiO 3 + H 2 O 2KON + H 2 SiO 3 ↓.
يستخدم الزجاج السائل ، على سبيل المثال ، لتصنيع الغراء والأقمشة المقاومة للماء.
يستخدم الأسمنت على نطاق واسع في البناء باعتباره رابطًا ، عندما يختلط بالماء. عادة ، يتم إنتاج الأسمنت في أفران دوارة كبيرة حيث يتم تحميص السيليكات المختلفة والأرض (عند درجة حرارة -1000 درجة مئوية).
هناك عدة أنواع من الأسمنت ، ومع ذلك ، فمن الممكن بشكل مشروط التمييز بين نوعين من الأسمنت وفقًا لمبدأ "التخثر" - الاسمنت العادي وأسمنت بورتلاند. تحدث عملية "ضبط" الأسمنت التقليدي المكون من سيليكات الكالسيوم بسبب تكوين كربونات الكالسيوم بسبب ثاني أكسيد الكربون في الهواء:
تساو. SiO 2 + CO 2 + H 2 O = CaCO 3 ↓ + H 2 SiO 3 ↓.
عند وضع ثاني أكسيد الكربون من الأسمنت البورتلاندي لا يشارك في هذه العملية ، ويحدث التحلل المائي للسيليكات مع التكوين اللاحق لهيدرات بلورية غير قابلة للذوبان:
Ca 3 SiO 5 + H 2 O = Ca 2 SiO 4 + Ca (OH) 2 ،
Ca 2 SiO 4 + 4H 2 O = Ca 2 SiO 4. 4H 2 O ↓.
· الكربيدات والمبيدات الحشرية
· يتم الحصول على مركبات الكربون والسيليكون مع المعادن - الكربيدات ومبيدات السيليكات ، بالإضافة إلى التفاعلات المدروسة ، عن طريق تفاعل السيليكون مع هيدرات المعادن ، على سبيل المثال:
· 2CaH 2 + Si = Ca 2 Si + 2H 2.
كل هذه التفاعلات تحدث في درجات حرارة عالية. بين كربيد ينبعث منها ما يسمى "الميثانيدات" و "الأسيتيلين". تعتبر الأولى مشتقات الميثان التي تحتوي على الكربون في حالة الأكسدة -4 (Be 2 C ، Al 4 C 3) ، والثانية - كمشتقات الأسيتيلين بدرجة أكسدة الكربون -1 (Li 2 C 2 ، Ag 2 C 2 ، Cu 2 C 2 ، CAC 2). يمكن الحصول على أسيتيليدات الفضة والنحاس (I) بسهولة عن طريق تمرير الأسيتيلين من خلال محلول الأمونيا من أكسيد الفضة أو كلوريد النحاس (I). تتفاعل معظم الميثانيدات والأسيتيدات بنشاط مع الماء (خاصة مع الأحماض) ، وتطلق الهيدروكربونات المقابلة:
· СаС 2 + 2Н 2 О = Са (ОН) 2 + С 2 Н 2 ،
· Al 4 C 3 + 12H 2 O = 4Al (OH) 3 ↓ + 3CH 4 ،
· Ag 2 C 2 + 2HCl = 2AgCl ↓ + C 2 H 2.
بخلاف الكربيدات ، تتفاعل المبيدات الحامضية فقط من المعادن القلوية أو القلوية مع الماء والأحماض ، وتنتج أبسط مركبات هيدروجين أحادية السيليكون ، والتي غالباً ما تسمى ببساطة سيلاني SiН 4:
· Ca 2 Si + 4HCl = 2CaCl 2 + SiH 4.
Silane هو غاز عديم اللون له رائحة العفن ، قابلة للاشتعال تلقائيًا في الهواء ، ويحترق حتى SiO 2 والماء:
· SiH 4 + 2O 2 = SiO 2 + 2H 2 O.
· القلويات تتحلل بسهولة silane بواسطة المعادلة:
· SiH 4 + 2KON + H 2 O = K 2 SiO 3 + 4H 2 ،
· الماء يتحلل أيضا سيلاني ، ولكن أبطأ بكثير:
· SiH 4 + 2H 2 O = SiO 2 + 4H 2.
عندما يتم تسخينه فوق 400 درجة مئوية دون الوصول إلى الهواء ، يتحلل سيلان إلى السيليكون والهيدروجين (إحدى طرق إنتاج السيليكون):
· SiH 4 = Si + 2H 2.
بالإضافة إلى monosilane ، ومن المعروف أيضا disilane Si 2 H 6 ، trisilane Si 3 H 8 ، tetrasilane Si 4 H 10 ، وما إلى ذلك. في الحالة الفردية ، تم عزل المركبات فقط حتى Si 6 H 14 شاملة. تنتمي كل هذه المركبات إلى سلسلة متجانسة من السيلانات ، والتي تتوافق مع الصيغة العامة Si n H 2 n + 2. مثل الألكانات ، السيلانات عديمة اللون ، والأعضاء الأولون في السلسلة المتجانسة غازيون في الظروف العادية ، فيما يلي السوائل. يختلف النشاط الكيميائي للسيلان والهيدروكربونات: على عكس الألكانات الخاملة بما فيه الكفاية ، سيلاني جميعها تفاعلية. ويرجع ذلك إلى انخفاض تقارب السليكون للهيدروجين مقارنة بالكربون والتقارب العالي جدًا للسيليكون للأكسجين. علاوة على ذلك ، تعتبر روابط Si-Si أقل متانة من سندات С-С. على عكس رابطة C - H ، فإن رابطة Si - H لها طابع أكثر الأيونية.
· طاقة روابط Si-E و CE.
· انخفاض قوة الرابطة Si-Si يرجع إلى حدود سلسلة متجانسة من silanes.
· بين كربيد ومبيدات السيليكات ، يشغل مكانًا خاصًا كربيد السيليكون ، والذي يمكن تسميته كربيد السيليكون ومبيد الكربون. Carborundum لديه نقطة انصهار عالية بسبب هيكلها يشبه الماس. صلابته قريبة من صلابة الماس. كيميائيا ، كربيد مستقرة جدا.
· مفهوم الحلول الغروية
في الطبيعة والتكنولوجيا ، غالبًا ما توجد أنظمة مشتتة يتم فيها توزيع مادة واحدة بالتساوي كجزيئات داخل مادة أخرى.
في النظم المشتتة ، هناك مرحلة مشتتة - مادة مقسمة بدقة ووسط مشتت - مادة متجانسة يتم فيها توزيع المرحلة المشتتة. تشتمل أنظمة التشتيت على حلول عادية (حقيقية) ، ومحاليل غروانية ، وكذلك معلقات ومستحلبات. وهي تختلف عن بعضها البعض في المقام الأول في أحجام الجسيمات ، أي درجة تشتت (تجزئة).
الأنظمة ذات حجم الجسيمات التي تقل عن 1 نانومتر هي حلول حقيقية تتكون من جزيئات ذائبة أو أيونات. ينبغي اعتبارها نظام مرحلة واحدة. الأنظمة ذات أحجام الجسيمات أكبر من 100 نانومتر هي أنظمة مشتتة الخشنة - معلقات ومستحلبات.
نظام التعليق عبارة عن أنظمة مشتتة تكون فيها المرحلة المشتتة صلبة ووسط التشتت سائل ، وتكون المادة الصلبة غير قابلة للذوبان عملياً في السائل.
المستحلبات عبارة عن أنظمة مشتتة يكون فيها كل من الطور المشتت ووسط التشتت سوائل غير قابلة للاختلاط. مثال على مستحلب الحليب ، حيث تطفو كرات صغيرة من الدهون في سائل.
نظام التعليق والمستحلبات عبارة عن أنظمة ثنائية الطور.
المحاليل الغروية هي أنظمة ثنائية الطور مشتتة للغاية تتكون من وسط تشتت ومرحلة مشتتة ، والأبعاد الخطية لجزيئات الأخير تكمن في المدى من 1 إلى 100 نانومتر. كما يمكن أن نرى ، المحاليل الغروية حسب حجم الجسيمات هي وسيطة بين الحلول الحقيقية والتعليق والمستحلبات. تتكون الجسيمات الغروية عادة من عدد كبير من الجزيئات أو الأيونات.
وتسمى الحلول الغروية أيضًا سولز. يتم الحصول عليها بواسطة طرق التشتت والتكثيف. غالبًا ما يتم إجراء التشتيت باستخدام "مطاحن غروانية" خاصة. في طريقة التكثيف ، تتشكل الجزيئات الغروية عن طريق الجمع بين الذرات أو الجزيئات في المجاميع. أثناء العديد من التفاعلات الكيميائية ، يحدث التكثيف وتتشكل أنظمة مشتتة للغاية (الترسيب ، التحلل المائي ، تفاعلات الحد من الأكسدة ، إلخ).
1 نانومتر - نانومتر (1 نانومتر = 10 -9 م).
على عكس الحلول الحقيقية ، تتميز السلالات بتأثير Tyndall ، أي تشتت الضوء بواسطة جسيمات الغروية. عندما يظهر مخروط الضوء عبر حزمة من الضوء ، فإنه يظهر في غرفة مظلمة. 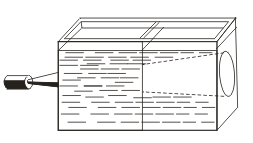 . حتى تتمكن من التعرف على ما إذا كان هذا الحل غروانيًا أم حقيقيًا.
. حتى تتمكن من التعرف على ما إذا كان هذا الحل غروانيًا أم حقيقيًا.
واحدة من الخصائص المهمة لل sols هو أن جزيئاتها لديها شحنة كهربائية من نفس العلامة. بسبب هذا ، فإنها لا تندمج في جزيئات أكبر ولا تترسب. في الوقت نفسه ، يكون لجسيمات بعض المواد الصلبة الذائبة ، على سبيل المثال ، المعادن ، والكبريتيدات ، والأحماض السيليكية والقصديرية ، شحنة سالبة ، في حين أن الجزيئات الأخرى ، مثل الهيدروكسيدات وأكاسيد المعادن ، لها شحنة موجبة. يتم تفسير ظهور شحنة بواسطة امتصاص أيونات من المحلول بواسطة جزيئات الغروية.
لترسيب سول ، من الضروري أن تندمج جزيئاته في المجاميع الكبيرة. يُطلق على مزيج الجزيئات في المجاميع الكبيرة التخثر ، ويسمى ترسيبها تحت تأثير الجاذبية الترسيب.
عادة ما يحدث التخثر عند الإضافة إلى sols: 1) المنحل بالكهرباء ، 2) محلول آخر له جسيمات لها شحنة معاكسة ، و 3) عند تسخينها.
