الكبريت. كبريتيد الهيدروجين والكبريتيدات
4.doc
240الكبريت. كبريتيد الهيدروجين ، والكبريتيدات ، والهيدروسلفات. أكاسيد الكبريت (IV) و (VI). حامض الكبريتيك وحمض الكبريتيك وأملاحهم. استرات حمض الكبريتيك. ثيوسلفات الصوديوم
4.1. كبريت
الكبريت هو أحد العناصر الكيميائية القليلة التي استخدمها الناس لعدة آلاف من السنين. يتم توزيعه على نطاق واسع في الطبيعة ويوجد على حد سواء في الحالة الحرة (الكبريت الأصلي) وفي المركبات. يمكن تقسيم المعادن المحتوية على الكبريت إلى مجموعتين - كبريتيد (البيريت ، التألق ، الدمى) والكبريتات. يوجد الكبريت الأصلي بكميات كبيرة في إيطاليا (جزيرة صقلية) والولايات المتحدة الأمريكية. في رابطة الدول المستقلة ، توجد رواسب الكبريت الأصلية في منطقة الفولغا ، في دول آسيا الوسطى ، وفي شبه جزيرة القرم وغيرها من المناطق.
المعادن من المجموعة الأولى تشمل تلميع الرصاص PbS ، تلميع النحاس Cu 2 S ، تألق الفضة - Ag 2 S ، تعطل الزنك - ZnS ، snag الكادميوم - CdS ، البايرايت أو البيريت الحديد - FeS 2 ، chalcopyrite - CuFeS 2 ، cinnabar - HgS.
تشتمل معادن المجموعة الثانية على الجبس CaSO 4 2H 2 O و mirabilite (ملح Glauber) - Na 2 SO 4 10H 2 O و kizerite - MgSO 4 H 2 O.
يوجد الكبريت في الحيوانات والنباتات كجزء من جزيئات البروتين. توجد مركبات الكبريت العضوية في البترول.
استقبال
1. عندما يتم الحصول على الكبريت من المركبات الطبيعية ، على سبيل المثال ، من الكبريت الحريري ، يتم تسخينه إلى درجات حرارة عالية. البيريت الكبريت يتحلل لتشكيل الحديد (II) كبريتيد والكبريت:
2. يمكن الحصول على الكبريت عن طريق أكسدة كبريتيد الهيدروجين بسبب نقص الأكسجين عن طريق التفاعل:
2H 2 S O 2 = 2S 2H 2 O
3. في الوقت الحاضر ، يعد استرداد الكبريت عن طريق تخفيض ثاني أكسيد الكربون من ثاني أكسيد الكبريت SO 2 منتجًا شائعًا في صهر المعادن من خامات الكبريت:
SO 2 C = CO 2 S
4. تحتوي غازات النفايات الناتجة عن الأفران المعدنية وفحم الكوك على مزيج من ثاني أكسيد الكبريت وكبريتيد الهيدروجين. يتم تمرير هذا الخليط عند درجة حرارة عالية على المحفز:
H 2 S SO 2 = 2H 2 O 3S
^ الخصائص الفيزيائية
الكبريت هو لون أصفر ليمون قاسي وهش. إنه غير قابل للذوبان عملياً في الماء ، ولكنه قابل للذوبان جيدًا في CS 2 الأنيلين في ثاني كبريتيد الكربون وبعض المذيبات الأخرى.
الفقراء يوصل الحرارة والتيار الكهربائي. الكبريت يشكل عدة تعديلات متآثر:
1 . ^ الكبريت المعيني (الأكثر ثباتًا) ، تكون للبلورات شكل الأوكتيدرا.
عندما يتم تسخين الكبريت ، يتغير لونه ولزوجته: أولاً ، يتشكل اللون الأصفر الفاتح ، ثم مع ارتفاع درجة الحرارة ، يصبح لونه أكثر قتامة ويصبح لزجًا لدرجة أنه لا يتدفق من الأنبوب ، مع مزيد من التسخين ، تنخفض اللزوجة مرة أخرى ، وعند درجة حرارة 444 ، 6 درجات مئوية .
2. ^ أحادي الكبريت - تعديل في شكل إبر صفراء داكنة ، يتم الحصول عليها عن طريق التبريد ببطء للكبريت المنصهر.
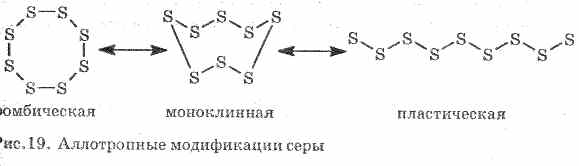
3. الكبريت البلاستيكتشكلت إذا تم سكب الكبريت الذي يسخن حتى الغليان في ماء بارد. امتدت بسهولة مثل المطاط (انظر الشكل 19).
يتكون الكبريت الطبيعي من مزيج من أربعة نظائر مستقرة: 32 16 S ، 33 16 S ، 34 16 S ، 36 16 S.
^ الخواص الكيميائية
يمكن لذرة الكبريت ، التي لديها مستوى طاقة خارجي غير مكتمل ، أن تربط إلكترونين وتحمل درجة علمية
الأكسدة -2. يعرض الكبريت حالة الأكسدة هذه في المركبات التي تحتوي على المعادن والهيدروجين (Na 2 S، H 2 S). عند الارتداد أو استنفاد الإلكترونات إلى ذرة العنصر الأكثر إلكترونيا ، يمكن أن تكون درجة أكسدة الكبريت 2 ، 4 ، 6
الكبريت خامل نسبيا في البرد ، ولكن مع زيادة درجة الحرارة ، يزداد تفاعله. 1. مع المعادن ، يعرض الكبريت خصائص مؤكسدة. عندما تكون ردود الفعل هذه عبارة عن كبريتيد (مع عدم تفاعل الذهب والبلاتين والإيريديوم): Fe S = FeS
2. في الظروف العادية ، لا يتفاعل الكبريت مع الهيدروجين ، وعند 150-200 درجة مئوية يحدث تفاعل عكسي:
3. في التفاعلات مع المعادن والهيدروجين ، يتصرف الكبريت كعامل مؤكسد نموذجي ، وفي وجود عوامل مؤكسدة قوية ، يُظهر خصائص مُخفِّفة.
S 3F 2 = SF 6 (لا يتفاعل مع اليود)
4. يبدأ احتراق الكبريت في الأكسجين عند 280 درجة مئوية ، وفي الهواء عند 360 درجة مئوية. هذا يشكل خليطًا من SO 2 و SO 3:
S O 2 = SO 2 2S 3O 2 = 2SO 3
5. عند تسخينه بدون هواء ، يتحد الكبريت مباشرة مع الفوسفور والكربون ، ويظهر خصائص مؤكسدة:
2P 3S = P 2 S 3 2S C = CS 2
6. عند التفاعل مع المواد المعقدة ، يتصرف الكبريت أساسًا كعامل اختزال:
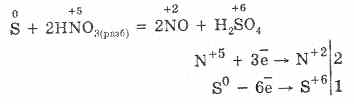
7. الكبريت قادر على ردود فعل غير متناسبة. لذلك ، عند غليان مسحوق الكبريت مع القلويات ، تتشكل الكبريتات والكبريتيدات:
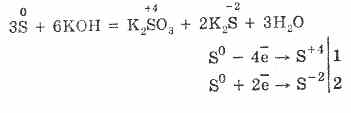
تطبيق
يستخدم الكبريت على نطاق واسع في الصناعة والزراعة. يستهلك حوالي نصف إنتاجه لإنتاج حمض الكبريتيك. يستخدم الكبريت لفلكنة المطاط: في هذه الحالة ، يتم تحويل المطاط إلى مطاط.
في شكل كبريت (مسحوق ناعم) يستخدم الكبريت لمكافحة أمراض الكرم والقطن. يتم استخدامه للحصول على البارود ، مباريات ، التراكيب المضيئة. في الطب ، أعد مرهم الكبريت لعلاج الأمراض الجلدية.
4.2. كبريتيد الهيدروجين ، والكبريتيدات ، والهيدروسلفات
كبريتيد الهيدروجين هو نظير للماء. الصيغة الإلكترونية
يوضح أن إلكترونين p من المستوى الخارجي لذرة الكبريت متورطان في تكوين روابط H - S - H. جزيء H 2S له شكل زاوي ، لذلك فهو قطبي.
^ يجري في الطبيعة
يوجد كبريتيد الهيدروجين في الطبيعة في الغازات البركانية وفي مياه بعض المصادر المعدنية ، مثل بياتيغورسك ، ماتسيستا. يتم تشكيله من خلال تحلل المواد العضوية المحتوية على الكبريت من بقايا الحيوانات والنباتات المختلفة. وهذا ما يفسر الرائحة المميزة غير السارة لمياه الصرف الصحي والأحواض ومدفن النفايات.
استقبال
1. يمكن الحصول على كبريتيد الهيدروجين عن طريق الاتصال المباشر بالكبريت بالهيدروجين عن طريق التسخين:
2. ولكن عادة ما يتم الحصول عليها عن طريق عمل حمض الهيدروكلوريك أو حامض الكبريتيك المخفف على كبريتيد الحديد (III):
2HCl FeS = FeCl 2 H 2 S 2H FeS = Fe 2 H 2 S يتم تنفيذ هذا التفاعل في الغالب في جهاز Kipp.
^ الخصائص الفيزيائية
في ظل الظروف العادية ، يعتبر كبريتيد الهيدروجين غازًا عديم اللون ذو رائحة مميزة قوية من البيض الفاسد. السامة جدا ، يرتبط استنشاق الهيموغلوبين ، مما يسبب الشلل ، وهو أمر غير صحي.
كو يؤدي إلى الموت. بتركيزات منخفضة ، أقل خطورة. من الضروري العمل معها في خزائن العادم أو مع الأجهزة المغلقة بإحكام. المحتوى المسموح به من H2S في مبنى الإنتاج هو 0.01 ملغ لكل 1 لتر من الهواء.
كبريتيد الهيدروجين قابل للذوبان في الماء بشكل جيد نسبياً (عند درجة حرارة 20 درجة مئوية ، يذوب كبريتيد الهيدروجين في حجم واحد من الماء).
ويطلق على محلول كبريتيد الهيدروجين في الماء ماء كبريتيد الهيدروجين أو حمض كبريتيد الهيدروجين (يكتشف خصائص حمض ضعيف).
^ الخواص الكيميائية
1 ، عندما تسخينها بشدة ، يتحلل كبريتيد الهيدروجين بالكامل تقريبا لتشكيل الكبريت والهيدروجين.
2. يحترق كبريتيد الهيدروجين الغازي في الهواء بلهب أزرق مع تكوين أكسيد الكبريت (IV) والماء:
2H 2 S 3O 2 = 2SO 2 2H 2 O
مع نقص الأكسجين ، تتشكل الكبريت والماء: 2H 2 S O 2 = 2S 2H 2 O
3. كبريتيد الهيدروجين هو عامل تخفيض قوي إلى حد ما. يمكن شرح هذه الخاصية الكيميائية الهامة على النحو التالي. في محلول H 2 S ، من السهل نسبيًا التبرع بالإلكترونات لتهوية جزيئات الأكسجين:
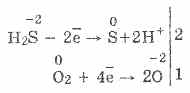
في الوقت نفسه ، يعمل الأكسجين الموجود في الهواء على أكسدة كبريتيد الهيدروجين إلى كبريت ، مما يجعل كبريتيد الهيدروجين عكرًا بالماء:
2H 2 S O 2 = 2S 2H 2 O
وهذا ما يفسر حقيقة أن كبريتيد الهيدروجين لا يتراكم بكميات كبيرة للغاية في الطبيعة عندما تتحلل المادة العضوية - الأكسجين من الهواء يؤكسده إلى الكبريت الحر.
4 ، يتفاعل كبريتيد الهيدروجين بقوة مع حلول الهالوجين ، على سبيل المثال:
H 2 S I 2 = 2HI S يتم تحرير الكبريت ويصبح محلول اليود مشوهًا.
5. تتفاعل المؤكسدات المختلفة بقوة مع كبريتيد الهيدروجين: تحت عمل حمض النيتريك ، يتشكل الكبريت الحر.
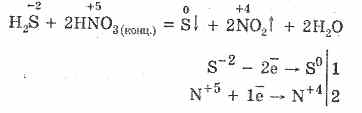
6. محلول كبريتيد الهيدروجين حامضي بسبب التفكك:
H 2 SH HS - HS - SH S -2
المرحلة الأولى تسود عادة. إنه حمض ضعيف جدًا: أضعف من حمض الفحم ، والذي عادة ما يحل محل H2S من الكبريتيدات.
الكبريتيدات والهيدروريدات
حمض الهيدروفلوريك ، باعتباره ديباسي ، يشكل صفين من الأملاح:
الكبريتيدات الوسطى (Na 2 S) ؛
حامض هيدروكلوريد (NaHS).
يمكن الحصول على هذه الأملاح: من خلال تفاعل الهيدروكسيدات مع كبريتيد الهيدروجين: 2NaOHH 2 S = Na 2 S 2H 2 O
التفاعل المباشر للكبريت مع المعادن:
تفاعل التبادل للأملاح مع H 2S أو بين الأملاح:
Pb (NO 3) 2 Na 2 S = PbS 2NaNO 3
CuSO 4 H 2 S = CuS H 2 SO 4 Cu 2 H 2 S = CuS 2H
هيدروكلويدات كلها تقريبا قابلة للذوبان في الماء.
كبريتيد المعادن القلوية والقلوية قابلة للذوبان في الماء بسهولة ، عديم اللون.
الكبريتيدات المعدنية الثقيلة غير قابلة للذوبان عملياً أو قابلة للذوبان في الماء قليلاً (FeS، MnS، ZnS)؛ بعضها لا يذوب في الأحماض المخففة (CuS ، PbS ، HgS).
كما أملاح حمض ضعيف ، والكبريتيدات في المحاليل المائية تتحلل للغاية. على سبيل المثال ، يكون للكبريتيدات المعدنية القلوية ، عندما تذوب في الماء ، تفاعل قلوي:
Na 2 S НОНNaHS NaOH
جميع الكبريتيدات ، مثل كبريتيد الهيدروجين نفسه ، عوامل خفض قوية:
3PbS -2 8HN 5 O 3 (الفقرة.) = 3PbS 6 O 4 4H 2 O 8N 2 O
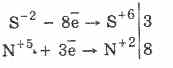
بعض الكبريتيدات لها لون مميز: CuS و PbS - أسود ، CdS - أصفر ، ZnS - أبيض ، MnS - وردي ، SnS - بني ، Al 2 S 3 - برتقالي. يعتمد التحليل النوعي للكاتيونات على ذوبان مختلف للكبريتيدات والألوان المختلفة لكثير منها.
^ 4.3. أكسيد الكبريت (IV) وحمض الكبريتيك
أكسيد الكبريت (IV) ، أو ثاني أكسيد الكبريت ، في الظروف العادية ، هو غاز عديم اللون ذو رائحة خانقة حادة. عند تبريده إلى -10 درجة مئوية ، فإنه يتحول إلى سائل عديم اللون.
استقبال
1. تحت ظروف المختبر ، يتم الحصول على أكسيد الكبريت (IV) من أملاح حامض الكبريتيك عن طريق عمل الأحماض القوية عليها:
Na 2 SO 3 H 2 SO 4 = Na 2 SO 4 S0 2 H 2 O 2NaHSO 3 H 2 SO 4 = Na 2 SO 4 2SO 2 2H 2 O 2HSO - 3 2H = 2 SO 2 2H 2 O
2. يتكون ثاني أكسيد الكبريت أيضًا من تفاعل حامض الكبريتيك المركز عند تسخينه بالمعادن قليلة النشاط:
Cu 2H 2 SO 4 = CuSO 4 SO 2 2H 2 O
Cu 4H 2 SO 2-4 = Cu 2 SO 2-4 SO 2 2H 2 O
3. يتكون أكسيد الكبريت (IV) أيضًا عند حرق الكبريت في الهواء أو الأكسجين:
4. في الظروف الصناعية ، يتم الحصول على ثاني أكسيد الكبريت عن طريق تحميص البايرايت مع FeS 2 أو خامات الكبريت من المعادن غير الحديدية (الزنك blende ZnS ، لمعان الرصاص PbS ، إلخ):
4FeS 2 11О 2 = 2Fe 2 O 3 8SO 2
الصيغة الهيكلية للجزيء SO 2:
تشارك أربع ذرات كبريت وأربعة إلكترونات من ذرتين أكسجين في تكوين روابط في جزيء ثاني أكسيد الكبريت. التنافر المتبادل لأزواج الإلكترون الرابطة والزوج الإلكترون الوحيد للكبريت يمنح الجزيء شكلًا زاويًا.
الخواص الكيميائية
1. يعرض أكسيد الكبريت (IV) جميع خصائص أكاسيد الحمض:
تفاعل الماء
التفاعل مع القلويات ،
التفاعل مع الأكاسيد الأساسية.
2. يتميز أكسيد الكبريت (IV) بتقليل الخواص:
S 4 O 2 O 0 2 2S 6 O -2 3 (في وجود محفز ، عند تسخينه)
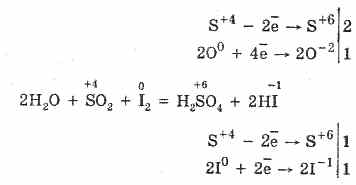
ولكن في وجود عوامل اختزال قوية ، يتصرف SO 2 كعامل مؤكسد:
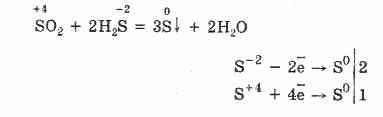
يتم تفسير ازدواج الأكسدة والاختزال لأكسيد الكبريت (IV) بحقيقة أن الكبريت لديه حالة أكسدة فيه 4 ، وبالتالي فإنه يمكن ، بالتخلي عن إلكترونين ، أن يتأكسد إلى S 6 ، وبأخذ 4 إلكترونات ، يمكن اختزاله إلى S °. يعتمد مظهر هذه الخصائص أو غيرها على طبيعة المكون التفاعلي.
أكسيد الكبريت (IV) قابل للذوبان بشدة في الماء (40 مجلدًا من SO 2 يذوب في حجم واحد عند 20 درجة مئوية). في هذه الحالة ، يتكون حمض الكبريتيك الموجود فقط في المحلول المائي:
SO 2 H 2 ОH 2 SO 3
رد الفعل هو عكسها. في المحلول المائي ، يكون أكسيد الكبريت (IV) وحمض الكبريتيك في حالة توازن كيميائي ، ويمكن إزاحتهما. مع ربط H 2 SO 3 (تحييد الحمض
أنت) رد فعل العائدات في اتجاه تشكيل حامض الكبريتيك. عند إزالة ثاني أكسيد الكبريت (تهب خلال محلول من النيتروجين أو التسخين) ، يستمر التفاعل نحو مواد البدء. يحتوي محلول حامض الكبريتيك دائمًا على أكسيد الكبريت (IV) ، مما يعطيه رائحة حادة.
حمض الكبريتيك لديه كل خصائص الأحماض. في الحل ينفصل في الخطوات:
H 2 SO 3 HSH HSO - 3 HSO - 3 SOH SO 2- 3
غير مستقرة حراريا ، متقلبة. حمض الكبريتيك ، كما dibasic ، يشكل نوعين من الأملاح:
الكبريتيت المتوسطة (Na 2 SO 3) ؛
حامض الهيدروسلفيت (NaHSO 3).
تتشكل الكبريتات عندما يتم تحييد القلويات بالكامل بواسطة الحمض:
H 2 SO 3 2NaOH = Na 2 SO 3 2H 2 O
يتم الحصول على hydrosulphites مع نقص القلويات:
H 2 SO 3 NaOH = NaHSO 3 H 2 O
يمتلك حمض الكبريتيك وأملاحه خصائص مؤكسدة ومختزلة على حد سواء ، والتي تحددها طبيعة شريك التفاعل.
1. لذلك ، تحت تأثير الأكسجين سلفات الأكسجين إلى الكبريتات:
2Na 2 S 4 O 3 O 0 2 = 2Na 2 S 6 O -2 4
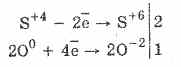
تستمر عملية أكسدة حمض الكبريتيك بواسطة البروم وبرمنجنات البوتاسيوم بسهولة أكبر:
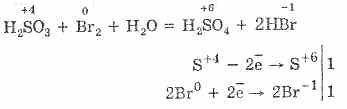
5H 2 S 4 O 3 2KMn 7 O 4 = 2H 2 S 6 O 4 2Mn 2 S 6 O 4 K 2 S 6 O 4 3H 2 O
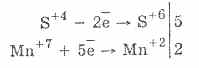
2. في ظل وجود عوامل اختزال أكثر قوة ، تظهر الكبريتيت خواص مؤكسدة:
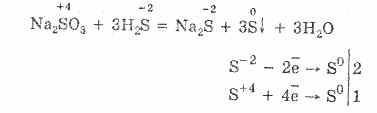
تقريبًا جميع ذرات hydrosulphites والكبريتات المعدنية القلوية تذوب من أملاح حامض الكبريتيك.
3. بما أن H 2 SO 3 عبارة عن حمض ضعيف ، فإن عمل الأحماض على الكبريتيت والهيدروسلفيت يؤدي إلى إطلاق ثاني أكسيد الكبريت. عادة ما تستخدم هذه الطريقة عند الحصول على SO 2 في ظروف المختبر:
NaHSO 3 H 2 SO 4 = Na 2 SO 4 SO 2 H 2 O
4. تخضع الكبريتات القابلة للذوبان في الماء بسهولة للتحلل المائي ، مما يؤدي إلى زيادة تركيز أيونات OH في المحلول:
Na 2 SO 3 NONNaHSO 3 NaOH
تطبيق
أكسيد الكبريت (الرابع) وحمض الكبريتيك تلطيخ العديد من الأصباغ ، وتشكيل معهم مركبات عديمة اللون. يمكن أن يتحلل هذا الأخير مرة أخرى عند تسخينه أو في الضوء ، ونتيجة لذلك يتم استعادة اللون. لذلك ، يختلف تأثير تبييض SO 2 و H 2 SO 3 عن تأثير تبييض الكلور. عادة ، الكبريت (الرابع) rxid يبيض الصوف والحرير والقش.
أكسيد الكبريت (الرابع) يقتل العديد من الكائنات الحية الدقيقة. لذلك ، لتدمير الفطريات العفن ، فإنها تبخير الأقبية الخام والأقبية وبرميل النبيذ ، وما إلى ذلك ، كما أنها تستخدم في نقل وتخزين الفواكه والتوت. بكميات كبيرة ، يستخدم أكسيد الكبريت الرابع) لإنتاج حمض الكبريتيك.
أحد التطبيقات المهمة هو محلول هيدروسلفيت الكالسيوم CaHSO 3 (سائل الكبريتيت) ، والذي يستخدم لعلاج لب الخشب والورق.
^ 4.4. أكسيد الكبريت (السادس). حمض الكبريتيك
أكسيد الكبريت (VI) (انظر علامة التبويب 20) هو سائل عديم اللون يصلب عند درجة حرارة 16.8 درجة مئوية إلى كتلة بلورية صلبة. يمتص الرطوبة بشدة ، مكونًا حمض الكبريتيك: SO 3 H 2 O = H 2 SO 4
الجدول 20. خصائص أكاسيد الكبريت
يرافق ذوبان أكاسيد الكبريت (VI) في الماء إطلاق كمية كبيرة من الحرارة.
أكسيد الكبريت (سادسا) قابل للذوبان في حمض الكبريتيك المركز. ويسمى محلول SO 3 في حمض اللامائي أوليوم. يمكن أن يحتوي الزيت على 70٪ من SO 3.
استقبال
1. يتم الحصول على أكسيد الكبريت (VI) عن طريق أكسدة ثاني أكسيد الكبريت مع الأكسجين في وجود المواد الحفازة عند درجة حرارة 450 درجة مئوية (انظر إنتاج حامض الكبريتيك):
2SO 2 O 2 = 2SO 3
2. هناك طريقة أخرى لأكسدة SO 2 إلى SO 3 وهي استخدام أكسيد النيتريك (IV) كعامل مؤكسد:
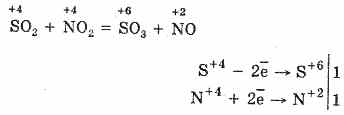
يتحول أكسيد النيتريك الناتج (II) عند التفاعل مع الأكسجين الجوي بسهولة وبسرعة إلى أكسيد النيتريك (IV): 2NO O 2 = 2NO 2
والتي يمكن استخدامها مرة أخرى في أكسدة SO 2. لذلك ، NO 2 بمثابة الناقل الأكسجين. هذه الطريقة المؤكسدة SO 2 إلى SO 3 تسمى النيتروز. يحتوي جزيء SO 3 على شكل مثلث ، في وسطه
تقع ذرة الكبريت:
هذا الهيكل يرجع إلى التنافر المتبادل لأزواج الإلكترون الرابطة. قدمت ذرة الكبريت ستة إلكترونات خارجية لتشكيلها.
الخواص الكيميائية
1. SO 3 - أكسيد حمض نموذجي.
2. أكسيد الكبريت (VI) له خصائص عامل مؤكسد قوي.
تطبيق
يستخدم أكسيد الكبريت (السادس) لإنتاج حمض الكبريتيك. الأهم هو طريقة الاتصال للحصول على
حمض الكبريتيك. بهذه الطريقة ، يمكنك الحصول على H 2 SO 4 من أي تركيز ، وكذلك الزيت. تتكون العملية من ثلاث مراحل: الحصول على SO 2 ؛ أكسدة SO 2 إلى SO 3 ؛ الحصول على H 2 SO 4.
يتم الحصول على SO 2 عن طريق حرق البايرايت FeS 2 في الأفران الخاصة: 4FeS 2 11О 2 = 2Fe 2 O 3 8SO 2
لتسريع عملية التحميص ، يكون البايرايت قبل الأرض ، وللحرق التام للكبريت ، يتم حقن كمية أكبر من الهواء (الأكسجين) أكثر مما هو مطلوب في التفاعل. يتكون الغاز الذي يترك الفرن من أكسيد الكبريت (IV) والأكسجين والنيتروجين ومركبات الزرنيخ (من الشوائب في البيريت) وبخار الماء. ويسمى تحميص الغاز.
يخضع غاز التحميص لتنظيف شامل ، حيث أن المحتوى الصغير من مركبات الزرنيخ ، وكذلك الغبار والرطوبة ، يسممان المحفز. يتم تنظيف الغاز من مركبات الزرنيخ والغبار ، ويمر به من خلال المرسبات الكهروستاتيكية الخاصة وبرج الغسيل ؛ يتم امتصاص الرطوبة بواسطة حمض الكبريتيك المركز في برج التجفيف. يتم تسخين الغاز المحتوي على الأكسجين في مبادل حراري يصل إلى 450 درجة مئوية ويدخل جهاز الاتصال. يوجد داخل جهاز التلامس أرفف شعرية مملوءة بالمحفز.
في السابق ، تم استخدام البلاتين المعدني المسحوق بشكل جيد كعامل مساعد. بعد ذلك ، تم استبداله بمركبات الفاناديوم - أكسيد الفاناديوم (V) V 2 O 5 أو كبريتات الفاناديل VOSO 4 ، وهو أرخص من البلاتينوم والتسمم ببطء.
تفاعل أكسدة SO 2 إلى SO 3 قابل للعكس:
2SO 2 O 2 2SO 3
تؤدي الزيادة في محتوى الأكسجين في غاز التكلس إلى زيادة إنتاج أكسيد الكبريت (VI): عند درجة حرارة 450 درجة مئوية ، عادة ما يصل إلى 95 ٪ أو أكثر.
بعد ذلك يتم تغذية أكسيد الكبريت المشكل (VI) بطريقة مكافحة التيار لبرج الامتصاص ، حيث يتم امتصاصه بواسطة حمض الكبريتيك المركز. عند تشبعه ، يتشكل حمض الكبريتيك اللامائي أولاً ، ثم الزيت. في المستقبل ، يخفف الزيت إلى 98 ٪ من حامض الكبريتيك ويسلم للمستهلكين.
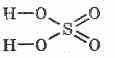
الصيغة الهيكلية لحمض الكبريتيك:
^ الخصائص الفيزيائية
حمض الكبريتيك هو سائل زيتي ثقيل عديم اللون ، يتبلور عند 10.4 درجة مئوية ، وهو ضعف تقريبا ( = 1.83 جم / سم 3) أثقل من الماء ، عديم الرائحة ، غير متطاير. استرطابي للغاية. تمتص الرطوبة مع إطلاق كميات كبيرة من الحرارة ، لذلك لا يمكنك صب الماء على حامض الكبريتيك المركز - سيكون هناك رش من الحمض. ل
يجب إضافة حمض الكبريتيك إلى الماء في أجزاء صغيرة.
يذوب حمض الكبريتيك اللامائي ما يصل إلى 70 ٪ من أكسيد الكبريت (VI). عندما يتم تسخينه ، فإنه يزيل SO 3 حتى يتم تشكيل محلول مع كتلة جزء من H 2 SO 4 من 98.3 ٪. اللامائية H 2 SO 4 بالكاد يوصل الكهرباء.
^ الخواص الكيميائية
1. يمتزج مع الماء في أي نسب ويشكل هيدرات من تكوين مختلف:
H 2 SO 4 H 2 O، H 2 SO 4 2H 2 O، H 2 SO 4 3H 2 O، H 2 SO 4 4H 2 O، H 2 SO 4 6.5H 2 O
2. حمض الكبريتيك المركز يفحم المواد العضوية - السكر والورق والخشب والألياف ، ويسلب منهم عناصر المياه:
C 12 H 22 O 11 H 2 SO 4 = 12 C H 2 SO 4 11H 2 O
الفحم المشكل يتفاعل جزئياً مع الحمض:
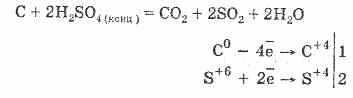
يعتمد الجفاف على امتصاص الماء بواسطة حامض الكبريتيك.
ك H2 SO 4 حمض قوي غير متطاير ، يحل محل الأحماض الأخرى من الأملاح الجافة:
NaNO 3 H 2 SO 4 = NaHSO 4 HNO 3
ومع ذلك ، إذا تمت إضافة H 2 SO 4 إلى محاليل الملح ، فلن يحدث إزاحة حمض.
H 2 SO 4 - حمض ديباسيك قوي: H 2 SO 4 HSH HSO - 4 HSO - 4 H SO 2- 4
لديها كل خصائص الأحماض القوية غير المتطايرة.
يتميز حمض الكبريتيك المخفف بجميع خصائص الأحماض غير المؤكسدة. وهي: تتفاعل مع المعادن الموجودة في السلسلة الكهروكيميائية لجهد المعادن حتى الهيدروجين:
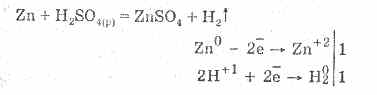
التفاعل مع المعادن يرجع إلى تقليل أيونات الهيدروجين.
6. حمض الكبريتيك المركز هو عامل مؤكسد نشط. عند تسخينها ، تتأكسد معظم المعادن ، بما في ذلك تلك الموجودة في سلسلة الضغوط الكهروكيميائية بعد الهيدروجين ، ولا تتفاعل فقط مع البلاتين والذهب. اعتمادًا على نشاط المعدن ، يمكن أن تكون منتجات الخفض هي S -2 و S ° و S 4.
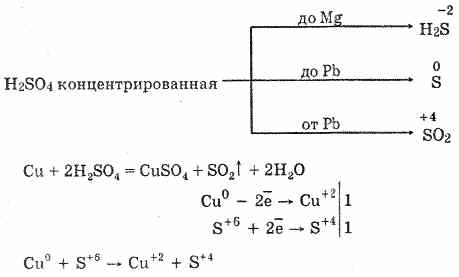
في البرد ، لا يتفاعل حمض الكبريتيك المركز مع معادن قوية مثل الألمنيوم والحديد والكروم. هذا بسبب تخميل المعادن. تستخدم هذه الميزة على نطاق واسع عندما يتم نقلها في حاوية حديدية.
ومع ذلك ، عند تسخينها:
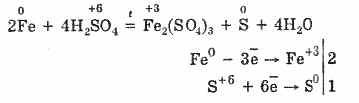
وهكذا ، يتفاعل حمض الكبريتيك المركز مع المعادن بسبب تقليل ذرات تكوين الحمض.
يتمثل رد الفعل النوعي لكبريتات أيون SO 2-4 في تكوين رواسب بلورية بيضاء من BaSO 4 ، غير قابلة للذوبان في الماء والأحماض:
SO 2- 4 با 2 باسو 4
تطبيق
حمض الكبريتيك هو المنتج الأكثر أهمية في الصناعة الكيميائية الرئيسية العاملة في مجال إنتاج المواد غير
الأحماض العضوية والقلويات والأملاح والأسمدة المعدنية والكلور.
لمجموعة متنوعة من التطبيقات حمض الكبريتيك في المرتبة الأولى بين الأحماض. تستهلك أكبر كمية منه للحصول على الأسمدة الفوسفاتية والنيتروجينية. كونه غير متطاير ، يستخدم حمض الكبريتيك لإنتاج الأحماض الأخرى - الهيدروكلوريك ، الهيدروفلوريك ، الفوسفوريك والخليك.
يذهب الكثير منها لتنقية المنتجات البترولية - البنزين والكيروسين وزيوت التشحيم - من الشوائب الضارة. في الهندسة الميكانيكية ، يقوم حمض الكبريتيك بتنظيف السطح المعدني من الأكاسيد قبل الطلاء (طلاء النيكل ، الطلاء بالكروم ، إلخ). يستخدم حمض الكبريتيك في صناعة المتفجرات والألياف الصناعية والأصباغ والبلاستيك وغيرها الكثير. يتم استخدامه لملء البطاريات.
أملاح حمض الكبريتيك مهمة.
^ كبريتات الصوديوميتبلور Na 2 SO 4 من المحاليل المائية في شكل هيدرات Na 2 SO 4 10H 2 O ، والذي يسمى ملح Glauber. يتم استخدامه في الطب كملين. كبريتات الصوديوم اللامائية تستخدم في صناعة الصودا والزجاج.
^ كبريتات الأمونيوم(NH 4) 2 SO 4 - الأسمدة النيتروجينية.
كبريتات البوتاسيومK 2 SO 4 - سماد البوتاس.
كبريتات الكالسيوم يوجد CaSO 4 في الطبيعة في شكل معدن الجبس CaSO 4 2H 2 O. عند تسخينه إلى 150 درجة مئوية ، فإنه يفقد بعض الماء وينتقل إلى هيدرات 2CaSO 4 H 2 O ، يسمى الجبس المحترق ، أو المرمر. عندما تخلط مع الماء في كتلة فطيرة ، تصلب المرمر مرة أخرى بعد بعض الوقت ، وتتحول إلى CaSO 4 2H 2 O. يستخدم الجبس على نطاق واسع في البناء (الجص).
كبريتات المغنيسيومتم العثور على MgSO 4 في مياه البحر ، مما تسبب في مذاقه المر. هيدرات بلورية ، تسمى الملح المر ، تستخدم كمسهل.
نقد لاذع- الاسم التقني للهيدرات البلورية للكبريتات المعدنية Fe و Cu و Zn و Ni و Co (الأملاح المجففة ليست زجاجية). كبريتات النحاسCuSO 4 5H 2 O مادة سامة زرقاء. يتم رش النباتات بمحلول مخفف وتزرع البذور قبل البذر. الحديد الزاجFeSO 4 7H 2 O مادة خضراء فاتحة. يستخدم للسيطرة على آفات النباتات والأحبار والدهانات المعدنية ، إلخ. كبريتات الزنكيستخدم ZnSO 4 7H 2 O في إنتاج الأحبار المعدنية ، في سيتوبريشاتاني ، دواء.
^ 4.5. استرات حمض الكبريتيك. ثيوسلفات الصوديوم
استرات حمض الكبريتيك تشمل كبريتات الديالكيل (RO 2) SO 2. هذه هي السوائل الغليان عالية. أقل للذوبان في الماء. في وجود القلويات ، يتم تشكيل الكحول وأملاح حمض الكبريتيك. كبريتات الديالكيل السفلى هي عوامل مؤلكلة.
كبريتات الإيثيل(C 2 H 5) 2 SO 4. نقطة انصهار -26 درجة مئوية ، نقطة الغليان 210 درجة مئوية ، قابلة للذوبان في الكحول ، غير قابلة للذوبان في الماء. تم الحصول عليها عن طريق تفاعل حمض الكبريتيك مع الإيثانول. هو العامل الإيثيلي في التخليق العضوي. تخترق الجلد.
ثنائي ميثيل سلفات(CH 3) 2 SO 4. درجة انصهار -26.8 درجة مئوية ، نقطة الغليان 188.5 درجة مئوية. قابل للذوبان في الكحول ، سيئة - في الماء. يتفاعل مع الأمونيا في غياب المذيبات (مع انفجار) ؛ الكبريت بعض المركبات العطرية ، مثل استرات الفينول. يتم الحصول عليها بتفاعل 60٪ من الزيت مع الميثانول عند 150 درجة مئوية. إنه عامل ميثيل في التوليف العضوي. مادة مسرطنة ، تصيب العينين والجلد وأعضاء الجهاز التنفسي.
^ ثيوسلفات الصوديوم Na 2 S 2 O 3
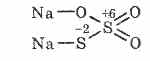
ملح حامض الثيوريكوريك الذي به ذرتان كبريتان لهما حالة أكسدة مختلفة: 6 و -2. مادة بلورية ، قابلة للذوبان في الماء بشكل جيد. متوفر في شكل بلوري Na 2 S 2 O 3 5H 2 O ، يشار إليه عادة باسم هيبوسلفيت. تم الحصول عليها من تفاعل كبريتيت الصوديوم مع الكبريت أثناء الغليان:
Na 2 SO 3 S = Na 2 S 2 O 3
مثل حمض الثيوريكوريك ، إنه عامل اختزال قوي ، إنه يتأكسد بسهولة بواسطة الكلور إلى حمض الكبريتيك:
Na 2 S 2 O 3 4Cl 2 5H 2 O = 2H 2 SO 4 2NaCl 6HCl
اعتمد استخدام ثيوسلفات الصوديوم لامتصاص الكلور (في أقنعة الغاز الأولى) على هذا التفاعل.
الأكسدة مختلفة قليلا يحدث ثيوكبريتات الصوديوم عوامل مؤكسدة ضعيفة. هذا يشكل أملاح حمض التتراثيونيك ، على سبيل المثال:
2Na 2 S 2 O 3 I 2 = Na 2 S 4 O 6 2NaI
ثيوسلفات الصوديوم هو منتج ثانوي في إنتاج NaHSO 3 ، أصباغ الكبريت ، في تنقية الغازات الصناعية من الكبريت. يتم استخدامه لإزالة آثار الكلور بعد تبييض الأقمشة ، لاستخراج الفضة من الخامات ؛ هو مادة مثبتة في التصوير الفوتوغرافي ، وهي كاشف في قياس الميل ، وهو ترياق للتسمم بمركبات الزرنيخ ، والزئبق ، وهو عامل مضاد للالتهابات.
يقع العنصر الكيميائي للكبريت في مجموعة VIА ، الفترة 3 PSCE. يوجد على الإلكترون الخارجي لذرة الكبريت 6 إلكترونات. يظهر خواص العامل المؤكسد في تكوين المواد مع المعادن والهيدروجين ، يكتسب الكبريت حالة الأكسدة -2 (يأخذ إلكترونين).
في تكوين المركبات المحتوية على الأكسجين ، يعرض الكبريت حالات أكسدة +4 و +6. وهكذا ، يتميز الكبريت بحالات الأكسدة -2 ؛ 0؛ (4)؛ 6.
في الطبيعة ، يوجد الكبريت في حالته الأصلية وفي تكوين المعادن. على سبيل المثال ، يحتوي الكبريت على لمعان الرصاص (المكون الرئيسي هو كبريتيد الرصاص PbS) ومعان النحاس (المكون الرئيسي هو كبريتيد النحاس Cu 2 S).
الكبريت يشكل بعض المواد البسيطة - تعديلات متآثر. الكبريت المعين هو الأكثر استقرارا في درجة حرارة الغرفة (الشكل 1). هذه المادة تتكون من جزيئات S 8. الكبريت المعين أصفر ويذوب عند درجة حرارة + 112.8 درجة مئوية.
التين. 1. المعينية تعديل الكبريت
عند تسخينها ، يتحول الكبريت المعيني تدريجياً إلى كتلة بنية داكنة لزجة. هذا هو آخر تعديل allotropic من الكبريت - الكبريت البلاستيك. يتكون الكبريت البلاستيكي من جزيئات الكبريت الخطية S n.
يلعب الكبريت في التفاعلات الكيميائية مع المعادن والهيدروجين دور عامل مؤكسد. تنخفض درجة الأكسدة من 0 إلى -2. في التفاعل مع الأكسجين ، يعمل الكبريت كعامل اختزال ، مما يزيد من درجة أكسده من 0 إلى +4.
النظر في أمثلة من التفاعلات التي تنطوي على الكبريت.
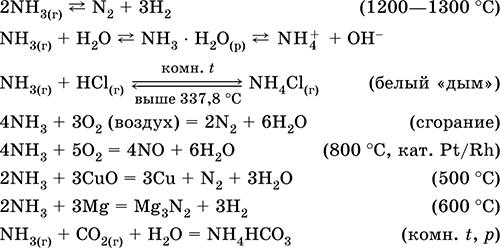
عندما يتفاعل الكبريت مع الهيدروجين ، يتشكل كبريتيد الهيدروجين:
عندما يتفاعل الزنك مع الكبريت ، يتشكل كبريتيد الزنك:
يحترق الكبريت في الأكسجين مع تكوين أكسيد الكبريت (IV) (الشكل 2):

التين. 2. حرق الكبريت في الأكسجين
النظر في خصائص مركبات الكبريت مع حالة الأكسدة "-2". وتشمل هذه المركبات كبريتيد الهيدروجين والكبريتيد - أملاح حمض كبريتيد الهيدروجين.
كبريتيد الهيدروجين هو غاز برائحة البيض الفاسد. يحترق في الهواء. علاوة على ذلك ، مع نقص الأكسجين وفائضه ، يستمر الاحتراق بشكل مختلف.
في كمية زائدة من الأكسجين ، يحترق كبريتيد الهيدروجين ليشكل أكسيد الكبريت (IV) والمياه:
2H 2 S + 3O 2 = 2SO 2 + 2H 2 O.
مع نقص الأكسجين ، يحدث احتراق غير كامل لكبريتيد الهيدروجين مع إطلاق الكبريت: 2H 2 S + O 2 = 2S + 2H 2 O.
كبريتيد الهيدروجين عالي الذوبان في الماء. الحل الناتج هو حمض كبريتيد الهيدروجين الضعيف. تسمى أملاح كبريتيد الهيدروجين كبريتيد. يدخل حمض الهيدروفلوريك والكبريتيدات القابلة للذوبان في الماء في تفاعلات التبادل.
يشكل تفاعل حمض كبريتيد الهيدروجين وكلوريد النحاس (II) كلوريد النحاس غير القابل للذوبان (II) وحمض الهيدروكلوريك: H 2 S + CuCl 2 = CuS + 2HCl.
عندما يتفاعل كبريتيد البوتاسيوم مع نترات الزنك ، تترسب كبريتيد الزنك وتتشكل نترات البوتاسيوم: K 2 S + Zn (NO 3) 2 = ZnS + 2 KNO 3.
مراجع
- Orzhekovsky P.A. مجموعة من المهام والتمارين في الكيمياء: الصف التاسع: في الكتاب المدرسي P.A. Orzhekovsky وغيرها. "الكيمياء. الصف 9 / سنة Orzhekovsky، N.A. تيتوف ، ف. هيغل. - M: AST: Astrel ، 2007. (ص 91-97)
- Orzhekovsky P.A. الكيمياء: الصف التاسع: دراسات. للصورة العامة. المعمول بها. / P.A. أورزيكوفسكي ، إل إم Meshcheryakova، L.S. Pontak. - M: AST: Astrel ، 2007. (§ 34)
- Orzhekovsky P.A. الكيمياء: الصف التاسع: دراسات عامة. المعمول بها. / P.A. أورزيكوفسكي ، إل إم ميشرياكوفا ، م. Shalashova. - M: Astrel ، 2013. (§§ 20 ، 21)
- رودزيت جي الكيمياء: neorgan. الكيمياء. سلطة. كيمياء: دراسات. ل 9 cl. / ج. رودزيتيس ، ف. فيلدمان. - م: التعليم ، موسكو للكتب المدرسية ، 2009.
- خومتشينكو مجموعة من المهام والتمارين في الكيمياء للمدرسة الثانوية. - م.: ريا "الموجة الجديدة": الناشر أومرينكوف ، 2008.
- موسوعة للأطفال. المجلد 17. الكيمياء / الفصل. إد. VA فولودين ، Ved. العلمية. إد. أنا لينسون. - م: أفانتا + ، 2003.
- مجموعة واحدة من الموارد التعليمية الرقمية (تجارب الفيديو حول الموضوع) ().
- النسخة الإلكترونية لمجلة "الكيمياء والحياة" ().
الواجب المنزلي
- أ. 136 رقم 3 ؛ ص .140 №№ 2-4 من الكتاب المدرسي P.A. Orzhekovsky "الكيمياء: الصف التاسع" / P.A. أورزيكوفسكي ، إل إم ميشرياكوفا ، م. Shalashova. - M: Astrel ، 2013.
كبريتيد (من الكبريت اللات ، الكبريت - الكبريت)
مركبات الكبريت مع عناصر أكثر إيجابية ؛ يمكن اعتبارها أملاح حمض كبريتيد الهيدروجين (انظر حمض كبريتيد الهيدروجين) H 2 S. يوجد سلسلتان C: المتوسط (الطبيعي) للصيغة العامة M 2 S والحمض (hydrosulfides) من الصيغة العامة MHS ، حيث M عبارة عن معدن أحادي التكافؤ. C. المعادن القلوية عديمة اللون ، قابلة للذوبان في الماء. المحاليل المائية لها تحلل وقلوية للغاية. تحت تأثير الأحماض المخففة تنبعث من H 2 S. C. المعادن الأرضية القلوية عديمة اللون ، قابلة للذوبان في الماء قليلاً. ينبعث H 2 S في الهواء الرطب ، وتشبه الخصائص الأخرى المعادن S. القلوية. كل من هؤلاء وغيرهم S. يتأكسد بسهولة إلى الكبريتات. C. المعادن الثقيلة غير قابلة للذوبان عمليا في الماء. جميعها تقريبا سوداء أو سوداء اللون البني (باستثناء ZnS الأبيض ، MnS الوردي ، CdS الأصفر ، البرتقالي الأحمر Sb 2 S 3 ، الأصفر SnS 2). يتم استخدام نسبة غير متساوية من C. إلى الأحماض و C. الأمونيوم في التحليل الكيميائي. ايك مالينا.
الموسوعة السوفيتية الكبرى. - م: الموسوعة السوفيتية. 1969-1978 .
تعرف على "الكبريتيدات" الموجودة في القواميس الأخرى:
مركبات الكبريت مع المعادن وبعضها غير المعادن. الكبريتيدات المعدنية هي أملاح حمض كبريتيد الهيدروجين H2S: متوسطة (على سبيل المثال ، Na2S) وحمضية ، أو هيدروكلوريد (NaHS). عن طريق حرق الكبريتيدات الطبيعية ، يتم الحصول على المعادن غير الحديدية و SO2. كبريتيد الفوسفور و ... قاموس موسوعي كبير
الموسوعة الحديثة
كبريتيد - الكبريتات والكبريتيدات غير العضوية لمركبات الكبريت مع المعادن وبعضها غير المعادن. المدرجة في خامات الكبريتيد. تستخدم الفوسفور (على سبيل المثال ، CdS ، ZnS). كبريتيد الموليبدينوم ، ومواد التشحيم الصلبة التيتانيوم. كبريتيد الفوسفور ... ... قاموس موسوعي مصور
- (خط جديد ، من اللاتينية. كبريت الكبريت). مركبات بعض الجسم بالكبريت ، تقابل أكاسيد أو أحماض. قاموس الكلمات الأجنبية المدرجة في اللغة الروسية. Chudinov ، AN ، 1910. SULFIDES Novolatinsk. ، From Lat. الكبريت والكبريت. اتصال ... ... معجم الكلمات الأجنبية للغة الروسية
1. مركبات الكبريت الطبيعية للمعادن وبعضها غير المعادن. في المادة الكيميائية تعتبر العلاقة كأملاح حمض كبريتيد الهيدروجين H2S. هناك عدد من العناصر التي تشكل polysulfides مع الكبريت ، وهي أملاح حمض الكبريت بولي H2Sx. الرئيسية ... ... الموسوعة الجيولوجية
كبريتيد - - مركبات الكبريت مع المعادن وبعضها غير المعادن ؛ أملاح كبريتيد المعادن من حمض كبريتيد الهيدروجين H2S. [قاموس المصطلحات للخرسانة والخرسانة المسلحة. FSUE "SIC" Construction "NIIZHB and A. A. Gvozdeva Metro station، Moscow، 2007. 110 p.] ... ... موسوعة المصطلحات والتعاريف والشروحات لمواد البناء
الكبريت ، ق ، ش كبريتيد ، زوج (المواصفات). المركبات الكيميائية للكبريت مع المعادن وبعض المعادن غير المعدنية. العضوية مع ق الطبيعية. | صفة. كبريتيد ، أوه ، أوه. قاموس Ozhegova. SI أوزيجوف ، نويو شفيدوفا. 1949 1992 ... قاموس Ozhegova
يتم الحصول بسهولة على الكبريتيدات ، R2S (جذرية عطرية) ، عن طريق إضافة محلول من أملاح الديازو إلى 60 70 ... موسوعة بروكهاوس وإيفرون
كبريتيد - (1) في الكيمياء غير العضوية ، مثل مركبات العناصر التي تحتوي على الكبريت ، والتي يكون لذرات الكبريت فيها حالة أكسدة قدرها 2. في المادة الكيميائية. تعتبر العلاقة كأملاح حمض كبريتيد الهيدروجين الضعيف (محلول مائي من H2S). العديد من S. طبيعية ... ... موسوعة البوليتكنيك الكبرى
الصورة. رر. (وحدات الكبريتيد ، و ؛ م.). [من اللات. كبريت الكبريت]. مركبات الكبريت مع المعادن وبعضها غير المعادن. C. التيتانيوم. العضوية مع ق الطبيعية. (فئة المعادن). ◁ كبريتيد ، ث ، أوه. مع مخاليط مختلطة. من خام الخام. * * * كبريتيد مركبات الكبريت ... القاموس الموسوعي
- (من الكبريت اللاتيني اللاتيني) هي فئة من المركبات الكيميائية التي هي مركبات معدنية (وكذلك عدد من المعادن غير الفلزية B و Si و P و As) مع الكبريت (S) ، حيث توجد حالة أكسدة فيها of2. يمكن اعتبارها أملاح كبريتيد الهيدروجين ... ويكيبيديا
الكتب
- رواسب اليورانيوم من نوع الخلاف في Phanerozoic ، أندريه بوريسوفيتش خاليزوف. يتم النظر في ميزات رواسب اليورانيوم في هياكل وادي نهر بالي على أسطح الخلاف الهيكلي والرقيقي على مثال ثلاث مناطق في منطقة الأورال مع اختلاف ...
كبريت - يشير عنصر الفترة الثالثة ومجموعة VIA للنظام الدوري ، الرقم التسلسلي 16 ، إلى كالكوجين. الصيغة الإلكترونية للذرة [10 Ne] 3s 2 3p 4 ، حالات الأكسدة المميزة 0 و ،II و + IV و + VI ، تعتبر الحالة S VI مستقرة.
مقياس أكسدة الكبريت:
تبلغ القدرة الكهربية للكبريت 2.60 ، وهي تتميز بخصائص غير معدنية. في مركبات الهيدروجين والأكسجين الموجودة في الأنيونات المختلفة ، فهي تشكل أحماض تحتوي على الأكسجين وأملاحها ، مركبات ثنائية.
في الطبيعة - الخامس عشر عنصر الانتشار الكيميائي (السابع بين غير المعادن). تم العثور عليه في شكل مجاني (أصلي) وما يتعلق به. عنصر حيوي للكائنات الحية الأعلى.
الكبريت مادة بسيطة. الأصفر البلوري (ألفا المعيني و β أحادي الميل ،
في 95.5 درجة مئوية) أو غير متبلور (البلاستيك). توجد في مواقع الشبكة جزيئات S 8 (دورات من نوع "كورونا" غير مستوية) ، ويتكون الكبريت غير المتبلور من سلاسل S n. مادة انصهار منخفضة ، تمر لزوجة السائل بحد أقصى عند 200 درجة مئوية (فجوة الجزيئات S 8 ، تشابك السلاسل S n). في زوج - جزيئات S 8 ، S 6 ، S 4 ، S 2. عند 1500 درجة مئوية ، يظهر الكبريت أحادي الذرة (في المعادلات الكيميائية للبساطة ، يتم تمثيل أي كبريت باسم S).
لا يذوب الكبريت في الماء وفي الظروف العادية لا يتفاعل معه ، فهو قابل للذوبان جيدًا في ثاني كبريتيد الكربون CS 2.
للكبريت ، خاصة المسحوق ، نشاط كبير عند تسخينه. يتفاعل كعامل مؤكسد مع المعادن وغير المعدنية:
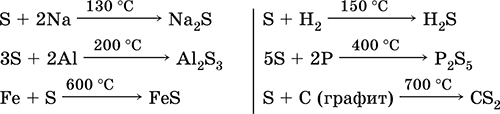
ماذا عن وكيل الحد - مع الفلور والأكسجين والأحماض (عند الغليان):
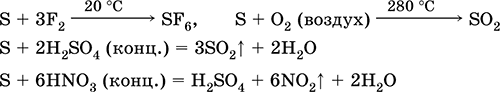
الكبريت يتعرض للتشويش في المحاليل القلوية:
3S 0 + 6KOH (conc.) = 2K 2 S ‑II + K 2 S IV O 3 + 3H 2 O
في درجات الحرارة المرتفعة (400 درجة مئوية) يحل الكبريت محل اليود من يوديد الهيدروجين:
S + 2НI (g) = I 2 + H 2 S ،
ولكن في حل رد الفعل يذهب في الاتجاه المعاكس:
I 2 + H 2 S (p) = 2 HI + S ↓
استقبال: في صناعة يتم صهره من الرواسب الطبيعية للكبريت الأصلي (باستخدام بخار الماء) ، الذي يتم إطلاقه أثناء إزالة الكبريت من منتجات تغويز الفحم.
يستخدم الكبريت لتوليف ثاني كبريتيد الكربون ، وحمض الكبريتيك ، والأصباغ الكبريتية (vat) ، في عملية الفلكنة من المطاط ، كوسيلة لحماية النباتات من البياض الدقيقي ، ولعلاج الأمراض الجلدية.
كبريتيد الهيدروجين H 2 S. حمض الأكسجين الخالي. غاز عديم اللون ذو رائحة خانقة ، أثقل من الهواء. يحتوي الجزيء على هيكل رباعي الاسطح غير مكتمل مزدوج [:: S (H) 2]
(sp 3 - تهجين ، زاوية مقبس H - S - H بعيدة عن رباعي السطوح). غير مستقر عند تسخينه فوق 400 درجة مئوية وهو قابل للذوبان في الماء قليلاً (2.6 لتر / 1 لتر من H 2 O عند 20 درجة مئوية) ، وهو محلول مشبع يكون عشري (0.1 متر ، "ماء كبريتيد الهيدروجين"). حمض ضعيف للغاية في المحلول ، لا ينفصل عملياً في المرحلة الثانية عن أيونات S 2 (أقصى تركيز لـ S 2 -1 يساوي 1 10–13 مول / لتر). عند الوقوف في الهواء ، يصبح المحلول غائمًا (مثبط - سكروز). يتم تحييده بواسطة القلويات ، وليس بالكامل - بواسطة هيدرات الأمونيا. وكيل تخفيض قوي. يدخل في تفاعلات التبادل الأيوني. عامل الكبريتات ، يترسب من محلول الكبريتيدات ذات الألوان المختلفة مع قابلية ذوبان منخفضة للغاية.
ردود الفعل النوعية - ترسيب الكبريتيدات ، وكذلك الاحتراق غير الكامل لـ H2S مع تكوين رواسب كبريتية صفراء على جسم بارد يدخل في اللهب (ملعقة خزفية). منتج ثانوي لتكرير البترول والغاز الطبيعي وفحم الكوك.
يتم استخدامه في إنتاج الكبريت ، والمركبات التي تحتوي على الكبريت غير العضوي والعضوي ككاشف تحليلي. سام للغاية. معادلات أهم التفاعلات:
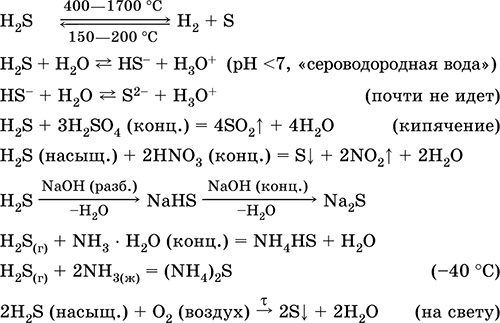

استقبال: في صناعة - التوليف المباشر:
H 2 + S = ح 2 ق(150-200 درجة مئوية)
أو عن طريق تسخين الكبريت مع البارافين.
في مختبر - إزاحة الكبريتيدات بأحماض قوية
FeS + 2НCl (conc.) = FeCl 2 + ح 2 ق
أو التحلل المائي الكامل للمركبات الثنائية:
Al 2 S 3 + 6H 2 O = 2Al (OH) 3 ↓ + 3 ح 2 ق
كبريتيد الصوديوم Na 2 S. ملح خال من الأكسجين. أبيض ، استرطابي جدا. يذوب دون تحلل ، مستقرة حراريا. يذوب في الماء جيدًا ، ويتحلل بواسطة أنيون ، ويخلق وسطًا قلويًا للغاية في المحلول. عند الوقوف في الهواء ، يصبح المحلول غائمًا (الكبريت الغروي) ويتحول إلى اللون الأصفر (صبغة polysulfide). وكيل الحد النموذجي. يعلق الكبريت. يدخل في تفاعلات التبادل الأيوني.
ردود الفعل النوعية على أيون S 2‑– ترسب كبريتيد المعادن الملونة المختلفة ، والتي تتحلل MnS ، FeS ، ZnS إلى HCl (s).
يتم استخدامه في إنتاج أصباغ الكبريت والسليلوز ، لإزالة شعر الجلود أثناء دباغة الجلود ، كمادة كاشف في الكيمياء التحليلية.
معادلات أهم التفاعلات:
Na 2 S + 2НCl (ديسمبر) = 2NaCl + H 2 S
Na 2 S + 3H 2 SO 4 (conc.) = SO 2 + S ↓ + 2H 2 O + 2NaHSO 4 (حتى 50 درجة مئوية)
Na 2 S + 4HNO 3 (conc.) = 2NO + S ↓ + 2H 2 O + 2NaNO 3 (60 ° C)
Na 2 S + H 2 S (السبت) = 2NaHS
Na 2 S (t) + 2O 2 = Na 2 SO 4 (أعلى من 400 درجة مئوية)
Na 2 S + 4H 2 O 2 (conc.) = Na 2 SO 4 + 4H 2 O
S 2‑ + M 2+ = MnS (عريف) ↓؛ FeS (أسود) ↓ ؛ ZnS (أبيض) ↓
S 2‑ + 2Ag + = Ag 2 S (أسود) ↓
S 2‑ + M 2+ = CdS (أصفر) ↓؛ PbS ، CuS ، HgS (أسود) ↓
3S 2‑ + 2Bi 3+ = Bi 2 S 3 (corr. - أسود) ↓
3S 2‑ + 6H 2 O + 2M 3+ = 3H 2 S + 2M (OH) 3 ↓ (M = Al، Cr)
استقبال في صناعة - تكليس المعادن mirabilite Na 2 SO 4 10H 2 O في وجود عوامل الاختزال:
Na 2 SO 4 + 4H 2 = Na 2 S + 4H 2 O (500 درجة مئوية ، القط. Fe 2 O 3)
Na 2 SO 4 + 4C (فحم الكوك) = Na 2 S + 4CO (800-1000 درجة مئوية)
Na 2 SO 4 + 4CO = Na 2 S + 4СO 2 (600–700 درجة مئوية)
كبريتيد الألومنيوم Al 2 S 3. ملح خال من الأكسجين. الأبيض ، رابطة آل س تسود في الغالب. يذوب بدون تحلل تحت الضغط الزائد N 2 ، يتم تسخينه بسهولة. يتأكسد في الهواء عندما المكلس. تحلل بالكامل بالماء ، لا يترسب من المحلول. تتحلل بواسطة الأحماض القوية. يتم استخدامه كمصدر صلب لكبريتيد الهيدروجين النقي. معادلات أهم التفاعلات:
Al 2 S 3 + 6H 2 O = 2Al (OH) 3 ↓ + 3H 2 S (محض)
Al 2 S 3 + 6НCl (ديسمبر) = 2AlCl 3 + 3H 2 S
Al 2 S 3 + 24HNO 3 (conc.) = Al 2 (SO 4) 3 + 24NO 2 + 12H 2 O (100 ° C)
2Al 2 S 3 + 9O 2 (الهواء) = 2Al 2 O 3 + 6SO 2 (700-800 درجة مئوية)
استقبال: تفاعل الألومنيوم مع الكبريت المنصهر في غياب الأكسجين والرطوبة:
2Al + 3S = AL 2 S 3(150-200 درجة مئوية)
الحديد (II) كبريتيد FeS. ملح خال من الأكسجين. الأسود والرمادي مع لون أخضر ، الحرارية ، تتحلل عند تسخينها في فراغ. في الحالة الرطبة حساسة للأكسجين في الهواء. غير قابلة للذوبان في الماء. لا تترسب عند تشبع محاليل أملاح الحديد (II) بكبريتيد الهيدروجين. تتحلل بواسطة الأحماض. يتم استخدامه كمادة خام في إنتاج الحديد ، وهو مصدر صلب لكبريتيد الهيدروجين.
مركب الحديد (III) تكوين Fe 2 S 3 غير معروف (غير مستلم).
معادلات أهم التفاعلات:
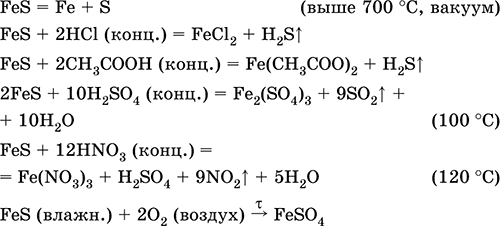
تلقي:
Fe + S = فاس (600 درجة مئوية)
Fe 2 O 3 + H 2 + 2H 2 S = 9 فاس + 3H 2 O (700-1000 درجة مئوية)
FeCl 2 + 2NH 4 HS (g) = فاس ↓ + 2NH 4 Cl + H 2 S
ثاني كبريتيد الحديد FeS 2. اتصال ثنائي. لديها هيكل أيوني Fe 2+ (–S - S–) 2‑. الأصفر الداكن ، مستقرة حراريا ، يتحلل عند الاشتعال. غير قابلة للذوبان في الماء ، لا يتفاعل مع الأحماض المخففة ، القلويات. تتحلل بواسطة عوامل مؤكسدة للحمض ، محمصة في الهواء. يتم استخدامه كمادة خام في إنتاج الحديد والكبريت وحمض الكبريتيك ، وهو محفز في التخليق العضوي. في الطبيعة - خام المعادن البيريت معدن و mARCASITE.
معادلات أهم التفاعلات:
FeS 2 = FeS + S (أعلى من 1170 درجة مئوية ، فراغ)
2FeS 2 + 14H 2 SO 4 (conc. ، الجبال) = Fe 2 (SO 4) 3 + 15SO 2 + 14Н 2 O
FeS 2 + 18HNO 3 (conc.) = Fe (NO 3) 3 + 2H 2 SO 4 + 15NO 2 + 7H 2 O
4FeS 2 + 11O 2 (الهواء) = 8SO 2 + 2Fe 2 O 3 (800 درجة مئوية ، تحميص)
هيدروكلوريد الأمونيوم NH 4 HS. ملح حامض خالي من الأكسجين. أبيض ، ذاب تحت الضغط. متقلبة للغاية وغير مستقرة حرارياً. يتأكسد على الهواء. يذوب في الماء جيدًا ، ويتحلل بواسطة الكاتيون والأنيون (يسود) ، ويخلق بيئة قلوية. يتحول المحلول إلى اللون الأصفر في الهواء. تتحلل بواسطة الأحماض ، في محلول مشبع يضيف الكبريت. لا يتم تحييد القلويات ، ولا يوجد الملح الأوسط (NH 4) 2 S في المحلول (للاطلاع على شروط الحصول على الملح الأوسط ، انظر العنوان "H 2 S"). يتم استخدامه كمكون لمطوري الصور ، ككاشف تحليلي (مرسب الكبريتيد).
معادلات أهم التفاعلات:
NH 4 HS = NH 3 + H 2 S (أعلى من 20 درجة مئوية)
NH 4 HS + HCl (ديسمبر) = NH 4 Cl + H 2 S
NH 4 HS + 3HNO 3 (conc.) = S ↓ + 2NO 2 + NH 4 NO 3 + 2H 2 O
2NH 4 HS (sat. H 2 S) + 2CuSO 4 = (NH 4) 2 SO 4 + H 2 SO 4 + 2CuS ↓
استقبال: تشبع المحلول المركز لـ NH 3 مع كبريتيد الهيدروجين:
NH 3 H 2 O (conc.) + H 2 S (g) = NH 4 HS + H 2 O
في الكيمياء التحليلية ، يُعتبر محلول يحتوي على كميات متساوية من NH 4 HS و NH 3 H 2 O تقليديًا محلول لـ (NH 4) 2 S ويتم استخدام صيغة الملح المتوسطة في كتابة معادلات التفاعل ، على الرغم من أن كبريتيد الأمونيوم يتحلل بالكامل في الماء إلى NH 4 HS و NH 3 س 2 س.
ثاني أكسيد الكبريت. الكبريتيت
ثاني أكسيد الكبريت SO 2. أكسيد الحمض. غاز عديم اللون ذو رائحة نفاذة. يحتوي الجزيء على بنية مثلث غير مكتمل [: S (O) 2] (sp 2 - تهجين) ، يحتوي على σ ، π - روابط S = O. المسال بسهولة ، مستقرة حراريا. قابل للذوبان في الماء (~ 40 لتر / 1 لتر من H 2 O عند 20 درجة مئوية). يشكل polyhydrate مع خصائص حمض ضعيف ، ونواتج التفكك - أيونات HSO 3 - و SO 3 2−. أيون HSO 3 - له شكلان tautomeric - متماثل (غير الحمضية) مع هيكل رباعي الاسطح (sp 3 - التهجين) ، الذي يسود في الخليط ، و لا متماثل (الحمضية) مع هيكل رباعي الاسطح غير مكتملة [: S (O) 2 (OH)] (sp 3 - التهجين). أيون SO 3 2‑ هو أيضا رباعي السطوح [: S (O) 3].
يتفاعل مع القلويات ، هيدرات الأمونيا. وكيل الحد النموذجي ، وكيل مؤكسد ضعيف.
رد فعل نوعي - تلون الأصفر والبني "ماء اليود". وسيطة في إنتاج الكبريتات وحمض الكبريتيك.
يتم استخدامه لتبييض الصوف والحرير والقش ، والحفاظ على وتخزين الفواكه ، كمطهر ، مضاد للأكسدة ، سائل التبريد. سامة.
مركب H 2 SO 3 (حمض الكبريتيك) غير معروف (غير موجود).
معادلات أهم التفاعلات:
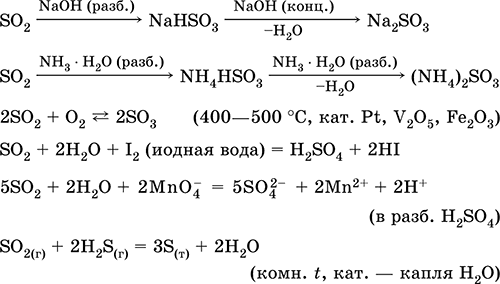
الذوبان في الماء والخصائص الحمضية:
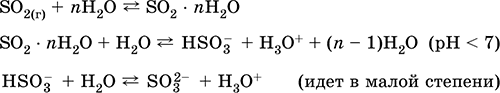
استقبال: في الصناعة - حرق الكبريت في الهواء المخصب بالأكسجين ، وبدرجة أقل تحميص خامات الكبريتيد (SO 2 - الغاز المصاحب أثناء تحميص البايرايت):
S + O 2 = SO 2(280-360 درجة مئوية)
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8 SO 2(800 درجة مئوية ، تحميص)
في المختبر - إزاحة الكبريتات مع حمض الكبريتيك:
BaSO 3 (t) + H 2 SO 4 (conc.) = BaSO 4 ↓ + SO 2 + H 2 O
كبريتيت الصوديوم Na 2 SO 3. Oksosol. الأبيض. عند تسخينها في الهواء تتحلل دون ذوبان ، يذوب تحت ضغط الأرجون الزائد. في الحالة الرطبة وفي محلول حساس للأكسجين في الهواء. قابل للذوبان في الماء ، تحلل بواسطة أنيون. تتحلل بواسطة الأحماض. وكيل الحد النموذجي.
رد فعل نوعي على أيون SO 3 2‑ - تشكيل راسب أبيض من كبريتات الباريوم ، والذي يتم نقله إلى المحلول مع أحماض قوية (حمض الهيدروكلوريك ، HNO 3).
يتم استخدامه بمثابة كاشف في الكيمياء التحليلية ، وهو مكون من حلول التصوير الفوتوغرافي ، ومحايد الكلور في تبييض الأقمشة.
معادلات أهم التفاعلات:
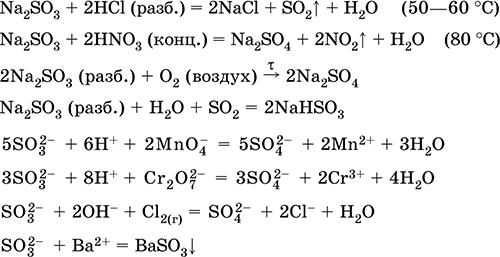
تلقي:
Na 2 CO 3 (conc.) + SO 2 = نا 2 SO 3 + CO 2
حمض الكبريتيك. الكبريتات
حامض الكبريتيك H 2 SO 4. حمض الأكسويك. السائل عديم اللون ، لزج جدا (الزيتية) ، استرطابي للغاية. يحتوي الجزيء على هيكل رباعي السطوح مشوه (تهجين ثلاثي الأبعاد) ، ويحتوي على روابط تساهمية - - روابط S - OH و σπ - روابط S = O. يحتوي أيون SO 4 2‑ على هيكل رباعي السطوح بشكل صحيح. لديها نطاق درجة حرارة واسع للحالة السائلة (~ 300 درجة). عندما يسخن فوق 296 درجة مئوية فإنه يتحلل جزئيا. يتم تقطيره كخليط أزيوتروبي بالماء (الكسر الجماعي للحمض هو 98.3٪ ، نقطة الغليان 296-340 درجة مئوية) ، تتحلل تمامًا مع تسخين أقوى. يمزج غير محدود مع الماء (مع قوي إكسو-effect). حمض قوي في محلول ، معادل بواسطة هيدرات القلويات والأمونيا. يحول المعادن إلى الكبريتات (مع وجود فائض من الحمض المركز في ظل الظروف العادية ، يتم تشكيل هيدروولفات قابلة للذوبان) ، لكن المعادن Be و Bi و Co و Fe و Mg و Nb يتم تخميلها في الحمض المركّز ولا تتفاعل معه. تتفاعل مع أكاسيد وهيدروكسيدات أساسية ، تتحلل أملاح الأحماض الضعيفة. مؤكسد ضعيف في محلول مخفف (بسبب H I) ، قوي - في محلول مركّز (بسبب S VI). يذوب البئر SO 3 ويتفاعل معه (يتشكل سائل زيتي كثيف - زيت، يحتوي على H 2 S 2 O 7).
رد فعل نوعي على SO 4 2 ‑ - ترسيب كبريتات الباريوم البيضاء BaSO 4 (لا يتم تحويل الراسب إلى محلول من أحماض الهيدروكلوريك والنتريك ، على عكس الترسبات البيضاء BaSO 3).
يتم استخدامه في إنتاج الكبريتات ومركبات الكبريت الأخرى والأسمدة المعدنية والمتفجرات والأصباغ والأدوية ، في التركيب العضوي ، من أجل "فتح" (المرحلة الأولى من المعالجة) من الخامات والمعادن المهمة صناعياً ، في تكرير المنتجات البترولية ، والتحليل الكهربائي للماء ، كالكهرباء من بطاريات الرصاص . سام ، يسبب حروق الجلد. معادلات أهم التفاعلات:
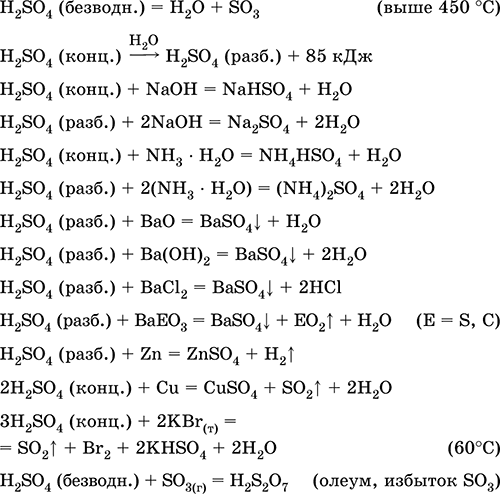
استقبال في صناعة:
أ) توليف ثاني أكسيد الكبريت من خامات الكبريت والكبريتيد وكبريتيد الهيدروجين وخامات الكبريتات:
S + O 2 (الهواء) = SO 2(280-360 درجة مئوية)
4FeS 2 + 11O 2 (الهواء) = 8 SO 2 + 2Fe 2 O 3 (800 درجة مئوية ، تحميص)
2H 2 S + 3O 2 (g) = 2 SO 2 + 2H 2 O (250-300 درجة مئوية)
CaSO 4 + С (coke) = CaO + SO 2 + CO (1300-1500 درجة مئوية)
ب) تحويل SO 2 إلى SO 3 في جهاز التلامس:
ج) تخليق حمض الكبريتيك المركز واللامائي:
H 2 O (Coll. H 2 SO 4) + SO 3 = H 2 SO 4(conc. ، anhyd.)
(لا يتم امتصاص SO 3 بواسطة الماء النقي مع إنتاج H 2 SO 4 بسبب التسخين القوي للخليط والتحلل العكسي لـ H 2 SO 4 ، انظر أعلاه) ؛
د) التوليف أوليوم - مزيج من اللامائية H 2 SO 4 ، وحمض disaric H 2 S 2 O 7 وفائض SO 3. يضمن D3 المذاب SO 3 عدم وجود ماء بدون زيت (يتم تشكيل H 2 SO 4 فور دخول الماء) ، مما يسمح بنقله بأمان في خزانات الصلب.
كبريتات الصوديوم Na 2 SO 4. Oksosol. أبيض ، استرطابي. يذوب ويغلي دون تحلل. أشكال هيدرات البلورية (المعدنية mirabilite) فقدان الماء بسهولة ؛ الاسم التقني ملح جلاوبر. قابل للذوبان في الماء ، لا يتحلل. يتفاعل مع H 2 SO 4 (conc.) ، SO 3. استعادة بواسطة الهيدروجين ، وفحم الكوك عند تسخينها. يدخل في تفاعلات التبادل الأيوني.
يستخدم في صناعة الزجاج والسليلوز والدهانات المعدنية ، كدواء. موجود في محلول ملحي من البحيرات المالحة ، ولا سيما في خليج كارا بوغاز جول في بحر قزوين.
معادلات أهم التفاعلات:
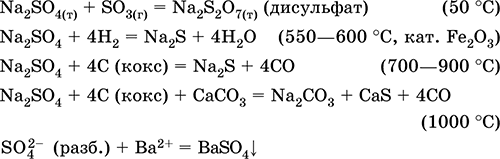
هيدروسلفات البوتاسيوم KHSO 4. ملح حامض الأكسول. أبيض ، استرطابي ، ولكن لا يشكل هيدرات بلورية. عندما يسخن يذوب ويتحلل. إنه قابل للذوبان جيدًا في الماء ، والأنيون يخضع للتفكك في المحلول ، ويكون وسط المحلول حامضًا بقوة. يتم تحييده من قبل القلويات.
يتم استخدامه كمكون للتدفقات في المعادن ، وهو جزء لا يتجزأ من الأسمدة المعدنية.
معادلات أهم التفاعلات:
2KHSO 4 = K 2 SO 4 + H 2 SO 4 (حتى 240 درجة مئوية)
2KHSO 4 = K 2 S 2 O 7 + H 2 O (320-340 درجة مئوية)
KHSO 4 (dil.) + KOH (conc.) = K 2 SO 4 + H 2 O KHSO 4 + KCl = K 2 SO 4 + HCl (450–700 درجة مئوية)
6KHSO 4 + M 2 O 3 = 2KM (SO 4) 2 + 2K 2 SO 4 + 3H 2 O (350–500 درجة مئوية ، M = Al ، Cr)
استقبال: علاج كبريتات البوتاسيوم في البرد (مع أكثر من 6O ٪) حامض الكبريتيك
K 2 SO 4 + H 2 SO 4 (conc.) = 2 KHSO 4
كبريتات الكالسيوم CaSO 4. Oksosol. الأبيض ، استرطابي جدا ، الحرارية ، يتحلل عندما المكلس. يوجد CaSO 4 الطبيعي في شكل معدن شائع جدًا جبس CaSO 4 2H 2 O. عند 130 درجة مئوية ، يفقد الجبس بعض الماء ويدخل الجص المحترق2CaSO 4 H 2 O (الاسم التقني المرمر). يستجيب الجبس المجفف بالكامل (200 درجة مئوية) للمعادن الأنهيدريتكاسو 4. يذوب قليلاً في الماء (0.206 جم / 100 غرام من H 2 O عند 20 درجة مئوية) ، وتنخفض الذوبان عند تسخينه. يتفاعل مع H 2 SO 4 (conc.). يتعافى من فحم الكوك خلال الانصهار. يعرّف معظم صلابة المياه العذبة "الثابتة" (لمزيد من التفاصيل ، انظر 9.2).
معادلات أهم التفاعلات: 100-128 درجة مئوية
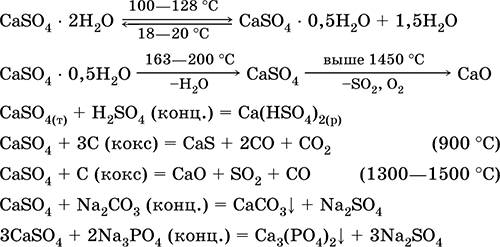
يتم استخدامه كمادة خام في إنتاج SO 2 ، H 2 SO 4 و (NH 4) 2 SO 4 ، كتدفق في المعادن ، حشو الورق. "مجموعات" الهاون ملزمة من الجبس المحترق "أسرع" من الخليط على أساس Ca (OH) 2. يتم توفير تصلب بواسطة ربط المياه ، وتشكيل الجبس في شكل كتلة حجرية. يستخدم الجبس المحترق في إنتاج قوالب الجبس والأشكال والمنتجات المعمارية والزخرفية والجدران والألواح الفاصلة والأرضيات الحجرية.
كبريتات البوتاسيوم الألومنيوم KAl (SO 4) 2. ملح مزدوج أوكسول. أبيض ، استرطابي. مع حرارة قوية تتحلل. أشكال هيدرات البلورية - الألومينا البوتاسيوم الشب. قابل للذوبان في الماء بشكل معتدل ، يتحلل بواسطة كاتيون الألومنيوم. يتفاعل مع القلويات ، هيدرات الأمونيا.
يستخدم كمورد في صباغة الأقمشة ، دباغة الجلود ، تجلط الدم في تنقية المياه العذبة ، مكون من مكونات تحجيم الورق ، وكيلا مرقئ خارجي في الطب والتجميل. يتم تشكيله من خلال التبلور المشترك لكبريتات الألومنيوم والبوتاسيوم.
معادلات أهم التفاعلات:
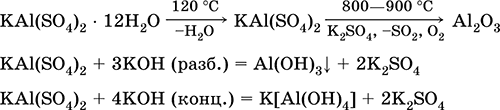
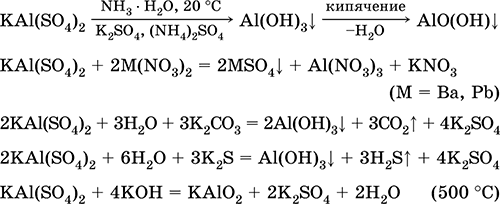
الكروم (III) كبريتات - البوتاسيوم KCr (SO 4) 2. ملح مزدوج أوكسول. الأحمر (هيدرات الأرجواني الداكن ، الاسم التقني شب البوتاسيوم). عندما تتحلل ساخنة دون ذوبان. وهو قابل للذوبان في الماء بسهولة (يتوافق اللون الرمادي والأزرق من المحلول مع أكوا كومبلكس 3+) ، ويتم تحلله بواسطة الكاتيون (III) الموجب. يتفاعل مع القلويات ، هيدرات الأمونيا. مؤكسد ضعيف وتقليل عامل. يدخل في تفاعلات التبادل الأيوني.
ردود الفعل النوعية إلى Cr 3+ ion - اختزال Cr 2+ أو الأكسدة إلى CrO 4 2‑ الأصفر.
يتم استخدامه كعامل دباغة للجلد ، ومورد في صباغة الأقمشة ، كاشف في الصورة. يتكون من تبلور الكروم (III) وكبريتات البوتاسيوم. معادلات أهم التفاعلات:
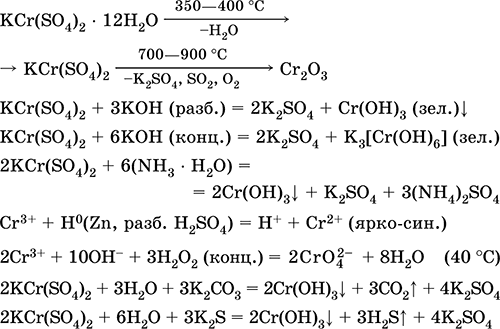
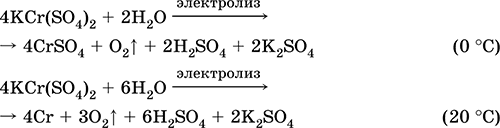
المنغنيز (II) كبريتات MnSO 4. Oksosol. أبيض ، عندما يكلس ، يذوب ويتحلل. هيدرات بلورية MnSO 4 5H 2 O - أحمر - وردي ، اسم فني المنغنيز الزاجل. إنه قابل للذوبان في الماء ، اللون الوردي الفاتح (عديم اللون تقريبًا) من المحلول يتوافق مع aquacomplex 2+ ؛ تحلل بواسطة الموجبة. يتفاعل مع القلويات ، هيدرات الأمونيا. يتفاعل عامل الاختزال الضعيف مع عوامل مؤكسدة (قوية) نموذجية.
ردود الفعل النوعية إلى Mn 2+ ion - توصيل مع MnO 4 ion واختفاء اللون البنفسجي من الأخير ، أكسدة Mn 2+ إلى MnO 4 ، وظهور لون بنفسجي.
يتم استخدامه للحصول على Mn و MnO 2 ومركبات أخرى من المنجنيز ، كمادة مغذية دقيقة وكاشف تحليلي.
معادلات أهم التفاعلات:
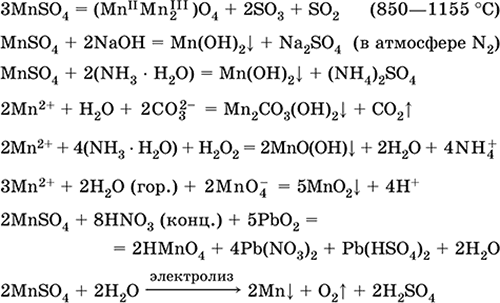
تلقي:
2MnO 2 + 2H 2 SO 4 (conc.) = 2 MnSO 4 + O 2 + 2H 2 O (100 درجة مئوية)
الحديد (الثاني) كبريتات FeSO 4. Oksosol. الأبيض (هيدرات الضوء الأخضر ، الاسم التقني الحديد الزاج)استرطابي. يتحلل عند تسخينها. قابل للذوبان في الماء ، إلى حد كبير تحلل بواسطة الموجبة. يتأكسد بسرعة في المحلول بواسطة الأكسجين في الهواء (يتحول المحلول إلى اللون الأصفر ويصبح غائما). يتفاعل مع العوامل المؤكسدة للحمض ، القلويات ، هيدرات الأمونيا. وكيل الحد النموذجي.
يتم استخدامه كمكون من الدهانات المعدنية ، الشوارد في الطلاء الكهربائي ، حافظة الخشب ، مبيدات الفطريات ، المخدرات المضادة لفقر الدم. في المختبر ، في كثير من الأحيان يؤخذ على أنه ملح مزدوج Fe (NH 4) 2 (SO 4) 2 6Н 2 O ( مورا الملح) أكثر مقاومة للهواء.
معادلات أهم التفاعلات:
![]()
تلقي:
Fe + H 2 SO 4 (ديسمبر) = FeSO 4+ ح 2
FeCO 3 + H 2 SO 4 (الاسمية) = FeSO 4 + CO 2 + H 2 O
7.4. مجموعة VA غير المعدنية
النيتروجين. غاز الأمونيا
نتروجين - عنصر من الفترة الثانية و VA - مجموعة من النظام الدوري ، الرقم التسلسلي 7. صيغة الإلكترون الذري [2 He] 2s 2 2p 3 ، حالات الأكسدة المميزة 0 ، –III ، + III و + V ، في كثير من الأحيان + II ، + IV و الخ؛ تعتبر حالة N v مستقرة نسبيا.
مقياس أكسدة النيتروجين:
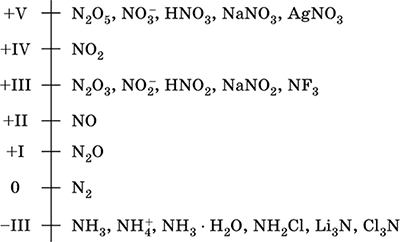
يحتوي النيتروجين على نسبة عالية من الكهربية (3.07) ، والثالثة بعد F و O. تُظهر الخصائص النموذجية غير المعدنية (الحمضية). يشكل مختلف الأحماض التي تحتوي على الأكسجين والأملاح والمركبات الثنائية ، وكذلك الأمونيوم الموجبة NH 4 + وأملاحه.
في الطبيعة - السابع عشر عنصر الانتشار الكيميائي (التاسع بين غير المعادن). عنصر حيوي لجميع الكائنات الحية.
النيتروجين N 2. مادة بسيطة. وهو يتألف من جزيئات غير قطبية لها رابطة مستقرة جدًا N-N ، وهذا ما يفسر الخمول الكيميائي للنيتروجين في الظروف العادية. غاز عديم اللون عديم الرائحة يتكثف في سائل عديم اللون (على عكس O 2).
المكون الرئيسي للهواء: 78.09 ٪ من حيث الحجم ، 75.52 ٪ من حيث الوزن. من الهواء السائل ، يغلي النيتروجين فوق الأكسجين O 2. هو قابل للذوبان في الماء قليلاً (15.4 مل / 1 لتر من H 2 O عند 20 درجة مئوية) ، وقابلية ذوبان النيتروجين أقل من الأكسجين.
في درجة حرارة الغرفة ، يتفاعل N 2 فقط مع الليثيوم (في جو رطب) ، ويشكل نيتريد الليثيوم Li 3 N ، ويتم تصنيع نيتريدات العناصر الأخرى مع تسخين قوي:
N 2 + 3Mg = Mg 3 N 2 (800 درجة مئوية)
في التفريغ الكهربائي ، يتفاعل N 2 مع الفلور وإلى حد كبير مع الأكسجين:
يحدث تفاعل عكسي لإنتاج الأمونيا عند 500 درجة مئوية ، تحت ضغط يصل إلى 350 atm ، بالضرورة بوجود محفز (Fe / F 2 O 3 / FeO ، في مختبر Pt):
وفقًا لمبدأ Le Chatelier ، يجب أن تحدث زيادة في غلة الأمونيا مع زيادة في الضغط وانخفاض في درجة الحرارة. ومع ذلك ، فإن معدل التفاعل عند درجات حرارة منخفضة منخفض للغاية ، لذلك يتم تنفيذ العملية في 450-500 درجة مئوية ، لتصل إلى 15 ٪ من الأمونيا. عودة N2 و H 2 غير المتفاعلين إلى المفاعل وبالتالي زيادة درجة التفاعل.
يعتبر النيتروجين سلبياً من الناحية الكيميائية فيما يتعلق بالأحماض والقلويات ، ولا يدعم الاحتراق.
استقبال في صناعة - التقطير التجزيئي للهواء السائل أو إزالة الأكسجين من الهواء بالوسائل الكيميائية ، على سبيل المثال ، بواسطة التفاعل 2C (فحم الكوك) + O 2 = 2CO بالتسخين. في هذه الحالات ، يتم إنتاج النيتروجين ، والذي يحتوي أيضًا على شوائب من الغازات النبيلة (الأرجون أساسًا).
ال مختبر يمكن الحصول على كميات صغيرة من النيتروجين النقي كيميائياً من خلال تفاعل مع تسخين معتدل:
N ‑III H 4 N III O 2 (t) = N 2 0 + 2H 2 O (60–70 درجة مئوية)
NH 4 Cl (p) + KNO 2 (p) = N 2 0 + KCl + 2H 2 O (100 ° C)
يتم استخدامه لتخليق الأمونيا ، وحامض النيتريك وغيرها من المنتجات التي تحتوي على النيتروجين ، كبيئة خاملة للعمليات الكيميائية والمعدنية وتخزين المواد القابلة للاشتعال.
الأمونيا NH 3. مركب ثنائي ، درجة أكسدة النيتروجين هي - III. غاز عديم اللون ذو رائحة مميزة حادة. يحتوي الجزيء على هيكل رباعي الاسطح غير مكتمل [: N (H) 3)] (sp 3 гиб-hybridization). إن وجود النيتروجين في جزيء NH 3 لزوج مانح للإلكترون في المدار sp 3 - الهجين يسبب تفاعل إضافة مميز للكاتيون الهيدروجيني ، مع تكوين الكاتيون الأمونيوم NH 4 +. مسال تحت الضغط في درجة حرارة الغرفة. في الحالة السائلة يرتبط بسبب روابط الهيدروجين. غير مستقرة حراريا. قابل للذوبان في الماء (أكثر من 700 لتر / 1 لتر من H 2 O عند 20 درجة مئوية) ؛ النسبة في المحلول المشبع = 34٪ بالكتلة و = 99٪ بالحجم ، الأس الهيدروجيني = 11.8.
رد الفعل للغاية ، عرضة لردود الفعل بالإضافة. ينشأ في الأكسجين ويتفاعل مع الأحماض. إنه يعرض خصائص تقليل (بسبب N ‑III) و أكسدة (بسبب H I). يجف فقط مع أكسيد الكالسيوم.
ردود الفعل النوعية - تكوين "دخان" أبيض في اتصال مع حمض الهيدروكلوريك الغازي ، وتغميق الورقة المبللة بمحلول Hg 2 (NO 3) 2.
منتج وسيط في تركيب HNO 3 وأملاح الأمونيوم. تستخدم في صناعة الصودا والأسمدة النيتروجينية والأصباغ والمتفجرات. الأمونيا السائلة هي سائل التبريد. سامة.
معادلات أهم التفاعلات:
استقبال: في مختبر - إزاحة الأمونيا من أملاح الأمونيوم عند تسخينها باستخدام الجير الصودا (NaOH + CaO):
أو غليان محلول مائي من الأمونيا ، تليها تجفيف الغاز.
ال صناعة يتم تصنيع الأمونيا من النيتروجين (انظر) مع الهيدروجين. التي تنتجها الصناعة إما في شكل سائل أو في شكل محلول مائي مركز تحت الاسم التقني ماء الأمونيا.
الأمونيا هيدرات NH 3 H 2 O. مركب بين الجزيئات. الأبيض ، في شعرية الكريستال هي جزيئات NH 3 و H 2 O ، ملزمة برابطة الهيدروجين ضعيفة H 3 N ... HON. يوجد في محلول مائي للأمونيا ، قاعدة ضعيفة (نتاج التفكك - الكاتيون NH 4 - والأنيون OH -). يحتوي كاتيون الأمونيوم على هيكل رباعي السطوح بشكل منتظم (sp 3 - تهجين). غير مستقر حرارياً ، متحلل تمامًا عن طريق غليان المحلول. تحييدها من الأحماض القوية. يظهر تقليل الخصائص (بسبب N III) في محلول مركّز. يدخل في تفاعل التبادل الأيوني والتعقيد.
رد فعل نوعي - تشكيل "دخان" أبيض في اتصال مع حمض الهيدروكلوريك الغازي.
يتم استخدامه لإنشاء وسط قلوي ضعيف في المحلول ، أثناء هطول هيدروكسيدات الأمفيتريك.
يحتوي محلول الأمونيا 1M بشكل رئيسي على هيدرات NH 3 H 2 O و 0.4٪ فقط من NH 4 + و OH - أيونات (بسبب تفكك الهيدرات) ؛ وبالتالي ، فإن أيوني "هيدروكسيد الأمونيوم NH 4 OH" غير موجود عملياً في المحلول ، ولا يوجد مثل هذا المركب في الهيدرات الصلبة. معادلات أهم التفاعلات:
NH 3 H 2 O (conc.) = NH 3 + H 2 O (الغليان مع هيدروكسيد الصوديوم)
NH 3 H 2 O + HCl (ديسمبر) = NH 4 Cl + H 2 O
3 (NH 3 H 2 O) (conc.) + CrCl 3 = Cr (OH) 3 ↓ + 3NH 4 Cl
8 (NH 3 H 2 O) (conc.) + ЗBr 2 (p) = N 2 + 6NH 4 Br + 8H 2 O (40-50 درجة مئوية)
2 (NH 3 H 2 O) (conc.) + 2KMnO 4 = N 2 + 2MnO 2 ↓ + 4H 2 O + 2KON
4 (NH 3 H 2 O) (conc.) + Ag 2 O = 2OH + 3H 2 O
4 (NH 3 H 2 O) (conc.) + Cu (OH) 2 + (OH) 2 + 4H 2 O
6 (NH 3 H 2 O) (conc.) + NiCl 2 = Cl 2 + 6H 2 O
غالبا ما يسمى محلول الأمونيا المخفف (3-10 ٪ - -) الأمونيا السائلة (اخترع الكيميائيون الاسم) ، والحل المركز (18.5-25 ٪) ماء الأمونيا (التي تنتجها الصناعة).
