Skema e strukturës së silikonit. Struktura e elektroneve
Struktura atomike Pozita në PS: Periudha III; grupi IV, që kryeson; Ngarkesa e kernelit: +14 Si; Masa atomike relative: Ar (Si) = 28 Struktura atomike: p = 14, e = 14, n = = 14 Formula elektronike: +14 Si 2e; 8e; 4e; +14 Si 1s 2 2s 2 2p 6 3s 2 3p Si 1s 2 2s 2 2p 6 3s 2 3p 2 Nemetall;
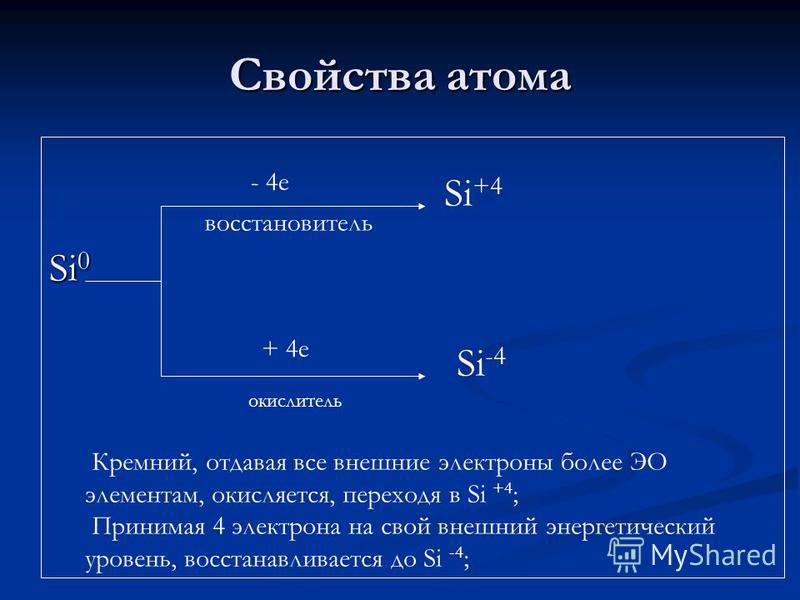
Vetitë atomike Si agjenti reduktues + 4 e oksidues Si + 4 Si -4 Siliconi, duke i dhënë të gjithë elektroneve të jashtëm më shumë elementë OE, është oksiduar, duke kaluar në Si + 4; Duke marrë 4 elektrona në nivelin e tij të jashtëm të energjisë, ajo reduktohet në Si-4;

Vetitë fizike të silikonit Siliconi është jo metalik, ekziston në një gjendje kristaline dhe amorf. Silic kristali është një substancë gri-çeliku me një shkëlqim metalik, shumë të vështirë, por të brishtë. Pluhur amorf silic - kafe. p = 2.33 g / cm 3; t pl. = C; t kip. = C;

Struktura kristale e silikonit Një grilë kristali e silikonit është një tip diamanti në qendër të fytyrës. Por për shkak të gjatësisë më të gjatë lidhëse midis Si-Si, ngurtësia e silikonit është dukshëm më e vogël se ajo e diamantit. Siliciti është i brishtë, vetëm kur nxehet lart C.

elektro vetitë fizike Silic Elemental Silic Elemental është një gjysmëpërçues tipik. gjysmëpërçues tipik. Vetitë elektrofizike të silikonit kristalor ndikohen shumë nga papastërtitë e gjurmëve të përfshira në të. Për të marrë kristale të vetme silikoni me përçueshmëri të p-lloj, aditivët e elementeve të grupit të tretë të bor, alumini, gallium dhe indium, me përçueshmëri elektronike të shtesës, futen në silikon elementet V fosfor, arsenik ose antimon.


Flint Flint, ky Flint, ky gur i shëmtuar dhe shumë i shëmtuar dhe shumë i qëndrueshëm, gur i qëndrueshëm, hodhi themelin për fillimin e gurit të epokës së gurit - shekullit - shekullit të veglave të punës së zjarrtë. mjetet e strallit. Ekzistojnë dy arsye: - Prevalenca dhe disponueshmëria e silikonit; - Prevalenca dhe disponueshmëria e silikonit; - aftësia për të formuar skajet e mprehta të prerjes kur janë të prera; - aftësia për të formuar skajet e mprehta të prerjes kur janë të prera;




A e dini se .. Metoda për marrjen e silikonit në formën e tij të pastër u zhvillua nga Nikolai Nikolayevich Beketov. Silic në Rusi prodhohet në fabrika: Kamensk - Uralsky (Rajoni Sverdlovsk) Kamensk - Uralsky (Rajoni Sverdlovsk) Shelekh (Rajoni Irkutsk). Shelekh (rajoni Irkutsk).

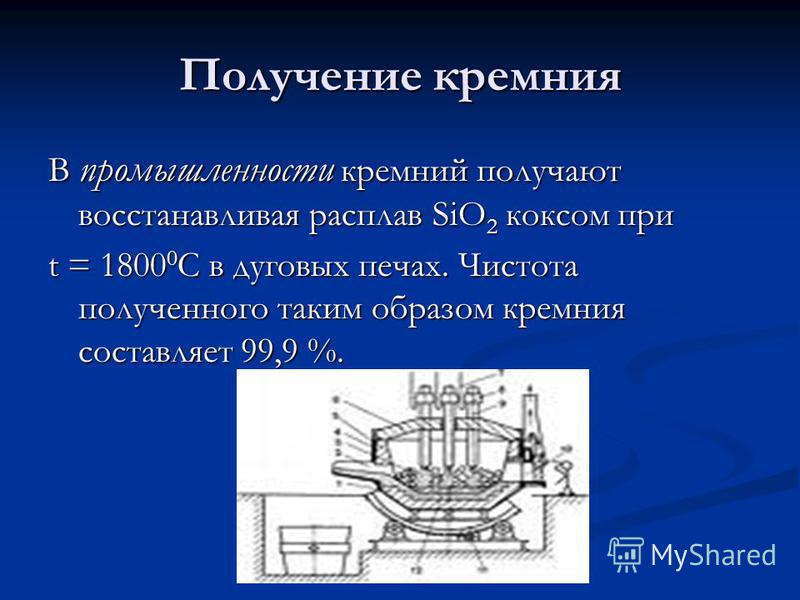
Prodhimi i silicit Në industrinë, silicit është marrë duke ulur shkrirjen e SiO 2 me koks në t = C në furrat e harkut. Pastërtia e silikonit të fituar në këtë mënyrë është 99.9%.
Marrja e silikonit Metoda e prodhimit të laboratorit: SiO Mg 2MgO + Si SiO Mg 2MgO + Si


Vetitë kimike të silikonit Kur nxehet në 400 - C, silic reagon me oksigjenin për të formuar dioksid silici: Si + O 2 SiO 2 Si + O 2 SiO 2



![]()
Karakteristikat e CO 2 CO 2 SiO 2 oksid Acid oksid Grilat kristal molekulare Gome Atomike pa ngjyrë. Kristal, i fortë, i fortë. Vetitë kimike kimike H2O + CO 2 = H2CO3 Nuk reagon CO 2 + CaO = CaCO3 SiO2 + CaO = CaSiO3 CO2 + Ca (OH) 2 = CaCO3 + H2O SiO2 + NaOH = Na 2 SiO 3 + H 2 O CO 2 + 2Mg = 2MgO + C SiO 2 + 2C = 2MgO + Si C + CO 2 = 2CO SiO 2 + 2C = Si + 2CO
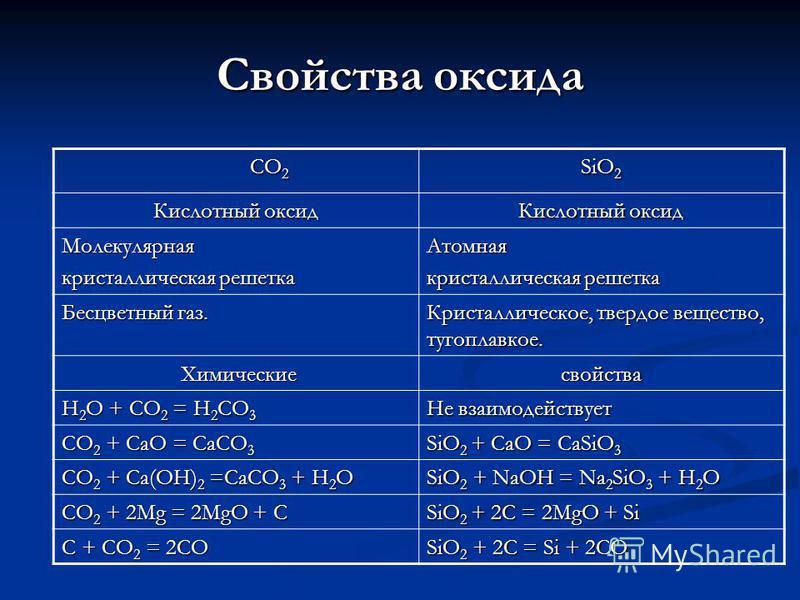
Karakteristikat e acideve H 2 CO 3 H 2 SiO 3 Dibasi, me përmbajtje oksigjeni, të dobët, të brishtë që nga viti bat. Dibasik, që përmban oksigjen, i dobët, i pazgjidhshëm në ujë. Pranimi: CO 2 + H 2 O = H 2 CO 3 Marrja: SiO2 + H2O = nuk mund të paqëndrueshme, të brishtë, shpërbëhet kur qëndron ose ndizet: H2CO3 = CO 2 + H 2 O Nuk mund të zgjidhet në formën e tij të pastër, sepse shpërbëhet kur nxehet: H 2 SiO 3 = SiO 2 + H 2 O Zn + H 2 CO 3 = ZnCO 3 + H 2 Evolucioni i vogël i gazit __________

Acidet Karbonike të acidit silicik - karbonat; - hidrokarburet; - silikat; - silikat; Karbonatet kanë të gjitha vetitë e kripërave, janë elektrolite të forta, plotësisht dissociojnë në jonet (të tretshëm në ujë). Vetëm kripërat e metalit alkali janë të tretshëm, të tjerët formojnë pazgjidhshëm ose nuk krijojnë fare kripëra (Al +3, Cr +3, Ag +).
![]()



Roli biologjik Komponenti më i rëndësishëm i silikonit, SiO 2, është thelbësor për jetën e bimëve dhe kafshëve. Falë tij, xunkthe, kallama Falë tij, kallamishtet, kallamat dhe horsetails qëndrojnë fort si bajoneta. dhe horsetails qëndrojnë të shtrënguar, si bajoneta. Gjethet e mprehta të lëvozhgave të prera si gjethet e Sharpit të prera si thika, kashtë në thika të fushave të prera, kallamishte në një fushë të prerë si gjilpëra, dhe gjethët e drithërave ngjiten si gjilpëra dhe gjethët e drithërave janë aq të forta sa nuk lejojnë aq të fortë se mos lejoni që fusha në fushat të bjerë nga shiu dhe fusha e erës në fusha për të shkuar nga shiu dhe era


Siliconi është një element gjurmë që vazhdimisht gjendet në trupin e njeriut. Shuma më e madhe e tij gjendet në nyjet limfatike, indet lidhëse të aortës, trakës, flokëve dhe lëkurës. Silic është i nevojshëm për të ndërtuar qeliza epiteliale. Siliconi është një element gjurmë që vazhdimisht gjendet në trupin e njeriut. Shuma më e madhe e tij gjendet në nyjet limfatike, indet lidhëse të aortës, trakës, flokëve dhe lëkurës. Silic është i nevojshëm për të ndërtuar qeliza epiteliale. Siliconi luan një rol të rëndësishëm në procesin e mineralizimit të kockave; e nevojshme për të ruajtur elasticitetin e murit arterial, ka një efekt pozitiv në sistemin imunitar dhe ngadalëson procesin e plakjes në indet e trupit të njeriut. Përmbajtja mesatare e silikonit në gjak është 8.25 mg / ditë. Me moshën, niveli i tij në trup ulet, kështu që në të moshuarit, nevoja për silikon tenton të rritet. Permiresimi i thithjes se silikonit nga trupi, prania e kalciumit, magnezit, manganit dhe kaliumit. Siliconi luan një rol të rëndësishëm në procesin e mineralizimit të kockave; e nevojshme për të ruajtur elasticitetin e murit arterial, ka një efekt pozitiv në sistemin imunitar dhe ngadalëson procesin e plakjes në indet e trupit të njeriut. Përmbajtja mesatare e silikonit në gjak është 8.25 mg / ditë. Me moshën, niveli i tij në trup ulet, kështu që në të moshuarit, nevoja për silikon tenton të rritet. Permiresimi i thithjes se silikonit nga trupi, prania e kalciumit, magnezit, manganit dhe kaliumit.

Roli biologjik i silicit gjithashtu përfshihet në përbërjen e organizmave më të ulët të gjallë - dijat dhe radiolarët - grumbujt më delikate të materieve të gjalla, të cilat krijojnë skelete të bukura të bukura të bëra prej silicë. Silicioni është gjithashtu pjesë e organizmave më të ulët të gjallë - diatomet dhe radiolarë - grumbujt më delikate të materieve të gjalla, të cilat krijojnë bukurinë e tyre të patejkalueshëm të skeleteve silicë. Diatoms Radiolaria Vetëkontrolli 1. Cili është vendi i silikonit në sistemin periodik: a) 2 periudha, 4 og. b) 3 periudha, 3 gr. kapitulli. c) 3 periudha, 4 gr. kapitulli) 2 periudhë, 4 gr. b) 3 periudha, 3 gr. kapitulli. c) 3 periudha, 4 gr. kapitulli. 2. Grilë silikoni: a) jonik; b) atomike; c) molekulare; a) jonik; b) atomike; c) molekulare; 3. Sipas prevalencës në natyrë të silikonit ... element: a) i pari; b) i dyti; c) i treti; a) i pari; b) i dyti; c) i treti; 4. Siliconi reagon me: a) metale, hidrogjen, halogjene; a) metale, hidrogjen, halogjene; b) metale, halogjene, lehtësisht të tretshëm në alkaline; b) metale, halogjene, lehtësisht të tretshëm në alkaline; c) oksidet, acidet, jo metalet. c) oksidet, acidet, jo metalet. 5. Kripërat e acidit silikik: a) silicide; b) hidrosilikate; c) silikat; a) silicide; b) hidrosilikate; c) silikat;

Silic.
silic - një element i nëngrupit kryesor IV të grupit të periudhës së tretë të sistemit periodik të elementeve kimike DI Mendeleev, me numrin atomik 14, masa atomike: 28.0855. Në komponimet, ai zakonisht shfaq një shkallë të oksidimit të +4 (valencë IV) dhe shumë rrallë +3, +2, dhe +1 (valencë, respektivisht, III, II dhe I). Në tabelën periodike, Mendeleev silicon gjendet në grupin IVA (A-tregon se ky është nëngrupi kryesor) (në grupin e karbonit), në periudhën e tretë. jometal . Shënuar me simbol si(lat. silicium). Në formë të lirë - pluhur ngjyrë kafe ose material kompakt gri gri me një shkëlqim metalik. Struktura e grilës: kub, diamant.
Gjendja kryesore: + 14 Si 14 e 1s 2 2s 2 2p 6 3s 2 3p 2, p-element.
2. Vetitë fizike.
Siliconi kristalor është një substancë e errët gri me një shkëlqim çeliku. Struktura e silikonit është e ngjashme me strukturën e diamantit. Në kristalin e tij, çdo atom është i rrethuar nga katër tetrahedral dhe është i lidhur me to nga një lidhje kovalente, e cila është shumë më e dobët se në mes të atomeve të karbonit në një diamant. Në një kristal silikoni, madje edhe nën kushte normale, disa nga lidhjet kovalente janë shkatërruar. Prandaj, ajo ka elektron të lirë, të cilat shkaktojnë një përçueshmëri të vogël elektrike. Kur ndriçimi dhe ngrohja rrisin numrin e lidhjeve të prishura, që do të thotë që numri i elektroneve të lirë rritet dhe përçueshmëria elektrike rritet. Pra, duhet të shpjegojë vetitë gjysmëpërçuese të silikonit.
Siliconi është shumë i brishtë, dendësia e tij është 2.33 g / cm3. Ashtu si qymyri, i referohet substancave të fortë.
Siliciti përbëhet nga tre izotopë të qëndrueshëm: 2814Si (92.27%), 2914Si (4.68%) dhe 3014Si (3.05%).
3. Të jesh në natyrë.
Më shpesh në natyrë, siliconi gjendet në formë silicë - komponimet e bazuara në dioksid silikoni (IV) SiO2 (rreth 12% të masës së kores së tokës). Mineralet kryesore dhe shkëmbinjtë e formuar nga dioksidi i silikonit janë rërë (lumi dhe kuarci), kuarci dhe kuarciti, gripi dhe feldspat. Silikatat natyrale kanë një përbërje dhe strukturë komplekse. Këtu është përbërja e disa silikat natyrore:
ü feldspar K 2 O × Al 2 O 3 × 6 SiO 2,
ü azbesti 3MgO × 2SiO 2 × 2H 2 O,
ü mikë K 2 O × 3Al 2 O 3 × 6 SiO 2 × 2H 2 O,
ü kaolinite 3Al 2 O 3 × 2 SiO 2 × 2H 2 O.
Grupi i dytë më i zakonshëm në natyrë i përbërësve të silikonit është silikate dhe alumino-silikate.
Janë vërejtur fakte të thjeshta për gjetjen e silikonit të pastër në formën amtare.
4. Vetitë kimike të silikonit dhe përbërjes së tij.
në kimike silic, si karbon, është një jo metal, por jo-metali i tij është më pak i theksuar, pasi ajo ka një rreze më të madhe atomike. Meqenëse atomet e silikonit kanë 4 elektrona në nivelin e jashtëm të energjisë, gjendja e oksidimit të të dyjave -4 dhe +4 është karakteristikë e silikonit (një kompleks silicik është i njohur, ku shkalla e oksidimit është +2).
Siliconi në kushte normale është mjaft i inertuar, i cili duhet të shpjegohet me fuqinë e grilës së saj kristalore. Ajo ndërvepron direkt me vetëm fluor:
acide (me përjashtim të përzierjes së HF hidrofluorike dhe HNO nitrik 3)silic nuk vepron. Megjithatë, ajo tretet në hidrokside metalike alkali, duke formuar silikat dhe hidrogjen:
Nga dy modifikimet alotropike të silikonit kristalor dhe amorf, silic amorf është më shumë kimikisht aktiv. Ai reagon me të me oksigjen kur nxehet, duke formuar SiO 2:
si dhe me të gjithë halogenspër shembull:
![]()
Në temperaturë të lartë silic lidh me karbonformimin e carborundum SiC:
Karbordundi ka një grilë kristali si diamanti, në të cilën çdo atom siloni është i rrethuar nga katër atome karboni dhe anasjelltas, dhe lidhjet kovalente janë shumë të forta, si në diamant. Prandaj, në ngurtësinë është afër diamantit. Gurë bluarje dhe rrota rëndë janë bërë nga karabit silic.
Silicid magnezi. Në reaksione me metale aktive, që ndodhin me formimin e silicide, Siliconi vepron si një agjent oksidues:
Në temperaturë të lartë, silikon rimëkëmbet shumë metale nga oksidet e tyre. (!!!)
Silane. Nën veprimin e acidit klorhidrik në silicide, komponimi më i thjeshtë hidrogjeni i silikonit është silani SiH 4:
Silani është një gaz helmues me një aromë të pakëndshme, vetë ndezëse në ajër (!!!):
Oksid silikoni (IV).Gjithashtu quhet oksidi i silikonit (IV) silicë. Kjo është një substancë e fortë refraktare. (pika e shkrirjes 1700 ° C) i përhapur në natyrë në dy forma:
1) silicë kristaline - në formën e një minerali të kuarcit dhe varieteteve të tij (kristal shkëmb, kalcedoni, agat, jasper, gëlqere); kuarci formon bazën e rërës së kuarcit të përdorur gjerësisht në ndërtim dhe industrinë e silikatit;
2) silicë amorf - në formën e përbërjes mineral të opalit SiO 2 × n H2O; format tokësore të silicës amorf janë diatomite, tripoli (infusorial earth); një shembull i silicë artificiale amorf anhydrous është xhel silicë, e cila është marrë nga metasilicate natriumi:
Xhel silicë ka një sipërfaqe të zhvilluar dhe për këtë arsye thith lagështi mirë. .
Në 1710 ° kuarci shkrihet. Me ftohjen e shpejtë të masës së shkrirë formohet qelqi kuarc . Ajo ka një koeficient shumë të ulët të zgjerimit, kështu që xhami i nxehtë kuarci nuk plas kur uji ftohet me shpejtësi. Qelqat laboratorike dhe instrumentet për kërkime shkencore janë bërë nga qelqi kuarci.
Formula më e thjeshtë e oksidit të silikonit (IV) SO 2 është i ngjashëm me formulën e monoksidit të karbonit (IV) CO 2. Ndërkohë, pronat e tyre fizike janë shumë të ndryshme (SiO 2 - të ngurta, CO 2 - gaz). Ky ndryshim është për shkak të strukturës së grilave kristalore. C0 2 kristalizohet në grilën molekulare, SiO 2 - në atomike. Struktura e SiO 2 në një imazh planar mund të përfaqësohet si më poshtë:
Numri koordinues i një atomi të karbonit në CO 2 të ngurta është 2, dhe siliconi në SiO 2 është 4. Çdo atom silikon është i mbyllur në një tetrahedron me 4 atome oksigjeni. Në të njëjtën kohë, atomi i silikonit është në qendër dhe atomet e oksigjenit ndodhen në majat e tetraedrit . I gjithë pjesa silicë mund të konsiderohet si një kristal formulë e të cilit është (SiO 2) n. Kjo strukturë e oksidit të silikonit (IV) përcakton fortësinë e saj të lartë dhe refractoriness .
Vetitë kimike të oksidit të silikonit (IV) SiO 2 i referohen oksideve të acidit. Kur shkrin atë me alkaline të ngurta, oksidet bazë dhe karbonatet, kripërat e acidit silikik formohen:
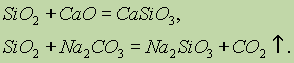
Vetëm acid hydrofluoric ndërvepron me oksid silikoni (IV):
Ky reagim përdoret për të etched glass. .
Silic (IV) nuk shpërndahet në ujë dhe nuk ndërvepron kimikisht me të. (!!!) Prandaj, acidi silikik merret indirekt duke vepruar me një acid në një solucion të kaliumit ose silikatit të natriumit:
Në këtë rast, acidi silikik (në varësi të përqendrimit të solucioneve fillestare të kripës dhe acidit) mund të merret si në formën e një mase xhelatinoze që përmban ujë, dhe në formën e një solucioni kolloid (sol).
Acidi silikik. SiO2 është anhidrid i një numri të acideve silicike, përbërja e të cilave mund të shprehet me formulën e përgjithshme: xSiO 2 × yH 2 O, ku x dhe y - integers:
1) x = 1, y = 1: SiO 2 × H 2 O, pra H 2 SiO 3 - acid metasilicic;
2) x = 1, y = 2: SiO 2 × 2H 2 O, pra H 4 SiO 4 - acid ortosilikik;
3) x = 2, y = 1: 2SiO 2 × H 2 O, pra H 2 Si 2 O 5 - acid bimetakrynic.
Acidi silikik është ndërtuar nga njësitë strukturore tetrahedral (në çdo njësi të tillë, atomi i silikonit është në qendër të tetraedrit dhe ka atome oksigjeni në majë). Lidhjet strukturore, që bashkohen në zinxhirë, formojnë acide më të qëndrueshme të polisilicës:
Përbërja e përbërjeve të tilla mund të shprehet me formulën (H2S03) n. Megjithatë, zakonisht acidi silicik përfaqësohet nga formula H2Si03. H 2 SiO 3 - acid është shumë i dobët, pak i tretshëm në ujë. Kur nxehet lehtë shpërbëhet si acid karbonik:
Të gjithë acidet silicike janë shumë të dobëta (më të dobëta se qymyri).
Silikate. Kripërat e të gjitha acideve silicike janë quajtursilikate, edhe pse, si rregull, në literaturën arsimore, silikat nënkuptojnë kripërat e acidit metacilikik. Përbërja e tyre përfaqësohet zakonisht nga formula në formën e përbërjeve të oksideve të elementeve. Për shembull, silikat kalciumi CaSiO3 mund të shprehet si: CaO × SiO 2.
Silikatat e përbërjes R 2 O × nSiO 2, ku R 2 O - okside të natriumit ose kaliumit , janë thirrur qelqi i tretshëm , dhe zgjidhjet e tyre të koncentruara ujore - xhami e lëngshme . Xhami sode natriumi është më e rëndësishme..
Kur qëndron në ajër, zgjidhjet e silikateve rriten të turbullta, pasi që dioksidi i karbonit (IV) në ajër zhvendos acidin silikik nga kripërat e tij:
Acidi silikik është praktikisht i pazgjidhshëm në ujë - kjo pronë është përdorur si një reagim cilësor ndaj jon SiO 3 2-.
Silikatet merren me shkrirjen e silicave me alkaline ose karbonate:
5. Zbulimi i jon SiO 3 2. (Unë nuk mund të gjej asgjë ...)
6. Roli i komponimeve të silikonit në formimin e dheut dhe pylltarisë.
Shkëmbinjtë e zjarrtë janë mjaft të qëndrueshëm në përbërjen e tyre dhe përmbajnë kryesisht komponimet e silikonit, aluminit, hekurit, alkaleve, magnezit dhe kalciumit. Sipas përmbajtjes Si0 2, shkëmbinjtë e zjarrtë ndahen në katër grupe: acid (\u003e 65%), mesatare (52-65%), bazë (40-52%) dhe ultrabazike (<40 %). Наиболее представительны две большие группы: кислые и основные породы. Как будет видно в дальнейшем, при характеристике многих типов почв именно этот фактор приуроченности почв к кислым или основным магматическим почвообразующим породам является решающим в отношении генезиса, эволюции и свойств почв.
Shkëmbinjtë e acidit të zjarrtë- granites, pegmatites, rhyolites, dacite dhe të tjerët - zakonisht kanë një ngjyrë të lehta dhe kafe me kristale të theksuara të kuarc, feldspat, mikë. Përmbajtja SiO 2 në to është e lartë (më shumë se 65%) me një sasi të konsiderueshme të kaliumit dhe natriumit. Në të njëjtën kohë, pak hekuri, dhe kalciumi dhe magnez janë të papërfillshëm. Tokat në shkëmbinj acidë të zjarrtë, për shembull, në granit, ndryshojnë në fazat e hershme të motit me anë të zhytjes, karakterit të zhavorrit të materialit burimor. Kur lulëzojnë në kushte të lagështa, ata lehtë humbasin elementet alkaline tokësore, si rezultat i të cilave toka në substrate të tilla të turbullta (eluvium i shkëmbinjve) është jashtëzakonisht i dobët, dobët pjellor.
Shkëmbinjtë kryesorë të zjarrtë -basalt, gabbro, etj, si rregull, kanë një ngjyrë të errët (të zezë). Ato karakterizohen nga një përmbajtje më e ulët SiO 2 në krahasim me shkëmbinjtë acid. Shkëmbinjtë kryesorë të zjarrit janë relativisht të pasura me komponimet e hekurit, manganit, kromit, kobaltit, zinkut, titanit, nikelit, bakrit. Produktet e klimës së tyre mjaft shpejt fitojnë një karakter balta, mbajnë një reagim alkalik dhe neutral për një kohë të gjatë dhe dallohen nga një përmbajtje e shtuar e mineraleve të humusit dhe argjilës. Toka në shkëmbinj të tillë është më pjellore.
Përveç specieve akute dhe themelore janë gjetur shpesh shkëmbinj të zjarrtë të tipit kalimtar(të mesme) - gurë ndërhyrës të grupit diorite dhe homologët e tyre të zymtë - andesitë. Prandaj, tokat në këto shkëmbore përftojnë karakteristika të ngjashme me ato që kufizohen në shkëmbinj acid ose bazë. Shumë më pak e zakonshme racave ultrabazike:peridotitët dhe picritët, të cilët kanë përmbajtjen më të ulët SiO 2.
Shkëmbinj metamorfikë -kalimtare midis shkëmbinjve masivë kristalor dhe sedimentarë. Gurët e lashtë sedimentare nën zhytje, presion të lartë dhe temperaturat janë metamorphosed, formimin gneisses, serpentinites, mermer, quartzites, shist argjilor. Gneisses janë veçanërisht të ngjashme në përbërje të granites. Tokat që formohen në shkëmbinj të tillë kanë karakteristika të ngjashme me tokat në vetë shkëmbinjtë e zjarrtë acid.
Klori.
1. Pozicioni i aluminit në tabelën D. I. Mendeleev. Struktura e atomit, shkalla e manifestuar e oksidimit.
klor - një element i nëngrupit kryesor të grupit VII, periudha e tretë, me numër atomik 17. Është shënuar me simbolin Cl (lat. Chlorum). Kimikisht aktive jometal . Të përfshira në grupin halogjen .
Klori substanca e thjeshtë në kushte normale - gazi helmues me ngjyrë të verdhë-jeshile është më e rëndë se ajri, me erë të fortë . Molekula diatomike e klorit (formula Cl2).
Shteti kryesor: +17 Cl 17e1s 2 2s 2 2p 6 3s 2 3p 5, p-element. Art.: -1 +1 +3 +5 +7.
Struktura e shell elektronike.
Në nivelin e valencës së atomit të klorit përmban 1 elektron i palëvizur : 1s 2 2s 2 2p 6 3s 2 3p 5, kështu valencë e 1 për një atom klori është shumë e qëndrueshme. Për shkak të pranisë në atomin e klorit të orbitalëve të pabanuar të d-sublevel, klori mund të shfaqë shkallë të tjera të oksidimit. Skema e formimit të shteteve të ngacmuara të atomit:
Gjithashtu janë të njohura komponimet e klorit në të cilat atomi i klorit formon formalisht valencë 4 dhe 6, për shembull ClO2 dhe Cl206. Megjithatë, këto komponime janë radikale, domethënë ata kanë një elektron të palëvizur.
2. Vetitë fizike.
Nën kushte normale, klori është një gaz i verdhë-gjelbër me erë mbytëse. Disa nga vetitë e tij fizike janë paraqitur më poshtë.
Dendësia: 3.214 g / l, liq - në -35 ° C - 1.557, TV. në -105 0 С-1.9 g / cm 3.
Pika e shkrirjes: 172.2 K
Pika e vlimit: 238.6 K
Nxehtësia e bashkimit: 6.41 kJ / mol
Nxehtësia e avullimit: 20.41 kJ / mol.
Gazi i klorit është relativisht i lehtë për t'u lëngëzuar. Duke filluar me një presion prej 0.8 MPa (8 atmosfera), klori do të jetë i lëngët tashmë në temperaturë dhome. Kur ftohur në një temperaturë prej -34 ° C, klori gjithashtu bëhet i lëngët në presionin normal atmosferik. Klori i lëngët është një lëng i verdhë-gjelbër me një efekt shumë të lartë gërryes (për shkak të përqendrimit të lartë të molekulave). Rritja e presionit, ju mund të arrini ekzistencën e klorit të lëngshëm deri në një temperaturë prej +144 ° C (temperatura kritike) në një presion kritik prej 7.6 MPa. Në terma të përçueshmërisë elektrike, klori i lëngshëm zhvillohet në mesin e izolatorëve më të fortë: ajo kryen pothuajse një miliard herë më të keq se uji i distiluar dhe 10 22 herë më i keq se argjendi. Shpejtësia e zërit në klorin është rreth një herë e gjysmë më e vogël se në ajër.
3. Të jesh në natyrë.
Në natyrë, ekzistojnë dy izotopë të klorit 35 Cl dhe 37 Cl. Klori është halogjeni më i zakonshëm në koren e tokës. . Klori është shumë aktiv - lidhet drejtpërdrejt me pothuajse të gjitha elementet e sistemit periodik. Prandaj, në natyrë, ajo gjendet vetëm në formën e përbërjeve në përbërjen e mineraleve:
ü halite NaCl,
ü sylvina KCl,
ü sylvinite KCl · NaCl,
ü bischofite MgCl2 · 6H2O,
ü carnallite KCl · MgCl2 · 6H2O,
ü Cainite KCl · MgSO4 · 3H 2 O.
Rezervat më të mëdha të klorit janë të përfshira në kripërat, ujërat, detet dhe oqeanet (përmbajtja në ujin e detit është 19 g / l). Klori përbën 0.024% të numrit të përgjithshëm të atomeve në koren e tokës; numri i klerit (numrat që shprehin përmbajtjen mesatare të elementëve kimikë në koren e tokës, hidrosferën, tokën, trupin hapësinor, sistemet gjeokimike ose kozmokimike, etj., në raport me masën totale të këtij sistemi, shprehet në% ose g / kg). klor - 0.017%. Trupi i njeriut përmban 0,25% joneve klori sipas peshës. Në njerëzit dhe kafshët, klori gjendet kryesisht në lëngjet ndërcellulare (duke përfshirë gjakun) dhe luan një rol të rëndësishëm në rregullimin e proceseve osmozike, si dhe në proceset që lidhen me punën e qelizave nervore.
4. Vetitë kimike të klorit dhe përbërësve të tij. Marrja e klorit.
Struktura e atomit të silikonit. Si. 14. Shteti i ngacmuar. E. 3d. 3P. 3s. E. 3d. 3P. 3s. 1s 2s 2p 3s 3p. 2e 8e 4e. 2. 2. 6. 2. 2.
Figura 3 e prezantimit "Silic" për mësimet e kimisë në temën e "silikonit"Përmasat: 960 x 720 pixels, format: jpg. Për të shkarkuar një imazh të lirë për një mësim të kimisë, klikoni me të djathtën mbi imazhin dhe klikoni "Save image as ...". Për të shfaqur fotot në mësim, gjithashtu mund të shkarkoni falas "Silicon.ppt" me të gjitha fotot në një arkiv zip. Madhësia e arkivit - 562 KB.
Shkarko prezantiminsilic
"Silic dhe përbërjet e tij" - Struktura dhe vetitë e atomeve. Semiconductor. t shkrihet (Si) = 1415? C, t shkrihet (diamanti) = 3730? C. Marrja e silikonit. Zbulimi i silikonit. Përfshirë edhe në përbërjen e bimëve dhe kafshëve. Vetitë fizike të silikonit. Prandaj, tulla është qeramikë, dhe pllakat dhe fragmente të amforës së lashtë greke janë gjithashtu qeramika. Objektivat: Vetitë kimike të silikonit.
"Përbërësit e silikonit" - Siliconi dhe komponimet e tij. Vetitë kimike të SiO2. Silane. Marrja e acidit silicik. Vetitë e silikonit. Oksid silikoni. Silikate natyrale. Shteti i oksidimit Diamant i rremë. Topaz. Marrja e silikonit në laborator. Të jesh në natyrë. Krasitë e kristaleve. Zbulimi i silikonit. Ametist. Marrja e silikonit.
"Izotopet e silicit" - Ndarja e izotopeve të silikonit. Prodhimi i silikonit polikristaline. Perspektivat për përdorimin e silikoneve monoizotopike. Lëngje izotopike kur rritet një kristal i vetëm nga një lustër kuarci. Prodhimi i farës së vetme kristale. Varësia e pozicionit të maksimumit të grupit Raman në masën atomike.
"Mësimi i Silicit" - Cila nga elementët më të rëndësishëm kimikë në natyrën e gjallë dhe jo të gjallë? Oksidet e karbonit dhe silikonit. Substanca është transparente. Mbi manifestimin e pronave jo metalike dhe metalike. Duke përmbledhur reflektimin. Testimi përfundimtar. Oksidet e karbonit dhe hidroksidet e silikonit? Gjendja e grumbullimit: a) e lëngshme, b) gazi, c) i ngurtë.
"Silic" - Silic është një substancë e thjeshtë. Vetitë fizike. Oksid silikoni (IV). Silicides. Kuptimi për organizmat e gjallë. Ndërveprimi me metale. Ndërveprimi me jo-metale. Karabit silik. Silic në natyrë. Silic. Produktet e industrisë së silikatit. Një nga llojet e përbërjeve natyrore të silikonit është silikat.
"Karboni dhe silic" - oksid silikoni (IV). Elementet e grupit IV të nëngrupit kryesor. Toksiciteti. 7. Interesante për karbonin. Silikate. Rrëshqitni në prekje. Diamanti është substanca më e vështirë natyrore. Vetitë kimike Më shumë se 99% e karbonit në atmosferë është në formën e dioksidit të karbonit. Carbides. 6. Aplikimi. Një nga më të butët në mesin e të ngurtave.
Ka 6 prezantime në total.
