Kalcijeve in magnezijeve spojine
Torej, ko je včeraj ugotovil, koliko kalcija je v zdrobljeni jajčni lupini, se je postavilo vprašanje »piti ali ne piti?«. Kot večina moških, sem prišel do vsega z znanstvenega vidika in dokler ga ne vidim sam, ugotovite, preverite, čutim besedo za žensko. Zato bom svoje misli delil na podlagi informacij o lupini jajc in kalcija.
Zbiranje informacij o uporabi jajčnih lupin kot dodatka hrani na internetu je več kot enkrat naletelo na kritične pripombe zdravnikov, da je kalcijev karbonat v jajčni lupini netopen v vodi in zato ga telo ne more absorbirati.
Poleg tega se je zgodba o zakoncu mojega prijatelja spomnila, da je med nosečnostjo zdravniku povedala, da je jemala zdrobljene jajčne lupine - zdravnik jo je odvrnil in predpisal nekakšen kompleks, ki vsebuje kalcij.
Kje je resnica?
Pravzaprav je kalcijev karbonat CaCO3 (ravno v tem tipu kalcij v jajčni lupini) netopen v vodi in alkoholu.
Resnično potreben predpogoj za absorpcijo kalcija je njegova topnost v vodi.
Ne pozabite, da je osnova naše prebave klorovodikova kislina, ki se izloča v želodec.
In to se dogaja v našem želodcu:
CaCO3 + 2HCl (klorovodikova kislina) = CaCl2 (kalcijev klorid) + Co2 + H20
Toda kalcijev klorid je popolnoma topen v vodi !!! V tej obliki se kalcij absorbira!
Ne poznaš zdravnikov? Ali pa preprosto zvijajo in nam prodajajo zdravila!
Poleg tega se med to reakcijo pojavi zmanjšanje kislosti želodca. Kaj je pomembno za ljudi, ki trpijo zaradi visoke kislosti.
Primer je moja žena, ima visoko kislost in vsak dan vzame malo zdrobljene jajčne lupine, kar rešuje dva problema naenkrat in kompenzira pomanjkanje kalcija in zmanjšuje njegovo kislost. Toda prah jajčne lupine je ugasnil limonin sok ne morem piti - je slabost! In zdaj razumem, zakaj.
Kot smo videli zgoraj, za absorpcijo kalcija iz kalcijevega karbonata je potrebna želodčni sok z visoko kislostjo.
V resničnem življenju se zelo pogosto zgodi, da je kislost želodca nizka ali nič. To stanje je še posebej značilno za starejše, ko je potreba po kalciju še posebej visoka za preprečevanje osteoporoze. Na primer, po 50 letih se nizka kislost pojavlja pri približno 40% ljudi. V teh pogojih se absorbcija kalcijevega karbonata, ki zahteva raztapljanje klorovodikove kisline v želodcu, zmanjša na 2%.
Morda je to odgovor, zakaj starejši ljudje pogosteje trpijo zaradi bolezni, ki so povezane s pomanjkanjem kalcija - preprosto jih ne morejo asimilirati v svoji običajni obliki.
Zdaj razmislite, zakaj je veliko receptov za sprejem zdrobljenih jajčnih lupin svetujemo, da ga pogasite z limoninim sokom.
Ko dodamo limonin sok v zdrobljeno citronsko kislino, kalcijev karbonat (CaCo3) reagira s citronsko kislino (C6H8O7) in dobimo kalcijev citrat (Ca3 (C6H5O7) 2):
2C6H8O7 + 3CaCO3 = Ca3 (C6H5O7) 2 + 3CO2 + 3H2O
Tukaj je. In absorpcija kalcijevega citrata, ki v želodcu ne potrebuje klorovodikove kisline, je 44%. Posledica tega je, da v razmerah nizke kislosti kalcijev citrat v telo pride v 11-krat več kalcija kot karbonat!
In kalcijev citrat je že dobro znano zdravilo, ki se nam prodaja za denar! In to počnejo, samo da ne uporabljajo limoninega soka, ampak citronske kisline!
Mimogrede, kalcijev karbonat (naša zdrobljena jajčna lupina) je registriran aditiv za živila. E170in kalcijev citrat (naša zdrobljena jajčna lupina, izlita z limoninim sokom) je registriran aditiv za živila. E333! Dodane so tudi številnim živilskim proizvodom, zlasti mlečnim proizvodom, vključno z mlekom, da bi povečali delež kalcija!
Torej, zakaj plačati več!
Zaključek, če imate visoko kislost - je verjetno bolje uporabiti samo razrezane jajčne lupine, če je kislost nižja, je verjetno bolje, da ga pogasimo z limoninim sokom.
In še več,
Ponoči se pospešeno sproščajo mineralne soli iz telesa (cirkadiani pospešek resorptivnih procesov v kosti). Zato je treba pripraviti kalcijeve pripravke po kosilu in zvečer.To bo preprečilo pospešeno izgubo kalcija v drugi polovici noči, še posebej pri zmanjšani ravni (ali odsotnosti) v črevesju. Ugotovljen je bil tudi negativen, od odmerka odvisen učinek farmakoterapevtske aktivnosti kalcija: \\ t v majhnih odmerkih se ta biometal absorbira bolje kot v visokih.
V zvezi s tem racionalneje jemati zdravilo večkrat na dan.
Beremo, razpravljamo. Spodaj je nekaj člankov o tej temi.
__________________________________________________________________________________________________________
Kalcijev citrat v primerjavi s kalcijevim karbonatom
Vir< http://www.ortho.ru/77_KMD/Ca_Sravni.htm >
_________________________________________________________________________________________________________
Kalcijev citrat.
Kalcijev citrat je odličen vir absorbiranega kalcija, ki ima v telesu zelo pomembno vlogo, saj vpliva na številne encimske procese in strjevanje krvi. Pomanjkanje kalcija vodi do krhkosti kosti in osteoporoze. Za majhne otroke je dobro za zdravje zob, odrasli potrebujejo redni vnos kalcija, da stabilizirajo krvni tlak.
Po podatkih National Cancer Institute (ZDA) lahko dodatek E-333 prepreči raka debelega črevesa in drugih vrst raka. Poleg tega se v medicini uporabljajo kalcijevi citrati za odstranjevanje težkih kovin iz telesa.
Ker je kalcijev citrat ena najpomembnejših transportnih oblik kalcija v človeškem telesu, se uporablja v medicini skupaj z manj učinkovitim kalcijevim karbonatom (aditiv E-170) za obnavljanje zalog kalcija v telesu. Iz istega razloga se kalcijev citrat uporablja v obliki prehranskih dopolnil (prehranskih dopolnil).
V prehrambeni industriji se E-333 uporablja kot stabilizator, konzervans, regulator kislosti, barvni fiksir.
Kot stabilizator se živilski dodatek E-333 uporablja pri proizvodnji kondenziranega mleka, smetane, smetanovega sira. Pri marmeladah, želeju in konzerviranem sadju se kot regulator kislosti uporablja dodatek E-333. Kalcijevi citrati se pogosto uporabljajo tudi za obogatitev kalcija v mleku in mlečnih izdelkih, pekarskih in mokastih izdelkih ter brezalkoholnih pijačah.
Po videzu je kalcijev citrat bel prašek z izrazitim kislim okusom. Topen v vodi. Molekularna formula kalcijevega citrata: Ca3 (C6H5O7) 2. Dobimo E-333 z interakcijo citronske kisline s kalcijevim hidroksidom.
Lastnosti in tehnološke funkcije:
Možna imena prehranskih dopolnil:
- E-333
- E-333
- Kalcijev citrat
- Kalcijevi citrati
- Monokalcijev citrat
- Dikalcijev citrat
- Trikalcijev citrat
_____________________________________________________________________________________________
Citrat
Sredi dvajsetega stoletja. začel se je nekakšen »bum«: biokemiki, fiziologi, biofiziki, farmakologi in kliniki so začeli izkazovati povečano zanimanje za proučevanje vloge kalcija pri uravnavanju delovanja organov in telesnih sistemov. Ugotovljeno je bilo, da so kalcijevi ioni vključeni v vzbujanje in krčenje mišičnih celic, uravnavanje prepustnosti celične membrane, medcelične interakcije, koagulacijo krvi, izločanje hormonov, mediatorje, encime; opravlja funkcijo signalnega pretvornika, ki vstopa v celico, sodeluje v procesih regulacije znotrajcelične presnove, vključno z energijo. Na površini membrane kardiomiocitov in posode prostih kalcijevih ionov je 1000-krat več kot v citosolu celic. Iz zunajceličnega prostora prodirajo v citoplazmo preko posebnih kalcijevih kanalov, kar vpliva na različne fiziološke procese in funkcije celic vseh organov, žilnega tonusa, intenzivnosti sistole, diastole.
Kalcij ima pomembno vlogo pri tvorbi kostnega tkiva in ohranjanju njegove normalne strukture in funkcije. Poleg posebnih beljakovin kalcijevi ioni zagotavljajo trdnost in elastičnost kosti.
Vse to je služilo kot teoretični temelj za razvoj in uvedbo kalcijevih pripravkov na osnovi njegovih soli v medicinsko prakso. Trenutno se v medicinski praksi uporabljajo kalcijeve soli, kot so glicerofosfat, glukonat, karbonat, laktat, citrat, klorid, fosfat in mnogi drugi.
Farmakokinetika zdravila CALCIUM CITRATE ima svoje značilnosti. Kalcij se iz črevesja absorbira v topni, ionizirani obliki. Raztapljanje zdravila se izboljša v kislem okolju želodca. Raztopljeni ionizirani kalcij prodre dobro v vsa tkiva, prodre skozi placentno pregrado, preide v materino mleko. Izloča se predvsem v blatu, približno 20% - z urinom. Pomembna lastnost kalcijevega citrata je nizka sposobnost tvorjenja ledvičnih kamnov, kar je pomembno pri dolgotrajni uporabi te soli. To je posledica dejstva, da citratna sol zmanjša količino oksalata v urinu.
Biološka razpoložljivost je določena s hitrostjo in obsegom aktivne sestavine absorbira iz dozirne oblike, postane na voljo na mestu predvidenega terapevtskega delovanja.
Ponoči se pospešeno sproščajo mineralne soli iz telesa (cirkadiani pospešek resorptivnih procesov v kosti). Zato je treba pripraviti kalcijeve pripravke po kosilu in zvečer, kar bo preprečilo pospešeno izgubo kalcija v drugi polovici noči, zlasti z zmanjšano ravnijo (ali odsotnostjo) v črevesju. Opažen je bil negativen, od odmerka odvisen učinek farmakoterapevtske aktivnosti kalcija: ta biometal se bolje absorbira v majhnih odmerkih kot pri visokih odmerkih. V zvezi s tem je bolj smiselno jemati zdravilo večkrat na dan. Za različne starostne skupine obstajajo različne fiziološke norme vnosa kalcija (tabela).
Tabela
Priporočena količina vnosa kalcija pri ljudeh različnih starosti
(v skladu s kanadsko družbo za osteoporozo)
Vitamin D, klorovodikova kislina, laktoza, citronska kislina, prisotnost beljakovin v hrani, fosfor, magnezij, pa tudi nekatera živila, kot so maslo, jajca, mleko, ribe, trska, zelje itd., Prispevajo k absorpciji kalcijevih ionov.
Absorpcija kalcija se slabša: pomanjkanje beljakovin v hrani, strogo upoštevanje vegetarijanske prehrane, pomanjkanje magnezija, fosforja, živila, bogata z oksalno kislino (kislica, rabarbara, špinača).
Absorpcija kalcija se upočasni pri boleznih prebavil (gastritis, enteritis, kolitis, peptični ulkus), trebušna slinavka (diabetes, pankreatitis), patologije drugih endokrinih organov.
Poudariti je treba, da nekatera zdravila, zlasti glukokortikoidi, hormonska kontracepcijska sredstva za sistemsko uporabo, levotiroksin tudi poslabšajo absorpcijo kalcijevih ionov.
Po rezultatih znanstvenih raziskav (podatki Kanadske družbe za osteoporozo) ni prepričljivih dokazov, na podlagi katerih bi bilo mogoče priporočiti dodatno uživanje drugih mineralov (magnezija, cinka, bakra itd.) Za preprečevanje ali zdravljenje osteoporoze.
Rezultati kliničnih študij v Ukrajini in drugih državah so potrdili visoko učinkovitost tega zdravila pri zdravljenju številnih bolezni. Kalcijev citrat se uporablja tudi za profilaktične namene pri različnih boleznih.
Pri osteoporozi pri starejših osteomalacija CALCIUM CITRATE je predpisana 2-6 tablet na dan, ki delijo dnevni odmerek na 3-4 odmerke. Zdravilo se jemlje pred obrokom ali 1–1,5 ure po obroku 3 mesece. Takšnim bolnikom je treba predpisati tudi vitamin D3 400–800 ie na dan, v prehrano pa tudi olje, mleko, ribe in jajca.
CALCIUM CITRATE je optimalna dozirna oblika za zagotavljanje kalcija ne samo za odrasle, ampak tudi za otroke in mladostnike, saj pomaga povečati mineralno gostoto kosti, povečati kostno maso, okrepiti dentin in zobno sklenino. Otrokom, mlajšim od 6 mesecev, se predpisujejo 1/2 tablete (250 mg) (zdrobljene, raztopljene v majhni količini mleka), v starosti 6–12 mesecev - tudi 1/2 tablete 2-krat na dan, pri starosti 1 leta - 10 let - 1-2 tableti, 10-18 let - 2-3 tablete na dan.
Indikacije za imenovanje Kalcijev citrat so:
hipokalcemija zaradi krvavitve različnega izvora, kot tudi med nosečnostjo in dojenjem, s poškodbami - za zapolnitev povišane telesne potrebe po kalcijevih ionih;
kršitev absorpcije kalcija pri boleznih prebavnega trakta in povečano izločanje kalcija skozi ledvice in črevesje;
hipoparatiroidizem, dehidracija organizma različne geneze, alergijske bolezni in alergijske zaplete med jemanjem zdravil, povečana prepustnost žilnih sten, zmanjšanje strjevanja krvi.
Pri jemanju glukokortikoidov, peroralnih kontraceptivov, levotiroksina je treba predpisati kalcijev citrat. V zadnjih treh primerih se zdravilo vzame 1 tableta 6-krat na dan po obroku.
Kalcijev citrat se praviloma dobro prenaša, včasih se pojavijo dispeptični simptomi (zaprtje ali driska, slabost, bruhanje, izguba apetita, bolečine v trebuhu), lahko se pojavi poliurija.
Sočasna uporaba zdravila CALCIUM CITRATE z antacidi, ki vsebujejo aluminij, ni priporočljiva zaradi zmanjšanja njihove učinkovitosti. Nepotrebno ga je predpisati sočasno z drugimi pripravki kalcija.
V zaključku lahko omenimo pozitivne farmakološke lastnosti CALCIUM CITRATE:
citratna kalcijeva sol je dobro raztopljena in absorbirana v prebavnem traktu, kar vodi v dobro absorpcijo kalcija v telesu in s tem učinkovitost zdravila v profilaktični ali terapevtsko uporaboTo potrjujejo rezultati številnih kliničnih študij.
Nizko tveganje za nastanek kamna v ledvicah pri jemanju zdravila povečuje vrednost kalcijevega sulfata pri dolgotrajni uporabi.
I.S. Chekman, predstojnik Oddelka za farmakologijo s predmetom Klinična farmakologija Nacionalne medicinske univerze, dopisni član Nacionalne akademije znanosti in Akademije medicinskih znanosti Ukrajine, častni znanstveni in tehnološki profesor, profesor
Stran 1
Reakcijo karbonatov s kislinami lahko uporabimo kot vzorec za karbonate. Ogljikova kislina je zelo šibka in nestabilna kislina. Svoje soli lahko iztisne z delovanjem manj hlapnih in močnejših kislin.
Podobno potekajo reakcije kalcijevega karbonata s kislinami.
Reakcija karbonata s klorovodikovo kislino daje kalcijev klorid in magnezijev klorid, ki se dobro raztopita v vodi in ostanejo v obliki raztopin različnih koncentracij. Hitrost reakcije v kolektorjih te vrste je odvisna predvsem od tlaka in temperature.
Kot posledica reakcije karbonata s klorovodikovo kislino kalcijev klorid in magnezija, dobro topen v vodi in ostane v obliki raztopine različnih koncentracij.
Vnos ne-suhega natrijevega karbonata v reakcijo zahteva višji tlak in povečanje količine katalizatorja.
Razlaga navedenih pojavov ali opaženih pojavov: zakaj se reakcija kalcijevega karbonata z žveplovo kislino začne najprej nasilno in se nato ustavi. Zakaj pri segrevanju suhe snovi amonijevega karbonata izgine iz cevi.
Ugoden učinek kalcijevega karbonata na stabilnost portlandskega cementa je mogoče pojasniti z reakcijo karbonata z minerali klinkerja, ki vsebujejo aluminij. Tako je aluminatna komponenta cementnega kamna kemično vezana, preden pride v stik s sulfati iz okolja.
Nekatere aplikacije barijevega karbonata temeljijo na praktični netopnosti barijevega sulfata, ki nastane z reakcijo barijevega karbonata s snovmi, ki vsebujejo sulfatne ione. Torej, ko sušenje opeke pred gorenjem, belega cvetenja pojavi na njeni površini, ki jih povzroča kristalizacija mavca ali magnezijevega sulfata, ki jih vsebuje glina. Da bi to preprečili, se glini doda barijev karbonat, ki povzroči obarjanje sulfatnega iona.
V svojem uvodu v kemijo trdnih snovi Hedwal kot primer teoretično možne reakcije povzroči reakcijo kalcijevega karbonata s Si02, kar ima za posledico tvorbo kalcijevega silikata. Ta primer spremlja s tem, da pri tako imenovanih geotermalnih metamorfozah običajna temperatura ni dovolj, saj lahko reakcijo med kalcijevim karbonatom in silicijevo kislino opazimo v laboratorijskih pogojih le pri temperaturah od 500 ° C.
Da bi zmanjšali stroške nastajanja flegma v tem procesu, sta Klima in Ward predlagala uporabo raztopine amonijevega karbonata (namesto amonijevega nitrata) in ustvarjanje sluzi zaradi reakcije obogatenega amonijevega karbonata z apnom.
Ko se temperatura dvigne, se reakcija premakne proti tvorbi bolj alkalnega silikata. Gibson in Ward11 pri reakciji natrijevega karbonata s kvarcem pri temperaturi od 726 do 805 ° C v toku dušika so pokazali, da se orto-silikat tvori v prisotnosti zadostne količine natrijevega karbonata. Hitrost reakcije je odvisna od časa, velikosti vzorca, hitrosti pretoka plina in sestave reakcijske zmesi. Gibson in Ward trdita, da so natrijevi silikati srednjega razreda.
Presežek natrijevega karbonata titriramo s klorovodikovo kislino. Količina žvepla v analiziranem produktu se izračuna s količino reagiranega natrijevega karbonata.
In kalcijev karbonat in kako te kemične spojine medsebojno delujejo.
Kalcijev karbonat
CaCO2 mrežica kalcijevega karbonataCaCO₃ je zelo pogosta spojina na svetu in jo sestavljajo: kreda, apnenec, marmor itd. Zato je treba omeniti, da je vloga te snovi za ljudi zelo pomembna, ker se kalcijev karbonat v živilski industriji pogosto uporablja kot naravna bela barva. CaCO₃ se uporablja tudi v proizvodnji papirja, plastike, v gradbeništvu in na mnogih drugih področjih.
Kalcijev karbonat je bela snov (trdni kristali) v prahu ali trdni obliki. Lahko reagira z vodo, vendar v njem ni povsem raztopljen. Zato voda postane motna in v njej je bela oborina. Ampak, če bo reakcija z vodo potekala v prisotnosti, potem bomo dobili solno kislino, kalcijev bikarbonat:
CaCO₃ + CO₂ + H₂O → Ca (HCO₃)
Razmislite, kako nastane kalcijev karbonat.
Večino kalcijevega karbonata dobimo iz naravnih virov. Torej, da bi dobili kalcijev karbonat za, praviloma, uporabite čist vir, pogosto marmor.
 Mavrični kip Davida Michelangelo Buonarroti
Mavrični kip Davida Michelangelo Buonarroti
Toda v laboratorijskih pogojih lahko kalcijev karbonat dobimo z žganjem kalcijevega oksida. Žganje se nanaša na splošno pojem gorenja, zaradi katerega kemikalije pridobijo nove lastnosti. Peko se izvaja pri dovolj visoki temperaturi, ki ne doseže taljenja.
Voda se zmeša z nastalim kalcijevim oksidom, reakcija proizvaja hidroksid. Nato tehniki dobijo ogljikov dioksid, ki se prehaja skozi predhodno pridobljeno raztopino. Nastala oborina je kalcijev karbonat:
CaO + H20 = Ca (OH);
Ca (OH) + CO2 = CaCO2 + H20
Če sol ogljikove kisline in kalcija segrevamo na visoko temperaturo (900 - 1000 ° C), bomo kot rezultat kemičnega procesa dobili ogljikov dioksid (ogljikov dioksid) in kalcijev oksid CaO - apno, ki se uporablja v gradbeništvu:
CaCO2 = CaO + CO₂
Če je temperatura še višja (1500 ° C), bodo reakcijski produkti kalcijev karbid in ogljikov monoksid.
Klorovodikova kislina
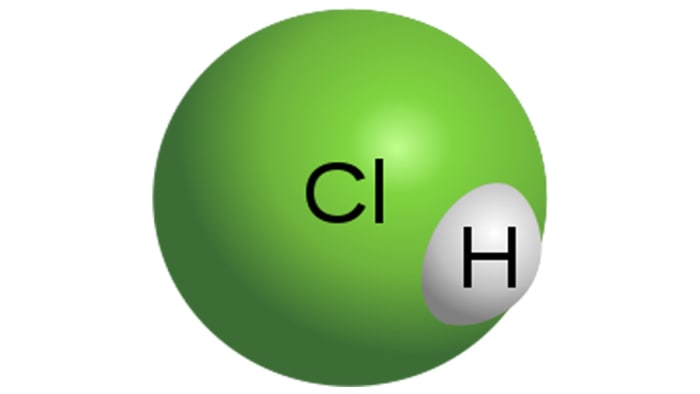 Molekula klorovodikove kisline
Molekula klorovodikove kisline
HCl je močna monobazična kislina, ki se pridobiva z raztapljanjem klorovodika v vodi. Je brezbarvna tekočina, čeprav ima tehnična kislina lahko rumeno obarvanost, na primer zaradi nečistoče železa. Lastnosti HCl bodo neposredno odvisne od koncentracije vodikovega klorida v raztopini.
Soli klorovodikove kisline se imenujejo kloridi. Ta snov je zelo jedka, zato zahteva previdno ravnanje: tudi če na kožo pade majhna kapljica, se močni kemični opekini ne moremo izogniti. Zato je pri delu z močnimi kislinami priporočljivo vedno nositi s seboj nevtralizatorje: šibke alkalne raztopine (pecilni soda) itd. Treba je spomniti, da pri odpiranju posode s koncentrirano kislino HCl hlapov se oblikujejo, ki negativno vplivajo na oči in dihalni sistem. Zato bi bilo v kemijskih poskusih najbolje uporabiti respirator in očala.
Pridobivanje klorovodikove kisline
Plin vodikov klorid se raztopi v vodi. Sama klorovodik dobimo takole: vodik se kuri v kloru in tako dobimo sintetično kislino. Alternativno lahko klorovodikovo kislino dobimo z uporabo stranskih plinov, ki jih dobimo v številnih kemijskih poskusih, na primer, kadar so klorirani ogljikovodiki klorirani. Tako pridobljena kislina se imenuje abgasic.
Nanesite klorovodikovo kislino v medicini, industriji in tudi na kemijske reakcije.
Brezbarvna kislina z ostrim vonjem vodikovega klorida dobro reagira s kovinami. Pojavi se redoksna reakcija. Reducirna sredstva v reakcijskem postopku so atomi kovin, oksidacijska sredstva pa so kationi vodika.
V glavnem kemične reakcije s kovinami spremlja sproščanje vodika. Intenzivnost interakcije je odvisna od aktivnosti kovine, npr. Litij alkalijske kovine reagira burno, medtem ko je reakcija z aluminijem šibka zaradi močnega oksidnega filma tega elementa.
Klorovodikova kislina in cink:
2HCl + Zn = ZnCl2 + H3
Klorovodikova kislina in železo:
2HCl + Fe = FeCl2 + H3
Klorovodikova kislina in magnezij:
2HCl + Mg = MgCl2 + H3
 Magnezijev klorid, ki se uporablja za čiščenje cest iz ledu
Magnezijev klorid, ki se uporablja za čiščenje cest iz ledu
S kovinskimi oksidi kislina tvori sol in vodo:
CuO + 2HCl = CuCl2 + H20
Reakcija klorovodikove kisline in kalcijevega karbonata
Za poskus bo potrebno:
epruveta;
kemična pipeta;
trdni kalcijev karbonat (marmor);
klorovodikovo kislino;
rokavice;
respirator.
Pozor! Te izkušnje ne poskusite sami!
Poskus izvedite v dobro prezračevanem prostoru, pri delu s klorovodikovo kislino bodite previdni.
V posodo dodajte nekaj kosov marmorja in pipeto dodajte nekaj klorovodikove kisline. Posledica bo takojšnja reakcija z nastankom mehurčkov - sproščanje ogljikovega dioksida. Gre za reakcijo izmenjave, katere proizvodi so: šibka in nestabilna spojina, karbonska kislina, ki se razgradi v ogljikov dioksid in vodo. Enačba reakcije raztapljanja kalcijevega karbonata v klorovodikovi kislini:
CaCO2 + 2HCl (raztopina) → CaCl2 + CO2 + H20
- značilnost magnezijevega elementa: elektronska struktura, možna oksidacijska stanja, osnovne spojine: oksid, hidroksid, soli. Kaj je karbonizacija in kakšna je njena vloga v gradbeništvu.
MgCO 3 = MgO + CO 2
Uporaba.
V industriji se uporablja za proizvodnjo ognjevzdržnih materialov, cementov in čiščenja naftnih derivatov, kot polnilo v proizvodnji gume. Ultra lahek magnezijev oksid se uporablja kot zelo fin abraziv za čiščenje površin, zlasti v elektronski industriji.
V medicini se uporablja v primeru povečane kislosti želodčnega soka, saj ga povzroča prekomerna vsebnost klorovodikove kisline. Po zaužitju magnezijeve kisline pride tudi v stik s kislino v želodec.
V živilski industriji je registriran kot aditiv za živila E530.
Je absolutni reflektor - snov s koeficientom odbojnosti, ki je enak širokemu spektralnemu pasu. Lahko se uporablja kot bel bel standard.
Magnezijev hidroksid - Glavni kovinski hidroksid je magnezij. Slaba netopna baza.
V standardnih pogojih je magnezijev hidroksid brezbarvna heksagonalna rešetka. Pri temperaturi nad 350 ° C se razgradi v magnezijev oksid in vodo. Absorbira ogljikov dioksid in vodo iz zraka in tvori glavni magnezijev karbonat. Magnezijev hidroksid je praktično netopen v vodi, vendar je topen v amonijevih solih. To je šibka osnova. Pojavlja se v naravi v obliki mineralnega brucita.
Prejem.
Interakcija topnih magnezijevih soli z alkalijami: \\ t
Na splošno:
Mg 2+ + 2OH - = Mg (OH) 2 ¯
Primeri:
MgCl2 + 2NaOH = Mg (OH) 2p + 2NaCl
Mg (NO3) 2 + 2KOH = Mg (OH) 2 ¯ + 2KNO 3
Interakcija raztopine magnezijevega klorida z zgorelim dolomitom:
MgCl2 + CaO × MgO + 2H2O = 2 Mg (OH) 2p + CaCl2
Medsebojno delovanje kovinskega magnezija z vodno paro: \\ t
Mg + 2H 2 O = Mg (OH) 2 ¯ + H 2 -
Kemijske lastnosti
Kot vse šibke baze je magnezijev hidroksid termično nestabilen. Razgradi se pri segrevanju na 350 ° C:
Deluje s kislinami in tvori sol in vodo (reakcija nevtralizacije): \\ t
Mg (OH) 2 + 2HCl = MgCl2 + 2H20
Mg (OH) 2 + H2S04 = MgS04 + 2H20
Medsebojno delovanje s kislimi oksidi za tvorbo soli in vode: \\ t
Mg (OH) 2 + S03 = MgS04 + H20
Interakcija z vročimi koncentriranimi raztopinami alkalij z nastajanjem hidroksimagnezatov: \\ t
Mg (OH) 2 + 2NaOH = Na2
Mg (OH) 2 + Sr (OH) 2 = Sr
Uporaba.
Magnezijev hidroksid se uporablja za vezavo žveplovega dioksida, kot flokulanta za čiščenje odpadne vode, kot zaviralec gorenja v termoplastičnih polimerih (poliolefini, PVC), kot dodatek v detergentih, za proizvodnjo magnezijevega oksida, rafiniranja sladkorja, kot sestavine zobnih past.
V medicini se uporablja kot zdravilo za nevtralizacijo kisline v želodcu, pa tudi zelo močan odvajalnik.
V Evropski uniji je magnezijev hidroksid registriran kot aditiv za živila E528.
Magnezijeve soli.
Večina magnezijevih soli je zelo topnih v vodi. Ion Mg 2+ daje raztopini grenak okus. Magnezijevi halidi, z izjemo MgF2, so zelo higroskopni - krvavijo v zraku.
Magnezijev klorid MgCl2 (magnezijev klorid) brezvodne taline pri 718 ° C. V prisotnosti sledov vode v zraku »kadi« - razpade se na HCl in MgO. Iz vodne raztopine se sproščajo brezbarvni kristalni hidrati z 1, 2, 4, 6, 8 in 12 vodnimi molekulami. V temperaturnem območju od –3,4 do 116,7 ° je MgCl 2 × 6H 2 0 kristalinični hidrat stabilen, kar se naravno pojavlja kot mineral bischofite, v velikih količinah pa se pridobiva z izhlapevanjem morskih slanic. Magnezijev klorid tvori dvojne soli, od katerih je mineralni karnalit KCl × MgCl 2 × 6H 2 O - vir magnezija in kalijevega klorida - izjemno pomemben.
Uporaba.
1. Magnezijev klorid se uporablja predvsem za proizvodnjo kovinskega magnezija, za pridobivanje magnezijevih cementov se uporablja MgCl 2 × 6H 2 0.
2. Uporablja se za predelavo ledu in snežne odeje kot dodatka. Zaradi reakcije s snegom povzroča taljenje. Ima 3. razred nevarnosti (zmerno nevarne snovi) in agresivne korozivne lastnosti.
Magnezijev bikarbonat - kisla sol magnezija in ogljikove kisline s formulo Mg (HCO 3) 2, obstaja samo v vodnih raztopinah.
Prejem.
Prenos ogljikovega dioksida skozi suspenzijo magnezijevega karbonata: \\ t
MgCO 3 + CO 2 + H 2 O = Mg (HCO 3) 2
Fizične lastnosti.
Magnezijev bikarbonat obstaja samo v vodnih raztopinah.
Prisotnost magnezijevega bikarbonata v vodi povzroča njegovo začasno togost.
Kemijske lastnosti
Pri koncentriranju raztopine se magnezijev bikarbonat razgradi:
Mg (HCO3) 2 = MgC03 + C02- + H20
Magnezijev hidrofosfat (disubstituiran magnezijev fosfat) - kisla sol magnezija in fosforjeva kislina s formulo MgHPO 4, rahlo topna v vodi, tvori kristalne hidrate.
Prejem.
Učinek ortofosforne kisline na magnezijev oksid ali magnezijev karbonat: \\ t
MgO + H3P04 = MgHP04 + H20
MgCO3 + H3P04 = MgHP04 + C02- + H20
Delovanje disubstituiranega natrijevega ortofosfata na magnezijev klorid: \\ t
MgCl2 + 2Na2HP04 = MgHP04 + 2NaCl
Razgradnja magnezija dihidrogen fosfata:
Mg (H 2 PO 4) 2 = MgHPO 4 + H3P04
Fizične lastnosti.
Magnezijev hidrogen fosfat tvori bele kristale, ki so kristalni hidrati: pri temperaturi do 225 ° C nastane MgHPO4 monohidrat. H 2 O, gostota 2.32 g / cm3, pri temperaturi 36 ° C nastane MgHPO4 trihidrat. 3H 2 O, gostota 2,10 g / cm3, s sobni temperaturi Nastane MgHPO4 heptahidrat. 7H2O.
Kemijske lastnosti.
Pri segrevanju gre v pirofosfat:
Uporaba.
Uporablja se za prehransko dopolnilo E343.
Magnezijev dihidrogenfosfat - kisla sol kovine magnezija in ortofosforne kisline s formulo Mg (H 2 PO 4) 2, brezbarvni higroskopski kristali, topni v vodi, tvorijo kristalne hidrate.
Prejem.
Raztapljanje hidroksida ali magnezijevega oksida v ortofosforni kislini: \\ t
Fizične lastnosti.
Magnezijev dihidrogenfosfat tvori brezbarvne kristale.
Sestava kristaliničnega hidrata v Mg (H 2 PO 4) 2. nH2O, kjer je n = 2, 4, 6.
Magnezijev karbid - binarna anorganska spojina magnezija in ogljika s formulo MgS2. Znan je tudi magnezijev karbid s formulo Mg 2 C.
Prejem.
Sintranje magnezijevega fluorida in kalcijevega karbida:
Tekoči acetilen nad magnezijevim prahom:
Z obnovo pentana z magnezijevim prahom pri 650 ° C lahko dobimo bolj kompleksen karbid Mg2C3.
Kemijske lastnosti.
Pri segrevanju se razgradi z nastankom vmesnega karbida Mg2C3:
Deluje z vodo:
Magnezijev karbonatmagnezijev karbonat, MgCO3 - magnezijeva sol ogljikove kisline.
Lastnosti
Beli kristali, gostota 3,037 g / cm3. Pri 500 ° C je opazen, pri 650 ° C pa se popolnoma razgradi v MgO in CO2. Topnost magnezijevega karbonata v vodi je neznatna (22 mg / l pri 25 ° C) in se z naraščanjem temperature zmanjšuje. Ko je CO2 nasičen z vodno suspenzijo MgCO3, se slednji raztopi zaradi tvorbe Mg (HCO3) 2 bikarbonata. Iz vodnih raztopin v odsotnosti presežka CO 2 se sproščajo bazični magnezijevi karbonati. Pri karbonatih številnih kovin magnezijev karbonat tvori dvojne soli, ki vključujejo naravni mineral dolomit MgCO 3 · CaCO 3.
Razširjenost v naravi.
Magnezijev karbonat je v naravi široko porazdeljen v obliki mineralnega magnezita.
Uporaba.
Osnovni magnezijev karbonat 3MgCO3 · Mg (OH) 2 · 3H2O (tako imenovani beli magnezijev oksid) se uporablja kot polnilo v gumenih zmesi za izdelavo toplotnoizolacijskih materialov.
Magnezijev karbonat je potreben pri proizvodnji stekla, cementa, opeke.
Magnezijev nitrat Mg (NO 3) 2 - brezbarvni higroskopski kristali s kubično rešetko; tališče 426 ° C (z razpadom). Topnost v vodi (g na 100 g): 73.3 (20 ° C), 81.2 (40 ° C), 91.9 (60 ° C). Tudi topen v etanolu, metanolu, tekočem NH3. Glede na koncentracijo iz vodnih raztopin kristalizirajo nona-, heksa- in dihidrati.
Sestavina kompleksnih gnojil, ker je magnezij del klorofila, ki je potreben za fotosintezo, povečuje aktivnost mnogih encimov in deluje kot fosforni transporter. Zaradi visoke topnosti in nizke električne prevodnosti je izdelek izjemno primeren za foliarno hranjenje in fertigacijo, zlasti pri uporabi vode za namakanje z visoko koncentracijo soli. Gnojilo se uporablja za prehrano korenin in listja zelenjave, jagodičja, sadnih rastlin, grozdja; oksidant v pirotehničnih sestavinah.
Karbonacija- nasičenje katere koli raztopine z ogljikovim dioksidom. Uporablja se v gradbeništvu.
Mineralna karbonacija - silicijeva kislina v silikatih se nadomesti z ogljikovo kislino, da se tvorijo karbonati. Karbonatov mineral v sedimentnih kamninah je kalcit CaCO3. Manj pogosta sta magnezit - MgCO3 in dolomit - CaMg (CO3) 2. V čista voda, ki ne vsebuje ogljikove kisline, se kalcit raztopi v majhni količini (0,03 g na liter vode); magnezit je praktično netopen. Če voda vsebuje ogljikov dioksid, se kalcit z lahkoto raztopi z nastajanjem kislega kalcijevega karbonata, topnega v vodi - Ca (HCO3) 2.
Karbonizacija je sprememba, ki se pojavi v betonu na portlandskem cementu, ko je izpostavljen zraku C0 2. Posebej prizadet je kalcijev hidroksid Ca (OH) 2 v prisotnosti vlage. Kalcijev hidroksid se pretvori v kalcijev karbonat, ko absorbira ogljikov dioksid. Kalcijev karbonat je slabo topen v vodi in zato skuša hermetično zapreti pore na površini betona (kar pomeni gost, vodotesen beton).
Značilno je, da pH porne vode v betonu znaša od 10,5 do 11,5. Če se zaradi karbonizacije zmanjša na 9 in manj, je možna korozija armature. Zato je debelina karbonizirane plasti pomemben dejavnik pri zaščiti ojačitve: večja je karbonizacija, večja je nevarnost korozije jekla. Globino karbonacije lahko določimo z obdelavo betona s fenolftaleinom. Prisotnost alkalnih lastnosti pod vplivom fenolftaleina je označena z videzom rožnate barve, medtem ko gazirani beton ohranja svojo prvotno barvo.
Visokokakovostni gosti beton se zelo počasi karbonizira. Malo verjetno je, da se bo karbonizacija opazila na globini več kot 5-10 mm tudi po obratovanju 50 let. Po drugi strani pa lahko globina karboniziranja prepustnega betona nizke trdnosti doseže 25 mm v manj kot 10 letih. Izkušnje kažejo, da so nizko kakovostni betonski izdelki še posebej dovzetni za karbonizacijo.
- značilnost kalcijevega elementa: elektronska struktura, možna oksidacijska stanja, glavne spojine: oksid, hidroksid, soli.
Kalcij - element glavne podskupine druge skupine, četrto obdobje periodnega sistema kemijskih elementov DI Mendeleev, z atomsko številko 20. Označuje ga simbol Ca (lat. kalcij). Elektronska struktura 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 = [18 Ar] 4s 2, oksidacijsko stanje +2, 0. Nanaša se na zemeljsko alkalijske kovine.
Preprosta snov kalcij je mehka, kemično aktivna zemeljsko alkalijska kovina srebrno bele barve. Industrijska proizvodnja: elektroliza staljenega kalcijevega klorida.
Kalcijev oksid CaO - bazični oksid, živo apno. Bel, higroskopičen. Ognjevzdržen, toplotno nestabilen, hlapen med vžigom. Energično reagira z vodo (z visokim ekso efektom), tvori močno alkalno raztopino, proces pa imenujemo gašenje apna. Reagira s kislinami, kovinskimi oksidi, nekovinami. Uporablja se za sintezo drugih kalcijevih spojin, ki so sestavni del veznih materialov v gradbeništvu.
Proizvodnja v industriji - žganje apnenca (900 - 1200 o C)
Kalcijev hidroksid Ca (OH) 2 - hidrirano apno, bazični hidroksid. Razgradi se z zmernim segrevanjem. Bel, higroskopičen. Absorbira vlago in ogljikov dioksid iz zraka. Rahlo topen v mrazu. vode, še manj - v vreli vodi. Bistra raztopina (apnenčasta voda) se hitro spremeni zaradi obarjanja hidroksida (suspenzija se imenuje mlečno apno). Kvalitativna reakcija je prenos ogljikovega dioksida skozi apneno vodo s pojavom usedline CaCO3 in njenim prehodom v raztopino. Reagira s kislinami in kislinskimi oksidi, vstopa v reakcije ionske izmenjave.
Uporablja se v gradbeništvu za pripravo apnene malte (pesek + gašeno apno + voda), ki služi kot vezni material za kamen in zid, končne (omet) stene in druge gradbene namene. Strjevanje takšnih raztopin je posledica absorpcije CO2 iz zraka.
Ca (OH) 2 + CO 2 → CaCO 3 + H 2 O
Ca (OH) 2 + H2SO4 → CaSO4 + 2H2O,
Reagira s solmi, če nastane oborina: \\ t
Ca (OH) 2 + Na2S03 → CaS03 + 2NaOH
Kalcijeve soli.
Kalcijev sulfat (CaSO 4) - anorganska spojina, kalcijeva sol žveplove kisline.
Je v naravi najdena kot CaSO 4 dihidrat? 2H 2 O (sadra, selenit) in v brezvodnem anhidritu.
Kalcijev klorid, CaCl2 - kalcijeva sol klorovodikove kisline.
Ima visoke higroskopske lastnosti. Topnost (g na 100 g H20): 74 (20 ° C) in 159 (100 ° C). Vodne raztopine kalcijevega klorida zamrznejo pri nizkih temperaturah (20% pri –18,57 ° C, 30% pri –48 ° C).
Tvori hidrat CaCl2 · 6H2O, stabilen do 29,8 ° C; pri višjih temperaturah iz nasičene raztopine padejo kristalni hidrati s 4, 2 in 1 molekulami H2O. Ko se CaCl2 * 6H2O (58,8%) zmeša s snegom ali ledom (41,2%), se temperatura spusti na -55 ° C (kriohidratna točka).
Kalcijev klorid se pridobiva kot stranski proizvod pri proizvodnji sode.
V kemijskem laboratoriju se kalcijev klorid uporablja kot polnilo za sušilne cevi, imenovane tudi kalcijev klorid, namenjen za izolacijo snovi v posodi iz atmosferske vodne pare in za sušenje plinov.
Kalcijev klorid se uporablja tudi kot pospeševalnik za vezavo cementa;
Kalcijev karbonat (kalcijev karbonat) - anorganska kemična spojina, sol ogljikove kisline in kalcij. Kemijska formula —CaCO 3. V naravi najdemo v obliki mineralov - kalcit, aragonit in vaterit, je glavna sestavina apnenca, marmorja, krede, je del lupine jajc. Netopen v vodi in etanolu.
Kiti, različna tesnila - vsi vsebujejo kalcijev karbonat v znatnih količinah. Prav tako je kalcijev karbonat bistvena sestavina pri proizvodnji gospodinjskih kemikalij.
Kalcijev karbonat se pogosto uporablja tudi v čistilnih sistemih, kot sredstvo za boj proti onesnaževanju okolja, s pomočjo kalcijevega karbonata pa se ponovno vzpostavi kislinsko-bazno ravnovesje tal.
- Primeri, ki ponazarjajo uporabo oksidov in hidroksidov kalcija in magnezija v gradbeništvu.
Kalcijev oksid in hidroksid:
Ko bele sobe.
Ko pobeljevanje lesene ograje in razmazanje špirovci - za zaščito pred gnitje in ogenj.
Za pripravo apnene malte. Lipa se že od antičnih časov uporablja za zidanje. Mešanica se običajno pripravi v tem razmerju: na del zmesi kalcijevega hidroksida (hidriranega apna) in vode dodamo tri ali štiri dele peska (po teži). Ko se to zgodi, se zmes strdi z reakcijo: Ca (OH) 2 + CO2 → CaCO3 H2 + H2O. To je eksotermna reakcija, sproščanje energije je 27 kcal (113 kJ).
Kot je razvidno iz reakcije, se med njim sprosti voda. To je negativen dejavnik, saj v prostorih, zgrajenih z apneno malto, visoka vlažnost traja dolgo časa. V zvezi s tem, kot tudi zaradi številnih drugih prednosti pred kalcijevim hidroksidom, ga je cement praktično nadomestil kot vezivo za gradbene rešitve. Poleg tega je tudi nesprejemljivo za uporabo pri polaganju peči, saj se pod vplivom visokih temperatur sprosti zadušljiv ogljikov dioksid.
Za pripravo silikatnega betona. Sestava silikatnega betona je enaka sestavi apnene malte, vendar pa se pripravlja z drugo metodo - mešanica kalcijevega oksida in kremenovega peska se ne obdeluje z vodo, temveč s pregreto (174,5-197,4 ° C) vodno paro v avtoklavu pri tlaku 9-15 atmosfer.
Pri izdelavi silikatnih opek.
Oksid in magnezijev hidroksid:
za proizvodnjo kombiniranih sistemov ognjevzdržnih materialov (magnezitne gradbene plošče) za proizvodnjo cementov. Kot vezivo se uporablja magnezijev oksid (kavstični magnezit), ki se pri mešanju z raztopino MgCl2 hitro strdi in poveča moč v zraku.
- trdota naravnih voda: definicija, vrste trdote, metode za odstranjevanje trdote vode: fizikalne, kemijske (reakcijske enačbe), fizikalno-kemijske.
Naravna voda z veliko količino kalcijevih ali magnezijevih soli v raztopini se imenuje trda voda v nasprotju z mehko vodo, ki vsebuje malo ali nič kalcijevih in magnezijevih soli.
Prvi je posledica prisotnosti kalcijevih in magnezijevih bikarbonatov, drugi pa prisotnosti soli močnih kislin, sulfatov ali kloridov kalcija in magnezija. Pri dolgotrajnem vrenju vode s karbonatno trdoto se v njem pojavi oborina, sestavljena pretežno iz CaCO3, istočasno pa se sprosti CO2.
Obe snovi se pojavita kot posledica razgradnje kalcijevega karbonata:
Zato se karbonatna togost imenuje tudi začasna togost. Kvantitativno je za začasno togost značilna vsebnost bikarbonatov, ki se odstranijo iz vode, ko jo kuhamo eno uro. Trdnost, ki ostane po tem vrenju, se imenuje stalna togost.
Trdota vode je izražena kot vsota miliekvivalentov kalcijevih in magnezijevih ionov v vodi. Ena miliekvivalentna togost ustreza vsebnosti 20,04 mg / l ali 12,16 mg / l.
Trdota naravnih voda je zelo različna. V različnih rezervoarjih je drugačen, v isti reki pa se spreminja skozi vse leto (minimalno med poplavo). Trdota voda morja je veliko večja od reke in jezera. Tako ima črnomorska voda skupno trdoto 65,5 meq / l. Povprečna vrednost trdote vode v svetovnem oceanu je 130,5 meq / l (vključno z 22,5 meq / l na meq / l).
Zaradi prisotnosti znatne količine kalcijevih ali magnezijevih soli v vodi je voda neprimerna za številne tehnične namene. Tako se pri daljšem hranjenju parnih kotlov s trdo vodo njihove stene postopoma prekrijejo z gosto skorjo nakiii. Takšna skorja že pri debelini plasti v veliki meri zmanjšuje prenos toplote s stenami kotla in posledično vodi k povečani porabi goriva. Poleg tega lahko povzroči nastanek mehurčkov in razpok tako v ceveh za ogrevanje kot tudi na stenah kotla.
Trda voda ne daje pene z milom, ker se topne natrijeve soli maščobnih kislin - palmitinske in stearinske -, ki jih vsebuje milo, pretvorijo v netopne kalcijeve soli istih kislin:
Trda voda se ne more uporabiti pri izvajanju nekaterih tehnoloških procesov, na primer pri barvanju.
Stalna trdota vode je posledica prisotnosti v njem predvsem sulfatov in kloridov kalcija in magnezija ter se ne izloča z vrenjem. Vsota začasne (odstranljive) in konstantne trdote je skupna trdota vode.
Obstajajo različni načini za določanje togosti.
Razmislite o dveh od njih:
1) določitev časovne togosti z uporabo titrirane raztopine klorovodikove kisline
2) kompleksometrična metoda za določanje skupne togosti.
Med titracijo vzorca vode s klorovodikovo kislino v prisotnosti metil oranževca pride do razkroja bikarbonatov, kar povzroči začasno togost:
Metoda določanja. \\ T 100 ml preskusne vode se odvzame v erlenmajerici s pipeto ali merilnim valjem, dodajo se 2-3 kapljice metil oranža in titrira z 0,1 in 0,7. \\ T Raztopine HCl, dokler se ne pojavi oranžna barva.
Analiza rezultatov izračuna. 1 ml 0,1 n. HCl raztopina ustreza 0,1 / 1000 g-eq ali 0,1 mg-eq Ca 2+. V (HCl) ustreza 0,1 V (HCl) / 1000 g-eq ali 0,1 V (HCl) mg-eq Ca 2+. 0,1 V (HCl) mEq v volumnu V A. Za izražanje togosti v miligramskih ekvivalentih na 1 l vode, morate razdeliti vrednost, ugotovljeno z V A, in jo pomnožiti s 1000, tj. Trdota vode, ki se preučuje, je enaka:
![]()
Metode odprave.
Toplotno mehčanje. Na podlagi vrelišča vode, zaradi termično nestabilnih kalcijevih in magnezijevih bikarbonatov se razgradijo z oblikovanjem lestvice:
Ca (HCO3) 2 → CaCO3 CO2 + CO2 + H2O.
Vrelo odstrani le začasno (karbonatno) trdoto. Najde aplikacijo v življenju.
Mehčanje reagenta. Metoda temelji na dodatku vode natrijevega karbonata Na2CO3 ali hidriranega apna Ca (OH) 2. Hkrati kalcijeve in magnezijeve soli preidejo v netopne spojine in se zato oborijo.
Dodatek hidriranega apna na primer vodi do pretvorbe kalcijevih soli v netopni karbonat:
Ca (HCO3) 2 + Ca (OH) 2 → 2CaCO3 + 2H2O
Najboljši reagent za odpravo skupne trdote vode je natrijev ortofosfat Na3PO4, ki je del večine gospodinjskih in industrijskih izdelkov:
3Ca (HCO3) 2 + 2Na3PO4 → Ca3 (PO4) 2 6 + 6NaHCO3
3MgSO4 + 2Na3PO4 → Mg3 (PO4) 2 + 3Na2S04
Kalcijev in magnezijev ortofosfat je zelo slabo topen v vodi in se tako zlahka loči z mehansko filtracijo. Ta metoda je upravičena pri relativno visoki porabi vode, saj vključuje reševanje številnih specifičnih problemov: filtracijo sedimentov, natančno doziranje reagenta.
Kationizacija. Metoda temelji na uporabi ionsko izmenjevalnega zrnatega nalaganja (najpogosteje ionske izmenjevalne smole). Takšna obremenitev pri stiku z vodo absorbira katione soli trdote (kalcij in magnezij, železo in mangan). Namesto tega, odvisno od ionske oblike, oddaja ione natrija ali vodika. Te metode se imenujejo Na-kationizacija in H-kationizacija. S pravilno izbrano ionsko izmenjalno obremenitvijo se trdota vode z enostopenjsko natrijevo kationizacijo zmanjša na 0,05-0,1 ° W, pri dvostopenjski obremenitvi - na 0,01 ° W. V industriji ionski izmenjevalci nadomestijo ione kalcija in magnezija z natrijevim in kalijevim ionom, pri čemer proizvajajo mehko vodo.
Reverzna osmoza. Metoda temelji na prehodu vode skozi polprepustno membrano (običajno poliamid). Poleg soli trdote se odstrani večina drugih soli. Učinkovitost čiščenja lahko doseže 99,9%.
Obstaja nanofiltracija (nominalni premer lukenj membrane je enaka enotam nanometrov) in picofiltracija (nominalni premer lukenj membrane je enaka enotam pikometrov).
Kot slabosti te metode je treba opozoriti:
Potreba po predobdelavi vode, ki se dobavlja membrani reverzne osmoze;
Razmeroma visok strošek 1 litra proizvedene vode (draga oprema, drage membrane);
Nizka mineralizacija proizvedene vode (zlasti pri picofiltraciji). Voda postane skoraj destilirana.
Elektrodializa Temelji na odstranjevanju soli iz vode pod vplivom električnega polja. Odstranjevanje ionov raztopljenih snovi nastane zaradi posebnih membran. Tako kot pri uporabi tehnologije reverzne osmoze se poleg trdote nastane tudi odstranitev drugih soli.
Popolnoma čisto vodo iz trdnih soli lahko destiliramo.
