Compuși de sulf. Gradul de oxidare a sulfului în compuși. Formule de compuși cu sulf. Sulf. Hidrogen sulfurat. sulfurilor
Sulf, fizic și fizic chimice. Valoarea biologică a sulfului, aplicarea acestuia (demercurizarea).
Cera în natură
Sulf nativ
PbS - strălucirea plumbului
cu 2 s - strălucirea cuprului
ZnS - amestec de zinc
FeS 2 - pirită, pirită de sulf, aur de pisică
H 2 s - hidrogen sulfurat (în surse minerale și gaze naturale)
CaSO 4 * 2H20- gips
MgSC 4 * 7H20 - sare amară (engleză)
Na2S04 * 10 H20 - Sarea lui Glauber (mirabilit)
Proprietăți fizice
Substanța cristalină solidă este galbenă, insolubilă în apă, nu umezită cu apă (plutește pe suprafață), t ° kip = 445 ° С.
Una dintre cele speciale proprietățile fizice sulf -flotație, abilitatea pulberii fine de sulf să plutească, atunci când cristalele sale mari se scufundă în apă. Faptul este că sulful nu este udat de apă și particulele sale sunt ținute pe suprafața apei datorită bulelor mici de aer aderente la ele.Această proprietate este folosită pentru separarea sulfului nativ de impurități. Grind minereu, umple-l cu apă, și sufla-l de jos cu aer, sulf float în sus, și impuritățile rămân în partea de jos.alotropie
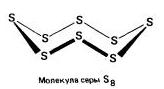
Sulful se caracterizează prin mai multe modificări alotropice., dar cele mai faimoase modificări sunt:rombic (Cristalin) , monoclinic (Ac) și plastic .
Ribic (a - sulf) - S 8
t ° pl. = 113 ° C; ρ = 2,07 g / cm3. Cea mai stabilă modificare.
Monoclinic (b - sulf) - S 8
ace de culoare galbenă închisăt ° pl. = 119 ° C; ρ = 1,96 g / cm3. Stabil la temperaturi de peste 96 ° C; în condiții normale se transformă în rombică.
plastic S n
maro din cauciuc (amorf). Nestabil, când solidificatul se transformă în rombică.
PRODUCȚIA SULFULUI PLASTIC
Structura atomului de sulf
Plasarea de electroni pe nivele și poduri
Terenul de bază
1s 2 2s 2 2p 6 3s 2 3p 4
Plasarea electronică de către
orbite (ultimul strat)gradul de
oxidarevalență
În stare de bază
Prima stare excitat
A doua stare excitat
Producția de sulf
1. Metoda industrială - topirea din minereu folosind vapori de apă.
2. Oxidarea incompletă a hidrogenului sulfurat (cu o lipsă de oxigen).
2H2S + 02 = 2S + 2H20
3. Reacția lui Wackenroder
2H2S + SO2 = 3S + 2H20
Proprietăți chimice ale sulfului
Sulful este un agent de oxidare S 0 + 2e→ S -2 | sulf - agent de reducere: S - 4e→ S +4; S - 6e→ S +6 |
1. Interacțiunea dintre sulf cutoate metalele alcaline și alcalino-pământoase, cuprul, mercurul, argintul fără încălzire: 2 Na + S→ Na2S EXPERIENȚA S + Hg = HgS Mercurul are o volatilitate ridicată. Cuplurile sale sunt otrăvitoare. Această reacție stă la baza eliminării și eliminării mercurului, de exemplu, de la un termometru medical distrus. Locurile din care este imposibil să se extragă picăturile de mercur sunt acoperite cu pulbere de sulf. Sulful și mercurul reacționează atunci când sunt atinse. Ca urmare, se formează o substanță chimică inertă și inofensivă. Acest proces se numește demercurizare. 2. Interacțiunea dintre sulfc alte metale (cu excepțiaAu, Pt) la o temperatură ridicată: 2Al + 3S T → Al2S3 Zn + S t
°
→
Experiența ZnS Cu + S t
→
CuS EXPERIENCE 3. Interacțiunea cu sulf unele non-metale pentru a forma compuși binari: H2 + S→ H 2S 2P + 3S→ P 2 S 3 C + 2S→ CS 2 | 1. Interacțiunea dintre sulf și oxigen: S + O2 t ° → S +4 02 2 S + 3 O 2 t °; pt → 2 S + 6 O 3 2. Interacțiunea dintre sulfc halogeni (cu excepția iodului): S + Cl2→ S + 2Cl2 ** Interacțiunea cu sulf acizi - agenți oxidanți: S + 2H2S04 (conc)→ 3S + 4O2 + 2H20 S + 6HNO3 (conc)→ H 2S + 6O 4 + 6NO 2 + 2H 2O ** Reacțiile de disproporție: 4. 3 S 0 + 6 KOH→ K 2 S +4 O 3 + 2 K 2 S -2 + 3 H 2 O |
cerere
Vulcanizarea cauciucului, obținerea de ebonit, producerea de chibrituri, praf de pușcă, în lupta împotriva dăunătorilor din agricultură, în scopuri medicale (unguent de sulf pentru tratarea bolilor de piele), pentru obținerea acidului sulfuric etc.
teme pentru acasăpunctul 21; exerciții 1, 3, 4 pp. 99-100.
Note suplimentare
Completați ecuațiile de reacție, p aranjați coeficienții prin metoda echilibrului electronic, specificați oxidantul, agentul reducător.
№2. Realizați transformarea conform schemei:
Acest lucru este interesant ...
- Conținutul de sulf din corpul uman cântărind 70 kg - 140 g.
- O persoană are nevoie de 1 g sulf pe zi.
- Mazăre, fasole, fulgi de ovăz, grâu, carne, pește, fructe și suc de mango sunt bogate în sulf.
- Sulful face parte din hormoni, vitamine, proteine, este în țesutul cartilajului, părul, unghiile. Cu o lipsă de sulf în organism, există o fragilitate a unghiilor și a oaselor, căderea părului.
Urmăriți-vă sănătatea!Știți ..
- Compușii sulfului pot servi ca medicamente;
- Sulf - baza unguentului pentru tratamentul bolilor cutanate fungice, pentru combaterea scabiei. Tiosulfat de sodiu Na 2 S 2 O 3 folosit pentru a-l combate.
- Multe săruri ale acidului sulfuric conțin apă de cristalizare: ZnSO 4 × 7H2O și CuSO4 × 5H2 A. Se utilizează ca antiseptice pentru pulverizarea plantelor și pentru prelucrarea cerealelor în lupta împotriva dăunătorilor din agricultură.
- Fier de vitriol de fier 4 × 7H2 O este folosit pentru anemie.
- BaS04 utilizat pentru examinarea radiografică a stomacului și a intestinelor.
- Aluminiu potasiu aluminiu KAI (SO 4) 2 × 12H2 O - hemostatic cu tăieturi.
- Mineral Na 2 SO 4 × 10H 2 O se numește "sarea lui Glauber" în onoarea chemistrului german Glauber I.R. Glauber, care la descoperit în secolul al VIII-lea și sa îmbolnăvit brusc în timpul călătoriei sale. Nu putea să mănânce nimic, stomacul lui a refuzat să mănânce. Unul dintre localnici l-au trimis la sursă. De îndată ce a băut apa amară amară, a început imediat să mănânce. Glauber a cercetat această apă, sare de Na cristalizată din ea. 2 SO 4 x 10H 2 A. Acum este folosit ca un laxativ în medicină, în vopsirea țesăturilor de bumbac. Sarea se regăsește și în fabricarea sticlei.
- Șobolanul are o capacitate crescută de a extrage sulful din sol și de a stimula absorbția acestui element cu plantele vecine.
- Usturoiul eliberează o substanță - albucidă, compus sulfuric caustic. Această substanță previne cancerul, încetinește îmbătrânirea, previne bolile de inimă.
Subgrupul de căldură conține sulf - acesta este al doilea element care este capabil să formeze un număr mare de depozite de minereu. Sulfații, sulfurile, oxizii și alți compuși ai sulfului sunt foarte răspândiți, importanți în industrie și în natură. Prin urmare, în acest articol, luăm în considerare ceea ce sunt, ce este sulful în sine, substanța sa simplă.
Sulf și caracteristicile sale
Acest element are următoarea poziție în sistemul periodic.
- Al șaselea grup, principalul subgrup.
- A treia perioadă mică.
- Masa atomică este de 32.064.
- Numărul secvenței este de 16, există atâția protoni și electroni, și există și 16 neutroni.
- Se referă la elementele nemetalice.
- Formula se citește "es", numele elementului sulf, sulful latin.
În natură, există patru izotopi stabili cu numere de masă 32,33,34 și 36. Acest element este al șaselea cel mai abundent în natură. Se referă la elemente biogene, ca parte a moleculelor organice importante.
Structura electronică a atomului
Compușii sulfului datorează diversitatea lor caracteristicilor structurii electronice a atomului. Se exprimă prin următoarea formulă de configurație: 1s 2 2s 2 2p 6 3s 2 3p 4.
Procedura de mai sus reflectă numai starea staționară a elementului. Cu toate acestea, se știe că dacă un atom este informat despre o energie suplimentară, atunci electronii pot fi despărțiți la subsolurile 3p și 3s, urmând tranziția următoare la 3d, care rămâne liberă. Ca urmare, nu numai valența atomului se schimbă, ci și toate posibilele stări de oxidare. Numărul lor crește semnificativ, la fel ca numărul de substanțe diferite cu sulf.
Grade de oxidare a sulfului în compuși
Există mai multe opțiuni principale pentru acest indicator. Pentru sulf este:
Dintre acestea, S +2 este cel mai rar, restul este dispersat pretutindeni. Gradul de oxidare a sulfului în compuși depinde de activitatea chimică și de capacitatea oxidativă a întregii substanțe. De exemplu, compușii cu -2 sunt sulfuri. În ele, elementul considerat de noi este un agent tipic de oxidare.
Cu cât este mai mare gradul de oxidare din compus, cu atât este mai pronunțată capacitatea de oxidare a substanței. Acest lucru este ușor de văzut dacă amintim cei doi acizi bazici care formează sulf:
- H 2 SO 3 - sulfuros;
- H 2 SO 4 - sulf.
Se știe că acesta din urmă este un compus mult mai stabil, puternic, care posedă într-o concentrație ridicată o capacitate de oxidare foarte gravă.
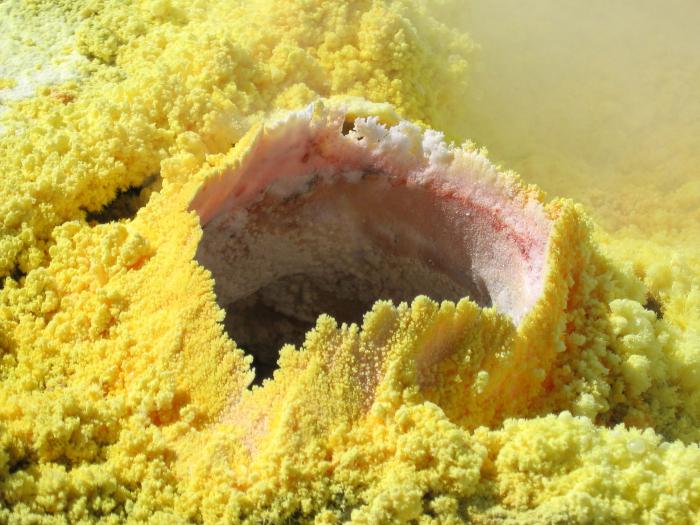
Substanță simplă
Ca o substanță simplă, sulful reprezintă cristale galbene frumoase, de formă obișnuită, alungită. Deși aceasta este doar una dintre formele sale, deoarece există două substanțe principale. Primul, monoclinic sau rombic, este galben, care nu poate fi dizolvat în apă, ci numai în solvenți organici. Diferă în fragilitate și o formă frumoasă a structurii, prezentată sub forma unei coroane. Punct de topire - aproximativ 110 0 С.
Dacă nu pierdeți timpul intermediar când încălzi o astfel de modificare, atunci puteți detecta o altă stare în timp - sulf de plastic. Este o soluție de cauciuc, vâscos, de culoare maro, care, la încălzire ulterioară sau răcire rapidă, se transformă din nou într-o formă rombică.
Dacă vorbim despre sulful chimic pur, obținut prin filtrarea repetată, atunci este vorba de cristale mici galbene strălucitoare, fragile și complet insolubile în apă. Poate fi aprins la contact cu umiditatea și oxigenul din aer. Diferă în activitatea chimică destul de ridicată.

Fiind în natură
În natură, există depuneri naturale din care se extrag compușii de sulf și ea însăși ca o substanță simplă. În plus, este conținut:
- în minerale, minereuri și pietre;
- în corpul animalelor, plantelor și omului, ca parte a multor molecule organice;
- în gaze naturale, petrol și cărbune;
- în șisturi combustibile și ape naturale.
Unele dintre cele mai bogate în sulf minerale sunt:
- cinabru;
- pirită;
- sfaleritul;
- stibnit;
- galena și altele.
Cea mai mare parte a sulfului produs astăzi se referă la producția de sulfați. O altă parte este utilizată în scopuri medicale, agricultură, procese industriale pentru producerea de substanțe.
Proprietăți fizice
Ele pot fi descrise în mai multe puncte.
- Este insolubil în apă, în disulfură de carbon sau în terebentină - este bine dizolvată.
- Cu frecare prelungită se acumulează o sarcină negativă.
- Punctul de topire este 110 0 С.
- Punct de fierbere 190 0 C.
- Când atinge 300 ° C, devine lichid, ușor de mobilat.
- Substanța pură poate aprinde foarte bine proprietățile combustibile.
- Mirosul în sine nu are aproape nici un efect, dar compușii de hidrogen ai sulfului emit un miros ascuțit de ouă putrede. La fel ca niște reprezentanți binari gazoși.
Proprietățile fizice ale substanței în cauză au fost cunoscute de oameni încă din antichitate. Tocmai datorită inflamabilității sale, sulful a primit un astfel de nume. În războaie, au folosit fumuri sufocante și otrăvitoare, care se formează în timpul arderii acestui compus, ca o armă împotriva dușmanilor. În plus, acizii care implică sulf au avut întotdeauna importanță industrială importantă.

Proprietăți chimice
Subiect: "Sulf și compușii săi" într-un curs de chimie școală nu ia o lecție, dar mai multe. La urma urmei, mulți dintre ei. Acest lucru se datorează activității chimice a substanței. Acesta poate prezenta atât proprietăți oxidante cu agenți reducători mai puternici (metale, bor, etc.), cât și reducerea proprietăților cu cele mai multe nemetale.
Totuși, în ciuda acestei activități, numai cu fluor, interacțiunea are loc în condiții normale. Toate celelalte necesită încălzire. Există mai multe categorii de substanțe cu care sulful poate interacționa:
- metale;
- nemetale;
- alcali;
- acizii oxidanți puternici - sulfuric și nitric.
Compuși ai sulfului: soiuri
Diversitatea lor se explică prin valoarea inegală a gradului de oxidare a elementului principal - sulf. Deci, puteți selecta mai multe tipuri principale de substanțe pentru această caracteristică:
- compuși cu starea de oxidare -2;
Dacă luăm în considerare clasele și nu un indicator al valenței, atunci acest element formează astfel de molecule ca:
- acid;
- oxizi;
- sare;
- compuși binari cu nemetale (disulfură de carbon, cloruri);
- materie organică.
Acum ia în considerare cele principale și dați exemple.

Substanțe cu stare de oxidare -2
Compușii de sulf 2 sunt conformația sa cu metalele, precum și cu:
- carbon;
- hidrogen;
- fosfor;
- siliciu;
- arsenic;
- bor.
În aceste cazuri, acționează ca agent de oxidare, deoarece toate elementele enumerate sunt mai electropozitive. Luați în considerare cele mai importante dintre ele.
- Disulfură de carbon - CS 2. Lichid limpede cu o aromă plăcută de eter. Este toxic, inflamabil și exploziv. Folosit ca solvent, și pentru cele mai multe tipuri de uleiuri, grăsimi, nemetale, nitrat de argint, rășini și cauciucuri. Este, de asemenea, un rol important în producerea raionului raional. În industrie, este sintetizat în cantități mari.
- Hidrogen sulfurat sau hidrogen sulfurat - H 2 S. Gaz, care nu are culori și gust dulce. Mirosul este ascuțit, extrem de neplăcut, reamintește un ou putred. Poisonous, deprimă centrul respirator, deoarece leagă ionii de cupru. Prin urmare, dacă este otrăvit, sufocă și moare. Este utilizat pe scară largă în medicină, sinteze organice, producția de acid sulfuric și, de asemenea, ca materie primă eficientă din punct de vedere energetic.
- Sulfurile metalice sunt utilizate pe scară largă în medicină, în producția de sulfați, în producția de vopsele, în fabricarea de fosfor și în alte locuri. Formula generală este Me x S y.

Compuși cu starea de oxidare +4
Compușii de sulf 4 sunt în principal oxid și sărurile corespunzătoare și acidul. Toate acestea sunt compuși destul de obișnuiți care au o anumită valoare în industrie. Acestea pot acționa ca agenți oxidanți, dar mai des arată proprietăți de reducere.
Formulele pentru compușii cu sulf cu starea de oxidare +4 sunt după cum urmează:
- oxid - dioxid de sulf SO2;
- acid sulfuric H2SO3;
- sărurile au formula generală Mex (S03) y.
Una dintre cele mai frecvente este sau anhidridă. Este o substanță incoloră cu mirosul unui meci ars. În grupurile mari formate în timpul erupției vulcanilor, în acest moment este ușor de determinat prin miros.
Se dizolvă în apă cu formarea unui acid ușor descompus, acid sulfuros. Se comportă ca forme tipice de sare, care este sub forma unui ion sulfit de SO3 2-. Această anhidridă este gazul principal care afectează poluarea atmosferei înconjurătoare. Acest lucru influențează educația. În industrie se utilizează în producția de sulfați.
Compuși în care sulful are o stare de oxidare de +6
Acestea includ, mai presus de toate, anhidrida sulfurică și acidul sulfuric cu sărurile lor:
- sulfați;
- sulfat acid.
Deoarece atomul de sulf din ele este puternic oxidat, proprietățile acestor compuși sunt destul de explicabile. Sunt agenți oxidanți puternici.
Oxidul de sulf (VI) - anhidrida sulfurică - este un lichid volatil, incolor. O caracteristică caracteristică este capacitatea puternică de deshidratare. Afară fumează. Când se dizolvă în apă, se obține unul dintre cele mai puternice acizi minerali - sulfurici. Soluția sa concentrată este un lichid greu uleios, ușor gălbuie. Dacă anhidrida este dizolvată în acid sulfuric, atunci veți obține un compus special numit oleum. Se folosește în industrie pentru producerea de acid.
Printre sărurile - sulfații - compuși cum ar fi:
- gips de CaSO4 · 2H20;
- bariți BaS04;
- săruri;
- sulfat de plumb și altele.
Ele sunt utilizate în construcții, sinteze chimice, medicamente, fabricarea de dispozitive optice și ochelari, și chiar și industria alimentară.
Hidrosulfații sunt utilizați pe scară largă în metalurgie, unde sunt utilizați ca fluxuri. Și, de asemenea, ele ajută la traducerea multor oxizi complexi în forme solubile de sulfat, care sunt utilizate în industriile relevante.
Studiul sulfului în cursul chimiei școlare
Când este cel mai bine pentru elevi să învețe ce este sulful, care sunt proprietățile sale, ce este compusul de sulf? Gradul 9 - cea mai bună perioadă. Acesta nu este chiar începutul când totul este nou și incomprehensibil pentru copii. Acesta este punctul central în studiul științei chimice, când fundațiile prezentate mai devreme vor ajuta la înțelegerea pe deplin a subiectului. Prin urmare, este a doua jumătate a clasei senior care este alocată pentru examinarea acestor probleme. În același timp, întregul subiect este împărțit în mai multe blocuri, în care lecția "Compușii de sulf, gradul 9" se află separat.
Acest lucru se datorează multitudinii lor. De asemenea, sa abordat separat problema producției de acid sulfuric în industrie. În general, o medie de 3 ore este dedicată acestui subiect.
Dar sulful este luat pentru a studia numai în clasa a 10-a, când se iau în considerare aspecte ecologice. Ele sunt, de asemenea, afectate de biologie în liceu. La urma urmei, sulful face parte din astfel de molecule organice, cum ar fi:
- trispirturi (tioli);
- proteine (structura terțiară, pe care se formează punți disulfidice);
- tioaldehidelor;
- tiofenoli;
- tioesteri;
- acizi sulfonici;
- sulfoxide și altele.
Ele se disting într-un grup special de compuși organo-sulfuri. Ele sunt importante nu numai în procesele biologice ale ființelor vii, ci și în industrie. De exemplu, acizii sulfonici sunt baza multora medicamente (aspirină, sulfonamidă sau streptocid).
În plus, sulful este o componentă permanentă a compușilor cum ar fi:
- aminoacizi;
- enzime;
- vitamine;
- hormoni.
La temperatura camerei, sulful reacționează numai cu mercur. Cu o temperatură în creștere, activitatea sa crește semnificativ. Când este încălzit, sulful reacționează direct cu multe substanțe simple, cu excepția gazelor inerte, azotului, seleniului, telurului, aurului, platinei, iridiului și iodului. Sulfurile de azot și aur sunt obținute indirect.
Interacțiunea cu metalele
Sulful prezintă proprietăți oxidante, ca urmare a interacțiunii, se formează sulfuri:
Interacțiunea cu hidrogen apare la 150-200 ° C:
H 2 + S = H 2S
Interacțiunea cu oxigenul
Sulful arde în oxigen la 280 ° C, în aer la 360 ° C și se formează un amestec de oxizi:
S + O2 = S02;
2S + 302 = 2S03.
Interacțiunea cu fosfor și carbon
Când este încălzit fără aer, sulful reacționează cu fosforul, carbonul, care prezintă proprietăți oxidante:
2P + 3S = P2S3;
Interacțiunea cu fluorul
În prezența agenților puternici de oxidare prezintă proprietăți de reducere:
S + 3F2 = SF6.
Interacțiunea cu substanțe complexe
Atunci când interacționează cu substanțe complexe, sulful se comportă ca agent reducător:
S + 2HNO3 = 2NO + H2S04.
Disproporționarea reacției
Sulful este capabil de reacții de disproporție, atunci când se formează interacțiunea cu sulfurile alcaline și sulfiții:
3S + 6KOH = K2S + O3 + 2K2S2 + 3H2O.
1.7. Producția de sulf
Din minereurile native
Când se încălzește pirita fără acces la aer
FeS2 = FeS + S.
Oxidarea hidrogenului sulfurat cu lipsa de oxigen
2H2S + 02 = 2S + 2H20.
De la gazele reziduale metalurgice și de cocsificare, când sunt încălzite în prezența unui catalizator
H2S + S02 = 2H20 + 3S.
1.8. Sulfura de hidrogen
Compus de hidrogen sulfurat - hidrogen sulfurat H 2 S . Hidrogenul sulfurat este un compus covalent. Structura moleculei este similară structurii moleculei de apă, atomul de sulf este în stare de hibridizare sp3, totuși, spre deosebire de apă, moleculele de hidrogen sulfurat nu formează legături de hidrogen între ele. Atomul de sulf este mai puțin electononegativ decât atomul de oxigen, are o dimensiune mai mare și, ca rezultat, o densitate de încărcare mai mică. Unghiul de valență HSH este de 91,1 °, lungimea legăturii H - S este de 0,133 nm.
Proprietăți fizice
În condiții normale, hidrogenul sulfurat este un gaz incolor, cu un puternic miros caracteristic de ouă putrede. T pl = -86 ° C T kip = -60 ° C, slab solubil în apă, la 20 ° C, 2,58 ml de H 2 S se dizolvă în 100 g de apă. Foarte toxic, provoacă paralizie prin inhalare, care poate fi fatală. În natură, se eliberează în compoziția gazelor vulcanice, formată prin degradarea organismelor vegetale și animale. Este solubil în apă, când se dizolvă, formează un acid slab hidrogen sulfurat.
Proprietăți chimice
În soluția apoasă, hidrogenul sulfurat are proprietățile unui acid dibazic slab:
H2S = HS - + H +;
HS - = S2 + H +.
Hidrogenul sulfurat arde în aer flacără albastră. Cu acces limitat la aer, se formează sulf liber:
2H2S + 02 = 2H20 + 2S.
Cu acces excesiv la aer, arderea hidrogenului sulfurat duce la formarea de oxid de sulf (IV):
2H2S + 302 = 2H20 + 2S02.
Hidrogenul sulfurat are proprietăți de reducere. În funcție de condiții, hidrogenul sulfurat poate fi oxidat în soluție apoasă la sulf, dioxid de sulf și acid sulfuric.
De exemplu, se decolorează apa de brom:
H2S + Br2 = 2HBr + S.
interacționează cu apa clorului:
H2S + 4CI2 + 4H2O = H2S04 + 8HCI.
Un jet de hidrogen sulfurat poate fi aprins folosind dioxid de plumb, deoarece reacția este însoțită de o eliberare mare de căldură:
3PbO2 + 4H2S = 3PbS + S02 + 4H2O.
Interacțiunea dintre hidrogen sulfurat și dioxid de sulf utilizate pentru producerea de sulf din gazele reziduale de producere metalurgică și sulfat:
SO2 + 2H2S = 3S + 2H20.
Formarea sulfului nativ în procesele vulcanice este asociată cu acest proces.
Cu transmiterea simultană a dioxidului de sulf și a hidrogenului sulfurat prin soluția alcalină se formează tiosulfat:
4S02 + 2H2S + 6NaOH = 3Na2S2O3 + 5H2O.
Hidrogenul sulfurat în condiții normale este un gaz incolor și foarte toxic, cu un miros caracteristic de ouă putrede.
Pentru a se obține în laborator, acidul clorhidric diluat se adaugă de obicei la sulfură:
O altă modalitate de a produce hidrogen sulfurat este de a adăuga apă rece la sulfura de aluminiu:
Hidrogenul sulfurat obținut în acest mod este mai curat.
Hidrogenul sulfurat este un compus covalent. Moleculele sale au o structură curbă similară cu structura moleculelor de apă (vezi secțiunea 2.2). Cu toate acestea, spre deosebire de apă, moleculele de hidrogen sulfurat nu formează legături de hidrogen între ele. Faptul este că atomul de sulf este mai puțin electonegativ decât atomul de oxigen, dar are o dimensiune mai mare. Prin urmare, atomul de sulf are o densitate de încărcare mult mai mică decât atomul de oxigen. Datorită lipsei legăturilor de hidrogen, hidrogenul sulfurat are un punct de fierbere mai scăzut decât apa. Lipsa legăturilor de hidrogen în hidrogen sulfurat explică de asemenea solubilitatea sa scăzută în apă.
În soluția apoasă, hidrogenul sulfurat are proprietățile unui acid dibazic slab:
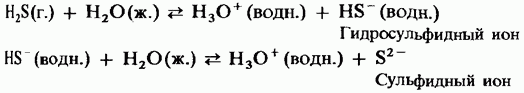
Hidrogenul sulfurat arde în aer cu o flacără albastră. Cu acces limitat la aer, arderea hidrogenului sulfurat este însoțită de eliberarea de sulf liber, care condensează pe suprafața rece a vasului:
Cu acces excesiv la aer, arderea hidrogenului conduce la formarea de dioxid de sulf:
Hidrogenul sulfurat are proprietăți de reducere. De exemplu, acesta decolorează apa de brom și reduce ionii la ioni.
Hidrogenul sulfurat ca acid dibazic poate forma două rânduri de săruri - sulfuri și hidrosulfuri (a se vedea mai sus). Sulfurile metalice alcaline se dizolvă în apă pentru a forma soluții alcaline. Acest lucru survine ca rezultat al hidrolizei:
Sulfurile insolubile ale altor metale pot fi precipitate din soluții apoase de săruri ale acestor metale prin trecerea hidrogenului sulfurat prin soluție. De exemplu, prin trecerea hidrogenului sulfurat printr-o soluție care conține ioni, se formează un precipitat de sulfură neagră
Această reacție este utilizată ca probă analitică pentru hidrogen sulfurat.
Oxizi de sulf
Sulful formează mai mulți oxizi, dintre care două sunt cele mai importante: dioxidul de sulf și trioxidul de sulf.
Dioxidul de sulf este un gaz dens, incolor, cu un miros ascuțit, sufocant. În condiții de laborator, se poate obține prin arderea de sulf în aer sau în oxigen, adăugarea unei soluții calde de acid diluat la o anumită sulfură de sare sau prin încălzirea acidului sulfuric concentrat cu cupru:
Oxid de sulf dioxid de sodiu. Se dizolvă ușor în apă, formând acid sulfuric. Acest acid este doar parțial ionizat și, prin urmare, este un acid slab:
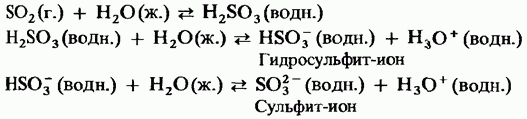
Prin trecerea gazului de bioxid de sulf prin soluție de hidroxid de sodiu se formează sulfit de sodiu. Sulfatul de sodiu, reacționând cu un exces de dioxid de sulf, formează hidrosulfit de sodiu. Aceste reacții sunt similare cu reacția dioxidului de carbon cu apa de var.
Atât dioxidul de sulf gazos cât și soluția sa apoasă sunt agenți reducători. De exemplu, dioxidul de sulf gazos reduce oxidul pentru a forma sulfatul a acid sulfuric restabilește ionul la ion
Dioxidul de sulf în condiții industriale este obținut prin prăjirea minereurilor de sulf sau de sulfuri în aer și este utilizat ca produs intermediar în procesul de obținere a acidului sulfuric (vezi Capitolul 7). Dioxidul de sulf este utilizat în industria celulozei, pentru înălbirea țesăturilor, precum și pentru prelucrarea fructelor și legumelor în timpul depozitării pe termen lung.
Dioxidul de sulf joacă un rol semnificativ în poluarea atmosferică și în special în formarea de ploi acide. În atmosferă, se oxidează la trioxid de sulf:
În condiții normale, acest proces se desfășoară destul de lent, dar în prezența unui catalizator, acesta poate fi accelerat în mod semnificativ, la fel cum se întâmplă în procesul de contact pentru producerea de acid sulfuric. Cantități mici de compuși ai fierului și manganului din atmosferă par să catalizeze oxidarea dioxidului de sulf. Trioxidul de sulf rezultat reacționează cu umiditatea în aer și, prin urmare, apar nori care poartă ploi acide (a se vedea și capitolul 12).
Solidul trioxid de sulf este un compus polimorf. Cele două forme cele mai importante: Primul dintre acestea este un trimer cu structură ciclică (Figura 15.24, a); cristalele sunt transparente. are o structură polimer aciclică (figura 15.24, b); există sub formă de ace. Punctul de topire În prezența umidității, se transformă treptat în ambele forme se fierbe la 45 ° C. Vaporii de trioxid de sulf constau din molecule plane plate simetrice.
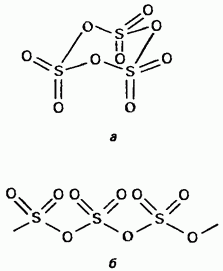
Fig. 15.24. Trioxid de sulf, a - structură ciclică, b - structură aciclică.
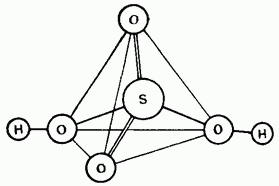
Fig. 15.25. Structura moleculei de acid sulfuric.
În condiții de laborator, trioxidul de sulf se obține prin încălzirea sulfatului
Trioxidul de sulf are proprietăți acide puternice. Reacționează exotermic cu apă pentru a forma acid sulfuric:
Trioxidul de sulf este un agent puternic de oxidare. De exemplu, oxidat bromura de hidrogen pentru a elibera bromul.
Acid sulfuric
Acid sulfuric - lichid caustic uleios incolor. Este unul dintre cele mai importante produse chimice industriale. Producția sa industrială utilizând procesul de contact și aplicarea este descrisă în Ch. 7.
Acidul sulfuric nediluat este un compus covalent. Moleculele sale au o structură tetraedrică (figura 15.25).
Acidul sulfuric se fierbe și se descompune la 340 ° C, formând trioxid de sulf și apă
Punctul de fierbere ridicat și vâscozitatea ridicată a acidului sulfuric, aparent, se datorează prezenței legăturilor de hidrogen între atomii de hidrogen și atomii de oxigen ai moleculelor învecinate.
Acidul sulfuric este un acid dibazic puternic. În apă, este ionizat complet, formând ioni de sulfat și sulfat:
Acidul sulfuric este implicat în toate reacțiile caracteristice acizilor. Reacționează cu metale, formând sulfați ai acestor metale și hidrogen, în reacțiile cu carbonații formează sulfați, dioxid de carbon și apă și în reacții cu baze și baze formează sulfați sau hidrosulfați.
Acidul sulfuric concentrat reacționează foarte violent cu apa. Din acest motiv, acidul sulfuric trebuie diluat întotdeauna prin turnarea în apă și nu invers. Acest acid este higroscopic, adică este capabil să absoarbă umezeala din aer. Prin urmare, este folosit pentru a usca gazele care nu reactioneaza cu acesta, trecand prin acid sulfuric. Afinitatea acidului sulfuric în apă este atât de mare încât acidul sulfuric poate servi drept agent de deshidratare; sub acțiunea acidului sulfuric concentrat:
cristalele albastre de pentahidrat de sulfat formează sulfat anhidru
carbohidrații, cum ar fi zaharoza, sunt carnați:
hârtia este de asemenea carbonizată prin acțiunea acidului sulfuric concentrat, care este cauzată de acțiunea acidului asupra fibrelor de celuloză;
etanolul este transformat în etilenă:
(deshidratare etanolică cu acid sulfuric, efectuată în condiții controlate
conduce la formarea de etoxietan (dietil eter), iar această reacție este utilizată pentru a produce etoxietan la scară industrială);
un amestec de clorbenzen și tricloroetanal (cloral) este deshidratat (vezi secțiunea 16.3).
Acidul sulfuric concentrat este un agent puternic de oxidare. Oxidează metalele și nemetalele. De exemplu
Ca alte exemple care ilustrează proprietățile oxidative ale acidului sulfuric concentrat, indicăm oxidarea ionilor la ioni, precum și ionii de bromură la bromul liber în următoarele reacții:
În final, acidul sulfuric este utilizat ca agent de sulfatare în chimia organică (vezi capitolul 17).
Sulfați, sulfuri și compuși tio
Ionul sulfat are o structură tetraedrică similară structurii moleculei de acid sulfuric.
Sare. Sulfații se formează în reacțiile acidului sulfuric diluat cu metalele, oxizii, hidroxizii sau carbonații lor. Cu excepția sulfatului de bariu, sulfatele rămase sunt solubile în apă. Sulfatul de calciu are o solubilitate scăzută în apă. Sulfații sunt de obicei rezistenți la căldură. Singurele excepții sunt sulfații de fier. De exemplu, sulfatul se descompune când este încălzit pentru a forma oxid de fier:
Pentru a detecta ionii de sulfat în orice soluție, se adaugă o soluție apoasă de clorură de bariu. Dacă în soluție de testare sunt prezente ioni de sulfat, se formează un precipitat alb de sulfat de bariu:
Sulfații au multe utilizări importante. De exemplu, sulfatul de magneziu (sare britanică, sare amară) este utilizat în fabricarea explozivilor, pentru fabricarea chibritelor și țesăturilor ignifuge. O soluție saturată a acestei sări este utilizată în practica medicală ca agent antiinflamator.
Tiosulfatul de sodiu poate fi considerat ca un analog al sulfatului de sodiu, în care un atom de oxigen este înlocuit cu un atom de sulf. Dintre acești compuși tioso, trebuie menționat un altul - tiocianat de potasiu. Este un analog de sulf al cianatului de potasiu. Pot să se obțină tiocianat de potasiu prin topirea cianurii de potasiu cu sulf:
Pot fi utilizate în analiza calitativă pentru detectarea ionilor. În cazul în care acești ioni sunt prezenți în soluția de testare, adăugarea unei soluții de tiocianat de potasiu duce la apariția unei culori roșii sanguine datorită formării unui ion complex
Deci, repetați din nou!
1. Când se deplasează în partea de jos a grupului VI, proprietățile elementelor sale treptat se schimbă de la nemetal la metal.
2. Elementele din grupa VI au capacitatea de a se combina cu hidrogenul și metalele reactive, formând compuși în care au o stare de oxidare de -2.
3. Oxigenul are o electronegativitate ridicată și proprietățile unui oxidant puternic.
4. Ozonul este un oxidant chiar mai puternic decât oxigenul.
5. Oxigenul joacă un rol extrem de important în sistemele biologice, participând la procesele de respirație și procesele metabolice (metabolismul).
6. Oxigenul formează compuși binari, oxizi de diferite tipuri cu alți compuși:

7. Peroxidul de hidrogen este un agent puternic de oxidare.
8. Sulful în formă liberă poate exista în mai multe forme enantiotropice.
9. Pentru a extrage sulful din depozitele subterane, se utilizează procesul Frash, care utilizează aer comprimat și abur supraîncălzit.
10. Sulful formează compuși în care se află în stări cu stări de oxidare +2, +4, +6 și -2.
11. Hidrogen sulfurat - acid dibazic slab și agent reducător.
12. Dioxid de sulf gazos și agenții săi de reducere a soluției apoase.
13. Trioxidul de sulf are proprietăți pronunțate de aciditate și oxidare.
14. Acidul sulfuric este un acid dibazic puternic, desicant, agent de deshidratare și un agent puternic de oxidare.
15. Moleculele de acid sulfuric și ionii sulfați au o structură tetraedrică.