Compuși de calciu și magneziu
Deci, determinând ieri cât de mult calciu este conținut în coaja de ouă zdrobită, a apărut întrebarea "să bei sau să nu bei?". La fel ca majoritatea bărbaților, am venit cu totul din punct de vedere științific și până când o văd eu, aflu, verifică, simt un cuvânt pentru o femeie. Prin urmare, îmi voi împărtăși gândurile pe baza informațiilor despre coaja de ouă și calciu.
Colectarea pe Internet a informațiilor despre utilizarea ca aditiv alimentar ouă de mai multe ori a venit peste observațiile critice ale medicilor că carbonatul de calciu conținut în coaja de ou nu este solubil în apă și, prin urmare, nu poate fi absorbit de organism.
Mai mult, mi-am amintit povestea soțului prietenului meu că, în timpul sarcinii, i-a spus medicului său, care a observat că ia niște cochilii de ou zdrobite - medicul ia descurajat și ia prescris un fel de complex de calciu.
Unde este adevărul?
Într-adevăr, carbonatul de calciu CaC03 (tocmai în acest tip de calciu este în coaja de ouă) este insolubil în apă și alcool.
O condiție absolut indispensabilă pentru absorbția calciului este solubilitatea în apă.
Dar amintiți-vă că baza digestiei noastre este acidul clorhidric excretat în stomac.
Și asta se întâmplă în stomacul nostru:
CaC03 + 2HCI (acid clorhidric) = CaCl2 (clorură de calciu) + Co2 + H20
Dar clorura de calciu este perfect solubilă în apă! În această formă este absorbit calciul!
Nu știu doctorii? Sau sunt pur și simplu vicioși și ne vinde medicamente!
În plus, în timpul acestei reacții, apare o scădere a acidității gastrice. Ce este important pentru persoanele care suferă de aciditate ridicată.
Un exemplu este soția mea, are o aciditate ridicată și ea ia o coajă de ou zdrobită în fiecare zi, iar acest lucru rezolvă două probleme simultan și compensează lipsa calciului și scade aciditatea. Dar praful de coajă de ou sa stins suc de lamaie nu pot bea - există greață! Și acum înțeleg de ce.
Așa cum am văzut mai sus, pentru absorbția calciului din carbonatul de calciu se impune sucuri gastrice cu aciditate ridicată.
În viața reală, foarte des apare o situație când aciditatea stomacului este scăzută sau zero. Această situație este deosebit de caracteristică pentru persoanele în vârstă, când nevoia de calciu este deosebit de ridicată pentru prevenirea osteoporozei. De exemplu, după 50 de ani, aciditatea scăzută apare în aproximativ 40% din populație. În aceste condiții, absorbția carbonatului de calciu, care necesită dizolvarea acidului clorhidric în stomac, scade la 2%.
Poate că acesta este răspunsul pentru care persoanele mai în vârstă sunt mai susceptibile de a suferi de boli asociate cu o lipsă de calciu - nu o pot asimila în forma obișnuită.
Acum, luați în considerare motivul pentru care multe rețete pentru primirea coajelor de ouă zdrobite sunt sfătuite să o stingă cu suc de lămâie.
Când adăugăm suc de lămâie la acidul citric zdrobit, carbonatul de calciu (CaCo3) reacționează cu acidul citric (C6H8O7) și ajungem citrat de calciu (Ca3 (C6H5O7) 2):
2C6H8O7 + 3CaCO3 = Ca3 (C6H5O7) 2 + 3CO2 + 3H2O
Aici este. Iar absorbția citratului de calciu, care nu necesită dizolvarea acidului clorhidric în stomac, este de 44%. Ca urmare, în condiții de aciditate scăzută, citratul de calciu intră în organism cu 11 ori mai mult calciu decât cel din carbonat!
Și citratul de calciu este deja un medicament bine cunoscut care ne este vândut pentru bani! Și o fac, numai ei nu folosesc suc de lamaie, ci acid citric!
Apropo, carbonatul de calciu (coaja de ouă mărunțită) este un supliment alimentar înregistrat. E170și citrat de calciu (coaja de ouă tocată turnată cu suc de lamaie) este un aditiv alimentar înregistrat. E333! Și adăugați-le în multe produse alimentare, în special lactate, inclusiv lapte, pentru a crește procentul de calciu!
Deci, de ce să plătiți mai mult!
În concluzie, dacă aveți aciditate ridicată - este probabil mai bine să utilizați învelișuri de ou zdrobite, dacă aciditatea este mai mică, este probabil mai bine să stingeți praful de coajă de ou cu suc de lămâie.
Și mai mult,
În timpul nopții, există o eliberare accelerată a sărurilor minerale din organism (accelerarea circadiană a proceselor resorptive în os). Prin urmare, preparatele de calciu trebuie administrate după prânz și seara.Acest lucru va preveni pierderea accelerată a calciului în a doua jumătate a nopții, mai ales cu nivelul redus (sau absența) în intestin. Se observă de asemenea efectul negativ dependent de doză al activității farmacoterapeutice a calciului: în doze mici acest biometall este absorbit mai bine decât în mare.
În legătură cu asta mai rațională de a lua drogul de mai multe ori pe zi.
Citim, discutăm. Mai jos sunt câteva articole pe această temă.
__________________________________________________________________________________________________________
Citrat de calciu și carbonat de calciu
Sursa< http://www.ortho.ru/77_KMD/Ca_Sravni.htm >
_________________________________________________________________________________________________________
Citrat de calciu.
Citratul de calciu este o excelentă sursă de calciu absorbit, care joacă un rol foarte important în organism, deoarece afectează multe procese enzimatice și coagularea sângelui. Deficitul de calciu duce la fragilitate osoasă și osteoporoză. Pentru copiii mici, este bine pentru dinții sănătoși; adulții au nevoie de aport regulat de calciu pentru a stabiliza tensiunea arterială.
Potrivit Institutului National al Cancerului (USA), suplimentul E-333 poate preveni cancerul de colon si alte tipuri de cancer. În plus, citraturile de calciu sunt utilizate în medicină pentru a elimina metalele grele din organism.
Deoarece citratul de calciu este una dintre cele mai importante forme de transport ale calciului în organismul uman, acesta este utilizat în medicină împreună cu un carbonat de calciu mai puțin eficient (aditiv E-170) pentru a umple calciul în organism. Din același motiv, citratul de calciu este utilizat sub formă de suplimente alimentare (suplimente alimentare).
În industria alimentară, aditivul E-333 este utilizat ca stabilizator, conservant, regulator de aciditate, fixativ de culoare.
Ca stabilizator, aditivul alimentar E-333 este utilizat în fabricarea laptelui condensat, cremă, brânză topită. Pentru gemuri, jeleuri și fructe conservate, aditivul E-333 este utilizat ca regulator de aciditate. Citrații de calciu sunt, de asemenea, utilizați pe scară largă pentru a îmbogăți calciu și lapte și produse lactate, produse de panificație și făină, băuturi răcoritoare.
Ca aspect, citratul de calciu este o pulbere albă cu un gust acru pronunțat. Solubil în apă. Formula moleculară a citratului de calciu: Ca3 (C6H5O7) 2. Luați E-333 prin interacțiunea dintre acidul citric și hidroxidul de calciu.
Proprietăți și funcții tehnologice:
Numele posibile ale suplimentelor alimentare:
- E-333
- E-333
- Citrat de calciu
- Calciu citrat
- Citrat de monocalciu
- Diciclu citrat
- Citrat citrat
_____________________________________________________________________________________________
Citrat de calciu
La mijlocul secolului al XX-lea. un fel de "boom" a început: biochimii, fiziologii, biofiziciștii, farmacologii și clinicienii au început să manifeste un interes sporit în studierea rolului calciului în reglarea activității organelor și sistemelor corporale. Sa constatat că ionii de calciu participă la excitația și contracția celulelor musculare, la reglarea permeabilității membranei celulare, la interacțiunile intercelulare, la coagularea sângelui, la secreția de hormoni, la mediatori, la enzime; îndeplinesc funcția unui traductor de semnale care intră în celulă, participă la procesele de reglare a metabolismului intracelular, inclusiv a energiei. Pe suprafața membranei cardiomiocitelor și vaselor de ioni de calciu liber este de 1000 de ori mai mare decât în citozolul celulelor. Din spațiul extracelular, ele pătrund în citoplasm prin canale speciale de calciu, afectând diferite procese și funcții fiziologice ale celulelor tuturor organelor, ton vascular, intensitate a sistolului, diastol.
Calciul joacă un rol important în formarea țesutului osos și menținerea structurii și funcției sale normale. Împreună cu proteine speciale, ionii de calciu asigură duritatea și elasticitatea oaselor.
Toate acestea au servit ca fundație teoretică pentru dezvoltarea și introducerea preparatelor de calciu pe bază de săruri în practica medicală. În prezent, în practica medicală, se utilizează astfel de săruri de calciu cum ar fi glicerofosfat, gluconat, carbonat, lactat, citrat, clorură, fosfat și multe altele.
Farmacocinetica medicamentului CALCIUM CITRATE are propriile caracteristici. Calciul este absorbit din intestin într-o formă ionizată solubilă. Dizolvarea medicamentului are loc mai bine în mediul acid al stomacului. Calciul dizolvat ionizat penetrează bine în toate țesuturile, penetrează bariera placentară, trece în laptele matern. Excretați în principal în fecale, aproximativ 20% - cu urină. O caracteristică importantă a citratului de calciu este capacitatea scăzută de a forma pietre la rinichi, ceea ce este important în utilizarea pe termen lung a acestei sări. Acest lucru se datorează faptului că sarea citrat reduce cantitatea de oxalat din urină.
Biodisponibilitatea este determinată de viteza și măsura în care ingredient activ absorbită din forma de dozare, devine disponibilă la locul acțiunii terapeutice intenționate.
În timpul nopții, există o eliberare accelerată a sărurilor minerale din organism (accelerarea circadiană a proceselor resorptive în os). De aceea, preparatele de calciu trebuie luate după prânz și seara, ceea ce va împiedica pierderea accelerată a calciului în a doua jumătate a nopții, în special la nivelul redus (sau absența) în intestin. Se observă efectul negativ dependent de doză al activității farmacoterapeutice a calciului: acest biometal este absorbit mai bine la doze mici decât la doze mari. În acest sens, este mai rațional să luați medicamentul de mai multe ori pe zi. Pentru diferite grupe de vârstă există diferite norme fiziologice ale consumului de calciu (tabel).
tabel
Rata recomandată de aport de calciu la persoanele de vârste diferite
(conform Societății Canadiene pentru Osteoporoză)
Asimilarea ionilor de calciu este promovată de vitamina D, acidul clorhidric, lactoza, acid citric, prezența proteinelor în alimente, fosfor, magneziu, precum și unele alimente: ulei, ouă, lapte, pește, grăsime de cod, varză etc.
Absorbția de calciu se înrăutățește: lipsa proteinelor în alimente, respectarea strictă a unei diete vegetariene, lipsa magneziului, fosforului, alimente bogate în acid oxalic (sorrel, rebarbora, spanac).
Absorbția de calciu încetinește bolile sistemului digestiv (gastrită, enteritis, colită, ulcer peptic), pancreas (diabet, pancreatită), patologii ale altor organe endocrine.
Trebuie subliniat faptul că unele medicamente, în special glucocorticoizi, medicamente contraceptive hormonale pentru uz sistemic, levotiroxina, de asemenea, agravează absorbția ionilor de calciu.
Potrivit rezultatelor studiilor științifice (date ale Societății Canadiene pentru Osteoporoză), nu există dovezi convingătoare în baza cărora se poate recomanda consumul suplimentar de alte minerale (magneziu, zinc, cupru etc.) pentru prevenirea sau tratamentul osteoporozei.
Rezultatele studiilor clinice efectuate în Ucraina și alte țări au confirmat eficiența ridicată a acestui medicament în tratamentul multor boli. Citratul de calciu este, de asemenea, utilizat în scopuri profilactice în diferite boli.
Cu osteoporoza la vârstnici, osteomalacia CALCIUM CITRATE este prescrisă cu 2-6 comprimate pe zi, împărțind doza zilnică în 3-4 doze. Medicamentul este luat înainte de mese sau 1-1,5 ore după masă, timp de 3 luni. La astfel de pacienți trebuie să se prescrie și vitamina D3 de 400-800 UI pe zi, și includ, de asemenea, în dieta ulei, lapte, pește, ouă.
CALCIUM CITRATE este forma de dozaj optimă pentru furnizarea de calciu nu numai pentru adulți, dar și pentru copii și adolescenți, deoarece contribuie la creșterea densității minerale osoase, la creșterea masei osoase și la întărirea dentinei și a smalțului dinților. Copiii sub vârsta de 6 luni sunt prescrise 1/2 comprimate (250 mg) (zdrobite, dizolvate într-o cantitate mică de lapte), la vârsta de 6-12 luni - de asemenea, 1/2 comprimate de 2 ori pe zi, la vârsta de 1 an - 10 ani - 1-2 comprimate, 10-18 ani - 2-3 comprimate pe zi.
Indicații pentru numire Citrat de calciu sunt:
hipocalcemia datorată hemoragiilor de diverse origini, precum și în timpul sarcinii și alăptării, cu răni - pentru a umple necesitățile crescute ale corpului în ionii de calciu;
încălcarea absorbției de calciu în afecțiunile tractului digestiv și creșterea nivelului de excreție a calciului prin rinichi și intestine;
hipoparathyroidismul, deshidratarea diverselor gene, bolile alergice și complicațiile alergice în timp ce iau medicamente, creșterea permeabilității peretelui vascular, scăderea coagulării sângelui.
CALCIUM CITRATE trebuie prescris atunci când se administrează glucocorticoizi, contraceptive orale, levothyroxine. În ultimele trei cazuri, medicamentul este luat de 1 comprimat de 6 ori pe zi după mese.
Citratul de calciu este, de regulă, bine tolerat, uneori simptome dispeptice (constipație sau diaree, greață, vărsături, pierderea poftei de mâncare, dureri abdominale), poate apărea poliuria.
Nu se recomandă administrarea simultană a citratului de calciu cu antiacide care conțin aluminiu datorită scăderii eficacității lor. Nu este de dorit să se prescrie simultan cu alte preparate de calciu.
În concluzie, putem observa proprietățile farmacologice pozitive ale CITRICULUI CALCIU:
sarea de calciu citrat este bine dizolvată și absorbită în tractul digestiv, ceea ce duce la o bună absorbție a calciului în organism și, în consecință, la eficacitatea medicamentului în profilaxia sau aplicare terapeuticăfapt confirmat de rezultatele multor studii clinice.
Riscul redus de formare a pietrelor în rinichi la administrarea medicamentului crește valoarea de sulfat de calciu cu utilizare prelungită.
IS Chekman, șef al Departamentului de Farmacologie cu curs de farmacologie clinică la Universitatea Națională Medicală, membru corespondent al Academiei Naționale de Științe și Academia de Științe Medicale din Ucraina, lucrător onorific al științei și tehnologiei, profesor universitar
Pagina 1
Reacția carbonaților cu acizi poate fi utilizată ca probă pentru carbonați. Acidul carbonic este un acid foarte slab și instabil. Poate fi scos din sărurile sale prin acțiunea acizilor mai puțin volatili și mai puternici.
Reacțiile carbonatului de calciu cu acizii se desfășoară în mod similar.
Ca urmare a reacției carbonatului cu acidul clorhidric, se obțin clorură de calciu și magneziu, care se dizolvă bine în apă și rămân sub forma unei soluții de diferite concentrații. Rata de reacție în colectoarele de acest tip depinde în principal de presiune și temperatură.
Ca rezultat al reacției dintre carbonat și acid clorhidric, clorură de calciu și magneziu, bine solubil în apă și rămas sub forma unei soluții de concentrații diferite.
Introducerea carbonatului de sodiu nesupravegheat în reacție necesită o presiune mai mare și o creștere a cantității de catalizator.
Explicarea fenomenelor enumerate sau observate: de ce reacția carbonatului de calciu cu acidul sulfuric începe de la început violent și apoi se oprește. De ce când substanța carbonat de amoniu uscată dispare din tub.
Efectul benefic al carbonatului de calciu asupra stabilității cimentului Portland poate fi explicat prin reacția carbonatului cu mineralele din clincher care conțin aluminiu. Astfel, componenta aluminat a pietrei de ciment este legată chimic înainte de a intra în contact cu sulfații mediului.
Unele aplicații ale carbonatului de bariu se bazează pe insolubilitatea practică a sulfatului de bariu, care se formează prin reacția carbonatului de bariu cu substanțele care conțin ioni de sulfat. Deci, când se usucă o cărămidă înainte de ardere, pe suprafața ei apare floare albă, cauzată de cristalizarea ghipsului sau a sulfatului de magneziu conținut în argilă. Pentru a preveni acest lucru, carbonatul de bariu se adaugă la lut, ceea ce provoacă precipitarea ionului sulfat.
În introducerea sa în chimia de stat solid ca un exemplu, teoretic posibilă reacție conduce reacția de carbonat de calciu cu SiO2, care conduce la formarea de silicat de calciu. El însoțește acest exemplu prin faptul că, cu așa-numitele metamorfoze geotermice, temperatura obișnuită nu este suficientă, deoarece reacția dintre carbonatul de calciu și acidul silicic poate fi observată în condiții de laborator numai la temperaturi de 500 ° C.
Pentru a reduce costul de formare a flegmului în acest proces, Klima și Ward au sugerat utilizarea soluției de carbonat de amoniu (în loc de azotat de amoniu) și crearea de flegm datorită reacției carbonatului de amoniu îmbogățit cu var.
Pe măsură ce crește temperatura, reacția se îndreaptă către formarea unui silicat mai alcalin. Gibson și Ward11 privind reacția carbonatului de sodiu cu cuarț la o temperatură de 726 până la 805 ° C într-un curent de azot au arătat că orto-silicatul este format în prezența unei cantități suficiente de carbonat de sodiu. Rata de reacție depinde de timp, de mărimea probei, de debitul de gaz și de compoziția amestecului de reacție. Gibson și Ward susțin că există silicați de sodiu cu compoziție intermediară.
Excesul de carbonat de sodiu este titrat cu acid clorhidric. Cantitatea de sulf din produsul analizat este calculată prin cantitatea de carbonat de sodiu reacționată.
Și carbonatul de calciu și cum interacționează acești compuși chimici.
Carbonat de calciu
CaCO3 reticulat de carbonat de calciuCaCO3 este un compus foarte comun în întreaga lume, constând din: cretă, calcar, marmură etc. Prin urmare, este de remarcat faptul că rolul acestei substanțe pentru oameni este foarte semnificativ, deoarece carbonatul de calciu este utilizat pe scară largă în industria alimentară, ca un colorant natural alb. CaCO3 este, de asemenea, utilizat în fabricarea hârtiei, materialelor plastice, în construcții și în multe alte domenii.
Carbonatul de calciu este o substanță albă (cristale solide) sub formă de pulbere sau solidă. El este capabil să reacționeze cu apa, dar nu complet dizolvat în ea. Prin urmare, apa devine tulbure și în ea există un precipitat alb. Dar dacă reacția cu apă va avea loc în prezență, atunci vom obține o sare acidă solubilă, bicarbonat de calciu:
CaCO3 + C02 + H20 - Ca (HCO3)
Luați în considerare modul în care se realizează carbonatul de calciu.
Cea mai mare parte a carbonatului de calciu este obținută din surse naturale. Deci, pentru a obține carbonat de calciu, de regulă, utilizați o sursă curată, adesea marmură.
 Statueta de marmură a lui David de Michelangelo Buonarroti
Statueta de marmură a lui David de Michelangelo Buonarroti
Dar în laborator, carbonatul de calciu poate fi obținut prin calcinarea oxidului de calciu. Calcinarea este noțiunea generalizată de ardere, în urma căreia substanțele chimice dobândesc proprietăți noi. Exploatarea se face la o temperatură suficient de ridicată, fără a se atinge topirea.
Apa este amestecată cu oxidul de calciu rezultat, reacția produc hidroxid. Apoi tehnicienii primesc dioxid de carbon, care trece prin soluția obținută anterior. Precipitatul format este carbonatul de calciu:
CaO + H20 = Ca (OH);
Ca (OH) + C02 = CaC03 + H20
Dacă încălziți sarea acidului carbonic și a calciului la o temperatură ridicată (900 - 1000 ° C), atunci, ca urmare a procesului chimic, vom obține dioxid de carbon (dioxid de carbon), precum și oxid de calciu CaO -
CaCO3 = CaO + C02
Dacă temperatura este chiar mai mare (1500 ° C), atunci produsele de reacție vor fi carbură de calciu și monoxid de carbon.
Acid clorhidric
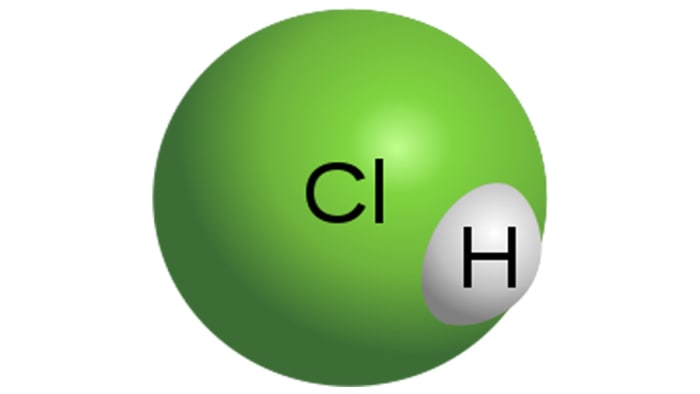 Modul de acid clorhidric
Modul de acid clorhidric
HCI este un acid monobazic puternic, care se obține prin dizolvarea acidului clorhidric în apă. Este un lichid incolor, deși acidul tehnic poate avea o nuanță galbenă, de exemplu, datorită impurității fierului. Proprietățile HCl vor depinde în mod direct de concentrația de acid clorhidric în soluție.
Sărurile de acid clorhidric se numesc cloruri. Această substanță este foarte caustică, prin urmare, necesită o manipulare atentă: chiar dacă o picătură mică cade pe piele, atunci o arsură chimică puternică nu poate fi evitată. Prin urmare, atunci când lucrați cu acizi puternici, este recomandabil să purtați întotdeauna neutralizatori cu dumneavoastră: soluții slab alcaline, (bicarbonat de sodiu), etc. Merită să ne amintim că atunci când se deschide un recipient cu un acid concentrat de acid clorhidric, se formează vapori care afectează negativ ochii și sistemul respirator. Prin urmare, în experimente chimice, ar fi mai bine să folosiți un aparat respirator și ochelari de protecție.
Obținerea de acid clorhidric
Clorura de hidrogen clorhidric se dizolvă în apă. Clorura de clorură se obține în felul următor: hidrogenul este ars în clor, obținându-se astfel un acid sintetic. În mod alternativ, acidul clorhidric poate fi obținut folosind gaze laterale, care sunt obținute într-un număr de experimente chimice, de exemplu când clorurați sunt hidrocarburi clorurate. Acidul obținut în acest mod se numește abgazic.
Aplicați acidul clorhidric în medicină, industrie și, de asemenea, pentru reacții chimice.
Acidul incolor, cu un miros mirositor de acid clorhidric, reacționează bine cu metalele. Se produce o reacție redox. Agenții reducători în procesul de reacție sunt atomi de metal, iar agenții de oxidare sunt cationi de hidrogen.
În principal, reacțiile chimice cu metalele sunt însoțite de eliberarea hidrogenului. Intensitatea interacțiunii depinde de activitatea metalului, de exemplu, litiul de metal alcalin reacționează violent, în timp ce reacția cu aluminiu este slabă datorită filmului puternic de oxid din acest element.
Acid clorhidric și zinc:
2HCI + Zn = ZnCl2 + H2
Acid clorhidric și fier:
2HCI + Fe = FeCl2 + H2
Acid clorhidric și magneziu:
2HCI + Mg = MgCl2 + H2
 Clorura de magneziu, utilizată pentru curățarea drumurilor din gheață
Clorura de magneziu, utilizată pentru curățarea drumurilor din gheață
Cu oxizi de metale, acidul formează sare și apă:
CuO + 2HCI = CuCI2 + H20
Reacția acidului clorhidric și a carbonatului de calciu
Pentru experiment vor fi necesare:
tubul de testare;
pipeta chimică;
carbonat de calciu solid (marmură);
acidul clorhidric;
mănuși;
mască de gaze.
Atenție! Nu încercați această experiență pe cont propriu!
Realizați experimentul într-o zonă bine ventilată, aveți grijă atunci când lucrați cu acid clorhidric.
Adăugați câteva bucăți de marmură în vas și pipetați puțin acid clorhidric. Ca urmare, va exista o reacție instantanee cu formarea de bule - dioxidul de carbon este eliberat. Aceasta este o reacție de schimb, ale cărei produse sunt: un compus slab și instabil, acid carbonic, care se descompune în dioxid de carbon și apă. Ecuația reacției de dizolvare a carbonatului de calciu în acid clorhidric:
CaCO3 + 2HCI (dil.) → CaCI2 + C02 + H20
- caracteristica elementului de magneziu: structura electronică, posibile stări de oxidare, compuși principali: oxid, hidroxid, săruri. Ce este carbonizarea și care este rolul său în construcții.
MgCO3 = MgO + C02
Aplicație.
În industrie se utilizează pentru producerea de materiale refractare, cimenturi și purificarea produselor petroliere, ca material de umplutură în producția de cauciuc. Oxidul de magneziu ultra-ușor este utilizat ca o substanță abrazivă foarte fină pentru curățarea suprafețelor, în special în industria electronică.
În medicină, se folosește în cazul acidității crescute a sucului gastric, deoarece este cauzată de conținutul excesiv de acid clorhidric. Magnezia arsă este de asemenea luată atunci când acidul este eliberat accidental în stomac.
În industria alimentară este înregistrat ca aditiv alimentar E530.
Este un reflector absolut - o substanță cu un coeficient de reflexie egal cu unul într-o bandă spectrală largă. Poate fi folosit ca standard alb disponibil.
Hidroxid de magneziu - hidroxid de metal de magneziu bazic. Slabă bază insolubilă.
În condiții standard, hidroxidul de magneziu este o rețea hexagonală incoloră. La temperaturi de peste 350 ° C se descompune în oxid de magneziu și apă. Absorbționează dioxidul de carbon și apa din aer pentru a forma carbonatul principal de magneziu. Hidroxidul de magneziu este practic insolubil în apă, dar solubil în sărurile de amoniu. Este o bază slabă. Apare în natură sub formă de brucete minerale.
Noțiuni de bază.
Interacțiunea sărurilor de magneziu solubile cu alcalii:
În general:
Mg2 + + 2OH - = Mg (OH) 2
exemple:
MgCl2 + 2NaOH = Mg (OH) 2 + 2NaCl
Mg (N03) 2 + 2KOH = Mg (OH) 2 + 2KNO3
Interacțiunea dintre soluția de clorură de magneziu și dolomitul ars:
MgCl2 + CaO x MgO + 2H20 = 2 Mg (OH) 2 + + CaCI2
Interacțiunea magneziului metalic cu vaporii de apă:
Mg + 2H20 = Mg (OH) 2 + H2 -
Proprietăți chimice
Ca toate bazele slabe, hidroxidul de magneziu este instabil din punct de vedere termic. Se descompune când este încălzit la 350 ° C:
Interacționează cu acizii pentru a forma sare și apă (reacție de neutralizare):
Mg (OH) 2 + 2HCI = MgCl2 + 2H20
Mg (OH) 2 + H2S04 = MgS04 + 2H20
Interacțiunea cu oxizi acide pentru a forma sare și apă:
Mg (OH) 2 + SO3 = MgS04 + H20
Interacțiunea cu soluțiile alcaline concentrate calde, cu formarea de hidroxigneații:
Mg (OH) 2 + 2NaOH = Na2
Mg (OH) 2 + Sr (OH) 2 = Sr
Aplicație.
Hidroxidul de magneziu se utilizează pentru a lega dioxidul de sulf ca agent de floculare pentru tratarea apei reziduale, ca agent de ignifugare în polimeri termoplastici (poliolefine, PVC), ca aditiv în detergenți, pentru a produce oxid de magneziu, rafinarea zahărului ca componentă a pastelor dentare.
În medicină, este folosit ca un medicament pentru a neutraliza acidul în stomac, precum și un laxativ foarte puternic.
În Uniunea Europeană, hidroxidul de magneziu este înregistrat ca aditiv alimentar E528.
Săruri de magneziu.
Cele mai multe săruri de magneziu sunt foarte solubile în apă. Ion Mg 2+ dă soluții un gust amar. Halogenurile de magneziu, cu excepția MgF2, sunt foarte higroscopice - sângerau în aer.
Clorură de magneziu MgCl2 (clorură de magneziu) anhidră se topește la 718 ° C. În prezența unor urme de apă "fumează" în aer - se descompune în HCI și MgO. Hidrații cristalini incolori cu molecule de apă 1, 2, 4, 6, 8 și 12 sunt eliberați din soluția apoasă. În intervalul de temperatură cuprins între -3,4 și 116,7 °, hidratul cristalin de MgCl2 × 6H2O este stabil, care apare în mod natural sub formă de minerale bischofite și se obține în cantități mari prin evaporarea saramurilor marine. Clorura de magneziu formează săruri duble, dintre care carnalitul mineral KCl × MgCl2 × 6H2O - sursa de magneziu și clorură de potasiu - este extrem de important.
Aplicație.
1. Clorura de magneziu se utilizează în principal în producția de magneziu metalic, MgCl2 × 6H2O este utilizat pentru a obține cimenturi de magnezie.
2. Utilizat pentru prelucrarea gheții și a stratului de zăpadă ca aditiv. Ca rezultat al reacției cu zăpada provoacă topirea. Are o clasă de pericol 3 (substanțe moderat periculoase) și proprietăți agresive corozive.
Magneziu bicarbonat - sarea acidă a magneziului și a acidului carbonic cu formula Mg (HCO3) 2, există numai în soluții apoase.
Noțiuni de bază.
Transmiterea dioxidului de carbon printr-o suspensie de carbonat de magneziu:
MgCO3 + C02 + H20 = Mg (HCO3) 2
Proprietăți fizice.
Bicarbonatul de magneziu există numai în soluții apoase.
Prezența bicarbonatului de magneziu în apă cauzează rigiditatea temporară.
Proprietăți chimice
Când se concentrează soluția, bicarbonatul de magneziu se descompune:
Mg (HCO3) 2 = MgCO3 + C02 - + H20
Hidrofosfat de magneziu (fosfat de magneziu dibazic) - o sare acidă de magneziu și acid fosforic cu formula MgHPO4, ușor solubilă în apă, formează hidrați cristalini.
Noțiuni de bază.
Efectul acidului fosforic asupra oxidului de magneziu sau a carbonatului de magneziu:
MgO + H3P04 = MgHPO4 + H20
MgCO3 + H3PO4 = MgHPO4 + C02 - + H20
Prin acțiunea ortofosfatului de sodiu disubstituit pe clorură de magneziu:
MgCl2 + 2Na2HP04 = MgHPO4 + 2NaCl
Descompunerea fosfatului de magneziu:
Mg (H2P04) 2 = MgHP04 + H3P04
Proprietăți fizice.
Magneziu fosfatul de magneziu formează cristale albe, care sunt hidrați cristalini: la temperaturi de până la 225 ° C, se formează MgHPO4 monohidrat. H 2 O, densitate de 2,32 g / cm3, la temperatura de 36 ° C se formează MgHPO4 trihidrat. 3H20, densitate 2,10 g / cm3, cu temperatura camerei Se formează heptahidrat de MgHPO4. 7H20.
Proprietăți chimice.
Când se încălzește pirofosfatul:
Aplicație.
Utilizat în suplimentul alimentar E343.
Magneziu fosfat dihidrogen - sarea acidă a metalului de magneziu și acidul ortofosforic cu formula Mg (H2PO4) 2, cristale higroscopice incolore, solubile în apă, formează hidrați cristalini.
Noțiuni de bază.
Dizolvarea hidroxidului sau a oxidului de magneziu în acidul ortofosforic:
Proprietăți fizice.
Fosfatul dihidrogen de magneziu formează cristale incolore.
Formată compoziție de hidrat cristalin de Mg (H2PO4) 2. nH20, unde n = 2, 4, 6.
Carbură de magneziu - compus anorganic binar de magneziu și carbon cu formula MgC2. De asemenea, carbură de magneziu cunoscută cu formula Mg2C.
Noțiuni de bază.
Sinterizarea fluorurii de magneziu și a carburii de calciu:
Acetilena care curge peste pulberea de magneziu:
Prin restaurarea pentanului cu pulbere de magneziu la 650 ° C, se poate obține carbură mai complexă Mg2C3.
Proprietăți chimice.
Când se încălzește se descompune prin formarea de carbură intermediară Mg2C3:
Interacționează cu apa:
Carbonat de magneziu, carbonat de magneziu, MgCO3 - sare de magneziu a acidului carbonic.
Proprietăți.
Cristale albe, densitate 3,037 g / cm³. La 500 ° C se observă și la 650 ° C se descompune complet în MgO și CO2. Solubilitatea carbonatului de magneziu în apă este nesemnificativă (22 mg / l la 25 ° C) și scade odată cu creșterea temperaturii. Când CO2 este saturat, suspensia apoasă de MgCO3 se dizolvă datorită formării de bicarbonat de Mg (HCO3) 2. Principalii carbonați de magneziu sunt emise din soluții apoase în absența unui exces de CO2. Cu carbonații unui număr de metale, carbonatul de magneziu formează săruri duble, care includ dolomitul mineral MgCO3 · CaCO3.
Prevalența în natură.
Carbonatul de magneziu este larg distribuit în natură sub formă de magnezită minerală.
Aplicație.
Carbonat de magneziu bazic 3MgCO3 · Mg (OH) 2 · 3H2O (așa-numita magnezie albă) este utilizat ca umplutură în compușii de cauciuc pentru fabricarea materialelor izolatoare.
Carbonatul de magneziu este necesar în producția de sticlă, ciment, cărămizi.
Azotat de magneziu Mg (NO3) 2 - cristale higroscopice incolore cu zăbrele cubice; punct de topire 426 ° C (cu descompunere). Solubilitate în apă (g per 100 g): 73,3 (20 ° C), 81,2 (40 ° C), 91,9 (60 ° C). De asemenea, solubil în etanol, metanol, NH3 lichid. În funcție de concentrație, nona-, hexa- și dihidrații cristalizează din soluții apoase.
Componenta îngrășămintelor complexe, deoarece magneziu face parte din clorofila, care este necesară pentru fotosinteză, crește activitatea multor enzime și acționează ca un transportor de fosfor. Solubilitatea ridicată și conductivitatea electrică scăzută fac ca produsul să fie extrem de potrivit pentru hrănirea și îngrășarea foliară, mai ales atunci când se utilizează ape de irigare cu o concentrație mare de sare. Îngrășământ este folosit pentru hrănirea rădăcinilor și a foliilor de legume, fructe de pădure, fructe, struguri; oxidant în compoziții pirotehnice.
carbonizare- saturarea oricărei soluții cu dioxid de carbon. Utilizat în construcții.
Carbonarea carbonică - acidul silicic în silicat este înlocuită cu acid carbonic pentru a forma carbonați. Din carbonați, mineralul formând rocă în rocile sedimentare este calcit (calcar de var) CaCO3 și este mai des întâlnit. Magnezitul - MgCO3 și dolomitul - CaMg (CO3) 2 sunt mai puțin frecvente. apă curată, care nu conține acid carbonic, calcitul este dizolvat într-o cantitate mică (0,03 g pe litru de apă); magnezitul este practic insolubil. Dacă apa conține dioxid de carbon, calcitul se dizolvă ușor cu formarea de carbonat acid de calciu, solubil în apă - Ca (HCO3) 2.
Carbonizarea este o schimbare care apare în beton pe cimentul Portland atunci când este expus aerului C02. Hidroxidul de calciu Ca (OH) 2 în prezența umezelii este în mod deosebit afectat. Hidroxidul de calciu este transformat în carbonat de calciu atunci când absoarbe dioxid de carbon. Carbonatul de calciu este slab solubil în apă și, prin urmare, tinde să închidă ermetic porii de pe suprafața betonului (adică beton dens și impermeabil).
În mod obișnuit, pH-ul apei poroase în beton variază de la 10,5 la 11,5. Dacă datorită carbonizării scade până la 9 și mai jos, este posibilă corodarea armăturii. În consecință, grosimea stratului carbonizat este un factor important în protejarea armăturii: cu cât carbonizarea este mai profundă, cu atât este mai mare riscul coroziunii oțelului. Adâncimea carbonației poate fi determinată prin tratarea betonului cu fenolftaleină. Prezența proprietăților alcaline sub acțiunea fenolftaleinei este indicată de apariția unei culori roz, în timp ce betonul carbonat își păstrează culoarea originală.
Un beton dens de înaltă calitate suferă o carbonizare foarte lentă. Este puțin probabil ca carbonizarea să fi fost observată la o adâncime mai mare de 5-10 mm chiar și după o perioadă de funcționare de 50 de ani. Pe de altă parte, adâncimea de carbonizare a betonului permeabil de joasă rezistență poate ajunge la 25 mm în mai puțin de 10 ani. Experiența arată că produsele din beton de calitate scăzută sunt în mod special susceptibile la carbonizare.
- caracteristică a elementului de calciu: structura electronică, posibile stări de oxidare, compuși principali: oxid, hidroxid, săruri.
calciu - un element al subgrupului principal al celui de-al doilea grup, a patra perioadă a tabelului periodic al elementelor chimice DI Mendeleev, cu numărul atomic 20. Denumită prin simbolul Ca (latură de calciu). Structura electronică 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 = [18 Ar] 4s 2, stare de oxidare +2, 0. Se referă la metale alcalino-pământoase.
Calciul este o substanță simplă - un metal alcalino-pământos moale, activ, chimic, de culoare alb-argintiu. Producția în industrie: electroliza clorurii de calciu topite.
Oxidul de calciu CaO - oxid de bază, praf negru. Alb, higroscopic. Refractar, instabil din punct de vedere termic, volatil în timpul calcinării. Reacționează viguros cu apă (cu un efect exo-ridicat), formează o soluție puternic alcalină, procesul se numește slabă de var. Reacționează cu acizi, oxizi de metale, nemetale. Se utilizează pentru a sintetiza alți compuși de calciu, o componentă a materialelor de legare în construcții.
Producția în industrie - arderea calcarului (900 - 1200 o C)
Hidroxid de calciu Ca (OH) 2 - var hidratat, hidroxid de bază. Descompus cu încălzire moderată. Alb, higroscopic. Absorbtează umezeala și dioxidul de carbon din aer. Puțin solubil în frig. apa, chiar mai puțin - în apă clocotită. O soluție limpede (apa de var) devine rapid tulbure datorită precipitării hidroxidului (suspensia se numește lapte de var). Reacția calitativă este transmiterea dioxidului de carbon prin apa de var cu apariția sedimentului de CaCO3 și trecerea acestuia în soluție. Reacționează cu acizi și oxizi de acizi, intră în reacții de schimb ionic.
Se utilizează în construcții pentru prepararea mortarului de var (nisip + tei de var și apă), care servesc drept material de legătură pentru piatră și zidărie, pereți de finisare (tencuieli) și alte scopuri de construcție. Înghețarea unor astfel de soluții se datorează absorbției de CO2 din aer.
Ca (OH) 2 + CO 2 → CaCO 3 ↓ + H 2 O
Ca (OH) 2 + H2S04 - CaS04 + 2H20,
Reacționează cu săruri dacă se formează un precipitat:
Ca (OH) 2 + Na2S03 → CaS03 ↓ + 2NaOH
Săruri de calciu.
Sulfat de calciu (CaS04) - compus anorganic, sare de calciu a acidului sulfuric.
Se găsește în natură ca CaS04 dihidrat? 2H2O (gips, selenit) și în stare anhidră - anhidrit.
Clorura de calciu, CaCl2 - sare de calciu a acidului clorhidric.
Are proprietăți higroscopice ridicate. Solubilitate (g pe 100 g H20): 74 (20 ° C) și 159 (100 ° C). Soluțiile apoase de clorură de calciu congează la temperaturi scăzute (20% la -18,57 ° C, 30% la -48 ° C).
Formează un hidrat de CaCl2 · 6H2O, stabil până la 29,8 ° C; la temperaturi mai ridicate, hidrații cristalini cu molecule de 4, 2 și 1 H2O cad din soluție saturată. Atunci când CaCl2 * 6H2O (58,8%) este amestecat cu zăpadă sau gheață (41,2%), temperatura scade până la -55 ° C (punct de criohidrat).
Clorura de calciu este obținută ca produs secundar în producerea de sodă.
În laboratorul chimic, clorura de calciu este utilizată ca umplutură pentru uscarea tuburilor, denumită și clorură de calciu, destinată izolării substanțelor din vas din vaporii de apă din atmosferă și pentru uscarea gazelor.
Clorura de calciu este, de asemenea, utilizată ca un accelerator pentru fixarea cimentului;
Carbonat de calciu (carbonat de calciu) - compus chimic anorganic, sare de acid carbonic și calciu. Formula chimică -CaCO3. În natură, se găsește sub formă de minerale - calcit, aragonit și vaterite, este componenta principală a calcarului, marmurei, cretei, face parte din coaja ouălor. Insolubil în apă și etanol.
Putty, diferite materiale de etanșare - toate conțin carbonat de calciu în cantități semnificative. De asemenea, carbonatul de calciu este o componentă esențială în producția de produse chimice de uz casnic.
Carbonatul de calciu este, de asemenea, utilizat pe scară largă în sistemele de purificare, ca mijloc de combatere a poluării mediului, cu ajutorul carbonatului de calciu, restabilind echilibrul acido-bazic al solului.
- Exemple care ilustrează utilizarea oxizilor și hidroxizilor de calciu și magneziu în construcții.
Oxid de calciu și hidroxid:
Când camerele de spălat.
Atunci când împodobiți garduri din lemn și căptușește - pentru a proteja împotriva putregaiului și a focului.
Pentru prepararea mortarului de var. Varul a fost folosit pentru construirea zidăriei din cele mai vechi timpuri. Amestecul este preparat în mod obișnuit în această proporție: trei sau patru părți de nisip (în greutate) se adaugă la o parte a amestecului de hidroxid de calciu (var hidratat) cu apă. Când se întâmplă acest lucru, amestecul se întărește prin reacția: Ca (OH) 2 + CO2 → CaCO3 ↓ + H2O. Aceasta este o reacție exotermă, eliberarea de energie este de 27 kcal (113 kJ).
Așa cum se poate observa din reacție, în timpul acesteia se eliberează apă. Acesta este un factor negativ, deoarece în încăperi construite cu mortar de var, umiditatea ridicată persistă mult timp. În acest sens, precum și datorită unui număr de alte avantaje față de hidroxidul de calciu, cimentul la înlocuit practic ca un liant pentru soluțiile de construcție. Mai mult decât atât, este inacceptabilă și utilizarea la sobe, deoarece sub influența temperaturilor ridicate se eliberează sufocarea dioxidului de carbon.
Pentru prepararea betonului silicat. Compoziția betonului silicat este identică cu cea a mortarului de var, dar este preparată printr-o altă metodă - un amestec de oxid de calciu și nisip quartz nu este tratat cu apă, ci cu vapori de apă supraîncălziți (174,5-197,4 ° C) într-o autoclavă la o presiune de 9-15 atmosfere.
În fabricarea cărămizilor din silicat.
Oxid și hidroxid de magneziu:
pentru producerea de sisteme combinate de materiale refractare (plăci de construcție din magnezită), pentru producția de cimenturi. Oxidul de magneziu (magneziu caustic) este utilizat ca liant, care, amestecat cu soluție de MgCl2, este capabil să se întărească rapid și să obțină rezistență în aer.
- duritatea apelor naturale: definiție, tipuri de duritate, metode de îndepărtare a durității apei: fizice, chimice (ecuații de reacție), fizico-chimice.
Apă naturală care conține o cantitate mare de săruri de calciu sau magneziu într-o soluție este numită apă tare, spre deosebire de apa moale care conține puțin sau deloc săruri de calciu și magneziu.
Primul dintre acestea se datorează prezenței bicarbonat de calciu și de magneziu, al doilea în prezența sărurilor de acizi puternici - sulfați sau cloruri de calciu și magneziu. Cu fierbere pe termen lung a apei cu duritate carbonatată, în ea apare un precipitat, constând în principal din CaCO3 și, în același timp, se eliberează CO2.
Ambele substanțe apar datorită descompunerii carbonatului de calciu:
Prin urmare, rigiditatea carbonatului este numită și rigiditate temporară. Din punct de vedere cantitativ, rigiditatea temporară se caracterizează prin conținutul de bicarbonați eliminați din apă când este fiert timp de o oră. Rigiditatea rămasă după astfel de fierbere se numește rigiditate permanentă.
Duritatea apei este exprimată prin suma de miliechivalenți de ioni de calciu și magneziu conținute în apă. Un miliequivalent de rigiditate corespunde unui conținut de 20,04 mg / l sau 12,16 mg / l.
Duritatea apelor naturale variază foarte mult. Este diferit în diferite rezervoare și în același râu variază pe tot parcursul anului (minim în timpul inundațiilor). Duritatea apelor mărilor este mult mai mare decât râurile și lacurile. Astfel, apa de la Marea Neagră are o duritate totală de 65,5 meq / l. Valoarea medie a durității apei din oceanul mondial este de 130,5 meq / l (inclusiv 22,5 meq / l per meq / l).
Prezența unor cantități semnificative de săruri de calciu sau magneziu în apă face ca apa să nu fie potrivită pentru multe scopuri tehnice. Astfel, cu alimentarea prelungită a cazanelor cu aburi cu apă tare, pereții lor se acoperă treptat cu o crudă densă de nakiii. O astfel de crustă deja la o grosime a stratului reduce în mod considerabil transferul de căldură prin pereții cazanului și, prin urmare, conduce la o creștere a consumului de combustibil. În plus, poate provoca formarea de vezicule și fisuri atât în tuburile de încălzire, cât și pe pereții cazanului.
Apa tare nu dă spumă cu săpun, așa cum este solubil în săpun săruri de sodiu acizii grași - palmitic și stearic - sunt transformați în săruri de calciu insolubile ale aceleași acizi:
Apa tare nu poate fi utilizată atunci când efectuați anumite procese tehnologice, de exemplu, atunci când vopsiți.
Duritatea constantă a apei se datorează prezenței în ea în principal a sulfați și cloruri de calciu și magneziu și nu este eliminată prin fierbere. Suma durității temporare (detașabilă) și constantă este duritatea totală a apei.
Există diferite moduri de determinare a rigidității.
Luați în considerare două dintre ele:
1) determinarea rigidității temporale utilizând soluția de acid clorhidric titrat
2) metoda complexometrică pentru determinarea rigidității totale.
În timpul titrării unei probe de apă cu acid clorhidric în prezența portocaliei metil, se produce descompunerea bicarbonatului, provocând rigiditate temporară:
Metoda de determinare. 100 ml din apa de testare sunt prelevate într-un balon conic cu pipeta sau cu un cilindru de măsurare, se adaugă 2-3 picături de portocaliu metil și se titrează cu 0,1 și. Soluție HCI până când apare culoarea portocalie.
Analiza rezultatelor analizei. 1 ml 0,1 n. Soluția de HCI corespunde cu 0,1 / 1000 g-eq sau 0,1 mg-eq Ca2 +. V (HCI) corespunde la 0,1 V (HCI) / 1000 g-eq sau 0,1 V (HCl) mg-eq Ca2 +. 0,1 V (HCl) mEq este în volumul V A. Pentru a exprima rigiditatea în echivalent miligrame pe 1 litru de apă, trebuie să împărțiți valoarea găsită de V A și să multiplicați cu 1000, adică duritatea apei studiate este
![]()
Metode de eliminare.
Înmuiere termică. Bazat pe fierberea apei, ca urmare a bicarbonatului de calciu și magneziu instabil termic, se descompune prin formarea de scară:
Ca (HCO3) 2 → CaC03 ↓ + CO2 + H2O.
Încălzirea elimină numai duritatea temporară (carbonatată). Găsește aplicația în viață.
Reîncălzirea reactivului. Metoda se bazează pe adăugarea de Na2CO3 de sodiu sau de Ca (OH) 2 calcarat hidratat în apă. În același timp, sărurile de calciu și magneziu trec în compuși insolubili și, ca rezultat, precipită.
De exemplu, adăugarea de var hidratat duce la conversia sărurilor de calciu în carbonat insolubil:
Ca (HCO3) 2 + Ca (OH) 2 → 2CaCO3 ↓ + 2H2O
Cel mai bun reactiv pentru eliminarea durității totale a apei este Na3PO4 ortofosfat de sodiu, care face parte din majoritatea produselor de uz casnic și industrial:
3Ca (HCO3) 2 + 2Na3P04 → Ca3 (PO4) 2 ↓ + 6NaHCO3
3MgS04 + 2Na3P04 → Mg3 (PO4) 2 ↓ + 3Na2S04
Calciul și ortofosfații de magneziu sunt foarte puțin solubili în apă și, prin urmare, ușor separați prin filtrare mecanică. Această metodă este justificată la un consum relativ ridicat de apă, deoarece este asociată cu soluția unui număr de probleme specifice: filtrarea sedimentelor, dozarea exactă a reactivului.
schimb de cationi. Metoda se bazează pe utilizarea încărcării granulate de schimb de ioni (cel mai adesea rășini schimbătoare de ioni). O astfel de sarcină la contactul cu apa absoarbe cationii sărurilor de duritate (calciu și magneziu, fier și mangan). În schimb, în funcție de forma ionică, dă ioni de sodiu sau hidrogen. Aceste metode sunt numite Na-cationizare și cationizare H. Cu încărcare cu schimb de ioni selectată în mod corespunzător, duritatea apei scade cu cationizarea sodică în monoetajare la 0,05-0,1 ° W, cu încărcare în două etape - la 0,01 ° W. În industrie, filtrele cu schimb de ioni înlocuiesc ionii de calciu și magneziu cu ioni de sodiu și potasiu, producând apă moale.
Osmos invers. Metoda se bazează pe trecerea apei prin membrane semipermeabile (de obicei poliamidă). Împreună cu sărurile de duritate, majoritatea celorlalte săruri sunt eliminate. Eficacitatea de purificare poate atinge 99,9%.
Există nanofiltrare (diametrul nominal al găurilor membranei este egal cu unitățile de nanometri) și picofiltrarea (diametrul nominal al găurilor membranei este egal cu unitățile de picometre).
Ca dezavantaje ale acestei metode trebuie notat:
Necesitatea unei tratări prealabile a apei furnizate membranei cu osmoză inversă;
Costul relativ ridicat de 1 litru de apă produsă (echipament costisitor, membrane costisitoare);
Mineralizare scăzută a apei produse (mai ales atunci când picofiltrarea). Apa devine aproape distilată.
Electrodializă. Se bazează pe îndepărtarea sărurilor din apă sub acțiunea unui câmp electric. Îndepărtarea ionilor de substanțe dizolvate se produce datorită membranelor speciale. La fel ca în cazul utilizării tehnologiei cu osmoză inversă, se produce îndepărtarea altor săruri, pe lângă ionii de duritate.
Completați curățarea apei din sărurile de duritate pot fi distilate.
