Genetinės nemetalų pavyzdžių serijos. Genetinis ryšys tarp cheminių medžiagų klasių - žinių hipermarket
Tarp genetinių medžiagų, oksidų, bazių, rūgščių ir druskų yra genetinis ryšys, būtent jų tarpusavio perėjimo (transformacijos) galimybė.
Pavyzdžiui, paprasta medžiaga - kalcis dėl sąveikos su deguonimi tampa oksidu: 2Ca + O 2 = 2CaO.
Kalcio oksidas, sąveikaujant su vandeniu, sudaro kalcio hidroksidą CaO + H20 = Ca (OH) 2, o pastarieji, sąveikaujant su rūgštimi, virsta druska: Ca (OH) 2 + H2S04 = CaSO 4 + 2H 2 O.
Šios transformacijos gali būti pateiktos schemoje:
Ca → CaO → Ca (OH) 2 → CaSO 4
Panaši schema gali būti parašyta ne metalo, pavyzdžiui, sieros:
S → SO3 → H2S04 → CaSO4
Taigi, ta pati druska gaunama įvairiais būdais.
Taip pat galimas atvirkštinis perėjimas iš druskos į kitas neorganinių junginių klases ir paprastas medžiagas:
CuSO 4 → Cu (OH) 2 → CuO → Cu
CuSO 4 + 2NaOH = Cu (OH) 2 ↓ + Na2S04
Cu (OH) 2 = CuO + H20
CuO + H2 = Cu + H20 (vario redukcija)
Panašus ryšys tarp neorganinių junginių klasių, pagrįstas vienos klasės medžiagų gamyba iš kitų medžiagų, vadinamas genetiniu.
Kompleksinių junginių savybės atsispindi pagrindinių neorganinių junginių klasių genetinėje schemoje (žr. Paveikslą). Jis atspindi neorganinių medžiagų išsivystymo etapus dviejose pagrindinėse linijose, nuo tipiškų metalų iki tipiškų nemetalų su priešingomis savybėmis.
Metalai, kurių cheminė atomo savybė yra gebėjimas paaukoti elektronus, ir nemetalai, kurių pagrindinė cheminė savybė yra jų atomų gebėjimas pridėti savybes priešais vienas kitą. Dėl sudėtingų medžiagų sudėties šios priešingos tendencijos ir toliau išlieka.
Tipiniai metalai ir pereinamieji elementai žemiausio oksidacijos būsenoje sudaro bazinius oksidus, o tipiniai nemetalai ir pereinamieji elementai aukšto oksidacijos būsenoje sudaro priešingus rūgšties oksidus.
Paprastos medžiagos
Amfoterinis
Nemetalai
Baziniai oksidai
Amfoterinis
Rūgštus
Priežastys
Amfoterinis
hidroksidai
Pagrindinių neorganinių junginių klasių genetinė schema
Toliau komplikuojant medžiagų sudėtį, susidaro hidroksidai, bazės oksidai atitinka bazę ir rūgšties oksidai. Priešingos savybės ir rūgštys aktyviai reaguoja tarpusavyje, formuodamos druskas. Oponentų sąveika yra reakcijos varomoji jėga. Todėl baziniai ir rūgštiniai oksidai, bazės ir rūgštys aktyviai sąveikauja tarpusavyje, o du rūgštiniai oksidai arba du baziniai oksidai nesusiję, nes jų savybės yra artimos.
Taigi kompleksinio junginio savybės nustatomos remiantis jo sudedamųjų dalių savybėmis. Pagrindiniai šių savybių pakeitimo įstatymai apibendrinti toliau pateiktose programose (6 lentelė).
1. Tais laikotarpiais, kai sekos numeris didėja, elementų savybės keičiasi iš metalo į nonmetal. Didėja elektronų skaičius išoriniame lygyje, padidėja elemento oksidacijos laipsnis, sumažėja atomo ir jonų spindulys, jonizacijos energija ir afinitetas elektronui didėja. Atsižvelgiant į tai, didėja oksidų ir hidroksidų pagrindiniai sumažėjimai ir rūgštinės savybės.
2. Pagrindiniuose pogrupiuose pagrindinės oksidų ir hidroksidų savybės didėja didėjant atominiam skaičiui. Šoninių grupių elementams, kurių eilės numeris padidėja, būdingas sudėtingesnis savybių pokytis. Pirma, metalinės savybės sustiprinamos ir sumažinamos.
3. Aktyvieji metalai atitinka oksidus ir hidroksidus su stipriomis pagrindinėmis savybėmis. Aktyviausi metalai yra šarminis ir šarminis žemė. Jie sudaro vandenyje tirpius oksidus ir stiprius tirpius pagrindus - šarmus.
4. Mažai aktyvūs metalai (visi, išskyrus šarminę ir šarminę žemę) sudaro silpnas bazes, kurias sunku ištirpinti vandenyje:
Cu (OH) 2, Fe (OH) 3.
5. Oksidai ir hidroksidai su stipriomis rūgštinėmis savybėmis atitinka aktyvius nemetalus.
6. Amfoteriniai metalai sudaro amfoterinius oksidus ir hidroksidus.
7. Jei elementas turi skirtingą oksidacijos laipsnį, tada oksidai ir hidroksidai su skirtingomis savybėmis atitinka jį.
Tema: metalų ir nemetalų ir jų junginių genetiška jungtis. 9 klasė
Tikslai: švietimo: konsoliduoti „genetinės serijos“, „genetinio ryšio“ sąvoką; išmokyti, kaip sukurti genetinių elementų seriją (metalus ir ne metalus), kad būtų sudarytos genetinės serijos reakcijos lygtys; patikrinkite, kaip išmokamos žinios cheminės savybės oksidai, rūgštys, druskos, bazės; plėtoti: ugdyti gebėjimą analizuoti, palyginti, apibendrinti ir padaryti išvadas, sudaryti cheminių reakcijų lygtis; švietimo: skatinti mokslinės pasaulėžiūros formavimąsi.
Klasių teikimas: lentelės „Periodinė sistema“, „Tirpumo lentelė“, „Metalų veiklos serija“, nurodymai studentams, užduotys žinoti.
Pažanga: 1) Org. šiuo metu
2) Patikrinkite d / s
3) Studijuoti naują medžiagą
4) Tvirtinimas
5) D / C
1) Org. šiuo metu. Sveikinimai
2) Patikrinkite d / s.
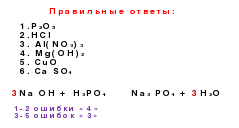
Genetiniai ryšiai yra ryšiai tarp skirtingų klasių, remiantis jų tarpusavio konversijomis.
Žinant neorganinių medžiagų klases, galima sudaryti genų ir metalų seriją. Šių serijų pagrindas yra tas pats elementas.
Tarp metalų yra dviejų tipų eilutės:
1
. Genų serija, kurioje šarmai veikia kaip pagrindas. Šią seriją galima atvaizduoti naudojant šias transformacijas:metalo → bazinio oksido → šarmų → druska
Pavyzdžiui, K → K
2 O → KOH → KCl2
. Genetinė serija, kurioje bazė yra netirpi bazė, tada serija gali būti pavaizduota kaip transformacijų grandinė:metalas → bazinis oksidas → druska → netirpus pagrindas →
→bazinis oksidas → metalas
Pavyzdžiui, Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu
1
. Genetinė nemetalų serija, kurioje tirpios rūgšties veikia kaip jungtis serijoje. Pakeitimų grandinę galima pavaizduoti taip:ne metalo → rūgšties oksidas → tirpus rūgštis → druska
Pavyzdžiui, P → P
2 O 5 → H 3 PO 4 → Na 3 PO 42
. Genetinė nemetalų serija, kurioje netirpi rūgštis veikia kaip serijos nuoroda:ne metalo → rūgšties oksidas → druska → rūgštis →
→rūgšties oksidas → ne metalas
Pavyzdžiui
Si→ Sio 2 → Na 2 Sio 3 → H 2 Sio 3 → Sio 2 → Si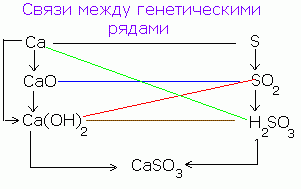
Priekinis pokalbis apie:
Kas yra genetinis ryšys? Genetiniai ryšiai yra ryšiai tarp skirtingų klasių, remiantis jų tarpusavio sąveika.
Genetinė serija - medžiagų serija - įvairių klasių atstovai, kurie yra vieno cheminio elemento junginiai, sujungti tarpusavyje ir atspindintys šių medžiagų transformacijas. Šių serijų pagrindas yra tas pats elementas.
Kokias genetinių serijų rūšis galima išskirti? Tarp metalų galima išskirti dviejų tipų serijas:
a) genetinė serija, kurioje šarmai veikia kaip pagrindas. Šią seriją galima atvaizduoti naudojant šias transformacijas:
metalo → bazinio oksido → šarmų → druska
pvz., kalio K → K genetinė serija
2 O → KOH → KClb) genetinė serija, kurioje bazė yra netirpi bazė, tada serija gali būti pavaizduota kaip transformacijų grandinė:
metalas → bazinis oksidas → druska → netirpus pagrindas → bazinis oksidas → metalas
pavyzdžiui: Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → CuTarp nemetalų taip pat galima išskirti dviejų tipų eilutes:
a) Ne metalo genetinė serija, kurioje tirpios rūgšties veikia kaip jungtis serijoje. Transformacijų grandinę galima pavaizduoti taip: ne metalo → rūgšties oksidas → tirpus rūgštis → druska.
Pavyzdžiui: P → P
2 O 5 → H 3 PO 4 → Na 3 PO 4b) Genetinė nemetalų eilutė, kurioje netirpi rūgštis: ne metalas → rūgšties oksidas → druska → rūgštis → rūgšties oksidas → ne metalas veikia kaip jungtis serijoje
Pavyzdžiui: Si → SiO
2 → Na 2 Sio 3 → H 2 Sio 3 → SiO 2 → SiUžduočių vykdymas parinktims:
1. Savo versijoje pasirinkite oksido formulę, paaiškinkite savo pasirinkimą, remiantis žiniomis apie šios klasės junginių sudėties savybes. Skambinkite jiems.
2. Savo varianto formulės stulpelyje raskite rūgščių formules ir paaiškinkite savo pasirinkimą, remiantis šių junginių sudėties analize.
3. Nustatykite rūgščių liekanų valios rūgšties kompozicijoje.
4. Pasirinkite druskos formules ir pavadinkite jas.
5. Užpildykite druskų, kurios gali būti susidariusios su magnio ir jūsų varianto rūgštimis, formules. Užrašykite juos, pavadinkite.
6. Savo variacijos formulės stulpelyje raskite pagrindines formules ir paaiškinkite savo pasirinkimą, remiantis šių junginių sudėties analize.
7. Savo variante pasirinkite medžiagų, su kuriomis gali reaguoti ortofosforo rūgšties (druskos, sieros) tirpalas, formules. Atlikite tinkamas reakcijos lygtis.
9. Tarp jūsų pasirinkimo formulių pasirinkite medžiagų, kurios gali sąveikauti tarpusavyje, formules. Atlikite tinkamas reakcijos lygtis.
10. Sukurkite neorganinių junginių genetinių ryšių grandinę, į kurią bus įtraukta medžiaga, kurios formulė pateikta jūsų versijoje pirmajame.
1 galimybė
2 galimybė
Cao
Hno
3Fe (OH)
3N
2 OZn (NE
3 ) 2Cr (OH)
3H
2 SO 3H
2 SPbo
LiOH
Ag
3 PO 4P
2 O 5NaOH
Zno
CO
2BaCl
2HCl
H
2 CO 3H
2 SO 4Cuso
4Iš šių medžiagų sukurkite genetinę liniją, naudojant visas formules. Parašykite reakcijos lygtis, su kuriomis galite atlikti šią transformacijų grandinę:
Aš pasirinksiu: ZnSO
4, Zn, ZnO, Zn, Zn (OH) 2 : II parinktis:Na 2 SO 4, NaOH, Na, Na 2 O 2 , Na 2 O4) Tvirtinimas1.
Al→ Al 2 O 3 → AlCl 3 → Al( OH) 3 → Al 2 O 32.
P→ P 2 O 5 → H 3 PO 4 → Na 3 PO 4 → Ca 3 ( PO 4 ) 23. Zn → ZnCl
2 → Zn (OH) 2 → ZnO → Zn (NE 3 ) 24. Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu5.N
2 O 5 → HNO 3 → Fe (NE 3 ) 2 → Fe (OH) 2 → FeS → FeSO 45) Namų darbas:
aprašyti laipsnišką perėjimą iš kalcio į kalcio karbonatą ir parengti ataskaitą apie bet kurios druskos vartojimą medicinoje (naudojant papildomą literatūrą).

Tarp metalų galima išskirti dviejų tipų eilutes: 1. Genetinė serija, kurioje šarmai veikia kaip pagrindas. Šią seriją galima pavaizduoti tokiomis transformacijomis: metalo - bazinio oksido - šarminės druskos, pavyzdžiui, kalio K - K 2 O - KOH - KCl genetinė serija.

2. Genetinė serija, kurioje netirpsta bazė veikia kaip bazė, tuomet serija gali būti pavaizduota kaip transformacijų grandinė: metalo - bazinio oksido - druskos netirpi bazė - bazinis oksidas - metalas. Cu - CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e Cu genetinė vario serija "\u003e Cu yra genetinė vario serija"\u003e "title =" (! LANG: 2. Genetinė serija, kurioje bazė yra netirpus pagrindas, tada serija gali būti pavaizduota kaip transformacijų grandinė: metalo - bazinio oksido - druskos netirpi bazė - pagrindinis oksidas yra metalas. Cu - CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e"> title="2. Genetinė serija, kurioje netirpsta bazė veikia kaip bazė, tuomet serija gali būti pavaizduota kaip transformacijų grandinė: metalo - bazinio oksido - druskos netirpi bazė - bazinis oksidas - metalas. Cu - CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e"> !}
Tarp nemetalinių medžiagų taip pat galima išskirti dviejų tipų eilutes: 1. Nemetalų genetinė serija, kurioje tirpios rūgšties veikia kaip jungtis serijoje. Transformacijų grandinę galima pavaizduoti taip: ne metalo rūgšties oksido - tirpios rūgšties - polio. P - P205 - H3P04 - Na3P04. Fosforo genetinė sritis

Tarp neorganinių junginių klasių yra genetinis ryšys. Iš paprastų medžiagų galite gauti sudėtingą ir atvirkščiai. Iš vienos klasės junginių galite gauti kitos klasės junginius.
Supaprastintas genetinis ryšys tarp neorganinių junginių klasių gali būti pateikiamas pagal šią schemą:
Tokių ne metalų transformacijų seką galima pavaizduoti tokia schema: CANPO 4
Р → Р 2 О 5 → Н 3 РО 4 → 3 (РО 4) 2
(Saonas) 3 PO 4
Tipiškiems metalams galite padaryti tokią transformacijų grandinę:
Ba → BaO → Ba (OH) 2 → BaSO 4
Metalams, kurių oksidai ir hidroksidai yra amfoteriniai (semimetrai), galima atlikti šiuos transformacijas:
Al → Al2O3 → Al (OH) 3 → Na → AlCl3 → AlOHCl2 → Al (OH) 3 → Al2O3.
Sąsajos tarp klasių:
1. Metalai, nemetalai→ druska.
Su tiesiogine metalų ir nemetalų sąveika susidaro deguonies neturinčių rūgščių (halogenidų, sulfidų) druskos:
2Na + C12 = 2NaCl
Šie junginiai yra stabilūs ir neskaidomi kaitinant.
2. Baziniai oksidai, rūgšties oksidai→ druska.
CaO + CO 2 = CaCO3;
Na2O + SO3 = Na2S04.
3. Bazės, rūgštys→ druska.
Jis atliekamas neutralizavimo reakcija:
2NaOH + H2S04 = Na2S04 + 2H2O,
HE - + H + → H20;
Mg (OH) 2 + 2HC1 = MgCl2 + 2H2O,
Mg (OH) 2 + 2H + → Mg2+ + 2H2O.
4. Metalai→ baziniai oksidai.
Dauguma metalų sąveikauja su deguonimi ir sudaro oksidus:
2Ca + O2 = 2CaO;
4A1 + 3O2 = 2A1203.
Auksas, sidabras, platina ir kiti taurieji metalai neturi sąveikos su deguonimi, tokių metalų oksidai gaunami netiesiogiai.
5. Nemetalai→ rūgšties oksidai.
Nemetalai (išskyrus halogenus ir taurias dujas) sąveikauja su deguonimi ir sudaro oksidus:
4P + 5O2 = 2P2O5;
S + O2 = SO2.
6. Baziniai oksidai→ priežasčių.
Tiesioginę sąveiką su vandeniu galima gauti tik šarminių ir šarminių metalų (šarmų) hidroksidams:
Na20 + H20 = 2NaOH;
CaO + H20 = Ca (OH) 2.
Likę pagrindai gaunami netiesiogiai.
7. Rūgštiniai oksidai→ rūgšties.
Rūgštiniai oksidai reaguoja su vandeniu, kad susidarytų atitinkamos rūgštys:
SO3 + H20 = H2S04;
Р 2O 5 + 3H 2 O = 2H3P04.
Išimtis yra SiO 2, kuris nereaguoja su vandeniu.
8. Bazės, rūgšties oksidai→ druska.
Šarmai sąveikauja su rūgštiniais oksidais, kad susidarytų druskos:
2NaOH + SO3 = Na2S04 + H20,
2OH - + SO3 = SO4 2- + H20;
Ca (OH) 2 + СO 2 = CaCO3 ↓ + Н 2 O,
Ca 2+ + 2OH - + CO 2 → CaCO3 ↓ + H 2 O.
9. Rūgštys, baziniai oksidai→ druska.
Metalo oksidai ištirpsta rūgštyse, sudarančios druskas:
CuO + H2S04 = CuS04 + H20,
CuO + 2H + = Cu2 + + H20;
Na2O + 2HS1 = 2NaCl + H20,
Na20 + 2H + = 2Na + + H20.
10. Priežastys→ baziniai oksidai.
Netirpios bazės ir LiOH suyra kaitinant:
2LiOH = Li20 + H20;
Cu (OH) 2 = CuO + H20.
11. Rūgštys→ rūgšties oksidai.
Nestabilios deguonies turinčios rūgštys sušildomos kaitinant (H2 SiO 3) ir net be kaitinimo (H 2CO 3, HClO). Tuo pačiu metu keletas rūgščių yra atsparios kaitinimui (H 2 SO 4, H 3 PO 4).
H2 SiO3 = H20 + Si02;
H 2CO 3 = H20 + CO 2.
12. Metalo oksidai→ metalai.
Kai kurie sunkiųjų metalų oksidai gali suskaidyti į metalą ir deguonį:
2HgO = 2Hg + O 2.
Be to, iš atitinkamų oksidų gaunami metalai, naudojant redukuojančius agentus:
3Mn02 + 4Al = 3Mn + 2Al203;
Fe203 + 3H2 = 2Fe + 3H2O.
13. Rūgštiniai oksidai→ nemetalų
Dauguma ne metalo oksidų neskaidomi kaitinant. Ne metalas ir deguonis išskiria tik keletą nestabilių oksidų (halogeno oksidų).
Kai kurie nemetalai gaunami redukuojant iš atitinkamų oksidų:
SiO 2 + 2Mg = 2MO + Si.
14. Druskos, bazės → bazės.
Netirpios bazės gaunamos veikiant šarmus atitinkamų rūgščių tirpalams:
CuSO 4 + 2NaOH = Cu (OH) 2 ↓ + Na2S04,
Cu 2+ + 2OH - → Cu (OH) 2 ↓;
FeCl2 + 2KOH = Fe (OH) 2 ↓ + 2KCl,
Fe 2+ + 2OH - = Fe (OH) 2 ↓.
15. Druskos, rūgštys → rūgštys.
Tirpios druskos reaguoja su rūgštimis (pagal slėgio seriją), jei rezultatas yra silpnesnė arba laki rūgštis:
Na 2 SiO 3 + 2HCl = 2NaCl + H 2 SiO 3 ↓,
SiO 3 2- + 2H + → H 2 SiO 3 ↓;
NaCl (s) + H2S04 (k) = NaHS04 + HCl.
16. Druskos→ baziniai oksidai, rūgšties oksidai.
Kai kurių deguonies turinčių rūgščių (nitratų, karbonatų) druskos sušildomos:
CaCO3 = CaO + CO 2;
2Cu (NO3) 2 = 2CuO + 4NO2 + O2.
NEPRIKLAUSOMO DARBO TYRIMAS DĖL TEMO „GENERINĖS SUSIJUSIOS SU NEORGANINIŲ SAVYBIŲ KLASĖS“
1. Nurodykite toliau išvardytas medžiagas, jas paskirstykite į neorganinių junginių klases: Na3P04, H2 SiO3, NO, B203, MgS, BaI2, Ca (OH) 2, KNO3, HNO2, Cl2 O7, Fe (OH) 2, P205, HF, MnO2.
2. Iš toliau išvardytų medžiagų galima gauti hidroksidą (rūgštį arba bazę) viename etape: varis, geležies oksidas (P), bario oksidas, azoto oksidas (P), azoto oksidas (V), silicio oksidas, vario sulfatas, kalio chloridas , kalio, magnio karbonato.
3. Iš pirmiau pateikto sąrašo užrašykite medžiagų, susijusių su: 1) oksidais, formules; 2) priežastys; 3) rūgštys; 4) druskos:
CO 2, NaOH, HCl, SO3, CuSO4, NaN03, KCl, H2SO4, Ca (OH) 2, P205, HN03, Al (OH) 3.
4. Nurodykite medžiagas: Zn (OH) 2, MgO, P203, NaHC03, H3P03, Fe2 (SO4) 3, KOH, (AlOH) 3 (PO 4) 2, Ba (MnO 4 ) 2, CO, HI. Nurodykite, kuri klasė priklauso kiekvienai medžiagai.
5. Parašykite šių medžiagų molekulines formules ir nurodykite, kuri klasė priklauso kiekvienai medžiagai:
1) vario (II) hidroksikarbonatas;
2) azoto oksidas (V);
3) nikelio (II) hidroksidas;
4) bario vandenilio fosfatas;
5) perchloro rūgštis;
6) chromo (III) hidroksidas;
7) kalio chloratas;
8) vandenilio sulfido rūgštis;
9) natrio cinkatas.
6. Pateikite reakcijos, susijusios su:
1) paprastos medžiagos - ne metalai;
2) paprasta medžiaga ir oksidas;
3) oksidai;
4) kompleksinės medžiagos, kurios nėra oksidai;
5) metalas ir ne metalas;
6) trys medžiagos.
7. Kuri iš šių medžiagų gali reaguoti:
1) anglies monoksidas (IV): HCl, O2, NO2, KOH, H20;
2) magnio oksidas: Ba (OH) 2, HCl, CO2, O2, HNO3;
3) geležies (II) hidroksidas: KCl, HCl, KOH, O2, H20, HNO3;
4) vandenilio chloridas: Zn, MgO, ZnCl2, HNO3, Ca (OH) 2, Cu, (ZnOH) Cl.
8. Ar įmanoma šių medžiagų sąveika?
1) anglies monoksidas (IV) ir kalio hidroksidas;
2) kalio hidrosulfatas ir kalcio hidroksidas;
3) kalcio fosfatas ir sieros rūgštis;
4) kalcio hidroksidas ir sieros oksidas (IV);
5) sieros rūgštis ir kalio hidroksidas;
6) kalcio hidrokarbonatas ir fosforo rūgštis;
7) silicio dioksidas ir sieros rūgštis;
8) cinko oksidas ir fosforo oksidas (V).
Parašykite galimų reakcijų lygtis, nurodykite sąlygas, kuriomis jie atsiranda. Jei reakcijos gali sukelti skirtingas medžiagas, nurodykite, koks jų įgyvendinimo sąlygų skirtumas.
9. Pateikite reakcijų lygtis, kad gautumėte šias medžiagas: natrio ortofosfatą (4 būdai), kalio sulfatą (7 būdai), cinko hidroksidą.
10. Vienas iš natrio karbonato gamybos būdų yra vandens ir anglies monoksido (IV) poveikis natrio aliuminatui. Užpildykite reakcijos lygtis.
11. Jis keičia koeficientus, rašo reakcijos produktus:
1) MgO + 2H 2 SO 4 →
2) 2SO 2 + Ba (OH) 2 →
3) 3N205 + 2Al (OH) 3 →
4) P205 + 4NaOH →
5) P205 + 6NaOH →
6) P205 + 2NaOH →
12. Atlikite skirtingų tipų druskų priėmimo reakcijų lygtis:
1) SO 2 + Ba (OH) 2 → (vidutinės ir rūgšties druskos),
2) A1203 + H20 + HNO3 → (vidutinė druska, bazinės druskos),
3) Na20 + H 2S → (terpės ir rūgšties druskos),
4) SO3 + Sa (OH) 2 → (vidutinės ir bazinės druskos),
5) CaO + H20 + P205 → (bazinė druska, rūgšties druskos).
13. Atlikite reakcijos lygtis:
CaO + A1203 → CaHPO4 + Ca (OH) 2 →
Cr203 + H2S04 → AlOHSO4 + NaOH →
Cr203 + NaOH → CaCO3 + CO 2 + H 2 O →
A1203 + HClO4 → Ca (HCO3) 2 + HCl →
Mn207 + KOH → ZnS + H 2S →
NO2 + Ca (OH) 2 → CaSO 4 + H 2 SO 4 →
Zn (OH) 2 + NaOH → (ZnOH) Cl + HCl →
Zn (OH) 2 + HNO3 → Bi (OH) 3 + H 2 SO 4 (nepakankamas) →
AlCl3 + NaOH (trūkumas) → (FeOH) Cl + NaHS →
AlCl3 + NaOH → Na2ZnO2 + H2S04 (perteklius) →
AlC1 3 + NaOH (perteklius) → Ca (AlO2) 2 + HCl (perteklius) →
14. Užsirašykite reakcijos lygtis, su kuriomis galite atlikti šias transformacijas:
1) Cu → CuO → CuSO 4 → Cu (OH) 2 → CuC1 2 → Cu (NO 3) 2
2) Zn → ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → ZnCl 2
3) Р → Р 2 O 5 → Н 3 РО 4 → К 3 РО 4 → Са 3 (РО 4) 2 → Н 3 РО 4
4) Mg → MgO → MgCl2 → Mg (OH) 2 → Mg (HSO 4) 2 → MgSO 4
5) Ca → CaO → Ca (OH) 2 → CaCO 3 → Ca (HCO 3) 2 → CO 2
6) Cr → Cr 2 (SO 4) 3 → Cr (OH) 3 → Na2R2 → Cr 2 O 3 → K
7) P → P2O5 → HPO 3 → H3P04 → NaH2P04 → Na3P04
8) CuS → CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
9) Al → Al2O3 → Al2 (SO4) 3 → Al (HSO4) 3 → Al (OH) 3 → K
10) S → SO2 → SO3 → NaHS04 → Na2S04 → BaSO4
11) Zn → ZnO → ZnCl2 → Zn → Na2
12) Zn → ZnSO4 → ZnCl2 → Zn (OH) 2 → Na 2 → Zn (NO 3) 2
13) Ca → CaCl2 → CaCO3 → Ca (HCO3) 2 → Ca (NO 3) 2
14) Ca → Ca (OH) 2 → CaCO3 → CaCl2 → CaCO 3 → Ca (NO 3) 2
15) CuO → CuCl 2 → Cu (NO 3) 2 → CuO → CuSO 4 → CuO
16) CaO → Ca (OH) 2 → Ca (NO 3) 2 → Ca (NO 2) 2 → HNO 2 → NaNO 2
17) MgO → MgS04 → MgCl2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
18) SO2 → H 2SO 3 → KHS03 → K2SO3 → KHS03 → SO2
19) P205 → H3P04 → Ca (H2P04) 2 → Ca3 (PO4) 2 → Ca (H2P04) 2 → CaHPO 4
20) CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl2 → Ca (NO 3) 2 → CaSO 4
21) PbO → Pb (NO3) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbCl2
22) ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2 → K 2
23) Al2O3 → AlCl3 → Al (OH) 3 → NaAlO2 → Al (OH) 3 → K
24) ZnSO 4 → Zn (OH) 2 → ZnCl2 → Zn → ZnO → Zn (NO 3) 2
25) AlCl3 → Al (NO 3) 3 → Al (OH) 3 → NaAlO 2 → A1C1 3 → Al
26) Pb (NO 3) 2 → Pb (OH) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbSO 4
27) Fe2 (SO4) 3 → FeCl3 → Fe (OH) 3 → FeOH (NO 3) 2 → Fe (NO 3) 3 → Fe 2 O 3
28) K → KOH → KHS04 → K2S04 → KCl → KNO3
29) Cu (OH) 2 → CuOHNO 3 → Cu (NO 3) 2 → CuSO 4 → CuCl2 → Cu (NO 3) 2
30) CaCl2 → Ca → Ca (OH) 2 → CaCl2 → Ca (NO 3) 2 → CaSO 4
31) Cu → Cu (NO 3) 2 → Cu (OH) 2 → CuSO 4 → Al 2 (SO 4) 3 → A1C1 3
32) Mg → MgS04 → MgCl2 → MgOHCl → Mg (OH) 2 → MgOHNO3
33) CuSO4 → CuCl2 → ZnCl2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2
34) Hg (NO3) 2 → Al (NO3) 3 → Al2O3 → NaAlO2 → Al (OH) 3 → AlOHCl2
35) ZnSO 4 → Zn (OH) 2 → ZnCl2 → AlCl3 → Al (OH) 3 → A1 2 O 3
36) CuCl2 → Cu (OH) 2 → CuSO 4 → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2
37) Fe (NO3) 3 → FeOH (NO3) 2 → Fe (OH) 3 → FeCl3 → Fe (NO 3) 3 → Fe
38) Al2O3 → AlCl3 → Al (OH) 3 → NaAlO2 → NaNO 3 → HNO 3
39) Mg (OH) 2 → MgS04 → MgCl2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
40) aliuminio sulfatas → aliuminio chloridas → aliuminio nitratas → aliuminio oksidas → kalio aliuminis → aliuminio hidroksidas → aliuminio hidroksidas → aliuminio chloridas.
41) Na → NaOH → Na3P04 → NaNO3 → HNO3 → N2O5
42) BaCO3 → Ba (HCO3) 2 → BaCO3 → (BaOH) 2CO3 → BaO → BaSO 4
43) Cu → CuSO 4 → (CuOH) 2SO4 → Cu (OH) 2 → Cu (HSO 4) 2 → CuSO 4
44) baris → bario hidroksidas → bario bikarbonatas → bario chloridas → bario karbonatas → bario chloridas → bario hidroksidas
45) P → P2O5 → H3P04 → Ca (H2P04) 2 → CaHPO 4 → Ca3 (PO 4) 2
46) Cr → CrO → Cr2O3 → NaCrO 2 → CrCl3 → Cr (OH) 3 → Cr 2 O 3 → Cr
47) Cr203 → CrCl3 → Cr (OH) 3 → Na3 → Cr2 (SO4) 3 → CrCl3
48) K → KOH → KCl → KOH → K 2 SO 4 → KNO 3 → KNO 2
49) S → FeS → H2S → SO2 → S → ZnS → ZnO → ZnCl2 → Zn (OH) 2 → K 2
50) C → CO 2 → CO → CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl2
51) С → CO 2 → NaHCO 3 → Na 2 CO 3 → CO 2
52) S → SO2 → K2SO3 → KHSO3 → K2SO3
53) Cu → Cu (OH) 2 → Cu (NO 3) 2 → CuO → Cu
54) Р 2 O 5 → Н 3 РО 4 → СаНРО 4 → Са (Н 2 РО 4) 2 → 3 (РО 4) 2
55) Fe → FeCl2 → Fe (OH) 2 → FeSO 4 → Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (NO 3) 2 → ZnO
57) CuS → SO 2 → KHSO 3 → CaSO 3 → SO 2
58) SO2 → H2S04 → CuSO 4 → CuO → Cu (NO 3) 2
59) KHS03 → CaSO3 → Ca (HSO 3) 2 → SO2 → K2SO4
60) SO2 → CaSO3 → SO2 → NaHS03 → SO2
61) NaHC03 → Na2C03 → NaCl → NaHS04 → Na2S04
62) K → KOH → KCl → KNO 3 → K2SO4 → KCl
63) NaCl → Na → NaOH → Na2S04 → NaCl
64) Al → AlCl3 → Al (OH) 3 → A1203 → Al (OH) 3
65) CuO → Cu → CuCl 2 → CuSO 4 → CuS
66) Fe → FeSO 4 → Fe (OH) 2 → Fe → Fe (OH) 3
67) Fe → Fe (OH) 2 → FeCl2 → Fe (NO 3) 2 → Fe
68) Fe (NO3) 3 → Fe203 → FeCl3 → Fe (NO 3) 3 → Fe
69) CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
70) MgCO3 → MgO → MgCl2 → Mg (OH) 2 → Mg (NO 3) 2
71) Mg → Mg (OH) 2 → MgSO 4 → MgCO 3 → Mg (HCO 3) 2
72) CaO → Ca (OH) 2 → CaCl2 → CaCO 3 → CO 2
73) CaCO 3 → Ca (HCO 3) 2 → CaCl2 → Ca (NO 3) 2 → O 2
74) FeS → Fe203 → Fe (OH) 3 → Fe2 (SO4) 3 → FeCl3
75) KS1 → K2S04 → KOH → K2CO3 → KOH
76) CuS → CuO → Cu (OH) 2 → CuSO 4 → Cu
77) Fe → Fe (OH) 3 → Fe (NO 3) 3 → FeCl3 → Fe2 (SO 4) 3
78) CuSO 4 → CuO → Cu (NO 3) 2 → CuO → CuS
79) ZnS → H2S → SO2 → Na2S04 → NaOH
80) Al → Al (OH) 3 → A12 (SO4) 3 → A1203 → Al (OH) 3
81) CaCl2 → CaCO3 → Ca (HCO3) 2 → CaCO 3 → CaSiO 3
82) S → ZnS → H2S → Ca (HSO 3) 2 → SO2
83) Na2S04 → NaCl → HCl → CaCl2 → Ca (NO 3) 2
84) Na2S03 → SO2 → H2S04 → HCl → FeCl2
85) С → Na2C03 → CaCO 3 → CaSiO 3 → H 2 SiO 3
86) P → P2O5 → Ca (H2P04) 2 → CaHPO 4 → H3P04
87) Al → A1 2 O 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
88) HCl → CuCl2 → Cl2 → HCl → H2
89) P205 → Na2HP04 → Na3P04 → Ca3 (PO 4) 2 → CaSO4
90) NH3 → NH4C1NH3H2O → NH4HCO3 → NH3
91) NH4C1 → KC1 → HCl → CuCl2 → Cu (OH) 2
92) NH3 → NH4H2P04 → (NH4) 2 HPO 4 → NH3 → NH4NO3
93) KOH → KHCO 3 → K 2 CO 3 → CO 2 → Ca (HCO 3) 2
94) Na → NaOH → NaHC03 → Na2S04 → NaOH
95) KNO 3 → K 2 SO 4 → KC1 → KNO 3 → KNO 2
96) Cl2 → KC1 → K2S04 → KNO 3 → KHS04
97) FeSO 4 → FeS → SO 2 → KHSO 3 → K 2 SO 4
98) KOH → Cu (OH) 2 → CuSO 4 → Cu (OH) 2 → Cu
99) Fe203 → FeCl3 → Fe (OH) 3 → Fe (NO3) 3 → Fe203
100) Al → A1 2 O 3 → A1 (NO 3) 3 → A1203 → Al (OH) 3
101) CaO → CaCO 3 → CaSiO 3 → Ca (NO 3) 2 → O 2
102) Cu → Cu (OH) 2 → Cu → CuSO 4 → CuCl2
103) H 2S → SO 2 → ZnSO 4 → ZnS → ZnO
104) Cl2 → NaCl → HCl → CuCl2 → CuO
105) Cl2 → FeCl3 → Fe203 → Fe (OH) 3 → Fe (NO3) 3
106) P205 → Ca3 (PO4) 2 → H3P04 → CaHPO4 → Ca (H2P04) 2
107) ZnS → ZnO → Zn → ZnCl2 → Zn (NO 3) 2
108) ZnO → ZnSO 4 → Zn (NO 3) 2 → ZnO → Zn (OH) 2
109) H3P04 → NH4H2P04 → (NH4) 2HPO4 → Na3P04 → Ca3 (PO 4) 2
110) CaCO3 → Na2C03 → Na3P04 → NaH2P04 → Ca3 (PO 4) 2
111) CaCl2 → CaSO 3 → Ca (OH) 2 → CaCl2 → Ca (NO 3) 2
112) NaOH → Na2C03 → NaHS04 → NaNO3 → NaHS04
113) Na 2 SiO 3 → Na2C03 → Na2S04 → NaCl → Na2S04
114) KNO 3 → KHS04 → K2S04 → KCl → Na2S04
115) SiO 2 → K 2 SiO 3 → H 2 SiO 3 → SiO 2 → CaSiO 3
116) Cu → CuCl2 → Cu (NO 3) 2 → NO 2 → HNO 3
117) Ca (NO 3) 2 → O 2 → SiO 2 → H 2 SiO 3 → SiO 2
118) P → H3P04 → Ca3 (PO4) 2 → CaHPO4 → Ca (H2P04) 2
119) CuSO 4 → Cu → CuS → CuO → CuCl 2
120) Al → A1 2 (SO 4) 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
121) S → SO3 → H2S04 → KHS04 → BaSO4
122) N2O5 → HNO3 → Cu (NO 3) 2 → CuO → Cu (OH) 2
123) Al → A1 2 O 3 → Al (OH) 3 → A1 2 (SO 4) 3 → A1 (NO 3) 3
124) Ca → Ca (OH) 2 → Ca (HCO3) 2 → CaO → CaCl2
125) NH3 × H2O → NH4C1NH3 → NH4HCO3 → (NH4) 2CO3
126) Cu (OH) 2 → H2O → HNO3 → Fe (NO 3) 3 → Fe
127) SO2 → Ca (HSO3) 2 → CaCl2 → Ca (OH) 2 → Ca (HCO 3) 2
128) NH3 2 H2O → NH4HCO3 → CaCO3 → CaSiO3 → CaCl2
129) CuSO 4 → Cu → CuO → Cu (OH) 2 → Cu
130) Fe (OH) 3 → Fe → FeCl3 → Fe (NO 3) 3 → Fe
131) Zn → Zn (OH) 2 → Na2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn
132) Zn → ZnO → Na2ZnO2 → Zn (OH) 2 → Na2 → ZnCl2
133) Zn → K 2 ZnO 2 → ZnSO 4 → K 2 → Zn (NO 3) 2 → ZnO
134) ZnO → Zn (OH) 2 → K2 ZnO2 → ZnSO 4 → ZnCl2 → ZnO
135) Zn → Na2 → Na2ZnO2 → Zn (NO 3) 2 → ZnO → Zn
136) Al → K3 → Al (OH) 3 → Na 3 → A1C1 3 → Al (OH) 3
137) Al 2 O 3 → KAO 2 → Al (OH) 3 → Al 2 O 3 → Na 3 → Al 2 O 3
138) Al (OH) 3 → A1 2 O 3 → K 3 → Al 2 (SO 4) 3 → A1 (NO 3) 3
139) A1C1 3 → K3 → Al (NO 3) 3 → NaAlO2 → Al2O3
140) Be → Na 2 → Be (OH) 2 → Na 2 BeO 2 → BaBeO 2
EKSPERIMENTINĖS PATIRTIES TYRIMAI „PAGRINDINĖS NEORGANINIŲ SAVYBIŲ KLASĖS“
PATIRTIS 1.Neutralizavimo reakcijos.
a) stiprios rūgšties ir stiprios bazės sąveika.
Į porceliano indą įpilkite 5 ml 2N druskos rūgšties tirpalo ir įlašinkite 2 n natrio hidroksido tirpalą. Tirpalą sumaišykite su stiklo lazdele ir išbandykite jo poveikį lakmusui, perkelkite tirpalo lašą į lakmuso testą. Būtina pasiekti neutralią reakciją (mėlynas ir raudonas lakmusinis popierius nekeičia spalvos). Gautas tirpalas išgarinamas iki sausumo. Kas buvo suformuota? Rašyti molekulinės ir joninės reakcijos lygtis.
b) Silpnos rūgšties ir stiprios bazės sąveika.
Į mėgintuvėlį įpilama 2 ml 2 N šarminio tirpalo ir įpilama acto rūgšties tirpalo, kol tirpalas yra neutralus. Rašyti molekulinės ir joninės reakcijos lygtis. Paaiškinkite, kodėl pusiausvyros jonų reakcija, kurioje dalyvauja silpnas elektrolitas (acto rūgštis), pereina prie vandens molekulių susidarymo.
PATIRTIS 2. Amfoteriniai hidroksidai.
Iš laboratorijoje prieinamų reagentų gauti cinko hidroksido nuosėdas. Sumaišykite gautas nuosėdas ir įpilkite nedidelį jo kiekį į 2 mėgintuvėlius. Viename iš mėgintuvėlių įpilama druskos rūgšties tirpalo, kitame - natrio hidroksido tirpalo (perteklius). Kas yra stebima? Rašykite atitinkamų reakcijų lygtis molekulinėje ir joninėje formoje.
PATIRTIS 3.Cheminės druskų savybės.
a) druskos tirpalų sąveika su mažai tirpios medžiagos susidarymu.
Į mėgintuvėlį įpilkite 2 ml natrio karbonato tirpalo ir pridėkite bario chlorido tirpalą, kol atsiras baltos nuosėdos. Parašykite cheminės reakcijos lygtį jonine ir molekuline forma. Nuosėdos suskirstytos į dvi dalis. Į vieną iš mėgintuvėlių įpilkite sieros rūgšties tirpalo ir į kitą įpilkite natrio hidroksido. Padarykite išvadą apie nuosėdų tirpumą rūgštyse ir šarmuose.
b) druskos tirpalo sąveika su rūgštimis, kad susidarytų lakus junginys.
Į mėgintuvėlį įpilkite 2 ml natrio karbonato tirpalo ir įpilkite nedidelį kiekį druskos rūgšties tirpalo. Kas yra stebima? Parašykite cheminės reakcijos lygtis jonine ir molekuline forma.
c) druskos tirpalų ir šarmų sąveika su lakiųjų junginių susidarymu.
Į mėgintuvėlį įpilkite truputį kai kurių amonio druskos tirpalo, įpilkite 1-2 ml natrio hidroksido tirpalo ir pašildykite. Bandymo mėgintuvėlyje su reakcijos mišiniu šlapias raudonas lakmuso testas. Kas yra stebima? Pateikite paaiškinimą. Parašykite reakcijos lygtis.
g ) Druskų sąveika su aktyvesniais metalais nei metalo, kuris yra druskos dalis.
Nuvalykite geležies (plieno) nagą švelniu šlifavimo popieriumi. Tada supilkite jį į vario sulfato tirpalą. Po kurio laiko stebėkite vario išsiskyrimą ant nago paviršiaus. Užrašykite atitinkamą reakcijos lygtį jonine ir molekuline forma.
PATIRTIS 4.Pagrindinių ir rūgštinių druskų gavimas.
a) Švino hidroksokarbonato paruošimas.
Į švino (II) acetato tirpalą įpilama šiek tiek švino (II) oksido ir keletą minučių virinama mišinys. Aušinamasis tirpalas nuleidžiamas iš nuosėdų ir per ją teka anglies dioksido srautas. Kas yra stebima? Filtruokite nuosėdas ir išdžiovinkite tarp filtravimo popieriaus lapų. Pažymėkite švino hidroksokarbonato nuosėdų spalvą ir pobūdį. Parašykite reakcijos lygtis. Sudarykite gautos druskos grafinę formulę.
b) Magnio bikarbonato paruošimas.
Į labai gerai atskiestą kai kurių magnio druskos tirpalą įpilkite šiek tiek natrio karbonato tirpalo. Kokia medžiaga nusėda? Sotintas tirpalas su nuosėdomis su anglies dioksidu. Stebėkite laipsnišką nuosėdų ištirpinimą. Kodėl taip vyksta? Parašykite reakcijos lygtis.
PATIRTIS 5.Sudėtingų druskų gavimas.
a) Sudėtinių katijonų junginių susidarymas.
Į mėgintuvėlį supilkite amoniako tirpalą 2-3 ml vario (II) chlorido tirpalo, kol susidaro vario (II) hidroksido nuosėdos, ir tada įpilkite amoniako tirpalo perteklių, kad ištirptų nuosėdos. Palyginkite Cu 2+ jonų spalvą su gauto tirpalo spalva. Kokie jonai yra tirpale? Parašykite reakcijos lygtį, kad gautumėte kompleksinį junginį.
b) Sudėtinių anijonų junginių susidarymas.
Į 1-2 ml gyvsidabrio (II) nitrato tirpalo pripilkite praskiesto kalio jodido tirpalo, kad susidarytų HgI 2 nuosėdos. Tada įpilkite kalio jodido tirpalo perteklių, kol nuosėdos ištirps. Parašykite kompleksinės druskos gavimo reakcijas.
PATIRTIS 6.Dvigubų druskų (kalio aliuminio) paruošimas.
Pasverkite 7,5 g Al 2 (SO 4) 3 ∙ 18H 2 O ir ištirpinkite 50 ml vandens, šiam tikslui naudodami pakankamai didelį porceliano patiekalą. Apskaičiuokite reakcijos lygtį ir pasverkite reakcijai reikalingą kalio sulfato masę. Paruoškite karštą prisotintą kalio sulfato tirpalą ir supilkite jį į porceliano indą su aliuminio sulfato tirpalu. Po kurio laiko stebėkite aliuminio kalio aliuminio kristalų nusodinimą. Atvėsinus ir kristalizavus, išpilkite motininį tirpalą, džiovinkite aliuminio kristalus tarp filtravimo popieriaus lapų ir pasverkite gautus kristalus. Apskaičiuokite derlingumo procentą.
NUSTATYMO UŽDAVINIAI
1. Per 16 g vario (II) sulfato tirpalo pripildant vandenilio sulfido perteklių, gauta 1,92 g nuosėdų. Raskite vario sulfato masės dalį naudojamame tirpale ir sunaudoto vandenilio sulfido tūrį.
2. Visam vario nusodinimui sulfido pavidalu iš 291 cm3 vario (II) sulfato tirpalo su 10% masės frakcija buvo panaudota dujos, gautos reaguojant 17,6 g geležies (II) sulfido su druskos rūgšties pertekliumi. Rasti pirminio vario sulfato tirpalo tankį.
3. Dujos, išleistos K 2 S tirpalo sąveikos metu su praskiesta sieros rūgštimi, perleidžiamos per daug švino (II) nitrato tirpalo. Susidariusių nuosėdų masė yra 71,7 g. Suraskite reaguojamo sieros rūgšties tirpalo tūrį, jei jo tankis yra 1,176 g / cm3, o masės dalis yra 25%.
4. Į tirpalą, turintį 8 g vario (II) sulfato, buvo pridėtas 4,68 g natrio sulfido tirpalas. Nuosėdos nufiltruotos, filtratas išgarinamas. Po garavimo nustatoma filtrate esančių medžiagų masė ir vario sulfido nuosėdų masė.
5. Geležies (II) sulfido dalis buvo apdorota druskos rūgšties pertekliumi. Gautos dujos reakcijoje su 12,5 cm3 NaOH tirpalu, kurio masės dalis yra 25% ir tankis 1,28 g / cm3, sudarė rūgšties druską. Rasti pradinio geležies sulfido masę.
6. Geležies (II) sulfidas, sveriantis 176 g, buvo apdorotas druskos rūgšties pertekliumi, ir susidariusios dujos buvo sudegintos perteklius. Kokio kiekio KOH tirpalo, kurio masės dalis yra 40% ir tankis 1,4 g / cm 3, reikia visiškai deginti susidarančioms dujoms neutralizuoti?
7. Skrudinant 100 g techninio pirito, jie gavo dujas, kurios visiškai neutralizuotos 400 cm3 NaOH tirpalu, kurio masės dalis buvo 25% ir tankis 1,28 g / cm3. Nustatykite priemaišų masės dalį pirituose.
8. Į 2 g geležies, geležies oksido (II) ir geležies oksido (III) mišinio buvo pridėta 16 cm3 HC1 tirpalo, kurio masės dalis yra 20% ir tankis 1,09 g / cm3. Siekiant neutralizuoti rūgšties perteklių, jis paėmė 10,8 cm3 NaOH tirpalo, kurio masės dalis buvo 10% tankio 1,05 g / cm3. Jei išleistos vandenilio tūris yra 224 cm3 (NU), suraskite mišinyje esančių medžiagų masę.
9. Mišinys yra Ca (OH) 2, CaCO3 ir BaSO 4, kurio masė yra 10,5 g. Kai mišinys buvo apdorotas vandenilio chlorido rūgšties pertekliumi, 672 cm3 (TV) buvo išleista ir 71,2 g rūgšties reagavo su masė 10%. Nustatykite mišinyje esančių medžiagų masę.
10. Yra bario chlorido, kalcio karbonato ir natrio bikarbonato mišinys. Kai 10 g šio mišinio ištirpinama vandenyje, netirpūs likučiai yra lygūs 3,5 g Kalkinant 20 g pradinio mišinio, jo masė sumažėja 5,2 g Rasti pradinių mišinių medžiagų masės dalis.
11. Yra tirpalas, kuriame yra ir sieros, ir azoto rūgščių. Norint visiškai neutralizuoti 10 g šio tirpalo, 12,5 cm3 KOH tirpalo suvartojama 19% masės ir 1,18 g / cm 3 tankio. Kai į 20 g to paties rūgšties tirpalo mišinio pridedama bario chlorido perteklių, iškrenta 4,66 g nuosėdų. Raskite mišinyje esančių rūgščių masės dalis.
12. Visas vandenilio chloridas, gautas iš 100 g KC1 ir KNO3 mišinio, buvo ištirpintas 71,8 cm3 vandens. Skaičiuojant 100 g to paties druskų mišinio, lieka 93,6 g kietos liekanos. Rasti vandenilio chlorido masės dalį vandenyje.
13. Į Ca (OH) 2 tirpalą perpylus 2 m 3 oro (NU), gauta 3 g anglies rūgšties druskos nuosėdų. Suraskite CO 2 kiekį ir masės dalį ore.
14. Anglies dioksidas patenka per suspensiją, kurioje yra 50 g CaCO 3. Reakcija įvyko 8,96 dm 3 dujų (NU). Kokia yra masė CaCO 3 paliekama kietoje fazėje?
15. Įpilant vandenį į CaO, jo masė padidėjo 30%. Kokia CaO dalis (masės%) buvo išnykusi?
16. Švinas (II) oksidas, sveriantis 18,47 g, kaitinamas vandenilio sraute. Po reakcijos susidariusio švino ir nereaguoto oksido masė buvo 18,07 g. Kokia nereagavusio švino oksido masė?
17. Šildant anglies monoksidas patenka per geležies (III) oksidą. Kietos liekanos masė po reakcijos yra 2 g mažesnė už pradinę geležies oksido masę. Kokio CO kiekio buvo reakcija (ar oksidas yra visiškai sumažintas)?
18. Yra 8,96 dm 3 (NU) N 2, CO 2 ir SO 2 mišinio su santykiniu vandenilio tankiu 25. Praplaukus per KOH tirpalo perteklių, mišinio tūris sumažėjo 4 kartus. Raskite dujų kiekį originaliame mišinyje.
19. Dviejuose stikluose yra 100 g HC1 tirpalo, kurio masės dalis yra 2,5%. Viename stiklyje pridėta 10 g CaCO3, kitame - 8,4 g MgCO3. Kaip po reakcijos bus akinių masė?
20. Kokį sieros dioksido tūrį (NU) reikia pernešti per 200 cm3 tirpalo su 0,1% masės NaOH ir 1 g / cm3 tankiu, kad gautumėte rūgšties druską?
21. Koks yra didžiausias anglies dioksido kiekis (anglies dioksidas) gali sugerti 25 cm3 tirpalo su 25% NaOH frakcija ir 1,1 g / cm3 tankiu?
22. Koks yra minimalus tirpalo tūris, kurio masės dalis yra 20% KOH ir tankis 1,19 g / cm3, kuris gali sugerti visą susidariusį anglies dioksidą, visiškai sumažinant 23,2 g magnetito su anglies monoksidu?
23. Kokia yra minimali KOH masė, su kuria turi būti reaguojama su 24,5 g ortofosforo rūgšties, kad produktas būtų tik kalio dihidrofosfatas?
24. Kokia yra minimali Ca (OH) 2 masė, kad į 16 g kalcio bikarbonato tirpalo būtų pridėta 5% druskos masės dalis, kad būtų gauta vidutinė druska?
25. Kokia kalio hidrofosfato masė turėtų būti pridėta į tirpalą, kuriame yra 12,25 g H 3 PO 4, kad po to tirpalas turi tik kalio dihidrofosfatą?
26. Tirpalas susideda iš 56,1 g kalcio ir magnio karbonatų mišinio. Norint juos paversti angliavandeniliais, jie išleido visą anglies dioksidą, susidarantį deginant 7 dm 3 (NU) etaną. Raskite kalcio karbonato masę pradiniame mišinyje.
27. Norint konvertuoti 9,5 g natrio hidro- ir dihidrofosfato mišinio į vidutinę druską, reikia 10 cm3 tirpalo su 27,7% NaOH masės frakcija ir 1,3 g / cm3 tankiu. Rasti vandenilio fosfato masę mišinyje.
28. Išmetus anglies dioksidą per tirpalą, kuriame yra 6 g NaOH, gautas 9,5 g rūgšties ir vidutinės druskos mišinio. Suraskite suvartoto anglies dioksido kiekį.
29. Pasiekus 11,2 dm 3 (NU) CO 2 per KOH tirpalą, gauta 57,6 g rūgščių ir vidutinių druskų mišinio. Rasti vidutinės druskos masę.
30. Kokia ortofosforo rūgšties masė turi būti neutralizuota, kad gautų 1,2 g dihidro ir 4,26 g natrio vandenilio fosfato?
31. Į sieros rūgšties tirpalą pridėta NaOH, gaunant 3,6 g hidrosulfato ir 2,84 g natrio sulfato. Nustatykite reaguojančios rūgšties ir šarmų chemines sumas.
32. Išmetus vandenilio chloridą per 200 cm3 NaOH tirpalo, kurio masės dalis buvo 10% ir tankis 1,1 g / cm3, NaOH masės dalis gautame tirpale sumažėjo perpus. Nustatoma NaCl masės dalis gautame tirpale.
33. 14,4 g vario ir jo oksido (II) mišinio ištirpinimas sunaudojo 48,5 g tirpalo, kurio HNO 3 masės dalis buvo 80%. Rasti vario ir oksido masės frakcijas pradiniame mišinyje.
34. Natrio oksido masė 6,2 g ištirpinama 100 cm3 vandens ir gautas tirpalas Nr. 1. Po to į tirpalą įdėta druskos rūgšties, kurios masės dalis buvo 10%, kol terpė tapo neutrali, ir gautas tirpalas Nr. :
1) medžiagų, esančių tirpaluose Nr. 1, 2, masės frakcijos;
2) HC1 tirpalo masė, kuri buvo skirta neutralizuoti tirpalo numerį 1.
35. 3 g cinko sąveikauja su 18,69 cm3 HC1 tirpalu, kurio masės dalis yra 14,6% ir tankis 1,07 g / cm3. Kai šildoma, susidariusi dujos patenka per karštą CuO, sveriančią 4 g. Kokia yra vario masė?
36. Dujos, išleistos apdorojus kalcio hidridą su pertekliniu vandeniu, praleistos per FeO. Dėl to oksido masė sumažėjo 8 g. Suraskite vandeniu apdorotą CaH 2 masę.
37. Kalcinuojant CaCO 3 mėginį, jo masė sumažėjo 35,2%. Kietosios reakcijos produktai buvo ištirpinti druskos rūgšties pertekliui, kad gautų 0,112 dm 3 (NU) dujų. Nustatykite pradinio kalcio karbonato mėginio masę.
38. Vario nitratas buvo suskaidytas ir gautas vario (II) oksidas buvo visiškai sumažintas vandeniliu. Gauti produktai patenka per mėgintuvėlį P 2 O 5, o po to mėgintuvėlio masė padidėjo 3,6 g. Koks yra mažiausias sieros rūgšties tūris, kurio masės dalis yra 88% ir tankis 1,87 g / cm3, reikalingas bandymui gauti vario ir kokia yra suskaldytos druskos masė?
39. Absorbavus azoto oksidą (IV) pertekliu KOH tirpalo šaltoje vietoje be deguonies, gauta 40,4 g KNO3. Kokia medžiaga dar susidaro ir kokia yra jo masė?
40. Neutralizuoti 400 g tirpalo, kuriame yra druskos ir druskos sieros rūgšties, sunaudojo 287 cm3 natrio hidroksido tirpalo, kurio masės dalis buvo 10%, o tankis - 1,115 g / cm3. Jei į 100 g pradinio tirpalo pridedama perteklinio bario chlorido tirpalo, iškrenta 5,825 g nuosėdų. Nustatykite rūgščių masės frakcijas pradiniame tirpale.
41. Išmetus anglies dioksidą per natrio hidroksido tirpalą, gauta 13,7 g terpės ir rūgšties druskų mišinio. Norint juos paversti natrio chloridu, reikia 75 g druskos rūgšties, kurios masės dalis yra 10% HCl. Suraskite absorbuoto anglies dioksido kiekį.
42. Vandenilio chlorido ir sieros rūgščių mišinys, kurio bendra masė yra 600 g tirpalo su tokiomis pačiomis rūgščių frakcijomis, buvo apdorotas natrio bikarbonato pertekliumi ir gauta 32,1 dm 3 dujų (N °). Rasti pradinę mišinio rūgščių masės dalį.
43. Neutralizuojant 1 dm 3 NaOH tirpalo, 66,66 cm3 HNO3 tirpalo buvo suvartota 63% masės dalimi ir 1,5 g / cm3 tankiu. Kokio kiekio sieros rūgšties tirpalo, kurio masės dalis yra 24,5%, ir tankio 1,2 g / cm 3, reikia neutralizuoti tą patį kiekį šarmų?
44. Kokiu santykiu turėtų būti tiriamas sieros rūgšties tirpalas, kurio masės dalis yra 5%, o tankis - 1,03 g / cm3, ir bario hidroksido tirpalas, kurio masės dalis yra 5%, o tankis - 1,1 g / cm 3? Įsivaizduokite atsakymą kaip šarminio tirpalo tūrio santykį su rūgšties tirpalu.
45. Apskaičiuokite mažiausią amoniako tirpalo tūrį, kurio tankis yra 0,9 g / cm 3, o masės dalis - 25%, reikalingą visiškam anglies dioksido absorbcijai, gaunamam skaidant 0,5 kg natūralaus kalkakmenio, kurio kalcio karbonato masės dalis yra lygi 92%.
46. Norint visiškai pakeisti 2,92 g natrio hidroksido ir natrio karbonato mišinio į chloridą, reikalingas 1,344 dm 3 vandenilio chlorido (NU). Suraskite natrio karbonato masę mišinyje.
47. Į 25 g vario (II) sulfato tirpalo su 16% masės frakcija buvo pridėta 16% natrio hidroksido tirpalo. Susidariusios nuosėdos filtruojamos, po to filtratas buvo šarminis. Siekiant visiškai neutralizuoti filtratą, jis paėmė 25 cm3 sieros rūgšties tirpalo, kurio molinė koncentracija buvo 0,1 mol / dm3. Apskaičiuokite pridėto natrio hidroksido tirpalo masę.
48. Medžiaga, gaunama visiškai redukuojant CuO, kurio masė yra 15,8 g vandenilio ir 11,2 dm 3 (NU), buvo ištirpinama kaitinant koncentruotoje sieros rūgštyje. Koks yra dujų kiekis (NU), išleistas dėl reakcijos?
49. Siekiant visiškai neutralizuoti 50 cm3 druskos rūgšties 20% masės HCl ir 1,10 g / cm3 tankio, buvo naudojamas kalio hidroksido tirpalas, kurio masės dalis yra 20%. Koks yra cheminis vandens kiekis, esantis gautame tirpale?
50. Dujos, gautos perduodant CO 2 pertekliui per 0,84 g karšto anglies, siunčiamos į reakciją su 14,0 g kaitinamo vario (II) oksido. Kokio tūrio azoto rūgšties tirpalo, kurio masės dalis sudaro 63%, ir tankio 1,4 g / cm3 tūris, kad būtų visiškai ištirpinta paskutinėje reakcijoje gauta medžiaga?
51. Kalcinuojant pagal pastovią vario (II) nitrato masę, druskos svoris sumažėjo 6,5 g.
52. Kai buvo naudojamas druskos rūgšties perteklius, aliuminio mišinyje su nežinomu monovalentiniu metalu išleista 6,72 dm 3 (NW) dujų ir mišinio masė sumažėjo perpus. Apdorojant liekaną praskiesta azoto rūgštimi, išsiskyrė 0,373 dm 3 (NU) NO. Nustatykite nežinomą metalą.
53. Kreidinio mėginio masė yra 105 g, o jo sudėtyje esantis deguonies elemento cheminis kiekis yra 1 mol. Nustatykite CaCO 3 masės dalį kreidos mėginyje (deguonis įtraukiamas tik į kalcio karbonato sudėtį).
54. Sieros oksido (VI) sąveika su vandeniu gautas tirpalas, kurio sieros rūgšties frakcija sudarė 25%. Kai prie šio tirpalo pridedamas Ba (OH) 2 perteklius, susidarė 29,13 g sveriančios nuosėdos.Kokios SO3 ir H2O masės buvo panaudotos rūgšties tirpalo susidarymui?
55. Kai SO2 per 200 g tirpalo, kuriame yra 16% NaOH masės dalis, susidaro druskų mišinys, įskaitant 41,6 g rūgšties druskos. Kokia sieros masė, turinti 4,5% priemaišų, buvo naudojama SO 2? Kas yra vidutinės druskos svoris?
56. Sąveika su 80 g Ca (NO 3) 2 tirpalo užtruko 50 g Na2C03 tirpalo. Nuosėdos buvo atskirtos, o apdorojant jį druskos rūgšties pertekliumi, išleista 2,24 dm 3 (NU) dujų. Kokios yra druskų frakcijos pradiniuose tirpaluose? Kokia yra natrio nitrato masės dalis tirpale po atskyrimo nuo nuosėdų?
57. Kai cinkas sąveikauja su sieros rūgštimi, susidaro 10 dm 3 (NU) SO2 ir H2S mišinio, turinčio santykinį argono tankį 1,51. Koks yra ištirpinto cinko kiekis? Kokia yra SO 2 masės dalis dujų mišinyje?
58. Cinko ir aliuminio pjuvenų mišinio, kurio bendra masė yra 11 g, mėginys buvo ištirpintas šarminiame tirpale. Jei cinko masės dalis mišinyje yra 30%, nustatykite išleistų dujų tūrį (NU).
59. Natrio hidroksidas, sveriantis 4,0 g, buvo legiruotas aliuminio hidroksidu, sveriančiu 9,8 g, apskaičiuokite gauto natrio metaaluminato masę.
60. Apdorojant 10 g vario ir aliuminio mišinio su koncentruota azoto rūgštimi kambario temperatūros išleido 2,44 dm 3 dujų (NU). Kokį dujų kiekį (NU) išleis, kai apdorojama ta pati mišinio masė su KOH tirpalo pertekliumi?
61. Vario ir aliuminio lydinys, sveriantis 20 g, buvo apdorotas šarminiu tirpalu, netirpi liekana ištirpinama koncentruotoje azoto rūgštyje. Gauta druska buvo išskirta, kalcinuota iki pastovios masės ir gauta 8 g kietos liekanos. Nustatomas panaudoto NaOH tirpalo tūris, kurio masės dalis yra 40% ir tankis - 1,4 g / cm 3).
62. Aliuminio ir metalo oksido (II) (ne-amfoterinio oksido), sveriančio 39 g, mišinys buvo apdorotas pertekliu KOH tirpalo, išmetama dujos, kad gautų 27 g vandens. Neištirpusi liekana buvo visiškai ištirpinta 25,2 cm3 tirpale, kurio HC1 masės dalis buvo 36,5% ir tankis 1,19 g / cm3). Nustatykite oksidą.
63. Cinko ir vario drožlių mišinys buvo apdorotas pertekliu KOH tirpalo, o išmetama 2,24 dm 3 (NU). Visam to paties metalo mėginio chloravimui reikėjo 8,96 dm 3 (NU) chloro. Apskaičiuokite cinko masės dalį mėginyje.
64. Geležies, aliuminio ir magnio pjuvenų mišinys, kurio masė yra 49 g, buvo apdorotas pertekliu praskiestu H2S04, taip gaunant 1,95 molio dujų. Kita to paties mišinio, sveriančio 4,9 g, dalis buvo apdorota šarminio tirpalo pertekliumi, gauta 1,68 dm 3 (NU) dujų. Suraskite mišinyje esančių metalų masę.
65. Kokia yra nuosėdų, susidarančių sujungiant tirpalus, kuriuose yra 10 g NaOH ir 13,6 g ZnCl2, masę?
66. Yra dvi Al, Mg, Fe, Zn mišinio dalys, tokios pačios molinės kompozicijos, kurių kiekvienas sveria 7,4 g. Viena dalis ištirpinama druskos rūgštyje ir gauta 3,584 dm 3 dujų (NU), kita - šarminiame tirpale ir Gauta 2,016 dm 3 dujų (NU). Yra žinoma, kad abiejuose mišiniuose yra 3 Zn atomai A1 atomui. Suraskite mišinyje esančių metalų masę.
67. Vario, magnio ir aliuminio mišinys, sveriantis 1 g, buvo apdorotas druskos rūgšties pertekliumi. Tirpalas nufiltruojamas, į filtratą pridedama NaOH tirpalo perteklių. Nuosėdos buvo atskirtos ir kalcinuotos iki pastovios 0,2 g masės, po to, kai apdorojus vandenilio chlorido rūgštimi, neištirpinta liekana, buvo kalcinuota ore ir gauta 0,8 g juodos medžiagos. Raskite aliuminio masės dalį mišinyje.
68. Kai cinko, magnio ir vario deguonies lydinio srovėje kaitinama, mišinio masė padidėjo 9,6 g. Produktas iš dalies ištirpinamas šarminėje medžiagoje, o ištirpinimui reikia 40 cm3 tirpalo, kurio masės dalis yra 40% ir tankis 1,4 g / cm. 3 Reakcijai su ta pačia lydinio dalimi reikia 0,7 molio HC1. Rasti cheminius metalų kiekius lydinyje.
69. Vario ir cinko lydinys, sveriantis 5 g, buvo apdorotas per dideliu NaOH tirpalu. Tada kieta liekana atskirta ir apdorojama koncentruota HNO3, taip gauta druska buvo išskirta, kalcinuota iki pastovios masės ir gaunama 2,5 g kietos liekanos. Nustatykite metalų masę lydinyje.
70. Vario ir aliuminio lydinys, sveriantis 12,8 g, buvo apdorotas druskos rūgšties pertekliumi. Neištirpinta liekana ištirpinama koncentruotoje azoto rūgštyje, gautas tirpalas išgarinamas, sausa liekana buvo kalcinuota iki pastovios masės ir gaunama 4 g kietos medžiagos. Nustatykite vario masės dalį lydinyje.
71. Kokios masės santykis turėtų būti paimtas iš dviejų A1 dalių, kad, kai pridėta prie šarmo tirpalo, o kitas - į vienodą vandenilio kiekį, jis patenka į vandenilio chlorido rūgštį?
72. Apdorojant aliuminio ir vario (II) oksido mišinį su KOH tirpalo pertekliumi, išsiskyrė 6,72 dm 3 (NU) dujų ir ištirpinant tą pačią mišinio dalį koncentruotame HNO 3 kambario temperatūroje gauta 75,2 g druskos. Rasti pradinio medžiagų mišinio masę.
73. Kokia vario (II) oksido masė gali būti atkurta vandeniliu, gaunamu reaguojant perteklių aliuminio su 139,87 cm3 tirpalu su 40% NaOH ir tankiu 1,43 g / cm3?
74. Visiškai oksidavus 7,83 g dviejų metalų lydinio, susidarė 14,23 g oksidų, kurių apdorojimo metu likučių perteklius liko neištirpus 4,03 g nuosėdų. Nustatykite metalą sudarančių metalų kokybinę sudėtį, jei jų katijonai turi oksidacijos būseną +2 ir +3, o oksidų molinis santykis yra 1: 1 (daroma prielaida, kad metalų oksidas su oksidacijos būsena +3 turi amfoterines savybes).
75. Ištirpintos dvi tos pačios masės aliuminio porcijos: viena kalio hidroksido tirpale, kita - druskos rūgštyje. Kaip išsivysčiusių dujų kiekiai (nos) yra tarpusavyje susiję?
76. Vario lydinys su aliuminiu, sveriančiu 1000 g, buvo apdorotas šarminio tirpalo pertekliumi, neištirpintos nuosėdos ištirpintos azoto rūgštyje, tada tirpalas išgarinamas, liekana buvo kalcinuota iki pastovaus svorio. Naujos liekanos masė yra 0,398 g. Kokia yra metalų masė lydinyje?
77. Cinko ir vario lydinys, sveriantis 20 g, buvo apdorotas pertekliu NaOH tirpalu, kurio masės dalis buvo 30% ir tankis 1,33 g / cm3. Kieta liekana buvo išskirta ir apdorojama koncentruoto HNO 3 tirpalo pertekliumi. Šio proceso metu susidariusi druska buvo izoliuota ir kalcinuota iki pastovios masės. Kietosios liekanos masė buvo 10,016 g. Apskaičiuokite metalų masės dalis lydinyje ir sunaudoto šarminio tirpalo tūrį.
78. Vario ir aliuminio lydinys, sveriantis 2 g, buvo apdorotas šarminio tirpalo pertekliumi. Liekana nufiltruojama, plaunama, ištirpinama HNO3, tirpalas išgarinamas ir kalcinuotas iki pastovaus svorio. Likučio masė po kalcinavimo buvo 0,736 g. Apskaičiuokite metalų masės dalis lydinyje.
79. Geležies, vario ir aliuminio mišinio chloravimui reikia 8,96 dm 3 chloro (NU), o to paties mėginio sąveika su vandenilio chloridu reikalauja 5,6 dm 3 (NU). Kai sąveikauja su ta pačia metalo mišinio su šarmu mase, išsiskiria 1,68 dm 3 (NU) dujų. Rasti cheminius metalų kiekius mišinyje.
80. Kalio hidridas, sveriantis 5,0 g, ištirpinamas vandenyje, kurio tūris 80 cm3, ir gautas tirpalas pridedamas 0,81 g sveriantis aliuminis, kurio metu gautų tirpalų medžiagų masės frakcijos yra iki tūkstančio procentų tikslumo.
LITERATŪROS SĄRAŠAS
1. Barannik, V.P. Šiuolaikinė Rusijos neorganinių junginių nomenklatūra / V.P. Barannik // Visuotinės chemijos draugijos leidinys. D.I. Mendeljevas. - 1983. - XXVIII tomas. - 9–16 psl.
2. Wroblewski, A.I. Chemijos simuliatorius / A.I. Wroblewski. - 2 red., Pererab. ir pridėkite. - Minskas: Krasiko-Print, 2007. - 624 p.
3. Glinka, N.L. Bendrosios chemijos užduotys ir pratybos: studijos. universitetų vadovas / red. V.A. Rabinovičius ir H.M. Rubina. - M .: Integral-Press, 2004. - 240 p.
4. Lidin, R.A. Bendrosios užduotys ir neorganinė chemija: tyrimai. aukštesnio lygio mokiniams. tyrimus. institucijos / R.A. Lidin, V.A. Milk, L.L. Andreeva; pateikė ed. R.A. Lidina. - M .: VLADOS, 2004. - 383 p.
5. Lidin, R.A. Neorganinių medžiagų nomenklatūros pagrindai / R.A. Lidin [et al.]; pateikė ed. B.D. Stepina. - M .: Chemistry, 1983 - 112 p.
6. Stepinas, B.D. IUPAC taisyklių taikymas neorganinių junginių nomenklatūrai rusų / B.D. Stepin, R.A. Lidin // Visuotinės chemijos draugijos leidinys. D.I. Mendeljevas. - 1983. - XXVIII tomas. - 17–20 psl.
| Įvadas …………………………………………………………………… Bendrosios taisyklės neorganinių medžiagų diapazonui ………… .. Oksidai ………………………………… ……………………………… Pagrindiniai oksidai ………………………………………………………… ... Rūgštiniai oksidai ………………………………… ………………………. Amfoteriniai oksidai ……………………………………………………… .. Oksidų gavimas ………………………………………………………… Tema „Oksidai“ …………………………………………………………. Rūgštys ……………………………………………………………………. Pratimai savarankiškam darbui tema „Rūgštys“ ………………………………………………………… Pagrindai …………………………………………………… ……… .. Pratimai savarankiškam darbui tema „Pamatai“ ………………………………………………………. Druskos …………………………………………………………………………. Pratimai savarankiškam darbui temoje „Druskos“ .......................................................... Neorganinių junginių klasių genetinis ryšys ......................................... …………… .. Pratimai savarankiškam darbui tema „Neorganinių junginių klasių genetinis ryšys“ ……………………………………………… Eksperimentiniai eksperimentai tema „Pagrindinės neorganinių junginių klasės …………… ……… .. Atsiskaitymo užduotys …………………………………………………………… Nuorodos ………………………… |
švietimo: nustatyti „genetinės serijos“, „genetinio ryšio“ sąvoką; išmokyti, kaip sukurti genetinių elementų seriją (metalus ir ne metalus), kad būtų sudarytos genetinės serijos reakcijos lygtys; patikrinti, kaip žinomos oksidų, rūgščių, druskų, bazių cheminės savybės;
plėtoti: plėtoti gebėjimą analizuoti, palyginti, apibendrinti ir padaryti išvadas, sudaryti cheminių reakcijų lygtis;
švietimo : skatinti mokslo pasaulėžiūrą.
2. Klasių teikimas: lentelės „Periodinė sistema“, „Tirpumo lentelė“, „Metalo veiklos serija“, nurodymai studentams, užduotys žinioms išbandyti.
3. Veikimo tvarka:
3.1. Priekinė apklausa.
3.2. Užduočių sprendimas.
3.3. Atlikite parinkčių tikrinimo darbus.
4. Ataskaitų išdėstymas:
4.1. Parašykite praktinės pamokos temą ir tikslus.
4.2. Įrašykite problemų sprendimą.
4.3. Išspręskite savarankiško darbo versiją, sprendimą rašyti nešiojamojoje knygoje ir perduoti mokytojui peržiūrėti.
Darbo pažanga
1. Priekinis pokalbis apie:
Kas yra genetinis ryšys?
Genetiniai ryšiai - tai yra ryšiai tarp skirtingų klasių, remiantis jų tarpusavio konversijomis.
Kas yra genetinė serija?
Genetinė eilutė - medžiagų serija - įvairių klasių atstovai, kurie yra vieno cheminio elemento junginiai, sujungti tarpusavyje ir atspindintys šių medžiagų transformacijas. Šių serijų pagrindas yra tas pats elementas.
Kokios rūšies genetinės serijos paprastai skiriamos?
Tarp metalų yra dviejų tipų eilutės:
a) genetinė serija, kurioje šarmai veikia kaip pagrindas. Šią seriją galima atvaizduoti naudojant šias transformacijas:
metalo → bazinio oksido → šarmų → druska
pvz., kalio K → K 2 O → KOH → KCl genetinė serija
b) genetinė serija, kurioje bazė yra netirpi bazė, tada serija gali būti pavaizduota kaip transformacijų grandinė:
metalas → bazinis oksidas → druska → netirpus pagrindas → bazinis oksidas → metalas
pavyzdžiui: Cu → CuO → CuCl 2 → Cu (OH) 2 → CuO → Cu
Tarp nemetalų taip pat galima išskirti dviejų tipų eilutes:
a) Ne metalo genetinė serija, kurioje tirpios rūgšties veikia kaip jungtis serijoje. Transformacijų grandinę galima pavaizduoti taip: ne metalo → rūgšties oksidas → tirpus rūgštis → druska.
Pavyzdžiui: P → P2O5 → H3P04 → Na3P04
b) Genetinė nemetalų eilutė, kurioje netirpi rūgštis: ne metalas → rūgšties oksidas → druska → rūgštis → rūgšties oksidas → ne metalas veikia kaip jungtis serijoje
Pavyzdžiui: Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Užduočių vykdymas parinktims:
| 1 galimybė | 2 galimybė |
|
Galiu pasirinkti: ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2
II variantas: Na2S04, NaOH, Na, Na2O2, Na2O
Namų darbas: aprašyti laipsnišką perėjimą iš kalcio į kalcio karbonatą ir parengti ataskaitą apie bet kurios druskos vartojimą medicinoje (naudojant papildomą literatūrą).
Praktinės pamokos instrukcija
Genetinis ryšys tarp pagrindinių neorganinių medžiagų klasių.
Tikslai: nustatyti „genetinės serijos“, „genetinio ryšio“ sąvoką; išmokti sukurti genetinių elementų seriją (metalus ir ne metalus), kad būtų sudarytos genetinės serijos reakcijos lygtys; pakartokite oksidų, rūgščių, druskų, bazių savybes.
Darbo pažanga
Užrašykite sąvokų apibrėžimus:
Genetiniai santykiai - __________________________________________
Genetinė eilutė - ___________________________________________
Genetinė metalų serija, kurioje šarmai veikia kaip pagrindas. gali būti atstovaujama apskritai: metalas → bazinis oksidas → šarmas → druska. Padarykite šią seriją naudodami kalį. Parašykite reakcijų lygtis, kurių pagalba galite atlikti šią transformacijų grandinę.
Genetinė nemetalų serija, kurioje tirpios rūgšties veikia kaip jungtis serijoje gali būti pavaizduota taip: ne metalo → rūgšties oksidas → tirpus rūgštis → druska. Padarykite šią seriją naudodami fosforą. Parašykite reakcijų lygtis, kurių pagalba galite atlikti šią transformacijų grandinę.
Genetinė eilutė, kurioje bazė yra netirpi bazė gali būti pavaizduota transformacijų grandine: metalas → bazinis oksidas → druska → netirpi bazė → bazinis oksidas → metalas. Sukurkite šią seriją naudodami varį. Parašykite reakcijų lygtis, kurių pagalba galite atlikti šią transformacijų grandinę.
Genetinė nemetalų serija, kurioje netirpi rūgštis veikia kaip serijos jungtis gali būti pavaizduota transformacijų grandine: ne metalas → rūgšties oksidas → druska → rūgštis → rūgšties oksidas → ne metalas. Sukurkite šią seriją naudodami silicį. Parašykite reakcijų lygtis, kurių pagalba galite atlikti šią transformacijų grandinę.
Atlikite parinkčių užduotis:
| 1 galimybė | 2 galimybė |
|
1. Savo versijoje pasirinkite oksido formulę, paaiškinkite savo pasirinkimą, remiantis žiniomis apie šios klasės junginių sudėties savybes. Skambinkite jiems.
2. Savo varianto formulės stulpelyje raskite rūgščių formules ir paaiškinkite savo pasirinkimą, remiantis šių junginių sudėties analize.
3. Nustatykite rūgščių liekanų valios rūgšties kompozicijoje.
4. Pasirinkite druskos formules ir pavadinkite jas.
5. Užpildykite druskų, kurios gali būti susidariusios su magnio ir jūsų varianto rūgštimis, formules. Užrašykite juos, pavadinkite.
6. Savo variacijos formulės stulpelyje raskite pagrindines formules ir paaiškinkite savo pasirinkimą, remiantis šių junginių sudėties analize.
7. Savo variante pasirinkite medžiagų, su kuriomis gali reaguoti ortofosforo rūgšties (druskos, sieros) tirpalas, formules. Atlikite tinkamas reakcijos lygtis.
9. Tarp jūsų pasirinkimo formulių pasirinkite medžiagų, kurios gali sąveikauti tarpusavyje, formules. Atlikite tinkamas reakcijos lygtis.
10. Sukurkite neorganinių junginių genetinių ryšių grandinę, į kurią bus įtraukta medžiaga, kurios formulė pateikta jūsų versijoje pirmajame.
Iš šių medžiagų sukurkite genetinę liniją, naudojant visas formules. Parašykite reakcijos lygtis, su kuriomis galite atlikti šią transformacijų grandinę:
I parinktis: ZnSO4, Zn, ZnO, Zn, Zn (OH) 2
IIparinktis: Na2S04, NaOH, Na, Na2O2, Na2O
Namų darbas: aprašyti laipsnišką perėjimą iš kalcio į kalcio karbonatą ir parengti ataskaitą apie bet kurios druskos vartojimą medicinoje (naudojant papildomą literatūrą).
