Cheminė sieros rūgšties formulė. Sieros rūgštis: cheminės savybės, paruošimas
H2SO3, silpna dinorūgšties rūgštis. Laisvoje formoje ji nėra paskirta, yra vandens tirpaluose. Sieros rūgščių sulfitai ... Didelis enciklopedinis žodynas
Sieros rūgštis - (H2SO3) silpna dumblinė rūgštis. Yra tik vandeniniuose tirpaluose. Sūros S. iki Sulfitai. Taikoma popieriaus ir maisto pramonėje. Taip pat žr. Rūgštys ir anhidridai ... Rusijos enciklopedija apie darbo apsaugą
sieros rūgšties - - [A.S. Goldberg. Anglų rusų kalbos žodynas. 2006] Energijos temos apskritai EN sieros rūgštis ... Techninio vertėjo vadovas
H2SO3, silpna dinorūgšties rūgštis. Laisvoje formoje ji nėra paskirta, yra vandens tirpaluose. Sieros rūgščių sulfitai. * * * Sieros rūgštis, sieros rūgštis, H2SO3, silpna dinorūgšties rūgštis. Laisvas nėra pasirinktas, ... ... Enciklopedinis žodynas
sieros rūgšties - sulfito rūgštis statusas T sritis chemija formulė H₂SO₃ atitikmenys: angl. sieros rūgšties rus. sieros rūgštis ryšiai: sinonimas - vandenilio trioksosulfatas (2–) ... Chemijos terminų aiškinamasis žodynas
H2SO3, silpna dumblinė rūgštis, atitinkanti sieros oksidacijos laipsnį +4. Žinomas tik praskiestuose vandeniniuose tirpaluose. Disociacijos konstantos: K1 = 1,6 · 10 2, K2 = 1,0 · 107 (18 ° C). Tai du eilutes druskų: normalus Sulfites ir rūgštus ... ... Didžioji sovietinė enciklopedija
H2SO3, silpna dinorūgšties rūgštis. Laisvoje formoje jis nėra išryškintas, jis egzistuoja vandenyse. p rah. Druskos S. k. Sulfitai ... Gamtos mokslai. Enciklopedinis žodynas
Žr. Enciklopedinis FA žodynas Brockhaus ir I.A. Efrona
Sieros dioksidas (dioksidas) susidaro deginant sierą ore arba deguonyje. Jis taip pat gaunamas metalų sulfidų, pvz., Geležies piritų, kalcinavimu ore ("degančiuose"):
Pagal šią reakciją sieros dioksidas paprastai gaunamas pramonėje (kitiems pramoniniams metodams gauti cm, 9 § 131).
Sieros dioksidas yra bespalvė dujos („sieros dioksidas“) su aštriu karšto sieros kiekiu. Jis lengvai kondensuojasi į bespalvį skystį, verdantį. Kai skystis išgaruoja, labai sumažėja temperatūra (prieš tai).
Sieros dioksidas labai gerai tirpsta vandenyje (apie 40 tūrių po 1 tūrio vandens); tuo pačiu metu vyksta reakcija su vandeniu ir susidaro sieros rūgštis:
Taigi sieros dioksidas yra sieros rūgšties anhidridas. Šildant, tirpumas mažėja ir pusiausvyra perkeliama į kairę; palaipsniui iš tirpalo išleidžiamas visas sieros dioksidas.
Molekulė yra pastatyta panašiai kaip ozono molekulė. Jo sudedamųjų atomų branduoliai sudaro lygiašalį trikampį:
Čia sieros atomas, kaip ir centrinis deguonies atomas ozono molekulėje, yra α-hibridizacijos būsenoje ir kampas yra artimas. Sieros, esančios statmenai molekulės plokštumai, sieros atomo orbitalas nedalyvauja hibridizacijoje. Dėl šių orbitų ir panašiai orientuotų deguonies atomų orbitalių susidaro trijų centrų ryšys; elektronų pora, kurioje ji yra, priklauso visiems trims molekulės atomai.
Sieros dioksidas naudojamas sieros rūgščiai gaminti, taip pat (daug mažesniais kiekiais) šiaudų, vilnos, šilko ir dezinfekavimo priemonių balinimui (pelėsinių grybų naikinimui rūsiuose, rūsiuose, vyno statinėse, fermentacijos talpyklose).
Sieros rūgštis yra labai trapus junginys. Jis žinomas tik vandeniniuose tirpaluose. Bandant izoliuoti sieros rūgštį, jis ištirpsta į vandenį. Pavyzdžiui, kai koncentruota sieros rūgštis veikia natrio sulfitu, vietoj sieros rūgšties išsiskiria sieros dioksidas:
Sieros rūgšties tirpalas turi būti apsaugotas nuo oro, kitaip jis, absorbuodamas deguonį iš oro, lėtai oksiduojasi į sieros rūgštį:
Sieros rūgštis yra geras redukcinis agentas. Pavyzdžiui, laisvieji halogenai atkuriami vandenilio halogenidams:
![]()
Tačiau, sąveikaujant su stipriais redukuojančiais agentais, sieros rūgštis gali atlikti oksidatoriaus vaidmenį. Taigi, jos reakcija su vandenilio sulfidu daugiausia vyksta pagal lygtį:
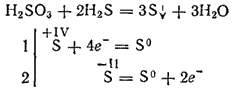
Būdamas dvipusis, sieros rūgštis sudaro dvi eilutes druskų. Jos vidurinės druskos vadinamos sulfitais, rūgšties druskomis - hidrosulfitais.
Kaip ir rūgštis, sulfitai ir hidrosulfitai yra reduktoriai. Kai jie yra oksiduoti, gaunamos sieros rūgšties druskos.
Aktyviausių metalų sulfitai kalcinavimo metu skaidosi susidarant sulfidams ir sulfatams (savaiminio oksidavimo reakcija - savęs mažinimas):
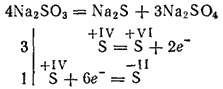
Kalio ir natrio sulfitai naudojami tam tikroms tekstilės pramonėje naudojamoms medžiagoms dažyti, fotografuojant. Tirpalas (ši druska egzistuoja tik tirpale) naudojamas medienai apdoroti į vadinamąją sulfito celiuliozę, iš kurios gaunamas popierius.
Sieros rūgštis gali reaguoti su deguonimi. Tai sudaro sieros rūgštį. Ši reakcija trunka labai ilgai ir yra įmanoma tik tuo atveju, jei pažeidžiamos saugojimo taisyklės. Sieros rūgštis turi ir oksiduojančių, ir mažinančių savybių. Naudodamiesi pagalba galite gauti halogeno rūgščių. Vandeninis tirpalas, reaguojant su chloru, sudaro druskos ir sieros rūgštį.
Reaguodamas su stipriais redukuojančiais agentais, sieros rūgštis vaidina oksiduojančio agento vaidmenį. Viena iš šių medžiagų yra vandenilio sulfidas, dujos, turinčios labai nemalonų kvapą. Sąveikaujant su vandeniniu sieros rūgšties tirpalu, ji sudaro sierą ir vandenį. Sieros rūgšties druskos taip pat mažina savybes. Jie skirstomi į sulfitus ir hidrosulfitus. Šių druskų oksidacijos reakcijos gamina sieros rūgštį.
Sieros rūgšties gamyba
Sieros rūgštis susidaro tik dėl sieros dioksido ir vandens sąveikos. Reikia gauti rūgštų dujų. Tai galima padaryti su variu ir sieros rūgštimi. Švelniai supilkite koncentruotą sieros rūgštį į mėgintuvėlį ir įdėkite vario gabalėlį. Vamzdį kaitinkite spirito lempute.
Dėl šildymo susidaro vario sulfatas (vario sulfatas), vanduo ir sieros dioksidas, kuris, naudojant specialų vamzdelį, turi būti nuleistas į kūgį. skaidrus vanduo. Tokiu būdu galima gauti sieros rūgštį.
Atminkite, kad sieros dioksidas yra kenksmingas žmonėms. Jis sukelia kvėpavimo takų pažeidimą, apetito praradimą ir galvos skausmą. Ilgalaikis įkvėpimas gali sukelti alpimą. Dirbant su juo reikia atsargumo.
Sieros rūgšties naudojimas
Sieros rūgštis pasižymi antiseptinėmis savybėmis. Jis naudojamas paviršių dezinfekavimui, grūdų fermentacijai. Jis gali būti naudojamas tam tikroms medžiagoms, kurios suyra, kai jos reaguoja su stipriais oksidatoriais (pvz., Chloru), balinti. Tokios medžiagos yra vilna, šilkas, popierius ir kai kurie kiti. Jos antibakterinės savybės naudojamos vyno fermentacijai bareliuose išvengti. Taigi, kilnus gėrimas gali būti saugomas labai ilgą laiką, įgyjant kilmingą skonį ir unikalų aromatą.
Sieros rūgštis naudojama popieriaus gamybai. Šios rūgšties pridėjimas yra įtrauktas į sulfito plaušienos technologiją. Tada jis apdorojamas kalcio hidrosulfito tirpalu, kad skaidulai susimaišytų.
