Lygios reakcijos, apibūdinančios ištirpusios sieros rūgšties galią. Egzamino patiekalų iš disciplinų sąrašas
Senų paveikslų, užrašytų alyvuogių dažais, paviršiaus juodinimas, į kurio sandėlį patenka švino baltas (PbCO3), sujungiamas su juodojo švino (II) sulfido tirpalais per atmosferoje cirkuliuojantį vandenį. Jei vanduo nudažytas peroksidu, stebima švino (II) sulfato tirpalo reakcija su balta spalva:
PbS + 4H2O2 = PbSO4 + 4H2O.
Tokiu būdu jie atkuria pajuodusius senus paveikslus, ištapytus alyvuogių dažais.
Zastosuvannya rūgštus ir sirki
Stosuvannya kisnya sritis žymi šiek tiek 61.
leisti vicoristovuvati yogo infekcijai geriamas vanduo tas pramoninių nuotekų šaltinis; kaip dezinfekavimo priemonė zasib medicinoje. Ozonas yra pergalingas ir jakų vidbіlyuyuchiy zasib.
Syrka vikoristas sieros rūgšties gamybai, syrnikivo ruošimui, bengalijos gaisrams, kovai su stiprios valstybės shkidnikais ir tokių negalavimų išaukštinimui. Serka žino zastosuvannya gumos, barnikų ir pigmentų, gabalinių pluoštų, liuminoforų ir kitų gamybos metu.
Mal. 61. Bučiavimasis

Rūgštumui išmatose, kurios yra tarp mažiausių elementų, labiausiai būdinga oksidacijos stadija -2, sieros, seleno ir telūro atomai rodo oksidacijos stadiją -2, +2, +4 ir +6.
Rūgščių ir sūkurinių vonių galios oksidai pasireiškia jų reakcijose su metalais, vandeniu ir kitais nemetalais.
Klausimas ir užduotis
1. Sulenkite formules su rūgštingumu su kaliu, kalciu ir aliuminiu. Nurodykite odos elemento oksidacijos stadiją ir įvardykite ligą.
2. Razrahuyte masės dalis sirka aliuminio sulfide.
3. Pavadinimas "kysen" - Oxinium reiškia „kuris gamina rūgštis“. Užsirašyti chemines formules atnešti jums rūgščių, į kurių sandėlį padėti elementą. Pavadinkite rūgštis.
4. Ar žinote, kokios alotropinės rūgštaus ir rūgštaus modifikacijos? Kodėl jie smirda po vieną?
5. Kisen, kurį įkvepia žmogus, kyla iš kraujo hemoglobino. Atrodo, kad 1 g hemoglobino masės tūris (n.a.) yra 1,35 cm3 3 . Sveikų žmonių kraujyje hemoglobino kiekis yra 140 g/dm3. Bendras kraujo tūris yra 6 dm3. Razrahuyte khіmіchnu kіlkіst kіlіkіst rūgštus, yоu mаzhe opinetytsya іn thе kraujyje і žmonių.
6. Nurodykite sirkovodinės rūgšties masės dalį diapazone, paimtą, kai atskiras sirvodnya tūris (n.a.) 8,96 dm 3 vandenyje, kurio masė 500 g.
7. Išplėskite koeficientus puolimo schemose ryškios oksido reakcijos:
a) H2S + Cl2 + H2O → H2SO4 + HCl; b) H2S + Br2 → S + HBr;
c) H2 S + O2 → S + H2 O.
At odos reakcija rodo oksidatorių.
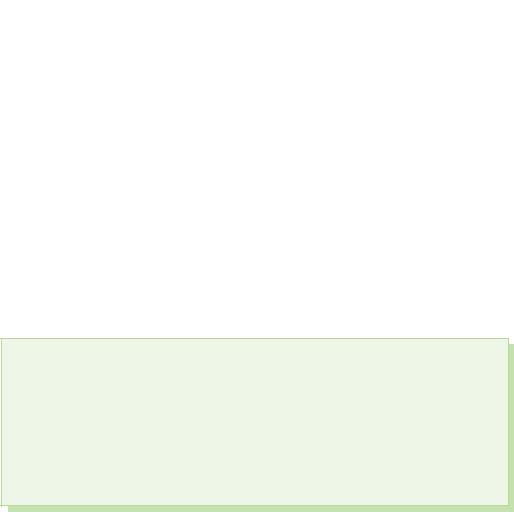
§ 39. Kisnevmisnі spoluki sirka
At z'ednannyah su rūgščiu sirka rodo oksidacijos stadiją+4 ir +6.
Sirka(IV) oksidas. Sieros rūgšties
Oksidas (IV) – SO2 (sirchistinės dujos) – tai bevamzdės dujos su aštriu būdingu kvapu, išsiskiriančios, kai oras karštas:
S + O2 = tSO2.

Vienas iš naujausių sirkos zastosuvanų buvo pririštas prie gyvybės sirkos fumigacijos, kuri turėtų sudegti. Kaip rašė senovės istorikas Plinijus vyresnysis I amžiuje prieš Kristų. e., „Sirkos židinio kvapai gali apsaugoti nuo visokių kerų ir išvaryti visas piktąsias dvasias“. Dezinfekuojanti ir baktericidinė sieros oksido (IV) galia yra užkrečiama ir užkrečiama. Sieros dujos kaitinamos daržoves, vaisius ir vaisius apdorojant, kad jie nesupūtų.
Sieros dujų išsiskyrimas šalia vandens (iki 40 tūrių SO2 1 tūriui vandens) - nedažo, dviejų bazių sieros rūgšties kaip prieinama tik mažmeninėje prekyboje:
SO2 + H2 O H2 SO3.
Sieros rūgštis yra silpna rūgštis, vandeniniuose tirpaluose ji dažnai disocijuoja su hidrosulfito ir sulfito jonų tirpalais:
H+ + HSO – , | – H+ + SO2–. |
||||
Sieros rūgštis pasižymi cheminiu dominavimu, sieros rūgštims: sąveikauja su baziniais oksidais, bazėmis, reaguoja su kitų rūgščių druskų mainais, zocrema, klampia silpna anglies rūgštimi iš druskų:
Na2CO3+H2SO3=Na2SO3+H2O+CO2.
Sirka(VI) oksidas
Oksidas (VI) turi oksiduojantį oksidą (IV) esant katalizatoriui maždaug 500 C temperatūroje:
t, katė.
2SO + O −−−−−← 2SO .
2 2 ←−−−−−3
Įspūdingiausiems protams sieros oksidas (VI) SO3 yra bebarškė rūgštis, kuri žemesnėje nei 17 °C temperatūroje virsta balta kristaline kalba. Ce tipiškas rūgšties oksidas, kuris sąveikauja su vandeniu, sudarydamas stiprią sieros rūgštį:
SO3 + H2O = H2SO4.
Sirchano rūgštis
Grafinė sieros rūgšties molekulės formulė ir modelis yra nukreiptas į mažąjį 62.
Mal. 62. Sieros rūgšties molekulės grafinė formulė ir modelis
At veisimo būreliai sieros rūgštiesє stiprus elektrolitas,
і її disociacija išreiškiama taip:
H2 SO4 → 2Н+ + SO4 2– .
Sieros rūgšties fizinė galia
Sieros rūgštis - vaza (stiprumas 1,83 g/cm3), riebi, bekvapė, nederlinga žemė. Ji eis prie vandens kažkokiuose vandens buteliuose.
H2SO4 paskirstymo iki 1 mol cheminio kiekio lydi 92 kJ šilumos, kurią galima palyginti su šiluminio poveikio dydžiais cheminėse reakcijose. Didelis šilumos kiekis sieros rūgščiai sąveikaujant su vandeniu rodo, kad tarp dviejų H2 SO4 n H2 O hidratacijos tipo upių susiformuoja mineraliniai daigai.
Pavyzdžiui, H2 SO4 H2 O; H2SO4 2H2O; H2 SO4 3H2 O ir pan.
nėra ї rūgščių ir hidratų, nesudaro klampumo її kaip stipriai vandenį atstumianti priemonė, pavyzdžiui, džiovina dujas.
Sumišių apibarstymas įvairia sieros rūgštimi vandenyje gali būti kartu su purškimu. Prisimink ką negalima pilti vandens, kad rūgtų
Lotі, slysta su nepertraukiamu maišymu, supilkite rūgštį į vandenį.
Cheminė galia sieros rūgšties. Sulfati
Sulfati. Ištirpusi sieros rūgštis atskleidžia visus būdingus dominuojančių rūgščių bruožus: sąveiką su metalais, kurie turėtų būti aktyvūs iki paros; su baziniais ir amfoteriniais oksidais, su bazėmis ir druskomis. Kieno druskos nusistovėjusios: vidurinės - sulfatas, pavyzdžiui, K 2 SO 4 i rūgštus -
hidrosulfatas, pavyzdžiui, KНSO4.
Daugumą sulfatų ir hidrosulfatų gerai išskiria vanduo, kuriame jų gausu kristalinis. Dejako kristalinės sieros rūgšties druskos ir vadinamos vitrioliu: vidutinis vitriolis CuSO4 ∙5H2O, potvynių vitriolis FeSO4∙7H2O ir į.
Rūgščiai sieros rūgšties ir її druskų pasireiškimui vandens rožėse naudojamos bario druskos:
Ba(NO3)2 + Na2SO4 = BaSO4 ↓ + 2NaNO3;
Ba2+ + SO4 2– = BaSO4 ↓.
Dėl reakcijos susidaro baltos bario sulfato nuosėdos.
Laboratorijos sertifikatas 6
Praskiestos sieros rūgšties cheminių galių stebėjimas
Anksčiau turėjo būti dedami penki mėgintuvėliai: metalo (cinko ar kito metalo, pasirinkto skaitytuvo), bazinio oksido, natrio hidroksido, natrio karbonato, bario chlorido. Į natrio hidroksido kiekį įlašinkite kelis lašus fenolftaleino ir pakeiskite dozę. Į odos mėgintuvėlį įpilkite 1-2 cm3 praskiestos sieros rūgšties. (Dėmesio! Kadangi reakcija su baziniu oksidu vyksta tinkamai, paspartinkite kaitinimą puse alkoholio vonios.)
Ką tu saugoji? Kokie požymiai gali pasakyti apie cheminių reakcijų viršijimą? Saugoti vienodas chemines reakcijas molekuline ir jonine forma. Kokią reakciją įvykdėte? Surinkti visnovok apie ištirpusios sieros rūgšties cheminę galią.
Koncentruota sieros rūgštisє stiprus oksidatorius, praskiestas mažiau. Sąveikaujant su koncentruota sieros rūgštimi
vandens nesimato su metalais.
W metalai, esantys šalia aktyvumo po vandens (raudonojo aukso ir platinos), reakcija vyksta su ištirpusiu sieros oksidu (IV) SO 2 :
Cu + 2H2 SO4 (konc) = t CuSO4 + SO2 + 2H2 O.
Reakcijoje su metalais, kurių aktyvumas yra iki vandens, koncentruota sieros rūgštis gali būti redukuota iki sieros oksido (IV) SO2, siera S arba vanduo H2 S nusėda metalo ir proto veikloje. reakcija. Pavyzdžiui:
4Zn + 5H2 SO4 (kinetai) = t 4ZnSO4 + H2 S+ 4H2 O.
Spėkime, šalta, aliuminis ir kiti diakonai, didžiausiems protams, pereina per koncentruotą sieros rūgštį.
Sieros rūgštis koncentruojasi sąveikaujant su paprastais kalbos nemetalais, pavyzdžiui, su siera:
S + 2H2 SO4 = t 3SO2 + 2H2 O.
Oksiduojantis gausiai sulankstomas ekologiški daigai, sieros rūgštis degina popierių, audinį, medieną, drabužius ir shkir. Todėl būkite atsargūs su koncentruota sieros rūgštimi.
Sieros rūgštis koncentruojama, kad pašalintų kitas, lakias rūgštis ir jų druskas. Pavyzdžiui:
NaCl (tv) + H2 SO4 (konc) = t NaНSO4 + HCl.
Baltarusijos Respublikoje Sirijos rūgštį vibruoja BAT „Gomelio chemijos gamykla“, BAT „Grodno Azot“.
Sieros rūgšties sąstingio sritys
Smirdžiai pristato mažylį 63.
Mal. 63. Sieros rūgšties stazė
Sieros rūgštis H2 SO4 yra bekvapė, riebi, riebi tėvynė.
Sieros rūgštis ištirpinama sąveikaujant su metalais, todėl ji gali būti aktyvi iki paros; su metalo oksidais; su pagrindais; nuo druskų.
Koncentruotai sieros rūgščiai sąveikaujant su metalais vandens nesimato.
Sieros rūgšties ir її druskų rūgštiniam pasireiškimui vandens rožėse naudojamos bario druskos.
Klausimas ir užduotis
1. Užrašykite savo oksidų ir cinino rūgščių formules. Nurodykite juose esančių sirkos atomų oksidacijos laipsnį.
2. Vznachete masu s_rki, scho degė rūgštyje, jakščo prie rago matėsi 29,69 kJ šilumos. Koks yra sieros oksido (VI) cheminis kiekis nusėdęs? Karšto oro reakcijos šiluminis efektas tampa 296,9 kJ/mol.
3. Koristuyuchis stalo rozchinnosti druskų, rūgščių ir bazių vandenyje, laikyti 2 lygias reakcijas praskiesta sieros rūgštis su druskomis. Parašykite rungtynes
v molekulinė ir joninė išvaizda.
4. Razrahuyte bario sulfato masę ir cheminį kiekį, kuris naudojamas praskiedus sieros rūgštimi bario nitrato pagrindu, kurio masė 200 g, Ba masės dalis (NO 3 )2 kainuoja 10 %.
5. Nukopijuokite iš pastraipos teksto lygias reakcijas, apibūdinančias koncentruotos sieros rūgšties cheminę galią. Nurodykite atomų oksidacijos laipsnį sirkoje її spolukah. Odos reakcija rodo oksidatorių.
6. Bet koks koncentruotos sieros rūgšties tūris (= 1,83 g/cm 3) su H2 SO4 masės dalimi 98% reikiamo vidutinės masės pasiskirstymo 6,4 r?
7. Nustatykite prasidėjusių oksidacinių-oksidacinių reakcijų išlyginimo schemų koeficientus:
a) HBr + H2SO4 → Br2 + SO2 + H2O; b) CaSO4 → CaO + SO2 + O2;
c) K2S + HClO → K2SO4 + HCl.
Odos reakcija rodo oksidatorių.
§ 40. Supratimas apie cheminės reakcijos produkto išeigą
Chemіchnі vnyannya, sulankstytas pagal kalbų masės išsaugojimo dėsnį, leidžia atlikti rozrahunki, zokrema skaičiuoti masu, nustatyti cheminį reakcijos produkto kiekį. Praktiškai daugelis reakcijų vyksta atvirkščiai, dalis kalbos vartojama dėl išgaravimo, atsiskyrimo ar pašalinių produktų priėmimo. Į tą produktą reakcija turėtų būti mažesnė, mažesnė, mažiau tikėtina, kad ji įvyktų, kol reakcija nebus lygi. Tokiu būdu, jei teoriškai priimtina kaip nerizikinga vienodai masės reakcijai arba produkto cheminis kiekis yra 100%, tai realiame procese produkto išeiga bus mažesnė nei 100%.
Reakcijos sandaugoje jis nurodomas graikiškos abėcėlės raide (tsya) ir šimtuose vietų pasirodo vieno chi dalimis.
Perteklinė cheminė reakcija į gaminį – vertė, kuri pridedama prie faktiškai iš gaminio pašalinto svorio (tūrio, cheminio kiekio) kiekio prie produkto masės (obsyagu, cheminis kiekis), apskaičiuotas lygiai reakcijai:
Visuose šiuose variantuose rasite tą pačią cheminės reakcijos produkto išėjimo reikšmę. Pavyzdžiui, kaip įprasta, sieros oksido (IV) oksidacijos reakcijai į sieros oksidą (VI)
2SO2 + O2 2SO3
vihіd tampa 80% (arba 0,8), tse reiškia, kad sieros (IV) oksido masė 64 g (tūris 22,4 dm3, cheminis kiekis 1 mol) tūris 22,4 dm3, cheminis kiekis 1 mol) ir masė 80 g ∙ 0,8 = 64 g (tūris 17,9 dm3, cheminis kiekis
Nuo prekių produkcijos dydžio iki realaus gamybos proceso, skubėkite vysnovok apie povnotі perevorennya syrovini, vitratah energії, būtinybę atlikti papildomas operacijas ir іn.
Pažvelkime į kelis rozrahunkiv pavyzdžius iš sąvokos "iš reakcijos produkto".
užpakalis 1. Nuplikius 48 g masės sirką, buvo pašalintas sirka(IV) oksidas, kurio tūris (n.a.) buvo 28,6 dm3. Nustatykite reakcijos produkto galiojimo laiką.
m(S) = 48 g | 1. Didelis cheminis sirkos kiekis, |
||||
V praktika (SO2) = 28,6 dm3 | sureagavo: | ||||
m(S) | |||||
(SO2)=? | n(S) | ||||
M(S) | 32 g/mol |
||||
2. Palyginti vienoda reakcija su sieros oksidu (IV): S + O2 = SO2.
3. Mes žinome teorinį sieros oksido kiekį (IV):
1 mol S - 1 mol SO2;
1,5 mol S-1,5 mol SO2.
Cheminės reakcijos produkto supratimas |
4. Žinome teorinę sieros (IV) oksido vertę:
V teoras (SO2) = n teoras (SO2) V m = 1,5 mol 22,4 mol/dm3 = 33,6 dm3.
5. Razrahuymo iš reakcijos produkto:
Vidpovіd: vyhіd į vaisto reakciją dorіvnyuє 85%.
2 pavyzdys. Pasirinkite pirito FeS2 masę, reikalingą gyvybingumui, norint paimti oksidą (IV), kurio tūris (n.a.) yra 8,96 dm3, kad reakcijos produkto išeiga būtų 90%.
V(SO2) = 8,96 dm3 | 1. Reikšminga teorinė sieros (IV) oksido vertė: |
|||||||||||
(SO2) = 90 % | V praktiška | V praktiška | ||||||||||
m (FeS2) =? | Žvaigždžių V teorija = | |||||||||||
V teorija | ||||||||||||
Vteoras (SO2) = | V praktinis (SO 2) | 8,96 dm 3 | 9,56 dm3. |
||||||||||
2. Mes žinome teorinį cheminį sieros oksido kiekį (IV): |
||||||||||||
n teorija(SO 2) | V teorija (SO 2) | 9,56 dm3 | ||||||||||
22,4 dm3/mol |
||||||||||||
3. Palyginti lygus sieros (IV) oksido reakcijai ir pirito cheminiam kiekiui, reikalingam vipalui:
x mol 0,4 mol
4FeS2 + 11O2 = 8SO2 + 2Fe2O3, 4 mol 8 mol
x = 0,2 mol.
3. Žymiai masu piritas, kuris reikalingas vipalui gauti: m (FeS2) = 0,2 mol 120 g/mol = 24 g.
Indikacija: norint turėti sieros oksidą (IV), reikalingas 24 g masės piritas.

Perteklinė cheminė reakcija į gaminį – reikšmė, padidinanti faktiškai iš produkto paimtą svorio kiekį (obsyagu, cheminis kiekis) iki gaminio masės (obsyagu, cheminis kiekis), skaičiuojant vienodoms reakcijoms. Atsiranda dalimis po vieną ir kelis šimtus.
Klausimas ir užduotis
1. Kodėl reakcijos produkto praktinė išeiga skamba mažiau, teoriškai žemesnė esant lygiai reakcijai?
2. Sirkai reaguojant su 1 molio vandeniniu cheminiu akmeniu, sirkovodny ištirpo 0,85 mol. Nustatykite reakcijos produkto galiojimo laiką.
3. Dėl to bario chlorido sąveika su 200 g masės iš sieros rūgšties nusodino bario sulfatą, kurio masė 100 g. Reakcijos produktas suskaidomas.
4. Nustatykite to cheminio sieros(IV) oksido kiekio tūrį (n.a.), kuris, ištirpęs sieros deginimo metu, sveria 64 g, vadinasi, reakcijos produktas yra 75% sveikesnis.
5. Apskaičiuokite sudegusios sirkos masę, taip pat neįtraukite sirka (IV) oksido pagal tūrį (n.a.) 89,6 dm3 3 tapti 80% teoriškai įmanomo.
6. Matyt, scho išsiskyrė į sieros oksidą (VI), kuris buvo pašalintas oksiduojant sieros oksidą (IV),
brangesnis 85 proc. Nustatykite sieros (IV) oksido masę, tūrį (n.a.) ir cheminį kiekį, kuris, patekęs į reakciją, pašalindamas sieros (VI) oksidą pagal tūrį (n.a.) 2,24 dm3.
7. Pasirinkite druskos masės dalį iš skirtumo, paimto iš mišinio, kurio masė 3,2 g iš sieros rūgšties, masė 192 g, kad reakcijos produkto išeiga būtų 85%.
§ 41. Azotas ir fosforas
Azotas N ir fosforas P yra sumaišyti periodinės sistemos VA grupėje. Mish'yak As, stibis Sb ir bismutas Bi gali būti matomi prieš periodinės sistemos grupę. Azotas ir fosforas yra nemetalai, mišjakas ir stibis patenka į napіvmetalіv, o vismutas yra metalai.
Budovos atomai tą oksidacijos stadiją
VA grupės elementų atomai išoriniame energijos lygyje turi po 5 elektronus, jų išorinio energijos lygio elektroninė konfigūracija ns 2 np 3 pvz.: azotas - 2s 2 2p 3 fosforas - 3s 2 3p 3.
7N↓ | 15p↓ |
Vadovas.
- Kodėl viklikana toks pokytis? Kokiu dichromato viešpatavimu grindžiamas chromo sumishi, skirto pirštinėms indams, gyvenimas?
- Į mėgintuvėlį įpilkite 5-6 lašus kalio dichromato ir 3 lašus sieros rūgšties. Įlašinti 2 lašus kalio jodido ir mėgintuvėlį praskiesti 10 lašų vandens. Dalį pipete perkelkite į kitą mėgintuvėlį ir įlašinkite lašelį krakmolo. Kas pasikeitė krakmolo atžvilgiu? Kodėl? OVR ir zvnyati sulankstymas elektroniniu-joniniu metodu.
- Svarbi 15 elemento charakteristika R. Fosforo alotropinių modifikacijų dominavimas. Fosforo sąveika su paprastomis ir lankstančiomis kalbomis.
Farmacijoje gyvsidabrio oksidas (II) yra zastosovuetsya kaip žemesnis antiseptikas zasibas paruošimui akių tepalai, yake sulaikykite atskirto natrio hidroksido praskiedimą ant komercinės gyvsidabrio druskos.
Vadovas.
1. Parašykite atitinkamą reakciją į gyvsidabrio oksidą (II). Paaiškinkite, kodėl reikia atlikti operacijas tamsoje?
3. Pagrindiniai chemijos dėsniai.
Vikoristannya su cinku medicinoje yra pagrįsta jogos pyragu, antiseptiniu poveikiu. 0,25% cinko sulfatas yra stiprus akių lašams ruošti kartu su 2% boro rūgštimi.
Vadovas.
- Paruoškite 0,25% cinko sulfato tirpalą, kurio tūris yra 100 ml (ρ = 1,02 g/ml).
- Sukurkite transformaciją
Zn → ZnCl 2 → ZnSO 4 → Zn(NO 3) 2 → Zn(OH) 2 → Na 2 → NaCl
- Kovalentinis ryšys, paskyrimas, matote, nušvitimo mechanizmas, galia. Valencija. Oksidacijos stadija.
· Vaistininkas permanganatometrijos metodu turi kontroliuoti fiziologinio tirpalo klampumą.
Vadovas.
1. Parašykite panašią reakciją ir palyginkite elektroniniu-joniniu metodu.
2. Apskaičiuokite 0,5 % (ρ = 1,004 g/ml) natrio hidroksido kiekį, reikalingą reakcijai su 0,1 M chlorido (III) kiekiu 20 ml.
3. Periodinis dėsnis periodinė sistemašviesoje vchennya apie atomo gyvenimą.
· Zalіzo, vіdnovlene, scho stosovuєtsya vnutrіshno jakų protianemіchne zasіb, maє bet vilno vіd vіd domіshok sulfіdіv midi, vugіllya, silicio rūgštis, mish'yaku.
Vadovas.
1. Paprašykite būdo apsaugoti įėjimą į namą. Obguruntuvati vіdpovіd.
3. Pagrindinis cheminio ryšio tipas. Gamta sukurs cheminį ryšį.
· Permanganato korpusui su ūdromis їx zneshkodzhennya atliekama su 3% vandeniniu H 2 Pro 2 parūgštintos akių rūgšties tirpalu.
Vadovas.
1. Parašykite panašų atsakymą. Ištirkite reakciją elektronų jonų metodu
- Oksidi, paskyrimas, klasifikacija, nomenklatūra, autoritetas ir turėjimo būdai.
· Kalbos analizė ruošiant seiles atliekama permanganatometrijos metodu, remiantis Fe2+ gebėjimu oksiduotis į Fe3+. Apatinė įkvepiamo oro dalis kaitinant atskiriama nuo sieros rūgšties, o po aušinimo titruojama 0,1 N kalio permanganatu.
Vadovas.
1. Parašykite lygias reakcijas, kurios yra apibrėžimo pagrindas.
2. Paruoškite 200 ml 0,1 N KMnO 4 (ekvivalentiškumo koeficientas priklauso nuo reakcijos).
3. Rūgštingumas, pavadinimas, klasifikacija, nomenklatūra, autoritetas, turėjimo būdai.
· Farmakopėjinis vaistas nitratas buvo nuimtas kita eile: vario-sidabro lydinys atskiriamas nuo azoto rūgšties, siekiant išvalyti nitratų pašalinimą iš namų, nusodinamas druskos rūgštimi. Apgultis, kuri yra viishov, atstatoma cinku rūgščioje terpėje, o sutraukta, zvilnene namuose, pakartotinai apipurškiama azoto rūgštimi.
Vadovas.
- Parašykite rіvnyanyya іdpovіdnyh reakcijas.
- Vikonaty yakіsnі reakcijos į Cl-, Br-, J anijoną su įvairiais nitratų srіbla, scho slypi chloridų, jodidų, kalio bromidų preparatų teisingumo patvirtinimo pagrindu.
- Pagrįsti, paskirti, klasifikuoti, nomenklatūrą, autoritetą, turėjimo būdus.
9. Nitratų srіbla zastosovuєtsya zvnіshno at erosіyah, vyrazki, gostromos konjunktyvitas į viglyadі 2,5 ir 10 proc. vandens tiekimas.
Vadovas.
- Paruoškite 50 ml tūrio 2 % AgNO 3 tirpalą (ρ= 1,015 g/ml). Kokių protų reikia norint pasirūpinti šiuo rozchinu?
- Sukurkite transformaciją
Ag→AgNO 3 →AgCl→ AgNO 3 →Ag
- Druska, pavadinimas, klasifikacija, nomenklatūra, autoritetas, turėjimo būdai.
· Vaistininkas turi atlikti farmakopėjinio vaisto bario sulfato identifikavimą.
Vadovas.
1. Koks yra bario sulfato metodas medicinoje? Kodėl prieš identifikavimo reakcijas bario sulfatas legiruojamas su natrio karbonatu? Vidpovidіd patvirtino vienodos reakcijos.
2. Viconati reakcijos ir druskų BaSO4, CaSO4, Na2SO4 identifikavimas.
3. Išsamus spoluky, žymėjimas, budov A. Werner, cheminio ryšio pobūdis, klasifikacija, nomenklatūra, disociacija. Zastosuvannya kompleksas medicinoje ir cheminėje analizėje.
· Vaistininkas, dirbdamas su amoniako koncentracija, leidęs grubiai sugadinti saugos įrangą – darbą prie dėmėtos spintos atlikęs be padidintos traukos.
Vadovas.
- Kokios gali būti pasekmės dirbant su amoniako koncentracija be papildomos saugos įrangos? Yaku pershu medicinos pagalba būtina kreiptis apsinuodijus amoniako garais.
- Sukurkite tokią transformaciją.
(NH 4) 3 PO 4 → NH 3 → NH 4 NO 2 → N 2 → NO → NO 2 → HNO 3 → Hg(NO 3) 2 → NO 2
Parašykite reakcijų lygtį molekulinei ir joninei išvaizdai, o OVR - pažiūrėkite elektronų balanso metodu.
- Cheminė kinetika. Cheminės reakcijos greitis. Įvairių veiksnių įtaka cheminių reakcijų greičiui.
· Zі spoluk azoto medicinoje zastosovuyutsya amoniako vandenyje, druskos, amonio, oksido diazoto ir natrio nitrito.
Vadovas.
- Koks yra pergalingo azoto atidavimo būdas? Parašykite šių kalbų formules ir lygiavertes reakcijas, apibūdinančias pagrindines galias.
- Parašykite vienodą natrio nitrato ir kalio permanganato reakciją rūgščioje terpėje. Ištirkite reakciją nap_reakcijos metodu
- Negrįžtami ir vilkolakiai cheminės reakcijos. Cheminis uolus. Masės dėsnis lygioms sistemoms. Nuosavybės konstanta. Le Chatelier principas.
· Vaistininkas turi atlikti natrio sulfato, natrio chlorido, natrio bikarbonato druskų identifikavimą.
Vadovas.
- Vikonaty akіsnі reakcijos į jonus SO 4 2-, Cl-, HCO 3-.
- Razrahuvat, skіlki gram_v kristalohidratas Na 2 SO 4 10H 2 O vaistininkui reikia užplikyti 500 g masės vandens, paimti 5% Na 2 SO 4 ?
- Oksido-vandens reakcijos. Pagrindinės elektroninės oksidaciją skatinančių reakcijų teorijos nuostatos. Svarbiausi oksidatoriai ir gidai. Zrivnyannya oksido-vandens reakcijos elektroninio balanso metodu ir jonų-elektroniniu metodu.
Atrodo, kad sieros rūgšties kalio stiprumo sudėtyje yra daug organizmui svetimų vaistų (ksenobiotikų). vaistiniai preparatai tie metabolitai su kai kurių smulkių kalbų tirpalais – konjugatais, kurie lengvai pasišalina iš organizmo.
Vadovas.
- Sieros rūgšties kalio stiprumą pašalinkite kitu būdu, vietoj reaktyvaus stalo. Parašykite rіvnyanyya іdpovіdnyh reakcijas.
- Sudėkite molekulines reakcijų lygybes, kurios išreiškiamos tokiomis greitomis joninėmis lygybėmis:
S 2- + H 2 S → 2HS -
S2- + 2H+ → H2S
HS - + OH - → S 2 - + H 2 O
· Dispersinės sistemos, žymėjimas, klasifikavimas. Suspensijos, aerozoliai, emulsijos. Stambių dispersinių sistemų parinkimas medicinoje ir farmacijoje.
Vaistininkui reikia paimti 5% sieros rūgšties.
Vadovas.
- Koks yra anijono SO 4 2 oksidacinės savybės nuosėdos rūgšties koncentracijoje? Parašykite reakcijų, apibūdinančių ištirpusios ir koncentruotos rūgšties galią, lygtį.
- Paruoškite 5% sieros rūgšties tirpalą, išplaudami 50 ml sieros rūgšties su 30% H 2 SO 4 masės dalimi.
- Koloidni razchini, klasifikacija, pavadinimas, molekulinė kinetika ta optinė galia, otrimannya. Kolonų stabilumas. Krešėjimas. Peptizacija. Budova mycel. Dializė.
· Sirka, patenkanti į aminorūgščių sandėlį, organizmuose oksiduojasi. Endogeninės sieros rūgšties atveju ji dalyvauja egzogeninėse sporose – fenolyje, krezolyje ir indolyje.
Vadovas.
- Apibūdinkite sieros rūgšties galią ir nepaisykite darbo su rūgštimis taisyklių.
- Kad ištirptų, kokio tūrio sieros rūgšties, kurios masės dalis yra 25% H 2 SO 4, o storis 1,18 g / ml, reikia neutralizuoti 50 ml tūrio kalio hidroksidu, kurio masės dalis KOH yra 12%. ir 1,1 g/ml storio
- Tikrasis skirtumas, paskirtis, pagrindinis supratimas, diferenciacijos proceso esmė. Difuzija. Osmosas. Osmosinis spaustukas.
· Pramoniniuose rajonuose, kur daug vugilijų, dažnai iškrenta rūgštūs medžiai.
Vadovas.
- prie ko tu chemijos sandėlis rūgšties dosch netoli tsikh sričių? Kaip gaminate vyną? Parašykite vienodas reakcijas.
- Sulenkite molekulinius ir trumpalaikius jonus, lygius besivystančių druskų hidrolizei:
K 2 S, Na 2 SO 4, Na 2 SO 3, Al 2 (SO 4) 3, Cr 2 S 3
Aplinkplaukimas vyksta gamtoje puikūs skaičiai už rahunok biocheminius procesus ir kerštą pro sirchanih mineraliniuose vandenyse.
Vadovas.
- Dienos galia.
- Sukurkite transformaciją:
H 2 S → SO 2 → H 2 SO 3 → NaHSO 3 → Na 2 SO 3
Parašykite molekulinės ir joninės išvaizdos reakcijų lygtį.
- Rūgščių, bazių, druskų, vandens disociacija. Rūgščių ir bazių lygis rozchinah. Joninis dobutok vanduo, lemiantis pH.
· Oficialus vaistinis preparatas sirka є sirka, išklota (Sulfur praecipitafum).
Vadovas.
- Apibūdinkite laisvosios sirkos galią ir alotropines sirkos modifikacijas.
- Sukurkite transformaciją:
Zrivnyati reakcijos elektroninio balanso metodu.
- Hidrolizė. Hidrolizės proceso esmė. Įvairių rūšių druskų hidrolizė. Pakopinė hidrolizė. Įvairių veiksnių antplūdis hidrolizės stadijoje.
· Vaistininkas atlieka 3% vandens peroksido tirpalo identifikavimo reakciją: iki 1 ml galutinio tirpalo įpilama 1 ml praskiestos sieros rūgšties, 1 ml eterio ir 0,5 ml kalio dichromato, dėl ko susidaro rutulys Esant 6 rūgščiai eteris virsta mėlyna spalva
Vadovas.
- Vikonaty reakcija іdentifіkatsії degtinės peroksidas.
- Parašykite vienodą vandens peroksido ir balanso identifikaciją elektroninio balanso metodu.
- VII grupės galvos pogrupio ir jų pusės elementų charakteristika. Medicinos biologinė reikšmė halogenai.
· Kisen yra farmacinis preparatas ir aprašymai GF. Yogo zastosovuyut įkvėpus įvairių tipų rūgštiniam badui.
20. Vadovas.
- Parašykite lygias atskleistų namų CO, 2, NO, NO2 reakcijas.
- Parašykite lygias reakcijas, kurios yra laboratorinio rūgšties šalinimo metodo pagrindas. Reakcijos indukcija elektronų balanso metodu
- Chloras, chloro vanduo, druskos rūgštis, chloridas. Fizinė ir cheminė chloro ir jogo spoluko galia. Halogenų medicininė ir biologinė reikšmė.
· Vaistininkas peržiūri vaistų, kurių pagrindą sudaro natrio chloridas, natrio bromidas ir natrio jodidas, galiojimą.
Vadovas.
- Tokiems tikslams vaistinėje ir medicinoje naudojamos vikoninės druskos.
- Vikonaty akіsnі reakcijos į anijonus Cl-, Br-, J-.
- Fizikinė ir cheminė rūgštaus chloro galia. Otrimannya. Zastosuvannya.
· Vienas iš pramoninių jodo išgavimo farmacijos tikslais būdų yra jodo gavimo iš gręžinių vandenų procesas. Jodidas, esantis šalia gręžimo vandenų, oksiduojamas pagal schemą:
NaJ + NaNO 2 + H 2 SO 4 → J 2 + Na 2 SO 4 + NO + H 2 O
22. Vadovas.
- Kaip paruošti jodą ir kaip jį naudoti medicinoje.
- Reakcijos metodu ištirkite reakciją, kuri yra jodo manijos pagrindas.
- Kritinė chalkogenų savybė. Galingumas rūgštus ir jogo pusė. Rūgštingumo medicininė-biologinė reikšmė.
· Natrio, kalio ir kalcio chloridų preparatų teisingumą nustato vaistininkas.
Vadovas.
- Tokiais tikslais vikoristai naudojami farmaciniuose preparatuose.
- Vikonati reakcijos _šių druskų identifikavimas.
- Pusiau rūgštus su vandeniu. Fizinės ir cheminės vandens galios. Vandens peroksidas, dominavimas, spūstys medicinoje. Vandens reikšmė organizmų gyvenime.
· Zі spoluk halogenіv z rūgsta mažiau hipochlorito, kad taptų įdomi medicina kaip dezinfekavimo priemonė.
Vadovas.
- Kokia hipochloritų galia grindžiama dezinfekcijos diena? Parašykite rіvnyanyya іdpovіdnyh reakcijas.
- Razrahuvati, skіlki gramіv chloro vonia turi būti paimta už otrimannya 2 litrus aktyvaus chloro.
- Sirka ir її nuo grindų. Laisvosios sirkos alotropija. Fizinė ir cheminė sirka, sirkovodnya, sirkovodnya rūgšties ir її druskų galia.
· Esant nepakankamam kevalų sulčių rūgštingumui, skiriama viduje praskiestos chlorovandenilio rūgšties.
Vadovas.
- Išvardykite bendrąsias darbo su rūgštimis taisykles.
- Razrahuvat, skіlki ml 36,5% - įvairių (ρ = 1,19g / ml) druskos rūgšties ir būtina paimti paruošimui 100 ml. 8,2 % – o (ρ=1,040 g/ml) rūgštis.
- Sieros oksidų, sieros rūgšties, sieros rūgšties fizinė ir cheminė galia. Sulfitas. Sulfati. Jėga, manija, zastosuvannya.
· Farmacijoje vienas iš standartinių dydžių yra 33% kalio acetatas, tai yra būdas paskirstyti kalio karbonatą 30% - okto rūgštyje.
Vadovas.
1. Parašykite molekulinės ir joninės išvaizdos reakcijos lygtį.
- Reikšminga V grupės galvų pogrupio elementų charakteristika. Laisvo azoto dominavimas. Azoto reikšmė organizmų gyvenime.
· Kalbų receptai, kurie yra stiprios bazės ir silpnos rūgštys. Norint naudoti GFH kaip stabilizatorių, į 4 ml 1 litrui produkto pridedama 0,1 n natrio hidroksido tirpalo.
Vadovas.
- Parašykite druskos CH3COONa hidrolizės reakcijos lygtį.
- Razrahuvat, skіlki gramіv NaOH būtina skambinti, paimti 500 ml 0,1n dydžio. Paruoškite visus naujausios saugos technologijos dizainus.
- amoniako. Amonio druska. galia. Zastosuvannya medicinoje ir farmacijoje.
· Vaistininkas paruošia tepalą pagal receptą: 1 g kalio karbonato ir 0,5 g natrio tetraborato sumaišoma 70 ml distiliuoto vandens, 10 g stearino legiruojama su 15 g vazelino aliejaus ir sumaišius plona srovele pilama. šiltu vandeniu, kad karbonizuotų. .
Vadovas.
- Kokios kalbos nusprendžiamos po kurio zmishuvannya? Kaip vidurys nusistovėjęs ir kodėl? Vidpovidіd patvirtino vienodos reakcijos.
- Technocheminės vagos paruošimas robotams. Technocheminėse vietose paimkite 1 g kalio karbonato.
- Azoto oksidas. Azoto rūgštis ir її druskos. Fizinės ir cheminės galios. Medicininė-biologinė azoto reikšmė
· Tuščiai burnai ir gerklei skalauti vaistininkui būtina paruošti 0,05 % kalio permanganato 200 ml tūrio.
Vadovas.
- Kokiu autoritetu yra kalio permanganatas, kurio šaknys yra yogo likuvalna diya? Yakі spoluky mangano zastosovuetsya in džiūgavimo tikslais?
- Norint užsisakyti 200 ml 0,05% KMnO 4 (ρ = 0,9994 g / ml), reikia pridėti keletą gramų KMnO 4. Parodykite šio dizaino paruošimo techniką.
- Budovo azoto rūgšties molekulės. Azoto rūgšties ir її druskų fizinė ir cheminė galia. Azoto ir її spoluko medicininė-biologinė reikšmė.
· Farmacijoje gyvsidabrio oksidas (II), kuris yra stiprus antiseptikas zasibas, yra atsietas nuo natrio hidroksido komercinėje gyvsidabrio druskoje (II).
Vadovas.
1. Parašykite atitinkamą reakciją į gyvsidabrio oksidą (II). Kodėl reikia reaguoti į nykštukus?
3. Pagrindiniai chemijos dėsniai.
K 2 Cr 2 O 7 + H 2 O 2 + H 2 SO 4 = K 2 SO 4 + H 2 CrO 6 + H 2 O
Perchromo rūgštis, kuri ištirpsta su čioma, H 2 CrO 6 yra mėlyna spalva. Mėlynosios rūgšties užterštumas patvirtina H2O2 paruošimo efektyvumą.
Vadovas.
- „Zrivnyati tsyu“ reakcija elektroniniu-joniniu metodu.
- Yakі spoluky chromas rodo oksidacinę galią, o yakі - vodnovlyuvalnі?
- Fosfino, fosforo oksidų ir fosforo rūgščių dominavimas, jų turėjimas. Fosforo medicininė-biologinė reikšmė
· Sumish magnio oksidas (85%) ir magnio peroksidas (15%) - vaistas, žinomas kaip "magnio peroksidas", kuris zastosovuyut esant gleivinės ir žarnyno sutrikimams.
Vadovas.
- Paaiškinkite antacidinius ir baktericidinius vaistus. Vidpovidіd patvirtino vienodos reakcijos.
- Razrahuvat, skilki gramus MgO ir MgO 2 reikia paimti, kad paruoštumėte 100 g šio vaisto. Iškvieskite 10 g magnio oksido.
- Pagrindinio pogrupio IV grupės elementų charakteristika. Budova, Fizinė galia alotropai anglyse. Laisvosios anglies cheminė galia.
· Suskaidyti natrio bikarbonatą (geriamąją sodą) į zastosovatą, kai nuplaunama, skalaujama su liepsnojančiais akių, viršutinių kvėpavimo takų gleivinių negalavimais.
Vadovas.
- Kokios galios natrio bikarbonatas turi antiseptinį poveikį? Vidpovidіd patvirtino vienodos reakcijos. Ar galite naudoti kaip antiseptiką zasibo natrio tetraboratą Na 2 B 4 O 7 ∙ 10H 2 Pro?
- Paruoškite 5% NaHC03 50 ml tūrio (= 1,036 g/ml).
- Budovo molekulės, fizikinės ir cheminės rūgščio iš anglies galios. Medicininė-biologinė anglies ir jogos reikšmė.
· Antacidiniai preparatai, keršijantys natrio bikarbonatą, padedantys sergant įvairiomis ligomis, kurias lydi padidėjęs rūgštingumas, tobto. acidozė.
Vadovas.
- Kokios galios druskos veikia antacidiniai preparatai? Vidpovidіd patvirtino vienodos reakcijos. Ar šiems tikslams gali būti panaudotos kitos kalbos?
- Sukurkite transformaciją:
NaOH → NaHCO 3 → Na 2 CO 3 → NaCl → NaNO 3
Parašykite molekulinės ir joninės išvaizdos reakcijų lygtį.
Viconati reakcijos Na 2 CO 3 → NaCl → NaNO 3.
- Silicis ir jogo pusė, gamtos pažinimas, otrimanija, fizinė ir cheminė galia. Medicininė-biologinė silicio reikšmė.
· 2,5 % NaCl tirpalas į vidų įvedamas kanalizacijai praplauti, kai AgNO 3 yra užterštas.
Vadovas.
1. Kuo pagrįstas NaCl? Vidpovidіd patvirtino vienodos reakcijos.
3. Pagrindinė III grupės pagrindinio pogrupio elementų charakteristika. Galingas miškas ir jogo spolukas. Medicininė-biologinė reikšmė medicinoje.
· Retų vaistinių formų, pripažintų injekcinėms, vietinėms izotoninėms atmainoms kurti.
Vadovas.
1. Kas yra izotoninė atmaina? Kodėl joga vadinama izotonine?
3. Aliuminis ir joga nuo grindų, dominavimas, otrimannya. Medicininė ir biologinė aliuminio reikšmė.
· 3% vandeninis vandens peroksido tirpalas zastosovuyut kaip veiksmingas baktericidinis zasib.
Vadovas.
1. Koks yra baktericidinio ir kraujo spinalinio peroksido vandens pagrindas. Kokius svetimus įrašus reikia apkarpyti dirbant su perhidroliu?
2. Razrahuvati, skilki ml. 500 ml 3% tirpalo (ρ = 1,005 g / ml) reikia paimti perhidrolį (30% vandeninis H 2 Pro 2 tirpalas, ρ = 1,1 g / ml). Paruošti tsey rozchin z dotrimannym tekhnіki bezpeka.
3. II grupės galvos pogrupio metalai. Zagalna charakteristika, otrimannya, fizinė ir cheminė galia. Kalcio ir magnio druskos. Vandens kietumas. Usunennia zhorstkostі vanduo. II grupės pagrindinio pogrupio elementų medicininė-biologinė reikšmė.
· Šiuolaikinė farmacijos pramonė gamina vaistinius preparatus pagal agregatinę stovyklą, dispersinių sistemų tipą, įvedimo į organizmą būdą.
Vadovas.
1. Kokios sistemos vadinamos išsklaidytomis?
Kaip klasifikuojamos išsklaidytos sistemos?
Ar atrodo, kad išsklaidytos sistemos dozuoja vaistinius preparatus? Pateikite konkrečių pavyzdžių.
- Pašalinkite kanifolijos hidrozolį pakeisdami mažmenininką.
- Būdinga balų metalų savybė, manija, fizinė ir cheminė galia. Svarbiausios mėnulio metalų dalys. Medikologinė-biologinė balų metalų reikšmė
· Matant vandens skirtumus įvairiose kalbose, zastosovuyutsya rіdkі vaistinių formų, kurios gali būti abipusės.
Vadovas.
- Spravzhnі rozchini, rozchinnist, nasicheniya, nenascheniya, renasistheniya rozhchiny. Kokie klerkai gali laikyti kalbas?
- Paruoškite 5% CuSO 4 100 ml tūrio (ρ = 1,051 g / ml) su mėlynu vitrioliu CuSO 4 ∙ 5H 2 O
- Būdinga d elementų charakteristika. 1-osios grupės šoninių pogrupių metalai ir spolukas. Medicininė ir biologinė reikšmė.
· Rusijoje vykdomas sulčių ir mažai sulčių turinčių šviežių žolelių ir laukinių sirovinų apdorojimas: uogos, vaisiai, daržovių šakniavaisiai, įvairūs būtybių organai, naudojant sulčių (sumaišytų iš vidaus) metodą. Vidinė erdvė yra baltų kolona, nukleino rūgštys, angliavandeniai, taninai
Vadovas.
1. Kokie skirtumai vadinami stulpeliais? Kaip klasifikuojami kvapai? Išvardykite stulpelių galias. Koks procesas yra pagrindas matyti rasotos sirovinos sultis?
2. FeCl hidrolizės būdu pašalinkite fiziologinio tirpalo (III) hidrozolio hidroksidą 3. Parašykite grybienos schemą.
- II grupės antrinių pogrupių metalai, bendrosios charakteristikos, budova, fizikinė ir cheminė galia. Medicininė ir biologinė reikšmė.
· Ruošiant tabletes valerijono šaknų ekstrakto pagrindu, nerekomenduojama kaip pagrindinio stiprintuvo naudoti vikoristato magnio karbonato, nes jis gali neutralizuoti izovalerijono rūgštį ir ruynuvannya valtrativ – rechovina, dar jautresnę pievų užpilui.
Vadovas.
1. Paaiškinkite magnio karbonato pudros galios pasireiškimą. Parašykite molekulinės ir joninės išvaizdos reakcijos lygtį. Kokius priminimus galima naudoti vicorist ruošiant tabletes su valerijono ekstraktu?
2. Sukurkite transformaciją:
MgO → MgCl 2 → MgSO 4 → Mg(OH) 2 → MgOHCl
Parašykite molekulinės ir joninės išvaizdos reakcijų lygtį.
3. Šoninių pogrupių VI, VII grupių elementų bendroji charakteristika. Oksidais pirmaujantis chromo, mangano ir jų dalių dominavimas. Medicininė ir biologinė reikšmė.
· Anglies dvideginio dujų panaudojimas farmacijos gamyboje biologiškai aktyvių kalbų išgavimui iš vaistinio rasotojo sirovino.
Vadovas.
- Kokie angliarūgštės dominavimas yra jogos palaikymas šiais tikslais?
- Sukurkite transformaciją:
C → CH 4 → CO → CO 2 → BaCO 3 → Ba(HCO 3) 2 → BaCO 3 → CO 2
Parašykite jonų mainų reakcijas molekuline ir jonine forma.
- Antrinio pogrupio VIII grupės elementų charakteristika. Salės viešpatavimas ir jogo spolukas. Medicininė ir biologinė reikšmė.
Egzamino patiekalų iš disciplinų sąrašas
Pagrindinės chemijos sąvokos ir dėsniai. Toks atomo gyvenimo nustatymas.
Periodinis įstatymas ir periodinė sistema D.I. Mendeljevas atomo gyvybės šviesoje.
Paskirti, pamatyti, suprasti, nušviesti cheminio ryšio pobūdį.
Paskyrimas, nušvitimo mechanizmas, kovalentinio ryšio galia. Valencija. Oksidacijos stadija.
Oksidi: paskyrimas, klasifikacija, nomenklatūra, galia ir turėjimo būdai.
Rūgštys: žymėjimas, klasifikacija, nomenklatūra, galia ir turėjimo būdai.
Pagrįsti: paskyrimas, klasifikacija, nomenklatūra, galia ir valdymo būdai.
Druskos: žymėjimas, klasifikacija, nomenklatūra, autoritetas ir turėjimo būdai.
Sudėtingas spoluky: paskyrimas, budova po Wernerio, tipi, nomenklatūra.
Cheminės reakcijos greitis. Pareigūnai, mokyklų mainai vplyvayut swidk_st cheminė reakcija.
Negrįžtamos ir grįžtamosios cheminės reakcijos. Cheminis uolus. M. Chatelier principas. Nuosavybės konstanta.
Oksido oksidacinės reakcijos: svarbiausios, pagrindinės sąvokos, oksidacijos ir atsinaujinimo diena, svarbiausi oksidatoriai ir reakcijos lyderiai.
Dispersinės sistemos: žymėjimas, klasifikavimas. Grubios sistemos: suspensijos, aerozoliai, emulsijos.
Koloidni razchiny: vyznachennya, viešpatavimas, apsėdimas, budova mycel.
Tikrieji skirtumai: paskirtis, pagrindinis supratimas, diferenciacijos proceso esmė. Difuzija. Osmosas. Osmosinis spaustukas.
Pagrindinės elektrinės disociacijos teorijos nuostatos. Elektrinės disociacijos mechanizmas. Ženkite tą disociacijos konstantą.
Rūgščių, bazių, druskų disociacija. pH skirtumo disociacija.
Hidrolizės esmė. Įvairių rūšių druskų hidrolizė. Pakopinė hidrolizė.
Būdingas VII grupės pagrindinio pogrupio elementų apibūdinimas. Halogenų medicininė ir biologinė reikšmė
Chloras, chloro vanduo ir druskos rūgštis. Otrimanya, dominija. Chloridas.
Kisnevі spoluki chloro.
Kritinė chalkogenų savybė. Kisen ta yogo pusiaukelėje. Rūgštingumo medicininė-biologinė reikšmė.
Dominuoja pusiau rūgštus su vandeniu (vanduo, vandens peroksidas). Zastosuvannya H 2 Pro 2 medicinoje. Švino vertė.
Sirka. Laisvosios sirkos alotropija. Pasaulio galios chemija. Aplinkplaukimas. Serkovodny rūgštis ir її druskos.
Sieros oksidų, sieros ir sieros rūgščių, sieros rūgšties druskų, sieros rūgščių fizikinė ir cheminė galia, jų sąstingis.
V grupės pagrindinio pogrupio elementų charakteristika. Azotas ir galia.
Amoniako ir amonio druskų dominavimas. Zastosuvannya medicinoje ir farmacijoje.
Azoto oksidas. Azoto rūgštis ir її druskos. Fizinė ir cheminė galia, stosuvannya.
Azoto rūgšties fizinė ir cheminė galia. neišlaidauti. Azoto ir її spoluko medicininė-biologinė reikšmė.
15 elemento R. Vile fosforo charakteristikos: alotropija, fizinė ir cheminė galia, apsėstumas.
Fosfinas. Fosforo ir fosforo rūgšties oksidai: galia, manija. Fosforo medicininė-biologinė reikšmė
Pagrindinio pogrupio IV grupės elementų charakteristika. Vuglets: Budova ir fizinis dominavimas, alotropija vugletsyu, cheminis dominavimas.
Kisnevі spoluky vugletsiu: Budova molekulės, fizinis ir cheminis dominavimas. Anglies ir jogos spoluko medicininė-biologinė reikšmė.
Silicis ir jogo pusė: gamtos, vyriškumo, fizinės ir cheminės galios pažinimas. Medicininė-biologinė silicio reikšmė.
Pagrindinis ІІІ grupės pogrupis: pagrindinė elementų charakteristika. Boras ir joga iš šono: otrimannya, fizinė ir cheminė galia, zastosuvannya medicinoje.
Aliuminio ir jogos fonai: manija, fizinė ir cheminė galia. Medicininė ir biologinė aliuminio reikšmė.
2-osios grupės galvos pogrupio metalai: charizmatinės savybės, manija, fizinė ir cheminė galia. Kalcio ir magnio druskos. Vandens kietumas. Usunennia zhorstkostі vanduo. II grupės pagrindinio pogrupio elementų medicininė-biologinė reikšmė.
Luzhnі metė: labdaringa savybė, manija, viešpatavimas, svarbiausias spoluchy. Medicininė ir biologinė reikšmė.
Būdingas d elementų apibūdinimas. 1-os grupės antrinio pogrupio metalai. Pojdnannya midi, sribla. Medicininė ir biologinė reikšmė.
II grupės šoninių pogrupių metalai: kritinė gyvybės charakteristika, fizinė ir cheminė galia. Medicininė ir biologinė reikšmė.
Šoniniai VI, VII grupės pogrupiai: pogrupio elementų charakteristika, chromo, mangano ir jų pusės dominavimas. Medicininė ir biologinė reikšmė.
VIII grupės pogrupis: bendra pogrupio elementų charakteristika, salės galia ir jogo spolukas. Medicininė ir biologinė reikšmė.
Atsiskaitymas. Ant odos stalo priešais mokinius yra pamokos planas, azoto rūgšties sąveikos su metalais schema, reagentų rinkinys, susuktos medžiagos tvirtinimo testai.
Azoto oksidas
Mokytojas.Atspėk ir parašyk azoto oksidų formulę. Yaki oksi vadinami druskingaisiais, yaki – ne druskingaisiais? Kodėl?
Išmokite savarankiškai užrašyti penkių azoto oksidų formules, pavadinti jas, nustatyti azoto rūgščių azoto rūką ir nustatyti oksidų ir rūgščių reaktyvumą. Vienas iš mokinių užrašytas ant dosh (lentelės).
stalo
Azoto oksidų, rūgščių ir druskų nustatymas
Demonstracinis sertifikatas:
azoto(IV) oksido sąveika su vandeniu
Mokytojas. Prie laivo NE 2 įpilkite šiek tiek vandens ir išmaišykite, tada pabandykite pašalinti dėmes lakmusu.
Kas yra saugoma? Rozchin chervonіє per dvi rūgštis, kurios nusėdo.
2NO 2 + H 2 O \u003d HNO 2 + HNO 3.
Azoto oksidacijos etapas NE 2 sėkmės +4. tai yra tarpinis tarp +3 ir +5, jak in rozchini stiykish, kad azoto(IV) oksidui duodamos dvi rugstys - azoto azoto.
Sandėlis, kad Budova molekulė
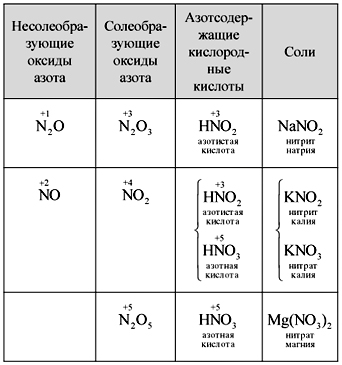
Mokytojas.Lentoje užrašykite azoto rūgšties molekulinę formulę, apskaičiuokite elementų molekulinę masę ir oksidacijos laipsnį. Sulenkite struktūrines ir elektronines formules.
Išmokite kurti tokias formules (1 pav.).
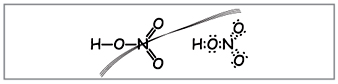
Mokytojas.Matyt, iki šių formulių aplink azotą yra apvyniota dešimt elektronų, bet jūs negalite jo naudoti, nes. azoto randama kitu periodu, o kiek įmanoma ant išorinio rutulio, naujajame, elektronų gali būti mažiau nei aukščiausi. Šis paviršutiniškumas yra nustatytas, todėl darykime prielaidą, kad tarp azoto atomo ir vieno atomo už donoro-akceptoriaus mechanizmo susidaro kovalentinis ryšys.(2 pav.).
Mal. 2. Elektroninė azoto rūgšties formulė.
Azoto atomo elektronai pažymėti juodais taškais
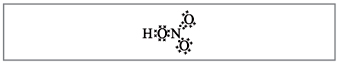
Ta pati struktūrinė azoto rūgšties formulė gali būti pavaizduota taip(3 pav.) :
Mal. 3. Azoto rūgšties struktūrinė formulė
(indikacijų donoro-akceptoriaus sujungimas su rodykle)
Tačiau paskutiniu keliu paaiškėjo, kad pagrindinė grandis yra tolygiai padalinta tarp dviejų rūgštingumo atomų. Azoto rūgštyje oksidacijos iki azoto laipsnis yra +5, o valentingumas (atskleisti pagarbą) yra daugiau nei pusė, daugiau nei pusė didelio elektroninio statymo.
Azoto rūgšties fizinė galia
Mokytojas.Prieš tai yra buteliai praskiestos ir koncentruotos azoto rūgšties. Apibūdinkite fizines galias, kurias galite numatyti.
Išmokite apibūdinti azoto rūgštį kaip vandens svarbos šaltinį, gelsvos spalvos, aštraus kvapo. Roschin azoto rūgštis be spalvos ir bekvapė.
Mokytojas. Pridursiu, kad azoto rūgšties virimo temperatūra +83 °C, užšalimo temperatūra -41 °C, tobto. didiesiems tėvynės protams. Aštrus kvapas ir tie, kurie išsaugomi nesudegs, paaiškinami tuo, kad rūgštis yra koncentruota, mažai atspari ir lengva arba kaitinama dažnai plečiasi.
Cheminė rūgšties galia
Mokytojas. Spėkite, kokias kalbas reikia bendrauti su rūgštimis?(Išmok įvardyti.)
Prieš reaguodami, pabandykite išvardyti reakcijas ir užsirašykite įspėjimus (reakcijos turėtų būti užrašytos atsižvelgiant į TED).
Ir dabar mes esame laukiniai dėl specifinių azoto rūgšties galių.
Mes išsakėme, kad rūgštis, išsaugoma, dabar atsiranda dėl cheminės reakcijos:
4HNO 3 \u003d 2H 2 O + 4NO 2 + O 2.
(Studijuokite savarankiškai, užregistruokite elektroninį reakcijos balansą.)
„Palaidoti dujas“, kuris matomas(NO2) farbuy rūgštis.
Ypač būtina rūgštį atlikti atnešant ją prie metalo. Žinote, kad iš įvairių rūgščių jie pašalindavo vandenį, bet sąveikaujant su azoto rūgštimi šis nepašalinamas.
Pažvelkite į diagramą ant savo stalo, kurioje parodyta, kaip dujos matomos įvairių koncentracijų rūgštims reaguojant su metalais.(Robotas su schema.)
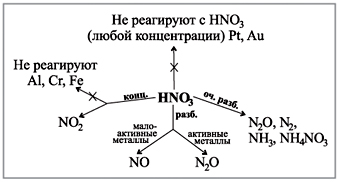
Demonstracinis sertifikatas:
koncentruotos azoto rūgšties sąveika su midumi
Dar veiksmingesnis yra azoto rūgšties (konc.) reakcijos su midi milteliais arba smulkiai supjaustytais medaus smiginio gabalėliais demonstravimas:
Išmokite savarankiškai įrašyti elektroninį reakcijos balansą:
Rūgšties turėjimas
Mokytojas. Pamoka bus nesuprantama, tarsi nematytume maistinės azoto rūgšties savybės.
Laboratorinis metodas: diya koncentruota sieros rūgštis ant nitrato (5 pav.).
NaNO3+H2SO4=NaHSO4+HNO3.
Pramonėje rūgštis daugiausia gaunama amoniako metodu.
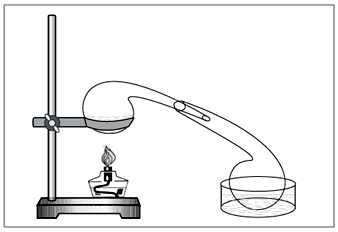
Mal. 5. Dėl azoto rūgšties pašalinimo laboratorijoje dos
rankiniu būdu išdaužyti seni cheminiai stiklo dirbiniai – replika
Rūgšties su azotu ir rūgštimi esant aukštesnei nei 2000 ° C temperatūrai metodas (elektros lankas) nepašalino jokio ypatingo išsiplėtimo.
Rusijoje azoto rūgšties įvedimo istorija siejama su chemiko-technologo Ivano Ivanovičiaus Andrejevo (1880–1919) vardu.
1915 m 1917 m. sukūręs pirmąją gamyklą rūgščių redukcijai amoniaku ir įdiegęs plėtimosi metodą gamykliniu mastu. Pirmoji buv zbudovanijos gamykla prie Donecko.
Šis metodas apima kelis veiksmus.
1) Amoniako-miltelių mišinio ruošimas.
2) Amoniako oksidacija vėl rūgštėja ant platinos lakšto:
4NH3 + 5O 2 \u003d 4NO + 6H 2 O.
3) Tolesnis oksidavimas iki azoto (II) oksido iki azoto (IV) oksido:
2NO + O2 = 2NO2.
4) Azoto oksido (IV) nustatymas vandeninėje rūgštyje:
3NO2+H2O=2HNO3+NO.
Atskiriama, kad esant rūgščiai, visas azoto oksidas (IV) paverčiamas azoto rūgštimi.
5) Paskutinis azoto rūgšties pašalinimo etapas yra dujų, pavyzdžiui, atmosferos, ir azoto oksidų valymas. Dujų saugojimas: iki 98% azoto, 2-5% rūgšties ir 0,02-0,15% azoto oksidų. (Pirmiausia naudojamas azotas, imamas amoniako oksidacijai.) Jei azoto oksidų šiose dujose yra daugiau nei 0,02 proc., tai katalizinis jų regeneravimas į azotą atliekamas specialiai, nes tokie maži šių oksidų kiekiai daro didelę žalą aplinkai. problemų.
Po viso to, kas buvo pasakyta, įrašas yra maistingas: ar mums dabar reikia rūgšties?
Rūgščių stagnacija
Mokytojas.Fermentacijai naudojama vikoristo azoto rūgštis: azoto dobrivas, pirmoje eilutėje aminonitratas (kaip jį gauti?); vibuchovo kalbos (kodėl?); barvnikovas; nitrativ, apie yakі timetsya apie ateinančią pamoką.
Tvirtinama prie medžiagos
Patirtis priekinėje klasėje
– Kodėl azoto oksidacijos greitis azoto rūgštyje yra +5, o chotiri valentingumas?
– Su kokiais metalais azoto rūgštis nepatenka į reakciją?
– Reikia žinoti druskos rūgštį ir azoto rūgštį, ant stalo yra trys metalai – varis, aliuminis ir auksas. Kaip tu kaltini ir kodėl?
Testas
1 variantas
1. Kokia skaičių serija parodo skirtumą tarp elektronų, kai energija yra lygi azoto atomuose?
1) 2, 8, 1; 2) 2, 8, 2; 3) 2, 4; 4) 2, 5.
2. Užbaikite praktinių reakcijų išlyginimą:
1) HNO 3 (rozb.) + Cu …;
2) Zn + HNO 3 (konc.) ...;
3) HNO3 + MgCO3...;
4) CuO + KNO 3 ... .
3. Pasakykite man, kaip iliustruoti vieną iš proceso etapų pramoninės gamybos azoto rūgštis.
1) 4NH3 + 5O2 = 4NO + 6H2O;
2) 5HNO3 + 3P + 2H2O = 3H3PO4 + 5NO;
3) N 2 + O 2 \u003d 2NO.
4. Neigiama oksidacijos būsena azotu pasireiškia taip:
1) N2O; 2) NE; 3) NO2; 4) Na 3 N.
5. Vario drožlių sąveika su koncentruota azoto rūgštimi gaminant iki gesinimo:
1) NO2; 2) NE; 3) Nr.2; 4) NH3.
2 variantas
1. Didžiausio azoto valentingumo vertė yra viena:
1) 1; 2) 2; 3) 5; 4) 4.
2. Galite užrašyti koncentruotos azoto rūgšties derinį su įžeidžiančiais metalais: natriu, aliuminiu, cinku, geležimi, chromu.
3. Azoto rūgščiai išgauti rinkitės kalbą, pavyzdžiui, siroviną:
1) azotas ir vanduo;
2) amoniakas, pakartotinis vanduo;
3) išleisti.
4. Koncentruota azoto rūgštis nereaguoja su:
1) anglies dioksidas;
2) druskos rūgštis;
3) anglis;
4) bario hidroksidas.
5. Sąveikaudama praskiestą rūgštį su magniu, nustatoma:
1) NO2; 2) NE; 3) N2O; 4) NH4NO3.
Vіdpovidі ant testų 1 variantas. 1 – 4;
3 – 1; 4 – 4; 5 – 1. 2 variantas. 1 – 4;
3 – 2; 4 – 1; 5 – 4. |
Tririvny Zalik patefonas 11 klasė
Tema: " NEMETAL"
Pamokos forma: salė
Tsіl: apžvelgti studentų įgytas žinias tema: „Nemetalas“; išmokti apie Aukšta įtampa nemetalas, kuris їх spoluk; toliau formuoti stosuvannya žinių įgūdžius nestandartinėse ir gyvenimiškose situacijose, individualių ir diferencijuojančių užduočių pergalėse.
vadovas:
1. Patikrinti ir įtvirtinti mokslininkų žinias apie tos pusės nemetėlius; logiškai priimti psichinės minties vystymąsi ir cheminės kasyklos laisvę; perėjimas nuo formalaus – loginio medžiagos perėmimo prie vaizdingai logiškos idėjos, pasitelkiant įvairias, įgyvendinamas ir nestandartines užduotis.
2. Ugdyti atsargumo, atlaidų apraiškos, dienos branginimo įpročius, vminnya įžvelgti šlamštą, pateisinti iškreiptus faktus, logiškai išreikšti visnovkos mintis ir robiti; skaityti rozіrkovuvati, robiti nuleisti, prognozuoti.
3. Per ugdomąją veiklą ir mokinių savarankiškumo kūrybiškumą perimti pagrindinių šviesą matančių idėjų formavimą.
4. Vikhovuvati vminnya pratsyuvati nepriklausomai nuo zastosuvannyam savęs, kad abipusės kontrolės. Parodykite zv'yazok tiems, kurie gyvena visą gyvenimą. Vihovuvati mokslinis svetoglyad remiantis vzaimozv'yazku autoritetu ir gyvenimu.
Turėdami tą reaktyvųjį: mėgintuvėliai, alkoholio lempos, mėgintuvėliai, syrniki ir kiti tipai: ; ;
; ;
;
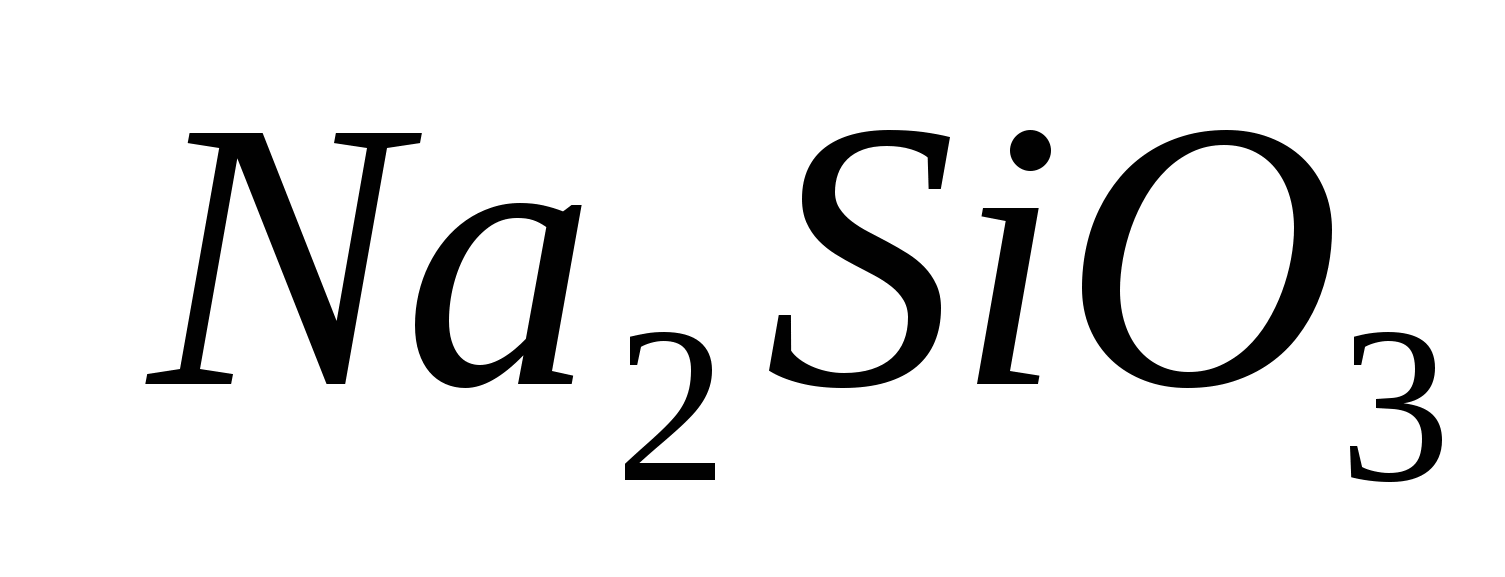 .
.
Pasiruošimas į salę.
Mokytojas parengia trijų lygių įžeidžiančių rūšių klosčių užduotį: testas, teorinė mityba, yakіsnі ir rozrahunkovі zavdannya, zavdannya kalbų transformacijai.
Mokytojas parengia mokinius, kaip jie peržiūri užduotį.
Mėnesio 1-2 dienomis biure iki durų iškabinamas informacinis lapas.
Maršruto lapas matomas odai. Darbo juodumas etapuose parodytas maršruto lapuose.
MARŠRUTO LAPAS.
F.I. mokymasis
Scenos įvardijimas
Pakopų skaičius
užsakymo numeris
Recenzento parašas
Rosrakhun problema
Pripažinimas
Reinkarnacija
Paslėpta pamoka.
Išmokite įeiti į klasę su maršruto lapais, 5 tušti lapai, su rašikliu ir eikite į sceną, pavadinimai Nr. 1. Išmokite atimti užduotį vienodai lankstyti ir laiduoti už naują raidę chi us, etape „ kalbų atpažinimas“ išlaikyti eksperimentą.
Odos stadijoje pridedamos 7 - 8 plunksnos, dar kartą patikrinamos, įdedamos į maršruto lapą, perpjaunamas, Nr.
Rezultatas nustatomas kaip visų etapų aritmetinis vidurkis.
PAPILDYMAS
„Kalbų atpažinimas“
1 plyšta
1. Pateikite jonų buvimą 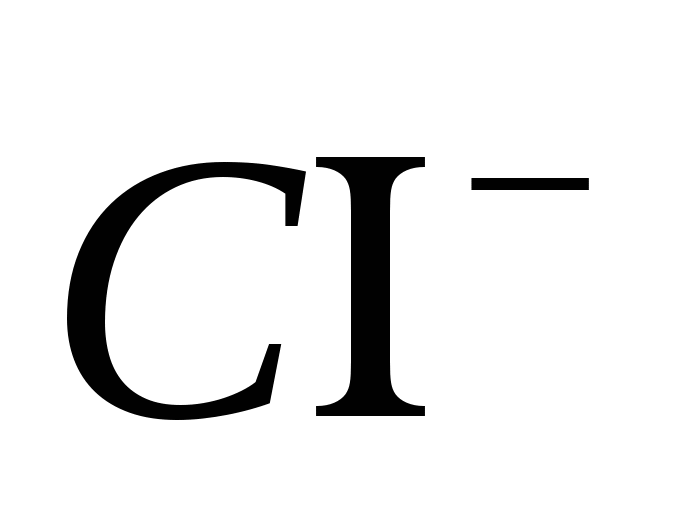
2. Atneškite jonų buvimą 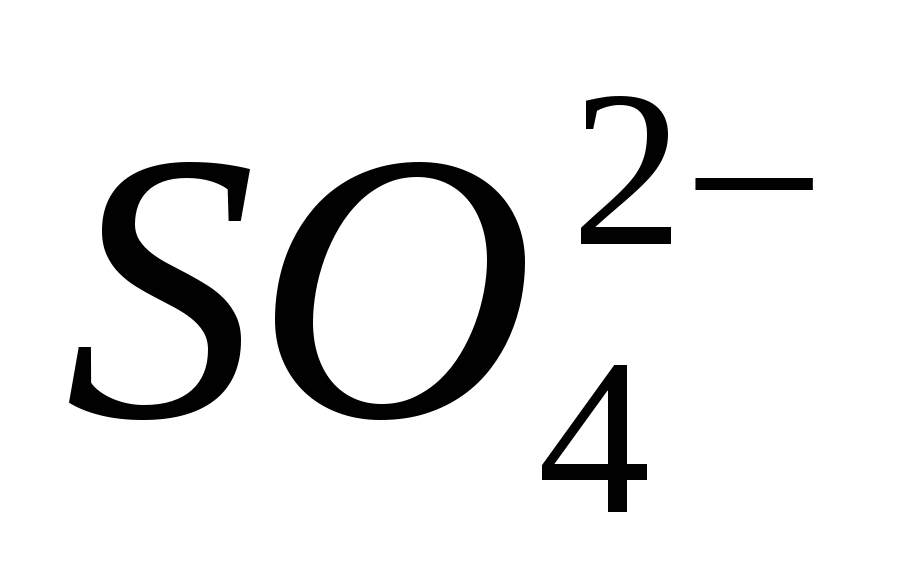
3. Įtraukite jonų buvimą 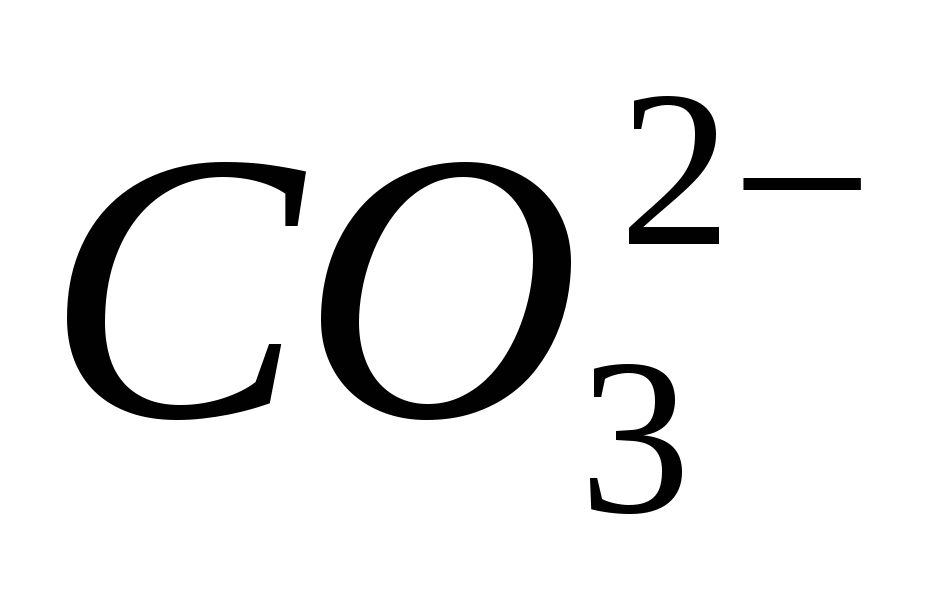
4. Įtraukite jonų buvimą 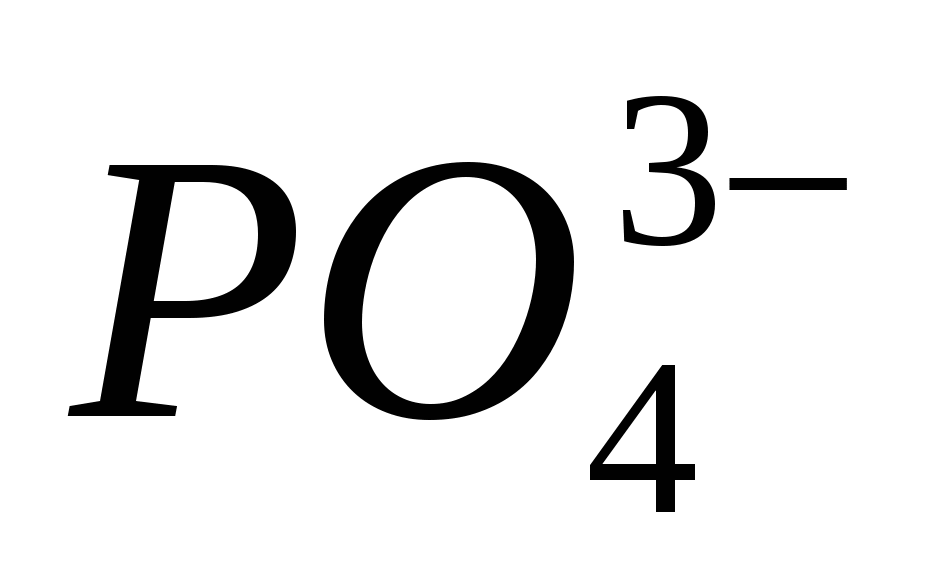
5. Įtraukite jonų buvimą 
2 perpjauti
1. Atpažinkite skirtumą vieno reagento pagalba:
2. Atpažinkite skirtumą vieno reagento pagalba:
3. Atpažinkite skirtumą vieno reagento pagalba:
4. Atpažinkite skirtumą vieno reagento pagalba: 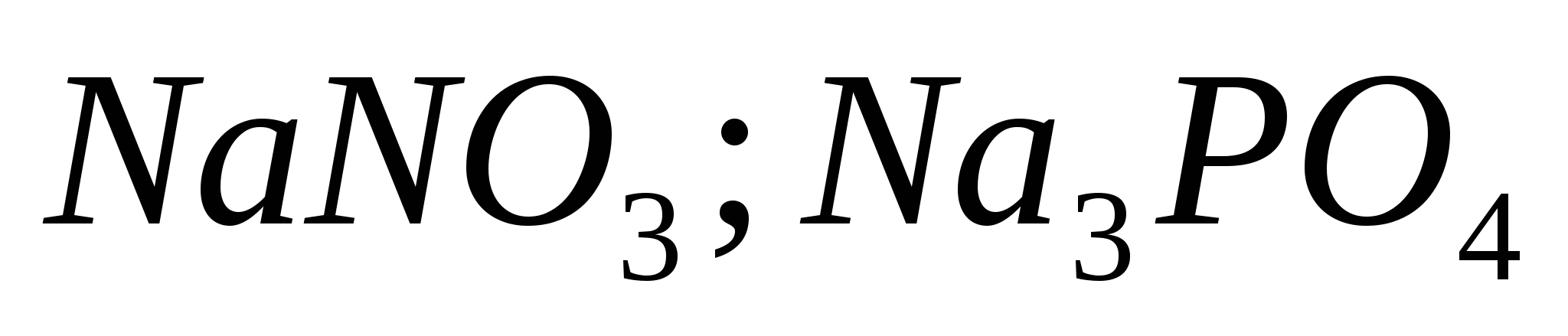 ;
;
5. Atpažinkite skirtumą vieno reagento pagalba:
3 perpjauti
1. Atpažinimas be priedų reagentų:
2. Atpažinimas be priedų reagentų:
3. Atpažinimas be priedų reagentų:
4. Atpažinimas be priedų reagentų:
5. Atpažinimas be priedų reagentų:
Etapas „Kalbų konvertavimas“
1 plyšta
1. Sustabdykite reakciją
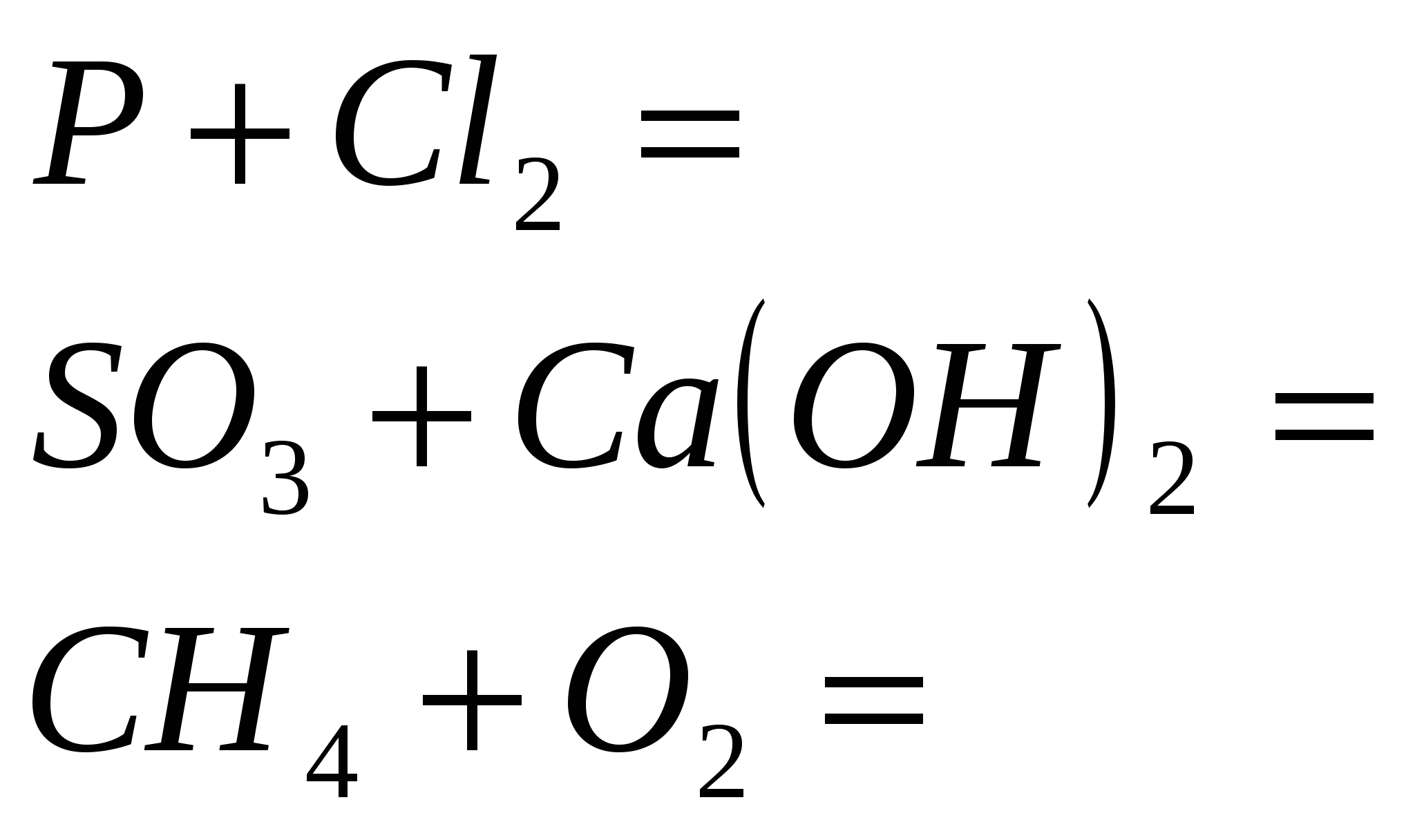
2. Užbaikite reakciją
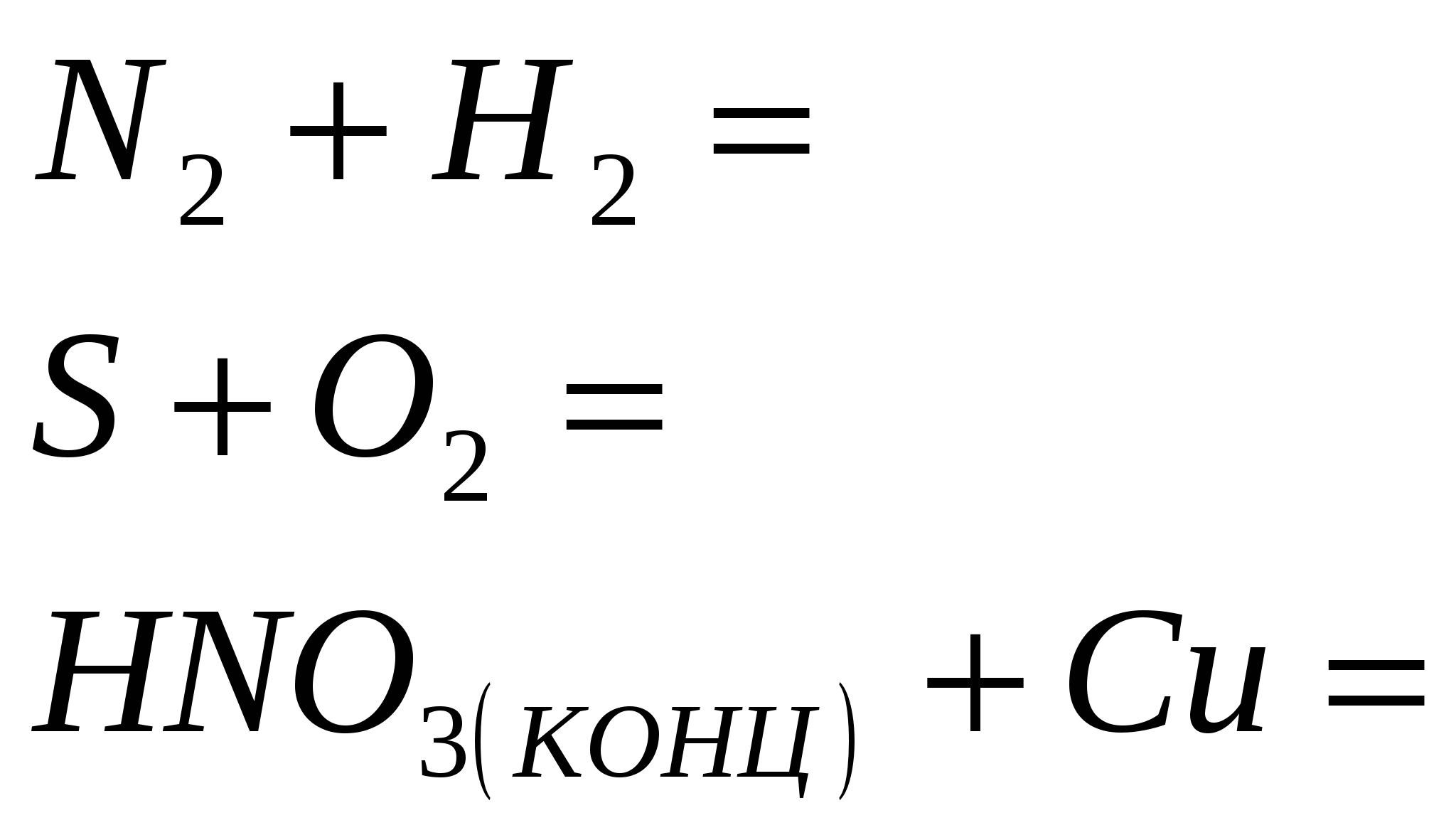
3. Užbaikite reakciją
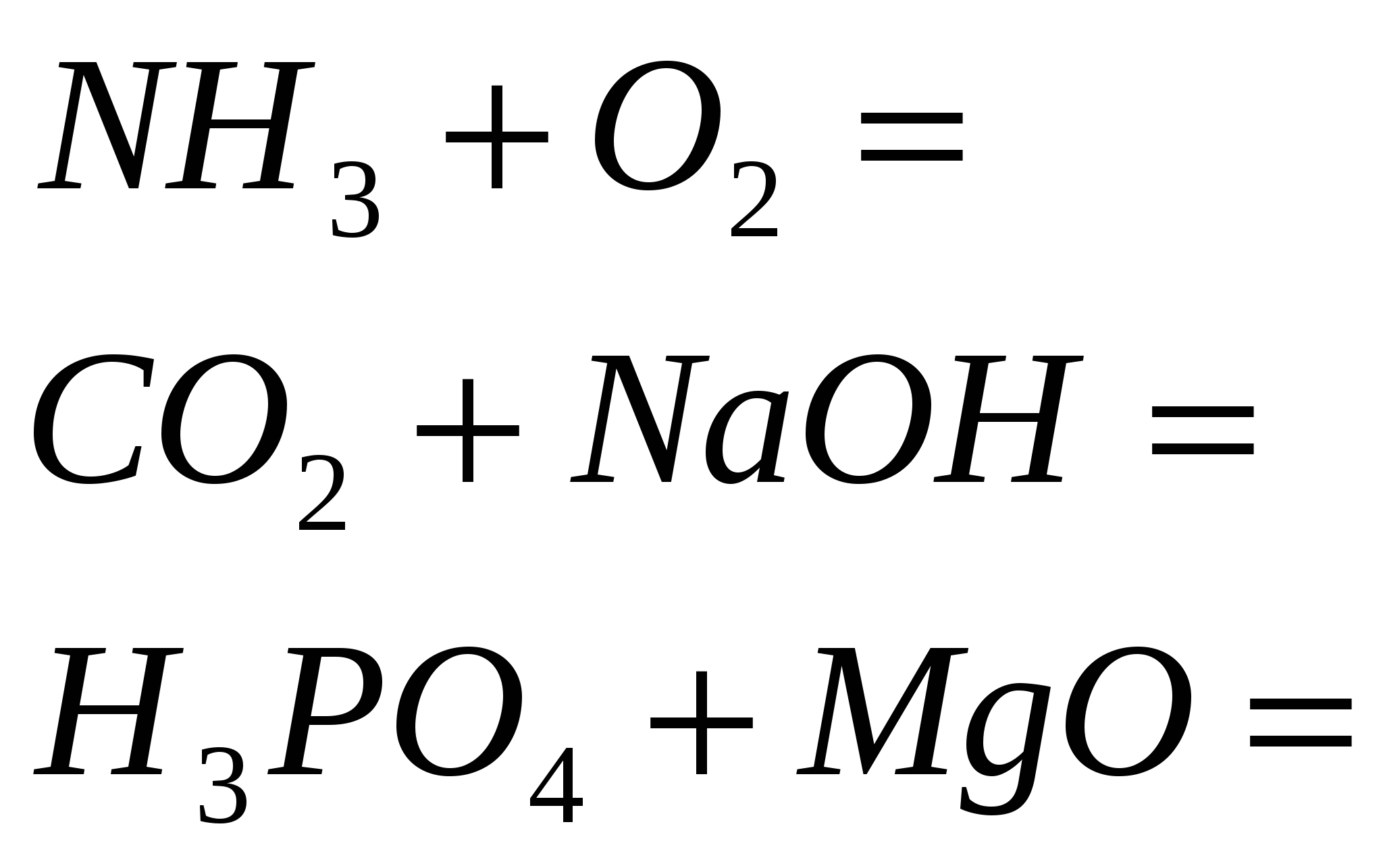
4. Užbaikite reakciją
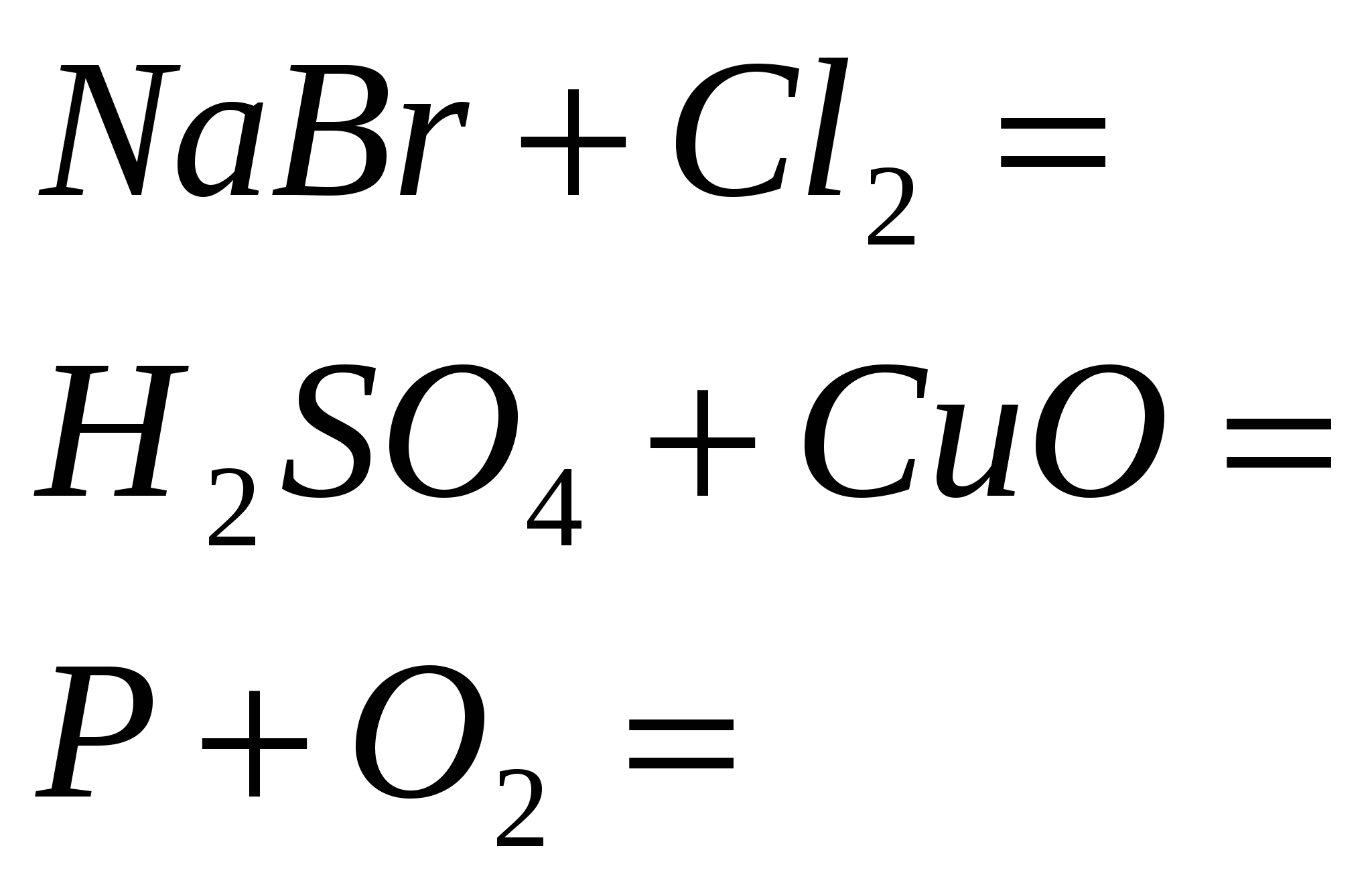
5. Užbaikite reakciją
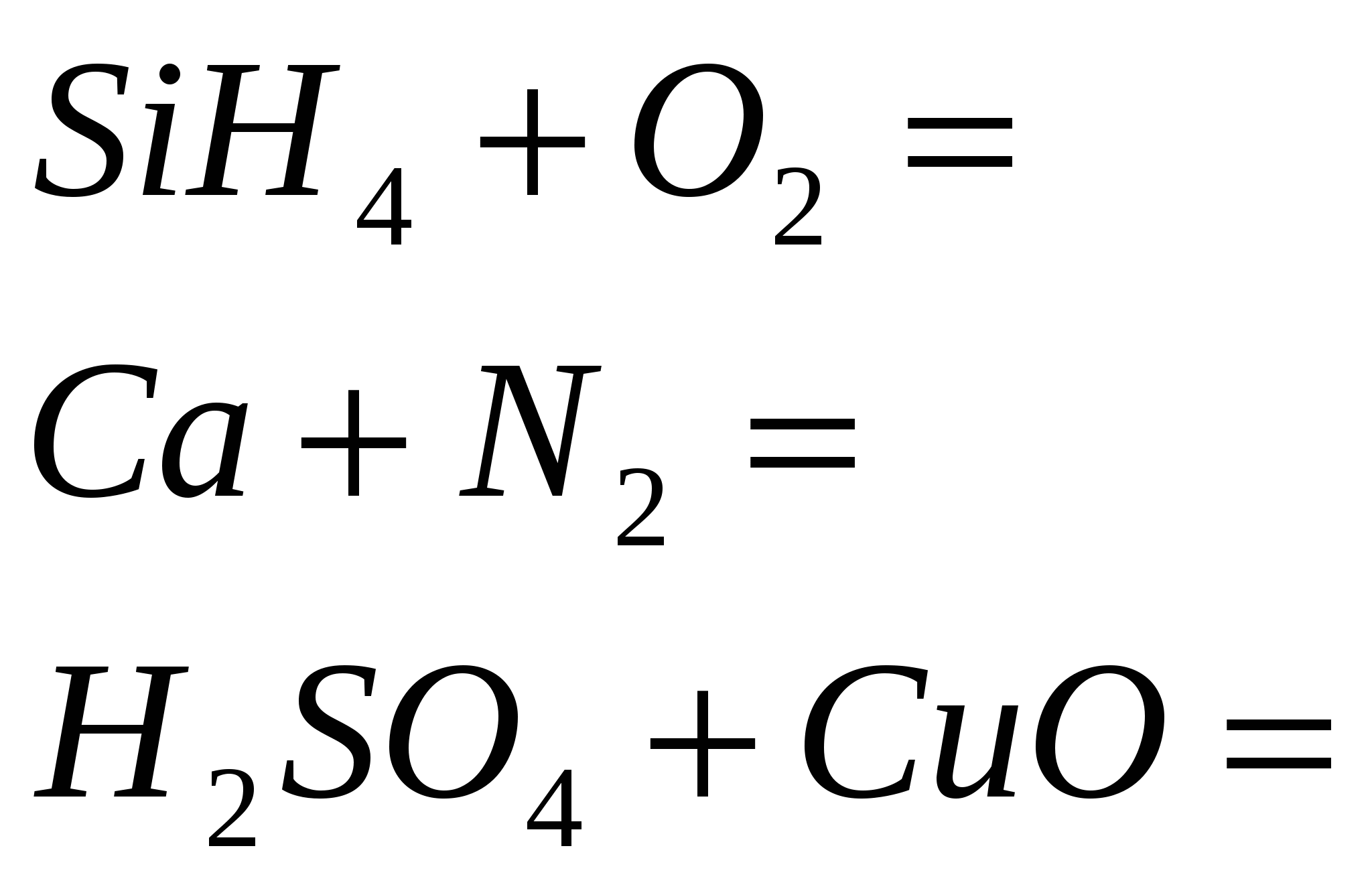
2 perpjauti
Sukurkite transformaciją:
3plyšta
Sukurkite transformaciją:
3.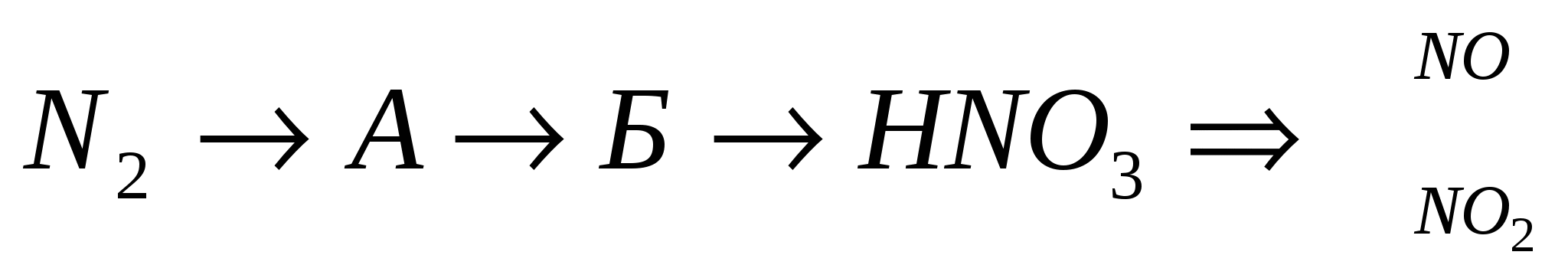
Etapas „Bandymas“
1 variantas
a) O, b) S, c) Cl, d) C, e) Si.
a) 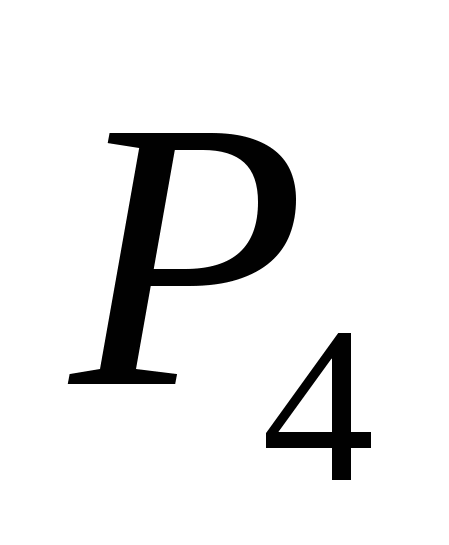 , b) C , c)
, b) C , c) 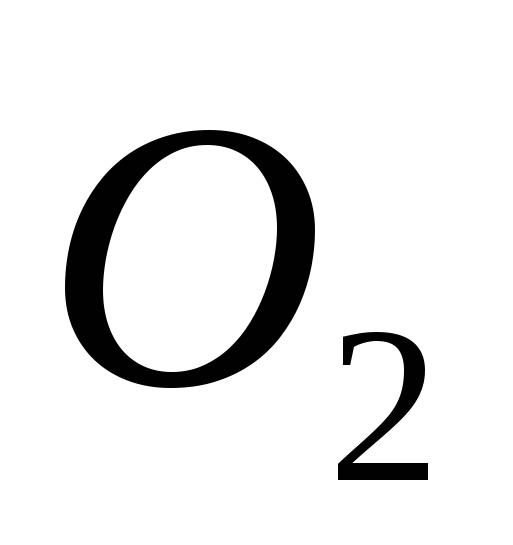 , G)
, G) 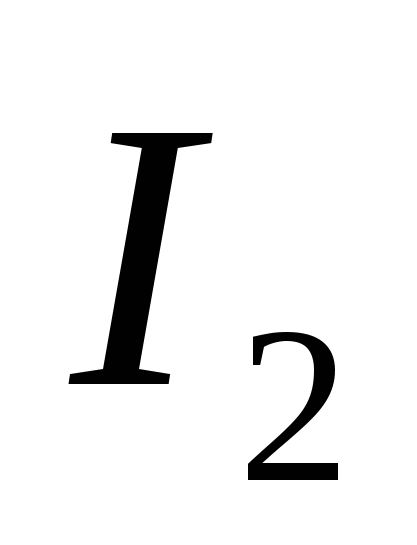 e)
e) 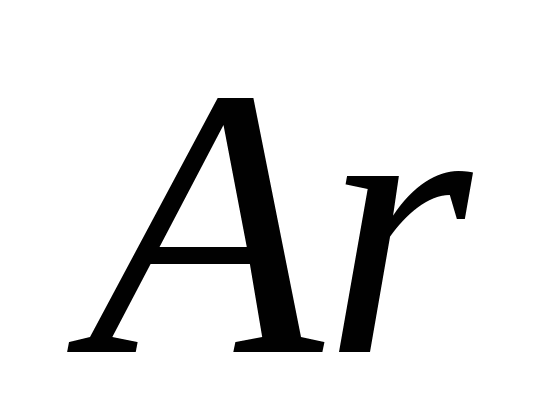 .
.
a)  , b)
, b)  , v)
, v)  , G)
, G)  e)
e)  .
.
4. Elektroninė elemento formulė. Jogo skraidantis vodnev spoluk:
a)  , b)
, b)  , v)
, v)  , G)
, G)  .
.
5. Vandenilio halogeninių rūgščių stiprumas auga iš eilės:
a) ![]()
b) 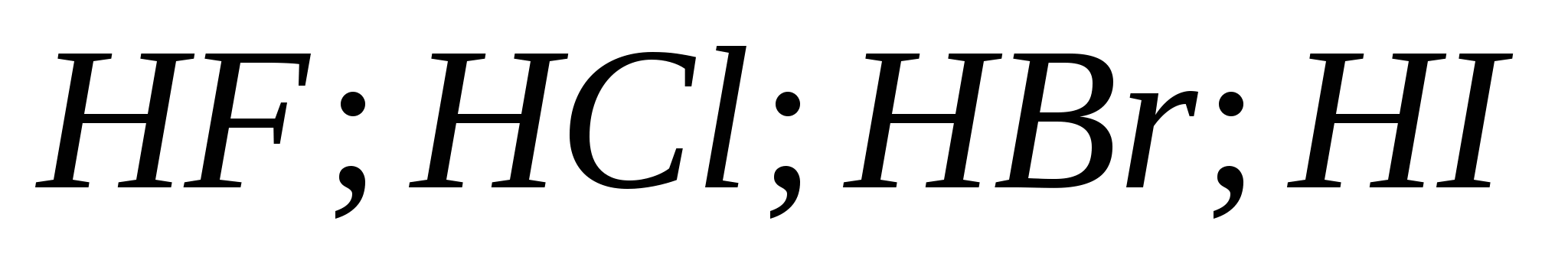
v) 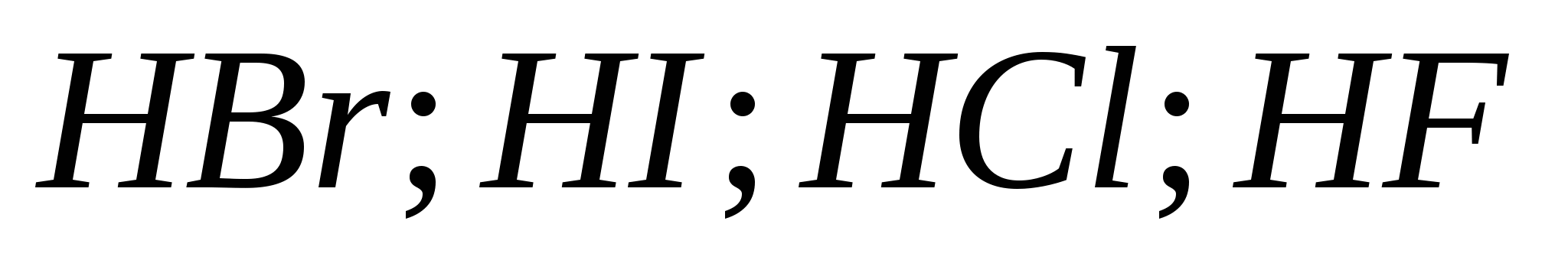
G) 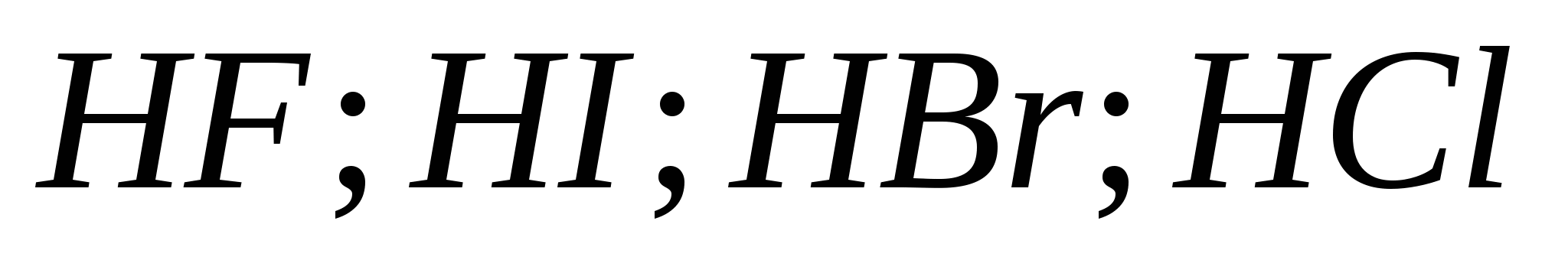
6. Nuo halogenų kovojantiems vaikams buvo užblokuota kalba:
a) fluoras; b) chloro; c) jodo; d) bromas.
7. Suskaidyta sieros rūgštis rodo oksidacinę galią atomų santykiui:
a)  , b)
, b)  , v)
, v)  .
.
8. Azoto oksidas V gali būti derinamas:
a)  , b)
, b)  , v)
, v)  , G)
, G) 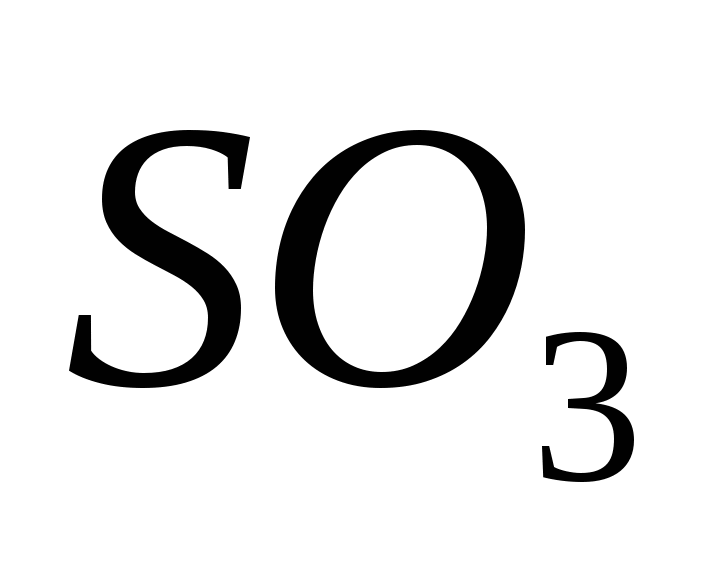 e)
e)  .
.
9. Reakcija: suteikite tokią galią amoniakui:
a) oksiduojantis, b) perteklinis, c) rūgštinis, d) šarminis.
10. Rūgščių stiprumas iš eilės
a) keisti, b) didinti, c) palaipsniui didinti, tada keisti; d) lėtai kristi, tada augti, e) nesikeisti.
2 variantas
Atominio kristalo nemokamos paprastos kalbos, patvirtintos:
a)  , b)
, b)  , v)
, v)  , G)
, G)  e)
e)  .
.
2. Dujos normalioms nuotekoms є:
a)  , b)
, b)  , v)
, v)  , G)
, G)  e)
e)  .
.
3. Alotropines modifikacijas sudaro šie elementai:
a)  , b)
, b)  , v)
, v)  , G)
, G)  e)
e)  ,
,
4. Elektroninė elemento formulė. Jogo skraidantis vodnev spoluk:
a)  , b)
, b)  , v)
, v)  , G)
, G)  e)
e)  .
.
5. Pagrindinės vasaros vandenų galios pokyčiai serijoje:
a) 
b) 
v) 
G) 
6. Norėdami užpilti chloro, galite sumaišyti įvairių koncentracijų:
a)  , b)
, b) 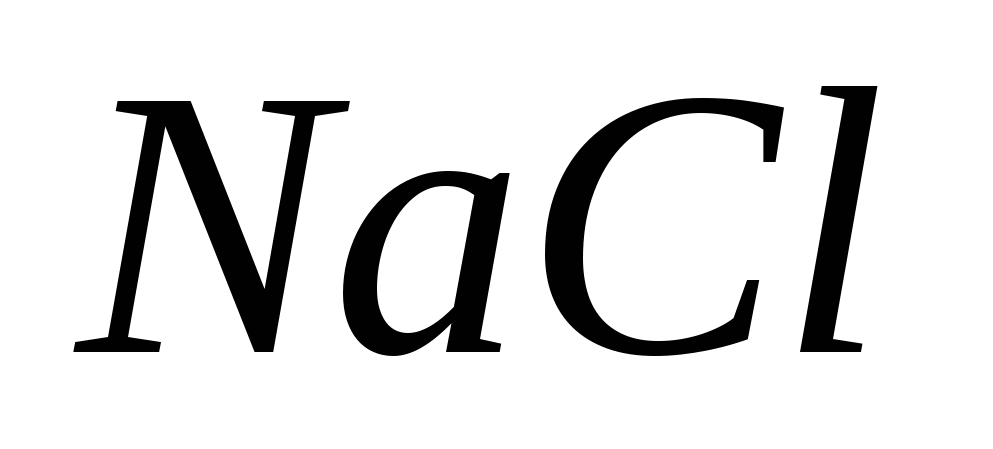 , v)
, v)  , G)
, G)  .
.
7. Koncentruota sieros rūgštis pasižymi atomų diapazono oksidacine galia:
a)  , b)
, b)  , v)
, v)  .
.
PASTABA: 9-10 teisingų atsakymų – „5“; 7-8-"4"; 5-6-"3"; mažiau nei 5-2
„Teorija“ etapas
Aš perplėšiau (ant "3")
Parašykite reakcijų lygį, apibūdinantį praskiestos sieros rūgšties galią.
Parašykite reakcijos greitį, apibūdinantį sieros oksido (VI) galią.
Parašykite reakcijų, apibūdinančių druskos rūgšties galią, lygtį.
Parašykite reakcijų, apibūdinančių fosforo (V) oksido galią, lygtį.
Parašykite lygias reakcijas, apibūdinančias amoniako galią.
II suskaldytas (ant "4")
Užrašykite II periodo nemetalų vasaros vandenų formules. Paaiškinkite, kaip ir kodėl keičiasi šios rūgštinės galios.
Užrašykite didžiausių nemetalų oksidų III periodo formules. Paaiškinkite, kaip ir kodėl keičiasi šios rūgštinės galios.
Užrašykite III periodo elementų svarbiausių rūgščių formules. Paaiškinkite, kaip ir kodėl keičiasi šios rūgštinės galios.
Užrašykite VI pogrupio nemetalų lakiųjų vandenų formules. Paaiškinkite, kaip ir kodėl keičiasi šios rūgštinės galios.
Parašykite VA pogrupio elementų svarbiausių rūgščių formules. Paaiškinkite, kaip ir kodėl keičiasi šios rūgštinės galios.
III suskaldytas (ant "5")
Subalansuokite sieros ir azoto rūgščių oksidacinę ir rūgštinę galią. Vidpovidas patvirtina vienodomis reakcijomis.
Subalansuokite sieros oksido (IV) ir anglies oksido (IV) oksidacinę ir rūgštinę galią. Vidpovidas patvirtina vienodomis reakcijomis.
Subalansuokite vandens ir fluorhidrido oksidacinę ir rūgštinę galią. Vidpovidas patvirtina vienodomis reakcijomis.
Subalansuokite koncentruotos ir praskiestos azoto rūgšties oksidacinę ir rūgštinę galią. Vidpovidas patvirtina vienodomis reakcijomis.
Išlyginkite anglies oksido (II) ir anglies oksido (IV) oksidacinę ir rūgštinę galią. Vidpovidas patvirtina vienodomis reakcijomis.
Scena „Rozrahūno užduotis“
Aš perplėšiau (ant "3")
II suskaldytas (ant "4")
Sąveikaujant su 37 g kalcio hidroksido su amonio sulfatu, buvo pašalinta 15 g amoniako. Apskaičiuokite išeinančio amoniako masės dalį.
Kai spalyuvanni rūgštus 62 g fosforo, buvo paimta 130 g fosforo (V) oksido. Apskaičiuokite išeinančio fosforo (V) oksido masės dalį.
Kiek gramų 10% natrio hidroksido reikia norint neutralizuoti 8,96 litro chloro vandens?
Iš kelių litrų anglies dvideginio galima laikyti 10 kg garų, kurie padengs 20% namų.
Kiek gramų apgulties tenka 11,2 litro anglies dioksido praleisti per 900 g 10% bario hidroksido?
III suskaldytas (ant "5")
Kokio tūrio 80% azoto rūgšties (pl. 1,46 g/ml) reikia 32 g midi "paskirstymui"?
Kiek masės midi reikės, kad reakcija su pernelyg koncentruota azoto rūgštimi gautų 4 litrus (N.O.) azoto oksido (IV), kad jogos produkcijos tūrinė dalis taptų 96%?
„Pakeitus“ sieros rūgšties koncentraciją 20 g aukso lydinio, buvo matyti 4,2 l (n.o.) sieros oksido (IV). Nurodykite šio lydinio masės dalį % midi.
Per kalio jodido paskirstymą buvo išleistos 1 litro tūrio chloro ir vandens sumišinės dujos. Mačiau 5,08 r jodo. Nustatykite chloro dujų tūrio dalį (%) išmetamųjų dujų sumoje.
Sumish silicis ir vugillya, kurių masė 10 g, buvo apdoroti pernelyg koncentruotu natrio hidroksido tirpalu. Po reakcijos buvo matyti 5,6 litro vandens (n.s.). Nurodykite šios sumos silicio masės dalį (%).
