Sujungus 28 g silicio su deguonimi. Silicio deguonies junginiai
Silicis. Bendrosios charakteristikos. Pagrindinis skirtumas nuo anglies: junginių nebuvimas junginiuose Silicidai, junginiai su vandeniliu (silanais), oksidacija ir hidrolizė, tetrafluoridas ir silicio tetrachloridas, hidrolizė, heksafluorosilikatai, deguonies junginiai, silicio dioksidas (IV). Silikatai Tirpumas ir hidrolizė Natūralūs silikatai ir aliuminio silikatai, ceolitai Organiniai silicio junginiai Silikonai ir siloksanai Silicio junginių naudojimas medicinoje.
Silicis (lat. Silicium), Si, periodinis sistemos IV grupės cheminis elementas; atominis skaičius 14, atominė masė 28.086. Silicis taip pat eksponuoja elektroninį sp3 hibridizavimą
orbitos. Iš silicio atomo išorinio elektroninio sluoksnio yra valentų 3d-
orbitos (Si: 3s23p23d0),
Silicis po deguonies yra labiausiai paplitęs plutos elementas. Skirtingai nei anglis, esančioje laisvoje būsenoje, silicis gamtoje nerastas. Dažniausiai jie yra silicio oksido (IV) SiO2 ir silicio rūgšties druskos, silikatai. Jie sudaro žemės plutos korpusą. Silicio junginiai randami augaluose ir gyvūnuose. Pagal chemines savybes, silicis, kaip ir anglis, yra ne metalas, bet jo nemetalumas yra mažiau ryškus, nes jis turi didesnį atominį spindulį
Silicis. sudaro junginius su beveik visais metalais icicidai (nerasta junginių tik su Bi, Tl, Pb, Hg). Gauta daugiau kaip 250 silicidų, kurių sudėtis (MeSi, MeSi2, Me5Si3, Me3Si, Me2Si ir tt) paprastai neatitinka klasikinių valentų. Silicidai skiriasi atsparumu ir kietumu; didžiausią praktinę reikšmę turi ferosilikonas (redukuojanti medžiaga specialiųjų lydinių lydymo procese, žr. geležies lydiniai) ir molibdeno silicidas MoSi2 (elektrinių krosnių šildytuvai, dujų turbinų mentės ir kt.).
Silanas Vandenilio chlorido rūgšties poveikis silicidams - paprasčiausias silicio junginys yra silanas SiH4:
Silanas yra nuodingas dujų kvapas, kuris savaime užsidega. oro
Jie yra reaktyvūs ir yra stiprūs reduktoriai.
reaguoti su vandeniu kambario temperatūroje:
SiH4 + 2H2O → SiO2 + 4H2,:
Tetrafluoridas Silicis gaminamas fluorinant silicio dioksidą su elementiniu fluoru.
Fluoravimo procesas atliekamas dviem etapais liepsnos reaktoriuje, nukreipiant elementinio fluoro perteklių nuo 1-ojo etapo iki 2-ojo etapo.
Techninis rezultatas - silicio gamyba nepertraukiamu režimu su dideliu derliumi ir produkto kokybe.
Silicio tetrafluoridas SiF4 susidaro hidrofluorūgšties (hidrofluorūgšties) rūgšties poveikis stiklui:
Na2Si03 + 6HF® 2NaF + SiF4 + 3H2O
Silicio deguonies junginiai
Svarbiausias deguonies junginys iš silicio yra silicio dioksidas SiO2 (silicio dioksidas), turintis keletą kristalinių modifikacijų.
Žemos temperatūros keitimas (iki 1143 K) vadinamas kvarcu. Kvarcas turi pjezoelektrinių savybių. Natūralios kvarco rūšys: roko kristalas, topazas, ametistas. Silicio veislės yra chalcedonija, opalas, agatas. jaspis, smėlis.
Silicio dioksidas yra chemiškai atsparus; jį veikia tik fluoras, fluoro rūgšties ir šarminiai tirpalai. Jis lengvai patenka į stiklinę būseną (kvarcinis stiklas). Kvarcinis stiklas yra trapus, labai chemiškai ir termiškai atsparus. Atitinkama SiO2 silicio rūgštis neturi specifinės sudėties. Paprastai silicio rūgštis įrašoma kaip xH2O-ySiO2. Pasirinktos silicio rūgštys: H2SiO3 (H2O-SiO2) - meta-silicis (trijų okso-silicis), H4Si04 (2H20-Si02) - orto-silicis (tetra-okso-silicis), H2Si2O5 (H2O * SiO2) - dimetilo silicis.
Silicio rūgštys yra blogai tirpios medžiagos. Pagal silicio mažiau metaloidinį pobūdį, palyginti su anglies dioksidu, H2SiO3 kaip elektrolitas yra silpnesnis nei H2CO3.
Pagal silicio rūgštis druskos-silikatai vandenyje yra netirpūs (išskyrus šarminių metalų silikatus). Tirpūs silikatai hidrolizuojami lygtimi
2SiO3 - + H20 = Si2O52- + 20H-.
Koncentruoti tirpių silikatų tirpalai vadinami skystu stiklu. Įprastas natrio ir kalcio stiklo silikatas turi Na20-CaO-6Si02 sudėtį. Jis gaunamas reakcijos būdu
Yra žinoma daug įvairių silikatų (tiksliau - oksosilikatų). Oksililikatų struktūroje pastebimas tam tikras reguliarumas: visi susideda iš Si04 tetraedro, kuris yra tarpusavyje sujungtas per deguonies atomą. Dažniausiai naudojami tetrahedra deriniai yra (Si2O76-), (Si3O9) 6-, (Si40l2) 8-, (Si6O1812-), kurie, kaip struktūriniai vienetai, gali būti sujungti į grandines, juosteles, tinklus ir skeletus (4 pav.).
Svarbiausi natūralūs silikatai yra, pavyzdžiui, talkas (3MO * H20-4Si02) ir asbestas (SmgO * H2O * SiO2). Kaip ir SiO2, silikatams būdinga stiklinė (amorfinė) būsena. Kontroliuojant stiklo kristalizaciją, galima gauti smulkios kristalinės būsenos (sitalls). Sitalls pasižymi didesne jėga.
Be silikatų, aliuminio silikatai yra plačiai paplitę. Aliuminio silikatai - rėmo oksosilikatai, kuriuose silicio atomų dalis pakeičiama trivalentu Al; pvz., Na12 [(Si, Al) 04] 12.
Silicio rūgšties atveju koloidinė būsena yra būdinga, kai rūgšties H2SiO3 druskos nepaveikia. Koloidiniai silicio rūgšties (solų) tirpalai tam tikromis sąlygomis (pvz., Kaitinant) gali būti paversti skaidria, vienalyčiu silicio rūgšties gelio masės gelu. Geliai yra didelio molekulinio kiekio junginiai, turintys erdvinę, labai laisvai sukauptą struktūrą, kurią sudaro SiO2 molekulės, kurių tuštumai užpildyti H2O molekulėmis. Dehidratuojant silikagelį, gaunamas silikagelis - akytas produktas, pasižymintis dideliu adsorbcijos pajėgumu.
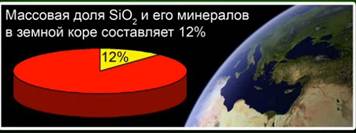
Silicio oksidas (IV) (silicio dioksidas) - labiausiai paplitęs žemės plutos junginys, sudarantis 12% jo masės įvairių mineralų pavidalu. Skirti kristalinį ir amorfinį silicio dioksidą. Paprasčiausia silicio oksido (IV) formulė yra SiO2. Jis kristalizuojasi atominėje grotelėje.
1) kristalinis silicio dioksidas - kvarco ir jo veislių (roko kristalų, chalcedonio, agato, jaspio, flinto) mineralų pavidalu; kvarcas yra kvarco smėlio, plačiai naudojamo statyboje ir silikato pramonėje, pagrindas.
2) amorfinis silicio dioksidas - opalinės mineralinės kompozicijos SiO2 nH2O forma; žemės amorfinės silicio formos yra diatomitas, Tripolis (infuzinė žemė); Dirbtinio amorfinio bevandenio silicio dioksido pavyzdys yra silikagelis, gaunamas iš natrio metasilikato:
Na2Si03 + 2HCl = 2NaCl + H2SiO3
Silikagelis turi išsivystytą paviršių, todėl gerai sugeria drėgmę.
Silikagelis yra džiovintas gelis, susidaręs iš viršsotintų silicio rūgšties (nSiO2 · mH2O) tirpalų, esant pH\u003e 5-6. Kietas hidrofilinis sorbentas.
Gauti
Jis gaunamas parūgštinant šarminių metalų silikato tirpalus, po to nuplaunant ir džiovinant gautą gelį:
Silicio rūgštis. SiO2 yra daugelio silicio rūgščių anhidridas
Silicio rūgštis yra pastatyta iš tetraedrinių struktūrinių vienetų (kiekviename tokiame vienete silicio atomas yra tetrahedrono centre, o deguonies atomai yra viršutinėse dalyse). Struktūrinės jungtys, jungiančios grandines, sudaro stabilesnes polisilicines rūgštis:
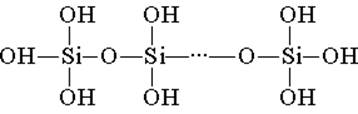
Tokio junginio kompozicija gali būti išreikšta formule (H2SiO3) n. Tačiau silicio rūgštis paprastai yra formulė H2SiO3. H2SiO3 - rūgštis yra labai silpna, mažai tirpsta vandenyje. Šildant, jis lengvai suyra tokiu pat būdu, kaip anglies rūgštis:
Visos silicio rūgštys yra labai silpnos (silpnesnės už anglis).
Silikatai. Visų silicio rūgščių druskos yra vadinamos silikatais, nors paprastai švietimo literatūroje silikatai reiškia metacilo rūgšties druskas. Jų sudėtį paprastai sudaro formulė elementų oksidų junginių pavidalu. Pavyzdžiui, kalcio silikatas CaSiO3 gali būti išreikštas kaip: CaO × SiO2.
R2O × nSiO2 kompozicijos silikatai, kur R2O yra natrio arba kalio oksidai, vadinami tirpiais stiklais, o jų koncentruoti vandeniniai tirpalai vadinami skystu stiklu. Svarbiausia yra natrio tirpusis stiklas.
Silikatų tirpalai auga ore, nes anglies dioksidas (IV) ore pakeičia druskos rūgštį iš jo druskų:
Silicio rūgštis yra beveik netirpi vandenyje - ši savybė naudojama kaip kokybinė reakcija į jonų SiO32-.
Silikatai gaunami sujungus silicio dioksidą su šarmais arba karbonatais:
Silicio rūgšties tirpumas ir jo ištirpinimo greitis priklauso nuo kelių veiksnių, iš kurių svarbiausia yra paimto silicio dioksido modifikacija, dispersijos laipsnis ir temperatūra. Kratant silikagelį vandeniu, tirpumo pusiausvyra nustatoma per kelias valandas, kvarco atveju - daug mėnesių ir net metų.
GAMTINIAI SILICATAI (iš lotynų. silex, genties. silicio atveju - flint * a. natūralūs silikatai; N. naturliche Silikate; F. silikatų naturels ir. Gamtinių silikatų dalis sudaro iki 75% žemės plutos masės ir apie 25% mineralinių rūšių. Gamtoje žinoma daugiau kaip 700 natūralių silikatų, įskaitant svarbiausius uolienų formavimo mineralus (lauko špatas, piroksenus, amfiboles, mikas ir kt.).
Aliuminio silikatai - natūralių ir sintetinių silikatų, kurių sudėtiniai anijonai yra silicis ir aliuminis, grupė. Kompleksinių anijonų pavyzdžiai: -, -, 2 -. Na +, K +, Mg2 +, Ca2 +, o kartais Ba2 + ir Li + veikia kaip katijonai.
Natūralūs mineralai yra natūralūs aliuminio silikatai, jie sudaro iki 50% žemės plutos masės. Tai apima lauko špatas (albitas, ortoklazė, anortitas), molio mineralai ir žėručio.
Ceolitai - Tai vandeniniai kalcio, natrio, kalio, bario ir kai kurių kitų elementų aliuminio silikatai. Zeolitų grupėje yra daugiau kaip keturiasdešimt mineralinių medžiagų, kurios skiriasi sudėtimi (ypač vandens molekulių skaičiumi kristaliniame hidrate) ir, žinoma, fizikinėse ir cheminėse savybėse. Tačiau beveik visi šios mineralų grupės atstovai turi bendrą bruožą - jie yra geri sorbentai, turi jonų mainų savybes, sugeba keisti atskirų jonų mobilumą ir dirbti kaip molekuliniai sietai. Ir palyginti neseniai šie mineralai naudojo visiškai netikėtą naudojimą - jie pradėjo būti naudojami žemės ūkyje.
Organiniai silicio junginiai - junginiai, kurių molekulėse yra ryšys tarp silicio ir anglies atomų. Organiniai silicio junginiai kartais vadinami silikonais iš Lotynų silicio pavadinimo „silicis“. Organiniai silicio junginiai naudojami tepalų, polimerų, gumos, gumos, silikoninių skysčių ir emulsijų gamybai. Organiniai silicio junginiai naudojami kosmetikoje, buitinėse chemikose, dažuose ir lakuose, plovikliuose. Produktų, kurių pagrindinė sudėtinė dalis yra organiniai junginiai, išskirtinis požymis yra paprastai aukštesnės eksploatacinės charakteristikos ir charakteristikos, taip pat žmonių saugumas. Silikoniniai polimerai gali būti naudojami ruošiant liejimo formas. Organinių silicio junginių ir hermetikų polimerizacija yra saugi žmonėms ir nereikalauja ekstrahavimo.
Siloksanai - junginiai, turintys kintamo silicio ir deguonies atomų molekulėje. Didžiausi yra didelio molekulinio svorio siloksanai - poliorganosiloksanai; žr. Silikono polimerai.
Silikonai (poliorganosiloksanai) - deguonimi didelio molekulinio svorio organiniai silicio junginiai, kurių cheminė formulė yra n, kur R = organinė grupė (metilas, etilas arba fenilas). Dabar šis apibrėžimas yra labai retai laikomas, ir poliorganosiloksanai (pvz., PMS tipo silikoninės alyvos, NGL tipo vandens repelentai arba mažos molekulinės masės SKTN gumos) ir net organiniai silikoniniai monomerai (įvairūs silanai) taip pat yra sujungti į "silikonus", ištrinant skirtumą tarp "silikono" ir "silikono". silikono. "
Metalinis silicis  Crystal Silicon
Crystal Silicon
Silicis (Si). Šis cheminis elementas yra 1/4 žemės plutos sudėties. Kvarcas, roko kristalas, smėlis, molis, granitas, žėručio, asbesto - visa tai cheminiai silicio junginiai
Silicis yra tarpinis elementas (amfoterinis) ir gali turėti ir metalines, ir nemetalines savybes. Jis gali sudaryti cheminius junginius tiek su metalais, tiek su ne metalais.
Grynas silicis - chemiškai paprasta pilka spalva, kieta, ugniai atspari ir trapi. Crystal Silicon Jis turi metalinį blizgesį ir yra plačiai naudojamas puslaidininkių pramonėje (tai yra puslaidininkis).
Silicis gali ištempti kaip kristalinėje būsenoje ( kristalinis silicis) ir amorfinėje būsenoje ( amorfinis silicis). Kristalinis silicis susidaro aušinant metalo amorfinio silicio tirpalą. Savo ruožtu, kristalinis silicis yra labai trapi medžiaga ir lengvai susmulkinamas į amorfinį miltelį. Taigi, amorfinis silicis yra kristalinio silicio kristalų fragmentas.
Laisvoje padėtyje silicis yra gana sunku. Jos pramoninė gamyba yra susijusi su kvarco regeneravimu, kurio cheminė formulė yra SiO 2, redukcijos reakcija gaminama karštuoju koksu (anglimi).
SiO 2 + C → CO 2 + Si
Laboratorijoje grynas silicis sumažinamas iš silicio smėlio metaliniu magniju, naudojant tokią reakciją:
SiO 2 + 2Mg → Si + 2MgO.
Šios reakcijos metu susidaro rudi amorfinio silicio milteliai. Įkaitinus milteliai lėtai gali reaguoti su koncentruotais šarmų tirpalais (pvz., Natrio hidroksido NaOH).
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2, - gauta kompleksinė medžiaga - dar vadinama skystu stiklu.
Įdomu, kad silicio cheminis aktyvumas priklauso nuo jo kristalų dydžio. Ko-kristalinis silicis yra mažiau chemiškai aktyvus nei amorfinis. Pastarasis lengvai reaguoja su fluoru net esant įprastai temperatūrai ir esant 400 - 600 ° C temperatūrai, jis reaguoja su deguonimi, chloru, bromu, siera, kad susidarytų atitinkami cheminiai junginiai. Labai aukštoje temperatūroje silicis reaguoja su azotu ir anglies dvideginiu, kad susidarytų atitinkamai nitridas ir silicio karbidas.
Jei bandysite ištirpinti silicį hidrofluorinių HF (hidrofluorinių) ir nitratinių HNO 3 rūgščių mišinyje, reakcija nebus tęsiama. Bet jei cheminę reakciją atliksite su šarmu, pavyzdžiui, kalio hidroksidu, reakcija vyksta susidarius silicio rūgšties druskai
Si + KOH → K 2 SiO 3 + H 2
Jei kalcis krosnyje (smėlis) su koksu, pasirodo labai kieta kristalinė medžiaga. Carborundum SiC
SiO 2 + 3C → SiC + 2CO
Carborundum - labai kieta ir ugniai atspari medžiaga. Pramonėje ši savybė gaminama dideliais kiekiais. Įdomu tai, kad karborundo kristalų grotelės yra panašios į sunkiausių medžiagų - deimantų - groteles, tačiau jame atskiras anglies atomas yra vienodai pakeistas silicio atomais.
Aukštoje temperatūroje, taip pat cheminių reakcijų metu, kai rūgštys veikia metaliniuose junginiuose su siliciu, silanas SiH 4.
Silanas - tai savaime užsidegantis bespalvis dujas. Jis gali užsidegti ore, kad susidarytų silicis ir vanduo.
SiH4 + 2O2\u003e → Si02 + 2H2O
Jei silicio oksidas SiO 2 yra kaitinamas anglies, chloro sraute, vyksta cheminė reakcija su silicio chlorido susidarymu.
Si02 + 2C + 2Cl2 → SiCl4 + 2CO
Silicio chloridas - tai yra skystis, kurio virimo temperatūra yra tik 54 0 C. Silicio chloridas lengvai ištirpinamas vandenyje, susidarant dviejų rūgščių tirpalui: siliciui ir vandenilio chloridui.
SiCl4 + H2O → H 2 SiO 3 + HCl
Jei ši cheminė reakcija vyksta drėgno oro atmosferoje, susidaro dvi storos dūmai.
Silicio fluoridas SiF 4 - susidaro dėl cheminės hidrofluorūgšties ir silicio oksido reakcijos
Si02 + 4HF → SiF4 + 2H2O
Silicio fluoridas yra bespalvis dujų "stiprus" kvapas. Kaip ir silicio chloridas, vandenyje ši dujos sudaro dvi rūgštis: silicį ir hidrofluorą. Tačiau įdomu, kad silicio fluoridas gali susidaryti su hidrofluorūgštimi heksafluorio rūgšties rūgštis kurio cheminė formulė yra H 2 SiF 6. Jo druskos ir pati rūgštis yra nuodingos.
Silicis
Netaurieji metalai ir nemetalai
Šioje pamokoje jūs ištirsite „Silicio“ temą. Apsvarstykite informaciją apie silicį: jos elektroninę struktūrą, kur silicis yra gamtoje, ištirti silicio allotropiją, paaiškinti jo fizines ir chemines savybes. Sužinokite, kur silicis naudojamas pramonėje ir kitose srityse, kaip jis gaminamas. Su silicio rūgštimi, silicio rūgštimi ir jos druskomis - silikatu.
Tema: Pagrindiniai metalai ir nemetalai
Pamoka: Silicis. Noble dujos
Silicis yra vienas iš labiausiai paplitusių cheminių elementų žemės plutoje. Jo kiekis yra beveik 30%. Gamtoje jis dažniausiai randamas įvairių formų silicio dioksido, silikatų ir aliuminio silikatų pavidalu.
Silicis tetravalentinis beveik visuose jo junginiuose. Tokiu atveju silicio atomai yra sužadinti. Fig. 1.
Norėdami eiti į šią būseną, vienas iš 3s elektronų užima laisvą vietą 3p orbituose. Tokiu atveju vietoj 2 nesusijusių elektronų įžeminimo būsenoje, sužadintos būsenos silicio atomas turės 4 nesusijusius elektronus. Jis galės sudaryti 4 kovalentines obligacijas mainų mechanizmu.


Silicio atomai nėra linkę į daugialypių ryšių formavimąsi, bet suformuoja junginius su vienintelėmis jungtimis-Si-O-. Silicis, skirtingai nei anglis, nėra tipiškas alotropijai.
Vienas iš allotropinis modifikavimas yra kristalinis siliciskurioje kiekvienas silicio atomas yra sp 3 hibridizacijoje. Fig. 2, 3. Kristalinis silicis yra kieta, ugniai atspari ir patvari tamsiai pilka kristalinė medžiaga su metaliniu blizgesiu. Normaliomis sąlygomis - puslaidininkis. Kartais amorfinis silicis taip pat išskiriamas kaip kitas silicio allotropinis modifikavimas. Tai yra tamsiai rudi milteliai, chemiškai aktyvesni nei kristalinis silicis. Ar tai yra allotropinis pakeitimas, yra ginčytinas dalykas.
Silicio cheminės savybės
1. Sąveika su halogenais
Si + 2F 2 → SiF 4
2. Šildant, susidaro silicio deguonis, susidaro silicio dioksidas (IV).
Si + O 2 → SiO 2
3. Aukštoje temperatūroje silicis sąveikauja su azotu arba anglies.
3Si + 2N 2 → Si 3 N 4
4. Silicis nereaguoja su vandeniniais rūgščių tirpalais. Bet jis ištirpsta šarmuose.
Si + 2NaOH + H2O → Na 2 SiO 3 + 2H2
5. Kai silicis susilieja su metalais, susidaro silicidai.
Si + 2Mg → Mg 2 Si
6. Silicis tiesiogiai nesąveikauja su vandeniliu, bet silicio junginius vandenyje galima gauti vandenilio junginiais.
Mg2Si + 4H2O → 2Mg (OH) 2 + SiH4 (silanas)
Silanai struktūroje panašūs į alkanus, tačiau yra žymiai reaktyvūs. Stabiliausias monosilanas yra degus ore.
SiH4 + 2O2 → Si02 + 2H2O
Silicio gavimas
Silicis gaunamas redukuojant iš silicio oksido (IV)
SiO 2 + 2Mg → Si + 2MgO
Viena iš užduočių yra gauti labai gryną silicį. Šiuo tikslu techninis silicis perkeliamas į silicio tetrachloridą. Gautas tetrachloridas redukuojamas iki silano, o silanas suyra į silicį ir vandenilį.
Silicis gali sudaryti du oksidus: Si02 - silicio oksidą (IV) ir SiO - silicio oksidą (II).
SiO - silicio oksidas (II) - tai yra amorfinė tamsiai ruda medžiaga, kurią sudaro silicio ir silicio oksido (IV) sąveika.
Si + Sio 2 → 2 Sio.
Nepaisant stabilumo, ši medžiaga beveik niekada nenaudojama.
SiO 2 - silicio oksidas (IV)


Ši medžiaga sudaro 12% žemės plutos. Fig. 4. Jį reprezentuoja tokie mineralai kaip roko kristalas, kvarcas, ametistas, citrinas, jaspis, kalcedonas. Fig. 5
SiO 2 - silicio oksidas (IV) - ne molekulinės struktūros medžiaga.
Jo kristalų grotelės yra atominės. Fig. 6. SiO 2 kristalai yra tetrahedrono formos, kurios yra tarpusavyje susijusios su deguonies atomais. (SiO 2) n molekulės formulė būtų tikslesnė. Kadangi SiO 2 sudaro molekulinės struktūros atominės struktūros ir CO 2 medžiagą, jų savybių skirtumas yra akivaizdus. CO 2 yra dujos, o Si02 yra kieta, skaidri, kristalinė medžiaga, netirpi vandenyje ir ugniai atsparioje medžiagoje.
Cheminės savybėsSiApie 2
1. Silicio oksidas (IV) Si02 yra rūgšties oksidas. Jis nereaguoja su vandeniu. Silicio rūgštis negali būti gaunama hidrinant SiO 2. Jos druskos, silikatai gali būti gaunami reaguojant SiO 2 su karštais šarminiais tirpalais.
Si02 + 2NaOH Na 2 SiO 3 + H20
2. Reaguoja su šarminių ir šarminių žemių metalų karbonatais.
CaCO 3 + SiO 2 CaSiO 3 + CO 2
3. Sąveikauja su metalais.
SiO 2 + 2Mg → Si + 2MgO
4. Reakcija su fluoro rūgštimi.
Si02 + 4HF → SiF4 + 2H2O
SiF 4 + 2HF → H2
Silicio rūgšties ir silikatų cheminės savybės
Silicio rūgšties gavimas
Silicio rūgštis nusodina kaip polimerinis junginys. Silicio rūgšties formulės -
H 2 SiO 3 (meta forma) ir H4 SiO 4 (orto forma) - atspindi elementų santykį, bet ne tikrąją sudėtį. Paprastai plokštumoje silicio rūgšties sudėtis yra pavaizduota kaip 7
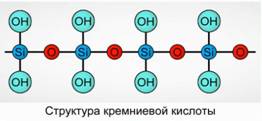
Silicio rūgščiai visada naudojama formulė H 2 SiO 3.
1. H 2 Sio 3 šildomas
H 2 SiO 3H 2O + Si02 (silikagelis)
2. Sąveikauja su šarminiais tirpalais
H 2 SiO 3 + 2NaOH Na 2 SiO 3 + 2H 2 O
Silicio rūgšties druskos - silikatai - nurodyti jonų junginius. Tai yra kietos bespalvės medžiagos. Tik šarminių metalų silikatai, išskyrus ličio, tirpsta vandenyje.
1. Tirpūs silikatai hidrolizuojami anijonu
Na 2 SiO 3 + H2O HS NaHSio 3 + NaOH
2. Tirpūs silikatai sąveikauja su stipriomis rūgštimis.
Na 2 SiO 3 + 2HCl → H2 SiO 3 ↓ + 2NaCl
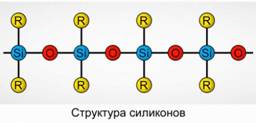
Poliorganosiloksanai (silikonai)
Poliorganosiloksanai (silikonai) yra deguoniniai, didelio molekulinio svorio organiniai silicio junginiai.
R 2 [ Sio] n
R yra organinė grupė (metilas, etilas arba fenilas). Siloksanų struktūros pagrindas yra kintančių silicio atomų ir deguonies grandinė. 8 pav. Keičiant grandinės ilgį ir organines grupes, galima gauti skirtingų savybių turinčius silikonus. Keičiant polimerizacijos sąlygas, galite gauti skirtingo ilgio molekules.


Trumpieji grandinės polimerai yra skysčiai, ilgesni yra vertingi tepalai. Fig. 9, kurie išlaiko savo savybes didžiuliame temperatūros diapazone nuo
100 0 С - + 300 0 C. Ilgesnės molekulės sudaro guma, kuri nepraranda elastingumo esant žemai temperatūrai. Turi didelį atsparumą dilimui, chemiškai inertiški. Fig. 10. Tai sukelia įvairius jų taikymo variantus. Jie gali būti naudojami dirbtinėms širdies ar inkstų mašinoms kurti ir gali būti naudojamos batų batus. Siloksano polimerai naudojami medicinoje įvairių minkštųjų audinių implantų kūrimui, nes tokie polimerai yra chemiškai inertiški ir nėra atmetami organizme. Jie nėra sudrėkinti vandeniu. Jis naudojamas kremuose. Taikant šį kremą ant rankų jis pakeis gumines pirštines.
Neorganinis sodas
Skaidrioje stiklinėje, pripildyto natrio silikatu, supilkite spalvotų druskų kristalus, pavyzdžiui, vario sulfatą. Po tam tikro laiko matyti, kad iš kristalų susidaro ploni tuščiaviduriai vamzdžiai, sudaryti iš netirpių silikatų. Fig. 11

„Kvailas“ glaistas
Sumaišomi vienodi natrio silikato ir medicininio alkoholio kiekiai. Nuosėdos nufiltruojamos ir išspaudžiamos taip, kad nenukristų alkoholio. Tai glaistas. Fig. 12. Tai pavadinta taip, nes buvo numatyta ją naudoti kaip glaistą langams. Tačiau paaiškėjo, kad ji turi tokias savybes, kad jos nebūtų galima naudoti pagal paskirtį. Jei sukite rutulį ir išmeskite jį ant grindų, jis atsimena kaip guminis rutulys. Jei ant stalo, tai bus plinta kaip skystis. Jei paspausite kietą objektą, jis susilieja kaip kietas kūnas. Po kurio laiko, kai alkoholis džiūsta, ši glaistai tik trupės.
![]()
Apibendrinant pamoką
Šioje pamokoje jūs ištyrėte temą „Silicis“. Išnagrinėjome informaciją apie silicį: jo elektroninė struktūra, kurioje silicis yra gamtoje, ištyrė silicio allotropiją, paaiškino jo fizines ir chemines savybes. Jie sužinojo apie tai, kur silicis naudojamas pramonėje ir kitose srityse, kaip jis gaminamas. Jūs susitiko su silicio rūgštimi, silicio rūgštimi ir jos druskomis - silikatais.
Nuorodos
1. Rudzitis G.E. Chemija. Bendrosios chemijos pagrindai. 11 klasė: vadovėlis mokymo įstaigoms: pagrindinis lygis / G.E. Rudzitis, F.G. Feldmanas. - 14 a. - M.: Apšvietimas, 2012 m.
2. Popel P.P. Chemija: 8 kl. Popelis, L.S. - К.: ИЦ "Akademija", 2008. - 240 p.
3. Gabrielyan O.S. Chemija. 11 klasė. Pagrindinis lygis. 2nd ed., Sr. - M .: Drofa, 2007. - 220 p.
Namų darbas
1. №22-4 (138 psl.) Rudzitis G.E. Chemija. Bendrosios chemijos pagrindai. 11 klasė: vadovėlis mokymo įstaigoms: pagrindinis lygis / G.E. Rudzitis, F.G. Feldmanas. - 14 a. - M.: Apšvietimas, 2012 m.
2. Kokie yra poliorganosiloksanų panaudojimo būdai.
3. Palyginkite silicio allotropinių modifikacijų savybes.
