Sio2 fizinės savybės. Deguonies junginiai. Silicio (II) SiO
Silicio oksidas (II) SiO. Gamtoje jis neįvyksta, tačiau jį galima gauti naudojant reakciją:
SiO 2 + Si → 2 SiO.
Esant normaliam slėgiui, silicio monoksido sublimacija prasideda apie 1200 ° C (kai pačios pradinės medžiagos beveik išgaruoja). Poromis SiO yra atskiras junginys. Elementų disociacijos energija yra 789 kJ / mol. Konversiją į kietą būseną galima atlikti tik greitai aušinant (fazuojant) dujų fazę. Priešingu atveju, lygtis su dismutacija turi laiko praeiti:
2 SiO = SiO 2 + Si.
Silicio monoksidas lėtai oksiduojamas atmosferos deguonimi ir lengvai ištirpsta šarmuose, kad susidarytų silicio rūgšties druskos ir išsiskirtų vandenilis. Jį lengvai elektrifikuoja trintis, įgyja stiprią neigiamą įkrovą.
Silicio oksidas (IV) SiO 2.Silicio oksidas (IV) taip pat vadinamas silicio dioksidu. Tai kieta ugniai atspari medžiaga. (lydymosi temperatūra 1700 ° C)gamtoje plačiai paplitęs dviem būdais: 1) kristalinis silicio dioksidas - kvarco ir jo veislių (uolienų kristalas, kalcedonas, agatas, jaspis, flintas) mineralinio pavidalo; kvarcas yra kvarco smėlio, plačiai naudojamo statyboje ir silikatų pramonėje, pagrindas; 2) amorfinis silicio dioksidas - mineralinės opalinės sudėties SiO 2 pavidalu nH20; žemės amorfinės silicio formos yra diatomitas, tripolis (infuzinė žemė); Dirbtinio amorfinio bevandenio silicio dioksido pavyzdys yra silikagelis, gaunamas iš natrio metasilikato:
Silikagelis turi išsivystytą paviršių, todėl gerai sugeria drėgmę.
1710 ° kvarcas tirpsta. Greitai atšaldant išlydytą masę susidaro kvarco stiklas. Jis turi labai mažą išsiplėtimo koeficientą, todėl karštas kvarcinis stiklas nesilaužęs, kai vanduo greitai atšaldomas. Laboratoriniai stiklo dirbiniai ir moksliniai tyrimai yra gaminami iš kvarco stiklo.
SiO 2 struktūrą plokščiame vaizde galima pavaizduoti taip:
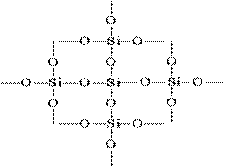
Kiekvienas silicio atomas yra uždarytas keturių deguonies atomų tetraedre. Tokiu atveju silicio atomas yra centre, o deguonies atomai yra prie Tetraedro viršūnių. Visą silicio gabalėlį galima laikyti kristalu, kurio formulė yra (SiO 2) n. Tokia silicio oksido (IV) struktūra lemia aukštą jo kietumą ir atsparumą ugniai.
Silicio oksido (IV) SiO 2 cheminės savybės reiškia rūgštinius oksidus. Lydant kietąsias šarmas, bazinius oksidus ir karbonatus, susidaro silicio rūgšties druskos:
Tik silicio oksidas (IV) (stiklinis ėsdinimas) sąveikauja tik su vandenilio fluoridu:
Si02 + HF → SiF4 + H20
Silicio (IV) oksidas neištirpsta vandenyje ir chemiškai sąveikauja su juo. Todėl silicio rūgštis gaunama netiesiogiai, pavyzdžiui, hidrolizuojant:
SiS 2 + H2O ↔ H2S + H 4 SiO 4 ortosilicio rūgštis.
H4 SiO 4 yra tirpus, šildant arba stovint, vyksta polimerizacijos procesas:
2H4 SiO4 → H20 + H6 Si2O7 diortokremnievio rūgštis.
2H6 Si2O7 → H20 + H10 Si4O13 tetraorotremilo rūgštis.
Ji uždaro žiedą:
H10 Si4O13 → H20 + (H2S04) 4 tetrametacilo rūgštis.
Šiuo atveju silicio rūgštis (priklausomai nuo druskos ir rūgšties pradinių tirpalų koncentracijos) gali būti gaunama tiek želatinės masės, kurioje yra vandens, tiek koloidinio tirpalo (sol) pavidalu. Gauto silicio rūgšties sudėtis priklauso nuo pradinių medžiagų ir paruošimo sąlygų. Visos silicio rūgštys yra labai silpnos (silpnesnės už anglis).
Jei anglies rūgštis tirpale išskiria silicio rūgštį iš jos druskų, tada atvirkštinė reakcija vyksta kalcinavimo metu. Pirmasis yra dėl silicio rūgšties mažesnio stiprumo (disociacijos laipsnio), antrasis - mažesnis jo kintamumas kaitinant.
Įkaitinus polisilines rūgštis ir jų laipsnišką dehidrataciją galima gauti smulkų Si02, kuris vadinamas silikagelis . Jis sugeria vandenį gerai, įdėjau į prietaisus, kad būtų išvengta brangių elementų oksidacijos.
Vokietijos pogrupis
Ge (+4) Sn (+2, +4) Pb(+2) atsparios oksidacijos būsenos
Vokiečiai buvo prognozuojami DI Mendelejevo 1871 m. Ir atrado 1886 m. Alavas ir švinas priklauso elementams, kurie žmonijai buvo žinomi ilgą laiką: egiptiečiai galėjo juos ištirpinti iš rūdų daugiau nei 3000 metų prieš Kristų. e. Indijoje švinas tapo žinomas apie 2500 metų, o alavo - 1500 metų prieš Kristų. e. Lydomasis alavas gaminamas senovės Kinijoje.
Gavimas.Natūralūs germanio junginiai konvertuojami į GeO 2 ir redukuojami vandeniliu:
GeO 2 + H 2 t → Ge + H20 maždaug 1000 ° C temperatūroje
Alavas gaunamas iš natūralaus mineralo kasiteritas(SnO 2):
SnO 2 + C → Sn + CO.
Paprasčiausia pramoninės švino mažinimo schema grindžiama dviem iš eilės atliekamomis reakcijomis:
PbS + O2 → SO2 + PbO Galena(PbS) sudeginama ir sumažinama anglies:
PbO + С → СO + Pb.
Taikymas.Visi trys elementai yra labai svarbūs šiuolaikinėms technologijoms. Kai kurie alavo ir švino junginiai taip pat yra labai naudingi. Švino dariniai yra labai toksiški.
Germanium yra tipiškas puslaidininkis (n-tipas, kurio plotis yra 0,75 eV), ir įvairios elektros inžinerijos srityse. Jis yra plačiausiai naudojamas kintamosios srovės lygintuvų gamybai.. Ši paraiška yra pagrįsta unipoliniu laidumu, atsirandančiu dėl germanio ir germanio lydinio su indiu. Srovė (elektronų srautas) tokiame įrenginyje praeina tik iš germanio į lydinį, bet ne atvirkščiai. Germanium lygintuvai pasižymi itin aukštu (apie 98%) efektyvumu ir labai dideliu (tinkamai veikiančiu) tarnavimo laiku. Pagrindinis šių lygintuvų trūkumas yra jų jautrumas šildymui - virš 70 ° C, jų efektyvumas greitai sumažėja.
Svarbi naudojimo sritis vokietija yra infraraudonųjų spindulių optika, kadangi spinduliai, kurių bangos ilgis yra didesnis nei 2 mikronai, jis praktiškai neveikia. Priešingai, šviesoje ir arti jos ribų (0,2? 2 mikronai), germanis intensyviai sugeria energiją. Jei blizgaus metalo paviršius (kuris gerai saugo šilumą, bet gerai nešildo) yra padengtas germanio plėvele, paviršius įkaista daug daugiau nei be plėvelės. Buvo pranešta, kad tokiu būdu pagamintame statine, veikiant saulės šviesai, galima gauti verdančio vandens.
Alavas daugiausia naudojamas geležies įdirbimui, siekiant apsaugoti jį nuo rūdžių. (skardos konservų pramonei). Tokių alavo dangų storis yra labai mažas - mikronais. Plonų lakštų (vadinamųjų „Stannioles“) forma alavo suvartojama kondensatorių gamybai elektros pramonėje . Švinas naudojamas baterijų plokščių, elektros kabelių plokščių, kulkų ir kulkų gamybai, apsaugančioms nuo rentgeno spindulių ir geležies spindulių, taip pat chemijos pramonėje (vamzdynuose ir tt). Daugeliui techniškai svarbių lydinių gamybai išleidžiama labai daug alavo ir švino.
Svarbiausi iš jų yra įvairūs bronzai (Cu ir Sn lydiniai), guolių lydiniai (babbits, paprastai pagaminti pagal Pb arba Sn, taip pat turintys Sb ir Cu), tipografiniai lydiniai (5-30% Sn, 10-20% Sb, likusi dalis yra Pb) ir įprastas „minkštas“ litavimas (30-70% Sn, 70-30% Pb). Jį dažnai galima pakeisti pigesniu 90% Pb, 6% Sn, 4% Sb lydiniu. Labai svarbūs guolių lydiniai, kurių apytikslė kompozicija yra 98% Pb, 1% Ca, 1% Na.
Silicio dioksidas (silicio dioksidas, silicio dioksidas) yra medžiaga, sudaryta iš bespalvių kristalų, kurių stiprumas, kietumas ir atsparumas yra atsparūs. Silicio dioksidas yra atsparus rūgštims ir neturi sąveikos su vandeniu. Padidėjus reakcijos temperatūrai, medžiaga sąveikauja su šarmais, ištirpsta vandenilio fluoro rūgštyje, yra puikus dielektrikas.
Gamtoje silicio dioksidas yra plačiai paplitęs: kristalinį silicio oksidą sudaro tokie mineralai kaip jaspis, agatas (kristaliniai silicio dioksido junginiai), akmens kristalai (dideli medžiagų kristalai), kvarcas (laisvasis silicio dioksidas), chalcedonas, ametistas, morionas, topazas (spalvoti kristalai) silicio dioksido).
Normaliomis sąlygomis (esant natūraliai aplinkos temperatūrai ir slėgiui) yra trys silicio dioksido modifikacijos - tridimitas, kvarcas ir kristobalitas. Kai temperatūra pakyla, silicio dioksidas pirmiausia virsta koesitu, o vėliau į stishovitą (1962 m. Randamas meteorito krateris). Remiantis tyrimais, stishovit, silicio dioksido darinys, sudaro didelę Žemės mantijos dalį.
Cheminė cheminė formulė - SiO 2
Silicio dioksido paruošimas
Silicio dioksidas gaminamas pramoniniu būdu kvarco gamyklose, gaminančiose gryną kvarco koncentratą, kuris vėliau naudojamas chemijos ir elektronikos pramonėje, gaminant optiką, gumą ir dažų bei lakų užpildus, juvelyrinių dirbinių gamybą ir kt. Natūralus silicio dioksidas, kitaip vadinamas silicio dioksidu, yra plačiai naudojamas statyboje (betono, smėlio, garso ir šilumos izoliacinės medžiagos).
Silicio dioksido sintezė sintetiniu būdu atliekama veikiant rūgštims natrio silikate, kai kuriais atvejais kitais tirpiais silikatais arba koloidinio silicio koaguliacijos būdu, veikiant jonams. Be to, silicio dioksidas yra gaunamas oksiduojant silicį deguonimi maždaug 500 laipsnių Celsijaus temperatūroje.
Silicio dioksido panaudojimas
Silicio turinčios medžiagos plačiai naudojamos tiek aukštųjų technologijų, tiek kasdienio gyvenimo srityse. Silicio dioksidas naudojamas stiklo, keramikos, betono gaminių, abrazyvinių medžiagų, taip pat radijo inžinerijos, ultragarso įrenginių, žiebtuvėlių ir kt. Gamyboje. Kartu su daugeliu ingredientų silicio dioksidas naudojamas gaminant skaidulinius optinius kabelius.
Neporinis amorfinis silicio dioksidas taip pat naudojamas maisto pramonėje kaip priedas, užregistruotas numeriu E551, užkertantis kelią pagrindinio produkto susikaupimui ir susmulkinimui. Dioksidas  silicio maistas yra naudojamas farmacijos pramonėje kaip narkotikų enterosorbentas, gaminant dantų pastas. Medžiaga randama lustuose, krekeriuose, kukurūzų lazdose, tirpioje kavoje ir kt.
silicio maistas yra naudojamas farmacijos pramonėje kaip narkotikų enterosorbentas, gaminant dantų pastas. Medžiaga randama lustuose, krekeriuose, kukurūzų lazdose, tirpioje kavoje ir kt.
Silicio žala
Oficialiai patvirtinta, kad silicio dioksido medžiaga nepakeičiama per virškinimo traktą, po to ji visiškai pašalinama iš kūno. Pagal 15 metų Prancūzijos ekspertų atliktą tyrimą geriamojo vandens geriamojo vandens gerinimas sumažina Alzheimerio ligos išsivystymo riziką 10%.
Taigi informacija apie silicio dioksido, kuris yra chemiškai inertiška medžiaga, keliamus pavojus yra klaidingas: E551 maisto papildas, vartojamas per burną, yra visiškai saugus sveikatai.
Silicio oksidas SiO 2 yra kieta, labai ugniai atspari medžiaga (lydymosi temperatūra didesnė kaip 1700 ° C), plačiai paplitusi gamtoje, kur ji randama daugiausia kvarco mineralo, taip pat kristobalito ir tridimito pavidalu.
Įprastomis temperatūromis kvarcas yra stabili modifikacija, didėjant temperatūros polimorfinėms transformacijoms:
Visų monomero formų modifikacijų silicio nėra; jis visada yra polimerinis ir „pastatytas“ iš tetraedro, sudarančio labai stiprią atominę grotelę
Kiekvienas silicio atomas (SiO 2) n kristaluose yra tetrahedrališkai apsuptas keturių deguonies atomų, kurių kiekvienas yra tiltas. Per bendrą deguonies atomą, tetrahedra skirtingais kampais susieja vienas su kitu, sudarydama nuolatinę trimatę grotelę; abipusis tetrahedra išdėstymas erdvėje lemia vieną ar kitą silicio dioksido modifikaciją.
Skirtinguose silicio dioksido rišiklio stiprumo pokyčiuose skiriasi. Tai daro įtaką Si-O-Si kampų ir Si-O atstumų dydžiui, pvz., Si-O-Si jungties kampas įvairiuose silicio modifikacijose svyruoja nuo 120 iki 180 °. Kvarciniai-tridimitiniai-kristobalitiniai perėjimai lydi lūžių ir transformacijų, kurios gali atsirasti tik esant aukštai temperatūrai.
Kvarcas Dažnai gamtoje randama labai gerai suformuotų kristalų, kartais didelės apimties, forma. Kristalai formuojami iš tetrahedro, išdėstyto spiralės formos aplink centrinę ašį, spiralės pavidalu. Tame pačiame kristale spiralės kryptis gali būti priešinga. Tokie kristalai yra optiniai izomerai. Jie sukasi šviesos poliarizacijos plokštumą ir gali būti ir dešinė, ir kairė. Šie ir kiti kristalai, kaip subjektas, skiriasi nuo jų veidrodžio.
Kvarcas naudojamas įvairiose mokslo ir technologijų srityse, o jo kristalai dažnai auginami dirbtinai. Kai kurie kvarco tipai yra ypatingi pavadinimai. Skaidrūs bespalviai kristalai vadinami roko kristalais. Taip pat yra spalvotų kvarco rūšių: rožinis kvarcas, violetinis (ametistas), tamsiai rudas (dūminis topazas), žalias (chrizoprazas) ir kt. Kvarcinis modifikavimas su kitų medžiagų mišiniais vadinamas chalcedoniu. Kalcedonijos veislės yra agatas, jaspis ir kt. Roko kristalai ir spalvotos kvarco rūšys naudojamos kaip brangakmeniai ir pusbrangiai akmenys.
Tridimitas atsiranda vulkaniniuose uolose, tačiau labai mažais kiekiais. Žinomas tridimitas ir meteorito kilmė.
Cristobalitas gamtoje kartais yra mažų kristalų, įterptų į lavą, forma, kaip tridimitas. Tridimitas ir kristobalitas turi daugiau „palaidų“ struktūrų nei kvarcas. Taigi, kristobalito, tridimito ir kvarco tankis yra 2,32; Atitinkamai 2,26 ir 2,65 g / cm3.
Silicio lydymas su lėtu aušinimu lengvai sudaro amorfinį kvarco stiklą. Stiklas taip pat randamas gamtoje. Amorfinio stiklo tankis yra 2,20 g / cm 3 - mažesnis nei visų kristalinių modifikacijų. Kvarcinis stiklas turi nedidelį temperatūros padidėjimo koeficientą, todėl jis naudojamas laboratoriniams stiklo gaminiams, atspariems staigiems temperatūros pokyčiams.
Visi vandenyje esančios silicio dioksido modifikacijos yra beveik netirpios (25 ° C temperatūroje kvarco tirpumas yra 7, kristobalitas - 12, tridimitas - 16, kvarcinis stiklas - 83 mg / l). Todėl normaliomis sąlygomis joms veikia tik šarminiai tirpalai ir fluoro rūgštis:
SiO 2 + 2KO = K 2 SiO 3 + H20, (1)
Si02 + 4HF = SiF4 + 2H2O. (2)
Pastaroji reakcija naudojama stiklo „ėsdinimui“.
Pridedamas silicio dioksidas reaguoja su baziniais oksidais, šarmais (reakcija (1)) ir karbonatais, kad susidarytų silikatai:
SiO 2 + CaO = СaSiO 3, (3)
Si02 + Na2CO3 = Na 2 SiO 3 + CO 2. (4)
Reakcijos (3) ir (4) grindžiamos įvairių stiklų ir cemento pramonine gamyba. Taigi paprasto stiklo (pvz., Langų, skirtų indų gamybai) sudėtis yra išreikšta formulė Na 2 O. CaO. 6SiO 2. Toks stiklas gaminamas sulydant natrio, smėlio ir kalkakmenio mišinį. Šis procesas atliekamas ~ 1400 ° C temperatūroje iki visiško dujų pašalinimo:
Na2C03 + CaCO3 + 6Si02 = Na2O. CaO. 6SiO 2 + 2CO2.
Specialioms stiklo rūšims - ugniai atsparios, „neperleidžiamos“ - gaminant, įpilkite bario, švino, boro oksidus. Norėdami gauti spalvotus stiklus, taip pat įvedami įvairūs priedai, pavyzdžiui, kobalto oksido Co 2 O 3 pridedant mėlyną spalvą, chromo oksidas Cr 2 O 3 - žalias, mangano dioksidas MnO 2 - rožinis.
SiO 2 oksidas yra daugelio silicio rūgščių anhidridas, kurio sudėtis gali būti išreikšta bendra formule xSiO 2 ∙ yH 2 O, kur x ir y yra sveikieji skaičiai: 1) x = 1, y = 1: SiO2. H 2 Oh, t.y. H 2 SiO 3 - meta-silicio rūgštis; 1) x = 1, y = 2: Si02. 2H2O, t.y. ortoilicino rūgštis; 1) x = 2, y = 1: 2SiO2. H 2 Oh, t.y. H 2 Si 2 O 5 - bimeta silicio rūgštis.
Rūgštys, kurių molekulėse yra daugiau nei viena SiO 2 molekulė, yra polisilicio.
Paprasčiausias silicio rūgštis yra H2 SiO 3, kuris dažnai vadinamas tiesiog siliciu, ir jo druskos yra silikatai. Iš silikatų vandenyje tirpsta tik natrio ir kalio silikatai, likusieji silikatai yra ugniai atsparios, vandenyje netirpios medžiagos.
Silikatų tirpalai auga drumsti stovėdami ore, nes juose esantis CO 2 išskiria silicio rūgštį iš jos druskų (H 2 SiO 3 yra silpnesnė nei anglies rūgštis; H 2 SiO 3 disociacijos konstanta pirmame etape yra lygi K1 = 2.2. ).
H 2 SiO 3 praktiškai netirpsta vandenyje - ši savybė naudojama kaip kokybinė reakcija silikato jonų aptikimui:
Na 2 SiO 3 + CO 2 + H 2 O = Na2C03 + H 2 SiO 3 ↓.
Silikatai gaunami sujungiant SiO 2 su šarmais arba karbonatais.
Koncentruoti natrio ir kalio silikato tirpalai vadinami skystu stiklu, jie turi stiprią šarminę reakciją dėl to, kad jie yra labai hidrolizuoti:
K 2 SiO 3 + H 2 O 2KON + H 2 SiO 3 ↓.
Skystas stiklas naudojamas, pavyzdžiui, klijų, vandeniui atsparių audinių gamybai.
Cementas yra labai plačiai naudojamas statyboje kaip rišiklis, kuris, sumaišius su vandeniu, sukietėja. Paprastai cementas gaminamas didelėse rotacinėse krosnyse, kuriose skrudinami ir sumalami įvairūs silikatai (-1000 ° C temperatūroje).
Yra keletas cemento tipų, tačiau sąlyginai galima išskirti dviejų tipų cementą pagal jų „koaguliacijos“ principą - paprastą cementą ir portlandcementį. Tradicinio cemento, kurį sudaro kalcio silikatas, nustatymo procesas vyksta dėl kalcio karbonato susidarymo dėl anglies dioksido ore:
Cao. SiO 2 + CO 2 + H 2 O = CaCO 3 ↓ + H 2 SiO 3 ↓.
Nustatant „Portland“ cementą, anglies dioksidas šiame procese nedalyvauja, o silikatų hidrolizė vyksta susidarius netirpiems kristaliniams hidratams:
Ca3 SiO5 + H20 = Ca 2 SiO 4 + Ca (OH) 2,
Ca 2 SiO 4 + 4H 2 O = Ca 2 SiO 4. 4H 2 O ↓.
· Karbidai ir silicidai
· Anglies ir silicio junginiai su metalais - karbidais ir silicidais, be minėtų reakcijų, taip pat gaunami sąveikaujant siliciui su metaliniais hidridais, pavyzdžiui:
· 2CaH2 + Si = Ca 2 Si + 2H2.
· Visos šios reakcijos vyksta esant aukštai temperatūrai. Tarp karbidų išskiriami vadinamieji "metanidai" ir "acetilenas". Pirmieji yra laikomi metano dariniais, kurių sudėtyje yra anglies oksidacijos būsenoje -4 (Be 2C, Al4C3), antrasis - kaip acetileno dariniai, turintys anglies oksidacijos laipsnį -1 (Li2C2, Ag2C2, Cu2C2 , CAC 2). Sidabro ir vario acetilidus (I) galima lengvai gauti per acetileną per sidabro oksido arba vario (I) chlorido amoniako tirpalą. Dauguma metanidų ir acetilidų aktyviai reaguoja su vandeniu (ypač su rūgštimis), atlaisvindami atitinkamus angliavandenilius:
· СаС 2 + 2Н 2 О = Са (ОН) 2 + С 2 Н 2,
· Al4C3 + 12H2O = 4Al (OH) 3 ↓ + 3CH4,
· Ag2C2 + 2HCl = 2AgCl ↓ + C2H2.
· Skirtingai nuo karbidų, tik šarminiai arba šarminiai metalai silicidai sąveikauja su vandeniu ir rūgštimis, gamindami paprasčiausią vandenilio junginio silicio monosilaną, kuris dažnai vadinamas tiesiog silaniniu SiН 4:
· Ca 2 Si + 4HCl = 2CaCl2 + SiH4.
· Silanas yra bespalvė duona, kurios kvapas yra spontaniškai degus ore, degantis SiO 2 ir vandeniu:
· SiH4 + 2O2 = Si02 + 2H2O.
· Šarminiai šarmai labai lengvai skaidomi pagal šią lygtį:
· SiH4 + 2KON + H20 = K 2 SiO 3 + 4H 2,
· Vanduo taip pat hidrolizuoja silaną, bet daug lėčiau:
· SiH4 + 2H2O = Si02 + 4H2.
· Šildant virš 400 ° C be oro patekimo, silanas skaidosi į silicį ir vandenilį (vienas iš silicio gamybos būdų):
· SiH4 = Si + 2H2.
· Be monosilano, taip pat žinomos disilano Si2H6, trisilano Si3H8, tetrasilano Si4H10 ir tt. Atskiru atveju junginiai buvo izoliuoti tik iki Si 6 H 14 imtinai. Visi šie junginiai priklauso homologinei silanų serijai, kuri atitinka bendrą formulę Si nH2n + 2. Kaip ir alkanai, silanai yra bespalviai, pirmieji homologinių serijų nariai įprastomis sąlygomis yra dujiniai, šie yra skysčiai. Cheminis silanų ir angliavandenilių aktyvumas yra skirtingas: priešingai nei pakankamai inertiniai alkanai, silanas yra reaktyvus. Taip yra dėl mažesnio silicio afiniteto vandenilio, palyginti su anglies kiekiu ir labai dideliu silicio afinitetu deguoniui. Be to, „Si-Si“ obligacijos yra mažiau patvarios nei С-С obligacijos. Skirtingai nuo C-H jungties, Si-H ryšys turi daugiau jonų.
· Si-E ir CE obligacijų energija.
· Mažas Si-Si jungties stiprumas priklauso nuo homologinių silanų serijos ribotumo.
· Tarp karbidų ir silicidų ypatinga vieta yra karborundo SiC, kuris gali būti vadinamas silicio karbidu ir anglies silicidu. „Carborundum“ turi aukštą lydymosi temperatūrą dėl savo deimantinės struktūros; jo kietumas yra artimas deimantų kietumui. Chemiškai, SiC yra labai stabilus.
· Koloidinių sprendimų koncepcija
Gamtoje ir technologijoje dažnai randamos išsklaidytos sistemos, kuriose viena medžiaga yra tolygiai paskirstyta kaip dalelės kitoje medžiagoje.
Disperguotose sistemose yra disperguota fazė - smulkiai suskaldyta medžiaga ir dispersijos terpė - homogeniška medžiaga, kurioje disperguota fazė yra paskirstyta. Dispersijos sistemos apima paprastus (tikrus) tirpalus, koloidinius tirpalus, taip pat suspensijas ir emulsijas. Jie skiriasi viena nuo kitos daugiausia dalelių dydžiu, t.y. dispersijos laipsniu (fragmentacija).
Sistemos, kurių dalelių dydis mažesnis kaip 1 nm, yra tikri tirpalai, sudaryti iš tirpių molekulių arba jonų. Jie turėtų būti laikomi vienos fazės sistema. Sistemos, kurių dalelių dydis yra didesnis nei 100 nm, yra šiurkščiai disperguotos sistemos - suspensijos ir emulsijos.
Suspensijos yra disperguotos sistemos, kuriose disperguota fazė yra kieta medžiaga ir dispersijos terpė yra skystis, o kieta medžiaga yra netirpi skystyje.
Emulsijos yra disperguotos sistemos, kuriose tiek disperguota, tiek dispersijos terpė yra skysčiai, kurie nėra tarpusavyje maišomi. Emulsijos pavyzdys yra pienas, kuriame skystyje plaukioja maži riebalų rutuliukai.
Suspensijos ir emulsijos yra dvifazės sistemos.
Koloidiniai tirpalai yra labai disperguotos dviejų fazių sistemos, susidedančios iš dispersijos terpės ir disperguotos fazės, o pastarųjų dalelių linijiniai matmenys yra nuo 1 iki 100 nm. Kaip matyti, koloidiniai tirpalai pagal dalelių dydį yra tarp tarp tikrųjų tirpalų ir suspensijų bei emulsijų. Koloidinės dalelės paprastai susideda iš daugybės molekulių arba jonų.
Koloidiniai sprendimai taip pat vadinami solais. Jie gaunami dispersijos ir kondensacijos metodais. Dažniausiai dispersijos atliekamos naudojant specialias „koloidines“. Kondensacijos metodu koloidinės dalelės susidaro sujungiant atomus arba molekules į agregatus. Daugelio cheminių reakcijų metu susidaro kondensacija ir susidaro labai disperguotos sistemos (nusodinimas, hidrolizė, oksidacijos-redukcijos reakcijos ir kt.).
1 nm - nanometras (1 nm = 10 -9 m).
Priešingai nei tikrieji sprendimai, sinds pasižymi Tyndall efektu, t. Y. Šviesos išsklaidymu koloidinėmis dalelėmis. Kai šviesos spinduliu atsiranda šviesus kūgis, jis atsiranda tamsioje patalpoje. 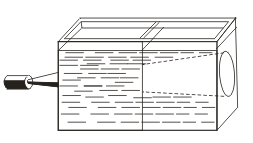 . Taigi galite atpažinti, ar šis sprendimas yra koloidinis, ar teisingas.
. Taigi galite atpažinti, ar šis sprendimas yra koloidinis, ar teisingas.
Viena iš svarbiausių solų savybių yra ta, kad jų dalelės turi to paties ženklo elektros įkrovą. Dėl to jie nesilieja į didesnes daleles ir nesidaro. Tuo pačiu metu kai kurių solų, pavyzdžiui, metalų, sulfidų, silicio ir alavo rūgščių dalelės turi neigiamą krūvį, o kitos, pavyzdžiui, hidroksidai, metalų oksidai, turi teigiamą krūvį. Įkrovimo išvaizda paaiškinama jonų adsorbcija iš tirpalo koloidinėmis dalelėmis.
Norėdami nusodinti solą, būtina, kad jo dalelės sujungtų į didesnius agregatus. Dalelių sujungimas į didesnius agregatus vadinamas koaguliacija, o jų nusodinimas gravitacijos poveikiu vadinamas sedimentacija.
Paprastai koaguliacija vyksta pridedant prie solų: 1) elektrolitas, 2) kitas solis, kurio dalelės turi priešingą krūvį, ir 3) kaitinant.
