Sieros. Vandenilio sulfidas ir sulfidai
4.doc
240Sieros. Vandenilio sulfidas, sulfidai, hidrosulfidai. Sieros oksidai (IV) ir (VI). Sieros rūgštis ir sieros rūgštis bei jų druskos. Sieros rūgšties esteriai. Natrio tiosulfatas
4.1. Sieros
Sieras yra vienas iš nedaugelio cheminių elementų, kuriuos žmonės naudojo kelis tūkstantmečius. Jis yra plačiai paplitęs gamtoje ir yra randamas ir laisvojoje būsenoje (gimtojoje sieroje), ir junginiuose. Mineralai, kurių sudėtyje yra sieros, gali būti suskirstyti į dvi grupes - sulfidus (piritus, glitters, dummies) ir sulfatus. Italijoje (Sicilijos saloje) ir JAV randama didelė siunta. NVS šalyse vietiniai sieros nuosėdos randami Volgos regione, Vidurio Azijos valstybėse, Kryme ir kitose vietovėse.
Pirmosios grupės mineralai apima švino blizgesį PbS, vario blizgesį Cu 2 S, sidabro blizgesį - Ag 2 S, cinko blendą - ZnS, kadmio užsikimšimą - CdS, piritą arba geležies piritą - FeS 2, chalkopiritą - CuFeS 2, cinnabar - HgS.
Antrosios grupės mineralai apima gipso CaSO 4H2O, mirabilitą (glazero druską) - Na2S0410H2O ir kizeritą - MgSO4H2O.
Sieras randamas gyvūnuose ir augaluose, kaip baltymų molekulių dalis. Organiniai sieros junginiai randami naftos produkte.
Gauti
1. Kai siera yra gaunama iš natūralių junginių, pavyzdžiui, iš piritinės sieros, ji kaitinama aukštoje temperatūroje. Sieros piritas skaidosi, kad susidarytų geležies (II) sulfidas ir siera:
2. Sierą galima gauti oksiduojant vandenilio sulfidą dėl to, kad reakcijos metu trūksta deguonies:
2H2S02 = 2S2H2O
3. Šiuo metu sieros dioksido sieros dioksido kiekio sumažinimas sieros dioksidu SO 2 yra bendras šalutinis produktas, naudojamas lydant sieros rūdas:
SO2C = CO 2S
4. Metalurgijos ir kokso krosnių atliekose yra sieros dioksido ir vandenilio sulfido mišinių. Šis mišinys perduodamas aukštoje temperatūroje per katalizatorių:
H2SSO2 = 2H2O3S
^ Fizinės savybės
Sieros yra kietos, trapios citrinos geltonos spalvos. Jis praktiškai netirpsta vandenyje, bet gerai tirpsta anglies disulfido ir kai kurių kitų tirpiklių CS 2 anilinu.
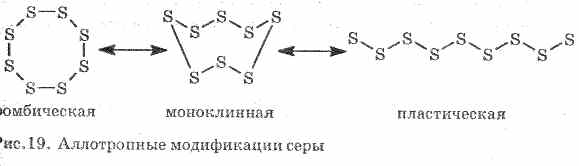
Prasta vykdo šilumą ir elektros srovę. Sieros sudaro keletą alotropinių modifikacijų:
1 . ^ Rombinė siera (stabiliausia), kristalai yra oktaedros formos.
Sieros kaitinimo metu pasikeičia jo spalva ir klampumas: pirmiausia susidaro šviesiai geltona, o tada, kai temperatūra pakyla, ji tampa tamsesnė ir tampa taip klampi, kad ji neišteka iš vamzdžio, toliau kaitinant, klampumas vėl sumažėja, o esant 444, 6 ° C - sieros srovė. .
2. ^ Monoklininė siera - modifikavimas tamsiai geltonos spalvos adatų pavidalu, gaunamas lėtai atšaldant išlydytą sierą.
3. Plastikinė sierasusidaro, jei siera, kaitinama iki virimo, pilama į šaltą vandenį. Lengvai ištemptas kaip guma (žr. 19 pav.).
Natūrali siera susideda iš keturių stabilių izotopų mišinio: 32 16 S, 33 16 S, 34 16 S, 36 16 S.
^ Cheminės savybės
Sieros atomas, turintis nepakankamą išorinį energijos lygį, gali prijungti du elektronus ir eksponuoti laipsnį
Oksidacija -2. Sieros tokioje oksidacijos būsenoje yra junginiuose su metalais ir vandeniliu (Na 2S, H2S). Kai elektronai atkuriami ar išeikvojami į daugiau elektronegatyvinio elemento atomą, sieros oksidacijos laipsnis gali būti 2, 4, 6.
Sieros yra gana inertiškos šalčio, tačiau didėjant temperatūrai, jos reaktyvumas didėja. 1. Su metalais siera pasižymi oksiduojančiomis savybėmis. Kai šios reakcijos sudaro sulfidus (su auksu, platiną ir iridį nereaguoja): Fe S = FeS
2. Normaliomis sąlygomis sieros nereaguoja su vandeniliu ir 150–200 ° C temperatūroje atsiranda grįžtama reakcija:
3. Reakcijose su metalais ir vandeniliu, sieros elgiasi kaip tipiškas oksidatorius, o esant stipriems oksidatoriams, jų savybės mažėja.
S 3F 2 = SF 6 (nereaguoja su jodu)
4. Sieros degimas deguonyje vyksta 280 ° C temperatūroje, o ore - 360 ° C temperatūroje. Tai sudaro SO 2 ir SO 3 mišinį:
S02 = SO2SSO02 = 2SO3
5. Sieros, šildomos be oro, tiesiogiai sujungia su fosforu, anglimi ir rodo oksiduojančias savybes:
2P 3S = P 2S 3 2S C = CS2
6. Sąveikaujant su sudėtingomis medžiagomis, siera daugiausia veikia kaip reduktorius:
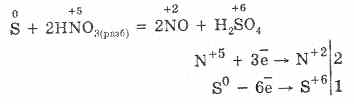
7. Sieros gali sukelti neproporcingas reakcijas. Taigi, virinant sieros miltelius su šarmais, susidaro sulfitai ir sulfidai:
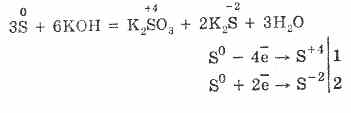
Taikymas
Sieras plačiai naudojamas pramonėje ir žemės ūkyje. Maždaug pusė jo produkcijos sunaudojama sieros rūgščiai gaminti. Sieras naudojamas gumos vulkanizavimui: šiuo atveju guma paverčiama guma.
Iš sieros (smulkių miltelių) sieros yra naudojamos kovoti su vynuogyno ir medvilnės ligomis. Jis naudojamas tam, kad gautų šautuvą, rungtynes, šviesos kompozicijas. Medicinoje paruoštas sieros tepalas odos ligų gydymui.
4.2. Vandenilio sulfidas, sulfidai, hidrosulfidai
Vandenilio sulfidas yra vandens analogas. Jo elektroninė formulė
Tai rodo, kad H-S-H ryšių formavime dalyvauja du sieros atomo išorinio lygio p-elektronai. H 2 S molekulė turi kampinę formą, todėl ji yra polinė.
^ Būdamas gamtoje
Vandenilio sulfidas gamtoje randamas vulkaninėse dujose ir kai kurių mineralinių šaltinių vandenyse, pavyzdžiui, Pyatigorsk, Matsesta. Jis susidaro iš įvairių gyvulių ir augalų likučių esančių sieros turinčių organinių medžiagų skilimo. Tai paaiškina būdingą nemalonų nuotekų, talpyklų ir sąvartynų kvapą.
Gauti
1. Vandenilio sulfidas gali būti gaunamas tiesiogiai prijungiant sierą vandeniliu kaitinant:
2. Tačiau paprastai jis gaunamas praskiedus druskos arba sieros rūgštimi ant geležies (III) sulfido:
2HCl FeS = FeCl2H2S2 2H FeS = Fe2H2S Ši reakcija dažnai vykdoma Kipp aparate.
^ Fizinės savybės
Esant normalioms sąlygoms, vandenilio sulfidas yra bespalvė dujos, pasižyminčios stipriais supuvusių kiaušinių kvapu. Labai nuodingas, įkvepiantis jungiasi prie hemoglobino, sukelia paralyžius, kuris yra nesveikas.
Ko veda į mirtį. Mažos koncentracijos, mažiau pavojingos. Būtina dirbti su juo išmetamosiose dėžėse arba hermetiškai uždarytuose įrenginiuose. Leistinas H 2S kiekis gamybos patalpose yra 0,01 mg 1 litrui oro.
Vandenilio sulfidas yra gana gerai tirpus vandenyje (20 ° C temperatūroje 2,5 tūrio vandenilio sulfido ištirpsta 1 tūrio vandens).
Vandenilio sulfido tirpalas vadinamas vandenilio sulfido vandeniu arba vandenilio sulfido rūgštimi (aptinka silpnos rūgšties savybes).
^ Cheminės savybės
1, Kai stipriai kaitinama, vandenilio sulfidas beveik visiškai skaidosi, kad susidarytų siera ir vandenilis.
2. Dujinis vandenilio sulfidas sudegina ore su mėlyna liepsna, susidarant sieros oksidui (IV) ir vandeniui:
2H2S3O2 = 2SO2 2H2O
Trūkstant deguonies, susidaro siera ir vanduo: 2H2S02 = 2S 2H 2 O
3. Vandenilio sulfidas yra gana stiprus reduktorius. Ši svarbi cheminė savybė gali būti paaiškinta taip. H 2 S tirpale yra gana lengva duoti elektronus oro deguonies molekulėms:
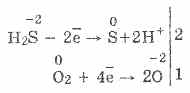
Tuo pačiu metu deguonis ore oksiduoja vandenilio sulfidą į sierą, todėl vandenilio sulfido vanduo yra drumstas:
2H2S02 = 2S2H2O
Tai paaiškina faktą, kad vandenilio sulfidas gamtoje nesikaupia labai dideliais kiekiais, kai organinės medžiagos išnyksta - deguonis iš oro oksiduoja jį į laisvą sierą.
4, vandenilio sulfidas aktyviai reaguoja su halogeniniais tirpalais, pavyzdžiui:
H 2 S 2 = 2HI S Sieras išsiskiria ir jodo tirpalas tampa spalvotas.
5. Įvairūs oksidatoriai aktyviai reaguoja su vandenilio sulfidu: veikiant azoto rūgščiai susidaro laisva siera.
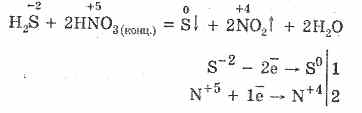
6. Vandenilio sulfido tirpalas yra rūgštus dėl disociacijos:
H 2 SH HS - HS - H S -2
Pirmas etapas paprastai vyrauja. Tai labai silpna rūgštis: silpnesnė nei anglies rūgštis, kuri paprastai iš H2S išsiskiria iš sulfidų.
Sulfidai ir hidrosulfidai
Hidrofluorūgštis, kaip dviguba druska, sudaro dvi eilutes druskų:
Vidurio sulfidai (Na2S);
Rūgščių - hidrosulfidų (NaHS).
Šios druskos gali būti gaunamos: hidroksidų sąveika su vandenilio sulfidu: 2NaOHH2S = Na 2S 2H 2 O
Tiesioginė sieros sąveika su metalais:
Keitimasis druskomis su H2S arba tarp druskų:
Pb (NO3) 2 Na2S = PbS2NaNO3
CuSO4H2S = CuS2 H2SO4 Cu2H2S = CuS2 2H
Hidrosulfidai beveik visi tirpsta vandenyje.
Šarminiai ir šarminių metalų sulfidai taip pat lengvai tirpsta vandenyje, bespalviai.
Sunkiųjų metalų sulfidai yra beveik netirpūs arba šiek tiek tirpūs vandenyje (FeS, MnS, ZnS); Kai kurie iš jų neištirpsta praskiestose rūgštyse (CuS, PbS, HgS).
Kaip silpnos rūgšties druskos, sulfidai vandeniniuose tirpaluose yra labai hidrolizuojami. Pavyzdžiui, šarminių metalų sulfidai, ištirpę vandenyje, turi šarminę reakciją:
Na 2S НОНNaHS NaOH
Visi sulfidai, kaip ir pats vandenilio sulfidas, yra energingi redukciniai agentai:
3PbS-8HN5O3 (par.) = 3PbS 6O 4 4H 2O 8N 2 O
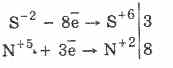
Kai kurie sulfidai turi būdingą spalvą: CuS ir PbS - juoda, CdS - geltona, ZnS - balta, MnS - rožinė, SnS - ruda, Al 2 S 3 - oranžinė. Kokybinė katijonų analizė yra pagrįsta skirtingais sulfidų tirpumu ir įvairių jų spalvomis.
^ 4.3. Sieros oksidas (IV) ir sieros rūgštis
Sieros oksidas (IV) arba sieros dioksidas, esant normalioms sąlygoms, yra bespalvė dujos, kurios smarkiai slopina kvapą. Atšaldžius iki -10 ° C, jis suskystina į bespalvį skystį.
Gauti
1. Laboratorinėmis sąlygomis sieros rūgštis (IV) gaunama iš sieros rūgšties druskų, veikiant stiprioms rūgštims:
Na2S03H2SO4 = Na2S04S02H2O2NaHSO3H2SO4 = Na2S04 2SO 2 '2H 2O 2HSO-3 2H = 2S02 2H2O
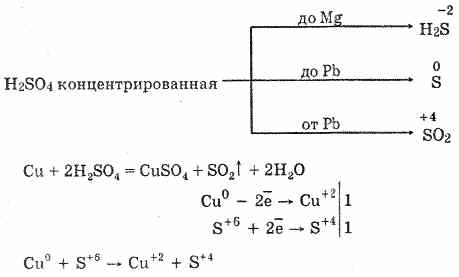
2. Taip pat sieros dioksidą sudaro koncentruotos sieros rūgšties sąveika, kai jis kaitinamas mažai aktyviais metalais:
Cu 2H 2SO 4 = CuS04S02 2H2O
Cu 4H 2SO 2-4 = Cu2SO2-4 SO22H2O
3. Sieros oksidas (IV) taip pat susidaro, kai siera sudeginama ore arba deguonyje:
4. Pramoninėmis sąlygomis SO 2 gaunamas skrudinant piritą su FeS 2 arba spalvotųjų metalų sieros rūdomis (cinko mišinys ZnS, švino blizgesys PbS ir tt):
4FeS 2 11О 2 = 2Fe 2O 3 8SO 2
Molekulės SO 2 struktūrinė formulė:
Keturių sieros atomų ir keturi elektronai iš dviejų deguonies atomų dalyvauja formuojant ryšius SO2 molekulėje. Abipusė jungiamųjų elektronų porų ir vienišų sieros elektronų pora atgauna molekulę kampine forma.
Cheminės savybės
1. Sieros oksidas (IV) turi visas rūgščių oksidų savybes:
Vandens sąveika
Sąveika su šarmais
Sąveika su baziniais oksidais.
2. Sieros oksidas (IV) pasižymi mažinančiomis savybėmis:
S 4O 2O 0 22S 6O -2 3 (esant katalizatoriui, kai kaitinama)
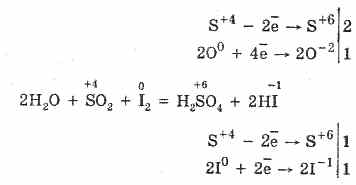
Tačiau esant stiprioms redukuojančioms medžiagoms, SO 2 veikia kaip oksidatorius:
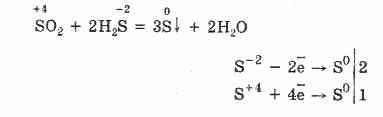
Sieros (IV) oksido redoksinis dvilypumas paaiškinamas tuo, kad sieros oksidacijos būsena yra 4, todėl ji gali, atsisakydama 2 elektronų, oksiduotis į S6, o 4 elektronais gali būti sumažinta iki S °. Šių ar kitų savybių pasireiškimas priklauso nuo reaktyvaus komponento pobūdžio.
Sieros oksidas (IV) labai gerai tirpsta vandenyje (40 tūrių SO 2 ištirpsta 1 tūrio 20 ° C temperatūroje). Šiuo atveju susidaro tik vandeniniame tirpale esanti sieros rūgštis:
SO2H2 ОH2SO3
Reakcija yra grįžtama. Vandeniniame tirpale sieros oksidas (IV) ir sieros rūgštis yra cheminėje pusiausvyroje, kurią galima perkelti. Su H2SO3 surišimu (rūgšties neutralizavimas)
Jūs) reakcija vyksta sieros rūgšties susidarymo kryptimi; pašalinant SO2 (pūtimas per azoto tirpalą arba kaitinant), reakcija vyksta į pradines medžiagas. Sieros rūgšties tirpalas visada turi sieros oksido (IV), kuris suteikia jai aštraus kvapo.
Sieros rūgštis turi visas rūgščių savybes. Sprendime jis skirstomas į veiksmus:
H2SO3 3HHSO-3HSO-3 3H SO2-3
Termiškai nestabili, laki. Sieros rūgštis, kaip dvigubas, sudaro dviejų tipų druskas:
Vidurio sulfitai (Na2S03);
Rūgštis - hidrosulfitas (NaHSO 3).
Sulfitai susidaro, kai rūgštis visiškai neutralizuoja šarmą:
H2S03 2NaOH = Na2S03 2H2O
Hidrosulfitai gaunami nesant šarmų:
H2SO3 NaOH = NaHS03H20
Sieros rūgštis ir jos druskos pasižymi oksiduojančiomis ir redukuojančiomis savybėmis, kurias lemia reakcijos partnerio pobūdis.
1. Taigi, esant deguoniui, sulfitai oksiduojami į sulfatus:
2Na2S4O3O 0 2 = 2Na 2S 6O -2 4
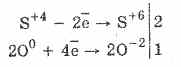
Sieros rūgšties oksidacija bromo ir kalio permanganato pagalba vyksta dar lengviau:
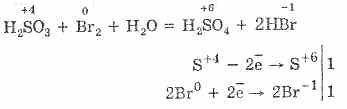
5H2S4O3 2KMn7O4 = 2H2S6O4 2Mn 2S 6O 4 K 2S 6O 4 3H 2 O
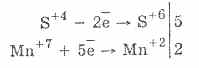
2. Esant daugiau energingų redukuojančių medžiagų, sulfitai pasižymi oksidacinėmis savybėmis:
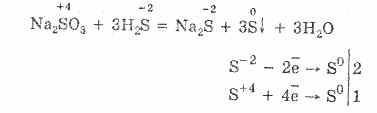
Beveik visi hidrosulfitai ir šarminių metalų sulfitai ištirpsta iš sieros rūgšties druskų.
3. Kadangi H2SO3 yra silpna rūgštis, rūgščių poveikis sulfitams ir hidrosulfitams lemia SO 2 išsiskyrimą. Šis metodas paprastai naudojamas gaunant SO 2 laboratorinėmis sąlygomis:
NaHS03H2SO4 = Na2S04S02H2O
4. Vandenyje tirpūs sulfitai lengvai hidrolizuojami, todėl tirpalo OH-jonų koncentracija padidėja:
Na2S03 NONNaSSO 3 NaOH
Taikymas
Sieros oksidas (IV) ir sieros rūgštis nusidažo daug dažiklių, su jais susidarančių bespalvių junginių. Pastaroji gali vėl suskaidyti, kai šildoma arba šviesa, todėl spalvos atkuriamos. Todėl SO 2 ir H2SO 3 balinimo efektas skiriasi nuo chloro balinimo efekto. Paprastai sieros (IV) roksidas balina vilną, šilkas ir šiaudus.
Sieros oksidas (IV) žudo daug mikroorganizmų. Todėl, siekiant sunaikinti pelėsių grybus, jie fumiguoja žaliavinius rūsius, rūsius, vyno statines ir kt. Jis taip pat naudojamas vežant ir saugant vaisius ir uogas. Dideliais kiekiais sieros rūgšties gamybai naudojamas IV sieros oksidas.
Svarbus taikymas yra kalcio hidrosulfito CaHSO 3 (sulfito alkoholio) tirpalas, naudojamas medienai ir popieriaus plaušienai valyti.
^ 4.4. Sieros oksidas (VI). Sieros rūgštis
Sieros oksidas (VI) (žr. 20 pav.) Yra bespalvis skystis, kuris kietėja 16,8 ° C temperatūroje iki kietos kristalinės masės. Labai stipriai sugeria drėgmę, susidaro sieros rūgštis: SO3H2O = H2S04
20 lentelė. Sieros oksidų savybės
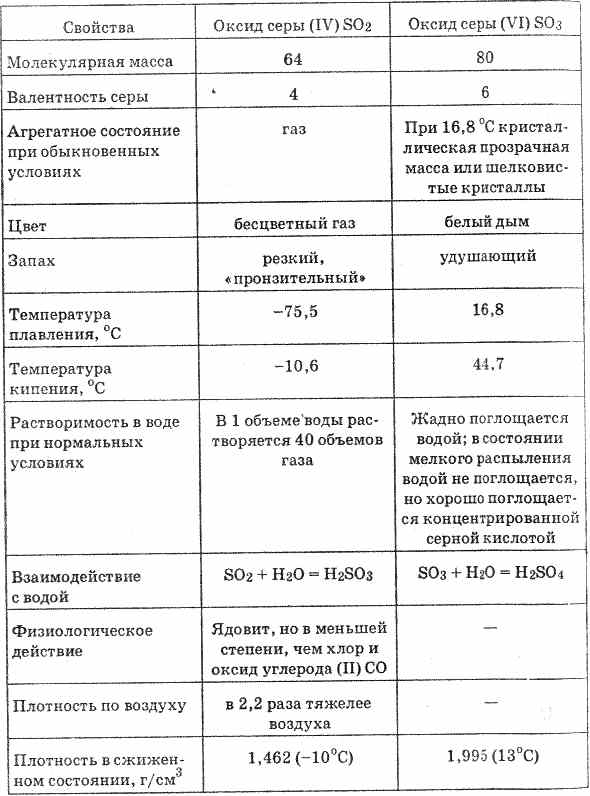
Sieros oksidų (VI) ištirpinimą vandenyje lydi didelis šilumos kiekis.
Sieros oksidas (VI) labai tirpsta koncentruotoje sieros rūgštyje. SO3 tirpalas bevandenėje rūgštyje vadinamas oleumu. Oleumuose gali būti iki 70% SO 3.
Gauti
1. Sieros oksidas (VI) gaunamas oksiduojant sieros dioksidą deguonimi, esant katalizatoriams 450 ° C temperatūroje (žr. Sieros rūgšties gamyba):
2SO2O2 = 2SO3
2. Kitas būdas oksiduoti SO2 į SO3 yra naudoti azoto (IV) oksidą kaip oksidatorių:
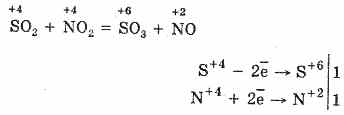
Gautas azoto oksidas (II), lengvai sąveikaujant su atmosferos deguonimi, greitai ir greitai virsta azoto oksidu (IV): 2NO 2 = 2NO 2
Kuris vėl gali būti naudojamas SO 2 oksidacijai. Todėl NO2 veikia kaip deguonies nešiklis. Šis SO 2 oksidavimo į SO3 metodas vadinamas nitritu. SO 3 molekulė yra trikampio formos, kurios centre yra
Sieros atomas yra:
Tokia konstrukcija atsiranda dėl abipusių jungiamųjų elektronų porų atsilikimo. Sieros atomas sukūrė šešis išorinius elektronus.
Cheminės savybės
1. SO3 yra tipiškas rūgšties oksidas.
2. Sieros oksidas (VI) pasižymi stipriu oksiduojančiu agentu.
Taikymas
Sieros rūgšties gamybai naudojamas sieros oksidas (VI). Svarbiausias yra kontakto metodas gauti
Sieros rūgštis. Šiuo metodu galite gauti bet kokios koncentracijos H 2 SO 4, taip pat ir oleumo. Procesą sudaro trys etapai: SO 2 gavimas; SO2 oksidavimas į SO3; gauti H 2 SO 4.
SO 2 gaunamas deginant piritą FeS 2 specialiose krosnyse: 4FeS 2 11О 2 = 2Fe 2 O 3 8SO 2
Norint pagreitinti skrudinimą, piritas yra iš anksto sumaltas ir visapusiškesnis sieros deginimas yra gerokai didesnis oro (deguonies) kiekis, nei reikalaujama reakcijoje. Dujos, išeinančios iš krosnies, susideda iš sieros (IV) oksido, deguonies, azoto, arseno junginių (iš piritų priemaišų) ir vandens garų. Tai vadinama skrudinimo dujomis.
Kepimo dujos kruopščiai valomos, nes net nedidelis kiekis arseno junginių, taip pat dulkės ir drėgmė, nuodija katalizatorių. Dujos valomos iš arseno junginių ir dulkių, perduodamos per specialius elektrostatinius nusodintuvus ir skalbimo bokštą; drėgmę sugeria koncentruota sieros rūgštis džiovinimo bokšte. Išgryninta deguonį turinti dujos šildomos šilumokaityje iki 450 ° C ir patenka į kontaktinį aparatą. Kontaktinio aparato viduje yra grotelių lentynos, užpildytos katalizatoriumi.
Anksčiau kaip katalizatorius buvo naudojamas smulkiai susmulkintas metalas. Vėliau jis buvo pakeistas vanadžio junginiais - vanadžio oksidu (V) V 2 O 5 arba vanadilo sulfatu VOSO 4, kuris yra pigesnis už platiną ir lėčiau apsinuodijęs.
SO 2 oksidacijos reakcija į SO3 yra grįžtama:
2SO 2O 2 2SO 3
Deguonies kiekio padidėjimas kalcinavimo dujose padidina sieros oksido (VI) derlingumą: esant 450 ° C temperatūrai, jis paprastai siekia 95% ar daugiau.
Po to susidaręs sieros oksidas (VI) įleidžiamas priešingos srovės būdu absorbcijos bokštui, kuriame jis sugeria koncentruotą sieros rūgštį. Kaip prisotina, bevandenės sieros rūgšties pirmosios formos ir tada oleumas. Ateityje oleumas praskiedžiamas iki 98% sieros rūgšties ir tiekiamas vartotojams.
Sieros rūgšties struktūrinė formulė:
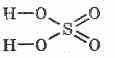
^ Fizinės savybės
Sieros rūgštis yra sunkus, bespalvis, aliejingas skystis, kristalizuojantis 10,4 ° C temperatūroje, beveik dvigubai ( = 1,83 g / cm3) yra sunkesnis už vandenį, bekvapis, lakus. Ypač higroskopiškas. Drėgmė sugeria didelį šilumos kiekį, todėl į koncentruotą sieros rūgštį negalima pilti vandens - rūgšties purslas. Dėl
Sieros rūgštis turi būti pridėta į vandenį mažomis porcijomis.
Bevandenė sieros rūgštis ištirpina iki 70% sieros oksido (VI). Šildant jis pašalina SO3, kol susidaro 98,3% H2S04 masės frakcijos tirpalas. Bevandenis H 2 SO 4 vos veda elektros energiją.
^ Cheminės savybės
1. Jis sumaišomas su vandeniu bet kokia proporcija ir sudaro skirtingos sudėties hidratus:
H2SO4H20, H2S04 2H20, H2SO43H20, H2S04 4H2O, H2S04 6.5H2O
2. Koncentruota sieros rūgštis karbonizuoja organinę medžiagą - cukrų, popierių, medieną, pluoštą, pašalindama juos iš vandens elementų:
C12H22O11H2S04 = 12C2S02S11H20
Suformuota anglis iš dalies sąveikauja su rūgštimi:
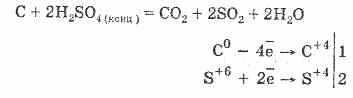
Dujų dehidratacija grindžiama vandens absorbcija sieros rūgštimi.
Kaip stiprios lakiosios rūgšties H 2SO 4 išstumia kitas rūgštis iš sausų druskų:
NaNO3H2SO4 = NaHS04HNO3
Tačiau, jei į druskos tirpalus pridedama H2S04, rūgšties poslinkis nėra.
H2SO4 - stiprus dvigubos rūgšties: H2SO4 H HSO-4 HSO-4 H SO 2-4
Jis turi visas nepastovių stiprių rūgščių savybes.
Praskiestą sieros rūgštį pasižymi visos neoksiduojančių rūgščių savybės. Būtent: ji sąveikauja su metalais, kurie yra metalų įtampos elektrocheminėje serijoje iki vandenilio:
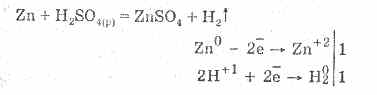
Sąveika su metalais susidaro dėl vandenilio jonų sumažėjimo.
6. Koncentruota sieros rūgštis yra energingas oksidatorius. Kai šildomas, daugelis metalų oksiduojasi, įskaitant tuos, kurie yra elektrocheminių įtempių serijoje po vandenilio, nereaguoja tik su platina ir auksu. Priklausomai nuo metalo aktyvumo, redukcijos produktai gali būti S -2, S ° ir S 4.
Šaltoje koncentruotoje sieros rūgštyje nėra tokių stiprių metalų kaip aliuminis, geležis ir chromas. Taip yra dėl metalų pasyvinimo. Ši funkcija plačiai naudojama gabenant geležies inde.
Tačiau šildant:
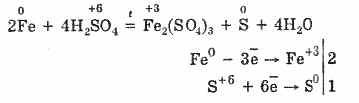
Taigi, koncentruotos sieros rūgštis sąveikauja su metalais dėl rūgšties formuojančių atomų redukcijos.
Kokybinė reakcija į sulfato joną SO 2-4 yra baltos kristalinės BaSO 4 nuosėdos, netirpus vandenyje ir rūgštyse, susidarymas:
SO 2-4 Ba 2 BaSO 4
Taikymas
Sieros rūgštis yra svarbiausias pagrindinės chemijos pramonės produktas, gaminantis ne
Organinės rūgštys, šarmai, druskos, mineralinės trąšos ir chloras.
Įvairioms reikmėms sieros rūgštis pirmauja tarp rūgščių. Didžiausias jo kiekis suvartojamas fosfato ir azoto trąšoms gauti. Būdamas nepastovus, sieros rūgštis naudojama kitų rūgščių - druskos, hidrofluorūgščių, fosforo ir acto - gamybai.
Daug jos skiriama naftos produktų - benzino, žibalo, tepalinių alyvų - iš kenksmingų priemaišų valymui. Mechaninėje inžinerijoje sieros rūgštis išvalo metalinį paviršių nuo oksidų prieš dengimą (nikelio padengimą, chromavimą ir tt). Sieros rūgštis naudojama sprogmenims, dirbtiniams pluoštams, dažams, plastikams ir daugeliui kitų gaminti. Jis naudojamas baterijoms užpildyti.
Svarbios yra sieros rūgšties druskos.
^ Natrio sulfatasNa2S04 kristalizuojasi iš vandeninių tirpalų Na 2SO 4 10H 2 O hidrato pavidalu, kuris vadinamas Glauberio druska. Jis naudojamas medicinoje kaip vidurius. Bevandenis natrio sulfatas naudojamas sodos ir stiklo gamyboje.
^ Amonio sulfatas(NH 4) 2 SO 4 - azoto trąšos.
Kalio sulfatasK 2 SO 4 - kalio trąšos.
Kalcio sulfatas CaSO 4 gamtoje randamas gipso mineralinio CaSO 4H 2 O formoje. Įkaitinus iki 150 ° C, jis praranda dalį vandens ir patenka į 2CaSO 4 H 2 O hidratą, vadinamą deginamu gipsu, arba alabasteriu. Sumaišius su vandeniu į pastos masę, alabasteris vėl šiek tiek sukietėja, virsta CaSO 4 2H 2 O. Gipso konstrukcija plačiai naudojama statyboje (tinkas).
Magnio sulfatasMgSO 4 randamas jūros vandenyje, sukeldamas savo kartaus skonio. Kristalinis hidratas, vadinamas kartaus druska, yra naudojamas kaip vidurius.
Vitriol- metalo sulfatų Fe, Cu, Zn, Ni, Co kristalinių hidratų techninis pavadinimas (dehidratuotos druskos nėra vitrialinės). Vario sulfatasCuSO 4 5H 2 O yra mėlyna toksinė medžiaga. Augalai purškiami atskiestu tirpalu, o sėklos sėjamos prieš sėjant. Geležies vitriolisFeSO 4 7H 2 O yra šviesiai žalia medžiaga. Naudojamas augalų, dažų, mineralinių dažų ir kt. Kenkėjų kontrolei. Cinko sulfatasZnSO 4 7H 2 O naudojamas mineralinių dažų gamybai, sittoprechatanii, medicinoje.
^ 4.5. Sieros rūgšties esteriai. Natrio tiosulfatas
Sieros rūgšties esteriai apima dialkilo sulfatus (RO 2) SO 2. Tai yra aukštos virimo skysčiai; mažesnis tirpumas vandenyje; esant šarmui, susidaro alkoholis ir sieros rūgšties druskos. Žemesni dialkilo sulfatai yra alkilinimo agentai.
Dietilo sulfatas(C2H5) 2S04. Lydymosi temperatūra -26 ° С, virimo temperatūra 210 ° С, tirpsta alkoholiuose, netirpi vandenyje. Gauta, reaguojant su sieros rūgštimi su etanoliu. Ar etilo agentas yra organinė sintezė. Praleidžia odą.
Dimetilo sulfatas(CH3) 2S04. Lydymosi temperatūra -26,8 ° С, virimo temperatūra 188,5 ° С. Tirpsta alkoholiuose, blogai - vandenyje. Reaguoja su amoniaku nesant tirpiklio (sprogus); Sieros, kai kurie aromatiniai junginiai, tokie kaip fenolio esteriai. Jis gaunamas sąveikaujant 60% oleumo ir metanolio 150 ° C temperatūroje. Tai yra metilinimo agentas organinėje sintezėje. Kancerogeninis, veikia akis, odą, kvėpavimo organus.
^ Natrio tiosulfatas Na2S2O3
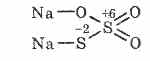
Tiosulfurūgšties druska, kurioje du sieros atomai turi skirtingas oksidacijos būsenas: 6 ir -2. Kristalinė medžiaga, gerai tirpi vandenyje. Yra kristalinio Na 2S 2 O 3 5H 2 O, paprastai vadinamo hiprulitu, forma. Gaunamas natrio sulfito ir sieros sąveikos metu:
Na2S03S = Na2S203
Kaip ir tiosulfurato rūgštis, tai yra stiprus redukcinis agentas, kurį chloru lengvai oksiduoja sieros rūgštimi:
Na2S203 4C1 5H 2O = 2H2S04 2NaCl 6HCl
Ši reakcija buvo pagrįsta natrio tiosulfato naudojimu chloro absorbcijai (pirmosiose dujų kaukėse).
Šiek tiek kitoks oksidavimas būna silpnas natrio tiosulfato oksidatoriai. Tai sudaro tetrationo rūgšties druskas, pavyzdžiui:
2Na2S2O3I2 = Na2S4O6NaI
Natrio tiosulfatas yra šalutinis produktas, gaminant NaHSO 3, sieros dažus, gryninant sieros pramonines dujas. Jis naudojamas pašalinti chloro pėdsakus po balinimo audiniais, išgaunant sidabro iš rūdų; yra fiksatorius fotografijoje, reagentas jodometrijoje, priešnuodis apsinuodijimui arseno junginiais, gyvsidabris, priešuždegiminis agentas.
Cheminis elementas yra sieros VIBA grupėje, 3-ajame PSCE. Sieros atomo išoriniame elektroniniame sluoksnyje yra 6 elektronai. Rodant oksiduojančios medžiagos savybes formuojant medžiagas su metalais ir vandeniliu, siera įgyja oksidacijos būseną -2 (užima 2 elektronus).
Deguonies turinčių junginių sudėtyje siera turi oksidacijos būseną +4 ir +6. Taigi sierai pasižymi oksidacijos būsenomis -2; 0; +4; +6.
Gamtoje siera randama gimtojoje valstybėje ir mineralų sudėtyje. Pavyzdžiui, sieros sudėtyje yra švino blizgesio (pagrindinis komponentas yra švino sulfidas PbS) ir vario blizgesys (pagrindinis komponentas yra vario sulfidas Cu 2 S).
Sieros sudaro kelias paprastas medžiagas - alotropinius pakeitimus. Rombinė siera yra stabiliausia kambario temperatūroje (1 pav.). Ši medžiaga susideda iš S 8 molekulių. Rombinė siera yra geltona ir tirpsta + 112,8 ° C temperatūroje.
Fig. 1. Rombinis sieros modifikavimas
Įkaitinus rombinę sierą palaipsniui tampa klampi tamsiai ruda masė. Tai dar vienas alotropinis sieros - sieros modifikavimas. Plastikinę sierą sudaro linijinės sieros molekulės S n.
Sieros cheminėse reakcijose su metalais ir vandeniliu yra oksiduojančios medžiagos vaidmuo. Jo oksidacijos laipsnis mažėja nuo 0 iki -2. Reakcijai su deguonimi, siera veikia kaip redukuojanti medžiaga, padidindama oksidacijos laipsnį nuo 0 iki +4.
Apsvarstykite sąveikos su siera pavyzdžius.
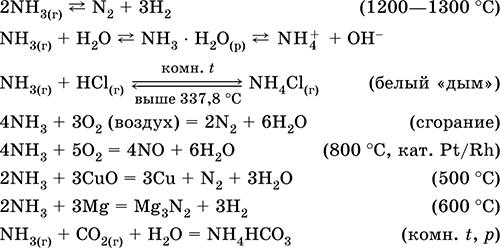
Kai siera sąveikauja su vandeniliu, susidaro vandenilio sulfidas:
Kai cinkas sąveikauja su siera, susidaro cinko sulfidas:
Sieros oksidas (IV) susidaro deguonyje (2 pav.):

Fig. 2. Deguonies sieros deginimas
Apsvarstykite sieros junginių savybes su oksidacijos būsena "-2". Tokie junginiai yra vandenilio sulfidas ir sulfidai - vandenilio sulfido rūgšties druskos.
Vandenilio sulfidas yra dujos su supuvusių kiaušinių kvapu. Jis sudegina ore. Be to, su deguonies trūkumu ir pertekliumi, degimas vyksta kitaip.
Deguonies perteklius vandenilio sulfidas sudegina, kad susidarytų sieros oksidas (IV) ir vanduo:
2H2S + 3O2 = 2SO2 + 2H2O.
Jei trūksta deguonies, nesandarus vandenilio sulfido degimas vyksta išleidžiant sierą: 2H2S + O2 = 2S + 2H 2 O.
Vandenilio sulfidas labai gerai tirpsta vandenyje. Gautas tirpalas yra silpna vandenilio sulfido rūgštis. Vandenilio sulfido druskos vadinamos sulfidais. Hidrofluorūgšties ir vandenyje tirpūs sulfidai patenka į mainų reakcijas.
Vandenilio sulfido rūgšties ir vario (II) chlorido sąveika susidaro netirpi vario (II) sulfido ir druskos rūgšties: H2S + CuCl2 = CuS + 2HCl.
Kai kalio sulfidas sąveikauja su cinko nitratu, susidaro cinko sulfido nuosėdos ir susidaro kalio nitratas: K 2S + Zn (NO 3) 2 = ZnS + 2 KNO 3.
Nuorodos
- Orzhekovsky P.A. Užduočių ir pratimų rinkimas chemijoje: 9 klasė: vadovėlio P.A. Orzhekovsky ir kt. „Chemija. 9 / P.A. klasė Orzhovovskis, N.A. Titovas, F.F. Hegel - M: AST: Astrel, 2007. (p. 91–97)
- Orzhekovsky P.A. Chemija: 9 klasė: studijos. bendrą vaizdą. institucija / P.A. Orzhovovskis, L.M. Meshcheryakova, L.S. Pontak - M: AST: Astrel, 2007. (34 straipsnis)
- Orzhekovsky P.A. Chemija: 9-oji klasė: bendrosios studijos. institucija / P.A. Orzhovovskis, L.M. Meshcheryakova, M.M. Shalashov. - M.: Astrel, 2013. (§ 20, 21)
- Rudzitis G.E. Chemija: neorgan. chemija Organas Chemija: tyrimai. už 9 cl. / G.E. Rudzitis, F.G. Feldmanas. - M .: Švietimas, Maskvos vadovėliai OJSC, 2009.
- Khomchenko I.D. Vidurinės mokyklos chemijos uždavinių ir pratimų rinkimas. - M: RIA "New Wave": leidėjas Umerenkovas, 2008.
- Enciklopedija vaikams. 17 tomas. Chemija / skyrius. ed. V.A. Volodinas, Ved. mokslo ed. I. Leensonas. - M .: Avanta +, 2003.
- Viena skaitmeninių švietimo išteklių kolekcija (vaizdo patirtis šia tema) ().
- Elektroninė žurnalo „Chemija ir gyvenimas“ versija ().
Namų darbas
- c. 136 Nr. 3; 140 psl. Nr. 2-4 iš vadovėlio P.A. Oržekovskio "Chemija: 9 klasė" / P.A. Orzhovovskis, L.M. Meshcheryakova, M.M. Shalashov. - M .: Astrel, 2013 m.
Sulfidai (iš lat. sieros, sieros ir sieros)
sieros junginiai, turintys daugiau elektrostatinių elementų; gali būti laikomos vandenilio sulfido rūgšties druskomis (žr. \\ t Vandenilio sulfido rūgštis) H 2 S. Yra dvi C serijos: vidutinė (normalioji) bendroji formulė M2S ir rūgštis (hidrosulfidai), kurių bendroji formulė MHS, kur M yra monovalentinis metalas. C. Šarminiai metalai yra bespalviai, tirpūs vandenyje. Jų vandeniniai tirpalai yra labai hidrolizuojami ir šarminiai. Praskiestų rūgščių metu išskiriama H 2 S. C. Šarminių žemių metalai yra bespalviai, šiek tiek tirpūs vandenyje. H 2 S išsiskiria drėgnu oru, kitos savybės yra panašios į S. šarminius metalus. Tiek šie, tiek kiti S. lengvai oksiduojami į sulfatus. C. sunkieji metalai yra beveik netirpūs vandenyje. Beveik visos jos yra juodos arba juodos rudos spalvos (išskyrus baltus ZnS, rausvos MnS, geltonos CdS, oranžinės raudonos Sb 2 S 3, geltonos SnS 2). Cheminės analizės metu naudojamas nevienodas C. santykis su rūgštimis ir C. amoniu. I.K. Malina.
Didžioji sovietinė enciklopedija. - M.: Sovietų enciklopedija. 1969-1978 .
Žiūrėkite, kas yra „sulfidai“ kituose žodynuose:
Sieros junginiai su metalais ir kai kuriais nemetalais. Metaliniai sulfidai yra vandenilio sulfido rūgšties H2S druskos: terpė (pavyzdžiui, Na2S) ir rūgštinės arba hidrosulfidai (NaHS). Deginant natūralius sulfidus gaunami spalvotieji metalai ir SO2. Fosforo sulfidai ir ... ... Didelis enciklopedinis žodynas
Šiuolaikinė enciklopedija
Sulfidai - SULFIDAI, neorganiniai sieros junginiai su metalais ir kai kuriais nemetalais. Įtraukta į sulfidų rūdas; naudojami kaip fosforai (pvz., CdS, ZnS). Molibdeno sulfidas, titano kietieji tepalai. Fosforo sulfidai ... ... Iliustruotas enciklopedinis žodynas
- (nauja lat., iš lotyniško sieros sieros). Kai kurių kūnų junginiai su siera, atitinkantys oksidus arba rūgštis. Užsienio kalbos žodynas, įtrauktas į rusų kalbą. Čudinovas, AN, 1910. SULFIDES Novolatinsk., Nuo lat. siera, siera. Ryšys ... ... Rusų kalbos užsienio kalbos žodžių žodynas
1. Natūralūs metalų ir kai kurių nemetalų sieros junginiai. Cheminėje medžiagoje santykis laikomas vandenilio sulfido rūgšties H2S druskomis. Daugelis elementų sudaro polisulfidus su siera, kurie yra polisulfato rūgšties H2Sx druskos. Pagrindinis ... ... Geologinė enciklopedija
Sulfidai - - sieros junginiai su metalais ir kai kuriais nemetalais; vandenilio sulfido rūgšties H2S metalo sulfidų druskos. [Terminologinis žodynas betonui ir gelžbetoniui. FAKTAS „SIC“ Statyba NIIZHB ir A. A. Gvozdeva metro stotis, Maskva, 2007. 110 p.] ...… Statybinių medžiagų terminų, apibrėžimų ir paaiškinimų enciklopedija
SULPHES, s, u sulfidas, a, vyras (spec.) Cheminiai sieros junginiai su metalais ir tam tikrais nemetalais. Ekologiški su Natūralūs s. | adj sulfidas, oh, oh. Žodynas Ozhegova. S.I. Ozhegov, N.Yu. Švedovas. 1949 m. Žodynas Ozhegova
Sulfidai, R2S (R aromatiniai radikalai), lengviausiai gaunami įpilant lašinant diazo druskų tirpalą iki 60 70 ... Brockhaus ir Efron enciklopedija
SULFIDAI - (1) neorganinėje chemijoje, tokie elementų junginiai su siera, kuriuose sieros atomai turi oksidacijos būseną 2. Chemiškai. santykis yra silpnos vandenilio sulfido rūgšties druskos (H2S vandeninis tirpalas). Daugelis S. yra natūralūs ... ... Didelė politechnikos enciklopedija
Oh; mn (sulfido vienetai ir m.). [iš lat. sieros siera] Chem. Sieros junginiai su metalais ir kai kuriais nemetalais. C. titanas. Ekologiški su Natūralūs s. (mineralų klasė). F Sulfidas, oi, oh. Su mišriais mišiniais. Iš rūdos rūdos. * * * sieros junginių sulfidai ... Enciklopedinis žodynas
- (iš lotyniškos sieros sieros) cheminių junginių, kurie yra metaliniai junginiai (taip pat ir nemetalų B, Si, P, As) su siera (S), klasė, kurioje yra oksidacijos būsena –2. Galima laikyti vandenilio sulfido druskomis ... ... Wikipedia
Knygos
- Urano nuosėdos, susijusios su nesutarimų fanozoziku, Andreju Borisovičiumi Khalezovu. Urano telkinių savybės upių paleo slėnio konstrukcijose struktūrinių ir stratigrafinių nesutarimų paviršiuje nagrinėjamos trijų Uralo regiono regionų, turinčių skirtingus ...
Sieros - 3 periodo elementas ir periodinės sistemos VIA grupė, serijos numeris 16, nurodo chalkogenai. Elektroninė atomo [10 Ne] 3s 2 3p 4 formulė, būdingos oksidacijos būsenos 0, -II, + IV ir + VI, būklė S VI yra laikoma stabilia.
Sieros oksidacijos skalė:
Sieros elektronegatyvumas yra 2,60, jam būdingos nemetalinės savybės. Vandenilio ir deguonies junginiuose jis yra įvairių anijonų, jis sudaro deguonies turinčias rūgštis ir jų druskas, dvejetainius junginius.
Gamtoje - penkioliktoji cheminio paplitimo elementas (septintasis tarp nemetalų). Jis randamas laisvoje (gimtojoje) ir susijusioje formoje. Esminis elementas aukštesniems organizmams.
Sulphur S. Paprasta medžiaga. Kristalinė geltona (α-rombinė ir β-monoklininė, \\ t
95,5 ° C) arba amorfinio (plastiko). Tinkleliuose yra S 8 molekulių (ne plokščių „koronos“ tipo ciklų), amorfinė siera susideda iš S n grandinių. Mažai lydanti medžiaga, skysčio klampumas eina per maksimalią temperatūrą 200 ° C temperatūroje (molekulių S 8 atotrūkis, grandinių susitraukimas S n). Pora - molekulės S8, S6, S4, S2. 1500 ° C temperatūroje atsiranda monoatominė siera (cheminės lygtys, skirtos paprastumui, bet kuri siera yra atstovaujama kaip S).
Sieros neištirpsta vandenyje ir normaliomis sąlygomis su juo nereaguoja, ji gerai tirpsta anglies disulfidu CS 2.
Sieros, ypač miltelių pavidalo, yra labai aktyvios šildant. Reaguoja kaip oksidatorius su metalais ir ne metalais:
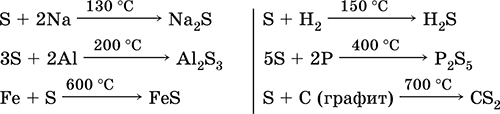
ką apie reduktorius - su fluoru, deguonimi ir rūgštimis (virinant):
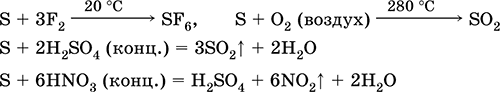
Sieros tirpaluose vyksta dismutacija:
3S 0 + 6KOH (konc.) = 2K2S-II + K2S IVO3 + 3H2O
Aukštoje temperatūroje (400 ° C) sieros išskiria jodą iš vandenilio jodido:
S + 2НI (g) = I2 + H 2S,
bet sprendime reakcija vyksta priešingai:
I 2 + H 2 S (p) = 2 HI + S ↓
Gauti: in pramonė iš natūralių vietinių sieros nuosėdų (naudojant vandens garus), išsiskiriančių anglies dujinimo produktų desulfuracijos metu.
Sieras naudojamas anglies disulfido, sieros rūgšties, sieros (vat) dažų sintezei, gumos vulkanizavimui, kaip priemonė apsaugoti augalus nuo miltligės ir odos ligų gydymui.
Vandenilio sulfidas H 2 S. Deguonis be rūgšties. Bespalvė dujos, kurių kvapas yra uždusęs, sunkesnis už orą. Molekulė turi dvigubos neišsamios tetrahedrono struktūrą [:: S (H) 2]
(sp 3 - hibridizacija, H - S - H lizdo kampas yra toli nuo tetraedro). Nestabilus, kai šildomas virš 400 ° C. Jis šiek tiek tirpsta vandenyje (2,6 l / 1 l H2O 20 ° C temperatūroje), sočiųjų tirpalas yra decimolinis (0,1 M, „vandenilio sulfido vanduo“). Labai silpna rūgštis tirpale, antrojo etapo metu beveik nesiskiria nuo S2-jonų (didžiausia S 2 -1 koncentracija yra lygi 1 10–13 mol / l). Stovantis ore, tirpalas tampa drumstas (inhibitorius - sacharozė). Jis neutralizuojamas šarmais, o ne visiškai - amoniako hidratu. Stiprus redukcinis agentas. Ji patenka į jonų mainų reakcijas. Sulfinantis agentas nusodina iš skirtingų spalvų sulfidų, turinčių labai mažą tirpumą, tirpalo.
Kokybinės reakcijos - sulfidų nusodinimas, taip pat neužbaigtas H 2S degimas su geltonos sieros nuosėdų susidarymu ant šaltų objektų, patekusių į liepsną (porceliano mentele). Šalutinis naftos, gamtinių ir kokso krosnių dujų valymo produktas.
Jis naudojamas sieros, neorganinių ir organinių sieros turinčių junginių gamyboje kaip analitinis reagentas. Labai nuodingas. Svarbiausių reakcijų lygtys:
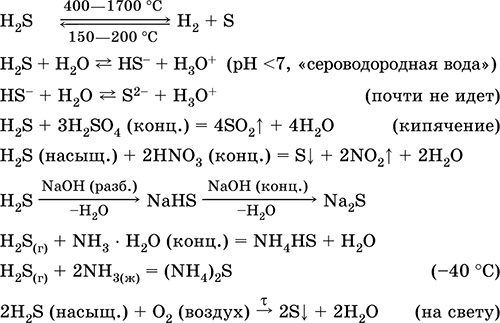

Gauti: in pramonė - tiesioginė sintezė:
H 2 + S = H 2 S(150–200 ° C)
arba kaitinant sierą parafinu;
į laboratorijose - sulfidų perkėlimas stipriomis rūgštimis
FeS + 2НCl (konc.) = FeCl2 + H 2 S
arba visiškai dvejetainių junginių hidrolizė:
Al2S3 + 6H2O = 2Al (OH) 3 ↓ + 3 H 2 S
Natrio sulfidas Na 2 S. Deguonies neturinti druska. Balta, labai higroskopiška. Lydosi be skilimo, termiškai stabilus. Jis gerai tirpsta vandenyje, hidrolizuojamas anijonu, sukuria labai šarminę terpę tirpale. Stovi ore, tirpalas tampa drumstas (koloidinis sieros) ir tampa geltonas (polisulfido dažai). Tipiškas reduktorius. Prideda sierą. Ji patenka į jonų mainų reakcijas.
Kokybinės reakcijos ant jonų S 2–– įvairių spalvų metalo sulfidų, iš kurių MnS, FeS, ZnS yra suskaidomi į HCl (-ius), nusodinimas.
Jis naudojamas sieros dažams ir celiuliozei gaminti, odos rauginimo odai pašalinti, kaip analitinės chemijos reagentas.
Svarbiausių reakcijų lygtys:
Na2S + 2НCl (dec.) = 2NaCl + H2S
Na2S + 3H2SO4 (konc.) = SO2 + S ↓ + 2H20 + 2NaSO 4 (iki 50 ° C)
Na2S + 4HNO3 (konc.) = 2NO + S ↓ + 2H20 + 2NaNO3 (60 ° C)
Na2S + H 2S (s.) = 2NaHS
Na2S (t) + 2O2 = Na2S04 (virš 400 ° C)
Na2S + 4H202 (konc.) = Na2S04 + 4H2O
S 2– + M 2+ = MnS (kūno) ↓; FeS (juoda) ↓; ZnS (balta) ↓
S 2– + 2Ag + = Ag 2 S (juoda) ↓
S 2– + M 2+ = CdS (geltona) ↓; PbS, CuS, HgS (juoda) ↓
3S 2– + 2Bi 3+ = Bi 2 S 3 (koreguoti - juoda) ↓
3S2- + 6H20 + 2M3+ = 3H2S + 2M (OH) 3 ↓ (M = Al, Cr)
Gauti į pramonė - mineralų kalcinavimas mirabilitas Na2S0410H20, esant redukuojantiems agentams:
Na2S04 + 4H2 = Na2S + 4H20 (500 ° C, kat. Fe 2 O 3)
Na2S04 + 4C (koksas) = Na 2S + 4CO (800–1000 ° C)
Na 2SO 4 + 4CO = Na 2S + 4СO 2 (600–700 ° C)
Aliuminio sulfidas Al 2S 3. Deguonies neturinti druska. Balta, Al-S jungtis yra daugiausia kovalentinė. Jis tirpsta be skilimo esant pernelyg dideliam N 2 slėgiui, jis lengvai sublimuojamas. Kalcinuojant jis oksiduojamas ore. Pilnai hidrolizuotas vandeniu, neišplaukia iš tirpalo. Skirti stipriomis rūgštimis. Jis naudojamas kaip kieto vandenilio sulfido šaltinis. Svarbiausių reakcijų lygtys:
Al2S3 + 6H2O = 2Al (OH) 3 ↓ + 3H2S (grynas)
Al2S3 + 6НCl (dec.) = 2AlCl3 + 3H2S
Al2S3 + 24HNO3 (konc.) = Al2 (SO4) 3 + 24NO2 + 12H20 (100 ° C)
2Al2S3 + 9O2 (oras) = 2Al 2O 3 + 6SO 2 (700–800 ° C)
Gauti: aliuminio ir lydytos sieros sąveika be deguonies ir drėgmės:
2Al + 3S = AL 2 S 3(150–200 ° C)
Geležies (II) sulfidas FeS. Deguonies neturinti druska. Juoda ir pilka su žaliu atspalviu, atsparus ugniai, suyra, kaitinant vakuume. Drėgnoje būsenoje yra jautrus oro deguoniui. Netirpi vandenyje. Nesikaupia geležies (II) druskų tirpalų prisotinimo vandenilio sulfidu. Skirta rūgštimis. Jis naudojamas kaip žaliava geležies gamybai, kietajam vandenilio sulfido šaltiniui.
Fe2S3 geležies (III) kompozicijos junginys nežinomas (nepriimtas).
Svarbiausių reakcijų lygtys:
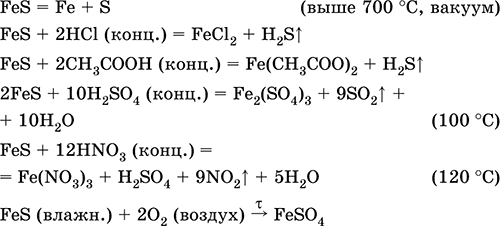
Gavimas:
Fe + S = Fes (600 ° C)
Fe203 + H2 + 2H2S = 9 Fes + 3H2O (700-1000 ° C)
FeCl2 + 2NH4 HS (g) = Fes ↓ + 2NH4Cl + H 2S
Geležies disulfidas FeS 2. Dvejetainis ryšys. Ji turi joninę struktūrą Fe 2+ (–S-S–). Tamsiai geltona, termiškai stabili, suyra degant. Netirpsta vandenyje, nereaguoja su praskiestomis rūgštimis, šarmais. Jį skaldo rūgštimi oksiduojančios medžiagos, skrudintos ore. Jis naudojamas kaip žaliava geležies, sieros ir sieros rūgšties, organinės sintezės katalizatoriaus gamybai. Gamtoje - rūdos mineralai piritas ir markazitas.
Svarbiausių reakcijų lygtys:
FeS2 = FeS + S (virš 1170 ° C, vakuumas)
2FeS2 + 14H2SO4 (konc., Kalnai) = Fe2 (SO4) 3 + 15SO 2 + 14Н 2 O
FeS2 + 18HNO3 (konc.) = Fe (NO3) 3 + 2H 2SO 4 + 15NO 2 + 7H 2 O
4FeS 2 + 11O 2 (oras) = 8SO 2 + 2Fe 2 O 3 (800 ° C, skrudinimas)
Amonio hidrosulfidas NH 4 HS. Deguonies rūgšties druska. Baltas, lydomas esant slėgiui. Labai lakus, termiškai nestabilus. Jis oksiduojasi ore. Jis gerai tirpsta vandenyje, hidrolizuojamas katijonais ir anijonais (vyrauja), sukuria šarminę aplinką. Tirpalas ore tampa geltonas. Jis suskaidomas rūgštimis, prisotintame tirpale, jis prideda sierą. Šarmai nėra neutralizuojami, tirpale nėra vidutinės druskos (NH 4) 2S (vidutinės druskos gavimo sąlygoms žr. Antraštę „H 2 S“). Jis naudojamas kaip nuotraukų kūrėjų komponentas, kaip analitinis reagentas (sulfido nusodintuvas).
Svarbiausių reakcijų lygtys:
NH4 HS = NH3 + H2S (virš 20 ° C)
NH4 HS + HCl (dec.) = NH4CI + H 2S
NH4 HS + 3HNO 3 (koncentr.) = S ↓ + 2NO 2 + NH4NO3 + 2H2O
2NH4 HS (sota H2S) + 2CuSO 4 = (NH4) 2SO4 + H 2SO 4 + 2CuS ↓
Gauti: koncentruoto NH3 tirpalo prisotinimas vandenilio sulfidu:
NH3H20 (konc.) + H 2S (g) = NH 4 HS + H20
Analitinėje chemijoje tirpalas, kuriame yra lygūs NH4 HS ir NH3H20 kiekiai, paprastai laikomas (NH4) 2S tirpalu, o vidutinė druskos formulė naudojama reakcijos lygčių rašymui, nors amonio sulfidas yra visiškai hidrolizuotas vandenyje iki NH4 HS ir NH 3 H 2 O.
Sieros dioksidas. Sulfitai
Sieros dioksidas SO 2. Rūgšties oksidas. Bespalvė kvapo dujos. Molekulėje yra neišsamios trikampio struktūra [: S (O) 2] (sp 2 - hibridizacija), yra σ, π - obligacijos S = O. Lengvai suskystintas, termiškai stabilus. Jis tirpsta vandenyje (~ 40 l / 1 l H2O 20 ° C temperatūroje). Suformuoja polihidratą su silpnos rūgšties savybėmis, disociacijos produktais - jonais HSO 3 ir SO 3 2−. Jonų HSO 3 - turi dvi tautomerines formas - simetriškas (ne rūgštus) su tetrahedrono struktūra (sp 3 - hibridizacija), kuri vyrauja mišinyje, ir asimetriška (rūgštus) su neišsamios tetrahedrono struktūra [: S (O) 2 (OH)] (sp 3 - hibridizacija). Jonų SO3 2- taip pat yra tetrahedras [: S (O) 3].
Reaguoja su šarmais, amoniako hidratu. Tipiškas reduktorius, silpnas oksidatorius.
Kokybinė reakcija - geltonai rudos „jodo vandens“ spalvos pasikeitimas. Tarpinis produktas sulfitų ir sieros rūgšties gamyboje.
Jis naudojamas vilnos, šilko ir šiaudų balinimui, vaisių išsaugojimui ir laikymui, kaip dezinfekavimo, antioksidanto, aušinimo skysčio. Nuodingas.
H 2 SO 3 (sieros rūgšties) junginys nėra žinomas (neegzistuoja).
Svarbiausių reakcijų lygtys:
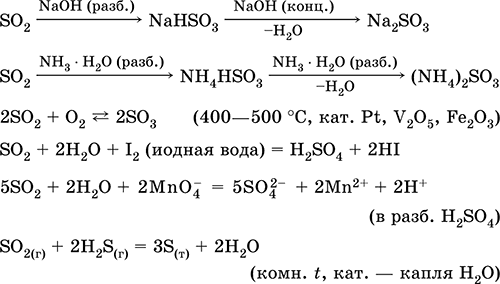
Ištirpinimas vandenyje ir rūgštinės savybės:
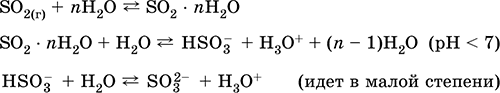
Gauti: pramonėje - sieros deginimas ore, praturtintame deguonimi, ir, kiek mažesniu mastu, skrudinant sulfidų rūdas (su SO 2 susijusi dujos skrudinant piritą):
S + O 2 = SO 2(280–360 ° C)
4FeS2 + 11O2 = 2Fe2O 3 + 8 SO 2(800 ° C, kepimas)
laboratorijoje - sulfitų perkėlimas su sieros rūgštimi:
BaSO3 (t) + H2S04 (konc.) = BaSO 4 ↓ + SO2 + H20
Natrio sulfito Na 2SO 3. Druskingas Balta Įkaitinus ore, jis ištirps be lydymosi, tirpsta pagal argono viršslėgį. Drėgnoje aplinkoje ir tirpale, jautriame ore esančiam deguoniui. Jis tirpsta vandenyje, hidrolizuojamas anijonu. Skirta rūgštimis. Tipiškas reduktorius.
Kokybinė reakcija ant jonų SO 3 2 - baltojo bario sulfito nuosėdų susidarymo, kuris perkeliamas į tirpalą su stipriomis rūgštimis (HCl, HNO 3).
Jis naudojamas kaip analitinės chemijos reagentas, fotografinių tirpalų komponentas, chloro neutralizatorius audinių balinimo metu.
Svarbiausių reakcijų lygtys:
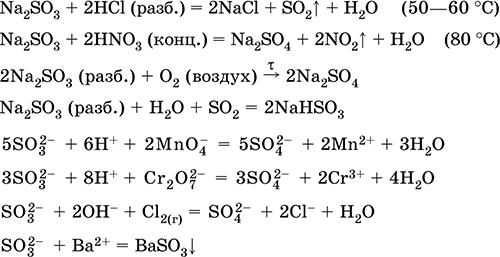
Gavimas:
Na2CO3 (konc.) + SO 2 = Na2S03 + CO 2
Sieros rūgštis. Sulfatai
Sieros rūgštis H 2 SO 4. Oksinė rūgštis. Bespalvis skystis, labai klampus (riebiai), labai higroskopiškas. Ši molekulė turi iškraipytą тет tetraedrinę struktūrą (sp 3 гиб hibridizacija), turi kovalentinį σ - ryšį S - OH ir σπ - obligacijas S = O. Jonų SO 4 2- yra teisingai tetraedrinės struktūros. Jis turi platų skysčio temperatūros intervalą (~ 300 laipsnių). Kai jis kaitinamas virš 296 ° C, jis iš dalies skaidosi. Jis distiliuojamas kaip azeotropinis mišinys su vandeniu (rūgšties masės dalis yra 98,3%, virimo temperatūra yra 296–340 ° C), visiškai suyra, stipresnis kaitinimas. Neribotas mišiniai su vandeniu (su stipriais exo-Effect). Stiprus rūgšties tirpalas, neutralizuotas šarmu ir amoniako hidratu. Metalus konvertuoja į sulfatus (esant normalioms sąlygoms koncentruotos rūgšties perteklius, susidaro tirpūs hidrosulfatai), bet Be, Bi, Co, Fe, Mg ir Nb metalai yra pasyvinti koncentruotoje rūgštyje ir nereaguoja su juo. Reaguoja su baziniais oksidais ir hidroksidais, suskaido silpnų rūgščių druskas. Silpnas oksidatorius praskiestame tirpale (dėl H I), stiprus - koncentruotame tirpale (dėl S VI). Gerai ištirpsta SO3 ir su juo reaguoja (susidaro sunkus aliejus). oleumas sudėtyje yra H2S2O7).
Kokybinė reakcija dėl SO 4 2-jonų - baltojo bario sulfato nusodinimo BaSO 4 (nuosėdos nekeičiamos druskos ir azoto rūgščių tirpalu, priešingai nei balta BaSO 3 nuosėdos).
Jis naudojamas sulfatų ir kitų sieros junginių, mineralinių trąšų, sprogmenų, dažiklių ir vaistų gamybai organinės sintezės būdu, pramoniniu požiūriu svarbių rūdų ir mineralų „atidarymui“ (pirmuoju etapu), rafinuojant naftos produktus, vandens elektrolizei, švino baterijų elektrolitui . Nuodingas, sukelia odos nudegimus. Svarbiausių reakcijų lygtys:
Gauti į pramonė:
a) SO 2 sintezė iš sieros, sulfido rūdų, vandenilio sulfido ir sulfatų rūdų:
S + O 2 (oras) = SO 2(280–360 ° C)
4FeS 2 + 11O 2 (oras) = 8 SO 2 + 2Fe 2 O 3 (800 ° C, skrudinimas)
2H2S + 3O2 (g) = 2 SO 2 + 2H 2 O (250–300 ° C)
CaSO 4 + С (koksas) = CaO + SO 2 + CO (1300–1500 ° C)
b) SO 2 konversija į SO 3 kontaktiniame aparate:
c) koncentruotos ir bevandenės sieros rūgšties sintezė: \\ t
H20 (Coll. H 2SO 4) + SO3 = H 2 SO 4(konc., anhyd.)
(SO 3 absorbcija gryname vandenyje, gaminant H2S04, nėra vykdoma dėl stipraus mišinio kaitinimo ir atvirkštinio H2SO 4 skilimo, žr. aukščiau);
d) sintezė oleumas - bevandenio H2SO4, disaro rūgšties H 2S 2 O 7 ir SO 3 pertekliaus mišinys. Ištirpintas SO 3 užtikrina vandenį be aliuminio (H 2 SO 4 susidaro iš karto, kai patenka į vandenį), o tai leidžia saugiai transportuoti plieniniuose rezervuaruose.
Natrio sulfatas Na2S04. Druskingas Balta, higroskopinė. Lydosi ir verda be skilimo. Sudaro kristalinį hidratą (mineralinis mirabilitas) lengvai prarasti vandenį; techninis pavadinimas Glauberio druska. Jis tirpsta vandenyje, nėra hidrolizuojamas. Reaguoja su H2SO4 (konc.), SO3. Atkurta vandeniliu, koksas šildomas. Ji patenka į jonų mainų reakcijas.
Jis naudojamas stiklo, celiuliozės ir mineralinių dažų gamybai kaip vaistas. Sudėtos druskos ežerų sūryme, ypač Kaspijos jūros Kara-Bogaz-Gol įlankoje.
Svarbiausių reakcijų lygtys:
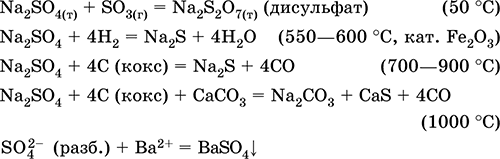
Kalio hidrosulfatas KHSO 4. Rūgštinė oksolio druska. Balta, higroskopinė, bet nesudaro kristalinių hidratų. Kai kaitinama, lydosi ir skilsta. Jis gerai tirpsta vandenyje, anijonas tirpalu tirpsta, tirpalo terpė yra stipri rūgštis. Jis neutralizuojamas šarmais.
Jis naudojamas kaip metalurgijos srautų komponentas, neatskiriama mineralinių trąšų dalis.
Svarbiausių reakcijų lygtys:
2KHSO4 = K2S04 + H2S04 (iki 240 ° C)
2KHSO4 = K2S2O7 + H20 (320–340 ° C)
KHS04 (skiedimas) + KOH (konc.) = K2S04 + H2O KHS04 + KCl = K2SO4 + HCl (450–700 ° C)
6KHS04 + M203 = 2KM (SO4) 2 + 2K2SO4 + 3H2O (350-500 ° C, M = Al, Cr)
Gauti: kalio sulfato apdorojimas šaltoje (daugiau kaip 6%) sieros rūgšties
K2SO4 + H2S04 (konc.) = 2 KHSO 4
Kalcio sulfatas CaSO 4. Druskingas Baltas, labai higroskopiškas, atsparus ugniai, sudegina. Natūralus CaSO 4 yra labai paplitęs mineralas gipsas CaSO 4 2H 2 O. 130 ° C temperatūroje gipsas praranda dalį vandens ir patenka į vandenį sudegintas tinkas2CaSO 4 H 2 O (techninis pavadinimas alabasteris). Pilnai dehidratuotas (200 ° C) gipsas reaguoja į mineralą anhidritasCaSO 4. Jis šiek tiek tirpsta vandenyje (0,206 g / 100 g H2O 20 ° C temperatūroje), tirpumas mažėja šildant. Reaguoja su H2SO4 (konc.). Susmulkinant susidaro koksas. Apibrėžia didžiąją dalį „pastovaus“ grynojo vandens kietumo (daugiau informacijos žr. 9.2).
Svarbiausių reakcijų lygtys: 100–128 ° C
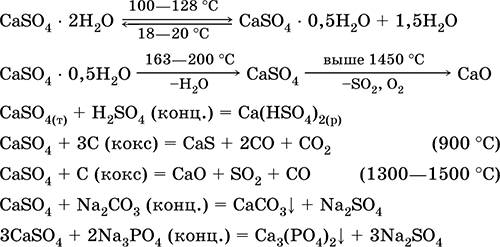
Jis naudojamas kaip žaliava SO 2, H 2 SO 4 ir (NH 4) 2 SO 4 gamybai, kaip metalurgijos srautas, popieriaus užpildas. Privalomasis skiedinys, pagamintas iš deginto gipso, „greičiau“ negu mišinys, pagrįstas Ca (OH) 2. Kietėjimą užtikrina vanduo, gipso formavimasis akmens masės pavidalu. Degintas gipsas naudojamas gipso, architektūrinių ir dekoratyvinių formų, gaminių, pertvarų ir plokščių bei akmens grindų gamybai.
Aliuminio kalio sulfatas KAl (SO 4) 2. Dviguba oksolio druska. Balta, higroskopinė. Su stipria šiluma skaidosi. Formos kristalinis hidratas - aliuminio kalio aliuminis. Vidutiniškai tirpsta vandenyje, hidrolizuojama aliuminio katijone. Reaguoja su šarmais, amoniako hidratu.
Jis naudojamas kaip dažiklis audinių dažymui, odos rauginimui, koaguliantui gryname vandenyje, popieriaus dydžio kompozicijų sudedamoji dalis ir išorinis hemostatinis vaistas medicinoje ir kosmetologijoje. Jis susidaro aliuminio ir kalio sulfatų bendro kristalizavimo būdu.
Svarbiausių reakcijų lygtys:
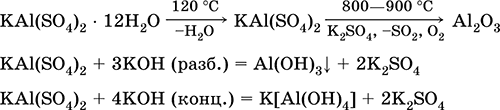
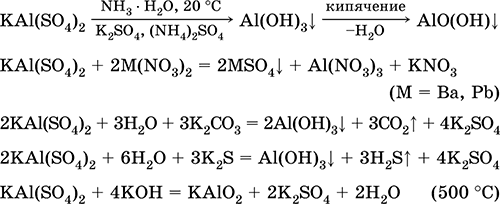
Chromo (III) sulfatas - kalis KCr (SO 4) 2. Dviguba oksolio druska. Raudona (tamsiai violetinis hidratas, techninis pavadinimas kalio aliuminis). Kai šildomas, suskaidomas be lydymosi. Jis lengvai tirpsta vandenyje (tirpalo pilka-mėlyna spalva atitinka 3+ akvakompleksą), ji hidrolizuojama chromo (III) katijone. Reaguoja su šarmais, amoniako hidratu. Silpnas oksidatorius ir redukuojantis agentas. Ji patenka į jonų mainų reakcijas.
Kokybinės reakcijos iki Cr 3+ jonų redukcijos iki Cr 2+ arba oksidacijos į geltoną CrO 4-2.
Jis naudojamas kaip odos rauginimo priemonė, audinių dažymo medžiaga, reagentas nuotraukoje. Jis susidaro ko-kristalizuojant chromą (III) ir kalio sulfatus. Svarbiausių reakcijų lygtys:
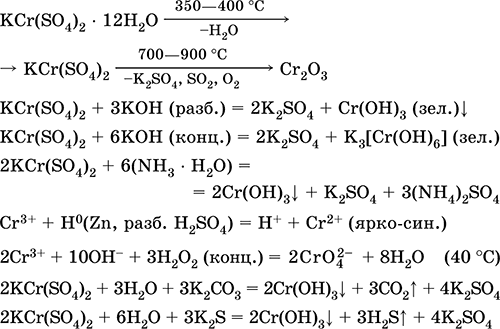
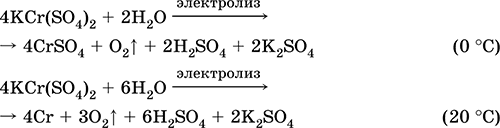
Mangano (II) sulfatas MnSO 4. Druskingas Baltas, ištirpęs, lydosi ir skilsta. Kristalinis hidratas MnSO 4 5H 2 O - raudonas - rožinis, techninis pavadinimas mangano vitriolis. Jis tirpsta vandenyje, šviesiai rožinė (beveik bespalvė) tirpalo spalva atitinka 2+ akvakompleksą; hidrolizuojama katijonu. Reaguoja su šarmais, amoniako hidratu. Silpnas redukcinis agentas reaguoja su tipiškomis (stipriomis) oksiduojančiomis medžiagomis.
Kokybinės reakcijos prie Mn 2+ jonų - laidumas su MnO 4 jonu ir jo violetinės spalvos išnykimas, Mn 2+ oksidacija į MnO 4 ir violetinės spalvos išvaizda.
Jis naudojamas Mn, MnO2 ir kitiems mangano junginiams gauti kaip mikroelementų ir analizės reagentas.
Svarbiausių reakcijų lygtys:
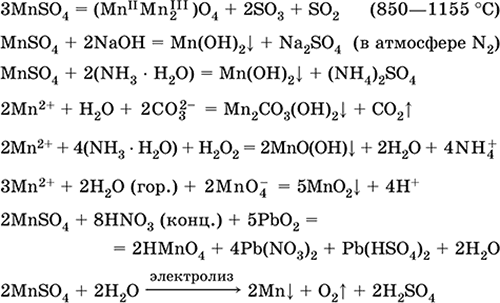
Gavimas:
2Mn02 + 2H2SO4 (konc.) = 2 MnSO 4 + O2 + 2H2O (100 ° C)
Geležies (II) sulfatas FeSO 4. Druskingas Balta (hidratuota šviesiai žalia, techninis pavadinimas) geležies vitriolis), \\ thigroskopinis. Šildant jis suyra. Ji tirpsta vandenyje, nedideliu kiekiu hidrolizuojama katijone. Jis greitai oksiduojamas tirpale deguonimi ore (tirpalas tampa geltonas ir tampa drumstas). Reaguoja su rūgštimi oksiduojančiais agentais, šarmais, amoniako hidratu. Tipiškas reduktorius.
Jis naudojamas kaip mineralinių dažų, elektrolitų galvanizavimo, medienos konservantų, fungicidų, vaistų nuo anemijos komponentas. Laboratorijoje dažniau jis laikomas dviguba druska Fe (NH 4) 2 (SO 4) 2 6Н 2 O ( druskos mora) atspariau orui.
Svarbiausių reakcijų lygtys:
![]()
Gavimas:
Fe + H 2 SO 4 (dec.) = FeSO 4+ H 2
FeCO3 + H2S04 (par.) = FeSO 4 + CO 2 + H 2 O
7.4. VA grupės nemetalai
Azotas Amoniakas
Azotas - 2 periodo elementas ir periodinės sistemos VA grupė, serijos numeris 7. Atominės elektronų formulė [2 He] 2s 2 2p 3, būdingos oksidacijos būsenos 0, –III, + III ir + V, rečiau + II, + IV ir kiti; N v būklė laikoma santykinai stabili.
Azoto oksidacijos skalė:
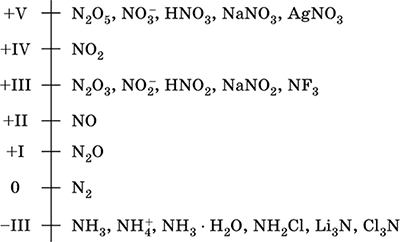
Azotas turi didelį elektronegatyvumą (3,07), trečias po F ir O. Rodo tipines nemetalo (rūgštines) savybes. Formuoja įvairias deguonies turinčias rūgštis, druskas ir dvejetainius junginius, taip pat amonio katijoną NH4 + ir jo druskas.
Gamtoje - septynioliktoji cheminio paplitimo elementas (devintasis tarp ne metalų). Esminis elementas visiems organizmams.
Azotas N 2. Paprasta medžiaga. Jis susideda iš ne polinių molekulių su labai stabiliu σππ ryšiu N N N, tai paaiškina azoto cheminę inertiškumą normaliomis sąlygomis. Bespalvė bekvapė dujos, kurios kondensuojasi į bespalvį skystį (skirtingai nei O 2).
Pagrindinė oro sudedamoji dalis: 78,09% tūrio, 75,52% masės. Iš skysto oro, azotas, virsta deguonimi O 2. Jis šiek tiek tirpsta vandenyje (15,4 ml / 1 l H2O 20 ° C temperatūroje), azoto tirpumas yra mažesnis nei deguonies.
Kambario temperatūroje N 2 reaguoja tik su ličiu (drėgnoje atmosferoje), formuodama ličio nitridą Li 3 N, kitų elementų nitridai yra sintezuojami stipriu kaitinimu:
N2 + 3Mg = Mg3N2 (800 ° C)
Elektros iškrovos atveju N 2 reaguoja su fluoru ir labai nedideliu kiekiu su deguonimi:
Reversiška reakcija amoniako gamybai vyksta 500 ° C temperatūroje, esant slėgiui iki 350 atm ir būtinai esant katalizatoriui (Fe / F 2 O 3 / FeO, Pt laboratorijoje):
Pagal „Le Chatelier“ principą amoniako išeiga turėtų padidėti, padidėjus slėgiui ir sumažėjus temperatūrai. Tačiau, esant žemai temperatūrai, reakcijos greitis yra labai mažas, todėl procesas atliekamas 450–500 ° C temperatūroje ir pasiekiamas 15% amoniako derlius. Neaktyvus N 2 ir H 2 grįžta į reaktorių ir taip padidėja reakcijos laipsnis.
Azotas chemiškai pasyvus rūgščių ir šarmų atžvilgiu, nepalaiko degimo.
Gauti į pramonė - skysto oro frakcinis distiliavimas arba deguonies pašalinimas iš oro cheminėmis priemonėmis, pavyzdžiui, 2C (koksas) + O2 = 2CO reakcija kaitinant. Tokiais atvejais susidaro azotas, kuriame yra ir tauriųjų dujų (daugiausia argono) priemaišų.
Į laboratorijose nedidelį kiekį chemiškai gryno azoto galima gauti derinant reakciją su vidutiniu šildymu:
N-IIIH4N IIIO2 (t) = N 2 0 + 2H 2 O (60–70 ° C)
NH4CI (p) + KNO2 (p) = N20 + KCl + 2H20 (100 ° C)
Jis naudojamas amoniako, azoto rūgšties ir kitų azoto turinčių produktų sintezei, kaip inertinė cheminių ir metalurginių procesų aplinka ir degių medžiagų saugojimas.
Amoniakas NH 3. Dvejetainis junginys, azoto oksidacijos laipsnis yra - III. Bespalvės dujos, turinčios smarkų kvapą. Molekulėje yra neišsamios tetrahedrono struktūros [: N (H) 3)] (sp 3 гиб-hibridizacija). Azoto kiekis elektronų donorų poros NH 3 molekulėje sp 3-hibridinėje orbitoje sukelia būdingą vandenilio katijono prisotinimo reakciją, susidarant katijonui. amonio NH 4 +. Skystas esant slėgiui kambario temperatūroje. Skystoje būsenoje susietos vandenilio obligacijos. Termiškai nestabilus. Jis tirpsta vandenyje (daugiau kaip 700 l / 1 l H2O 20 ° C temperatūroje); sočiųjų tirpalo santykis yra = 34% masės ir = 99% tūrio, pH = 11,8.
Labai reaktyvios, linkusios į reakcijos reakcijas. Susidaro deguonyje, reaguoja su rūgštimis. Jis mažina (dėl N-III) ir oksiduojasi (dėl H I) savybių. Išdžiovintas tik su kalcio oksidu.
Kokybinės reakcijos - baltos dūmų susidarymo sąlyčio su dujiniu HCl formavimu, popieriaus sudrėkinimu, sudrėkintu Hg 2 (NO 3) 2 tirpalu.
Tarpinis produktas HNO3 ir amonio druskų sintezei. Naudojamas sodos, azoto trąšų, dažiklių, sprogmenų gamybai; skystas amoniakas yra aušinimo skystis. Nuodingas.
Svarbiausių reakcijų lygtys:
Gauti: in laboratorijose - amoniako perkėlimas iš amonio druskų, kaitinant natrio kalkėmis (NaOH + CaO): \\ t
arba verdant vandeninį amoniako tirpalą, po to išdžiovinus dujas.
Į pramonė amoniakas sintezuojamas iš azoto (žr.) vandeniliu. Pagaminta pramonėje arba suskystintu pavidalu, arba koncentruoto vandeninio tirpalo pavidalu su techniniu pavadinimu amoniako vanduo.
Amoniako hidratas NH3H2O. Tarpmolekulinis junginys. Baltos spalvos, kristalų grotelėse yra NH3 ir H20 molekulės, susietos su silpna vandenilio jungtimi H 3 N ... HON. Esama vandeninio amoniako tirpalo, silpnos bazės (disociacijos produktų - katijono NH 4 - ir anijono OH -). Amonio katijonas turi reguliariai π-tetraedrinę struktūrą (sp 3 - hibridizacija). Termiškai nestabilus, visiškai suskaidytas virinant tirpalą. Neutralizuotos stipriomis rūgštimis. Rodo koncentracijos tirpalo savybes (dėl N III). Ji patenka į jonų mainų ir kompleksų reakciją.
Kokybinė reakcija - baltos dūmų susidarymo sąlyčio su dujiniu HCl formavimu.
Jis naudojamas silpnai šarminiai terpėms tirpalu sukurti amfoterinių hidroksidų nusodinimo metu.
1M amoniako tirpale yra daugiausia NH3H2O hidrato ir tik 0,4% NH4 + ir OH-jonų (dėl hidrato disociacijos); taigi, joninis „amonio hidroksidas NH4OH“ praktiškai nėra tirpale, todėl nėra tokio junginio kietajame hidrate. Svarbiausių reakcijų lygtys:
NH3H20 (konc.) = NH3 + H20 (verdantis su NaOH)
NH3H20 + HCl (dec.) = NH4CI + H20
3 (NH3H20) (konc.) + CrCl3 = Cr (OH) 3 ↓ + 3NH 4 Cl
8 (NH3H20) (konc.) + ЗBr2 (p) = N2 + 6NH4Br + 8H20 (40–50 ° C)
2 (NH3H20) (konc.) + 2KMnO4 = N2 + 2MnO2 ↓ + 4H 2 O + 2KON
4 (NH3H20) (konc.) + Ag 2 O = 2OH + 3H 2 O
4 (NH3H20) (konc.) + Cu (OH) 2 + (OH) 2 + 4H2O
6 (NH3H20) (konc.) + NiCl2 = Cl2 + 6H2O
Dažnai vadinamas praskiestas amoniako tirpalas (3–10% laiko) skystas amoniakas (pavadinimą išrado alchemikai) ir koncentruotą tirpalą (18,5–25%) amoniako vanduo (pagaminta pramonėje).
