Kalcio ir magnio junginiai
Taigi, nustatydamas vakarą, kiek kalcio yra susmulkinto kiaušinio lukšto, kyla klausimas „gerti ar negerti?“. Kaip ir dauguma vyrų, aš atėjau viską, kas yra moksliniu požiūriu, ir kol pamatysiu save, sužinosite, patikrinkite, jaustis moteriai. Todėl pasidalinsiu savo mintimis remiantis informacija apie kiaušinių lukštą ir kalcio kiekį.
Renkant informaciją apie kiaušinių lukštų naudojimą kaip maisto priedą, daugiau nei vieną kartą buvo aptikta kritinių gydytojų pastabų, kad kiaušinio lukšto sudėtyje esantis kalcio karbonatas yra netirpus vandenyje ir todėl organizmas negali jį absorbuoti.
Be to, mano draugo sutuoktinio istorija buvo priminta, kad nėštumo metu ji pasakė savo gydytojui, kuris pastebėjo, kad ji vartoja susmulkintas kiaušinių lukštas - gydytojas ją atsisakė ir paskyrė tam tikrą kalcio sudėtį.
Kur yra tiesa?
Iš tiesų, kalcio karbonatas CaCO3 (tiksliai tokio tipo kalcis yra kiaušinių lukšte) netirpsta vandenyje ir alkoholyje.
Iš tikrųjų būtina kalcio absorbcijos sąlyga yra jo tirpumas vandenyje.
Tačiau atminkite, kad mūsų virškinimo pagrindas yra druskos rūgštis, išsiskirianti į skrandį.
Ir tai atsitinka mūsų skrandyje:
СCO3 + 2HCl (druskos rūgštis) = СaCl2 (kalcio chloridas) + Co2 + H20
Bet kalcio chloridas puikiai tirpsta vandenyje! Tokiu būdu kalcis absorbuojamas!
Nežinau gydytojų? Arba jie tiesiog gudrus ir parduoda mums vaistus!
Be to, šios reakcijos metu pasireiškia skrandžio rūgštingumo sumažėjimas. Kas yra svarbu žmonėms, kenčiantiems nuo didelio rūgštingumo.
Pavyzdžiui, mano žmona, ji turi didelį rūgštingumą, ir ji kasdien užima šiek tiek susmulkintą kiaušinių lukštą, ir tai du kartus išsprendžia dvi problemas ir kompensuoja kalcio trūkumą ir sumažina jos rūgštingumą. Bet kiaušinio lukšto milteliai užgeso citrinos sultys negali gerti - yra pykinimas! Ir dabar suprantu, kodėl.
Kaip matėme aukščiau, kalcio absorbcijai kalcio karbonatu reikia skrandžio sulčių, turinčių didelį rūgštingumą.
Realiame gyvenime dažnai būna situacija, kai skrandžio rūgštingumas yra mažas arba nulis. Ši situacija ypač būdinga vyresnio amžiaus žmonėms, kai kalcio poreikis yra ypač didelis, kad būtų išvengta osteoporozės. Pavyzdžiui, po 50 metų mažas rūgštingumas atsiranda apie 40% žmonių. Esant tokioms sąlygoms, kalcio karbonato, reikalaujančio, kad druskos rūgštis ištirptų skrandyje, absorbcija sumažėtų iki 2%.
Galbūt tai yra atsakymas, kodėl vyresnio amžiaus žmonės dažniau kenčia nuo ligų, susijusių su kalcio trūkumu - jie tiesiog negali įsisavinti įprastinės formos.
Dabar apsvarstykite, kodėl rekomenduojama daug receptų, skirtų gauti susmulkintą kiaušinių lukštą, jį nuraminti citrinos sultimis.
Kai į citrinos rūgštį įpilama citrinų sulčių, kalcio karbonatas (CaCo3) reaguoja su citrinos rūgštimi (C6H8O7) ir mes gauname kalcio citratas (Ca3 (C6H5O7) 2):
2C6H8O7 + 3CaCO3 = Ca3 (C6H5O7) 2 + 3CO2 + 3H2O
Čia tai yra. Ir kalcio citrato, kurio skrandyje nereikia druskos rūgšties, absorbcija yra 44%. Dėl to, esant mažam rūgštingumui, kalcio citratas patenka į kūną 11 kartų daugiau kalcio nei iš karbonato!
Ir kalcio citratas jau yra gerai žinomas vaistas, kuris mums parduodamas už pinigus! Ir jie tai daro, tik jie naudoja ne citrinos sultis, bet citrinos rūgštį!
Beje, kalcio karbonatas (mūsų susmulkintas kiaušinių lukštas) yra registruotas maisto priedas. E170ir kalcio citratas (mūsų susmulkintas kiaušinių lukštas pilamas su citrinos sultimis) yra registruotas maisto priedas. E333! Ir jie pridedami prie daugelio maisto produktų, ypač pieno produktų, įskaitant pieną, kad padidėtų kalcio kiekis.
Tad kodėl mokėti daugiau!
Išvada, jei turite aukštą rūgštingumą - tikriausiai geriau naudoti tik susmulkintus kiaušinių lukštus, jei rūgštingumas yra mažesnis, tikriausiai geriau gesinti kiaušinio lukšto miltelius su citrinos sultimis.
Ir dar daugiau
Naktį pagreitėja mineralų druskų išsiskyrimas iš organizmo (cirkadinis rezorbcinių procesų pagreitis kauluose). Todėl kalcio preparatai turėtų būti vartojami po pietų ir vakare.Tai užkirs kelią pagreitintam kalcio praradimui antroje nakties pusėje, ypač sumažinus jo (ar nebuvimo) lygį žarnyne. Taip pat pastebimas neigiamas dozės priklausomas kalcio farmakoterapinio aktyvumo poveikis: mažomis dozėmis šis biometalas yra geriau absorbuojamas, nei aukštas.
Dėl to racionaliau vartoti narkotikus kelis kartus per dieną.
Mes skaitome, aptariame. Žemiau pateikiami keli straipsniai šia tema.
__________________________________________________________________________________________________________
Kalcio citratas, palyginti su kalcio karbonatu
Šaltinis< http://www.ortho.ru/77_KMD/Ca_Sravni.htm >
_________________________________________________________________________________________________________
Kalcio citratas.
Kalcio citratas yra puikus absorbuoto kalcio šaltinis, kuris yra labai svarbus organizme, nes jis veikia daugelį fermentinių procesų ir kraujo krešėjimą. Kalcio trūkumas sukelia kaulų trapumą ir osteoporozę. Mažiems vaikams, tai geras dantų sveikatai, suaugusiems reikia reguliariai vartoti kalcio, kad stabilizuotų kraujo spaudimą.
Nacionalinio vėžio instituto (JAV) teigimu, E-333 priedas gali užkirsti kelią storosios žarnos vėžiui ir kitiems vėžio atvejams. Be to, kalcio citratai yra naudojami medicinoje, siekiant pašalinti sunkiuosius metalus iš organizmo.
Kadangi kalcio citratas yra vienas iš svarbiausių kalcio transportavimo būdų žmogaus organizme, jis naudojamas medicinoje kartu su mažiau veiksmingu kalcio karbonatu (E-170 priedas), kad kalcio atsargos būtų papildytos organizme. Dėl tos pačios priežasties kalcio citratas naudojamas kaip maisto papildai (maisto papildai).
Maisto pramonėje E-333 priedas naudojamas kaip stabilizatorius, konservantas, rūgštingumo reguliatorius, spalvų fiksatorius.
Kaip stabilizatorius maisto priedas E-333 naudojamas kondensuoto pieno, grietinėlės, grietinėlės sūrio gamybai. Džemuose, želė ir konservuoti vaisiai E-333 priedas naudojamas kaip rūgštingumo reguliatorius. Kalcio citratai taip pat plačiai naudojami kalcio praturtinimui piene ir pieno produktuose, kepyklose ir miltų produktuose bei gaivieji gėrimai.
Išvaizda kalcio citratas yra baltas milteliai su ryškiu rūgštiniu skoniu. Tirpus vandenyje. Kalcio citrato molekulinė formulė: Ca3 (C6H5O7) 2. Gauti E-333 citrinos rūgšties ir kalcio hidroksido sąveika.
Savybės ir technologinės funkcijos:
Galimi maisto papildų pavadinimai:
- E-333
- E-333
- Kalcio citratas
- Kalcio citratai
- Monokalcio citratas
- Dikalcio citratas
- Trikalcio citratas
_____________________________________________________________________________________________
Kalcio citratas
XX a. Viduryje. prasidėjo „bumas“: biochemikai, fiziologai, biofizikai, farmakologai ir gydytojai pradėjo rodyti didesnį susidomėjimą tirti kalcio vaidmenį reguliuojant organų ir kūno sistemų veiklą. Nustatyta, kad kalcio jonai yra susiję su raumenų ląstelių sužadinimu ir susitraukimu, ląstelių membranos pralaidumo reguliavimu, ląstelių tarpusavio sąveika, kraujo krešėjimu, hormonų sekrecija, tarpininkais, fermentais; atlieka į ląstelę įeinančio signalo keitiklio funkciją, dalyvauja ląstelių metabolizmo, įskaitant energiją, reguliavimo procesuose. Kardiomiocitų ir laisvo kalcio jonų membranos paviršiuje yra 1000 kartų daugiau nei ląstelių citozolyje. Iš ekstraląstelinės erdvės jie patenka į citoplazmą per specialius kalcio kanalus, paveikdami įvairius fiziologinius procesus ir visų organų ląstelių funkcijas, kraujagyslių tonusą, sistolės intensyvumą, diastolę.
Kalcis vaidina svarbų vaidmenį formuojant kaulinį audinį ir išsaugant jo normalią struktūrą bei funkciją. Kartu su specialiais proteinais kalcio jonai užtikrina kaulų kietumą ir elastingumą.
Visa tai buvo teorinis pagrindas kalcio preparatų, kurių pagrindą sudaro jo druskos, kūrimui ir diegimui medicinos praktikoje. Šiuo metu medicinos praktikoje naudojamos tokios kalcio druskos kaip glicerofosfatas, gliukonatas, karbonatas, laktatas, citratas, chloridas, fosfatas ir daugelis kitų.
Narkotikų KALCIO CITRATO farmakokinetika turi savo savybes. Kalcis absorbuojamas iš žarnyno tirpioje jonizuotoje formoje. Vaisto tirpinimas geriau pasireiškia rūgščioje skrandžio aplinkoje. Ištirpusio jonizuoto kalcio įsiskverbia į visus audinius, prasiskverbia per placentos barjerą, patenka į motinos pieną. Išsiskiria daugiausia su išmatomis, apie 20% - su šlapimu. Svarbus kalcio citrato bruožas yra mažas gebėjimas sudaryti inkstų akmenis, kuris yra svarbus ilgalaikiam šios druskos naudojimui. Taip yra dėl to, kad citrato druska sumažina oksalato kiekį šlapime.
Biologinį prieinamumą lemia greitis ir mastas veiklioji medžiaga absorbuojamas iš vaisto formos, jis pasireiškia numatomo terapinio poveikio vietoje.
Naktį pagreitėja mineralų druskų išsiskyrimas iš organizmo (cirkadinis rezorbcinių procesų pagreitis kauluose). Todėl kalcio preparatai turėtų būti vartojami po pietų ir vakare, o tai neleis paspartinti kalcio praradimo antroje nakties pusėje, ypač mažinant žarnyno kiekį (arba jo nebuvimą). Pastebimas neigiamas dozės priklausomas kalcio farmakoterapinio aktyvumo poveikis: šis biometalas geriau absorbuojamas mažomis dozėmis nei didelėmis dozėmis. Šiuo atžvilgiu racionaliau vartoti šį vaistą kelis kartus per dieną. Skirtingoms amžiaus grupėms yra skirtingos kalcio suvartojimo fiziologinės normos (lentelė).
Lentelė
Rekomenduojamas kalcio suvartojimo lygis įvairaus amžiaus žmonėms
(pagal Kanados osteoporozės draugiją)
Vitaminas D, druskos rūgštis, laktozė, citrinų rūgštis, baltymų buvimas maiste, fosforas, magnis, taip pat kai kurie maisto produktai, pavyzdžiui, sviestas, kiaušiniai, pienas, žuvis, menkių riebalai, kopūstai ir tt, prisideda prie kalcio jonų absorbcijos.
Kalcio absorbcija blogėja: baltymų trūkumas maisto produktuose, griežtas vegetariškos mitybos laikymasis, magnio trūkumas, fosforas, maisto produktai, kuriuose yra daug oksalo rūgšties (druskos, rabarbarų, špinatų).
Kalcio absorbcija sulėtėja virškinimo organų ligomis (gastritu, enteritu, kolitu, peptine opa), kasa (diabetu, pankreatitu), kitų endokrininių organų patologijomis.
Reikia pabrėžti, kad kai kurie vaistai, ypač gliukokortikoidai, hormoniniai kontraceptiniai vaistai sisteminiam vartojimui, taip pat pablogina kalcio jonų absorbciją.
Remiantis mokslinių tyrimų rezultatais (Kanados osteoporozės draugijos duomenimis), nėra įtikinamų įrodymų, kuriais remiantis būtų galima rekomenduoti papildomą kitų mineralų (magnio, cinko, vario ir kt.) Vartojimą osteoporozės profilaktikai ar gydymui.
Ukrainoje ir kitose šalyse atliktų klinikinių tyrimų rezultatai patvirtino, kad šis vaistas yra veiksmingas daugelio ligų gydymui. Kalcio citratas taip pat naudojamas profilaktikai įvairiose ligose.
Su osteoporoze pagyvenusiems žmonėms, osteomalacija CALCIUM CITRATE skiriama 2-6 tabletės per dieną, dalijant paros dozę į 3-4 dozes. Vaistas vartojamas prieš valgį arba 1–1,5 valandos po valgio 3 mėnesius. Tokiems pacientams taip pat turėtų būti skiriamas 400–800 TV vitamino D3 per dieną, taip pat į maistą įtraukiamas aliejus, pienas, žuvis ir kiaušiniai.
CALCIUM CITRATE yra optimali dozavimo forma, skirta kalcio tiekimui ne tik suaugusiems, bet ir vaikams, taip pat paaugliams, nes ji padeda padidinti kaulų mineralų tankį, didina kaulų masę, stiprina dentiną ir dantų emalį. Vaikams iki 6 m. Amžiaus skiriama 1/2 tablečių (250 mg) (susmulkintos, ištirpintos nedideliame pieno kiekyje), 6–12 mėnesių amžiaus, taip pat 1/2 tablečių 2 kartus per dieną, 1 metų amžiaus - 10 metų amžiaus - 1-2 tabletės, 10–18 metų amžiaus - 2-3 tabletės per dieną.
Nurodymai paskyrimui Kalcio citratas yra:
hipokalcemija dėl įvairios kilmės kraujavimo, taip pat nėštumo ir žindymo laikotarpiu su traumomis - užpildyti padidėjusį organizmo poreikį kalcio jonams;
kalcio absorbcijos pažeidimas virškinamojo trakto ligose ir padidėjęs kalcio išsiskyrimas per inkstus ir žarnyną;
hipoparatiroidizmas, įvairių genezės organizmo dehidratacija, alerginės ligos ir alerginės komplikacijos vartojant vaistus, padidėjęs kraujagyslių sienelių pralaidumas, sumažėjęs kraujo krešėjimas.
Vartojant gliukokortikoidus, geriamuosius kontraceptikus, levotiroksiną, reikia nurodyti kalcio citratą. Per pastaruosius tris atvejus narkotikas vartojamas po 1 tabletę 6 kartus per dieną po valgio.
Kalcio citratas, kaip taisyklė, yra gerai toleruojamas, kartais diseptiniai simptomai (vidurių užkietėjimas ar viduriavimas, pykinimas, vėmimas, apetito praradimas, pilvo skausmas), gali atsirasti poliurija.
Dėl sumažėjusio jų veiksmingumo nerekomenduojama kartu vartoti kalcio citrato su aliuminio turinčiais antacidiniais vaistais. Nepageidautina jį skirti kartu su kitais kalcio preparatais.
Apibendrinant, galime atkreipti dėmesį į teigiamas farmakologines CALCIUM CITRATE savybes:
citrato kalcio druska gerai ištirpsta ir absorbuojama virškinamajame trakte, o tai lemia gerą kalcio absorbciją organizme ir, atitinkamai, vaisto veiksmingumą profilaktikos ar \\ t terapinis taikymastai patvirtina daugelio klinikinių tyrimų rezultatai.
Maža akmenų susidarymo inkstuose rizika padidina kalcio sulfato vertę ilgą laiką.
I.S. Chekmanas, Nacionalinės medicinos universiteto Farmakologijos katedros vedėjas, Nacionalinės medicinos akademijos korespondentinis narys ir Ukrainos medicinos mokslų akademija, gerbiamas mokslo ir technologijų darbuotojas, profesorius
Puslapis 1
Karbonatų reakcija su rūgštimis gali būti naudojama kaip karbonatų mėginys. Anglies rūgštis yra labai silpna ir nestabili rūgštis. Jis gali būti išspaustas iš jo druskų veikiant mažiau lakioms ir stipresnėms rūgštims.
Taip pat vyksta kalcio karbonato reakcijos su rūgštimis.
Karbonato reakcija su druskos rūgštimi suteikia kalcio chlorido ir magnio chlorido, kuris gerai ištirpsta vandenyje ir lieka įvairių koncentracijų tirpalu. Šio tipo kolektorių reakcijos greitis daugiausia priklauso nuo slėgio ir temperatūros.
Karbonato ir druskos rūgšties reakcijos rezultatas kalcio chloridas ir magnio, gerai tirpsta vandenyje ir lieka įvairių koncentracijų tirpalu.
Neišdžiūvusio natrio karbonato įvedimas į reakciją reikalauja didesnio slėgio ir katalizatoriaus kiekio padidėjimo.
Nurodytų arba pastebėtų reiškinių paaiškinimas: kodėl kalcio karbonato reakcija su sieros rūgštimi prasideda nuo smarkiai ir tada sustoja. Kodėl, kai šildomas sausas amonio karbonato medžiaga iš vamzdelio išnyksta.
Kalcio karbonato teigiamą poveikį Portlandcemento stabilumui galima paaiškinti karbonato reakcija su aliuminio turinčiais klinkerio mineralais. Taigi, cemento akmens aliuminio komponentas yra chemiškai surištas prieš jį liečiant su aplinkos sulfatais.
Kai kurie bario karbonato panaudojimo būdai yra pagrįsti bario sulfato, kuris susidaro bario karbonato reakcijoje su sulfato jonų turinčiomis medžiagomis, praktiniu netirpumu. Taigi, džiovinant plytą prieš deginimą, ant jo paviršiaus atsiranda baltas žydėjimas, kurį sukelia molyje esančio gipso arba magnio sulfato kristalizacija. Kad tai būtų išvengta, į molį pridedamas bario karbonatas, kuris sukelia sulfato jonų nusodinimą.
Savo įvade į kietųjų medžiagų chemiją Hedwal, kaip teoriškai galimos reakcijos pavyzdys, sukelia kalcio karbonato reakciją su SiO2, dėl kurio susidaro kalcio silikatas. Jis priduria šį pavyzdį, pažymėdamas, kad vadinamosiomis geoterminėmis metamorfozėmis nepakanka įprastos temperatūros, nes kalcio karbonato ir silicio rūgšties reakciją galima stebėti tik esant 500 C temperatūrai.
Siekiant sumažinti skreplių susidarymo kainą šiame procese, „Klima“ ir „Ward“ pasiūlė naudoti amonio karbonato tirpalą (vietoj amonio nitrato) ir sukurti skreplių dėl prisodrinto amonio karbonato reakcijos su kalkėmis.
Kai temperatūra pakyla, reakcija pereina link daugiau šarminio silikato. Gibson ir Ward11 dėl natrio karbonato ir kvarco reakcijos, esant 726-805 ° C temperatūrai, azoto sraute parodė, kad orto-silikatas susidaro esant pakankamam natrio karbonato kiekiui. Reakcijos greitis priklauso nuo laiko, mėginio dydžio, dujų srauto greičio ir reakcijos mišinio sudėties. Gibsonas ir Wardas teigia, kad yra vidutinio lygio natrio silikatai.
Natrio karbonato perteklius titruojamas druskos rūgštimi. Sieros kiekis analizuojamame produkte apskaičiuojamas reagavusio natrio karbonato kiekiu.
Ir kalcio karbonatas ir kaip šie cheminiai junginiai sąveikauja.
Kalcio karbonatas
CaCO₃ kalcio karbonato grotelėsCaCO₃ yra labai dažnas junginys pasaulyje, kurį sudaro: kreida, kalkakmenis, marmuras ir kt. Todėl verta pažymėti, kad šios medžiagos vaidmuo žmonėms yra labai svarbus, nes kalcio karbonatas plačiai naudojamas maisto pramonėje, kaip natūralus baltas dažiklis. CaCO₃ taip pat naudojamas gaminant popierių, plastiką, statyboje ir daugelyje kitų sričių.
Kalcio karbonatas yra balta medžiaga (kietieji kristalai) miltelių arba kietos formos. Jis sugeba reaguoti su vandeniu, bet jo ne visiškai ištirpsta. Todėl vanduo tampa drumstas, jame yra baltos nuosėdos. Bet jei reakcija su vandeniu prasidės, tuomet mes gausime tirpią rūgšties druską, kalcio bikarbonatą:
CaCO2 + CO₂ + H20 → Ca (HCO₃)
Apsvarstykite, kaip gaminamas kalcio karbonatas.
Dauguma kalcio karbonato gaunama iš natūralių šaltinių. Taigi, norėdami gauti kalcio karbonatą, paprastai naudokite švarų šaltinį, dažnai marmurą.
 Michelangelo Buonarroti marmuro statula
Michelangelo Buonarroti marmuro statula
Tačiau laboratorinėmis sąlygomis kalcio karbonatas gali būti gaunamas kalcinuojant kalcio oksidą. Apskaičiavimas reiškia apibendrintą degimo sąvoką, dėl kurios cheminės medžiagos įgyja naujų savybių. Šaudymas atliekamas pakankamai aukštoje temperatūroje, nesiekiant lydymosi.
Vanduo sumaišomas su gautu kalcio oksidu, reakcija sukuria hidroksidą. Tada technikai gauna anglies dioksidą, kuris patenka į anksčiau gautą tirpalą. Susidariusios nuosėdos yra kalcio karbonatas:
CaO + H20 = Ca (OH);
Ca (OH) + CO2 = CaCO2 + H20
Jei šildome anglies rūgšties ir kalcio druską į aukštą temperatūrą (900–1000 ° C), tada dėl cheminio proceso gausime anglies dioksidą (anglies dioksidą), taip pat kalcio oksidą CaO, kuris naudojamas statyboje:
CaCO₃ = CaO + CO₂
Jei temperatūra yra dar didesnė (1500 ° C), reakcijos produktai bus kalcio karbidas ir anglies monoksidas.
Druskos rūgštis
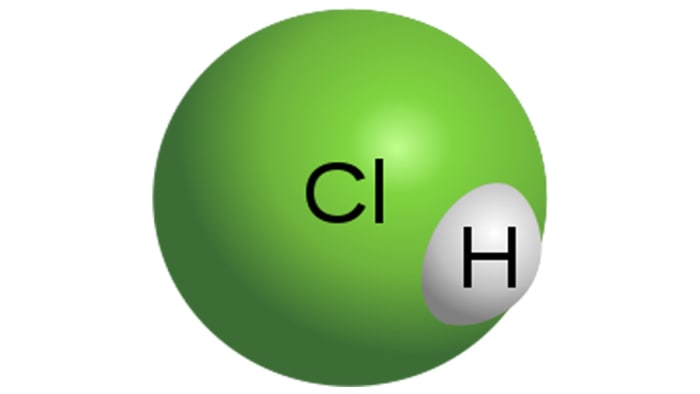 Druskos rūgšties molekulė
Druskos rūgšties molekulė
HCl yra stipri monobazinė rūgštis, gaunama ištirpinant vandenilio chloridą vandenyje. Tai yra bespalvis skystis, nors techninė rūgštis gali būti geltonos spalvos, pavyzdžiui, dėl geležies priemaišos. HCl savybės tiesiogiai priklausys nuo vandenilio chlorido koncentracijos tirpale.
Druskos rūgšties druskos vadinamos chloridais. Ši medžiaga yra labai šarminė, todėl reikia kruopščiai tvarkyti: net jei ant odos patenka mažas lašas, negalima išvengti stipraus cheminio nudegimo. Todėl dirbant su stipriomis rūgštimis patartina visuomet nešiotis neutralizatorių: silpni šarminiai tirpalai, (soda) ir kt. Verta prisiminti, kad atidarius talpyklą su koncentruotomis rūgštimis susidaro HCl garai, kurie neigiamai veikia akis ir kvėpavimo takus. Todėl cheminiais eksperimentais geriausia naudoti respiratorių ir akinius.
Vandenilio chlorido rūgštis
Vandenilio chlorido dujos yra ištirpintos vandenyje. Pats vandenilio chloridas gaunamas taip: vandenilis sudeginamas chloru, taip gaunant sintetinę rūgštį. Kita vertus, druskos rūgštį galima gauti naudojant šonines dujas, kurios gaunamos keliais cheminiais bandymais, pavyzdžiui, kai chloruoti angliavandeniliai yra chlorinti. Tokiu būdu gauta rūgštis vadinama abrazyvu.
Taikyti druskos rūgštį medicinoje, pramonėje ir cheminėms reakcijoms.
Bespalvė rūgštis, turinti aštrų vandenilio chlorido kvapą, gerai reaguoja su metalais. Atsiranda redoksinė reakcija. Reakcijos procese redukuojančios medžiagos yra metalo atomai, o oksidatoriai yra vandenilio katijonai.
Daugiausia cheminių reakcijų su metalais lydi vandenilis. Sąveikos intensyvumas priklauso nuo metalo aktyvumo, pavyzdžiui, šarminio metalo ličio reakcija smarkiai reaguoja, o reakcija su aliuminiu yra silpna dėl šio elemento stipraus oksido plėvelės.
Druskos rūgštis ir cinkas:
2HCl + Zn = ZnCl2 + H₂
Druskos rūgštis ir geležis:
2HCl + Fe = FeCl2 + H₂
Druskos rūgštis ir magnis:
2HCl + Mg = MgCl2 + H₂
 Magnio chloridas, naudojamas keliams iš ledo valyti
Magnio chloridas, naudojamas keliams iš ledo valyti
Su metalo oksidais, rūgštis sudaro druską ir vandenį:
CuO + 2HCl = CuCl2 + H20
Druskos rūgšties ir kalcio karbonato reakcija
Eksperimentui reikės:
mėgintuvėlis;
cheminė pipetė;
kietas kalcio karbonatas (marmuras);
druskos rūgštis;
pirštinės;
respiratorius.
Dėmesio! Nebandykite šios patirties!
Atlikite eksperimentą gerai vėdinamoje vietoje, dirbdami su druskos rūgštimi, būkite atsargūs.
Į indą įpilkite kelis marmuro gabalus ir pipete supilkite druskos rūgšties. Dėl to susidarys momentinė reakcija su burbulų susidarymu - išsiskiria anglies dioksidas. Tai yra keitimosi reakcija, kurios produktai yra: silpnas ir nestabilus junginys, anglies rūgštis, kuri skaidosi į anglies dioksidą ir vandenį. Kalcio karbonato ištirpinimo druskos rūgštyje lygtis:
CaCO2 + 2HCl (praskiedimas) → CaCl2 + CO₂ + H20
- būdingas magnio elementui: elektroninė struktūra, galimos oksidacijos būsenos, baziniai junginiai: oksidas, hidroksidas, druskos. Kas yra karbonizacija ir koks jo vaidmuo statant.
MgCO 3 = MgO + CO 2
Taikymas.
Pramonėje jis naudojamas ugniai atsparių medžiagų, cemento gamybai ir naftos produktų valymui, kaip gumos gamybos užpildas. Itin lengvas magnio oksidas naudojamas kaip labai smulkus abrazyvas paviršių valymui, ypač elektronikos pramonėje.
Medicinoje jis vartojamas esant padidėjusiam skrandžio sulčių rūgštingumui, nes jį sukelia per didelis druskos rūgšties kiekis. Nudegusios magnezijos taip pat laikoma, kai rūgštis atsitiktinai patenka į skrandį.
Maisto pramonėje ji yra įregistruota kaip maisto priedas E530.
Tai absoliutus atšvaitas - medžiaga, kurios atspindžio koeficientas yra lygus plačiam spektriniam diapazonui. Galima naudoti kaip baltą standartą.
Magnio hidroksidas - Pagrindinis metalo hidroksidas yra magnis. Silpna netirpi bazė.
Standartinėmis sąlygomis magnio hidroksidas yra bespalvis šešiakampis tinklelis. Esant aukštesnei nei 350 ° C temperatūrai, jis suskaido į magnio oksidą ir vandenį. Anglies dioksidą ir vandenį sugeria iš oro, kad susidarytų pagrindinis magnio karbonatas. Magnio hidroksidas beveik netirpsta vandenyje, bet tirpsta amonio druskose. Tai silpna bazė. Jis atsiranda gamtoje kaip mineralinis brucitas.
Gavimas.
Tirpių magnio druskų sąveika su šarmais:
Apskritai:
Mg 2+ + 2OH - = Mg (OH) 2 ¯
Pavyzdžiai:
MgCl2 + 2NaOH = Mg (OH) 2 + + 2NaCl
Mg (NO3) 2 + 2KOH = Mg (OH) 2 ¯ + 2KNO3
Magnio chlorido tirpalo ir deginto dolomito sąveika:
MgCl2 + CaO × MgO + 2H2O = 2 Mg (OH) 2 ¯ + CaCl2
Metalo magnio ir vandens garų sąveika:
Mg + 2H 2 O = Mg (OH) 2 ¯ + H 2 -
Cheminės savybės
Kaip ir visos silpnos bazės, magnio hidroksidas yra termiškai nestabilus. Suyra, kai kaitinama iki 350 ° C:
Sąveika su rūgštimis sudaro druską ir vandenį (neutralizavimo reakcija):
Mg (OH) 2 + 2HCl = MgCl2 + 2H2O
Mg (OH) 2 + H2S04 = MgS04 + 2H2O
Sąveika su rūgštiniais oksidais, sudarant druską ir vandenį:
Mg (OH) 2 + SO3 = MgS04 + H20
Sąveika su karštais koncentruotais šarmų tirpalais susidarant hidroksimetagams: \\ t
Mg (OH) 2 + 2NaOH = Na2
Mg (OH) 2 + Sr (OH) 2 = Sr
Taikymas.
Magnio hidroksidas naudojamas sieros dioksido, kaip nuotekų valymo flokuliantui, prijungti kaip liepsną termoplastiniuose polimeruose (poliolefinuose, PVC), kaip ploviklių priedas, gaminant magnio oksidą, cukraus rafinavimą, kaip dantų pastos komponentą.
Medicinoje jis naudojamas kaip vaistas neutralizuoti rūgštį skrandyje, taip pat labai stiprus vidurius.
Europos Sąjungoje magnio hidroksidas yra registruotas kaip maisto priedas E528.
Magnio druskos.
Dauguma magnio druskų labai gerai tirpsta vandenyje. Ion Mg 2+ suteikia tirpalams kartaus skonio. Magnio halogenidai, išskyrus MgF2, yra labai higroskopiški - jie kraujuoja ore.
Magnio chloridas MgCl2 (magnio chloridas) bevandenis lydosi esant 718 °. Jei yra vandens pėdsakų, jis „rūksta“ ore - jis suskaido į HCl ir MgO. Iš vandeninio tirpalo išsiskiria bespalviai kristaliniai hidratai su 1, 2, 4, 6, 8 ir 12 vandens molekulių. Temperatūros diapazone nuo –3,4 iki 116,7 °, kristalinis MgCl 2 × 6H 2 0 hidratas yra stabilus, kuris natūraliai atsiranda kaip bischofito mineralas, ir dideliais kiekiais gaunamas išgarinant jūros sūrymus. Magnio chloridas sudaro dvigubas druskas, iš kurių ypač svarbus yra magnio ir kalio chlorido šaltinis - mineralinis karnalitas KCl × MgCl 2 × 6H 2 O.
Taikymas.
1. Magnio chloridas daugiausia naudojamas metalinio magnio gamyboje, magnio cemento gamybai naudojamas MgCl 2 × 6H 2 0.
2. Naudojamas ledo ir sniego dangos apdorojimui kaip priedas. Reakcija su sniegu sukelia lydymą. Ji turi trečiąją pavojingumo klasę (vidutiniškai pavojingas medžiagas) ir agresyvias korozines savybes.
Magnio bikarbonatas - magnio ir anglies rūgšties rūgšties druska, kurios formulė Mg (HCO 3) 2, yra tik vandeniniuose tirpaluose.
Gavimas.
Anglies dioksido perdavimas per magnio karbonato suspensiją:
MgCO 3 + CO 2 + H2O = Mg (HCO 3) 2
Fizinės savybės.
Magnio bikarbonatas yra tik vandeniniuose tirpaluose.
Magnio bikarbonato buvimas vandenyje sukelia laikiną standumą.
Cheminės savybės
Koncentruojant tirpalą, magnio bikarbonatas suyra:
Mg (HCO3) 2 = MgCO 3 + CO 2 - + H 2 O
Magnio hidrofosfatas (pakeistas magnio fosfatas) - rūgštinė magnio ir fosforo rūgšties druska, kurios formulė MgHPO 4, šiek tiek tirpsta vandenyje, sudaro kristalinius hidratus.
Gavimas.
Ortofosforo rūgšties poveikis magnio oksidui arba magnio karbonatui:
MgO + H3P04 = MgHPO4 + H20
MgCO3 + H3P04 = MgHPO4 + CO 2 - + H20
Diaubstituuoto natrio ortofosfato poveikis magnio chloridui:
MgCl2 + 2Na 2 HPO 4 = MgHPO4 + 2NaCl
Dihidrofosfato magnio skaidymasis:
Mg (H2P04) 2 = MgHPO4 + H3P04
Fizinės savybės.
Magnio vandenilio fosfatas sudaro baltus kristalus, kurie yra kristaliniai hidratai: esant temperatūrai iki 225 ° C, susidaro MgHPO4 monohidratas. H2O, tankis 2,32 g / cm³, esant 36 ° C temperatūrai, susidaro MgHPO4 trihidratas. 3H2O, tankis 2,10 g / cm³, su kambario temperatūros Susidaro MgHPO4 heptahidratas. 7H2O.
Cheminės savybės.
Įkaitinus patenka į pirofosfatą:
Taikymas.
Naudojamas maisto papilduose E343.
Magnio dihidrofosfatas - magnio ir ortofosforo rūgšties metalo rūgšties druska, kurios formulė yra Mg (H 2 PO 4) 2, bespalviai higroskopiniai kristalai, tirpūs vandenyje, sudaro kristalinius hidratus.
Gavimas.
Hidroksido arba magnio oksido ištirpinimas ortofosforo rūgštyje: \\ t
Fizinės savybės.
Magnio dihidrofosfatas sudaro bespalvius kristalus.
Sukurta Mg (H2P04) 2 kristalinė hidrato kompozicija. nH2O, kur n = 2, 4, 6.
Magnio karbidas - dvejetainis neorganinis magnio ir anglies junginys, kurio formulė yra MgС2. Taip pat žinomas magnio karbidas, kurio formulė yra Mg 2 C.
Gavimas.
Sintetinis magnio fluoridas ir kalcio karbidas:
Tekantis acetilenas per magnio miltelius:
Atkuriant pentaną su magnio milteliais 650 ° C temperatūroje, galima gauti sudėtingesnį karbido Mg2C3.
Cheminės savybės.
Įkaitinus suyra, susidarant Mg2C3 tarpiniam karbidui:
Sąveikauja su vandeniu:
Magnio karbonatas, magnio karbonatas, MgCO 3 - magnio druskos anglies rūgštis.
Savybės
Balti kristalai, tankis 3,037 g / cm3. 500 ° C temperatūroje jis pastebimas, o 650 ° C temperatūroje jis visiškai suskaidomas į MgO ir CO2. Magnio karbonato tirpumas vandenyje yra nereikšmingas (22 mg / l 25 ° C temperatūroje) ir mažėja, didėjant temperatūrai. Kai CO 2 yra prisotinta vandenine MgCO 3 suspensija, pastaroji ištirpsta dėl Mg (HCO 3) 2 bikarbonato susidarymo. Iš vandeninių tirpalų, nesant CO 2, išsiskiria baziniai magnio karbonatai. Karbonatais, kuriuose yra daugelio metalų, magnio karbonatas sudaro dvigubas druskas, įskaitant natūralų mineralinį dolomitą MgCO 3 · CaCO 3.
Paplitimas gamtoje.
Magnio karbonatas gamtoje yra plačiai paplitęs mineralinio magnezito pavidalu.
Taikymas.
Bazinis magnio karbonatas 3MgCO 3 · Mg (OH) 2 · 3H 2 O (vadinamasis balta magnezija) naudojamas kaip guminių junginių užpildas šilumos izoliacinėms medžiagoms gaminti.
Magnio karbonatas reikalingas stiklo, cemento, plytų gamybai.
Magnio nitratas Mg (NO 3) 2 - bespalviai higroskopiniai kristalai su kubiniais grotelėmis; lydymosi temperatūra 426 ° C (suirstant). Tirpumas vandenyje (g 100 g): 73,3 (20 ° C), 81,2 (40 ° C), 91,9 (60 ° C). Taip pat tirpsta etanolyje, metanolyje, skystame NH3. Priklausomai nuo koncentracijos, vandeniniai tirpalai kristalizuoja ne-, heksa- ir dihidratus.
Sudėtinių trąšų komponentas, nes magnis yra dalis chlorofilo, kuris yra būtinas fotosintezei, didina daugelio fermentų aktyvumą ir veikia kaip fosforo transporteris. Dėl didelio tirpumo ir mažo elektros laidumo produktas yra ypač tinkamas lapų šėrimui ir tręšimui, ypač naudojant drėkinimo vandenis, kuriuose yra didelė druskos koncentracija. Trąšos naudojamos daržovių, uogų, vaisinių kultūrų, vynuogių šaknų ir lapų mitybai; oksidatorius pirotechnikos kompozicijose.
Karbonizavimas- bet kurio tirpalo prisotinimas anglies dioksidu. Naudojamas statyboje.
Mineralinis karbonizavimas - silicio rūgštis silikate pakeičiama anglies rūgštimi, kad susidarytų karbonatai. Iš karbonatų nuosėdų uolienos formuojantis mineralas yra kalcitas (kalkių sparčiai) CaCO3. Magnesitas - MgCO3 ir dolomitas - CaMg (CO3) 2 yra mažiau paplitę. Į švarus vanduobe kalcio rūgšties, kalcitas yra ištirpinamas nedideliame kiekyje (0,03 g / l vandens); magnezitas yra beveik netirpus. Jei vandenyje yra anglies dioksido, kalcitas lengvai ištirpsta susidaro rūgštinis kalcio karbonatas, tirpus vandenyje - Ca (HCO3) 2.
Karbonizacija yra betono pakitimas Portlandcementui, kai jis yra veikiamas C0 2 oru. Ypač paveikiamas kalcio hidroksido Ca (OH) 2, esant drėgmei. Kalcio hidroksidas paverčiamas kalcio karbonatu, kai jis sugeria anglies dioksidą. Kalcio karbonatas blogai tirpsta vandenyje ir todėl linkęs hermetiškai uždaryti betono paviršiaus poras (ty tankų, vandeniui atsparų betoną).
Paprastai betono vandens porų pH yra nuo 10,5 iki 11,5. Jei dėl karbonizacijos jis sumažėja iki 9 ir žemiau, tai gali būti sustiprinta armatūra. Todėl karbonizuoto sluoksnio storis yra svarbus faktorius apsaugant armatūrą: kuo giliau karbonizacija, tuo didesnis plieno korozijos pavojus. Karbonizacijos gylį galima nustatyti apdorojant betoną fenolftaleinu. Šarminių savybių, veikiančių fenolftaleino, buvimą rodo rožinės spalvos išvaizda, o gazuotasis betonas išlaiko savo originalią spalvą.
Aukštos kokybės tankus betonas labai lėtai karbonizuojamas. Mažai tikėtina, kad karbonizacija bus stebima daugiau kaip 5–10 mm gylyje net po 50 metų eksploatavimo. Kita vertus, mažo stiprio pralaidumo betono karbonizavimo gylis per mažiau nei 10 metų gali siekti 25 mm. Patirtis rodo, kad žemos kokybės betono gaminiai yra ypač jautrūs karbonizacijai.
- būdingas kalcio elementui: elektroninė struktūra, galimos oksidacijos būsenos, pagrindiniai junginiai: oksidas, hidroksidas, druskos.
Kalcis - antrosios grupės pagrindinio pogrupio elementas, ketvirtasis periodinių cheminių elementų lentelės periodas DI Mendeljevas, su atominiu skaičiumi 20. Jis žymimas simboliu Ca (lat. kalcio). Elektroninė struktūra 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 = [18 Ar] 4s 2, oksidacijos būsena +2, 0. Nurodo šarminius žemės metalus.
Paprasta medžiaga kalcis yra minkštas, chemiškai aktyvus šarminio žemės metalas, sidabro baltos spalvos. Pramoninė gamyba: lydyto kalcio chlorido elektrolizė.
Kalcio oksidas CaO - bazinis oksidas, kalkės. Balta, higroskopinė. Ugniai atsparus, termiškai nestabilus, lakus degimo metu. Aktyviai reaguoja su vandeniu (su dideliu exo efektu), sudaro stipriai šarminį tirpalą, procesas vadinamas kalkių slinkimu. Reaguoja su rūgštimis, metalų oksidais, nemetalais. Jis naudojamas kitų kalcio junginių, statyboje esančių rišamųjų medžiagų komponento, sintezei.
Gamyba pramonėje - kalkakmenio deginimas (900 - 1200 o C)
Kalcio hidroksidas Ca (OH) 2 - hidratuotas kalkės, bazinis hidroksidas. Skilimas su vidutiniu šildymu. Balta, higroskopinė. Sugeria drėgmę ir anglies dioksidą iš oro. Švelniai tirpsta šaltame. vandens, dar mažiau - verdančiame vandenyje. Skaidrus tirpalas (kalkių vanduo) greitai tampa drumstas dėl hidroksido nusodinimo (suspensija vadinama kalkių pienu). Kokybinė reakcija yra anglies dioksido perdavimas per kalkių vandenį, atsirandant CaCO3 nuosėdoms ir pereinant prie tirpalo. Reaguoja su rūgštimis ir rūgšties oksidais, patenka į jonų mainų reakcijas.
Jis naudojamas statyboje kalkių skiedinio (smėlio + slakinto kalkių + vandens) paruošimui, kuris naudojamas kaip klijų medžiaga akmens ir plytų, apdailos (tinkavimo) sienoms ir kitiems statybos tikslams. Tokių tirpalų kietėjimas priklauso nuo CO2 absorbcijos iš oro.
Ca (OH) 2 + CO 2 → CaCO3 ↓ + H20
Ca (OH) 2 + H2S04 → CaSO4 + 2H2O,
Reaguoja su druskomis, jei susidaro nuosėdos:
Ca (OH) 2 + Na2S03 → CaSO3 ↓ + 2NaOH
Kalcio druskos.
Kalcio sulfatas (CaSO 4) - neorganinis junginys, sieros rūgšties kalcio druska.
Rasta gamtoje kaip CaSO 4 dihidratas? 2H 2 O (gipsas, selenitas) ir bevandenėje būsenoje - anhidritas.
Kalcio chloridas, CaCl2 - druskos rūgšties kalcio druska.
Turi aukštas higroskopines savybes. Tirpumas (g 100 g H2O): 74 (20 ° C) ir 159 (100 ° C). Kalcio chlorido vandeniniai tirpalai užšaldomi žemoje temperatūroje (20% esant –18,57 ° C temperatūrai, 30% esant –48 ° C temperatūrai).
Formuoja CaCl2 · 6H2O hidratą, stabilų iki 29,8 ° C; aukštesnėje temperatūroje kristaliniai hidratai, turintys 4, 2 ir 1 H2O molekules, patenka iš sočiųjų tirpalo. Kai CaCl2 * 6H2O (58,8%) sumaišoma su sniegu ar ledu (41,2%), temperatūra nukrenta iki -55 ° C (kriohidrato taškas).
Kalcio chloridas gaunamas kaip šalutinis produktas gaminant sodą.
Chemijos laboratorijoje kalcio chloridas naudojamas kaip džiovinimo vamzdžių, taip pat vadinamų kalcio chloridu, užpildas, skirtas inde esančioms medžiagoms išskirti iš atmosferos vandens garų ir dujų džiovinimo.
Kalcio chloridas taip pat naudojamas kaip cemento pagreitis;
Kalcio karbonatas (kalcio karbonatas) - neorganinis cheminis junginys, anglies rūgšties druska ir kalcis. Cheminė formulė —CaCO 3. Gamtoje jis randamas mineralų pavidalu - kalcitas, aragonitas ir vateritas yra pagrindinė kalkakmenio, marmuro, kreidos dalis, yra kiaušinių lukšto dalis. Netirpsta vandenyje ir etanolyje.
Glaistai, įvairūs hermetikai - visi juose yra daug kalcio karbonato. Be to, kalcio karbonatas yra esminė buitinių cheminių medžiagų gamybos dalis.
Kalcio karbonatas taip pat plačiai naudojamas valymo sistemose, kaip priemonė kovoti su aplinkos tarša, o naudojant kalcio karbonatą atkuriamas dirvožemio rūgšties ir bazės balansas.
- Pavyzdžiai, iliustruojantys kalcio ir magnio oksidų ir hidroksidų naudojimą statyboje.
Kalcio oksidas ir hidroksidas:
Kai skalbimo patalpos.
Valant medines tvoras ir užtepus gegnes - siekiant apsaugoti nuo puvimo ir gaisro.
Kalkių skiedinio paruošimui. Kalkės buvo naudojamos mūro statybai nuo seniausių laikų. Paprastai mišinys paruošiamas tokiu santykiu: į vieną dalį kalcio hidroksido (hidratuotų kalkių) ir vandens mišinio pridedama trijų ar keturių smėlio dalių (pagal svorį). Tokiu atveju mišinys sukietėja reakcijos būdu: Ca (OH) 2 + CO2 → CaCO3 ↓ + H2O. Tai yra egzoterminė reakcija, energijos išsiskyrimas yra 27 kcal (113 kJ).
Kaip matyti iš reakcijos, per jį išsiskiria vanduo. Tai yra neigiamas veiksnys, nes patalpose, pastatytose kalkių skiediniu, didelis drėgnumas išlieka ilgą laiką. Šiuo atžvilgiu, taip pat dėl daugelio kitų privalumų, palyginti su kalcio hidroksidu, cementas jį praktiškai pakeitė kaip statybinių tirpalų rišiklį. Be to, jis yra nepriimtinas naudoti krosnelėms kloti, nes esant aukštai temperatūrai, išsiskiria anglies dioksidas.
Silikatinio betono paruošimui. Silikato betono sudėtis yra identiška kalkių skiedinio sudėčiai, tačiau ji gaminama kitu būdu - kalcio oksido ir kvarco smėlio mišinys nėra apdorojamas vandeniu, bet perkaitintu (174,5-197,4 ° C) vandens garu autoklave, esant 9-15 atmosferų slėgiui.
Silikatinių plytų gamyboje.
Oksidas ir magnio hidroksidas:
kombinuotų ugniai atsparių medžiagų (magnezito statybinių plokščių) gamybai cemento gamybai. Magnio oksidas (kaustinis magnezitas) naudojamas kaip rišiklis, kuris, sumaišytas su MgCl2 tirpalu, gali greitai sukietėti ir stiprinti orą.
- natūralių vandenų kietumas: apibrėžimas, kietumo tipai, vandens kietumo pašalinimo metodai: fizinės, cheminės (reakcijos lygtys), fizikinės ir cheminės.
Natūralus vanduo, turintis didelį kiekį kalcio ar magnio druskų tirpale, vadinamas kietuoju vandeniu, o ne minkštu vandeniu, kuriame yra mažai kalcio ir magnio druskų.
Pirmasis iš jų yra kalcio ir magnio bikarbonatų buvimas, antrasis - stiprių rūgščių, sulfatų arba kalcio ir magnio chloridų druskų buvimas. Ilgą laiką virinant vandenį su karbonato kietumu, jame atsiranda nuosėdos, daugiausia susidedančios iš CaCO3, ir kartu išsiskiria CO2.
Abi šios medžiagos atsiranda dėl kalcio karbonato skilimo:
Todėl karbonato standumas taip pat vadinamas laikinu standumu. Kiekybiškai laikinasis standumas pasižymi bikarbonatų kiekiu, pašalintu iš vandens, kai jis virinamas vieną valandą. Po tokio virimo likęs standumas vadinamas pastoviu standumu.
Vandens kietumas išreiškiamas vandenyje esančių kalcio ir magnio jonų miliekvivalentų suma. Vienas miliekvivalentas standumo atitinka 20,04 mg / l arba 12,16 mg / l.
Natūralių vandenų kietumas labai skiriasi. Skirtingose rezervuaruose jis skiriasi, o toje pačioje upėje ištisus metus (minimalus potvynių metu). Jūrų vandenų kietumas yra daug didesnis nei upių ir ežerų. Taigi Juodosios jūros vanduo turi kietumą 65,5 meq / l. Vidutinė pasaulio vandenyno vandens kietumo vertė yra 130,5 meq / l (įskaitant 22,5 meq / l / meq / l).
Didelio kiekio kalcio ar magnio druskų buvimas vandenyje daro vandenį netinkamą daugeliui techninių tikslų. Taigi, ilgai maitinant garo katilus su kietu vandeniu, jų sienos palaipsniui padengtos tankiu nakiii pluteliu. Toks plutos storis jau žymiai sumažina šilumos perdavimą katilo sienose ir todėl padidina kuro sąnaudas. Be to, tai gali sukelti pūslių susidarymą ir įtrūkimus tiek šildymo vamzdžiuose, tiek pačioje katilo sienoje.
Kietasis vanduo nesuteikia muilo su putomis, nes tirpios riebalų rūgščių natrio druskos - palmitinės ir stearinės - į muilą yra transformuojamos į netirpias tų pačių rūgščių kalcio druskas:
Kietas vanduo negali būti naudojamas atliekant kai kuriuos technologinius procesus, pavyzdžiui, dažant.
Pastovus vandens kietumas kyla dėl to, kad juose yra daugiausia kalcio ir magnio sulfatų ir chloridų, o ne virinant. Laikinojo (nuimamo) ir pastovaus kietumo suma yra bendras vandens kietumas.
Yra įvairių būdų nustatyti standumą.
Apsvarstykite du iš jų:
1) laiko standumo nustatymas titruojamu druskos rūgšties tirpalu
2) kompleksinis metodas, skirtas nustatyti bendrą standumą.
Titruojant vandens mėginį su vandenilio chlorido rūgštimi, kai yra oranžinės spalvos, atsiranda bikarbonatų skilimas, kuris sukelia laikiną nelankstumą:
Nustatymo metodas. 100 ml bandomojo vandens įpilama į kūginę kolbą su pipete arba matavimo cilindru, pridedama 2-3 lašai metilo apelsino ir titruojami 0,1 ir 0,1 ml. HCl tirpalas, kol pasirodys oranžinė spalva.
Skaičiavimo rezultatų analizė. 1 ml 0,1 n. HCl tirpalas atitinka 0,1 / 1000 g ekv. Arba 0,1 mg ekv. Ca 2+. V (HCl) atitinka 0,1 V (HCl) / 1000 g ekv. Arba 0,1 V (HCl) mg-ekv. Ca 2+. 0,1 V (HCl) mEq yra V tūrio. Norint išreikšti miligramo ekvivalentų standumą 1 l vandens, reikia padalinti vertę, gautą iš VA, ir padauginti iš 1000, t. Y. Tiriamo vandens kietumas yra:
![]()
Pašalinimo metodai.
Terminis minkštinimas. Remiantis termiškai nestabiliu kalcio ir magnio bikarbonatais, dėl vandens virimo, susidaro skalė:
Ca (HCO3) 2 → CaCO3 ↓ + CO2 + H2O.
Virimas pašalina tik laikiną (karbonato) kietumą. Randa taikymą gyvenime.
Reagento minkštinimas. Metodas pagrįstas natrio karbonato Na2CO3 arba hidratuoto kalkių Ca (OH) 2 pridėjimu į vandenį. Tuo pačiu metu kalcio ir magnio druskos patenka į netirpius junginius ir dėl to susidaro nuosėdos.
Pavyzdžiui, pridėjus hidratuotą kalkę kalcio druskos paverčiamas netirpiais karbonatais:
Ca (HCO3) 2 + Ca (OH) 2 → 2CaCO3 ↓ + 2H2O
Geriausias reagentas vandeniui pašalinti yra natrio ortofosfatas Na3PO4, kuris yra daugelio namų ūkio ir pramonės produktų dalis:
3Ca (HCO3) 2 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 6NaHCO3
3MSO4 + 2Na3PO4 → Mg3 (PO4) 2 ↓ + 3Na2SO4
Kalcio ir magnio ortofosfatai yra labai prastai tirpūs vandenyje ir todėl lengvai atskiriami mechaniniu filtravimu. Šis metodas pagrįstas santykinai dideliu vandens suvartojimu, nes jis susijęs su tam tikrų specifinių problemų sprendimu: nuosėdų filtravimu, tiksliu reagento dozavimu.
Katijonizacija. Metodas pagrįstas jonų mainų granulių pakrovimo (dažniausiai jonų mainų dervų) naudojimu. Tokia sąlyčio su vandeniu apkrova sugeria kietumo druskų katijonus (kalcio ir magnio, geležies ir mangano). Vietoj to, priklausomai nuo jonų formos, jis išskiria natrio arba vandenilio jonus. Šie metodai yra atitinkamai vadinami Na-kationizavimu ir H-kationizacija. Tinkamai parinkta jonų mainų apkrova, vandens kietumas sumažėja, kai vienpakopis natrio katijimas yra iki 0,05-0,1 ° W, su dviejų pakopų pakrovimu - iki 0,01 ° W. Pramonėje jonų mainų filtrai pakeičia kalcio ir magnio jonus natrio ir kalio jonais, gamindami minkštą vandenį.
Grįžtamoji osmozė. Metodas pagrįstas vandens pernešimu per pusiau laidžią membraną (paprastai poliamidą). Kartu su kietumo druskomis pašalinama dauguma kitų druskų. Valymo efektyvumas gali siekti 99,9%.
Yra nanofiltracija (nominalus membranos skylių skersmuo yra lygus nanometrų vienetams) ir pikofiltracija (membranos skylių nominalus skersmuo yra lygus pikometrų vienetams).
Kaip šio metodo trūkumus reikėtų pažymėti:
Išankstinio vandens, tiekiamo į atvirkštinio osmoso membraną, apdorojimo poreikis;
Santykinai didelės 1 litro pagamintos vandens kainos (brangios įrangos, brangių membranų);
Nedidelis pagaminto vandens mineralizavimas (ypač kai yra pikofiltracija). Vanduo tampa beveik distiliuotas.
Elektrodializė Jis pagrįstas druskų pašalinimu iš vandens, veikiant elektriniam laukui. Ištirpusių medžiagų jonų pašalinimas atsiranda dėl specialių membranų. Kaip ir naudojant atvirkštinio osmoso technologiją, atsiranda kitų druskų pašalinimas, be kietumo jonų.
Visiškai švarus vanduo iš kietumo druskų gali būti distiliuotas.
