Seri genetik contoh non-logam. Hubungan genetik antar kelas zat - Pengetahuan Hypermarket
Ada hubungan genetik antara zat sederhana, oksida, basa, asam dan garam, yaitu kemungkinan transisi timbal balik mereka (transformasi).
Misalnya, zat sederhana - kalsium sebagai akibat interaksi dengan oksigen berubah menjadi oksida: 2Ca + O2 = 2CaO.
Kalsium oksida ketika berinteraksi dengan air membentuk kalsium hidroksida CaO + H 2 O = Ca (OH) 2, dan yang terakhir, ketika berinteraksi dengan asam, berubah menjadi garam: Ca (OH) 2 + H 2 SO 4 = CaSO 4 + 2 H 2 O.
Transformasi ini dapat diwakili oleh skema:
Ca → CaO → Ca (OH) 2 → CaSO 4
Skema serupa dapat ditulis untuk non-logam, misalnya belerang:
S → SO 3 → H 2 SO 4 → CaSO 4
Jadi, garam yang sama diperoleh dengan berbagai cara.
Transisi balik dari garam ke kelas lain dari senyawa anorganik dan zat sederhana juga dimungkinkan:
CuSO 4 → Cu (OH) 2 → CuO → Cu
CuSO 4 + 2NaOH = Cu (OH) 2 ↓ + Na 2 SO 4
Cu (OH) 2 = CuO + H 2 O
CuO + H 2 = Cu + H 2 O (reduksi tembaga)
Hubungan serupa antara kelas-kelas senyawa anorganik, berdasarkan pada produksi zat-zat dari satu kelas dari zat-zat lainnya, disebut genetik.
Sifat-sifat senyawa kompleks tercermin dalam skema genetik kelas utama senyawa anorganik (lihat gambar). Ini mencerminkan tahap pengembangan materi anorganik di sepanjang dua garis utama, dari logam khas ke logam non-khas dengan sifat yang berlawanan.
Logam yang sifat kimianya dari atom adalah kemampuan untuk menyumbangkan elektron, dan non-logam, yang sifat kimianya utama adalah kemampuan atomnya untuk menempelkan elektron yang berseberangan satu sama lain dalam sifat. Dengan komplikasi komposisi zat, kecenderungan yang berlawanan ini terus muncul.
Logam khas dan elemen transisi dalam tingkat oksidasi terendah membentuk oksida basa, sedangkan non-logam dan elemen transisi khas dalam keadaan oksidasi tinggi membentuk oksida asam yang berlawanan.
Zat sederhana
Amfoterik
Bukan logam
Oksida dasar
Amfoterik
Bersifat asam
Alasan
Amfoterik
hidroksida
Skema genetik dari kelas utama senyawa anorganik
Dengan komplikasi lebih lanjut dari komposisi zat, hidroksida terbentuk, oksida basa sesuai dengan basa, dan asam oksida sesuai dengan asam. Basa yang berlawanan dalam sifat dan asam secara aktif bereaksi satu sama lain, membentuk garam. Interaksi lawan adalah kekuatan pendorong reaksi. Oleh karena itu, oksida basa dan asam, basa dan asam secara aktif berinteraksi satu sama lain, dan dua oksida asam atau dua oksida basa tidak berinteraksi, karena sifatnya yang dekat.
Dengan demikian, sifat-sifat senyawa kompleks ditentukan berdasarkan sifat-sifat unsur penyusunnya. Hukum utama perubahan properti ini dirangkum dalam aplikasi berikut (Tabel 6).
1. Pada periode dengan peningkatan nomor urut, sifat-sifat unsur berubah dari logam menjadi non logam. Jumlah elektron pada tingkat eksternal meningkat, tingkat oksidasi elemen meningkat, jari-jari atom dan ion berkurang, energi ionisasi dan afinitas untuk peningkatan elektron. Sesuai dengan ini, basa menurun dan sifat asam oksida dan hidroksida meningkat.
2. Pada subkelompok utama, sifat-sifat dasar oksida dan hidroksida meningkat dengan meningkatnya jumlah atom. Untuk elemen kelompok samping dengan peningkatan jumlah urutan, perubahan sifat yang lebih kompleks adalah karakteristik. Pertama, sifat logam ditingkatkan dan kemudian dikurangi.
3. Logam aktif sesuai dengan oksida dan hidroksida dengan sifat dasar yang sangat jelas. Logam yang paling aktif adalah alkali dan alkali-tanah. Mereka membentuk oksida yang larut dalam air dan basa kuat yang larut - alkali.
4. Logam rendah-aktif (semua kecuali alkali dan alkali-bumi) membentuk basa lemah yang sulit larut dalam air:
Cu (OH) 2, Fe (OH) 3.
5. Oksida dan hidroksida dengan sifat asam yang sangat jelas berhubungan dengan non-logam aktif.
6. Logam amfoterik membentuk oksida dan hidroksida amfoter.
7. Jika suatu elemen menunjukkan tingkat oksidasi yang berbeda, maka oksida dan hidroksida dengan sifat yang berbeda sesuai dengannya.
Topik: SAMBUNGAN GENETIK ANTARA logam dan non-logam dan senyawanya. Kelas 9
Tujuan: pendidikan: untuk mengkonsolidasikan konsep "seri genetik", "koneksi genetik"; mengajarkan bagaimana membuat rangkaian unsur genetik (logam dan non-logam), untuk membuat persamaan reaksi yang sesuai dengan rangkaian genetik; periksa bagaimana pengetahuan dipelajari sifat kimia oksida, asam, garam, basa, berkembang: mengembangkan kemampuan untuk menganalisis, membandingkan, meringkas dan menarik kesimpulan, menyusun persamaan reaksi kimia; pendidikan: untuk mempromosikan pembentukan pandangan dunia ilmiah.
Menyediakan kelas: tabel "Sistem Berkala", "Tabel Kelarutan", "Seri Kegiatan Logam", instruksi untuk siswa, tugas untuk menguji pengetahuan.
Kemajuan: 1) Organisasi. saat ini
2) Periksa d / s
3) Pelajari materi baru
4) Penambat
5) D / C
1) Organisasi saat ini. Salam
2) Periksa d / s.
Koneksi genetik adalah koneksi antar kelas yang berbeda berdasarkan interkonversi mereka.
Mengetahui kelas zat anorganik, dimungkinkan untuk membuat seri genetik logam dan non-logam. Dasar dari seri ini adalah elemen yang sama.
Di antara logam ada dua jenis baris:
1
. Serangkaian genetik di mana alkali bertindak sebagai basa. Seri ini dapat direpresentasikan menggunakan transformasi berikut:logam → oksida basa → alkali → garam
Misalnya, K → K
2 O → KOH → KCl2
. Seri genetik, di mana basis adalah basis tidak larut, maka seri dapat direpresentasikan sebagai rantai transformasi:logam → basa oksida → garam → basa tidak larut →
→oksida dasar → logam
Misalnya, Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu
1
. Seri genetik non-logam, di mana asam larut bertindak sebagai penghubung dalam seri ini. Rantai transformasi dapat direpresentasikan sebagai berikut:non-logam → asam oksida → asam larut → garam
Misalnya, P → P
2 O 5 → H 3 PO 4 → Na 3 PO 42
. Seri genetik non-logam, di mana asam tidak larut berperan sebagai tautan dalam seri ini:non-logam → asam oksida → garam → asam →
→asam oksida → bukan logam
Sebagai contoh
Si→ Sio 2 → Na 2 Sio 3 → H 2 Sio 3 → Sio 2 → Si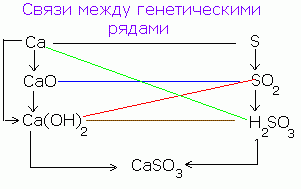
Percakapan frontal aktif:
Apa yang dimaksud dengan koneksi genetik? Koneksi genetik adalah koneksi antara kelas yang berbeda berdasarkan interkonversi mereka. Apa yang dimaksud dengan seri genetik?
Seri genetik - serangkaian zat - perwakilan dari kelas yang berbeda, yang merupakan senyawa dari satu unsur kimia, dihubungkan oleh interkonversi dan mencerminkan transformasi zat ini. Dasar dari seri ini adalah elemen yang sama.
Apa jenis seri genetik yang dapat dibedakan? Di antara logam, dua jenis seri dapat dibedakan:
a) Serangkaian genetik di mana alkali bertindak sebagai basa. Seri ini dapat direpresentasikan menggunakan transformasi berikut:
logam → oksida basa → alkali → garam
misalnya, seri genetik kalium K → K
2 O → KOH → KClb) Seri genetik, di mana basis adalah basis tidak larut, maka seri dapat direpresentasikan sebagai rantai transformasi:
logam → basa oksida → garam → basa tidak larut → oksida basa → logam
misalnya: Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → CuDi antara non-logam juga dimungkinkan untuk membedakan dua jenis baris:
a) Seri genetik non-logam, di mana asam larut bertindak sebagai penghubung dalam seri ini. Rantai transformasi dapat direpresentasikan sebagai berikut: non-logam → asam oksida → asam larut → garam.
Misalnya: P → P
2 O 5 → H 3 PO 4 → Na 3 PO 4b) Baris genetik non-logam, di mana asam tidak larut: non-logam → asam oksida → garam → asam → asam oksida → non-logam bertindak sebagai penghubung dalam rangkaian
Misalnya: Si → SiO
2 → Na 2 Sio 3 → H 2 Sio 3 → SiO 2 → SiEksekusi tugas untuk opsi:
1. Pilih formula oksida dalam versi Anda, jelaskan pilihan Anda, berdasarkan pengetahuan tentang karakteristik komposisi senyawa kelas ini. Panggil mereka.
2. Di kolom formula varian Anda, cari formula asam dan jelaskan pilihan Anda berdasarkan analisis komposisi senyawa-senyawa ini.
3. Tentukan valensi residu asam dalam komposisi asam.
4. Pilih formula garam dan beri nama.
5. Buat formula garam, yang dapat dibentuk dengan magnesium dan asam dari varian Anda. Tuliskan, beri nama.
6. Di kolom rumus variasi Anda, cari formula basa dan jelaskan pilihan Anda berdasarkan analisis komposisi senyawa ini.
7. Dalam varian Anda, pilih formula zat yang dengannya larutan asam ortofosfat (hidroklorik, sulfat) dapat bereaksi. Buat persamaan reaksi yang sesuai.
9. Di antara formula pilihan Anda, pilih formula zat yang dapat saling berinteraksi. Buat persamaan reaksi yang sesuai.
10. Buatlah rantai ikatan genetik senyawa anorganik, yang akan mencakup suatu zat, formula yang diberikan dalam versi Anda di nomor satu.
Opsi 1
Opsi 2
Cao
Tidak tahu
3Fe (OH)
3N
2 OZn (TIDAK
3 ) 2Cr (OH)
3H
2 SO 3H
2 SPbo
LiOH
Ag
3 PO 4P
2 O 5NaOH
Tidak
CO
2BaCl
2HCl
H
2 CO 3H
2 SO 4Cuso
4Dari zat-zat ini buat garis genetik menggunakan semua formula. Tulis persamaan reaksi yang dengannya Anda dapat mencapai rantai transformasi ini:
Opsi I: ZnSO
4, Zn, ZnO, Zn, Zn (OH) 2 : II opsi:Na 2 SO 4, NaOH, Na, Na 2 O 2 , Na 2 O4) Penambat1.
Al→ Al 2 O 3 → AlCl 3 → Al( OH) 3 → Al 2 O 32.
P→ P 2 O 5 → H 3 PO 4 → Na 3 PO 4 → Ca 3 ( PO 4 ) 23. Zn → ZnCl
2 → Zn (OH) 2 → ZnO → Zn (TIDAK 3 ) 24. Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu5.N
2 O 5 → HNO 3 → Fe (TIDAK 3 ) 2 → Fe (OH) 2 → FeS → FeSO 45) Pekerjaan Rumah:
bagan transisi bertahap dari kalsium ke kalsium karbonat dan siapkan laporan tentang penggunaan garam apa pun dalam pengobatan (menggunakan literatur tambahan).

Di antara logam, dua jenis baris dapat dibedakan: 1. Seri genetik, di mana alkali bertindak sebagai basa. Seri ini dapat direpresentasikan oleh transformasi berikut: logam - basa oksida - garam - alkali, misalnya, seri genetik kalium K - K 2 O - KOH - KCl.

2. Serangkaian genetik, di mana basa tidak larut bertindak sebagai basa, maka deret tersebut dapat direpresentasikan sebagai rantai transformasi: logam - basa oksida - garam - basa tidak larut - basa oksida - logam. Cu-- CuO-- CuCl 2 - Cu (OH) 2 - CuO -\u003e Cu seri genetik tembaga "\u003e Cu adalah seri genetik tembaga"\u003e "title =" (! LANG: 2. Seri genetik, di mana basis adalah basis yang tidak dapat larut, maka seri ini dapat direpresentasikan sebagai rantai transformasi: logam - oksida - garam - garam - tidak larut oksida utama adalah logam. Cu-- CuO-- CuCl 2 - Cu (OH) 2 - CuO -\u003e"> title="2. Serangkaian genetik, di mana basa tidak larut bertindak sebagai basa, maka deret tersebut dapat direpresentasikan sebagai rantai transformasi: logam - basa oksida - garam - basa tidak larut - basa oksida - logam. Cu-- CuO-- CuCl 2 - Cu (OH) 2 - CuO -\u003e"> !}
Di antara non-logam juga dimungkinkan untuk membedakan dua jenis baris: 1. Seri genetik non-logam, di mana asam larut bertindak sebagai penghubung dalam seri. Rantai transformasi dapat direpresentasikan sebagai berikut: non-logam - asam oksida - asam larut - -ol. P-- P 2 O 5 - H 3 PO 4 - Na 3 PO 4. Kisaran Genetika Fosfor

Ada hubungan genetik antara golongan senyawa anorganik. Dari zat sederhana Anda bisa mendapatkan kompleks dan sebaliknya. Dari senyawa dari satu kelas, Anda bisa mendapatkan senyawa dari kelas lain.
Hubungan genetik yang disederhanakan antara kelas-kelas senyawa anorganik dapat diwakili oleh skema berikut:
Urutan transformasi tersebut untuk non-logam dapat diwakili oleh skema berikut: CANPO 4
Р → Р 2 О 5 → Н 3 РО 4 → Са 3 (РО 4) 2
(Saon) 3 PO 4
Untuk logam tipikal, Anda dapat membuat rantai transformasi berikut:
Ba → BaO → Ba (OH) 2 → BaSO 4
Untuk logam yang oksida dan hidroksida bersifat amfoter (semimetal), transformasi berikut dapat dilakukan:
Al → Al 2 O 3 → Al (OH) 3 → Na → AlCl 3 → AlOHCl 2 → Al (OH) 3 → Al 2 O 3.
Tautan antar kelas:
1. Logam, bukan logam→ garam
Dengan interaksi langsung antara logam dan non-logam, garam asam bebas oksigen (halida, sulfida) terbentuk:
2Na + C1 2 = 2NaCl
Senyawa ini stabil dan tidak terurai saat dipanaskan.
2. Oksida dasar, oksida asam→ garam
CaO + CO 2 = CaCO 3;
Na 2 O + SO 3 = Na 2 SO 4.
3. Basa, asam→ garam
Itu dilakukan melalui reaksi netralisasi:
2NaOH + H 2 SO 4 = Na 2 SO 4 + 2 H 2 O,
HE - + H + → H 2 O;
Mg (OH) 2 + 2HC1 = MgCl 2 + 2H 2 O,
Mg (OH) 2 + 2H + → Mg 2+ + 2H 2 O.
4. Logam→ oksida dasar.
Sebagian besar logam berinteraksi dengan oksigen untuk membentuk oksida:
2Ca + O 2 = 2CaO;
4A1 + 3O 2 = 2A1 2 O 3.
Emas, perak, platinum, dan logam mulia lainnya tidak berinteraksi dengan oksigen, oksida dari logam tersebut diperoleh secara tidak langsung.
5. Bukan logam→ asam oksida.
Non-logam (dengan pengecualian halogen dan gas mulia) berinteraksi dengan oksigen, membentuk oksida:
4P + 5O2 = 2P2O5;
S + O 2 = SO 2.
6. Oksida dasar→ alasan.
Interaksi langsung dengan air hanya dapat diperoleh hidroksida dari logam alkali dan alkali-tanah (alkali):
Na 2 O + H 2 O = 2NOH;
CaO + H 2 O = Ca (OH) 2.
Alasan yang tersisa diperoleh secara tidak langsung.
7. Asam oksida→ asam.
Asam oksida bereaksi dengan air untuk membentuk asam yang sesuai:
SO 3 + H 2 O = H 2 SO 4;
Р 2 O 5 + 3H 2 O = 2H 3 PO 4.
Pengecualian adalah SiO 2, yang tidak bereaksi dengan air.
8. Basa, asam oksida→ garam
Alkali berinteraksi dengan oksida asam untuk membentuk garam:
2NaOH + SO 3 = Na 2 SO 4 + H 2 O,
2OH - + SO 3 = SO 4 2- + H 2 O;
Ca (OH) 2 + СO 2 = CaCO 3 ↓ + Н 2 O,
Ca 2+ + 2OH - + CO 2 → CaCO 3 ↓ + H 2 O.
9. Asam, oksida dasar→ garam
Logam oksida larut dalam asam, membentuk garam:
CuO + H 2 SO 4 = CuSO 4 + H 2 O,
CuO + 2H + = Cu 2+ + H 2 O;
Na 2 O + 2HS1 = 2NaCl + H 2 O,
Na 2 O + 2H + = 2Na + + H 2 O.
10. Alasan→ oksida dasar.
Basa tidak larut dan LiOH terurai ketika dipanaskan:
2LiOH = Li 2 O + H 2 O;
Cu (OH) 2 = CuO + H 2 O.
11. Asam→ asam oksida.
Asam yang mengandung oksigen yang tidak stabil terurai ketika dipanaskan (H 2 SiO 3) dan bahkan tanpa pemanasan (H 2 CO 3, HClO). Pada saat yang sama, sejumlah asam tahan terhadap pemanasan (H 2 SO 4, H 3 PO 4).
H 2 SiO 3 = H 2 O + SiO 2;
H 2 CO 3 = H 2 O + CO 2.
12. Oksida logam→ logam.
Beberapa oksida logam berat dapat terurai menjadi logam dan oksigen:
2HgO = 2Hg + O 2.
Juga, logam diperoleh dari oksida yang sesuai dengan bantuan zat pereduksi:
3MnO 2 + 4Al = 3Mn + 2Al 2 O 3;
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O.
13. Asam oksida→ bukan logam
Kebanyakan oksida non-logam tidak terurai ketika dipanaskan. Non-logam dan oksigen hanya terurai beberapa oksida tidak stabil (halogen oksida).
Beberapa non-logam diperoleh dengan mereduksi dari oksida yang sesuai:
SiO 2 + 2Mg = 2MgO + Si.
14. Garam, pangkalan → pangkalan.
Basa tidak larut diperoleh dengan aksi alkali pada larutan asam yang sesuai:
CuSO 4 + 2NaOH = Cu (OH) 2 ↓ + Na 2 SO 4,
Cu 2+ + 2OH - → Cu (OH) 2 ↓;
FeCl 2 + 2KOH = Fe (OH) 2 ↓ + 2KCl,
Fe 2+ + 2OH - = Fe (OH) 2 ↓.
15. Garam, asam → asam.
Garam larut bereaksi dengan asam (sesuai dengan seri tekanan) jika hasilnya adalah asam yang lebih lemah atau volatil:
Na 2 SiO 3 + 2HCl = 2NaCl + H 2 SiO 3 ↓,
SiO 3 2- + 2H + → H 2 SiO 3 ↓;
NaCl (s.) + H 2 SO 4 (k) = NaHSO 4 + HCl.
16. Garam→ oksida dasar, asam oksida.
Garam dari beberapa asam yang mengandung oksigen (nitrat, karbonat) terurai ketika dipanaskan:
CaCO 3 = CaO + CO 2;
2Cu (NO 3) 2 = 2CuO + 4NO 2 + O 2.
LATIHAN UNTUK PEKERJAAN INDEPENDEN DI TOPIK “SAMBUNGAN GENETIK ANTARA KELAS DARI SENYAWA SENYAWA INORGANIK”
1. Sebutkan zat-zat yang tercantum di bawah ini, sebarkan ke dalam golongan senyawa anorganik: Na 3 PO 4, H 2 SiO 3, NO, B 2 O 3, MgS, BaI 2, Ca (OH) 2, KNO 3, HNO 2, Cl 2 O 7, Fe (OH) 2, P 2 O 5, HF, MnO 2.
2. Dari zat apa yang tercantum di bawah ini dimungkinkan untuk memperoleh hidroksida (asam atau basa) dalam satu tahap: tembaga, besi oksida (P), barium oksida, nitrogen oksida (P), nitrogen oksida (V), oksida silikon, tembaga sulfat, kalium klorida , kalium, magnesium karbonat.
3. Dari daftar di atas, tuliskan formula zat yang terkait dengan: 1) oksida; 2) alasan; 3) asam; 4) garam:
CO 2, NaOH, HCl, SO 3, CuSO 4, NaNO 3, KCl, H 2 SO 4, Ca (OH) 2, P 2 O 5, HNO 3, Al (OH) 3.
4. Beri nama zat: Zn (OH) 2, MgO, P 2 O 3, NaHCO 3, H 3 PO 3, Fe 2 (SO 4) 3, KOH, (AlOH) 3 (PO 4) 2, Ba (MnO 4 ) 2, CO, HI. Tunjukkan ke kelas mana setiap zat berada.
5. Tuliskan rumus molekul dari zat-zat berikut dan tunjukkan kelas mana yang dimiliki masing-masing zat:
1) tembaga (II) hidroksokarbonat;
2) nitrogen oksida (V);
3) nikel (II) hidroksida;
4) barium hidrogen fosfat;
5) asam perklorat;
6) kromium (III) hidroksida;
7) potasium klorat;
8) asam hidrogen sulfida;
9) natrium seng.
6. Berikan contoh reaksi koneksi antara:
1) zat sederhana - bukan logam;
2) zat dan oksida sederhana;
3) oksida;
4) zat kompleks yang bukan oksida;
5) logam dan non-logam;
6) tiga zat.
7. Manakah dari zat berikut yang dapat bereaksi:
1) karbon monoksida (IV): HCl, O 2, NO 2, KOH, H 2 O;
2) magnesium oksida: Ba (OH) 2, HCl, CO 2, O 2, HNO 3;
3) besi (II) hidroksida: KCl, HCl, KOH, O 2, H 2 O, HNO 3;
4) hidrogen klorida: Zn, MgO, ZnCl 2, HNO 3, Ca (OH) 2, Cu, (ZnOH) Cl.
8. Apakah interaksi antara zat-zat berikut ini mungkin?
1) karbon monoksida (IV) dan kalium hidroksida;
2) kalium hidrosulfat dan kalsium hidroksida;
3) kalsium fosfat dan asam sulfat;
4) kalsium hidroksida dan sulfur oksida (IV);
5) asam sulfat dan kalium hidroksida;
6) kalsium bikarbonat dan asam fosfat;
7) silika dan asam sulfat;
8) seng oksida dan fosfor oksida (V).
Tulis persamaan reaksi yang mungkin, tentukan kondisi di mana mereka terjadi. Jika reaksi dapat menyebabkan zat yang berbeda, maka tunjukkan apa perbedaan kondisi pelaksanaannya.
9. Berikan persamaan reaksi untuk mendapatkan bahan berikut: natrium ortofosfat (4 cara), kalium sulfat (7 cara), seng hidroksida.
10. Salah satu metode untuk memproduksi soda (natrium karbonat) adalah aksi air dan karbon monoksida (IV) pada natrium aluminat. Buat persamaan reaksi.
11. Dia mengubah koefisien, menulis produk reaksi:
1) MgO + 2H 2 SO 4 →
2) 2SO 2 + Ba (OH) 2 →
3) 3N 2 O 5 + 2Al (OH) 3 →
4) P 2 O 5 + 4NaOH →
5) P 2 O 5 + 6NaOH →
6) P 2 O 5 + 2NaOH →
12. Buat persamaan reaksi untuk menerima berbagai jenis garam:
1) SO 2 + Ba (OH) 2 → (garam sedang dan asam),
2) A1 2 O 3 + H 2 O + HNO 3 → (garam sedang, garam dasar),
3) Na 2 O + H 2 S → (garam sedang dan asam),
4) SO 3 + Sa (OH) 2 → (garam sedang dan dasar),
5) CaO + H 2 O + P 2 O 5 → (garam basa, garam asam).
13. Selesaikan persamaan reaksi:
CaO + A1 2 O 3 → CaHPO 4 + Ca (OH) 2 →
Cr 2 O 3 + H 2 SO 4 → AlOHSO 4 + NaOH →
Cr 2 O 3 + NaOH → CaCO 3 + CO 2 + H 2 O →
A1 2 O 3 + HClO 4 → Ca (HCO 3) 2 + HCl →
Mn 2 O 7 + KOH → ZnS + H 2 S →
NO 2 + Ca (OH) 2 → CaSO 4 + H 2 SO 4 →
Zn (OH) 2 + NaOH → (ZnOH) Cl + HCl →
Zn (OH) 2 + HNO 3 → Bi (OH) 3 + H 2 SO 4 (tidak cukup) →
AlCl 3 + NaOH (kurang) → (FeOH) Cl + NaHS →
AlCl 3 + NaOH → Na 2 ZnO 2 + H 2 SO 4 (berlebih) →
AlC1 3 + NaOH (berlebih.) → Ca (AlO 2) 2 + HCl (berlebih) →
14. Tuliskan persamaan reaksi yang dengannya Anda dapat melakukan transformasi berikut:
1) Cu → CuO → CuSO 4 → Cu (OH) 2 → CuC1 2 → Cu (NO 3) 2
2) Zn → ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → ZnCl 2
3) Р → Р 2 O 5 → Н 3 РО 4 → К 3 РО 4 → Са 3 (РО 4) 2 → Н 3 РО 4
4) Mg → MgO → MgCl 2 → Mg (OH) 2 → Mg (HSO 4) 2 → MgSO 4
5) Ca → CaO → Ca (OH) 2 → CaCO 3 → Ca (HCO 3) 2 → CO 2
6) Cr → Cr 2 (SO 4) 3 → Cr (OH) 3 → NaСrO 2 → Cr 2 O 3 → K
7) P → P 2 O 5 → HPO 3 → H 3 PO 4 → NaH 2 PO 4 → Na 3 PO 4
8) CuS → CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
9) Al → Al 2 O 3 → Al 2 (SO 4) 3 → Al (HSO 4) 3 → Al (OH) 3 → K
10) S → SO 2 → SO 3 → NaHSO 4 → Na 2 SO 4 → BaSO 4
11) Zn → ZnO → ZnCl 2 → Zn → Na 2
12) Zn → ZnSO 4 → ZnCl 2 → Zn (OH) 2 → Na 2 → Zn (NO 3) 2
13) Ca → CaCl 2 → CaCO 3 → Ca (HCO 3) 2 → Ca (NO 3) 2
14) Ca → Ca (OH) 2 → CaCO 3 → CaCl 2 → CaCO 3 → Ca (NO 3) 2
15) CuO → CuCl 2 → Cu (NO 3) 2 → CuO → CuSO 4 → Cu
16) CaO → Ca (OH) 2 → Ca (NO 3) 2 → Ca (NO 2) 2 → HNO 2 → NaNO 2
17) MgO → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
18) SO 2 → H 2 SO 3 → KHSO 3 → K 2 SO 3 → KHSO 3 → SO 2
19) P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2 → Ca (H 2 PO 4) 2 → CaHPO 4
20) CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
21) PbO → Pb (NO 3) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbCl 2
22) ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2 → K 2
23) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → Al (OH) 3 → K
24) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → Zn → ZnO → Zn (NO 3) 2
25) AlCl 3 → Al (NO 3) 3 → Al (OH) 3 → NaAlO 2 → A1C1 3 → Al
26) Pb (NO 3) 2 → Pb (OH) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbSO 4
27) Fe 2 (SO 4) 3 → FeCl 3 → Fe (OH) 3 → FeOH (NO 3) 2 → Fe (NO 3) 3 → Fe 2 O 3
28) K → KOH → KHSO 4 → K 2 SO 4 → KCl → KNO 3
29) Cu (OH) 2 → CuOHNO 3 → Cu (NO 3) 2 → CuSO 4 → CuCl 2 → Cu (NO 3) 2
30) CaCl 2 → Ca → Ca (OH) 2 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
31) Cu → Cu (NO 3) 2 → Cu (OH) 2 → CuSO 4 → Al 2 (SO 4) 3 → A1C1 3
32) Mg → MgSO 4 → MgCl 2 → MgOHCl → Mg (OH) 2 → MgOHNO 3
33) CuSO 4 → CuCl 2 → ZnCl 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2
34) Hg (NO 3) 2 → Al (NO 3) 3 → Al 2 O 3 → NaAlO 2 → Al (OH) 3 → AlOHCl 2
35) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → AlCl 3 → Al (OH) 3 → A1 2 O 3
36) CuCl 2 → Cu (OH) 2 → CuSO 4 → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2
37) Fe (NO 3) 3 → FeOH (NO 3) 2 → Fe (OH) 3 → FeCl 3 → Fe (NO 3) 3 → Fe
38) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → NaNO 3 → HNO 3
39) Mg (OH) 2 → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
40) aluminium sulfat → aluminium klorida → aluminium nitrat → aluminium oksida → kalium aluminat → aluminium hidroksida → aluminium hidroksida → aluminium klorida.
41) Na → NaOH → Na 3 PO 4 → NaNO 3 → HNO 3 → N 2 O 5
42) BaCO 3 → Ba (HCO 3) 2 → BaCO 3 → (BaOH) 2 CO 3 → BaO → BaSO 4
43) Cu → CuSO 4 → (CuOH) 2 SO 4 → Cu (OH) 2 → Cu (HSO 4) 2 → CuSO 4
44) barium → barium hidroksida → barium bikarbonat → barium klorida → barium karbonat → barium klorida → barium hidroksida
45) P → P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → CaHPO 4 → Ca 3 (PO 4) 2
46) Cr → CrO → Cr 2 O 3 → NaCrO 2 → CrCl 3 → Cr (OH) 3 → Cr 2 O 3 → Cr
47) Cr 2 O 3 → CrCl 3 → Cr (OH) 3 → Na 3 → Cr 2 (SO 4) 3 → CrCl 3
48) K → KOH → KCl → KOH → K 2 SO 4 → KNO 3 → KNO 2
49) S → FeS → H 2 S → SO 2 → S → ZnS → ZnO → ZnCl 2 → Zn (OH) 2 → K 2
50) C → CO 2 → CO → CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2
51) С → CO 2 → NaHCO 3 → Na 2 CO 3 → CO 2
52) S → SO 2 → K 2 SO 3 → KHSO 3 → K 2 SO 3
53) Cu → Cu (OH) 2 → Cu (NO 3) 2 → CuO → Cu
54) Р 2 O 5 → Н 3 РО 4 → СаНРО 4 → Са (Н 2 РО 4) 2 → С 3 (РО 4) 2
55) Fe → FeCl 2 → Fe (OH) 2 → FeSO 4 → Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (NO 3) 2 → ZnO
57) CuS → SO 2 → KHSO 3 → CaSO 3 → SO 2
58) SO 2 → H 2 SO 4 → CuSO 4 → CuO → Cu (NO 3) 2
59) KHSO 3 → CaSO 3 → Ca (HSO 3) 2 → SO 2 → K 2 SO 4
60) SO 2 → CaSO 3 → SO 2 → NaHSO 3 → SO 2
61) NaHCO 3 → Na 2 CO 3 → NaCl → NaHSO 4 → Na 2 SO 4
62) K → KOH → KCl → KNO 3 → K 2 SO 4 → KCl
63) NaCl → Na → NaOH → Na 2 SO 4 → NaCl
64) Al → AlCl 3 → Al (OH) 3 → A1 2 O 3 → Al (OH) 3
65) CuO → Cu → CuCl 2 → CuSO 4 → CuS
66) Fe → FeSO 4 → Fe (OH) 2 → Fe → Fe (OH) 3
67) Fe → Fe (OH) 2 → FeCl 2 → Fe (NO 3) 2 → Fe
68) Fe (NO 3) 3 → Fe 2 O 3 → FeCl 3 → Fe (NO 3) 3 → Fe
69) CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
70) MgCO 3 → MgO → MgCl 2 → Mg (OH) 2 → Mg (NO 3) 2
71) Mg → Mg (OH) 2 → MgSO 4 → MgCO 3 → Mg (HCO 3) 2
72) CaO → Ca (OH) 2 → CaCl 2 → CaCO 3 → CO 2
73) CaCO 3 → Ca (HCO 3) 2 → CaCl 2 → Ca (NO 3) 2 → O 2
74) FeS → Fe 2 O 3 → Fe (OH) 3 → Fe 2 (SO 4) 3 → FeCl 3
75) KS1 → K 2 SO 4 → KOH → K 2 CO 3 → KOH
76) CuS → CuO → Cu (OH) 2 → CuSO 4 → Cu
77) Fe → Fe (OH) 3 → Fe (NO 3) 3 → FeCl 3 → Fe 2 (SO 4) 3
78) CuSO 4 → CuO → Cu (NO 3) 2 → CuO → CuS
79) ZnS → H 2 S → SO 2 → Na 2 SO 4 → NaOH
80) Al → Al (OH) 3 → A1 2 (SO 4) 3 → A1 2 O 3 → Al (OH) 3
81) CaCl 2 → CaCO 3 → Ca (HCO 3) 2 → CaCO 3 → CaSiO 3
82) S → ZnS → H 2 S → Ca (HSO 3) 2 → SO 2
83) Na 2 SO 4 → NaCl → HCl → CaCl 2 → Ca (NO 3) 2
84) Na 2 SO 3 → SO 2 → H 2 SO 4 → HCl → FeCl 2
85) С → Na 2 CO 3 → CaCO 3 → CaSiO 3 → H 2 SiO 3
86) P → P 2 O 5 → Ca (H 2 PO 4) 2 → CaHPO 4 → H 3 PO 4
87) Al → A1 2 O 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
88) HCl → CuCl 2 → Cl 2 → HCl → H 2
89) P 2 O 5 → Na 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4
90) NH 3 → NH 4 C1 → NH 3 ∙ H 2 O → NH 4 HCO 3 → NH 3
91) NH 4 C1 → KC1 → HCl → CuCl 2 → Cu (OH) 2
92) NH 3 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → NH 3 → NH 4 NO 3
93) KOH → KHCO 3 → K 2 CO 3 → CO 2 → Ca (HCO 3) 2
94) Na → NaOH → NaHCO 3 → Na 2 SO 4 → NaOH
95) KNO 3 → K 2 SO 4 → KC1 → KNO 3 → KNO 2
96) Cl 2 → KC1 → K 2 SO 4 → KNO 3 → KHSO 4
97) FeSO 4 → FeS → SO 2 → KHSO 3 → K 2 SO 4
98) KOH → Cu (OH) 2 → CuSO 4 → Cu (OH) 2 → Cu
99) Fe 2 O 3 → FeCl 3 → Fe (OH) 3 → Fe (NO 3) 3 → Fe 2 O 3
100) Al → A1 2 O 3 → A1 (NO 3) 3 → A1 2 O 3 → Al (OH) 3
101) CaO → CaCO 3 → CaSiO 3 → Ca (NO 3) 2 → O 2
102) Cu → Cu (OH) 2 → Cu → CuSO 4 → CuCl 2
103) H 2 S → SO 2 → ZnSO 4 → ZnS → ZnO
104) Cl 2 → NaCl → HCl → CuCl 2 → CuO
105) Cl 2 → FeCl 3 → Fe 2 O 3 → Fe (OH) 3 → Fe (NO 3) 3
106) P 2 O 5 → Ca 3 (PO 4) 2 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2
107) ZnS → ZnO → Zn → ZnCl 2 → Zn (NO 3) 2
108) ZnO → ZnSO 4 → Zn (NO 3) 2 → ZnO → Zn (OH) 2
109) H 3 PO 4 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2
110) CaCO 3 → Na 2 CO 3 → Na 3 PO 4 → NaH 2 PO 4 → Ca 3 (PO 4) 2
111) CaCl 2 → CaSO 3 → Ca (OH) 2 → CaCl 2 → Ca (NO 3) 2
112) NaOH → Na 2 CO 3 → NaHSO 4 → NaNO 3 → NaHSO 4
113) Na 2 SiO 3 → Na 2 CO 3 → Na 2 SO 4 → NaCl → Na 2 SO 4
114) KNO 3 → KHSO 4 → K 2 SO 4 → KCl → Na 2 SO 4
115) SiO 2 → K 2 SiO 3 → H 2 SiO 3 → SiO 2 → CaSiO 3
116) Cu → CuCl 2 → Cu (NO 3) 2 → NO 2 → HNO 3
117) Ca (NO 3) 2 → O 2 → SiO 2 → H 2 SiO 3 → SiO 2
118) P → H 3 PO 4 → Ca 3 (PO 4) 2 → CaHPO 4 → Ca (H 2 PO 4) 2
119) CuSO 4 → Cu → CuS → CuO → CuCl 2
120) Al → A1 2 (SO 4) 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
121) S → SO 3 → H 2 SO 4 → KHSO 4 → BaSO 4
122) N 2 O 5 → HNO 3 → Cu (NO 3) 2 → CuO → Cu (OH) 2
123) Al → A1 2 O 3 → Al (OH) 3 → A1 2 (SO 4) 3 → A1 (NO 3) 3
124) Ca → Ca (OH) 2 → Ca (HCO 3) 2 → CaO → CaCl 2
125) NH 3 ∙ H 2 O → NH 4 C1 → NH 3 → NH 4 HCO 3 → (NH 4) 2 CO 3
126) Cu (OH) 2 → H 2 O → HNO 3 → Fe (NO 3) 3 → Fe
127) SO 2 → Ca (HSO 3) 2 → CaCl 2 → Ca (OH) 2 → Ca (HCO 3) 2
128) NH 3 ∙ H 2 O → NH 4 HCO 3 → CaCO 3 → CaSiO 3 → CaCl 2
129) CuSO 4 → Cu → CuO → Cu (OH) 2 → Cu
130) Fe (OH) 3 → Fe → FeCl 3 → Fe (NO 3) 3 → Fe
131) Zn → Zn (OH) 2 → Na 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn
132) Zn → ZnO → Na 2 ZnO 2 → Zn (OH) 2 → Na 2 → ZnCl 2
133) Zn → K 2 ZnO 2 → ZnSO 4 → K 2 → Zn (NO 3) 2 → ZnO
134) ZnO → Zn (OH) 2 → K 2 ZnO 2 → ZnSO 4 → ZnCl 2 → ZnO
135) Zn → Na 2 → Na 2 ZnO 2 → Zn (NO 3) 2 → ZnO → Zn
136) Al → K 3 → Al (OH) 3 → Na 3 → A1C1 3 → Al (OH) 3
137) Al 2 O 3 → KAlO 2 → Al (OH) 3 → Al 2 O 3 → Na 3 → Al 2 O 3
138) Al (OH) 3 → A1 2 O 3 → K 3 → Al 2 (SO 4) 3 → A1 (NO 3) 3
139) A1C1 3 → K 3 → Al (NO 3) 3 → NaAlO 2 → Al 2 O 3
140) Jadilah → Na 2 → Jadilah (OH) 2 → Na 2 BeO 2 → BaBeO 2
PENGALAMAN EKSPERIMENTAL PADA TOPIK “KELAS DASAR SENYAWA INORGANIK”
PENGALAMAN 1.Reaksi Netralisasi.
a) Interaksi asam kuat dan basa kuat.
Tuang 5 ml larutan asam hidroklorat 2N ke dalam piring porselen dan tambahkan larutan natrium hidroksida 2N secara bertahap. Aduk larutan dengan batang kaca dan uji efeknya pada lakmus, transfer setetes larutan ke tes lakmus. Diperlukan reaksi netral (kertas lakmus biru dan merah tidak berubah warna). Evaporasi larutan yang dihasilkan hingga kering. Apa yang terbentuk? Tulis persamaan reaksi molekul dan ion.
b) Interaksi asam lemah dan basa kuat.
Tuang ke dalam tabung reaksi 2 ml larutan alkali 2N dan tambahkan larutan asam asetat sampai larutan itu netral. Tulis persamaan reaksi molekul dan ion. Jelaskan mengapa reaksi ion kesetimbangan, di mana elektrolit lemah (asam asetat) mengambil bagian, bergeser ke arah pembentukan molekul air.
PENGALAMAN 2. Hidroksida amfoterik.
Dari reagen yang tersedia di laboratorium, dapatkan endapan seng hidroksida. Kocok endapan yang diperoleh dan tuangkan sedikit ke dalam 2 tabung. Dalam salah satu tabung tambahkan larutan asam klorida, yang lain - larutan natrium hidroksida (berlebih). Apa yang diamati? Tulis persamaan reaksi yang sesuai dalam bentuk molekul dan ion.
PENGALAMAN 3.Sifat kimia dari garam.
a) Interaksi larutan garam dengan pembentukan zat yang sangat larut.
Tuang 2 ml larutan natrium karbonat ke dalam tabung dan tambahkan larutan barium klorida hingga endapan putih muncul. Tuliskan persamaan reaksi kimia dalam bentuk ionik dan molekuler. Endapan dibagi menjadi dua bagian. Tuang larutan asam sulfat ke dalam salah satu tabung, dan natrium hidroksida ke yang lain. Buat kesimpulan tentang kelarutan endapan dalam asam dan basa.
b) Interaksi larutan garam dengan asam untuk membentuk senyawa yang mudah menguap.
Tuang 2 ml larutan natrium karbonat ke dalam tabung dan tambahkan sedikit larutan asam klorida. Apa yang diamati? Tuliskan persamaan reaksi kimia dalam bentuk ionik dan molekul.
c) Interaksi larutan garam dengan alkali dengan pembentukan senyawa yang mudah menguap.
Tuangkan sedikit larutan garam ammonium ke dalam tabung, tambahkan 1-2 ml larutan natrium hidroksida dan panaskan sampai mendidih. Dalam tabung reaksi dengan campuran reaksi untuk membuat tes lakmus merah basah. Apa yang diamati? Berikan penjelasan. Tulis persamaan reaksi.
g ) Interaksi garam dengan logam lebih aktif daripada logam yang merupakan bagian dari garam.
Bersihkan paku besi (baja) dengan amplas halus. Kemudian celupkan ke dalam larutan tembaga sulfat. Setelah beberapa waktu, amati pelepasan tembaga pada permukaan kuku. Tulis persamaan reaksi yang sesuai dalam bentuk ionik dan molekul.
PENGALAMAN 4.Mendapatkan garam basa dan asam.
a) Persiapan hidroksokarbonat timbal.
Tambahkan sedikit timah (II) oksida ke dalam larutan timah (II) asetat dan didihkan campuran selama beberapa menit. Solusi yang didinginkan dikeringkan dari endapan dan aliran karbon dioksida dilewatkan melalui itu. Apa yang diamati? Saring endapan dan keringkan di antara lembaran kertas saring. Tandai warna dan sifat endapan hidroksokarbonat timbal yang dihasilkan. Tulis persamaan reaksi. Buat formula grafik dari garam yang diperoleh.
b) Persiapan magnesium bikarbonat.
Untuk larutan garam magnesium yang sangat sangat encer, tambahkan sedikit larutan natrium karbonat. Zat apa yang mengendap? Larutan jenuh dengan endapan dengan karbon dioksida. Amati pembubaran endapan secara bertahap. Mengapa ini terjadi? Tulis persamaan reaksi.
PENGALAMAN 5.Mendapatkan garam kompleks.
a) Pembentukan senyawa dengan kation kompleks.
Tambahkan larutan amonia tetes demi tetes ke dalam tabung dengan 2-3 ml larutan tembaga (II) klorida sampai bentuk endapan tembaga (II) hidroksida, dan kemudian tambahkan larutan amonia berlebih untuk melarutkan endapan. Bandingkan warna ion Cu 2+ dengan warna larutan yang dihasilkan. Ion apa yang ada dalam larutan? Tulis persamaan reaksi untuk memperoleh senyawa kompleks.
b) Pembentukan senyawa dengan anion kompleks.
Ke dalam larutan 1-2 ml merkuri (II) nitrat tambahkan tetes demi tetes larutan kalium iodida yang diencerkan untuk membentuk endapan HgI2. Kemudian tuangkan larutan Kalium iodida berlebih hingga endapan larut. Tuliskan reaksi mendapatkan garam kompleks.
PENGALAMAN 6.Persiapan garam ganda (kalium tawas).
Timbang 7,5 g Al 2 (SO 4) 3 ∙ 18H 2 O dan larutkan dalam 50 ml air, ambil cawan porselen yang cukup besar untuk tujuan ini. Hitung persamaan reaksi dan timbang massa kalium sulfat yang diperlukan untuk reaksi. Siapkan larutan kalium sulfat panas jenuh dan tuangkan ke piring porselen dengan larutan aluminium sulfat sambil diaduk. Amati setelah beberapa saat presipitasi kristal alum aluminium kalium. Setelah pendinginan dan kristalisasi, tuangkan larutan induk, keringkan kristal tawas di antara lembaran kertas saring dan timbang kristal yang dihasilkan. Hitung persentase hasil.
TUGAS PENYELESAIAN
1. Dengan melewatkan kelebihan hidrogen sulfida melalui 16 g larutan tembaga (II) sulfat, 1,92 g endapan diperoleh. Temukan fraksi massa tembaga sulfat dalam larutan bekas dan volume hidrogen sulfida yang dikonsumsi.
2. Untuk pengendapan lengkap tembaga dalam bentuk sulfida dari 291 cm 3 larutan tembaga (II) sulfat dengan fraksi massa 10%, gas diperoleh dengan mereaksikan 17,6 g besi (II) sulfida dengan kelebihan asam klorida digunakan. Temukan kerapatan larutan tembaga sulfat asli.
3. Gas yang dilepaskan selama interaksi larutan K 2 S dengan asam sulfat encer dilewatkan melalui kelebihan larutan nitrat timbal (II). Endapan yang dihasilkan memiliki massa 71,7 g. Temukan volume larutan asam sulfat yang bereaksi, jika densitasnya 1,176 g / cm 3, dan fraksi massa 25%.
4. Untuk larutan yang mengandung 8 g tembaga (II) sulfat, larutan yang mengandung 4,68 g natrium sulfida ditambahkan. Endapan disaring, filtratnya diuapkan. Tentukan massa zat dalam filtrat setelah penguapan dan massa endapan tembaga sulfida.
5. Beberapa besi (II) sulfida diperlakukan dengan asam klorida berlebih. Gas yang dihasilkan dalam reaksi dengan larutan NaOH 12,5 cm 3 dengan fraksi massa 25% dan kerapatan 1,28 g / cm 3 membentuk garam asam. Temukan massa besi sulfida asli.
6. Besi (II) sulfida seberat 176 g diperlakukan dengan asam klorida berlebih, dan gas yang dihasilkan dibakar di udara berlebih. Berapa volume larutan KOH dengan fraksi massa 40% dan kerapatan 1,4 g / cm3 yang dibutuhkan untuk menetralkan gas yang dihasilkan selama pembakaran?
7. Ketika memanggang 100 g pirit teknis, mereka memperoleh gas, yang dinetralkan sepenuhnya dengan larutan NaOH 400 cm 3 dengan fraksi massa 25% dan kerapatan 1,28 g / cm 3. Tentukan fraksi massa pengotor dalam pirit.
8. Ke 2 g campuran besi, besi oksida (II) dan besi oksida (III) ditambahkan 16 cm 3 larutan HC1 dengan fraksi massa 20% dan kerapatan 1,09 g / cm 3. Untuk menetralkan kelebihan asam, dibutuhkan larutan NaOH 10,8 cm 3 dengan fraksi massa kepadatan 10% 1,05 g / cm 3. Temukan massa zat dalam campuran jika volume hidrogen yang dilepaskan adalah 224 cm 3 (NU).
9. Ada campuran Ca (OH) 2, CaCO 3 dan BaSO 4 dengan massa 10,5 g. Ketika campuran diperlakukan dengan asam klorida berlebih, 672 cm 3 (IU) gas dilepaskan, dan 71,2 g asam bereaksi dengan massa bagian 10%. Tentukan massa zat dalam campuran.
10. Ada campuran barium klorida, kalsium karbonat dan natrium bikarbonat. Ketika 10 g campuran ini dilarutkan dalam air, residu yang tidak larut sama dengan 3,5 g. Ketika mengalsinasi 20 g campuran awal, massanya berkurang sebesar 5,2 g. Temukan fraksi massa zat dalam campuran awal.
11. Ada solusi yang mengandung asam sulfat dan nitrat. Untuk sepenuhnya menetralkan 10 g larutan ini, 12,5 cm 3 larutan KOH dikonsumsi dengan fraksi massa 19% dan kerapatan 1,18 g / cm 3. Ketika kelebihan barium klorida ditambahkan ke 20 g campuran larutan asam yang sama, 4,66 g endapan rontok. Temukan fraksi massa asam dalam campuran.
12. Semua hidrogen klorida yang diperoleh dari 100 g campuran KC1 dan KNO 3 dilarutkan dalam air 71,8 cm 3. Ketika mengalsinasi 100 g campuran garam yang sama, 93,6 g residu padat tetap ada. Temukan fraksi massa hidrogen klorida di dalam air.
13. Dengan melewatkan 2 m 3 udara (NU) melalui larutan Ca (OH) 2, 3 g endapan garam asam karbonat diperoleh. Temukan volume dan fraksi massa CO 2 di udara.
14. Karbon dioksida dilewatkan melalui suspensi yang mengandung 50 g CaCO 3. Reaksinya datang 8,96 dm 3 gas (NU). Berapa massa CaCO 3 yang tersisa dalam fase padat?
15. Saat menambahkan air ke CaO, massanya meningkat 30%. Apa bagian dari CaO (dalam% massa) telah padam?
16. Timbal (II) oksida seberat 18,47 g dipanaskan dalam aliran hidrogen. Setelah reaksi, massa timbal yang dihasilkan dan oksida yang tidak bereaksi adalah 18,07 g. Berapa massa timbal oksida yang tidak bereaksi?
17. Karbon monoksida dilewatkan melalui besi (III) oksida saat dipanaskan. Massa residu padat setelah reaksi adalah 2 g kurang dari massa awal oksida besi. Berapa volume CO yang diambil reaksi (apakah oksida benar-benar berkurang)?
18. Ada 8,96 dm 3 (NU) dari campuran N2, CO2 dan SO2 dengan kerapatan relatif hidrogen 25. Setelah melewati larutan KOH berlebih, volume campuran menurun sebanyak 4 kali. Temukan volume gas dalam campuran asli.
19. Dalam dua gelas ada 100 g larutan HC1 dengan fraksi massa 2,5%. Dalam satu gelas ditambahkan 10 g CaCO 3, di yang lain - 8,4 g MgCO 3. Bagaimana massa kacamata berbeda setelah reaksi?
20. Berapa volume (NU) sulfur dioksida yang harus dilewati melalui 200 cm 3 larutan dengan fraksi massa NaOH 0,1% dan kepadatan 1 g / cm 3 untuk mendapatkan garam asam?
21. Berapakah jumlah maksimum (karbon dioksida) karbon dioksida dapat menyerap 25 cm 3 larutan dengan fraksi massa NaOH 25% dan kepadatan 1,1 g / cm 3?
22. Berapa volume minimum larutan dengan fraksi massa 20% KOH dan kerapatan 1,19 g / cm 3 yang dapat menyerap semua karbon dioksida yang dihasilkan dengan reduksi penuh 23,2 g magnetit dengan karbon monoksida?
23. Berapa massa minimum KOH yang harus direaksikan dengan 24,5 g asam ortofosfat sehingga hanya produk kalium dihidrogen fosfat yang dihasilkan?
24. Berapa massa minimum Ca (OH) 2 untuk ditambahkan ke 16 g larutan kalsium bikarbonat dengan fraksi massa 5% garam untuk mendapatkan garam sedang?
25. Berapa massa kalium hidrogen fosfat yang harus ditambahkan ke larutan yang mengandung 12,25 g H 3 PO 4 sehingga setelah ini larutan hanya mengandung kalium dihidrogen fosfat?
26. Larutan mengandung 56,1 g campuran kalsium dan magnesium karbonat dalam suspensi. Untuk mengubahnya menjadi hidrokarbonat, mereka menghabiskan semua karbon dioksida yang dihasilkan dengan membakar 7 dm 3 (NU) etana. Temukan massa kalsium karbonat dalam campuran awal.
27. Untuk mengubah 9,5 g campuran natrium hidro dan dihidrogen fosfat menjadi garam sedang, 10 cm3 larutan dengan fraksi massa NaOH 27,7% dan kepadatan 1,3 g / cm 3 diperlukan. Temukan massa hidrogen fosfat dalam campuran.
28. Dengan melewatkan karbon dioksida melalui larutan yang mengandung 6 g NaOH, diperoleh 9.5 g campuran asam dan garam sedang. Temukan jumlah karbon dioksida yang dikonsumsi.
29. Setelah melewati 11,2 dm 3 (NU) CO 2 melalui larutan KOH, diperoleh 57,6 g campuran garam asam dan garam sedang. Temukan massa garam sedang.
30. Berapa massa asam ortofosfat yang harus dinetralkan untuk memperoleh 1,2 g dihidro- dan 4,26 g natrium hidrogen fosfat?
31. NaOH ditambahkan ke larutan asam sulfat untuk memperoleh 3,6 g hidrosulfat dan 2,84 g natrium sulfat. Tentukan jumlah kimia asam dan alkali yang bereaksi.
32. Setelah melewatkan hidrogen klorida melalui larutan NaOH 200 cm 3 dengan fraksi massa 10% dan kerapatan 1,1 g / cm 3, fraksi massa NaOH dalam larutan yang dihasilkan berkurang setengahnya. Tentukan fraksi massa NaCl dalam larutan yang dihasilkan.
33. Melarutkan 14,4 g campuran tembaga dan oksida (II) yang dikonsumsi 48,5 g larutan dengan fraksi massa HNO 3 sebesar 80%. Temukan fraksi massa tembaga dan oksida dalam campuran awal.
34. Massa natrium oksida 6,2 g dilarutkan dalam 100 cm 3 air dan larutan No. 1 diperoleh. Kemudian asam klorida dengan fraksi massa 10% ditambahkan ke larutan ini sampai medium menjadi netral, dan larutan No. 2 diperoleh. :
1) fraksi massa zat dalam larutan No. 1, 2;
2) massa larutan HC1, yang digunakan untuk menetralkan solusi nomor 1.
35. 3 g seng berinteraksi dengan 18,69 cm 3 larutan HC1 dengan fraksi massa 14,6% dan kerapatan 1,07 g / cm 3. Saat dipanaskan, gas yang dihasilkan dilewatkan pada panas CuO dengan berat 4 g. Berapakah massa tembaga yang diperoleh?
36. Gas dilepaskan setelah perawatan kalsium hidrida dengan air berlebih, terlewatkan oleh FeO. Hasilnya, massa oksida berkurang 8 g. Temukan massa CaH 2 yang diolah dengan air.
37. Selama kalsinasi sampel CaCO 3, massanya menurun 35,2%. Produk reaksi padat dilarutkan dalam kelebihan asam klorida untuk memperoleh 0,112 dm 3 (NU) gas. Tentukan massa sampel asli kalsium karbonat.
38. Tembaga nitrat terurai, dan tembaga (II) oksida yang dihasilkan sepenuhnya tereduksi oleh hidrogen. Produk yang dihasilkan melewati tabung dengan P 2 O 5, dan massa tabung setelah itu meningkat 3,6 g. Berapa volume minimum asam sulfat dengan fraksi massa 88% dan kerapatan 1,87 g / cm 3 yang diperlukan untuk pembubaran yang diperoleh dalam percobaan tembaga dan berapakah massa garam terurai?
39. Setelah penyerapan oksida nitrat (IV) dengan kelebihan larutan KOH dalam dingin tanpa adanya oksigen, diperoleh 40,4 g KNO 3. Substansi apa yang masih terbentuk dan berapa massanya?
40. Untuk menetralkan 400 g larutan yang mengandung hidroklorik dan asam sulfat, mengkonsumsi 287 cm 3 larutan natrium hidroksida dengan fraksi massa 10% dan kepadatan 1.115 g / cm 3. Jika larutan barium klorida berlebih ditambahkan ke 100 g larutan awal, 5,825 g endapan akan rontok. Tentukan fraksi massa asam dalam larutan awal.
41. Setelah melewati karbon dioksida melalui larutan natrium hidroksida, 13,7 g campuran garam medium dan asam diperoleh. Untuk mengubahnya menjadi natrium klorida, diperlukan 75 g asam klorida dengan fraksi massa HCl 10%. Temukan volume karbon dioksida yang diserap.
42. Campuran asam hidroklorik dan sulfur dengan massa total 600 g larutan dengan fraksi massa asam yang sama diolah dengan kelebihan natrium bikarbonat dan gas 32,1 dm 3 (N o.). Temukan fraksi massa asam dalam campuran awal.
43. Untuk menetralkan 1 dm 3 larutan NaOH, 66,66 cm 3 larutan HNO 3 dikonsumsi dengan fraksi massa 63% dan kerapatan 1,5 g / cm 3. Berapa volume larutan asam sulfat dengan fraksi massa 24,5% dan kepadatan 1,2 g / cm3 yang dibutuhkan untuk menetralkan jumlah alkali yang sama?
44. Dalam perbandingan volume berapa seseorang harus mengambil larutan asam sulfat dengan fraksi massa 5% dan kerapatan 1,03 g / cm 3 dan larutan barium hidroksida dengan fraksi massa 5% dan kerapatan 1,1 g / cm 3 untuk netralisasi lengkap? Bayangkan jawabannya sebagai hasil bagi volume larutan alkali pada larutan asam.
45. Hitung volume minimum larutan amonia dengan kerapatan 0,9 g / cm 3 dan fraksi massa 25%, yang diperlukan untuk penyerapan karbon dioksida lengkap yang diperoleh dengan mendekomposisi 0,5 kg batu kapur alami dengan fraksi massa kalsium karbonat sebesar 92%.
46. Untuk konversi total 2,92 g campuran natrium hidroksida dan natrium karbonat menjadi klorida, diperlukan 1,344 dm 3 hidrogen klorida (NU). Temukan massa natrium karbonat dalam campuran.
47. Ke 25 g larutan tembaga (II) sulfat dengan fraksi massa 16% ditambahkan sejumlah larutan natrium hidroksida dengan fraksi massa 16%. Endapan yang terbentuk disaring, setelah itu filtratnya bersifat basa. Untuk menetralkan filtrat sepenuhnya, dibutuhkan 25 cm 3 larutan asam sulfat dengan konsentrasi molar 0,1 mol / dm 3 larutan. Hitung massa larutan natrium hidroksida yang ditambahkan.
48. Zat yang diperoleh dengan reduksi lengkap CuO dengan massa 15,8 g hidrogen dengan volume 11,2 dm 3 (NU) dilarutkan dengan memanaskan dalam asam sulfat pekat. Berapa volume gas (NU) yang dilepaskan sebagai hasil reaksi?
49. Untuk netralisasi lengkap 50 cm 3 asam klorida dengan fraksi massa HCl 20% dan kerapatan 1,10 g / cm 3, larutan kalium hidroksida dengan fraksi massa KOH 20% digunakan. Berapa jumlah kimiawi air yang terkandung dalam larutan yang dihasilkan?
50. Gas yang diperoleh dengan melewatkan kelebihan CO 2 di atas 0,84 g batubara panas, dikirim ke reaksi dengan 14,0 g tembaga dipanaskan (II) oksida. Berapa volume larutan asam nitrat dengan fraksi massa 63% dan kerapatan 1,4 g / cm3 yang diperlukan untuk melarutkan zat yang diperoleh dalam reaksi terakhir sepenuhnya?
51. Ketika dikalsinasi dengan berat konstan tembaga (II) nitrat, berat garam menurun 6,5 g. Berapa garam yang terurai?
52. Ketika kelebihan asam klorida digunakan, 6,72 dm 3 (NW) gas dilepaskan pada campuran aluminium dengan logam monovalen yang tidak diketahui, dan massa campuran dibelah dua. Ketika mengobati residu dengan asam nitrat encer, 0,373 dm 3 (NU) NO dilepaskan. Identifikasi logam yang tidak dikenal.
53. Massa sampel kapur adalah 105 g, dan jumlah kimiawi unsur oksigen dalam komposisinya adalah 1 mol. Tentukan fraksi massa CaCO 3 dalam sampel kapur (oksigen hanya termasuk dalam komposisi kalsium karbonat).
54. Dalam interaksi sulfur oksida (VI) dengan air, larutan diperoleh dengan fraksi massa asam sulfat 25%. Ketika kelebihan Ba (OH) 2 ditambahkan ke larutan ini, endapan dengan berat 29,13 g diendapkan. Massa SO3 dan H2O apa yang dihabiskan untuk pembentukan larutan asam?
55. Ketika melewati SO 2 sampai 200 g larutan dengan fraksi massa NaOH 16%, campuran garam dibentuk, termasuk 41,6 g garam asam. Berapakah massa sulfur yang mengandung 4,5% pengotor berat, digunakan untuk memperoleh SO 2? Berapa berat garam medium?
56. Interaksi dengan 80 g larutan Ca (NO 3) 2 mengambil 50 g larutan Na 2 CO 3. Presipitasi dipisahkan, sementara memprosesnya dengan asam klorida berlebih, 2,24 dm 3 (NU) gas dilepaskan. Berapa fraksi massa garam dalam larutan awal? Berapa fraksi massa natrium nitrat dalam larutan setelah memisahkan endapan?
57. Ketika seng berinteraksi dengan asam sulfat, 10 dm 3 (NU) dari campuran SO 2 dan H 2 S dengan kerapatan relatif argon 1,51 terbentuk. Berapa jumlah zat kimia dari seng yang terlarut? Berapa fraksi massa SO 2 dalam campuran gas?
58. Sampel campuran seng dan serbuk gergaji aluminium dengan massa total 11 g dilarutkan dalam larutan alkali berlebih. Tentukan volume (NU) gas yang dilepaskan, jika fraksi massa seng dalam campuran adalah 30%.
59. Natrium hidroksida seberat 4,0 g dicampur dengan aluminium hidroksida seberat 9,8 g. Hitung massa natrium metaaluminasi yang diperoleh.
60. Saat memproses 10 g campuran tembaga dan aluminium dengan asam nitrat pekat di suhu kamar merilis gas 2.24 dm 3 (NU). Berapa volume (NU) gas yang akan dilepaskan saat memproses massa campuran yang sama dengan kelebihan larutan KOH?
61. Paduan tembaga dan aluminium seberat 20 g diperlakukan dengan kelebihan alkali, residu yang tidak larut dilarutkan dalam asam nitrat pekat. Garam yang diperoleh diisolasi, dikalsinasi dengan berat konstan, dan 8 g residu padat diperoleh. Tentukan volume larutan NaOH bekas dengan fraksi massa 40% dan kepadatan 1,4 g / cm3).
62. Campuran aluminium dan oksida logam (II) (oksida non-amfoter) dengan berat 39 g diolah dengan kelebihan larutan KOH, gas yang dipancarkan dibakar untuk memperoleh 27 g air. Residu yang tidak larut sepenuhnya dilarutkan dalam 25,2 cm 3 larutan dengan fraksi massa HC1 36,5% dan kepadatan 1,19 g / cm 3). Tentukan oksida.
63. Campuran seng dan keripik tembaga diperlakukan dengan kelebihan larutan KOH, sementara gas 2,24 dm 3 (NU) dilepaskan. Untuk klorinasi lengkap dari sampel logam yang sama, klorin dengan volume 8,96 dm 3 (NU) diperlukan. Hitung fraksi massa seng dalam sampel.
64. Campuran serbuk kayu dari besi, aluminium dan magnesium dengan massa 49 g diperlakukan dengan H 2 SO 4 yang diencerkan, sehingga memperoleh 1,95 mol gas. Bagian lain dari campuran yang sama dengan berat 4,9 g diperlakukan dengan larutan alkali berlebih; 1,68 dm 3 (NU) gas diperoleh. Temukan massa logam dalam campuran.
65. Berapa massa sedimen yang terbentuk ketika menggabungkan larutan yang mengandung 10 g NaOH dan 13,6 g ZnCl 2?
66. Ada dua bagian dari campuran Al, Mg, Fe, Zn, sama dalam komposisi molar, masing-masing seberat 7,4 g. Satu bagian dilarutkan dalam asam klorida dan 3,584 dm 3 gas (NU) diperoleh, yang lain dalam larutan alkali dan Menerima gas 2.016 dm 3 (NU). Diketahui bahwa dalam kedua campuran ada 3 atom Zn per atom A1. Temukan massa logam dalam campuran.
67. Campuran tembaga, magnesium, dan aluminium dengan berat 1 g diperlakukan dengan kelebihan asam klorida. Larutan disaring, kelebihan larutan NaOH ditambahkan ke filtrat. Endapan dipisahkan dan dikalsinasi menjadi massa konstan 0,2 g. Residunya, yang tidak larut setelah perlakuan dengan asam klorida, dikalsinasi di udara dan diperoleh 0,8 g zat hitam. Temukan fraksi massa aluminium dalam campuran.
68. Ketika dipanaskan dalam aliran paduan oksigen dari seng, magnesium dan tembaga, massa campuran meningkat 9,6 g. Produk sebagian dilarutkan dalam alkali, dan 40 cm 3 larutan dengan fraksi massa KOH 40% dan kepadatan 1,4 g / cm diperlukan untuk disolusi 3 Untuk reaksi dengan porsi alloy yang sama, dibutuhkan 0,7 mol HC1. Temukan jumlah kimiawi logam dalam paduan.
69. Paduan tembaga dan seng seberat 5 g diperlakukan dengan kelebihan larutan NaOH. Kemudian residu padat dipisahkan dan diolah dengan HNO 3 pekat, garam yang diperoleh diisolasi, dikalsinasi dengan berat konstan, dan 2,5 g residu padat diperoleh. Tentukan massa logam dalam paduan.
70. Paduan tembaga dan aluminium seberat 12,8 g diperlakukan dengan kelebihan asam klorida. Residu yang tidak larut dilarutkan dalam asam nitrat pekat, larutan yang dihasilkan diuapkan, residu kering dikalsinasi dengan berat konstan dan diperoleh 4 g padatan. Tentukan fraksi massa tembaga dalam paduan.
71. Dalam perbandingan massa apa yang harus mengambil dua bagian A1, sehingga ketika satu ditambahkan ke larutan alkali dan yang lain dengan jumlah hidrogen yang sama dilepaskan ke dalam asam klorida?
72. Saat memproses campuran aluminium dan tembaga (II) oksida dengan kelebihan larutan KOH, 6,72 dm 3 (NU) gas dilepaskan, dan dengan melarutkan bagian yang sama dari campuran dalam HNO 3 pekat pada suhu kamar, diperoleh 75,2 g garam. Temukan massa campuran zat awal.
73. Berapa massa tembaga (II) oksida yang dapat direstorasi oleh hidrogen yang diperoleh dengan mereaksikan kelebihan aluminium dengan 139,87 cm3 larutan dengan 40% NaOH dan kerapatan 1,43 g / cm 3?
74. Dengan oksidasi lengkap dari 7,83 g paduan dari dua logam, 14,23 g oksida terbentuk, selama pengolahan yang kelebihan alkali tetap 4,03 g endapan yang tidak larut. Tentukan komposisi kualitatif logam yang membentuk paduan, jika kation-kation mereka memiliki keadaan oksidasi +2 dan +3, dan rasio molar oksida adalah 1: 1 (asumsikan bahwa oksida logam dengan keadaan oksidasi +3 memiliki sifat amfoter).
75. Dua bagian aluminium, memiliki massa yang sama, dilarutkan: satu dalam larutan kalium hidroksida, yang lain dalam asam klorida. Bagaimana volume gas berevolusi (nos) berhubungan satu sama lain?
76. Paduan tembaga dengan aluminium seberat 1.000 g diperlakukan dengan larutan alkali berlebih, endapan yang tidak larut dilarutkan dalam asam nitrat, kemudian larutan diuapkan, residunya dikalsinasi hingga berat konstan. Massa residu baru adalah 0,398 g. Berapa massa logam dalam paduan?
77. Paduan seng dan tembaga seberat 20 g diperlakukan dengan kelebihan larutan NaOH dengan fraksi massa 30% dan kerapatan 1,33 g / cm 3. Residu padat diisolasi dan diperlakukan dengan kelebihan larutan pekat HNO 3. Garam yang terbentuk selama proses ini diisolasi dan dikalsinasi hingga berat konstan. Massa residu padatan adalah 10,016 g. Hitung fraksi massa logam dalam paduan dan volume larutan alkali yang dikonsumsi.
78. Paduan tembaga dan aluminium seberat 2 g diperlakukan dengan larutan alkali berlebih. Residu disaring, dicuci, dilarutkan dalam HNO 3, larutan diuapkan dan dikalsinasi dengan berat konstan. Massa residu setelah kalsinasi adalah 0,736 g. Hitung fraksi massa logam dalam paduan.
79. Klorinasi campuran besi, tembaga dan aluminium membutuhkan 8,96 dm 3 klorin (NU), dan interaksi sampel yang sama dengan hidrogen klorida membutuhkan 5,6 dm 3 (NU). Ketika berinteraksi dengan massa yang sama dari campuran logam dengan alkali, 1,68 dm 3 (NU) gas dilepaskan. Temukan jumlah kimiawi logam dalam campuran.
80. Kalium hidrida dengan berat 5,0 g dilarutkan dalam air dengan volume 80 cm 3 dan aluminium dengan berat 0,81 g ditambahkan ke dalam larutan yang dihasilkan. Temukan fraksi massa zat dalam larutan yang dihasilkan dengan akurasi hingga seperseribu persen.
DAFTAR SASTRA
1. Barannik, V.P. Nomenklatur Rusia modern dari senyawa anorganik / V.P. Barannik // Jurnal Masyarakat Kimia All-Union. Saya Mendeleev. - 1983. - Jilid XXVIII. - hlm. 9-16.
2. Wroblewski, A.I. Simulator kimia / A.I. Wroblewski. - 2nd ed., Pererab. dan tambahkan. - Minsk: Krasiko-Print, 2007. - 624 hal.
3. Glinka, N.L. Tugas dan latihan dalam kimia umum: studi. manual untuk universitas / red. V.A. Rabinovich dan H.M. Rubina. - M .: Integral-Press, 2004. - 240 p.
4. Lidin, R.A. Tugas dalam kimia umum dan anorganik: studi. manual untuk siswa yang lebih tinggi. belajar. institusi / R.A. Lidin, V.A. Milk, L.L. Andreeva; oleh ed. RA Lidina. - M .: VLADOS, 2004. - 383 hal.
5. Lidin, R.A. Dasar-dasar nomenklatur zat anorganik / R.А. Lidin [et al.]; oleh ed. B.D. Stepina. - M.: Kimia, 1983. - 112 hal.
6. Stepin, B.D. Penerapan aturan IUPAC tentang tata nama senyawa anorganik dalam bahasa Rusia / B. Stepin, R.A. Lidin // Jurnal Masyarakat Kimia All-Union. Saya Mendeleev. - 1983. - Jilid XXVIII. - hlm. 17–20.
| Pendahuluan ………………………………………………………………………… Aturan umum untuk kisaran zat anorganik ………… .. Oksida ………………………………… ……………………………… Oksida dasar ………………………………………………………… ... Asam oksida ………………………………… ………………………. Oksida amfoterik ……………………………………………………… .. Memperoleh oksida ………………………………………………………… Latihan untuk pekerjaan mandiri di Topik “Oksida” ……………………………………………………. Asam ……………………………………………………………………. Latihan-latihan untuk pekerjaan independen dengan topik “Asam” ………………………………………………………… Alasan ………………………………………………………… ……… .. Latihan untuk pekerjaan independen dengan topik “Yayasan” ………………………………………………………. Garam …………………………………………………………………………. Latihan untuk pekerjaan independen dengan topik "Garam" ................................................................ Hubungan genetik antara kelas senyawa anorganik ............................................. …………… .. Latihan untuk pekerjaan independen dengan topik “Koneksi genetik antara kelas senyawa anorganik” ……………………………………………… Eksperimen eksperimental dengan topik “Kelas utama senyawa anorganik …………… ……… .. Tugas penyelesaian …………………………………………………………… Referensi ………………………………………………………… |
pendidikan: untuk memperbaiki konsep "seri genetik", "koneksi genetik"; mengajarkan bagaimana membuat rangkaian unsur genetik (logam dan non-logam), untuk membuat persamaan reaksi yang sesuai dengan rangkaian genetik; periksa bagaimana pengetahuan tentang sifat-sifat kimia oksida, asam, garam, basa diasimilasi;
mengembangkan: mengembangkan kemampuan untuk menganalisis, membandingkan, merangkum, dan menarik kesimpulan, membuat persamaan reaksi kimia;
mendidik : mempromosikan pembentukan pandangan dunia ilmiah.
2. Menyediakan kelas: tabel "Sistem periodik", "tabel kelarutan", "Seri aktivitas logam", instruksi untuk siswa, tugas untuk menguji pengetahuan.
3. Urutan kinerja:
3.1. Survei frontal.
3.2. Solusi tugas.
3.3. Lakukan pekerjaan verifikasi pada opsi.
4. Tata letak laporan:
4.1. Tulislah topik dan tujuan pelajaran praktis.
4.2. Catat pemecahan masalah.
4.3. Selesaikan versi pekerjaan independen Anda sendiri, keputusan untuk menulis di buku catatan dan sampaikan kepada guru untuk ditinjau.
Kemajuan kerja
1. Percakapan frontal aktif:
Apa itu koneksi genetik?
Koneksi genetik - ini adalah koneksi antara kelas yang berbeda berdasarkan interkonversi mereka.
Apa itu seri genetik?
Baris genetik - serangkaian zat - perwakilan dari kelas yang berbeda, yang merupakan senyawa dari satu unsur kimia, dihubungkan oleh interkonversi dan mencerminkan transformasi zat ini. Dasar dari seri ini adalah elemen yang sama.
Jenis seri genetik apa yang biasanya dialokasikan?
Di antara logam ada dua jenis baris:
a) Serangkaian genetik di mana alkali bertindak sebagai basa. Seri ini dapat direpresentasikan menggunakan transformasi berikut:
logam → oksida basa → alkali → garam
misalnya, seri genetik kalium K → K 2 O → KOH → KCl
b) Seri genetik, di mana basis adalah basis tidak larut, maka seri dapat direpresentasikan sebagai rantai transformasi:
logam → basa oksida → garam → basa tidak larut → oksida basa → logam
misalnya: Cu → CuO → CuCl 2 → Cu (OH) 2 → CuO → Cu
Di antara non-logam juga dimungkinkan untuk membedakan dua jenis baris:
a) Seri genetik non-logam, di mana asam larut bertindak sebagai penghubung dalam seri ini. Rantai transformasi dapat direpresentasikan sebagai berikut: non-logam → asam oksida → asam larut → garam.
Misalnya: P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
b) Baris genetik non-logam, di mana asam tidak larut: non-logam → asam oksida → garam → asam → asam oksida → non-logam bertindak sebagai penghubung dalam rangkaian
Misalnya: Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Eksekusi tugas untuk opsi:
| Opsi 1 | Opsi 2 |
|
Opsi I: ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2
Opsi II: Na 2 SO 4, NaOH, Na, Na 2 O 2, Na 2 O
PR: bagan transisi bertahap dari kalsium ke kalsium karbonat dan siapkan laporan tentang penggunaan garam apa pun dalam pengobatan (menggunakan literatur tambahan).
Instruksi untuk pelajaran praktis
Hubungan genetik antara kelas utama zat anorganik.
Tujuan: untuk memperbaiki konsep "seri genetik", "koneksi genetik"; belajar membuat rangkaian unsur-unsur genetik (logam dan non-logam), untuk membuat persamaan reaksi yang sesuai dengan rangkaian genetik; ulangi sifat oksida, asam, garam, basa.
Kemajuan kerja
Tuliskan definisi konsep:
Hubungan genetik - __________________________________________
Baris genetik - ___________________________________________
Serangkaian genetik logam di mana alkali bertindak sebagai basa. dapat direpresentasikan secara umum: logam → basa oksida → alkali → garam. Buat seri ini menggunakan kalium. Tulis persamaan reaksi, dengan bantuan yang Anda bisa capai rantai transformasi ini.
Seri genetik non-logam, di mana asam larut bertindak sebagai penghubung dalam seri ini dapat direpresentasikan sebagai berikut: non-logam → asam oksida → asam larut → garam. Buat seri ini menggunakan fosfor. Tulis persamaan reaksi, dengan bantuan yang Anda bisa capai rantai transformasi ini.
Baris genetik, di mana basis adalah basis tidak larut dapat diwakili oleh rantai transformasi: logam → oksida basa → garam → basa tidak larut → oksida basa → logam. Bangun seri ini menggunakan tembaga. Tulis persamaan reaksi, dengan bantuan yang Anda bisa capai rantai transformasi ini.
Seri genetik non-logam, di mana asam tidak larut berperan sebagai penghubung dalam seri ini dapat diwakili oleh rantai transformasi: non-logam → asam oksida → garam → asam → asam oksida → non-logam. Buat seri ini menggunakan silikon. Tulis persamaan reaksi, dengan bantuan yang Anda bisa capai rantai transformasi ini.
Lakukan tugas untuk opsi:
| Opsi 1 | Opsi 2 |
|
1. Pilih formula oksida dalam versi Anda, jelaskan pilihan Anda, berdasarkan pengetahuan tentang karakteristik komposisi senyawa kelas ini. Panggil mereka.
2. Di kolom formula varian Anda, cari formula asam dan jelaskan pilihan Anda berdasarkan analisis komposisi senyawa-senyawa ini.
3. Tentukan valensi residu asam dalam komposisi asam.
4. Pilih formula garam dan beri nama.
5. Buat formula garam, yang dapat dibentuk dengan magnesium dan asam dari varian Anda. Tuliskan, beri nama.
6. Di kolom rumus variasi Anda, cari formula basa dan jelaskan pilihan Anda berdasarkan analisis komposisi senyawa ini.
7. Dalam varian Anda, pilih formula zat yang dengannya larutan asam ortofosfat (hidroklorik, sulfat) dapat bereaksi. Buat persamaan reaksi yang sesuai.
9. Di antara formula pilihan Anda, pilih formula zat yang dapat saling berinteraksi. Buat persamaan reaksi yang sesuai.
10. Buatlah rantai ikatan genetik senyawa anorganik, yang akan mencakup suatu zat, formula yang diberikan dalam versi Anda di nomor satu.
Dari zat-zat ini buat garis genetik menggunakan semua formula. Tulis persamaan reaksi yang dengannya Anda dapat mencapai rantai transformasi ini:
Saya opsi: ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2
IIopsi: Na 2 SO 4, NaOH, Na, Na 2 O 2, Na 2 O
PR: bagan transisi bertahap dari kalsium ke kalsium karbonat dan siapkan laporan tentang penggunaan garam apa pun dalam pengobatan (menggunakan literatur tambahan).
