Formula kimia asam sulfat. Asam sulfat: sifat kimia, persiapan
H2SO3, asam dibasic lemah. Dalam bentuk bebas itu tidak dialokasikan, ada dalam larutan air. Sulfat asam sulfat ... Kamus Ensiklopedis Besar
Asam sulfat - (H2SO3) asam dibasic lemah. Hanya ada dalam larutan air. Garam S. hingga Sulfit. Diterapkan dalam industri kertas pulp dan makanan. Lihat juga Asam dan anhidrida ... Ensiklopedia Rusia tentang perlindungan tenaga kerja
asam sulfat - - [A.S. Goldberg. Kamus energi Rusia Bahasa Inggris. 2006] Topik energi pada umumnya asam sulfat EN ... Panduan Penerjemah Teknis
H2SO3, asam dibasic lemah. Dalam bentuk bebas itu tidak dialokasikan, ada dalam larutan air. Asam sulfat sulfit. * * * Asam sulfat, asam sulfat, H2SO3, asam dibasat lemah. Gratis tidak dipilih, ... ... Kamus ensiklopedis
asam sulfat - sulfito status status sebagai T chritis form formė H₂SO₃ atitikmenys: angl. asam sulfat rus. asam sulfat ryšiai: sinonimas - vandenilio trioksosulfatas (2–) ... Terminal Chemijos digunakan sebagai basis
H2SO3, asam dibasic lemah, sesuai dengan tingkat oksidasi sulfur +4. Hanya dikenal dalam larutan encer. Konstanta disosiasi: K1 = 1,6 · 10 2, K2 = 1,0 · 10 7 (18 ° C). Ini memberi dua baris garam: Sulfit normal dan asam ... ... Ensiklopedia Besar Soviet
H2SO3, asam dibasic lemah. Dalam bentuk bebas tidak disorot, itu ada di perairan. p rah. Garam S. k. Sulfit ... Ilmu alam. Kamus ensiklopedis
Lihat Belerang ... Kamus ensiklopedis FA Brockhaus dan I.A. Efrona
Sulfur dioksida (dioksida) dibentuk dengan membakar belerang di udara atau oksigen. Ini juga diperoleh dengan mengkalsinasi sulfida logam ("pembakaran") di udara, misalnya, pirit besi:
Menurut reaksi ini, sulfur dioksida biasanya diperoleh dalam industri (untuk metode industri lainnya untuk memperoleh cm, 9 § 131).
Sulfur dioksida adalah gas tidak berwarna ("sulfur dioksida") dengan belerang tajam yang panas. Ini mengembun dengan mudah menjadi cairan tidak berwarna yang mendidih. Ketika cairan menguap, ada penurunan suhu yang kuat (sebelum).
Sulfur dioksida sangat larut dalam air (sekitar 40 volume dalam 1 volume air pada); pada saat yang sama, reaksi dengan air terjadi sebagian dan asam sulfur terbentuk:
Jadi, sulfur dioksida adalah asam sulfat anhidrida. Ketika dipanaskan, kelarutan berkurang dan keseimbangan bergeser ke kiri; lambat laun semua sulfur dioksida dilepaskan dari larutan lagi.
Molekul ini dibangun mirip dengan molekul ozon. Inti atom penyusunnya membentuk segitiga sama kaki:
Di sini, atom sulfur, seperti atom oksigen sentral dalam molekul ozon, berada dalam keadaan hibridisasi-a dan sudutnya dekat. Berorientasi tegak lurus terhadap bidang molekul, orbital atom sulfur tidak berpartisipasi dalam hibridisasi. Karena orbital ini dan, orbital atom oksigen yang berorientasi serupa, ikatan tiga pusat terbentuk; pasangan elektron yang membawanya adalah milik ketiga atom molekul.
Sulfur dioksida digunakan untuk memproduksi asam sulfat, dan juga (dalam jumlah yang jauh lebih kecil) untuk memutihkan jerami, wol, sutra dan sebagai desinfektan (untuk penghancuran jamur kapang di ruang bawah tanah, gudang, tong anggur, tangki fermentasi).
Asam sulfat adalah senyawa yang sangat rapuh. Hanya dikenal dalam larutan air. Ketika mencoba untuk mengisolasi asam belerang, ia terurai menjadi air. Misalnya, ketika asam sulfat pekat bekerja pada natrium sulfit, sulfur dioksida dilepaskan alih-alih asam sulfur:
Larutan asam sulfat harus dilindungi dari udara, jika tidak, menyerap oksigen dari udara, perlahan teroksidasi menjadi asam sulfat:
Asam sulfat adalah agen pereduksi yang baik. Misalnya, halogen bebas dipulihkan olehnya menjadi hidrogen halida:
![]()
Namun, ketika berinteraksi dengan zat pereduksi kuat, asam sulfat dapat memainkan peran agen pengoksidasi. Jadi, reaksinya dengan hidrogen sulfida terutama berlangsung sesuai dengan persamaan:
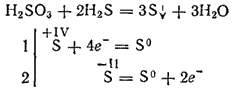
Karena dibasic, asam belerang membentuk dua baris garam. Garam tengahnya disebut sulfit, garam asam - hidrosulfit.
Seperti asam, sulfit dan hidrosulfit adalah agen pereduksi. Ketika mereka dioksidasi, garam asam sulfat diperoleh.
Sulfit dari logam yang paling aktif selama kalsinasi terurai dengan pembentukan sulfida dan sulfat (reaksi oksidasi sendiri - reduksi sendiri):
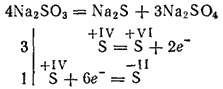
Potasium dan natrium sulfit digunakan untuk memutihkan beberapa bahan dalam industri tekstil untuk mewarnai kain, dalam fotografi. Solusinya (garam ini hanya ada dalam larutan) digunakan untuk mengolah kayu menjadi apa yang disebut pulp sulfit, dari mana kertas kemudian diperoleh.
Asam belerang mampu bereaksi dengan oksigen. Ini membentuk asam sulfat. Reaksi ini memakan waktu sangat lama dan hanya mungkin terjadi jika aturan penyimpanan dilanggar. Asam sulfat memiliki sifat oksidasi dan pereduksi. Dengan bantuannya Anda bisa mendapatkan asam halogen. Larutan berair ketika bereaksi dengan klor membentuk asam klorida dan hidroklorat.
Saat bereaksi dengan zat pereduksi kuat, asam sulfat berperan sebagai zat pengoksidasi. Salah satu zat ini adalah hidrogen sulfida, gas dengan bau yang sangat tidak enak. Berinteraksi dengan larutan asam sulfat dalam air, ia membentuk sulfur dan air. Garam asam sulfat juga memiliki sifat pereduksi. Mereka dibagi menjadi sulfit dan hidrosulfit. Reaksi oksidasi dari garam-garam ini menghasilkan asam sulfat.
Produksi asam sulfat
Asam sulfat hanya terbentuk oleh interaksi sulfur dioksida dan air. Perlu mendapatkan gas asam. Ini dapat dilakukan dengan tembaga dan asam sulfat. Tuang perlahan asam sulfat pekat ke dalam tabung dan lemparkan sepotong tembaga ke dalamnya. Panaskan tabung dengan lampu roh.
Sebagai hasil dari pemanasan, tembaga sulfat (tembaga sulfat), air dan sulfur dioksida terbentuk, yang dengan bantuan tabung khusus harus dibawa ke kerucut dengan air jernih. Dengan cara ini, asam sulfat dapat diperoleh.
Ingatlah bahwa sulfur dioksida berbahaya bagi manusia. Ini menyebabkan kerusakan jalan nafas, kehilangan nafsu makan dan sakit kepala. Menghirup dalam waktu lama dapat menyebabkan pingsan. Ketika bekerja dengannya perlu hati-hati.
Gunakan asam sulfat
Asam sulfat memiliki sifat antiseptik. Ini digunakan dalam desinfeksi permukaan, fermentasi butir. Ini dapat digunakan untuk memutihkan beberapa zat yang terurai ketika mereka bereaksi dengan oksidan kuat (misalnya, klorin). Zat semacam itu termasuk wol, sutra, kertas, dan beberapa lainnya. Sifat antibakterinya digunakan untuk mencegah fermentasi anggur dalam tong. Dengan demikian, minuman yang mulia dapat disimpan untuk waktu yang sangat lama, memperoleh rasa yang mulia dan aroma yang unik.
Asam sulfat digunakan dalam pembuatan kertas. Penambahan asam ini termasuk dalam teknologi produksi pulp sulfit. Kemudian diperlakukan dengan larutan kalsium hidrosulfit untuk mengikat serat.
