Senyawa kalsium dan magnesium
Jadi, setelah menentukan berapa banyak kalsium yang terkandung dalam kulit telur yang dihancurkan kemarin, muncul pertanyaan "untuk minum atau tidak minum?". Seperti kebanyakan pria, saya memunculkan segala sesuatu dari sudut pandang ilmiah dan sampai saya melihatnya sendiri, mencari tahu, mengecek, merasakan kata-kata untuk seorang wanita. Karena itu, saya akan membagikan pemikiran saya berdasarkan informasi yang ditemukan tentang kulit telur dan kalsium.
Mengumpulkan informasi di Internet tentang penggunaan kulit telur sebagai aditif makanan lebih dari sekali menemukan komentar kritis dokter bahwa kalsium karbonat yang terkandung dalam kulit telur tidak larut dalam air dan karenanya tidak dapat diserap oleh tubuh.
Selain itu, kisah pasangan teman saya teringat bahwa selama kehamilan dia memberi tahu dokternya, yang telah mengamati bahwa dia mengambil kulit telur yang dihancurkan - dokter membujuknya dan meresepkan semacam kompleks yang mengandung kalsium.
Dimana kebenarannya?
Memang, kalsium karbonat CaCO3 (tepatnya dalam tipe ini, kalsium ada dalam kulit telur) tidak larut dalam air dan alkohol.
Prasyarat yang sangat diperlukan untuk penyerapan kalsium adalah kelarutan dalam air.
Tetapi ingat bahwa dasar dari pencernaan kita adalah asam hidroklorat yang diekskresikan dalam lambung.
Dan itulah yang terjadi di perut kita:
СaCO3 + 2HCl (asam klorida) = СaCl2 (kalsium klorida) + Co2 + H20
Tapi kalsium klorida sangat larut dalam air !!! Dalam bentuk inilah kalsium diserap!
Tidak kenal dokter? Atau mereka hanya licik dan menjual obat-obatan kepada kita!
Plus, selama reaksi ini, terjadi penurunan keasaman lambung. Yang penting bagi orang yang menderita keasaman tinggi.
Contohnya adalah istri saya, ia memiliki keasaman tinggi, dan ia mengambil cangkang telur yang dihancurkan setiap hari dan ini memecahkan dua masalah sekaligus dan mengimbangi kekurangan kalsium dan menurunkan keasamannya. Namun bubuk kulit telur padam jus lemon tidak bisa minum - ada mual! Dan sekarang saya mengerti mengapa.
Seperti yang kita lihat di atas, untuk penyerapan kalsium dari kalsium karbonat membutuhkan jus lambung dengan keasaman tinggi.
Dalam kehidupan nyata, sangat sering terjadi situasi ketika keasaman lambung rendah atau nol. Situasi ini terutama menjadi ciri khas orang tua, ketika kebutuhan kalsium sangat tinggi untuk mencegah osteoporosis. Misalnya, setelah 50 tahun, keasaman rendah terjadi pada sekitar 40% orang. Dalam kondisi ini, penyerapan kalsium karbonat, yang membutuhkan asam klorida untuk larut dalam perut, turun menjadi 2%.
Mungkin ini adalah jawaban mengapa orang tua lebih mungkin menderita penyakit yang berhubungan dengan kekurangan kalsium - mereka tidak bisa berasimilasi dengan bentuk biasa.
Sekarang pertimbangkan mengapa banyak resep untuk menerima kulit telur yang dihancurkan disarankan untuk memadamkannya dengan jus lemon.
Ketika kita menambahkan jus lemon ke dalam asam sitrat yang dihancurkan, kalsium karbonat (CaCo3) bereaksi dengan asam sitrat (C6H8O7) dan kita mendapatkan kalsium sitrat (Ca3 (C6H5O7) 2):
2C6H8O7 + 3CaCO3 = Ca3 (C6H5O7) 2 + 3CO2 + 3H2O
Ini dia. Dan penyerapan kalsium sitrat, yang tidak memerlukan asam klorida dalam perut, adalah 44%. Akibatnya, dalam kondisi keasaman rendah, kalsium sitrat memasuki tubuh dengan 11 kali lebih banyak kalsium daripada dari karbonat!
Dan kalsium sitrat sudah merupakan obat terkenal yang dijual kepada kita untuk mendapatkan uang! Dan mereka melakukannya, hanya saja mereka tidak menggunakan jus lemon, tetapi asam sitrat!
Ngomong-ngomong, kalsium karbonat (cangkang telur kami) adalah makanan tambahan yang terdaftar. E170, dan kalsium sitrat (kulit telur suwir kami yang dituangkan dengan jus lemon) adalah bahan tambahan makanan terdaftar. E333! Dan mereka ditambahkan ke banyak produk makanan, terutama produk susu, termasuk susu, untuk meningkatkan persentase kalsium!
Jadi mengapa membayar lebih banyak!
Kesimpulannya, jika Anda memiliki tingkat keasaman tinggi - mungkin lebih baik menggunakan kulit telur yang diparut, jika tingkat keasamannya lebih rendah, mungkin lebih baik untuk memadamkan bubuk kulit telur dengan jus lemon.
Dan lagi,
Pada malam hari, ada pelepasan garam mineral yang dipercepat dari tubuh (akselerasi proses resorptif di tulang). Karena itu, persiapan kalsium harus dilakukan setelah makan siang dan malam hari.Itu akan mencegah percepatan kehilangan kalsium di paruh kedua malam, terutama dengan tingkat berkurangnya (atau tidak adanya) di usus. Efek negatif tergantung dosis dari aktivitas farmakoterapi kalsium juga dicatat: dalam dosis rendah biometall ini diserap lebih baik daripada yang tinggi.
Sehubungan dengan ini lebih rasional untuk minum obat beberapa kali sehari.
Kami membaca, kami berdiskusi. Di bawah ini adalah beberapa artikel tentang topik ini.
__________________________________________________________________________________________________________
Kalsium sitrat versus kalsium karbonat
Sumber dari< http://www.ortho.ru/77_KMD/Ca_Sravni.htm >
_________________________________________________________________________________________________________
Kalsium sitrat.
Kalsium sitrat adalah sumber kalsium terserap yang sangat baik, yang memainkan peran yang sangat penting dalam tubuh, karena itu mempengaruhi banyak proses enzimatik dan pembekuan darah. Kekurangan kalsium menyebabkan kerapuhan tulang dan osteoporosis. Untuk anak kecil, itu baik untuk kesehatan gigi, orang dewasa membutuhkan asupan kalsium secara teratur untuk menstabilkan tekanan darah.
Menurut National Cancer Institute (USA), suplemen E-333 berpotensi dapat mencegah kanker usus besar dan kanker lainnya. Selain itu, kalsium sitrat digunakan dalam pengobatan untuk menghilangkan logam berat dari tubuh.
Karena kalsium sitrat adalah salah satu bentuk transportasi kalsium yang paling penting dalam tubuh manusia, kalsium sitrat digunakan dalam pengobatan bersama dengan kalsium karbonat (E-170 aditif) yang kurang efektif untuk mengisi cadangan kalsium dalam tubuh. Untuk alasan yang sama, kalsium sitrat digunakan dalam bentuk suplemen makanan (suplemen makanan).
Dalam industri makanan, aditif E-333 digunakan sebagai zat penstabil, pengawet, pengatur keasaman, pengawet warna.
Sebagai penstabil, aditif makanan E-333 digunakan dalam pembuatan susu kental, krim, keju krim. Dalam selai, jeli dan buah kaleng, aditif E-333 digunakan sebagai pengatur keasaman. Kalsium sitrat juga banyak digunakan untuk memperkaya kalsium dalam produk susu dan susu, produk roti dan tepung, dan minuman ringan.
Secara tampilan, kalsium sitrat adalah bubuk putih dengan rasa asam yang nyata. Larut dalam air. Formula molekuler kalsium sitrat: Ca3 (C6H5O7) 2. Dapatkan E-333 melalui interaksi asam sitrat dengan kalsium hidroksida.
Properti dan fungsi teknologi:
Kemungkinan nama suplemen makanan:
- E-333
- E-333
- Kalsium sitrat
- Kalsium sitrat
- Monocalcium citrate
- Dicalcium citrate
- Tricalcium citrate
_____________________________________________________________________________________________
Sitrat Kalsium
Di pertengahan abad kedua puluh. semacam "booming" dimulai: ahli biokimia, ahli fisiologi, ahli biofisika, ahli farmakologi dan dokter mulai menunjukkan minat yang meningkat dalam mempelajari peran kalsium dalam mengatur aktivitas organ dan sistem tubuh. Ion kalsium telah ditemukan terlibat dalam eksitasi dan kontraksi sel otot, regulasi permeabilitas membran sel, interaksi antar sel, pembekuan darah, sekresi hormon, mediator, enzim; melakukan fungsi transduser sinyal memasuki sel, berpartisipasi dalam proses regulasi metabolisme intraseluler, termasuk energi. Pada permukaan selaput kardiomiosit dan pembuluh ion kalsium bebas adalah 1000 kali lebih banyak dari pada sel sitosol. Dari ruang ekstraseluler mereka menembus ke dalam sitoplasma melalui saluran kalsium khusus, mempengaruhi berbagai proses fisiologis dan fungsi sel-sel semua organ, tonus pembuluh darah, intensitas sistol, diastol.
Kalsium memainkan peran penting dalam pembentukan jaringan tulang dan menjaga struktur dan fungsinya yang normal. Seiring dengan protein khusus, ion kalsium memberikan kekerasan dan elastisitas tulang.
Semua ini berfungsi sebagai landasan teoretis untuk pengembangan dan pengenalan persiapan kalsium berdasarkan garamnya ke dalam praktik medis. Saat ini, dalam praktik medis, garam kalsium seperti gliserofosfat, glukonat, karbonat, laktat, sitrat, klorida, fosfat, dan banyak lainnya digunakan.
Farmakokinetik obat CALCIUM CITRATE memiliki karakteristiknya sendiri. Kalsium diserap dari usus dalam bentuk terionisasi yang larut. Pembubaran obat terjadi lebih baik di lingkungan asam lambung. Kalsium terionisasi terlarut menembus dengan baik ke semua jaringan, menembus penghalang plasenta, masuk ke ASI. Diekskresikan terutama dalam tinja, sekitar 20% - dengan urin. Fitur penting dari Kalsium Sitrat adalah kemampuan rendah untuk membentuk batu ginjal, yang penting dengan penggunaan jangka panjang dari garam ini. Ini disebabkan oleh fakta bahwa garam sitrat mengurangi jumlah oksalat dalam urin.
Ketersediaan hayati ditentukan oleh kecepatan dan sejauh mana bahan aktif diserap dari bentuk sediaan, itu tersedia di tempat tindakan terapeutik yang dimaksud.
Pada malam hari, ada pelepasan garam mineral yang dipercepat dari tubuh (akselerasi proses resorptif di tulang). Oleh karena itu, persiapan kalsium harus dilakukan setelah makan siang dan di malam hari, yang akan mencegah percepatan kehilangan kalsium pada paruh kedua malam, terutama dengan kadar (atau ketidakhadiran) di usus yang berkurang. Efek negatif dosis-tergantung dari aktivitas farmakoterapi kalsium dicatat: biometall ini diserap lebih baik pada dosis rendah daripada pada dosis tinggi. Dalam hal ini, lebih rasional mengonsumsi obat beberapa kali sehari. Untuk kelompok umur yang berbeda ada norma fisiologis yang berbeda dari asupan kalsium (tabel).
Meja
Tingkat asupan kalsium yang disarankan pada orang-orang dari berbagai usia
(menurut Masyarakat Kanada untuk Osteoporosis)
Vitamin D, asam klorida, laktosa, asam sitrat, adanya protein dalam makanan, fosfor, magnesium, serta beberapa makanan seperti mentega, telur, susu, ikan, lemak ikan kod, kubis, dll., Berkontribusi pada penyerapan ion kalsium.
Penyerapan kalsium memburuk: kekurangan protein dalam makanan, ketaatan ketat pada diet vegetarian, kekurangan magnesium, fosfor, makanan yang kaya akan asam oksalat (sorrel, rhubarb, bayam).
Penyerapan kalsium melambat pada penyakit pada organ pencernaan (gastritis, enteritis, kolitis, tukak lambung), pankreas (diabetes, pankreatitis), patologi organ endokrin lainnya.
Perlu ditekankan bahwa beberapa obat, terutama glukokortikoid, obat kontrasepsi hormonal untuk penggunaan sistemik, levothyroxine juga memperburuk penyerapan ion kalsium.
Menurut hasil penelitian ilmiah (data Canadian Society for Osteoporosis), tidak ada bukti yang meyakinkan atas dasar mana tambahan konsumsi mineral lain (magnesium, seng, tembaga, dll.) Dapat direkomendasikan untuk pencegahan atau pengobatan osteoporosis.
Hasil studi klinis yang dilakukan di Ukraina dan negara-negara lain telah mengkonfirmasi efektivitas tinggi obat ini dalam pengobatan banyak penyakit. Kalsium sitrat juga digunakan untuk tujuan profilaksis pada berbagai penyakit.
Dengan osteoporosis pada orang tua, osteomalacia CALCIUM CITRATE diresepkan 2-6 tablet per hari, membagi dosis harian menjadi 3-4 dosis. Obat ini diminum sebelum makan atau 1-1,5 jam setelah makan, selama 3 bulan. Pasien seperti itu juga harus diberi resep vitamin D3 400-800 IU per hari, dan juga termasuk minyak, susu, ikan, dan telur dalam makanan.
CALCIUM CITRATE adalah bentuk dosis optimal untuk menyediakan kalsium tidak hanya untuk orang dewasa, tetapi juga untuk anak-anak, serta remaja, karena membantu meningkatkan kepadatan mineral tulang, meningkatkan massa tulang, memperkuat dentin dan enamel gigi. Anak-anak di bawah usia 6 bulan diresepkan 1/2 tablet (250 mg) (dihancurkan, dilarutkan dalam sedikit susu), pada usia 6-12 bulan - juga 1/2 tablet 2 kali sehari, pada usia 1 tahun - 10 tahun - 1-2 tablet, 10-18 tahun - 2-3 tablet per hari.
Indikasi untuk pengangkatan Kalsium Sitrat adalah:
hipokalsemia akibat perdarahan dari berbagai asal, serta selama kehamilan dan menyusui, dengan cedera - untuk memenuhi peningkatan kebutuhan tubuh akan ion kalsium;
pelanggaran penyerapan kalsium pada penyakit pada saluran pencernaan dan peningkatan tingkat ekskresi kalsium melalui ginjal dan usus;
hipoparatiroidisme, dehidrasi organisme berbagai genesis, penyakit alergi dan komplikasi alergi saat minum obat, meningkatkan permeabilitas dinding pembuluh darah, mengurangi pembekuan darah.
CALCIUM CITRATE harus diresepkan ketika mengambil glukokortikoid, kontrasepsi oral, levothyroxine. Dalam tiga kasus terakhir, obat diminum 1 tablet 6 kali sehari setelah makan.
Kalsium sitrat, sebagai suatu peraturan, ditoleransi dengan baik, kadang-kadang gejala dispepsia (sembelit atau diare, mual, muntah, kehilangan nafsu makan, sakit perut), poliuria dapat terjadi.
Penggunaan simultan CALCIUM CITRATE dengan antasida yang mengandung aluminium tidak dianjurkan karena penurunan efektivitasnya. Tidak diinginkan untuk meresepkannya bersamaan dengan sediaan kalsium lainnya.
Kesimpulannya, kita dapat mencatat sifat farmakologis positif dari CALCIUM CITRATE:
garam kalsium sitrat terlarut dengan baik dan diserap dalam saluran pencernaan, yang mengarah pada penyerapan kalsium yang baik dalam tubuh dan, karenanya, efektivitas obat dalam profilaksis atau aplikasi terapiyang dikonfirmasi oleh hasil banyak studi klinis.
Risiko rendah pembentukan batu di ginjal ketika mengambil obat meningkatkan nilai kalsium sulfat dengan penggunaan jangka panjang.
Saya Chekman, Kepala Departemen Farmakologi dengan program Farmakologi Klinis dari Universitas Kedokteran Nasional, Anggota Sejalan Akademi Ilmu Pengetahuan Nasional dan Akademi Ilmu Kedokteran Ukraina, Pekerja terhormat Ilmu Pengetahuan dan Teknologi, Profesor
Halaman 1
Reaksi karbonat dengan asam dapat digunakan sebagai sampel untuk karbonat. Asam karbonat adalah asam yang sangat lemah dan tidak stabil. Ini dapat diperas dari garamnya dengan aksi asam yang lebih mudah menguap dan lebih kuat.
Demikian pula, reaksi kalsium karbonat dengan asam berlangsung.
Reaksi karbonat dengan asam hidroklorat menghasilkan kalsium klorida dan magnesium klorida, yang larut dengan baik dalam air dan tetap dalam bentuk larutan dengan konsentrasi berbeda. Laju reaksi dalam kolektor jenis ini tergantung terutama pada tekanan dan suhu.
Sebagai hasil dari reaksi karbonat dengan asam klorida kalsium klorida dan magnesium, larut dalam air dan tersisa dalam bentuk larutan dengan konsentrasi berbeda.
Pengenalan natrium karbonat yang tidak dikeringkan ke dalam reaksi memerlukan tekanan yang lebih tinggi dan peningkatan jumlah katalis.
Penjelasan dari fenomena yang terdaftar atau diamati: mengapa reaksi kalsium karbonat dengan asam sulfat dimulai pada awalnya dengan keras dan kemudian berhenti. Mengapa ketika dipanaskan zat amonium karbonat kering menghilang dari tabung.
Efek menguntungkan dari kalsium karbonat pada stabilitas semen Portland dapat dijelaskan oleh reaksi karbonat dengan mineral klinker yang mengandung aluminium. Jadi, komponen aluminat dari batu semen terikat secara kimiawi sebelum bersentuhan dengan sulfat lingkungan.
Beberapa aplikasi barium karbonat didasarkan pada ketidakmampuan praktis barium sulfat, yang dibentuk oleh reaksi barium karbonat dengan zat yang mengandung ion sulfat. Jadi, ketika mengeringkan bata sebelum terbakar, mekar putih muncul di permukaannya, disebabkan oleh kristalisasi gipsum atau magnesium sulfat yang terkandung dalam tanah liat. Untuk mencegah hal ini terjadi, barium karbonat ditambahkan ke tanah liat, yang menyebabkan pengendapan ion sulfat.
Dalam pengantar tentang kimia padatan, Hedwal, sebagai contoh reaksi yang mungkin secara teoritis, menghasilkan reaksi kalsium karbonat dengan SiO2, yang menghasilkan pembentukan kalsium silikat. Dia menyertai contoh ini dengan mencatat bahwa dengan apa yang disebut metamorfosis panas bumi, suhu biasa tidak cukup, karena reaksi antara kalsium karbonat dan asam silikat dapat diamati dalam kondisi laboratorium hanya pada suhu 500 C.
Untuk mengurangi biaya pembentukan dahak dalam proses ini, Klima dan Ward menyarankan menggunakan larutan amonium karbonat (bukan amonium nitrat) dan membuat dahak karena reaksi amonium karbonat yang diperkaya dengan kapur.
Saat suhu naik, reaksi bergeser ke arah pembentukan silikat yang lebih basa. Gibson dan Ward11 pada reaksi natrium karbonat dengan kuarsa pada suhu dari 726 hingga 805 C dalam aliran nitrogen menunjukkan bahwa orto-silikat terbentuk di hadapan jumlah natrium karbonat yang cukup. Laju reaksi tergantung pada waktu, ukuran sampel, laju aliran gas dan komposisi campuran reaksi. Gibson dan Ward berpendapat bahwa ada natrium silikat tingkat menengah.
Kelebihan natrium karbonat dititrasi dengan asam klorida. Jumlah sulfur dalam produk yang dianalisis dihitung dengan jumlah natrium karbonat yang direaksikan.
Dan kalsium karbonat dan bagaimana senyawa kimia ini berinteraksi.
Kalsium karbonat
Kisi kalsium karbonat CaCO₃CaCO₃ adalah senyawa yang sangat umum di dunia sekitar, terdiri dari: kapur, batu kapur, marmer, dll. Oleh karena itu, perlu dicatat bahwa peran zat ini bagi manusia sangat signifikan, karena kalsium karbonat banyak digunakan dalam industri makanan, sebagai pewarna putih alami. CaCO₃ juga digunakan dalam pembuatan kertas, plastik, konstruksi dan banyak bidang lainnya.
Kalsium karbonat adalah zat putih (kristal padat) dalam bentuk bubuk atau padat. Dia mampu bereaksi dengan air, tetapi tidak sepenuhnya larut di dalamnya. Oleh karena itu, air menjadi keruh, dan ada endapan putih di dalamnya. Tetapi jika reaksi dengan air akan terjadi di hadapan, maka kita akan mendapatkan garam asam yang larut, kalsium bikarbonat:
CaCO₃ + CO₂ + H₂O → Ca (HCO₃)
Pertimbangkan bagaimana kalsium karbonat dibuat.
Sebagian besar kalsium karbonat diperoleh dari sumber alami. Jadi, untuk mendapatkan kalsium karbonat, biasanya, gunakan sumber yang bersih, sering berupa marmer.
 Patung marmer David oleh Michelangelo Buonarroti
Patung marmer David oleh Michelangelo Buonarroti
Tetapi dalam kondisi laboratorium, kalsium karbonat dapat diperoleh dengan mengalsinasi kalsium oksida. Kalsinasi mengacu pada gagasan umum tentang pembakaran, sebagai akibatnya bahan kimia memperoleh sifat baru. Penembakan dilakukan pada suhu yang cukup tinggi, tidak mencapai titik leleh.
Air dicampur dengan kalsium oksida yang dihasilkan, reaksi menghasilkan hidroksida. Kemudian teknisi mendapatkan karbon dioksida, yang dilewatkan melalui solusi yang diperoleh sebelumnya. Endapan yang terbentuk adalah kalsium karbonat:
CaO + H₂O = Ca (OH);
Ca (OH) + CO₂ = CaCO₃ + H₂O
Jika kita memanaskan garam asam karbonat dan kalsium ke suhu tinggi (900 - 1000 ° C), maka sebagai hasil dari proses kimia kita akan mendapatkan karbon dioksida (karbon dioksida), serta kalsium oksida CaO - kapur api yang digunakan dalam konstruksi:
CaCO₃ = CaO + CO₂
Jika suhunya bahkan lebih tinggi (1500 ° C), maka produk-produk reaksi adalah kalsium karbida dan karbon monoksida.
Asam klorida
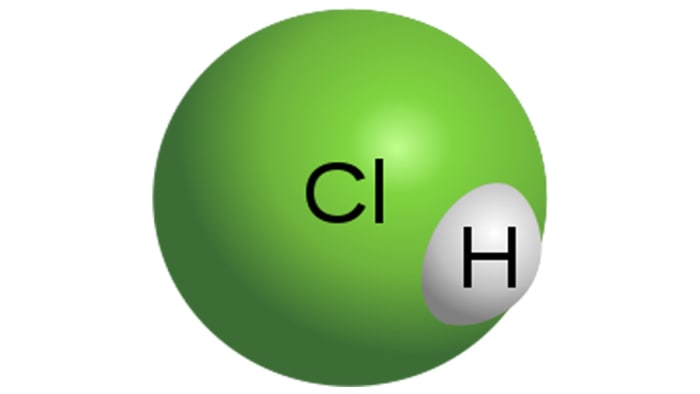 Molekul asam klorida
Molekul asam klorida
HCl adalah asam monobasa yang kuat, yang diperoleh dengan melarutkan hidrogen klorida dalam air. Ini adalah cairan tidak berwarna, meskipun asam teknis mungkin memiliki warna kuning, misalnya, karena pengotor besi. Sifat-sifat HCl akan langsung tergantung pada konsentrasi hidrogen klorida dalam larutan.
Garam asam klorida disebut klorida. Zat ini sangat pedas, oleh karena itu, memerlukan penanganan yang hati-hati: bahkan jika setetes jatuh ke kulit, maka luka bakar kimiawi yang kuat tidak dapat dihindari. Karena itu, ketika bekerja dengan asam kuat, disarankan untuk selalu membawa penetralisir dengan Anda: larutan alkali lemah, (baking soda), dll. Perlu diingat bahwa ketika membuka wadah dengan uap asam HCl pekat terbentuk, yang berdampak buruk pada mata dan sistem pernapasan. Karena itu, dalam percobaan kimia, sebaiknya menggunakan respirator dan kacamata.
Mendapatkan asam klorida
Gas hidrogen klorida dilarutkan dalam air. Hidrogen klorida sendiri diperoleh sebagai berikut: hidrogen dibakar dalam klorin, sehingga diperoleh asam sintetis. Atau, asam klorida dapat diperoleh dengan menggunakan gas samping, yang diperoleh dalam sejumlah percobaan kimia, misalnya, ketika hidrokarbon terklorinasi diklorinasi. Asam yang diperoleh dengan cara ini disebut abgasic.
Terapkan asam klorida dalam obat-obatan, industri, dan juga untuk reaksi kimia.
Asam tidak berwarna dengan bau menyengat dari hidrogen klorida bereaksi dengan baik dengan logam. Reaksi redoks terjadi. Zat pereduksi dalam proses reaksi adalah atom logam, dan zat pengoksidasi adalah kation hidrogen.
Terutama reaksi kimia dengan logam disertai dengan pelepasan hidrogen. Intensitas interaksi tergantung pada aktivitas logam, misalnya, logam alkali lithium bereaksi keras, sedangkan reaksi dengan aluminium lemah karena film oksida yang kuat dari elemen ini.
Asam klorida dan seng:
2HCl + Zn = ZnCl₂ + H₂
Asam klorida dan zat besi:
2HCl + Fe = FeCl₂ + H₂
Asam klorida dan magnesium:
2HCl + Mg = MgCl₂ + H₂
 Magnesium klorida, digunakan untuk membersihkan jalan dari es
Magnesium klorida, digunakan untuk membersihkan jalan dari es
Dengan oksida logam, asam membentuk garam dan air:
CuO + 2HCl = CuCl₂ + H₂O
Reaksi asam klorida dan kalsium karbonat
Untuk percobaan perlu:
tabung reaksi;
pipet kimia;
kalsium karbonat padat (marmer);
asam klorida;
sarung tangan;
respirator.
Perhatian! Jangan coba pengalaman ini sendiri!
Lakukan percobaan di area yang berventilasi baik, berhati-hatilah saat bekerja dengan asam klorida.
Tambahkan beberapa potong marmer ke kapal dan pipetkan asam klorida. Akibatnya, akan ada reaksi instan dengan pembentukan gelembung - karbon dioksida dilepaskan. Ini adalah reaksi pertukaran, produk-produknya adalah: senyawa asam karbonat yang lemah dan tidak stabil, yang terurai menjadi karbon dioksida dan air. Persamaan reaksi pelarutan kalsium karbonat dalam asam klorida:
CaCO₃ + 2HCl (dil.) → CaCl₂ + CO₂ + H₂O
- karakteristik elemen magnesium: struktur elektronik, kemungkinan keadaan oksidasi, senyawa dasar: oksida, hidroksida, garam. Apa itu karbonisasi dan apa perannya dalam konstruksi.
MgCO 3 = MgO + CO 2
Aplikasi.
Dalam industri ini digunakan untuk produksi refraktori, semen, dan pemurnian produk minyak bumi, sebagai pengisi dalam produksi karet. Magnesium oksida ultra-ringan digunakan sebagai abrasif yang sangat halus untuk membersihkan permukaan, khususnya, dalam industri elektronik.
Dalam pengobatan, digunakan jika terjadi peningkatan keasaman jus lambung, karena itu disebabkan oleh kandungan asam klorida yang berlebihan. Magnesia yang terbakar juga dikonsumsi ketika asam secara tidak sengaja dilepaskan ke dalam lambung.
Dalam industri makanan terdaftar sebagai aditif makanan E530.
Ini adalah reflektor absolut - suatu zat dengan koefisien refleksi yang sama dengan satu dalam pita spektrum lebar. Dapat digunakan sebagai standar putih yang tersedia.
Magnesium hidroksida - Hidroksida logam utama adalah magnesium. Basis tidak larut lemah.
Dalam kondisi standar, magnesium hidroksida adalah kisi heksagonal tidak berwarna. Pada suhu di atas 350 ° C terurai menjadi magnesium oksida dan air. Menyerap karbon dioksida dan air dari udara untuk membentuk magnesium karbonat utama. Magnesium hidroksida praktis tidak larut dalam air, tetapi larut dalam garam amonium. Ini adalah basis yang lemah. Ini terjadi di alam dalam bentuk mineral brucite.
Kwitansi.
Interaksi garam magnesium terlarut dengan alkali:
Secara umum:
Mg 2+ + 2OH - = Mg (OH) 2 ¯
Contoh:
MgCl 2 + 2NaOH = Mg (OH) 2 ¯ + 2NaCl
Mg (NO 3) 2 + 2KOH = Mg (OH) 2 ¯ + 2KNO 3
Interaksi larutan magnesium klorida dengan dolomit terbakar:
MgCl 2 + CaO × MgO + 2H 2 O = 2 Mg (OH) 2 ¯ + CaCl 2
Interaksi magnesium logam dengan uap air:
Mg + 2H 2 O = Mg (OH) 2 ¯ + H 2 -
Sifat kimia
Seperti semua basa lemah, magnesium hidroksida secara termal tidak stabil. Terurai saat dipanaskan hingga 350 ° C:
Berinteraksi dengan asam untuk membentuk garam dan air (reaksi netralisasi):
Mg (OH) 2 + 2HCl = MgCl 2 + 2H 2 O
Mg (OH) 2 + H 2 SO 4 = MgSO 4 + 2 H 2 O
Interaksi dengan oksida asam untuk membentuk garam dan air:
Mg (OH) 2 + SO 3 = MgSO 4 + H 2 O
Interaksi dengan larutan alkali pekat panas dengan pembentukan hydroxymagnesates:
Mg (OH) 2 + 2NaOH = Na 2
Mg (OH) 2 + Sr (OH) 2 = Sr
Aplikasi.
Magnesium hidroksida digunakan untuk mengikat belerang dioksida, sebagai flokulan untuk pengolahan air limbah, sebagai penghambat nyala dalam polimer termoplastik (poliolefin, PVC), sebagai aditif dalam deterjen, untuk menghasilkan magnesium oksida, pemurnian gula, sebagai komponen pasta gigi.
Dalam pengobatan, ia digunakan sebagai obat untuk menetralkan asam di lambung, serta obat pencahar yang sangat kuat.
Di Uni Eropa, magnesium hidroksida terdaftar sebagai aditif makanan E528.
Garam magnesium.
Kebanyakan garam magnesium sangat larut dalam air. Ion Mg 2+ memberikan solusi rasa pahit. Magnesium halida, dengan pengecualian MgF2, sangat higroskopis - mereka berdarah di udara.
Magnesium klorida MgCl 2 (magnesium klorida) meleleh pada 718 °. Di hadapan jejak air itu "merokok" di udara - itu terurai menjadi HCl dan MgO. Hidrat kristal tidak berwarna dengan 1, 2, 4, 6, 8 dan 12 molekul air dilepaskan dari larutan berair. Dalam kisaran suhu dari -3,4 hingga 116,7 °, MgCl 2 × 6H 2 0 hidrat kristalin stabil, yang terjadi secara alami sebagai mineral bischofite, dan dalam jumlah besar diperoleh dengan penguapan air laut. Magnesium klorida membentuk garam ganda, yang mana mineral karnalit KCl × MgCl 2 × 6H 2 O - sumber magnesium dan kalium klorida - sangat penting.
Aplikasi.
1. Magnesium klorida digunakan terutama dalam produksi magnesium logam, MgCl 2 × 6H 2 0 digunakan untuk mendapatkan semen magnesia.
2. Digunakan untuk memproses es dan salju sebagai aditif. Sebagai hasil dari reaksi dengan salju, itu menyebabkan leleh. Ini memiliki kelas bahaya ke-3 (zat berbahaya sedang) dan sifat korosif yang agresif.
Magnesium bikarbonat - Garam asam magnesium dan asam karbonat dengan rumus Mg (HCO 3) 2, hanya ada dalam larutan air.
Kwitansi.
Transmisi karbon dioksida melalui suspensi magnesium karbonat:
MgCO 3 + CO 2 + H 2 O = Mg (HCO 3) 2
Sifat fisik.
Magnesium bikarbonat hanya ada dalam larutan air.
Kehadiran magnesium bikarbonat dalam air menyebabkan kekakuan sementara.
Sifat kimia
Ketika memekatkan larutan, magnesium bikarbonat terurai:
Mg (HCO 3) 2 = MgCO 3 + CO 2 - + H 2 O
Magnesium Hidrofosfat (magnesium fosfat disubstitusi) - garam asam magnesium dan asam fosfat dengan formula MgHPO 4, sedikit larut dalam air, membentuk hidrat kristal.
Kwitansi.
Efek asam ortofosfat terhadap magnesium oksida atau magnesium karbonat:
MgO + H 3 PO 4 = MgHPO 4 + H 2 O
MgCO 3 + H 3 PO 4 = MgHPO 4 + CO 2 - + H 2 O
Tindakan natrium ortofosfat yang disubstitusi pada magnesium klorida:
MgCl 2 + 2Na 2 HPO 4 = MgHPO 4 + 2NaCl
Dekomposisi magnesium dihidrogen fosfat:
Mg (H 2 PO 4) 2 = MgHPO 4 + H 3 PO 4
Sifat fisik.
Magnesium hidrogen fosfat membentuk kristal putih, yang merupakan kristal hidrat: pada suhu hingga 225 ° C, MgHPO4 monohydrate terbentuk. H 2 O, densitas 2,32 g / cm³, pada suhu 36 °, MgHPO4 trihydrate terbentuk. 3H 2 O, kepadatan 2.10 g / cm³, dengan suhu kamar MgHPO4 heptahydrate terbentuk. 7H 2 O.
Sifat kimia.
Saat dipanaskan masuk ke pirofosfat:
Aplikasi.
Digunakan dalam suplemen makanan E343.
Magnesium dihidrogen fosfat - garam asam dari logam magnesium dan asam ortofosfat dengan rumus Mg (H 2 PO 4) 2, kristal higroskopis tidak berwarna, larut dalam air, membentuk hidrat kristalin.
Kwitansi.
Pembubaran hidroksida atau magnesium oksida dalam asam ortofosfat:
Sifat fisik.
Magnesium dihydrogen fosfat membentuk kristal tidak berwarna.
Komposisi kristal hidrat yang terbentuk dari Mg (H 2 PO 4) 2. nH 2 O, di mana n = 2, 4, 6.
Magnesium karbida - senyawa anorganik biner dari magnesium dan karbon dengan rumus MgС 2. Juga dikenal magnesium karbida dengan rumus Mg 2 C.
Kwitansi.
Sintering magnesium fluoride dan kalsium karbida:
Acetylene mengalir di atas bubuk magnesium:
Dengan mengembalikan pentana dengan bubuk magnesium pada 650 ° C, karbida Mg 2 C 3 yang lebih kompleks dapat diperoleh.
Sifat kimia.
Ketika dipanaskan terurai dengan pembentukan karbida menengah Mg2C3:
Berinteraksi dengan air:
Magnesium karbonat, magnesium karbonat, MgCO 3 - garam magnesium dari asam karbonat.
Properti
Kristal putih, kepadatan 3.037 g / cm ³. Pada 500 ° C terlihat, dan pada 650 ° C sepenuhnya terurai menjadi MgO dan CO2. Kelarutan magnesium karbonat dalam air tidak signifikan (22 mg / l pada 25 ° C) dan menurun dengan meningkatnya suhu. Ketika CO 2 jenuh dengan suspensi berair MgCO 3, yang terakhir larut karena pembentukan Mg (HCO 3) 2 bikarbonat. Dari larutan berair tanpa adanya kelebihan CO 2, magnesium karbonat dasar dipancarkan. Dengan karbonat dari sejumlah logam, magnesium karbonat membentuk garam ganda, yang termasuk mineral alami dolomit MgCO 3 · CaCO 3.
Prevalensi di alam.
Magnesium karbonat didistribusikan secara luas di alam dalam bentuk mineral magnesit.
Aplikasi.
Magnesium karbonat dasar 3MgCO 3 · Mg (OH) 2 · 3H 2 O (disebut white magnesia) digunakan sebagai pengisi senyawa karet untuk pembuatan bahan isolasi termal.
Magnesium karbonat diperlukan dalam produksi kaca, semen, batu bata.
Magnesium nitrat Mg (NO 3) 2 - kristal higroskopis tidak berwarna dengan kisi kubik; titik leleh 426 ° C (dengan penguraian). Kelarutan dalam air (g per 100 g): 73,3 (20 ° C), 81,2 (40 ° C), 91,9 (60 ° C). Juga larut dalam etanol, metanol, NH3 cair. Tergantung pada konsentrasi, nona-, heksa dan dihidrat mengkristal dari larutan berair.
Komponen pupuk kompleks, karena Magnesium adalah bagian dari klorofil, yang diperlukan untuk fotosintesis, meningkatkan aktivitas banyak enzim dan bertindak sebagai transporter fosfor. Kelarutan yang tinggi dan konduktivitas listrik yang rendah membuat produk ini sangat cocok untuk pemberian makan dan fertilisasi daun, terutama ketika menggunakan air irigasi dengan konsentrasi garam yang tinggi. Pupuk digunakan untuk nutrisi akar dan daun sayuran, beri, tanaman buah, anggur; pengoksidasi dalam komposisi piroteknik.
Karbonasi- saturasi larutan apa pun dengan karbon dioksida. Digunakan dalam konstruksi.
Karbonasi mineral - asam silikat dalam silikat digantikan oleh asam karbonat untuk membentuk karbonat. Dari karbonat, mineral pembentuk batuan dalam batuan sedimen adalah kalsit (lime spar) CaCO3. Magnesit - MgCO3 dan dolomit - CaMg (CO3) 2 lebih jarang terjadi. Masuk air bersih, tidak mengandung asam karbonat, kalsit dilarutkan dalam jumlah kecil (0,03 g per liter air); Magnesit praktis tidak larut. Jika air mengandung karbon dioksida, kalsit mudah larut dengan pembentukan kalsium karbonat asam, larut dalam air - Ca (HCO3) 2.
Karbonisasi adalah perubahan yang terjadi pada beton pada semen Portland ketika terpapar ke udara C02. Kalsium hidroksida Ca (OH) 2 dengan adanya uap air sangat terpengaruh. Kalsium hidroksida dikonversi menjadi kalsium karbonat ketika menyerap karbon dioksida. Kalsium karbonat tidak larut dalam air dan, sebagai akibatnya, cenderung menutup pori-pori pada permukaan beton (artinya beton padat, tahan air).
Biasanya, pH air pori dalam beton berkisar dari 10,5 hingga 11,5. Jika karena karbonisasi berkurang menjadi 9 ke bawah, maka korosi pada tulangan dimungkinkan. Oleh karena itu, ketebalan lapisan berkarbonisasi merupakan faktor penting dalam melindungi tulangan: semakin dalam karbonisasi, semakin besar bahaya korosi baja. Kedalaman karbonasi dapat ditentukan dengan mengolah beton dengan fenolftalein. Kehadiran sifat alkali di bawah aksi fenolftalein ditunjukkan oleh penampilan warna merah muda, sedangkan beton berkarbonasi mempertahankan warna aslinya.
Beton padat berkualitas tinggi mengalami karbonisasi sangat lambat. Tidak mungkin karbonisasi akan diamati pada kedalaman lebih dari 5-10 mm bahkan setelah operasi selama 50 tahun. Di sisi lain, kedalaman karbonisasi beton permeabel berkekuatan rendah dapat mencapai 25 mm dalam waktu kurang dari 10 tahun. Pengalaman menunjukkan bahwa produk beton berkualitas rendah sangat rentan terhadap karbonisasi.
- karakteristik elemen kalsium: struktur elektronik, kemungkinan keadaan oksidasi, senyawa utama: oksida, hidroksida, garam.
Kalsium - sebuah elemen dari subkelompok utama dari kelompok kedua, periode keempat dari tabel periodik unsur-unsur kimia DI Mendeleev, dengan nomor atom 20. Hal ini dilambangkan dengan simbol Ca (lat. Kalsium). Struktur elektronik 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 = [18 Ar] 4s 2, oksidasi +2, 0. Mengacu pada logam alkali tanah.
Zat kalsium sederhana adalah logam tanah alkali lunak, aktif secara kimiawi berwarna perak-putih. Produksi industri: elektrolisis kalsium klorida cair.
Kalsium Oksida CaO - oksida dasar, kapur tohor. Putih, higroskopis. Tahan api, tidak stabil secara termal, tidak stabil selama pengapian. Bereaksi keras dengan air (dengan efek exo tinggi), membentuk larutan yang sangat basa, proses ini disebut kapur slaking. Bereaksi dengan asam, oksida logam, non-logam. Ini digunakan untuk mensintesis senyawa kalsium lainnya, komponen bahan pengikat dalam konstruksi.
Produksi di industri - penembakan batu kapur (900 - 1200 o C)
Kalsium hidroksida Ca (OH) 2 - kapur terhidrasi, hidroksida dasar. Dibusuk dengan pemanasan sedang. Putih, higroskopis. Menyerap kelembaban dan karbon dioksida dari udara. Sedikit larut dalam dingin. air, apalagi - dalam air mendidih. Larutan jernih (air kapur) dengan cepat menjadi keruh karena pengendapan hidroksida (suspensi disebut milk of lime). Reaksi kualitatif adalah transmisi karbon dioksida melalui air kapur dengan penampakan sedimen CaCO3 dan transisinya menjadi larutan. Bereaksi dengan asam dan asam oksida, masuk ke dalam reaksi pertukaran ion.
Ini digunakan dalam konstruksi untuk persiapan mortar kapur (pasir + kapur + air kapur), yang berfungsi sebagai bahan pengikat untuk batu dan batu bata, finishing dinding (plesteran) dan tujuan konstruksi lainnya. Pemadatan solusi tersebut disebabkan oleh penyerapan CO2 dari udara.
Ca (OH) 2 + CO 2 → CaCO 3 ↓ + H 2 O
Ca (OH) 2 + H 2 SO 4 → CaSO 4 + 2 H 2 O,
Bereaksi dengan garam jika endapan terbentuk:
Ca (OH) 2 + Na 2 SO 3 → CaSO 3 ↓ + 2NaOH
Garam kalsium.
Kalsium sulfat (CaSO 4) - senyawa anorganik, garam kalsium dari asam sulfat.
Apakah ditemukan di alam sebagai dihidrat CaSO 4? 2H 2 O (gypsum, selenite) dan dalam keadaan anhidrat - anhidrit.
Kalsium klorida, CaCl2 - garam kalsium dari asam klorida.
Memiliki sifat higroskopis yang tinggi. Kelarutan (g per 100 g H2O): 74 (20 ° C) dan 159 (100 ° C). Larutan larutan kalsium klorida membeku pada suhu rendah (20% pada –18,57 ° C, 30% pada –48 ° C).
Membentuk hidrat CaCl2 · 6H2O, stabil hingga 29,8 ° C; pada suhu yang lebih tinggi, kristal hidrat dengan 4, 2, dan 1 molekul H2O keluar dari larutan jenuh. Ketika CaCl2 * 6H2O (58,8%) dicampur dengan salju atau es (41,2%), suhu turun menjadi -55 ° C (titik cryohydrate).
Kalsium klorida diperoleh sebagai produk sampingan dalam produksi soda.
Di laboratorium kimia, kalsium klorida digunakan sebagai pengisi untuk pengeringan tabung, juga disebut kalsium klorida, dimaksudkan untuk mengisolasi zat dalam kapal dari uap air atmosfer dan untuk pengeringan gas.
Kalsium klorida juga digunakan sebagai akselerator untuk memasang semen;
Kalsium karbonat (kalsium karbonat) - senyawa kimia anorganik, garam asam karbonat dan kalsium. Formula kimia —CaCO 3. Di alam, ditemukan dalam bentuk mineral - kalsit, aragonit dan vaterite, merupakan komponen utama dari batu kapur, marmer, kapur, adalah bagian dari kulit telur. Tidak larut dalam air dan etanol.
Dempul, berbagai sealant - semuanya mengandung kalsium karbonat dalam jumlah yang signifikan. Selain itu, kalsium karbonat adalah komponen penting dalam produksi bahan kimia rumah tangga.
Kalsium karbonat juga banyak digunakan dalam sistem pemurnian, sebagai cara memerangi pencemaran lingkungan, dengan bantuan kalsium karbonat mengembalikan keseimbangan asam-basa tanah.
- Contoh yang menggambarkan penggunaan oksida dan hidroksida kalsium dan magnesium dalam konstruksi.
Kalsium oksida dan hidroksida:
Saat mengapur kamar.
Ketika mengapur pagar kayu dan kasau corengan - untuk melindungi dari pembusukan dan kebakaran.
Untuk persiapan mortar kapur. Kapur telah digunakan untuk membangun batu sejak zaman kuno. Campuran biasanya disiapkan dalam proporsi ini: tiga atau empat bagian pasir (berat) ditambahkan ke satu bagian campuran kalsium hidroksida (kapur terhidrasi) dan air. Ketika ini terjadi, campuran mengeras oleh reaksi: Ca (OH) 2 + CO2 → CaCO3 ↓ + H2O. Ini adalah reaksi eksotermik, pelepasan energi adalah 27 kkal (113 kJ).
Seperti yang bisa dilihat dari reaksi, air dilepaskan selama itu. Ini adalah faktor negatif, karena di kamar yang dibangun dengan mortar kapur, kelembaban tinggi bertahan untuk waktu yang lama. Dalam hal ini, juga karena sejumlah keunggulan lain dibandingkan kalsium hidroksida, semen praktis menggantikannya sebagai pengikat untuk solusi bangunan. Selain itu, itu juga tidak dapat diterima untuk digunakan ketika meletakkan kompor, karena di bawah pengaruh suhu tinggi, karbon dioksida yang mencekik dilepaskan.
Untuk persiapan beton silikat. Komposisi beton silikat identik dengan komposisi mortar kapur, namun dibuat dengan metode lain - campuran kalsium oksida dan pasir kuarsa tidak diolah dengan air, tetapi dengan uap air super panas (174,5-197,4 ° C) dalam autoklaf pada tekanan 9-15 atmosfer.
Dalam pembuatan batu bata silikat.
Oksida dan magnesium hidroksida:
untuk produksi sistem gabungan bahan tahan api (papan bangunan magnesit), untuk produksi semen. Magnesium oksida (caustic magnesite) digunakan sebagai pengikat, yang bila dicampur dengan larutan MgCl2, mampu dengan cepat mengeras dan mendapatkan kekuatan di udara.
- kekerasan air alami: definisi, jenis kekerasan, metode untuk menghilangkan kekerasan air: fisik, kimia (persamaan reaksi), fisika-kimia.
Air alami yang mengandung sejumlah besar kalsium atau garam magnesium dalam larutan disebut air keras sebagai lawan air lunak yang mengandung sedikit atau tidak ada garam kalsium dan magnesium.
Yang pertama adalah karena adanya kalsium dan magnesium bikarbonat, yang kedua dengan adanya garam asam kuat, sulfat atau klorida kalsium dan magnesium. Dengan perebusan air yang berkepanjangan dengan kekerasan karbonat, endapan muncul di dalamnya, terutama terdiri dari CaCO3, dan pada saat yang sama CO2 dilepaskan.
Kedua zat ini muncul sebagai akibat dari penguraian kalsium karbonat:
Oleh karena itu, kekakuan karbonat juga disebut kekakuan sementara. Secara kuantitatif, kekakuan sementara dicirikan dengan kandungan bikarbonat yang dikeluarkan dari air ketika direbus selama satu jam. Kekakuan yang tersisa setelah didih seperti itu disebut kekakuan konstan.
Kekerasan air dinyatakan oleh jumlah miliequivalents ion kalsium dan magnesium yang terkandung dalam air. Satu miliivalen dari kekakuan berhubungan dengan kandungan 20,04 mg / l atau 12,16 mg / l.
Kekerasan air alami sangat bervariasi. Ini berbeda di reservoir yang berbeda, dan di sungai yang sama bervariasi sepanjang tahun (minimal selama banjir). Kekerasan air laut jauh lebih tinggi dari sungai dan danau. Dengan demikian, air Laut Hitam memiliki total kekerasan 65,5 meq / l. Nilai rata-rata kekerasan air laut dunia adalah 130,5 meq / l (termasuk 22,5 meq / l per meq / l).
Kehadiran dalam air dari sejumlah besar kalsium atau garam magnesium membuat air tidak cocok untuk banyak keperluan teknis. Dengan demikian, dengan pemberian makan yang lama dari ketel uap dengan air yang keras, dinding mereka secara bertahap menjadi ditutupi dengan kerak nakiii yang padat. Kerak seperti itu sudah pada ketebalan lapisan sangat mengurangi transfer panas oleh dinding boiler dan, akibatnya, menyebabkan peningkatan konsumsi bahan bakar. Selain itu, dapat menyebabkan lepuh dan retak baik di pipa pemanas dan di dinding boiler itu sendiri.
Air keras tidak menghasilkan busa dengan sabun, karena garam natrium asam lemak yang larut - palmitat dan stearat - yang terkandung dalam sabun diubah menjadi garam kalsium tidak larut dari asam yang sama:
Air sadah tidak dapat digunakan saat melakukan beberapa proses teknologi, misalnya saat mewarnai.
Kekerasan air yang konstan disebabkan oleh adanya di dalamnya terutama dari sulfat dan klorida kalsium dan magnesium dan tidak dihilangkan dengan cara direbus. Jumlah dari kekerasan sementara (yang dapat dilepas) dan konstan adalah total kekerasan air.
Ada berbagai cara untuk menentukan kekakuan.
Pertimbangkan dua di antaranya:
1) penentuan kekakuan temporal menggunakan larutan asam klorida yang dititrasi
2) metode kompleksometri untuk menentukan kekakuan total.
Selama titrasi sampel air dengan asam hidroklorat dengan adanya metil jeruk, dekomposisi bikarbonat terjadi, menyebabkan kekakuan sementara:
Metode penentuan. 100 ml air uji diambil dalam labu berbentuk kerucut dengan pipet atau tabung pengukur, ditambahkan 2-3 tetes metil oranye dan dititrasi dengan 0,1 dan. Solusi HCl sampai warna oranye muncul.
Analisis hasil perhitungan. 1 ml 0,1 n. Solusi HCl sesuai dengan 0,1 / 1000 g-eq atau 0,1 mg-eq Ca 2+. V (HCl) sesuai dengan 0,1 V (HCl) / 1000 g-eq atau 0,1 V (HCl) mg-eq Ca 2+. 0,1 V (HCl) mEq dalam volume V A. Untuk menyatakan kekakuan dalam miligram-ekuivalen per 1 l air, Anda perlu membagi nilai yang ditemukan oleh V A dan mengalikannya dengan 1000, yaitu kekerasan air yang diteliti sama dengan:
![]()
Metode eliminasi.
Pelunakan termal. Berdasarkan air mendidih, sebagai akibat dari kalsium dan magnesium bikarbonat yang secara termal tidak stabil terurai dengan pembentukan skala:
Ca (HCO3) 2 → CaCO3 ↓ + CO2 + H2O.
Merebus hanya menghilangkan kekerasan sementara (karbonat). Menemukan aplikasi dalam hidup.
Pelunakan reagen. Metode ini didasarkan pada penambahan soda abu Na2CO3 atau kapur terhidrasi Ca (OH) 2 ke dalam air. Pada saat yang sama, garam kalsium dan magnesium masuk ke senyawa yang tidak larut dan, sebagai akibatnya, mengendap.
Misalnya, penambahan kapur terhidrasi menyebabkan konversi garam kalsium menjadi karbonat tidak larut:
Ca (HCO3) 2 + Ca (OH) 2 → 2CaCO3 ↓ + 2H2O
Reagen terbaik untuk menghilangkan kekerasan air secara keseluruhan adalah natrium ortofosfat Na3PO4, yang merupakan bagian dari sebagian besar produk rumah tangga dan industri:
3Ca (HCO3) 2 + 2Na3PO4 → Ca3 (PO4) 2 ↓ + 6NaHCO3
3MgSO4 + 2Na3PO4 → Mg3 (PO4) 2 ↓ + 3Na2SO4
Kalsium dan magnesium ortofosfat sangat buruk larut dalam air, dan karenanya mudah dipisahkan dengan penyaringan mekanis. Metode ini dibenarkan pada konsumsi air yang relatif tinggi, karena melibatkan penyelesaian sejumlah masalah khusus: penyaringan sedimen, dosis reagen yang akurat.
Kationisasi. Metode ini didasarkan pada penggunaan muatan granular penukar ion (paling sering resin penukar ion). Beban seperti itu pada kontak dengan air menyerap kation garam kekerasan (kalsium dan magnesium, zat besi dan mangan). Sebagai gantinya, tergantung pada bentuk ionik, itu memberikan ion natrium atau hidrogen. Metode ini masing-masing disebut kationisasi Na dan kationisasi H. Dengan pemuatan penukaran ion yang dipilih dengan benar, kekerasan air berkurang dengan kationisasi natrium satu tahap menjadi 0,05-0,1 ° W, dengan pemuatan dua tahap - hingga 0,01 ° W. Di industri, filter pertukaran ion menggantikan ion kalsium dan magnesium dengan ion natrium dan kalium, menghasilkan air lunak.
Reverse osmosis. Metode ini didasarkan pada saluran air melalui membran semipermeabel (biasanya poliamida). Bersama dengan garam kekerasan, sebagian besar garam lainnya dihilangkan. Efisiensi pembersihan dapat mencapai 99,9%.
Ada nanofiltrasi (diameter nominal lubang-lubang membran sama dengan satuan nanometer) dan picofiltrasi (diameter nominal lubang-lubang membran sama dengan unit-unit pikometer).
Karena kerugian dari metode ini harus diperhatikan:
Kebutuhan untuk pra-pengolahan air yang dipasok ke membran reverse osmosis;
Biaya 1 liter air yang relatif tinggi (peralatan mahal, membran mahal);
Mineralisasi rendah dari air yang diproduksi (terutama ketika picofiltration). Air menjadi hampir suling.
Elektrodialisis Ini didasarkan pada penghapusan garam dari air di bawah aksi medan listrik. Penghapusan ion zat terlarut terjadi karena membran khusus. Seperti halnya dengan penggunaan teknologi reverse osmosis, penghilangan garam lain, selain ion kekerasan, terjadi.
Air yang benar-benar bersih dari garam yang keras dapat disuling.
