Ոչ մետաղական օրինակների գենետիկական շարքը: Գենետիկական հարաբերություններ նյութերի դասերի միջեւ `Գիտելիքի հիպերմարկետ
Պարզ նյութերի, օքսիդների, բազաների, թթուների եւ աղերի միջեւ գոյություն ունի գենետիկ կապ, այսինքն նրանց փոխադարձ անցման (փոխակերպման) հնարավորությունը:
Օրինակ, պարզ նյութ `կալցիում, թթվածնի փոխազդեցության արդյունքում, վերածվում է օքսիդի: 2Ca + O 2 = 2CaO:
Ca (OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O. Կալցիումի օքսիդը կալցիումի հիդրոքսիդը CaO + H 2 O = Ca (OH) 2- ն է, իսկ վերջինս, երբ թթուով փոխազդեցության դեպքում վերածվում է աղ:
Այս վերափոխումները կարող են ներկայացվել սխեմայով.
Ca → CaO → Ca (OH) 2 → CaSO 4
Նմանատիպ սխեմա կարելի է գրել ոչ մետաղի համար, օրինակ `ծծմբ:
S → SO 3 → H 2 SO 4 → CaSO 4
Այսպիսով, նույն աղը ստացվում է տարբեր ձեւերով:
Հնարավոր է նաեւ աղի անցումը դեպի այլ անօրգանական միացությունների եւ պարզ նյութերի դասեր.
CuSO 4 → Cu (OH) 2 → CuO → Cu
CuSO 4 + 2NaOH = Cu (OH) 2 ↓ + Na 2 SO 4
Cu (OH) 2 = CuO + H 2 O
CuO + H 2 = Cu + H 2 O (պղնձի նվազեցում)
Անօրգանական միացությունների դասերի միջեւ նման հարաբերությունները, մեկ դասի նյութերի արտադրության հիման վրա, մյուսի նյութերից են, կոչվում են գենետիկ:
Բարդ բաղադրությունների հատկությունները արտացոլվում են անօրգանական միացությունների հիմնական դասերի գենետիկ սխեմայով (տես նկարը): Այն արտացոլում է անօրգանական նյութերի զարգացման փուլերը երկու հիմնական տողերում `տիպիկ մետաղներից մինչեւ տիպիկ ոչ մետաղներ` հակառակ հատկություններով:
Մետաղները, որոնց ատոմի քիմիական հատկությունները հանդիսանում են էլեկտրոնների նվիրաբերման ունակությունը, եւ ոչ մետաղները, որոնց հիմնական քիմիական հատկությունները հանդիսանում են իրենց ատոմների ունակությունները հատկությունների մեջ միմյանց հակադրելու էլեկտրոնները: Նյութերի կազմի բարդության հետ մեկտեղ, այդ հակառակ միտումները շարունակում են հայտնվել:
Տիպիկ մետաղները եւ անցումային տարրերը ամենացածր օքսիդացման վիճակում ձեւավորում են հիմնական օքսիդները, իսկ բարձր օքսիդացման դեպքում բնորոշ ոչ մետաղները եւ անցումային տարրերը ձեւավորում են հակառաթթուային օքսիդները:
Պարզ նյութեր
Ամփոթերական
Ոչ մետաղներ
Հիմնական օքսիդներ
Ամփոթերական
Acidic
Հիմք
Ամփոթերական
հիդրոքսիդներ
Անօրգանական միացությունների հիմնական դասերի գենետիկական սխեմա
Նյութերի կազմի հետագա բարդության արդյունքում ձեւավորվում են հիդրօքսիդներ, բազայինին համապատասխանող բազային օքսիդները եւ թթվային տոքսին օքսիդները: Հատկությունների եւ թթվային հակառակն այն հիմքերը, որոնք ակտիվորեն արձագանքում են միմյանց, ձեւավորելով աղեր: Հակադրությունների փոխազդեցությունը ռեակցիայի շարժիչ ուժն է: Հետեւաբար, հիմնական եւ թթվային օքսիդները, բազաները եւ թթուները ակտիվորեն համագործակցում են միմյանց հետ, եւ երկու acidic oxides կամ երկու հիմնական օքսիդները չեն փոխազդում, քանի որ դրանց հատկությունները մոտ են:
Այսպիսով, բարդ բաղադրության հատկությունները որոշվում են նրա բաղադրիչների տարրերի հիման վրա: Այդ հատկությունների փոփոխության հիմնական օրենքները ամփոփված են հետեւյալ հայտերում (Աղյուսակ 6):
1. Պարբերական թվի ավելացման ժամանակահատվածներում տարրերի հատկությունները փոխվում են մետաղից ոչ մետաղական: Արտաքին մակարդակով էլեկտրոնների քանակը ավելանում է, տարրերի օքսիդացման աստիճանը մեծանում է, ատոմի եւ իոնի շառավղը նվազում է, էլեկտրոնի իոնացման էներգիան եւ էլեկտրոնի մոտեցումը աճում է: Դրան համապատասխան, ավելանում են օքսիդների եւ հիդրոքսիդների հիմնական նվազումները եւ թթվային հատկությունները:
2. Հիմնական ենթախմբերում օքսիդների եւ հիդրօքսիդների հիմնական հատկությունները աճում են ատոմային քանակի աճով: Կողմերի խմբերի տարրերի քանակի ավելացման համար բնութագրվում է հատկությունների ավելի բարդ փոփոխություն: Նախ, մետաղական հատկությունները ուժեղանում են, հետո կրճատվում են:
3. Ակտիվ մետաղները համապատասխանում են օքսիդներին եւ հիդրօքսիդներին, որոնք հստակորեն արտահայտված հիմնական հատկություններ ունեն: Առավել ակտիվ մետաղները ալկալիական եւ ալկալային են: Դրանք ձեւավորում են ջրի լուծելի օքսիդներ եւ ուժեղ լուծվող բազաներ `ալկալիներ:
4. Ցածր ակտիվ մետաղները (բոլորը, սակայն ալկալային եւ ալկալային), ձեւավորում են թույլ հիմքեր, որոնք դժվար է լուծարել ջրի մեջ:
Cu (OH) 2, Fe (OH) 3:
5. Ակնթարթորեն արտահայտված acidic հատկություններով օքսիդները եւ հիդրոքսիդները համապատասխանում են ակտիվ ոչ մետաղներին:
6. Ամֆրատերային մետաղները ձեւավորում են ամֆոտերային օքսիդները եւ հիդրոքսիդները:
7. Եթե տարրը օքսիդացման տարբեր աստիճաններ է պարունակում, ապա տարբեր հատկություններով օքսիդները եւ հիդրօքսիդները համապատասխանում են այն:
Թեմա. Գենետիկ կապը մետաղների եւ ոչ մետաղների եւ դրանց միացությունների միջեւ: 9-րդ դասարան
Նպատակները `կրթական. Համախմբել« գենետիկ շարքը »,« գենետիկական կապ »հասկացությունը: սովորեցնել, թե ինչպես կատարել տարրերի գենետիկական շարքը (մետաղներ եւ ոչ մետաղներ), կազմելու գենետիկական շարքին համապատասխանող արձագանքման հավասարումներ, ստուգեք, թե ինչպես է իմացվում գիտելիքները քիմիական հատկություններ օքսիդներ, թթուներ, աղեր, հիմքեր, զարգացում. զարգացնել եզրակացությունները, վերլուծել, համեմատել, ամփոփել եւ եզրակացնել, քիմիական ռեակցիաների հավասարումներ: կրթական. նպաստել գիտական աշխարհայացքի ձեւավորմանը:
Դասավանդվող դասընթացներ. «Պարբերական համակարգ», «Լուծելիության աղյուսակ», «Մեթալների գործունեության սերիա», ուսանողներին տրված հրահանգներ, գիտելիքների փորձարկման խնդիրներ:
Առաջընթաց. 1) Օրգ. պահը
2) ստուգեք d / s- ը
3) ուսումնասիրեք նոր նյութ
4) ամրացում
5) D / C- ն
1) Օրգ. պահը: Ողջույններ
2) ստուգեք d / s- ը:
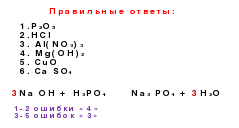
Գենետիկական կապերը տարբեր դասերի միջեւ կապերն են, որոնք հիմնված են իրենց փոխկապակցվածությունների վրա:
Անօրգանական նյութերի դասերը գիտակցելը հնարավոր է մետաղների եւ ոչ մետաղների գենետիկական շարքը կազմելու համար: Այս շարքի հիմքը նույն տարրն է:
Մետաղների մեջ կան երկու տեսակի տողեր.
1
. Գենետիկ շարքը, որի մեջ ալկալը հանդես է գալիս որպես հիմք: Այս շարքը կարելի է ներկայացնել հետեւյալ փոփոխությունների միջոցով.մետաղական → հիմնական օքսիդ → ալկալի → աղ
Օրինակ, K → K
2 O → KOH → KCl2
. Գենետիկ շարքը, որտեղ բազան անլուծելի հիմք է, ապա շարքը կարող է ներկայացվել որպես վերափոխումների շղթա.մետաղական → բազային օքսիդ → աղ → անլուծելի հիմք →
→հիմնական օքսիդ → մետաղ
Օրինակ, Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu
1
. Ոչ մետաղների գենետիկական շարքը, որտեղ լուծվող թթունն ազդում է սերիայի կապակցությամբ: Փոխակերպումների շղթան կարող է ներկայացվել հետեւյալ կերպ.ոչ մետաղական → թթվային օքսիդ → լուծվող թթու → աղ
Օրինակ, P → P
2 O 5 → H 3 PO 4 → Na 3 PO 42
. Ոչ մետաղների գենետիկական շարքը, որտեղ լուծելի թթունն ազդում է սերիայի մեջ.ոչ մետաղական → թթվային օքսիդ → աղ → թթու →
→թթու օքսիդ → ոչ մետաղական
Օրինակ
Si→ Սիո 2 → Na 2 Սիո 3 → Հ 2 Սիո 3 → Սիո 2 → Si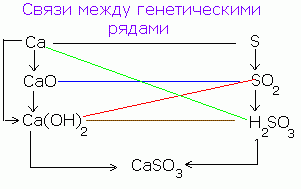
Ֆրոնտալ զրույցը:
Ինչպիսին է գենետիկ կապը Գենետիկական կապերը տարբեր դասերի միջեւ կապերն են, որոնք հիմնված են իրենց փոխկապակցվածությունների վրա: Ինչ է գենային շարքը:
Գենետիկական շարքը `մի շարք նյութեր` տարբեր դասերի ներկայացուցիչներ, որոնք մի քիմիական տարրերի միացություններ են, որոնք կապված են փոխկապակցման հետ եւ արտացոլում են այդ նյութերի վերափոխումները: Այս շարքի հիմքը նույն տարրն է:
Ինչ տեսակի գենետիկական շարքեր կարելի է առանձնացնել: Մետաղների շարքում կարելի է առանձնացնել երկու տեսակի շարքը.
ա) Գենետիկական շարքը, որի մեջ ալկալը հանդես է գալիս որպես հիմք: Այս շարքը կարելի է ներկայացնել հետեւյալ փոփոխությունների միջոցով.
մետաղական → հիմնական օքսիդ → ալկալի → աղ
օրինակ, կալիումի K → K գենետիկ շարքը
2 O → KOH → KClբ) գենային շարքը, որտեղ բազան անլուծելի հիմք է, ապա սերիան կարող է ներկայացվել որպես վերափոխումների շղթա.
մետաղական → բազային օքսիդ → աղ → անլուծելի բազա → բազային օքսիդ → մետաղ
օրինակ `Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → CuՈչ մետաղների թվում կարելի է տարբերակել երկու տիպի տողեր.
ա) Ոչ մետաղների գենետիկական շարքը, որտեղ լուծվող թթուները հանդես են գալիս սերիայի հղում: Փոխակերպումների շղթան կարող է ներկայացվել հետեւյալ կերպ. Ոչ մետաղական → թթվային օքսիդ → լուծվող թթու → աղ:
Օրինակ `P → P
2 O 5 → H 3 PO 4 → Na 3 PO 4բ) ոչ մետաղների գենետիկական շարքը, որտեղ չլուծվող թթու: ոչ մետաղական → թթվային օքսիդ → աղ → թթու → թթվային օքսիդ → ոչ մետաղական գործառույթներ, որպես կապ
Օրինակ `Si → SiO
2 → Na 2 Սիո 3 → H 2 Սիո 3 → SiO 2 → SiԸնտրանքների ընտրանքների կատարում.
1. Ընտրեք ձեր տարբերակով օքսիդի բանաձեւերը, բացեք ձեր ընտրությունը, հիմնված միացությունների այս դասի կազմի բնութագրերի իմացության վրա: Զանգահարեք նրանց:
2. Ձեր տարբերակի բանաձեւի սյունակում գտնել թթվային բանաձեւերը եւ բացատրել ձեր ընտրությունը `հիմնվելով այդ միացությունների կազմի վերլուծության վրա:
3. Որոշեք թթվային կազմի մեջ թթվային մնացորդների արժեքները:
4. Ընտրեք աղի բանաձեւեր եւ անվանեք դրանք:
5. Դարձնել աղերի բանաձեւերը, որոնք կարող են ձեւավորվել ձեր տարբերակի մագնեզիումի եւ թթուների հետ: Գրեք դրանք, անվանեք այն:
6. Ձեր տատանումների բանաձեւի սյունակում գտնել բազային բանաձեւերը եւ բացատրել ձեր ընտրությունը `հիմնվելով այդ միացությունների կազմի վերլուծության վրա:
7. Ձեր տարբերակով ընտրեք նյութերի բանաձեւերը, որոնց հետ կարող են արձագանքել orthophosphoric acid (hydrochloric, sulfuric) լուծումը: Կատարեք համապատասխան արձագանքման հավասարումներ:
9. Ձեր տարբերակի բանաձեւերի մեջ ընտրեք նյութերի բանաձեւեր, որոնք կարող են փոխազդել միմյանց հետ: Կատարեք համապատասխան արձագանքման հավասարումներ:
10. Անօրգանական միացությունների գենետիկական կապերի շղթա ստեղծեք, որը ներառում է մի նյութ, որի բանաձեւը տրվում է ձեր տարբերակով:
Տարբերակ 1
Ընտրանք 2
Cao
Hno
3Fe (OH)
3Ն
2 OZn (NO
3 ) 2Cr (OH)
3Հ
2 SO 3Հ
2 ՍPbo
LiOH- ը
Ագ
3 PO 4Պ
2 O 5NaOH- ը
Zno
CO
2BaCl
2HCl
Հ
2 CO 3Հ
2 SO 4Կուսո
4Այս նյութերից գենետիկ գիծ է ստեղծում, օգտագործելով բոլոր բանաձեւերը: Գրեք արձագանքման հավասարումների հետ, որոնցով կարող եք իրականացնել այդ փոփոխությունների շղթան.
Ես ընտրում եմ `ZnSO
4, Zn, ZnO, Zn, Zn (OH) 2 : II տարբերակը `Na 2 SO 4, NaOH- ը, Na, Na 2 O 2 , Na 2 O4) ամրացում 1.
Ալ→ Ալ 2 O 3 → Ալկլ 3 → Ալ( ՕՀ) 3 → Ալ 2 O 32.
Պ→ Պ 2 O 5 → Հ 3 PO 4 → Na 3 PO 4 → Ca 3 ( PO 4 ) 23. Zn → ZnCl
2 → Zn (OH) 2 → ZnO → Zn (NO 3 ) 24. Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu5. Ն
2 O 5 → HNO 3 → Fe (NO 3 ) 2 → Fe (OH) 2 → FeS → FeSO 45) տնային աշխատանքներ.
նկարագրում է կալցիումի կալցիումի կարբոնատից աստիճանական անցումը եւ բժշկության մեջ ցանկացած աղի օգտագործման մասին զեկույց պատրաստելը (լրացուցիչ գրականություն օգտագործելով):

Մետաղների շարքում կարելի է առանձնացնել երկու տիպի տողեր. 1. Գենետիկական շարքը, որի մեջ ալկալը հանդես է գալիս որպես հիմք: Այս շարքը կարող է ներկայացվել հետեւյալ փոփոխությունների միջոցով. Մետաղ - հիմնական օքսիդ - ալկալային - աղ, օրինակ, K - K 2 O - KOH - KCl կալիումի գենետիկական շարքը:

2. Գենետիկական շարքը, որտեղ առանց լուծվող բազան հանդես է գալիս որպես հիմք, ապա շարքը կարող է ներկայացվել որպես վերափոխումների շղթա. Մետաղ - հիմնական օքսիդ - աղ - չլուծվող բազա `հիմնական օքսիդ - մետաղ: Cu- CuO- CuCl2 - Cu (OH) 2 - CuO -\u003e Cu գենետիկ շարքը պղնձի 2. Գենետիկ շարքը, որտեղ բազան անլուծելի հիմք է, ապա սերիան կարող է ներկայացվել փոխակերպումների շղթայով. Մետաղական հիմնական օքսիդ - աղ - չլուծվող բազա - հիմնական օքսիդը մետաղ է, Cu- CuO- CuCl2-Cu (OH) 2-CuO-\u003e"> title="2. Գենետիկական շարքը, որտեղ առանց լուծվող բազան հանդես է գալիս որպես հիմք, ապա շարքը կարող է ներկայացվել որպես վերափոխումների շղթա. Մետաղ - հիմնական օքսիդ - աղ - չլուծվող բազա `հիմնական օքսիդ - մետաղ: Cu-CuO- CuCl2-Cu (OH) 2-CuO-\u003e"> !}
Ոչ մետաղների շարքում հնարավոր է նաեւ տարբերակել երկու տիպի տողեր. 1. Ոչ մետաղների գենետիկական շարքը, որտեղ լուծվող թթունն ազդում է սերիայի մեջ: Փոխակերպումների շղթան կարող է ներկայացվել հետեւյալ կերպ. Ոչ մետաղական - թթվային օքսիդ `լուծվող թթու - սոլ. P - P 2 O 5 - H 3 PO 4 - Na 3 PO 4. Ֆոսֆորի գենետիկական շրջանակը

Անօրգանական միացությունների դասերի միջեւ գոյություն ունի գենետիկ կապ: Պարզ նյութերից դուք կարող եք բարդ եւ հակառակը: Մեկ դասի միացություններից, դուք կարող եք ստանալ մեկ այլ դասի միացություններ:
Անօրգանական միացությունների դասերի միջեւ պարզեցված գենետիկական հարաբերությունները կարող են ներկայացվել հետեւյալ սխեմայով.
Ոչ մետաղների նման վերափոխումների հերթականությունը կարող է ներկայացվել հետեւյալ սխեմայով. CANPO 4
Р → Р 2 О 5 → Н 3 РО 4 → Са 3 (РО 4) 2
(Saon) 3 PO 4
Տիպիկ մետաղների համար դուք կարող եք կատարել հետեւյալ վերափոխումների շղթան.
Ba → BaO → Ba (OH) 2 → BaSO 4
Մետաղների համար, որոնց օքսիդները եւ հիդրօքսիդները ամֆոտեռիկ (կիսամյակային) են, կարող են իրականացվել հետեւյալ փոփոխությունները.
Al → Al 2 O 3 → Al (OH) 3 → Na → AlCl 3 → AlOHCl 2 → Al (OH) 3 → Al 2 O 3:
Հղումներ դասերի միջեւ.
1. Մետաղներ, ոչ մետաղներ→ աղ:
Մետաղների եւ ոչ մետաղների անմիջական փոխազդեցության արդյունքում ձեւավորվում են թթվածնով ազատ թթուների (halides, sulfides) աղեր.
2Na + C1 2 = 2NaCl
Այս միացությունները կայուն են եւ չեն ջերմացվում:
2. Հիմնական օքսիդները, թթվային օքսիդները→ աղ:
CaO + CO 2 = CaCO 3;
Na 2 O + SO 3 = Na 2 SO 4:
3. Հիմք, թթուներ→ աղ:
Այն իրականացվում է չեզոքացման ռեակցիայի միջոցով.
2NaOH + H 2 SO 4 = Na 2 SO 4 + 2H 2 O,
HE - + H + → H 2 O;
Mg (OH) 2 + 2HC1 = MgCl 2 + 2H 2 O,
Mg (OH) 2 + 2H + → Mg 2+ + 2H 2 O.
4. Մետաղներ→ հիմնական օքսիդներ:
Մետաղների մեծ մասը փոխազդում է թթվածինով `օքսիդներ ձեւավորելու համար.
2Ca + O 2 = 2CaO;
4A1 + 3O 2 = 2A1 2 O 3:
Ոսկին, արծաթը, պլատինը եւ այլ ազնիվ մետաղները չեն համագործակցում թթվածնի հետ, նման մետաղների օքսիդները անուղղակիորեն են ձեռք բերվում:
5. Ոչ մետաղներ→ թթվային օքսիդներ:
Ոչ մետաղներ (բացառությամբ հալոգենների եւ ազնիվ գազերի), համագործակցում են թթվածինով, կազմելով օքսիդներ.
4P + 5O 2 = 2P 2 O 5;
S + O 2 = SO 2:
6. Հիմնական օքսիդներ→ հիմքեր:
Ջրի հետ ուղղակի փոխազդեցությունը կարելի է ձեռք բերել միայն ալկալիների եւ ալկալային հողային մետաղների հիդրոքսիդներ (ալկալի).
Na 2 O + H 2 O = 2NaOH;
CaO + H 2 O = Ca (OH) 2:
Մնացած հիմքերը ձեռք են բերվում անուղղակի:
7. Թթվային օքսիդներ→ թթու:
Թթվային օքսիդները արձագանքում են ջրի հետ `համապատասխան թթուներ ձեւավորելու համար.
SO 3 + H 2 O = H 2 SO 4;
Р 2 O 5 + 3H 2 O = 2H 3 PO 4.
Բացառություն է կազմում SiO 2, որը չի արձագանքում ջրի հետ:
8. Հիմքերը, թթվային օքսիդներ→ աղ:
Ալկալիները համագործակցում են թթվային օքսիդներով `աղեր կազմելու համար.
2NaOH + SO 3 = Na 2 SO 4 + H 2 O,
2OH - + SO 3 = SO 4 2- + H 2 O;
Ca (OH) 2 + СO 2 = CaCO 3 ↓ + Н 2 O,
Ca 2+ + 2OH - + CO 2 → CaCO 3 ↓ + H 2 O.
9. Թթվածներ, հիմնական օքսիդներ→ աղ:
Մետաղական օքսիդները լուծվում են թթուներով `կազմելով աղեր.
CuO + H 2 SO 4 = CuSO 4 + H 2 O,
CuO + 2H + = Cu 2+ + H 2 O;
Na 2 O + 2HS1 = 2NaCl + H 2 O,
Na 2 O + 2H + = 2Na + + H 2 O.
10. Հիմք→ հիմնական օքսիդներ:
Լուծվող չլուծվող հիմքերը եւ LiOH ջերմաստիճանը ջերմացվում են.
2LiOH = Li 2 O + H 2 O;
Cu (OH) 2 = CuO + H 2 O.
11. Թթուներ→ թթվային օքսիդներ:
Անկայուն թթվածին պարունակող թթուները քայքայում են (H 2 SiO 3) եւ նույնիսկ առանց ջեռուցման (H 2 CO 3, HClO): Միեւնույն ժամանակ, մի շարք թթուներ ջերմության նկատմամբ հագեցած են (H 2 SO 4, H 3 PO 4):
H 2 SiO 3 = H 2 O + SiO 2;
H 2 CO 3 = H 2 O + CO 2:
12. Մետաղական օքսիդներ→ մետաղներ:
Որոշ ծանր մետաղական օքսիդներ կարող են քայքայվել մետաղի եւ թթվածնի.
2HgO = 2Hg + O 2:
Բացի այդ, մետաղները համապատասխան օքսիդներից ստացվում են նվազեցնող նյութերի օգնությամբ.
3MnO 2 + 4Al = 3Mn + 2Al 2 O 3;
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O.
13. Թթվային օքսիդներ→ ոչ մետաղներ
Ոչ մետաղական օքսիդների մեծ մասը չի ջերմացվում: Ոչ մետաղական եւ թթվածին բաժանվում են միայն մի քանի անկայուն օքսիդներ (հալոին օքսիդներ):
Որոշ ոչ մետաղներ ստացվում են համապատասխան օքսիդներից նվազեցմամբ.
SiO 2 + 2Mg = 2MgO + Si:
14. Աղեր, հիմքեր → հիմքեր:
Անլուծելի հիմքերը ստացվում են համապատասխան թթուների լուծույթներում ալկալների գործողությամբ.
CuSO 4 + 2NaOH = Cu (OH) 2 ↓ + Na 2 SO 4,
Cu 2+ + 2OH - → Cu (OH) 2 ↓;
FeCl 2 + 2KOH = Fe (OH) 2 ↓ + 2KCl,
Fe 2+ + 2OH - = Fe (OH) 2 ↓:
15. Աղեր, թթուներ եւ թթուներ:
Լուծվող աղերը արձագանքում են թթուներով (ըստ ճնշման սերիայի), եթե արդյունքը թուլություն է կամ թթու:
Na 2 SiO 3 + 2HCl = 2NaCl + H 2 SiO 3 ↓,
SiO 3 2- + 2H + → H 2 SiO 3 ↓;
NaCl (s) + H 2 SO 4 (k) = NaHSO 4 + HCl:
16. Աղեր→ հիմնական օքսիդներ, թթվային օքսիդներ:
Որոշ թթվածնի պարունակող թթուների (նիտրատների, կարբոնատների) աղերը տարրալուծվում են, երբ ջեռուցվում են.
CaCO 3 = CaO + CO 2;
2Cu (NO 3) 2 = 2CuO + 4NO 2 + O 2:
ԱՆԿԱԽ ԱՇԽԱՏԱՆՔՆԵՐԻ ԶՈՐԱՎԱՐԺՈՒԹՅՈՒՆՆԵՐԸ «ԳՆԱՀԱՏԱԿԱՆՆԵՐԻ ՄԻՋԱԶԳԱՅԻՆ ՀԻՄՈՒՆՔՆԵՐԻ ԴԱՍԱԿԱՐԳԵՐԻ ՄԻՋԵՎ» թեմայով թեմայով
1. Անունը հետեւյալ նյութերը, առանձնացնել նրանց մեջ դասերի անօրգանական միացությունների `ԱԺ 3 PO 4, Հ 2 SiO 3, NO, B 2 O 3, mgs, Bai 2 Ca (OH) 2, որտե 3, HNO 2, Cl 2 O 7, Fe (OH) 2, P 2 O 5, HF, MnO 2:
2. ցանկացած է հետեւյալ նյութերի, կարող է լինել մեկ քայլ է ձեռք բերել հիդրօքսիդի (acid կամ բազան) պղնձի երկաթի օքսիդ (II), barium օքսիդ, ազոտի օքսիդ (P) ազոտի օքսիդ (V) Սիլիկոնային օքսիդ, պղնձի sulfate, կալիում քլորիդ , կալիում, մագնեզիումի կարբոնատ:
3. Վերոնշյալ ցուցակից գրեք հետեւյալ նյութերի բանաձեւերը, որոնք վերաբերում են, 1) օքսիդներին. 2) հիմքեր. 3) թթուներ; 4) աղեր.
CO 2, NaOH, HCl, SO 3, CuSO 4, nano 3, KCI, H 2 SO 4, Ca (OH) 2, P 2 O 5, HNO 3, Al (OH) 3.
4. Անունը նյութ: Zn (OH) 2, MgO, P 2 O 3, NaHCO 3, H 3 PO 3 Fe 2 (SO 4) 3, KOH, (Alon) 3 (PO4) 2, Ba (MnO 4 ) 2, CO, HI: Նշեք, թե որ դասը պատկանում է յուրաքանչյուր նյութ:
5. Գրեք հետեւյալ նյութերի մոլեկուլային բանաձեւերը եւ նշեք, թե յուրաքանչյուր դասի ինչ դաս է պատկանում.
1) պղնձի (II) հիդրօքսոկարբոնատ;
2) ազոտի օքսիդ (V);
3) նիկել (II) հիդրոքսիդը.
4) բարիում ջրածնի ֆոսֆատ;
5) փխրուն թթու;
6) քրոմ (III) հիդրոօքսիդ;
7) կալիումի քլորիդ;
8) ջրածնի սուլֆիդաթթու;
9) նատրիումի ցինկատ:
6. Ներկայացրեք կապի վերաբերյալ ռեակցիաների օրինակներ.
1) պարզ նյութեր, ոչ մետաղներ;
2) պարզ նյութ եւ օքսիդ;
3) օքսիդներ.
4) բարդ նյութեր, որոնք օքսիդ չեն.
5) մետաղական եւ ոչ մետաղական;
6) երեք նյութ:
7. Հետեւյալ նյութերից որն է արձագանքել.
1) ածխածնի երկօքսիդ (IV). HCl, O 2, NO 2, KOH, H 2 O;
2) մագնեզիումի օքսիդ `Բա (OH) 2, HCl, CO 2, O 2, HNO 3;
3) երկաթ (II) հիդրոքսիդը `KCl, HCl, KOH, O 2, H 2 O, HNO 3;
4) ջրածնի քլորիդ `Zn, MgO, ZnCl 2, HNO 3, Ca (OH) 2, Cu, (ZnOH) Cl:
8. Հնարավոր է հետեւյալ նյութերի միջեւ փոխազդեցությունը:
1) ածխածնի երկօքսիդ (IV) եւ կալիումի հիդրոօքսիդ;
2) կալիումի հիդրոուլֆատ եւ կալցիումի հիդրոքսիդ;
3) կալցիումի ֆոսֆատ եւ ծծմբաթթու;
4) կալցիումի հիդրոքսիդ եւ ծծմբի օքսիդ (IV);
5) ծծմբաթթու եւ կալիումի հիդրոքսիդ;
6) կալցիումի բիկարբոնատ եւ ֆոսֆորական թթու;
7) silica եւ ծծմբաթթու;
8) ցինկի օքսիդ եւ ֆոսֆորային օքսիդ (V):
Գրեք հնարավոր ռեակցիաներին հավասարումներ, նշեք այն պայմանները, որոնք տեղի են ունենում: Եթե ռեակցիաները կարող են հանգեցնել տարբեր նյութերի, ապա նշեք, թե ինչ տարբերություն դրանց իրականացման պայմաններում:
9. Ստացեք հետեւյալ նյութերի ստացման ռեակցիաների հավասարումները `նատրիումի orthophosphate (4 ուղի), կալիումի սուլֆատ (7 ուղի), ցինկի հիդրոքսիդ:
10. Սոդա (նատրիումի կարբոնատ) արտադրելու մեթոդներից մեկը ջրի եւ ածխածնի երկօքսիդի (IV) ածխաթթու գազի ալյումինատի վրա գործողությունն է: Կատարեք ռեակցիայի հավասարումներ:
11. Այն փոխում է գործակիցները, գրեք ռեակցիային արտադրանքները.
1) MgO + 2H 2 SO 4 →
2) 2SO 2 + Ba (OH) 2 →
3) 3N 2 O 5 + 2Al (OH) 3 →
4) P 2 O 5 + 4NaOH →
5) P 2 O 5 + 6NaOH →
6) P 2 O 5 + 2NaOH →
12. Կատարել տարբեր տեսակի աղեր ստանալու համար ռեակցիաների հավասարումներ.
1) SO 2 + Ba (OH) 2 → (միջին եւ թթվային աղեր),
2) A1 2 O 3 + H 2 O + HNO 3 → (միջին աղ, հիմնական աղեր),
3) Na 2 O + H 2 S → (միջին եւ թթվային աղեր),
4) SO 3 + Sa (OH) 2 → (միջին եւ հիմնական աղեր),
5) CaO + H 2 O + P 2 O 5 → (հիմնական աղ, թթվային աղեր):
13. Լրացրեք ռեակցիաների հավասարումները.
CaO + A1 2 O 3 → CaHPO 4 + Ca (OH) 2 →
Cr 2 O 3 + H 2 SO 4 → AlOHSO 4 + NaOH →
Cr 2 O 3 + NaOH → CaCO 3 + CO 2 + H 2 O →
A1 2 O 3 + HClO 4 → Ca (HCO 3) 2 + HCl →
Mn 2 O 7 + KOH → ZnS + H 2 S →
NO 2 + Ca (OH) 2 → CaSO 4 + H 2 SO 4 →
Zn (OH) 2 + NaOH → (ZnOH) Cl + HCl →
Zn (OH) 2 + HNO 3 → Bi (OH) 3 + H 2 SO 4 (բավարար չէ) →
AlCl 3 + NaOH (բացակայում) → (FeOH) Cl + NaHS →
AlCl 3 + NaOH → Na 2 ZnO 2 + H 2 SO 4 (ավելցուկ) →
AlC1 3 + NaOH (ավելցուկային) → Ca (AlO 2) 2 + HCl (ավելցուկ) →
14. Գրեք այն արձագանքման հավասարումները, որոնց հետ դուք կարող եք իրականացնել հետեւյալ փոփոխությունները.
1) Cu → CuO → CuSO 4 → Cu (OH) 2 → CuC1 2 → Cu (NO 3) 2
2) Zn → ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → ZnCl 2
3) Р → Р 2 О 5 → Н 3 РО 4 → К 3 РО 4 → Са 3 (РО 4) 2 → Н 3 РО 4
4) Mg → MgO → MgCl 2 → Mg (OH) 2 → Mg (HSO 4) 2 → MgSO 4
5) Ca → CaO → Ca (OH) 2 → CaCO 3 → Ca (HCO 3) 2 → CO 2
6) Cr\u003e Cr 2 (SO 4) 3 → Cr (OH) 3 → NaСrO 2 → Cr 2 O 3 → K
7) P → P 2 O 5 → HPO 3 → H 3 PO 4 → NaH 2 PO 4 → Na 3 PO 4
8) CuS → CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
9) Al → Al 2 O 3 → Al 2 (SO 4) 3 → Al (HSO 4) 3 → Al (OH) 3 → K
10) S → SO 2 → SO 3 → NaHSO 4 → Na 2 SO 4 → BaSO 4
11) Zn → ZnO → ZnCl 2 → Zn → Na 2
12) Zn → ZnSO 4 → ZnCl 2 → Zn (OH) 2 → Na 2 → Zn (NO 3) 2
13) Ca → CaCl 2 → CaCO 3 → Ca (HCO 3) 2 → Ca (NO 3) 2
14) Ca → Ca (OH) 2 → CaCO 3 → CaCl 2 → CaCO 3 → Ca (NO 3) 2
15) CuO → CuCl 2 → Cu (NO 3) 2 → CuO → CuSO 4 → Cu
16) CaO → Ca (OH) 2 → Ca (NO 3) 2 → Ca (NO 2) 2 → HNO 2 → NaNO 2
17) MgO → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
18) SO 2 → H 2 SO 3 → KHSO 3 → K 2 SO 3 → KHSO 3 → SO 2
19) P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2 → Ca (H 2 PO 4) 2 → CaHPO 4
20) CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
21) PbO → Pb (NO 3) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbCl 2
22) ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2 → K 2
23) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → Al (OH) 3 → K
24) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → Zn → ZnO → Zn (NO 3) 2
25) AlCl 3 → Al (NO 3) 3 → Al (OH) 3 → NaAlO 2 → A1C1 3 → Al
26) Pb (NO 3) 2 → Pb (OH) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbSO 4
27) Fe 2 (SO 4) 3 → FeCl 3 → Fe (OH) 3 → FeOH (NO 3) 2 → Fe (NO 3) 3 → Fe 2 O 3
28) K → KOH → KHSO 4 → K 2 SO 4 → KCl → ՔՆՈ 3
29) Cu (OH) 2 → CuOHNO 3 → Cu (NO 3) 2 → CuSO 4 → CuCl 2 → Cu (NO 3) 2
30) CaCl 2 → Ca → Ca (OH) 2 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
31) Cu → Cu (NO 3) 2 → Cu (OH) 2 → CuSO 4 → Al 2 (SO 4) 3 → A1C1 3
32) Mg → MgSO 4 → MgCl 2 → MgOHCl → Mg (OH) 2 → MgOHNO 3
33) CuSO 4 → CuCl 2 → ZnCl 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2
34) Hg (NO 3) 2 → Al (NO 3) 3 → Al 2 O 3 → NaAlO 2 → Al (OH) 3 → AlOHCl 2
35) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → AlCl 3 → Al (OH) 3 → A1 2 O 3
36) CuCl 2 → Cu (OH) 2 → CuSO 4 → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2
37) Fe (NO 3) 3 → FeOH (NO 3) 2 → Fe (OH) 3 → FeCl 3 → Fe (NO 3) 3 → Fe
38) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → NaNO 3 → HNO 3
39) Mg (OH) 2 → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
40) ալյումինե սուլֆատ → ալյումինե քլորիդ → ալյումինե նիտրատ → ալյումինե օքսիդ → կալիումի ալյումինատ → ալյումինե հիդրոօքսիդ → ալյումինե հիդրօքսիդ → ալյումինե քլորիդ:
41) Na → NaOH → Na 3 PO 4 → NaNO 3 → HNO 3 → N 2 O 5
42) BaCO 3 → Ba (HCO 3) 2 → BaCO 3 → (BaOH) 2 CO 3 → BaO → BaSO 4
43) Cu → CuSO 4 → (CuOH) 2 SO 4 → Cu (OH) 2 → Cu (HSO 4) 2 → CuSO 4
44) բարիում → բարիում հիդրօքսիդ → բարիում բիկարբոնատ → բարիում քլորիդ → բարիում կարբոնատ → բարիում քլորիդ → բարիում հիդրօքսիդ
45) P → P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → CaHPO 4 → Ca 3 (PO 4) 2
46) Cr → CrO → Cr 2 O 3 → NaCrO 2 → CrCl 3 → Cr (OH) 3 → Cr 2 O 3 → Cr
47) Cr 2 O 3 → CrCl 3 → Cr (OH) 3 → Na 3 → Cr 2 (SO 4) 3 → CrCl 3
48) K → KOH → KCl → KOH → K 2 SO 4 → ԿՆՈ 3 → ԿՆՈ 2
49) S → FeS → H 2 S → SO 2 → S → ZnS → ZnO → ZnCl 2 → Zn (OH) 2 → K 2
50) C → CO 2 → CO → CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2
51) С → CO 2 → NaHCO 3 → Na 2 CO 3 → CO 2
52) S → SO 2 → K 2 SO 3 → KHSO 3 → K 2 SO 3
53) Cu → Cu (OH) 2 → Cu (NO 3) 2 → CuO → Cu
54) Ռ 2 Օ 5 → Հ 3 ՊՈ 4 → CaHPO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2
55) Fe → FeCl 2 → Fe (OH) 2 → FeSO 4 → Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (NO 3) 2 → ZnO
57) CuS → SO 2 → KHSO 3 → CaSO 3 → SO 2
58) SO 2 → H 2 SO 4 → CuSO 4 → CuO → Cu (NO 3) 2
59) KHSO 3 → CaSO 3 → Ca (HSO 3) 2 → SO 2 → K 2 SO 4
60) SO 2 → CaSO 3 → SO 2 → NaHSO 3 → SO 2
61) NaHCO 3 → Na 2 CO 3 → NaCl → NaHSO 4 → Na 2 SO 4
62) K → KOH → KCl → KNO 3 → K 2 SO 4 → KCl
63) NaCl → Na → NaOH → Na 2 SO 4 → NaCl
64) Al → AlCl 3 → Al (OH) 3 → A1 2 O 3 → Al (OH) 3
65) CuO → Cu → CuCl 2 → CuSO 4 → CuS
66) Fe → FeSO 4 → Fe (OH) 2 → Fe → Fe (OH) 3
67) Fe → Fe (OH) 2 → FeCl 2 → Fe (NO 3) 2 → Fe
68) Fe (NO 3) 3 → Fe 2 O 3 → FeCl 3 → Fe (NO 3) 3 → Fe
69) CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
70) MgCO 3 → MgO → MgCl 2 → Mg (OH) 2 → Mg (NO 3) 2
71) Mg → Mg (OH) 2 → MgSO 4 → MgCO 3 → Mg (HCO 3) 2
72) CaO → Ca (OH) 2 → CaCl 2 → CaCO 3 → CO 2
73) CaCO 3 → Ca (HCO 3) 2 → CaCl 2 → Ca (NO 3) 2 → O 2
74) FeS → Fe 2 O 3 → Fe (OH) 3 → Fe 2 (SO 4) 3 → FeCl 3
75) KS1 → K 2 SO 4 → KOH → K 2 CO 3 → KOH
76) CuS → CuO → Cu (OH) 2 → CuSO 4 → Cu
77) Fe → Fe (OH) 3 → Fe (NO 3) 3 → FeCl 3 → Fe 2 (SO 4) 3
78) CuSO 4 → CuO → Cu (NO 3) 2 → CuO → CuS
79) ZnS → H 2 S → SO 2 → Na 2 SO 4 → NaOH
80) Al → Al (OH) 3 → A1 2 (SO 4) 3 → A1 2 O 3 → Al (OH) 3
81) CaCl 2 → CaCO 3 → Ca (HCO 3) 2 → CaCO 3 → CaSiO 3
82) S → ZnS → H 2 S → Ca (HSO 3) 2 → SO 2
83) Na 2 SO 4 → NaCl → HCl → CaCl 2 → Ca (NO 3) 2
84) Na 2 SO 3 → SO 2 → H 2 SO 4 → HCl → FeCl 2
85) С 2 Na 2 CO 3 → CaCO 3 → CaSiO 3 → H 2 SiO 3
86) P → P 2 O 5 → Ca (H 2 PO 4) 2 → CaHPO 4 → H 3 PO 4
87) Al → A1 2 O 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
88) HCl → CuCl 2 → Cl 2 → HCl → H 2
89) P 2 O 5 → Na 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4
90) NH 3 → NH 4 C1 → NH 3 ∙ H 2 O → NH 4 HCO 3 → NH 3
91) NH 4 C1 → KC1 → HCl → CuCl 2 → Cu (OH) 2
92) NH 3 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → NH 3 → NH 4 NO 3
93) KOH → KHCO 3 → K 2 CO 3 → CO 2 → Ca (HCO 3) 2
94) Na → NaOH → NaHCO 3 → Na 2 SO 4 → NaOH
95) KNO 3 → K 2 SO 4 → KC1 → KNO 3 → ԿՆՈ 2
96) Cl 2 → KC1 → K 2 SO 4 → ԿՆՈ 3 → KHSO 4
97) FeSO 4 → FeS → SO 2 → KHSO 3 → K 2 SO 4
98) KOH → Cu (OH) 2 → CuSO 4 → Cu (OH) 2 → Cu
99) Fe 2 O 3 → FeCl 3 → Fe (OH) 3 → Fe (NO 3) 3 → Fe 2 O 3
100) Al → A1 2 O 3 → A1 (NO 3) 3 → A1 2 O 3 → Al (OH) 3
101) CaO → CaCO 3 → CaSiO 3 → Ca (NO 3) 2 → O 2
102) Cu → Cu (OH) 2 → Cu → CuSO 4 → CuCl 2
103) H 2 S → SO 2 → ZnSO 4 → ZnS → ZnO
104) Cl 2 → NaCl → HCl → CuCl 2 → CuO
105) Cl 2 → FeCl 3 → Fe 2 O 3 → Fe (OH) 3 → Fe (NO 3) 3
106) P 2 O 5 → Ca 3 (PO 4) 2 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2
107) ZnS → ZnO → Zn → ZnCl 2 → Zn (NO 3) 2
108) ZnO → ZnSO 4 → Zn (NO 3) 2 → ZnO → Zn (OH) 2
109) H 3 PO 4 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2
110) CaCO 3 → Na 2 CO 3 → Na 3 PO 4 → NaH 2 PO 4 → Ca 3 (PO 4) 2
111) CaCl 2 → CaSO 3 → Ca (OH) 2 → CaCl 2 → Ca (NO 3) 2
112) NaOH → Na 2 CO 3 → NaHSO 4 → NaNO 3 → NaHSO 4
113) Na 2 SiO 3 → Na 2 CO 3 → Na 2 SO 4 → NaCl → Na 2 SO 4
114) KNO 3 → KHSO 4 → K 2 SO 4 → KCl → Na 2 SO 4
115) SiO 2 → K 2 SiO 3 → H 2 SiO 3 → SiO 2 → CaSiO 3
116) Cu → CuCl 2 → Cu (NO 3) 2 → NO 2 → HNO 3
117) Ca (NO 3) 2 → O 2 → SiO 2 → H 2 SiO 3 → SiO 2
118) P → H 3 PO 4 → Ca 3 (PO 4) 2 → CaHPO 4 → Ca (H 2 PO 4) 2
119) CuSO 4 → Cu → CuS → CuO → CuCl 2
120) Al → A1 2 (SO 4) 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
121) S → SO 3 → H 2 SO 4 → KHSO 4 → BaSO 4
122) N 2 O 5 → HNO 3 → Cu (NO 3) 2 → CuO → Cu (OH) 2
123) Al → A1 2 O 3 → Al (OH) 3 → A1 2 (SO 4) 3 → A1 (NO 3) 3
124) Ca → Ca (OH) 2 → Ca (HCO 3) 2 → CaO → CaCl 2
125) NH 3 ∙ H 2 O → NH 4 C1 → NH 3 → NH 4 HCO 3 → (NH 4) 2 CO 3
126) Cu (OH) 2 → H 2 O → HNO 3 → Fe (NO 3) 3 → Fe
127) SO 2 → Ca (HSO 3) 2 → CaCl 2 → Ca (OH) 2 → Ca (HCO 3) 2
128) NH 3 ∙ H 2 O → NH 4 HCO 3 → CaCO 3 → CaSiO 3 → CaCl 2
129) CuSO 4 → Cu → CuO → Cu (OH) 2 → Cu
130) Fe (OH) 3 → Fe → FeCl 3 → Fe (NO 3) 3 → Fe
131) Zn → Zn (OH) 2 → Na 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn
132) Zn → ZnO → Na 2 ZnO 2 → Zn (OH) 2 → Na 2 → ZnCl 2
133) Zn → K 2 ZnO 2 → ZnSO 4 → K 2 → Zn (NO 3) 2 → ZnO
134) ZnO → Zn (OH) 2 → K 2 ZnO 2 → ZnSO 4 → ZnCl 2 → ZnO
135) Zn → Na 2 → Na 2 ZnO 2 → Zn (NO 3) 2 → ZnO → Zn
136) Al → K 3 → Al (OH) 3 → Na 3 → A1C1 3 → Al (OH) 3
137) Al 2 O 3 → KAlO 2 → Al (OH) 3 → Al 2 O 3 → Na 3 → Al 2 O 3
138) Al (OH) 3 → A1 2 O 3 → K 3 → Al 2 (SO 4) 3 → A1 (NO 3) 3
139) A1C1 3 → K 3 → Al (NO 3) 3 → NaAlO 2 → Al 2 O 3
140) Եղեք → Na 2 → Be (OH) 2 → Na 2 BeO 2 → BaBeO 2
ՓՈՐՁԱՐԿՄԱՆ ՓՈՐՁԵՐ «ՆՈՐԱՁԵՎԱԿԱՆ ՀԻՄՈՒՆՔՆԵՐԻ ՀԻՄՆԱԿԱՆ ԴԱՍԱԿԱՐԳԵՐ» ԹԵՄԱՅՈՎ
ՓՈՐՁՈՒԹՅՈՒՆ 1.Չեզոքացման ռեակցիաները:
ա) ուժեղ թթու եւ ուժեղ բազայի փոխազդեցությունը:
Լցնել 5 մլ 2N հիդրոքլորիկ թթու լուծույթը ճարպաթթուների մեջ եւ ավելացնել դրա 2 նատրիումի հիդրոօքսիդ լուծույթը: Խառնեք լուծումը մի բաժակ գավազանով եւ ստուգեք դրա ազդեցությունը lakmus- ում, փոխանցելով լակմուսի թեստի լուծույթը: Անհրաժեշտ է հասնել չեզոք արձագանքին (կապույտ եւ կարմիր lakmus թուղթ չի փոխում գույնը): Գոլորշիացրեք արդյունքի լուծումը չորանալու համար: Ինչ է ձեւավորվել: Գրեք մոլեկուլային եւ իոնային արձագանքման հավասարումներ:
բ) թույլ թթու եւ ուժեղ բազայի փոխազդեցությունը:
Լցնել թեստային 2 մլ 2N ալկալային լուծույթ եւ ավելացնել քացախաթթվի լուծույթ մինչեւ լուծումը չեզոք է: Գրեք մոլեկուլային եւ իոնային արձագանքման հավասարումներ: Բացատրեք, թե ինչու է հավասարակշռության իոնային ռեակցիան, որը թույլ է տալիս մասնակցել էլեկտրոլիտին (քացախաթթու), փոխում է ջրի մոլեկուլների ձեւավորմանը:
ՓՈՐՁՈՒԹՅՈՒՆ 2. Ամֆոտերային հիդրօքսիդներ:
Լաբորատորիայում առկա ռեակտիվներից ստացեք ցինկի հիդրոքսիդի նստվածք: Ստուգեք ստացությունը եւ լցնել փոքր քանակությամբ այն 2 խողովակ: Խողովակների մեկում ավելացնում են հիդրոքլորային թթու լուծույթը, մյուսը `նատրիումի հիդրոքսիդի լուծույթը (ավելցուկային): Ինչ է նկատվում: Գրեք համապատասխան ռեակցիաների հավասարումները մոլեկուլային եւ իոնային ձեւով:
ՓՈՐՁՈՒԹՅՈՒՆ 3.Աղերի քիմիական հատկություններ:
ա) աղ լուծումների փոխազդեցությունը `ապահով լուծելի նյութի ձեւավորման հետ:
Լցնել 2 մլ նատրիումի կարբոնատ լուծույթը խողովակի մեջ եւ ավելացնել բորիումի քլորիդ լուծումը մինչեւ սպիտակ աղը: Գրեք քիմիական ռեակցիայի հավասարումը իոնիկ եւ մոլեկուլային ձեւով: Աղտոտվածությունը բաժանված է երկու մասի: Ներծծվող ծծմբաթթվի լուծույթը խառնել մեկի մեջ, իսկ նատրիումի հիդրոքսիդը մյուսի մեջ: Եղեք եզրակացություն, թթուների եւ alkalis- ներում նստվածքների լուծելիության մասին:
բ) աղ լուծույթի փոխազդեցությունը թթուների միջոցով `անկայուն բարդի ձեւավորման համար:
Լցնել 2 մլ նատրիումի կարբոնատային լուծույթը խողովակի մեջ եւ ավելացնել մի փոքր ծավալի հիդրոքլորիդային լուծույթ: Ինչ է նկատվում: Գրեք քիմիական ռեակցիայի հավասարումները իոնիկ եւ մոլեկուլային ձեւով:
գ) աղ լուծումների փոխկապակցումը alkalis- ի հետ `անկայուն բարդի ձեւավորման հետ:
Լցնել մի փոքրիկ ամոնիումի աղի լուծույթը խողովակի մեջ, ավելացնել 1-2 մլ նատրիումի հիդրօքսիդի լուծույթ եւ եռալեզու ջերմություն: Մի փորձարկման խողովակում, ռեակցիայի խառնուրդով, խոնավ կարմիր լակմուսի թեստի համար: Ինչ է նկատվում: Բացատրեք: Գրեք արձագանքման հավասարումներ:
գ ) Աղերի փոխազդեցությունը ավելի ակտիվ մետաղների հետ, քան աղի մասի մետաղից:
Մաքրեք երկաթե (պողպատե) եղունգները նուրբ փայլով: Այնուհետեւ խառնել այն պղնձի սուլֆատ լուծույթով: Որոշ ժամանակ անց նկատեք եղունգների մակերեսին պղնձի թողարկումը: Գրեք համապատասխան ռեակցիայի հավասարումը իոնիկ եւ մոլեկուլային ձեւով:
ՓՈՐՁՈՒԹՅՈՒՆ 4.Ստացեք հիմնական եւ թթվային աղեր:
ա) արծաթե հիդրոքկառոնատի պատրաստում:
Ավելացնել մի փոքր կապար (II) օքսիդ `կապար (II) ացետատի լուծույթին եւ խառնել մի քանի րոպե: The cooled լուծումը drained է նստվածքից եւ անցնում է ածխածնի երկօքսիդի հոսքը: Ինչ է նկատվում: Զտեք աղը եւ չորացրեք ֆիլտր թղթի թերթերը: Նշեք կապարի հիդրոքկառոնատի արդյունահանման գույնը եւ բնույթը: Գրեք արձագանքման հավասարումներ: Ձեռք բերեք գրաֆիկական բանաձեւ:
բ) մագնեզիումի բիկարբոնատի պատրաստում:
Որոշ մագնեզիումի աղի շատ խառնած լուծույթին ավելացնում է նատրիումի կարբոնատի մի փոքր լուծույթ: Ինչ նյութ է առաջանում: Խտացված ածխածնի երկօքսիդի լուծույթով: Հանգստացեք աստիճանաբար լուծույթի լուծարման վրա: Ինչու է սա տեղի ունենում: Գրեք արձագանքման հավասարումներ:
ՓՈՐՁՈՒԹՅՈՒՆ 5.Դառնալով բարդ աղեր:
ա) համալիր կաթի հետ միացությունների ձեւավորում:
Ամոնիակի կաթիլային լուծույթին ավելացնել 2-3 մլ պղնձի (II) քլորիդ լուծույթի խողովակ, մինչեւ որ պղնձի (II) հիդրոքսիդը ձեւավորվի, եւ ավելացրեք ամոնիակային լուծույթը `լուծարումը լուծելու համար: Համեմատեք ներկերի Cu 2+ գույնը, արդյունքում լուծվող գույնի հետ: Ինչ իոններ են ներկա լուծման մեջ: Գրեք արձագանքման հավասարումը բարդ բաղադրություն ստանալու համար:
բ) բարդ միանման միացությունների ձեւավորում:
Սնդիկի (II) նիտրատի 1-2 մլ լուծույթին կաթիլային եղանակով ավելացնում է կալիումի յոդիի զտված լուծույթը `HgI 2 աղբը կազմելու համար: Այնուհետեւ լցնել ավելցուկային կալիումի յոդի լուծույթը, մինչեւ մինչեւ աղը թափվի: Գրեք բարդ աղի ստացման ռեակցիաները:
ՓՈՐՁՈՒԹՅՈՒՆ 6.Կրկնակի աղերի պատրաստում (կալիումի սինուս):
Կշռի 7.5 գ Ալ 2 (SO4) 3 ∙ 18H 2 O եւ լուծարեք 50 մլ ջրի մեջ `այդ նպատակով բավականաչափ մեծ ճենապակյա ճաշատեսակներ ստանալու համար: Հաշվարկեք ռեակցիայի հավասարումը եւ կշռադատեք ռեակցիայի համար անհրաժեշտ կալիումի սուլֆատի զանգվածը: Պատրաստել կաթի սուլֆատի տաքացած հագեցած լուծույթ եւ լցնել այն ճենապակյա ճաշատեսակով, ալյումինե սուլֆատի լուծույթով: Դիտեք մի քանի օր հետո ալյումինի կալիումի կաղամբի բյուրեղների տեղադրումը: Սառեցման եւ բյուրեղացման արդյունքում լցնել լորձաթաղանթը, մաքուր շաղ տալ բետոնի թղթերի թերթիկների միջեւ եւ քաշել արդյունքի բյուրեղները: Հաշվարկեք եկամտաբերության տոկոսը:
ԿԱՐԳԱՎՈՐՄԱՆ ՆՊԱՏԱԿՆԵՐԸ
1. 16 գ պղնձի (II) սուլֆատ լուծույթի միջոցով գերազանցելով ջրածնի սուլֆիդը, ստացվում է 1.92 գ աղը: Գտեք օգտագործված լուծման մեջ պղնձի սուլֆատի զանգվածային մասը եւ սպառված ջրածնի սուլֆիդի ծավալը:
2. Պղնձի ամբողջական տեղադրման համար, 291 սմ 3-ից պղնձի (II) սուլֆատ լուծույթից 10% զանգվածի մասնաբաժինով, օգտագործվել է 17.6 գ երկաթ (II) սուլֆիդի արձագանքման միջոցով ստացված գազ, որն օգտագործվում է հիդրոկլորիթից ավելցուկով: Գտեք բնօրինակի պղնձե ծծմբի լուծույթի խտությունը:
3. K 2 S լուծույթի փոխկապակցված ժամանակահատվածում զտված ծծմբաթթուով լուծվող գազը անցնում է կապարի (II) նիտրատի ավելցուկի ավելցուկից: Արդյունքում առաջացող աղը ունի 71.7 գ զանգված: Գտեք ծծմբաթթվային ռեակցիայի լուծույթի ծավալը, եթե դրա խտությունը կազմում է 1.176 գ / սմ 3, իսկ զանգվածային մասը `25%:
4. 8 գ պղնձի (II) սուլֆատի պարունակող լուծույթին ավելացվել է 4.68 գ նատրիումի սուլֆիդի պարունակող լուծույթ: Աղտոտվածքը ֆիլտրացված է, սիլտրատը գոլորշիացվել է: Որոշեք այս աղտոտվածությունից հետո աղտոտված նյութերի զանգվածը եւ պղնձի սուլֆիդի զանգվածի զանգվածը:
5. Որոշ երկաթի (II) սուլֆիդի նկատմամբ կիրառվել է հիդրոքլորի թթու ավելցուկ: Արդյունքում արդյունահանվող գազը 12.5 սմ 3 NaOH լուծույթի հետ զանգվածային մասնաբաժինը 25% եւ խտությունը 1.28 գ / սմ 3 ձեւավորեց թթվային աղ: Գտեք բնօրինակը երկաթի սուլֆիդի զանգվածը:
6. 176 գ-ի կշռի երկաթի (II) սուլֆիդը վերաբերվում էր հիդրոքլորի թթու ավելցուկին, եւ արդյունքում գազը այրվել է ավելցուկային օդի մեջ: Կոճակի արդյունահանման արդյունքում արտադրվող գազը լիովին չեզոքացնելու համար ինչ ծավալով է KOH լուծումը պահանջվում է 40% զանգվածային մասի եւ 1.4 գ / սմ 3 խտության հետ:
7. 100 գ տեխնիկական պիրիտի տապալման ժամանակ նրանք ձեռք են բերել գազ, որը լիովին չեզոքացվել է 400 սմ 3 NaOH լուծույթի հետ, զանգվածային մասնաբաժինը 25% եւ խտությունը 1.28 գ / սմ 3: Որոշեք պիրիտի խառնուրդների զանգվածային մասը:
8. 2 գ երկաթի, երկաթի օքսիդի (II) եւ երկաթի օքսիդի (III) խառնուրդին ավելացվել է HC1 լուծույթի 16 սմ 3, 20% զանգվածային մասի եւ 1.09 գ / սմ 3 խտության հետ: Ավելցուկային տերմինը չեզոքացնելու համար այն տեւում է 10.8 սմ 3 NaOH լուծույթ `1.05 գ / սմ 3 10% խտության զանգվածային մասի հետ: Գտնել խառնուրդի մեջ նյութերի զանգվածները, եթե թողարկված ջրածնի ծավալը կազմում է 224 սմ 3 (NU):
9. Կա (OH) 2, CaCO 3 եւ BaSO 4 խառնուրդ կա 10,5 գ զանգվածով: Երբ խառնուրդը վերաբերվում է հիդրոքլորի թթու ավելցուկին, 672 սմ 3 (IU) գազ է արձակվել, իսկ 71,2 գ թթվին արձագանքել է զանգվածային 10% -ը: Որոշեք նյութերի զանգվածը խառնուրդում:
10. Կա բարիում քլորիդ, կալցիումի կարբոնատ եւ նատրիումի բիկարբոնատի խառնուրդ: Երբ այս խառնուրդի 10 գ ջուրը լուծարվում է, չլուծվող մնացորդը հավասար է 3,5 գ-ի: Նախնական խառնուրդի 20 գ կալցիման դեպքում դրա զանգվածը նվազում է 5.2 գ-ով: Գտնել սկզբնական խառնուրդի նյութերի զանգվածային ֆրակցիաները:
11. Կա լուծույթ, որը պարունակում է ինչպես ծծմբային, այնպես էլ ազոտական թթուներ: Այս լուծույթի 10 գ-ի ամբողջովին չեզոքացնելու համար 12.5 սմ 3 KOH լուծումը սպառվում է 19% զանգվածային մասով եւ 1,18 գ / սմ 3 խտությամբ: Երբ բարիումի քլորիդի ավելցուկը ավելանում է թթվային լուծույթի նույն խառնուրդի 20 գ-ի վրա, 4.66 գ թաղանթը ընկնում է: Գտնել խառնուրդում թթուների զանգվածային ֆրակցիաները:
12. KC1- ի եւ KNO3- ի 100 գ խառնուրդից ստացված բոլոր ջրածնային քլորիդը լուծարվել է 71.8 սմ 3 ջրի մեջ: Միեւնույն աղի խառնուրդից 100 գ ջերմաստիճանի դեպքում 93,6 գ մշտական մնացորդ մնա: Գտնել ջրի մեջ ջրածնի քլորիդի զանգվածային մասը:
13. 2 մ 3 օդի (NU) միջոցով Ca (OH) 2 լուծույթով անցնելով, ստացվեց 3 գ կարբոնաթթվի աղ աղը: Գտնել CO 2- ի ծավալը եւ զանգվածային մասը օդի մեջ:
14. ածխածնի երկօքսիդը անցնում է 50 μ CaCO 3 պարունակող կասկադի միջոցով: Ռեակցիան եկավ 8,96 դմ 3 գազ (NU): Որն է CaCO 3- ի զանգվածը ամուր փուլում:
15. CaO- ին ջուր ավելացնելիս դրա զանգվածը ավելացել է 30% -ով: CaO- ի (մասշտաբի%) մասի ինչ մասը մարվեց:
16. 18.47 գ կշռի (II) օքսիդը ջերմացվում էր ջրածնի հոսքի մեջ: Reaction- ից հետո, արդյունքում առաջացած եւ չպահպանվող օքսիդի զանգվածը կազմում էր 18.07 գ: Որն է կապարի օքսիդի զանգվածը, որը չի արձագանքում:
17. ածխածնի երկօքսիդը անցնում է երկաթ (III) օքսիդով: Ռեակցիայի արդյունքում ամուր մնացորդի զանգվածը 2 գ պակաս է, քան երկաթի օքսիդի նախնական զանգվածը: Ինչ ծավալով CO- ն արձագանքեց (օքսիդը ամբողջովին կրճատվել է):
18. Կա 8,96 դմ 3 (NU) N 2, CO 2 եւ SO 2 խառնուրդներ, որոնք ունեն ջրածնի 25 հարաբերական խտություն: ՔՈՀ լուծույթի ավելացումից հետո խառնուրդի ծավալը կրճատվել է 4 անգամ: Գազերի ծավալները գտնել սկզբնական խառնուրդում:
19. Երկու բաժակներում կա 100 գ HC1 լուծույթ, որի զանգվածը կազմում է 2.5%: Մեկ բաժակում ավելացվել է 10 գ CaCO 3, մյուս կողմից, 8,4 գ MgCO 3: Ինչպես է ակնոցների զանգվածը տարբերվում արձագանքից հետո:
20. Ծծմբի երկօքսիդի ծավալը (NU) պետք է փոխանցվի լուծույթի 200 սմ 3-ի միջոցով, NaOH- ի 0.1% զանգվածային մասնաբաժինը եւ 1 գ / սմ 3 խտությունը `թթվային աղի ստանալու համար:
21. Ինչ է ածխածնի երկօքսիդի առավելագույն քանակությունը (ածխածնի երկօքսիդը) կարող է կլանել 25 սմ 3 լուծույթ, NaOH- ի զանգվածային զանգվածի 25% -ը եւ 1.1 գ / սմ խտությունը:
22. Որն է լուծույթի նվազագույն ծավալը 20% KOH- ի զանգվածային մասի եւ 1.19 գ / սմ 3 խտության հետ, որը կարող է կլանել ածխածնի երկօքսիդի 23.2 գ մագնետիտի լիակատար կրճատմամբ արտադրվող ածխածնի երկօքսիդը:
23. Որն է KOH- ի նվազագույն զանգվածը, որը պետք է արձագանքվի 24.5 գ orthophosphoric թթու հետ, որպեսզի միայն կալիումի դիձիձեն ֆոսֆատը լինի արտադրանքը:
24. Որն է Ca (OH) 2- ի նվազագույն զանգվածը ավելացնել 16 գ կալցիումի բիկարբոնատ լուծույթը, աղի աղի զանգվածի մասնաբաժինով, միջին աղի ստանալու համար:
25. Որքան կալիումի ջրածնի ֆոսֆատի զանգվածը պետք է ավելացվի 12.25 գ H 3 PO 4 պարունակող լուծույթին, որպեսզի դրանից հետո լուծումը պարունակում է միայն կալիումի դիօդրոգեն ֆոսֆատ:
26. լուծումը պարունակում էր 56.1 գ կալցիումի եւ մագնեզիումի կարբոնատների խառնուրդ `կասեցման ժամանակ: Փոխակերպել դրանք ածխաջրածինների մեջ, նրանք ծախսել են ածխածնի երկօքսիդը, որը արտադրվում է էթան 7 դմ 3 (NU): Գտնել կալցիումի կարբոնատի զանգվածը նախնական խառնուրդում:
27. Նատրիումի հիդրո եւ դիխոդրոֆ ֆոսֆատի խառնուրդից 9.5 գ փոխանակելու համար անհրաժեշտ է միջին աղ, 10 սմ 3 լուծում `27.7% NaOH զանգվածային մասնաբաժինով եւ 1.3 գ / սմ 3 խտությամբ: Գտնել խառնուրդում ջրածնի ֆոսֆատի զանգվածը:
28. ածխածնի երկօքսիդի միջոցով անցնելով 6 գ NaOH պարունակող լուծույթով, ձեռք է բերվել 9,5 գ թթվային եւ միջին աղեր խառնուրդ: Գտեք սպառված ածխածնի երկօքսիդի գումարը:
29. ՔՈՀ լուծույթի միջոցով 11.2 դմ 3 (NU) CO 2 անցելուց հետո ձեռք բերվեց թթվային եւ միջին աղի խառնուրդի 57,6 գ: Գտնել միջին աղի զանգվածը:
30. Որքան է orthophosphoric թթու զանգվածը պետք է չեզոքացվի, ստանալ 1.2 գ դիհրդրո եւ 4.26 գ նատրիումի ջրածնի ֆոսֆատ:
31. NaOH ավելացվել է ծծմբաթթվի լուծույթին, 3.6 գ հիդրոդուլֆատ եւ 2.84 գ նատրիումի սուլֆատ: Որոշել են թթու եւ ալկալիների քիմիական նյութերը, որոնք արձագանքել են:
32. Ջերմոցային քլորիդը 200 սմ 3 NaOH լուծույթի միջով անցնելուց հետո զանգվածի մասնաբաժինը 10% -ով եւ 1.1 գ / սմ 3 խտությամբ, արդյունքում լուծվող NaOH- ի զանգվածային մասը նվազեց մինչեւ կեսը: Որոշեք լուծվող լուծույթում NaCl- ի զանգվածային մասնիկը:
33. Պղնձի եւ դրա օքսիդի (II) խառնուրդի 14.4 գ ջերմաստիճանը սպառվում է 48.5 գ լուծույթով, HNO 3 զանգվածի մասնաբաժինը `80%: Գտնել պղնձի եւ օքսիդի զանգվածային ֆրակցիաները նախնական խառնուրդում:
34. 6,2 գ նատրիումի օքսիդ զանգվածը լուծարվել է 100 սմ 3 ջրի մեջ, իսկ 1-ի լուծույթը ստացվել է, իսկ այդ լուծույթին ավելացվել է 10% զանգվածի հիդրոքլորային թթու, մինչեւ միջինը չեզոք դարձավ, իսկ թիվ 2 լուծումը ստացվեց: :
1) 1, 2 լուծույթներում նյութերի զանգվածային ֆրակցիաները.
2) HC1 լուծույթի զանգվածը, որը գնաց 1-ի լուծումը չեզոքացնելու համար:
35. 3 գ ցինկը համագործակցում է 18.69 սմ 3 HC1 լուծույթի հետ, 14.6% զանգվածով եւ 1.07 գ / սմ 3 խտությամբ: Երբ ջեռուցվում է, արդյունքում գազը անցնում է տաք CuO- ի կշիռը 4 գ: Ինչ է ձեռք բերված պղնձի զանգվածը:
36. Կալցիումի հիդրիդի բուժման արդյունքում ազատված ջուրը, ավելցուկային ջրով, բաց թողնված է FeO- ի վրա: Արդյունքում, օքսիդի զանգվածը նվազել է 8 գ-ով:
37. CaCO 3 նմուշի նոսրացման ընթացքում նրա զանգվածը նվազել է 35.2% -ով: Պինդ ռեակցիաների արտադրանքը լուծարվել է հիդրոքլորային թթվի ավելցուկում `0.112 դմ 3 (NU) գազ ստանալու համար: Որոշեք կալցիումի կարբոնատի օրիգինալ նմուշի զանգվածը:
38. Պղնձի նիտրատը քայքայվել է, եւ արդյունքում պղնձի (II) օքսիդը ամբողջությամբ կրճատվել է ջրածնի միջոցով: Արդյունքում ստացված արտադրանքը անցնում էր P 2 O 5 խողովակի միջոցով, իսկ հետո խողովակի զանգվածը ավելացել է 3.6 գ-ով: Որն է փորձարկումում ստացված լուծույթի համար անհրաժեշտ 88% զանգվածային բարդությամբ եւ 1,87 գ / սմ 3 խտությամբ ծծմբաթթվի նվազագույն ծավալը: պղինձ եւ ինչն է աղի աղի զանգվածը:
39. Նատրիումի օքսիդի (IV) կլանման դեպքում COH լուծույթի ավելցուկով սառնամանիքներում թթվածնի բացակայության դեպքում ստացվել է 40,4 գ ՔՆՕ 3: Ինչ նյութ է ձեւավորվում, եւ որն է դրա զանգվածը:
40. Չեզոքացնել 400 գ լուծույթը, որը պարունակում է հիդրոքլորիդ եւ այլն ծծմբաթթու, սպառել է 287 սմ 3 նատրիումի հիդրօքսիդ լուծույթի զանգվածային մասնաբաժինը `10% եւ խտությունը` 1,115 գ / սմ 3: Եթե բարիումի քլորիդի ավելցուկ լուծումը ավելացվում է նախնական լուծույթի 100 գ-ի վրա, ապա 5.825 գ թաղանթը կընկնի: Որոշեք սկզբնական լուծման մեջ թթուների զանգվածային ֆրակցիաները:
41. Նատրիումի հիդրոօքսիդի լուծույթով ածխածնի երկօքսիդը անցնելուց հետո ստացվել է միջին եւ թթու աղերի 13.7 գ խառնուրդ: Նատրիումի քլորիդին փոխակերպելու համար անհրաժեշտ է 75 գ հիդրոքլորային թթու `10% HCl զանգվածային մասնաբաժին: Գտնել ներծծվող ածխածնի երկօքսիդի ծավալը:
42. Հիդրոքլորիկ եւ ծծմբական թթուների խառնուրդը, 600 գ լուծույթի ընդհանուր զանգվածով, նույն թթվածնի զանգվածային ֆրակցիաների հետ միասին վերցվեց նատրիումի բիկարբոնատից եւ 32,1 դմ 3 գազից (N o) ստացվեց: Գտնել սկզբնական խառնուրդում թթուների զանգվածային մասը:
43. NaOH լուծույթի 1 դմ 3 չեզոքացնելու համար HNO 3 լուծույթի 66.66 սմ 3 սպառումը սպառվում է 63% զանգվածի եւ 1.5 գ / սմ 3 խտությամբ: Ինչ ծավալի ծավալի թթվի լուծույթի 24.5% զանգվածային մասի եւ 1.2 գ / սմ 3 խտության հետ անհրաժեշտ էր նույն քանակությամբ ալկալի չեզոքացնել:
44. Ինչ ծավալով հարաբերակցությունը պետք է լուծի 5% զանգվածային զանգվածով եւ 1.03 գ / սմ 3 խտությամբ եւ բարիումի հիդրոքսիդի լուծույթ 5% զանգվածային մասով եւ 1.1 գ / սմ 3 խտությամբ լիարժեք չեզոքացման համար: Պատկերացրեք պատասխանը, որպես թթվային լուծույթի ածխաթթու լուծույթի ծավալը:
45. Հաշվարկել ամոնիակային լուծույթի նվազագույն ծավալը 0.9 գ / սմ 3 խտությամբ եւ 25% զանգվածի մասնաբաժինը, որը անհրաժեշտ է ածխածնի երկօքսիդի ամբողջական կլանման համար ստացված 0.5 կգ բնական կրաքարից `կալցիումի կարբոնատի զանգվածային մասնաբաժինը` 92%:
46. 2.92 գ նատրիումի հիդրօքսիդի եւ նատրիումի կարբոնատի խառնուրդի քլորիդի ամբողջական փոխակերպման համար պահանջվում է 1,344 դմ 3 ջրածնի քլորիդ (NU): Գտնել խառնուրդում նատրիումի կարբոնատի զանգվածը:
47. 25 գ զանգվածի մասնաբաժին ունեցող պղնձի (II) սուլֆատ լուծույթին ավելացվել է մի շարք նատրիումի հիդրօքսիդ լուծույթ `16% -ով զանգվածի մասնաբաժինով: Թաղանթը ձեւավորվել է ֆիլտրացված, որից հետո ֆիլտրատը ալկալային էր: Խտանյութը լիովին չեզոքացնելու համար այն լուծվում է 25 մմ 3 ծծմբաթթու լուծույթի լուծույթով 0.1 մոլ / դմ 3 մոլիսային կոնցենտրացիան: Հաշվարկել ավելացված նատրիումի հիդրօքսիդի լուծույթի զանգվածը:
48. CuO- ի ամբողջական կրճատման արդյունքում ձեռք բերված նյութը 15.8 գ ջրածնի զանգվածով 11.2 դմ 3 (NU) ծավալով լուծարվել է ջերմացմամբ `խտացված ծծմբաթթվի մեջ: Ինչպիսին է արձագանքման արդյունքում արձակված գազի ծավալը (NU):
49. Քաղցկեղի թթու 50 սմ 3-ի ամբողջական չեզոքացման համար օգտագործվել է HCl- ի 20% զանգվածային զանգված եւ 1.10 գ / սմ 3 խտություն, օգտագործվել է կալիումի հիդրոօքսիդի լուծույթ `20% զանգվածի մասնաբաժինով: Որքանով է լուծված լուծում պարունակվող ջրի քիմիական քանակը:
50. CO2- ի ավելցուկից ավելի քան 0.84 գ տաքած ածուխի անցնելու արդյունքում ստացված գազը 14.0 գ ջերմային պղնձի (II) օքսիդի հետ արձագանք է ստանում: Որքան է ազոտաթթուի լուծույթը, որն ունի 63% զանգվածային մաս եւ 1,4 գ / սմ 3 խտություն, անհրաժեշտ է լիովին լուծարել վերջին ռեակցիայի արդյունքում ստացված նյութը:
51. Երբ պղնձի (II) նիտրատի մշտական կշիռը հավասարեցրեց աղի քաշը, նվազեց 6,5 գ-ը:
52. Երբ օգտագործվում է հիդրոքլորական թթվի ավելցուկ, 6.72 dm 3 (NW) գազը թողարկվել է ալյումինի խառնուրդով, անհայտ մոնոպոլի մետաղի հետ, եւ խառնուրդի զանգվածը կիսով չափ կրճատվել է: Թթվածին նիտրոնաթթուով վարելիս 0,373 dm 3 (NU) NO է արձակվել: Բացահայտեք անհայտ մետաղը:
53. Կավիճի զանգվածի զանգվածը 105 գ է, իսկ դրա կազմում կազմված թթվածնի տարրերի քիմիական քանակը `1 մոլ է: Որոշեք CaCO 3- ի զանգվածային մասը կավիճի նմուշում (թթվածին ընդգրկված է միայն կալցիումի կարբոնատի կազմի մեջ):
54. Ծծմբի օքսիդի (VI) ջրերի հետ փոխազդեցության մեջ լուծում է ստացվել 25% ծծմբաթթուի զանգվածային մասի հետ: Երբ այս լուծույթին ավելացվել է Ba (OH) 2 ավելցուկը, 29,13 գ-ի կշիռը մնացորդային էր: Որ SO 3 եւ H 2 O զանգվածները ծախսվել են թթու լուծույթի ձեւավորման վրա:
55. SO2- ից մինչեւ 200 գ լուծույթը անցնելիս, 16% զանգված NaOH- ի զանգվածով, կազմվել է աղի խառնուրդ, ներառյալ 41.6 գ թթվային աղ: Ինչ է օգտագործվում SO 2 ձեռք բերելու համար օգտագործվող ծծմբի զանգվածի 4,5% -ը պարունակող կեղտերի զանգվածը: Ինչ է միջին աղի քաշը:
56. 80 գ Ca (NO 3) 2 լուծույթի հետ փոխազդեցությունը ստացավ 50 գ Na2 CO 3 լուծույթ: Տեղումներն առանձնացվել են, իսկ այն վերամշակելով այն հիդրոքլորիդային թթվից, 2.24 dm 3 (NU) գազը ազատ է արձակվել: Որոնք են նախնական լուծումների աղերի զանգվածային խմբաքանակները: Որն է լուծման մեջ նատրիումի նիտրատի զանգվածային մասը որոշելուց հետո:
57. Երբ ցինկը համագործակցում է ծծմբաթթվի հետ, ձեւավորվում է 1.51 միջնորմի խտությամբ SO 2 եւ H 2 S խառնուրդների 10 դմ 3 (NU): Որն է ցինկի քիմիական նյութը լուծարված: Ինչ է գազի խառնուրդում SO2- ի զանգվածային մասը:
58. 11 գ ընդհանուր զանգվածով ցինկի եւ ալյումինե խառնուրդի խառնուրդի նմուշը լուծարվել է ալկալիային լուծույթի ավելցուկով: Սահմանված գազի ծավալը (NU), եթե խառնուրդի մեջ ցինկի զանգվածային մասը կազմում է 30%:
59. Քաշով 4.0 գ նատրիումի հիդրոօքսիդը օժտված էր 9,8 գ-ի քաշով ալյումինի հիդրօքսիդով: Հաշվարկված ստացվող նատրիումի մետալալինատայի զանգվածը:
60. 10 գ պղնձի եւ ալյումինի խառնուրդ մշակելիս `կենտրոնացված ազոտաթթուով սենյակի ջերմաստիճանը ազատ է արձակվել 2.24 dm 3 գազ (NU): Ինչ ծավալով (NU) գազը կթողարկվի, երբ խառնուրդի նույն զանգվածը մշակվի KOH լուծույթի ավելցուկով:
61. Քաշով 20 գ-ի պղնձի եւ ալյումինի խառնուրդ էր վերաբերվում ալկալիների ավելցուկին, լուծելի մնացորդը լուծարվել է կենտրոնացված ազոտաթթվի մեջ: Ստացված աղը մեկուսացված էր, կշտապեցվի մշտական քաշով եւ ստացվեց 8 գ ամուր մնացորդ: Որոշեք կորած NaOH լուծույթի ծավալը `40% զանգվածային զանգվածով եւ 1,4 գ / սմ 3 խտությամբ:
62. 39 գ-ի քաշով ալյումինի եւ մետաղական օքսիդի (II) (ոչ ամֆոտերային օքսիդի) խառնուրդը վերաբերվում էր KOH լուծույթի գերազանցմանը, արտանետված գազը այրվել է 27 գ ջուր ստանալու համար: Չլուծված մնացորդը լիովին լուծարվել է լուծույթի 25.2 սմ 3-ից, 36.5% HC1- ի զանգվածային մասի եւ 1.19 գ / սմ խտության 3): Որոշեք օքսիդը:
63. Ցինկ եւ պղնձի խառնուրդների խառնուրդն օգտագործվել է KOH լուծույթի ավելցուկով, իսկ 2.24 դմ 3 (NU) գազը թողարկվել է: Նույն մետաղական նմուշի ամբողջական քլորացման համար պահանջվեց քլորի 8,96 դմ 3 (NU) ծավալով: Հաշվարկել նմուշի մեջ ցինկի զանգվածային մասը:
64. 49 գ զանգվածով երկաթ, ալյումինե եւ մագնեզիումի խառնուրդի նկատմամբ կիրառվել է ավելցուկային զտված H 2 SO 4 `այդպիսով ստանալով 1.95 մոլթ գազ: Նույն խառնուրդի մեկ այլ հատվածը, որը քաշով 4.9 գ էր, վերաբերվում էր ալկալիային լուծույթի գերազանցմանը, 1.68 dm 3 (NU) գազի ստացում: Գտնել խառնուրդի մեջ մետաղների զանգվածը:
65. Որն է լուծույթի զանգվածը ձեւավորելու դեպքում ձեւավորելով 10 գ NaOH եւ 13,6 գ ZnCl 2:
66. Ալ, Մգ, Fe, Zn- ի խառնուրդի երկու մասերը կան, որոնք նույնն են մոլի կազմի մեջ, որոնցից յուրաքանչյուրը կշռում է 7.4 գ: Մի մասը լուծվել է հիդրոքլորիթում, 3.584 դմ 3 գազ (NU), մյուսը `ալկալային լուծույթով եւ Ստացվել է 2.016 դմ 3 գազ (NU): Հայտնի է, որ երկու խառնուրդներում կա 3 Zn ատոմ, մեկ A1 ատոմի դիմաց: Գտնել խառնուրդի մեջ մետաղների զանգվածը:
67. 1 գ կշիռ ունեցող պղնձի, մագնեզիումի եւ ալյումինի խառնուրդի նկատմամբ կիրառվել է հիդրոքլորի թթու ավելցուկ: Լուծումը ֆիլտրացված է, ավելացված է NaOH լուծույթի ավելցուկը: Աղտոտվածությունը բաժանվել է եւ կալսվել է 0,2 գ մշտական զանգվածի վրա: Հանքային քլորի թթուով բուժումից հետո չլուծված մնացորդը օճառում էր փոշու եւ 0,8 գ սեւ նյութ է ստացվել: Գտնել խառնուրդում ալյումինի զանգվածային մասը:
68. Երբ ցինկի, մագնեզիումի եւ պղնձի թթվածնի հոսքի մեջ ջերմացվում է խառնուրդի զանգվածը 9.6 գ-ով: Արդյունքը մասնակի լուծարման մեջ է, իսկ 40 սմ 3 լուծույթը `լուծույթի համար անհրաժեշտ է KOH 40% զանգվածի եւ 1,4 գ / սմ խտությամբ: 3 Ալյումինի նույն մասի հետ արձագանքման համար անհրաժեշտ է 0.7 մկ HC1: Գտնել խառնուրդում մետաղների քիմիական քանակությունները:
69. 5 գ-ի կշիռ ունեցող պղնձի եւ ցինամի խառնուրդի նկատմամբ կիրառվել է NaOH լուծույթի ավելցուկ: Այնուհետեւ ամուր մնացորդը առանձնացված եւ բուժվում է խտացված HNO3- ի հետ, այդպիսով ստացված աղը մեկուսացված է, կալցինված է մշտական քաշով, եւ ստացվում է 2.5 գ ամուր մնացորդ: Որոշեք մետաղների զանգվածը խառնուրդում:
70. Քաշով 12.8 գ պղնձի եւ ալյումինի մի խառնուրդ էր վերաբերվում ավելցուկային հիդրոքլորի թթու: Չլուծված մնացորդը լուծարվել է կենտրոնացված ազոտաթթվի վրա, արդյունքում լուծվող լուծույթը խտացրեց, չոր մնացորդը կալվացվեց մշտական քաշով եւ 4 գ պինդ ստացվեց: Հստակ սահմանեք պղնձի զանգվածային մասը:
71. Որ զանգվածային հարաբերակցության մեջ պետք է երկու մասի A1, որպեսզի երբ մի ավելացվի լուծարային լուծույթին, իսկ մյուսը, հավասար քանակությամբ ջրածնի, ազատվում են հիդրոքլորիթին:
72. Ալյումինի եւ պղնձի (II) օքսիդի խառնուրդ մշակելիս, KOH լուծույթի ավելցուկով, ազատ է արձակվել 6.72 դմ 3 (NU) գազ եւ սենյակային ջերմաստիճանի մեջ խառնուրդի նույն մասի լուծարման միջոցով 75.2 գ աղ: Գտնել նյութերի սկզբնական խառնուրդի զանգվածը:
73. Որքան պղնձի (II) օքսիդի զանգվածը կարող է վերականգնվել ջրածինով, որը ստացվում է ալյումինի ավելցուկից 139,87 սմ 3 լուծույթով 40% NaOH եւ 1,43 գ / սմ 3 խտությամբ:
74. Երկու մետաղների համաձուլվածքների 7.83 գ-ի ամբողջական օքսիդացումով կազմվել է 14.23 գ օքսիդներ, որոնց բուժման ընթացքում ալկալիների ավելցուկը մնաց չլուծված 4.03 գ նստվածք: Որոշեք մետաղների որակական կազմը, որը կազմավորում է խառնուրդ, եթե դրանց կալիումները ունեն օքսիդացման վիճակ +2 եւ +3, իսկ օքսիդների մոլի հարաբերակցությունը, 1: 1 (ենթադրենք, որ օքսիդացման հետ կապված մետաղային օքսիդը +3 է ամֆոտերային հատկություններ ունի):
75. Նույն զանգված ունեցող ալյումինի երկու հատվածները լուծարվել են `մեկը կալիումի հիդրոօքսիդի լուծույթում, մյուսը` հիդրոքլորիթում: Ինչպես զարգացած գազերի ծավալները (nos) վերաբերում են միմյանց:
76. 1000 գ կշռված ալյումինով պղնձե խառնուրդ, որը վերաբերվում էր ալկալիային լուծույթի ավելցուկին, չլուծված աղը նատրիումի հանքում լուծարվեց, ապա լուծումը խտացրեց, մնացորդը կալվացվեց մշտական քաշով: Նոր մնացորդի զանգվածը կազմում է 0.398 գ: Ինչ են մետաղների զանգվածը խառնուրդում:
77. 20 գ կշիռ ունեցող ցինկի եւ պղնձի համաձուլվածքների բուժումը կատարվել է NaOH լուծույթի ավելցուկով 30% զանգվածային մասի եւ 1.33 գ / սմ 3 խտության հետ: Կոշտ մնացորդը մեկուսացվել եւ բուժվել է HNO 3-ի կենտրոնացված լուծույթի ավելցուկով: Այս գործընթացի ընթացքում ձեւավորված աղը մեկուսացված է եւ կալվացվի մշտական քաշով: Կոշտ մնացորդի զանգվածը 10.016 գ էր: Հաշվարկեք մետաղների զանգվածային ֆրակցիաները խառնուրդում եւ սպառված ալկալային լուծույթի ծավալը:
78. 2 գ կշիռ ունեցող պղնձի եւ ալյումինի խառնուրդի նկատմամբ կիրառվել է ալկալիային լուծույթի ավելցուկ: Մնացորդը ֆիլտրացված, լվացվեց, լուծարվեց ՀՆՈ 3-ում, լուծումը խտացրեց եւ կալվացվեց մշտական քաշով: Հալեցման արդյունքում մնացորդի զանգվածը 0.736 գ էր: Հաշվարկեք մետաղների զանգվածային ֆրակցիաները խառնուրդում:
79. Երկաթի, պղնձի եւ ալյումինի խառնուրդի քլորացումը պահանջում է 8,96 դմ 3 քլոր (NU) եւ նույն նմուշի փոխազդեցությունը ջրածնի քլորիդով պահանջում է 5.6 դմ 3 (NU): Երբ խոսքը վերաբերում է ալկալիների հետ մետաղների խառնուրդի նույն զանգվածին, 1.68 dm 3 (NU) գազի գինը: Գտնել խառնուրդում մետաղների քիմիական քանակները:
80. Կալիումի հիդրոդը կշռում էր 5.0 գ, ջուրը լուծարվեց 80 սմ 3 ծավալով, իսկ 0.81 գ կշիռ ալյումինը ավելացրեց արդյունահանման լուծույթին: Գտեք արդյունահանման նյութերի զանգվածային ֆրակցիաները `մինչեւ 100% -ի ճշգրտությամբ:
ԳՐԱԿԱՆՈՒԹՅՈՒՆԻ ՑԱՆԿԸ
1. Բարանիկ, Վ.Պ. Անօրգանական միացությունների ժամանակակից ռուսական անվանացուցակ / V.P. Barannik // Համամիութենական քիմիական հասարակության ամսագիր: Դ.Ի. Մենդելեվը: - 1983. - XXVIII դ. - էջ 9-16:
2. Վրոբուլուսկի, Ա. Քիմիայի սիմուլյատոր / Ա. Wroblewski. - 2-րդ հրատարակություն, Պերաբեր: եւ ավելացնել: - Մինսկ. Krasiko-Print, 2007. - 624 էջ.
3. Գլինկա, Ն. Ընդհանուր քիմիայի խնդիրներն ու վարժությունները `ուսումնասիրություններ: ուսումնական ձեռնարկներ / ed. Վ.Ա. Ռաբինովիչը եւ Հ.Մ. Ռուբինա. - M: Integral-Press, 2004. - 240 էջ:
4. Լինին, Ռ.Ա. Ընդհանուր եւ անօրգանական քիմիայի խնդիրները `ուսումնասիրություններ: ձեռնարկը բարձրագույն ուսանողների համար: ուսումնասիրություններ: հաստատություններ / Ռ.Ա. Լիդին, Վ.Ա. Կաթ, L.L. Անդրեա. կողմից: Ռ.Ա. Լիդինա. - Մ .: ՎԼԱԴՈՍ, 2004. - 383 էջ.
5. Լինին, Ռ.Ա. Անօրգանական նյութերի անվանացանկարի հիմունքներ / Ռ.Ա. Lidin [et al.]; կողմից: B.D. Ստեպինա. - Մ., Քիմիա, 1983 թ. - 112 էջ:
6. Ստեփին, Բ.Դ. IUPAC- ի կանոնների կիրառումը ռուսական / B.D.- ի անօրգանական միացությունների անվանացանկի վրա: Ստեփին, Ռ.Ա. Լիդին // Համամիութենական քիմիական ընկերության ամսագիր: Դ.Ի. Մենդելեվը: - 1983. - XXVIII դ. - էջ 17-20:
| Ներածություն .............................................................................. Անօրգանական նյութերի տեսակների ընդհանուր կանոններ ............ .. Օքսիդներ ....................................... .................................... Հիմնական օքսիդներ .................................................................. ... թթվային օքսիդներ ....................................... ............................ Ամֆրատերային օքսիդներ ................................................................... Օքսիդներ ձեռք բերելը .................................................................. «Օքսիդներ» թեման ................................................................... Թթուններ ............................................................................... «Թթուններ» թեմայով ինքնուրույն աշխատանքի համար պարապմունքներ .................................................................. Հիմունքներ ............................................................ ......... .. «Հիմնադրամներ» թեմայով ինքնուրույն աշխատանքի համար պարապմունքներ ................................................................ Աղեր .................................................................................................. Դասընթացի համար «Սաթ» թեմայով ինքնուրույն աշխատանքի համար պարապմունքներ ........................................................ Անօրգանական միացությունների դասերի միջեւ գենետիկական հարաբերություններ ......................... «Անօրգանական միացությունների դասերի միջեւ գենետիկական կապ» թեմայով ինքնուրույն աշխատանքի համար վարժություններ ................................................................... «Անօրգանական միացությունների հիմնական դասեր ...» թեմայով փորձարարական փորձարկումներ ......... .. Հաշվարկային խնդիրներ ..................................................................... Հղումներ .................................... |
կրթական: ամրագրել «գենետիկական շարքի», «գենետիկ կապի» հայեցակարգը. սովորեցնել, թե ինչպես կատարել տարրերի գենետիկական շարքը (մետաղներ եւ ոչ մետաղներ), կազմելու գենետիկական շարքին համապատասխանող արձագանքման հավասարումներ, ստուգել, թե ինչպես օքսիդների, թթուների, աղերի, բազաների քիմիական հատկությունների մասին գիտելիքները յուրացվում են.
զարգացում. զարգացնում է եզրակացությունները վերլուծելու, համեմատելու, ամփոփելու եւ եզրակացնելու ունակությունը, քիմիական ռեակցիաների հավասարումները:
կրթական : նպաստել գիտական աշխարհայացքի ձեւավորմանը:
2. Դասընթացների տրամադրում. «Պարբերական համակարգ», «Լուծելիության սեղան», «Մետաղների գործունեության սերիա» աղյուսակները, ուսանողներին տրված հրահանգները, գիտելիքների փորձարկման խնդիրները:
3. կատարման կարգը.
3.1. Ֆրոնտալ հետազոտություն:
3.2. Առաջադրանքների լուծում:
3.3. Ընտրանքների ստուգում կատարեք:
4. Հաշվետվության դասավորությունը.
4.1. Գրել գործնական դասի թեման եւ նպատակները:
4.2. Գրանցման խնդիրը լուծելու համար:
4.3. Լուծել ինքնուրույն աշխատանքի ձեր սեփական տարբերակը, նոթատետրում գրելու որոշումը եւ վերանայել ուսուցիչին:
Աշխատանքային առաջընթաց
1. Ֆրոնտալ զրույցը:
Ինչ է գենետիկ կապը:
Գենետիկական կապեր - դրանք կապեր են տարբեր դասերի միջեւ, որոնք հիմնված են իրենց փոխկապակցվածությունների վրա:
Ինչ է գենային շարքը:
Գենետիկ տող - մի շարք նյութեր `տարբեր դասերի ներկայացուցիչներ, որոնք մի քիմիական տարրերի միացություններ են, որոնք կապված են փոխկապակցման հետ եւ արտացոլում են այդ նյութերի վերափոխումները: Այս շարքի հիմքը նույն տարրն է:
Հաճախ ինչ գենետիկ շարք է հատկացված:
Մետաղների մեջ կան երկու տեսակի տողեր.
ա) Գենետիկական շարքը, որի մեջ ալկալը հանդես է գալիս որպես հիմք: Այս շարքը կարելի է ներկայացնել հետեւյալ փոփոխությունների միջոցով.
մետաղական → հիմնական օքսիդ → ալկալի → աղ
օրինակ, կալիումի K → K 2 O → KOH → KCl- ի գենետիկական շարքը
բ) գենային շարքը, որտեղ բազան անլուծելի հիմք է, ապա սերիան կարող է ներկայացվել որպես վերափոխումների շղթա.
մետաղական → բազային օքսիդ → աղ → անլուծելի բազա → բազային օքսիդ → մետաղ
օրինակ `Cu → CuO → CuCl 2 → Cu (OH) 2 → CuO → Cu
Ոչ մետաղների թվում կարելի է տարբերակել երկու տիպի տողեր.
ա) Ոչ մետաղների գենետիկական շարքը, որտեղ լուծվող թթուները հանդես են գալիս սերիայի հղում: Փոխակերպումների շղթան կարող է ներկայացվել հետեւյալ կերպ. Ոչ մետաղական → թթվային օքսիդ → լուծվող թթու → աղ:
Օրինակ `P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
բ) ոչ մետաղների գենետիկական շարքը, որտեղ չլուծվող թթու: ոչ մետաղական → թթվային օքսիդ → աղ → թթու → թթվային օքսիդ → ոչ մետաղական գործառույթներ, որպես կապ
Օրինակ `Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Ընտրանքների ընտրանքների կատարում.
| Տարբերակ 1 | Ընտրանք 2 |
|
I տարբերակ `ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2
Option II- ը `Na 2 SO 4, NaOH, Na, Na 2 O 2, Na 2 O
Տնային: նկարագրում է կալցիումի կալցիումի կարբոնատից աստիճանական անցումը եւ բժշկության մեջ ցանկացած աղի օգտագործման մասին զեկույց պատրաստելը (լրացուցիչ գրականություն օգտագործելով):
Գործնական դասի հրահանգներ
Անօրգանական նյութերի հիմնական դասերի միջեւ գենետիկական հարաբերություններ:
Նպատակը ` ամրագրել «գենետիկական շարքի», «գենետիկ կապի» հայեցակարգը. սովորել է տարրերի գենետիկական շարքը (մետաղներ եւ ոչ մետաղներ), կազմելու գենետիկական շարքին համապատասխանող արձագանքման հավասարումներ, կրկնել օքսիդների, թթուների, աղերի, հիմքերի հատկությունները:
Աշխատանքային առաջընթաց
Գրել հասկացությունների սահմանումները.
Գենետիկ հարաբերություններ - __________________________________________
Գենետիկ շարքը ` ___________________________________________
Մետաղների գենետիկական շարքը, որի մեջ ալկալը հանդես է գալիս որպես հիմք: կարող է ներկայացվել ընդհանրապես. մետաղական → հիմնական օքսիդ → ալկալի → աղ: Կատարել կալիումի այս շարքը: Գրեք ռեակցիաների հավասարումներ, որոնց միջոցով կարող եք իրականացնել վերափոխումների այս շղթան:
Ոչ մետաղների գենետիկական շարքը, որտեղ լուծվող թթունն ազդում է սերիայի կապակցությամբ կարող են ներկայացվել հետեւյալը. ոչ մետաղական → թթվային օքսիդ → լուծվող թթու → աղ: Կատարեք այս շարքը ֆոսֆորի օգտագործմամբ: Գրեք ռեակցիաների հավասարումներ, որոնց միջոցով կարող եք իրականացնել վերափոխումների այս շղթան:
Գենետիկ տող, որտեղ բազան անլուծելի հիմք է կարող են ներկայացվել փոխակերպումների շղթան `մետաղի → հիմնական օքսիդ → աղ → անլուծելի հիմք → հիմնական օքսիդ → մետաղ. Կառուցեք այս շարքը պղնձի միջոցով: Գրեք ռեակցիաների հավասարումներ, որոնց միջոցով կարող եք իրականացնել վերափոխումների այս շղթան:
Ոչ մետաղների գենետիկական շարքը, որտեղ չլուծվող թթունն ազդում է սերիայի մեջ կարող են ներկայացվել փոխակերպումների շղթան `ոչ մետաղական → թթվային օքսիդ → աղ → թթու → թթվային օքսիդ → ոչ մետաղական: Կառուցեք այս շարքը, օգտագործելով սիլիկոն: Գրեք ռեակցիաների հավասարումներ, որոնց միջոցով կարող եք իրականացնել վերափոխումների այս շղթան:
Կատարել ընտրանքների ընտրանքները.
| Տարբերակ 1 | Ընտրանք 2 |
|
1. Ընտրեք ձեր տարբերակով օքսիդի բանաձեւերը, բացեք ձեր ընտրությունը, հիմնված միացությունների այս դասի կազմի բնութագրերի իմացության վրա: Զանգահարեք նրանց:
2. Ձեր տարբերակի բանաձեւի սյունակում գտնել թթվային բանաձեւերը եւ բացատրել ձեր ընտրությունը `հիմնվելով այդ միացությունների կազմի վերլուծության վրա:
3. Որոշեք թթվային կազմի մեջ թթվային մնացորդների արժեքները:
4. Ընտրեք աղի բանաձեւեր եւ անվանեք դրանք:
5. Դարձնել աղերի բանաձեւերը, որոնք կարող են ձեւավորվել ձեր տարբերակի մագնեզիումի եւ թթուների հետ: Գրեք դրանք, անվանեք այն:
6. Ձեր տատանումների բանաձեւի սյունակում գտնել բազային բանաձեւերը եւ բացատրել ձեր ընտրությունը `հիմնվելով այդ միացությունների կազմի վերլուծության վրա:
7. Ձեր տարբերակով ընտրեք նյութերի բանաձեւերը, որոնց հետ կարող են արձագանքել orthophosphoric acid (hydrochloric, sulfuric) լուծումը: Կատարեք համապատասխան արձագանքման հավասարումներ:
9. Ձեր տարբերակի բանաձեւերի մեջ ընտրեք նյութերի բանաձեւեր, որոնք կարող են փոխազդել միմյանց հետ: Կատարեք համապատասխան արձագանքման հավասարումներ:
10. Անօրգանական միացությունների գենետիկական կապերի շղթա ստեղծեք, որը ներառում է մի նյութ, որի բանաձեւը տրվում է ձեր տարբերակով:
Այս նյութերից գենետիկ գիծ է ստեղծում, օգտագործելով բոլոր բանաձեւերը: Գրեք արձագանքման հավասարումների հետ, որոնցով կարող եք իրականացնել այդ փոփոխությունների շղթան.
Ես տարբերակը ` ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2
IIտարբերակը: Na 2 SO 4, NaOH, Na, Na 2 O 2, Na 2 O
Տնային: նկարագրում է կալցիումի կալցիումի կարբոնատից աստիճանական անցումը եւ բժշկության մեջ ցանկացած աղի օգտագործման մասին զեկույց պատրաստելը (լրացուցիչ գրականություն օգտագործելով):
