Ծծմբի միացություններ: Միացությունների մեջ ծծմբի օքսիդացման աստիճանը: Ծծմբի միացությունների ձեւակերպումներ: Ծծումբ: Ջրածին սուլֆիդ: Սուլֆիդներ
Ծծումբ, նրա ֆիզիկական եւ քիմիական հատկություններ. Ծծմբի կենսաբանական արժեքը, դրա կիրառումը (demercurization):
Cera բնույթով
Մթնոլորտային ծծումբ
PbS - կապարի փայլ
Cu 2 ր - պղնձե փայլ
ZnS- ը - ցինկ բլենդեն
Ֆես 2 - պիրիտ, ծծմբի պիրիտ, կատու ոսկի
Հ 2 ր - ջրածնի սուլֆիդ (հանքային աղբյուրներում եւ բնական գազով)
CaSO 4 * 2H2 O- գիպս
MgSO 4 * 7H2 O - դառը աղ (անգլերեն)
Na 2 SO 4 * 10 H 2 O - Գլաուբերի աղը (mirabilite)
Ֆիզիկական հատկություններ
Պինդ բյուրեղային նյութը դեղին է, լուծելի չէ ջրի մեջ, ջրի հետ չի թրջվում (մակերեւույթում), t ° kip = 445 ° С.
Հատուկ մեկն է ֆիզիկական հատկություններ ծծմբի -ֆլոտացիա, խիտ ծծմբի փոշու փորելու ունակությունը, ապա, քանի որ նրա մեծ բյուրեղները ջրով լցվում են: Փաստն այն է, որ ծծմբի ջուրը չի խոնավեցնում ջրով, եւ նրա մասնիկները պահվում են ջրի մակերեւույթին, կապված փոքր օդային փուչիկների հետ, որոնք պատկանում են նրանց:Այս հատկությունը օգտագործվում է ծծմբի ծծմբի առանձնացումը աղտերից: Խառնել հանքաքարը, լցնել ջրով եւ պայթեցնել ներքեւից ցածր օդի հետ, ծծմբի լողում է, եւ լվանալը մնում է ներքեւում:Allotropy
Ծծումբը բնութագրվում է մի քանի allotropic փոփոխություններով:, սակայն առավել հայտնի փոփոխությունները հետեւյալն են.ռոմիկ (բյուրեղային) , մոնոկլինիկ (ասեղ) եւ պլաստիկ .
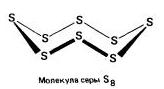
Ռոմբիկ (ա - ծծումբ) - S 8
t ° pl. = 113 ° C; ρ = 2.07 գ / սմ 3: Առավել կայուն փոփոխություն:
Մոնոկլինիկ (բ - ծծումբ) - S 8
մուգ դեղին ասեղներt ° pl. = 119 ° C; ρ = 1.96 գ / սմ3: Կայուն է 96 ° C-ից ավելի ջերմաստիճանում. նորմալ պայմաններում վերածվում է ռոմիկի:
Պլաստիկ S n
շագանակագույն ռետին (ամորֆ) զանգված: Անկայուն, երբ ամրապնդվում է ռոմբին:
ՊԼԱՍՏԻԿ ՍՈՒԼՖՈՒՐԻ ԱՐՏԱԴՐՈՒԹՅՈՒՆԸ
Ծծմբի ատոմի կառուցվածքը
Էլեկտրոնները մակարդակների եւ ենթադասների տեղադրումը
Հիմնական վիճակ
1s 2 2s 2 2p 6 3s 2 3p 4
Էլեկտրոնների տեղադրում ըստ
orbitals (վերջին շերտ)Դիպլոմ
օքսիդացումՎալանսը
Հիմնական վիճակում
Առաջին հուզված պետություն
Երկրորդ հուզված պետություն
Ծծմբի արտադրությունը
1. Արդյունաբերական մեթոդ `հանքաքարի արդյունահանմամբ` ջրի գոլորշի օգտագործմամբ:
2. Թթվածնի ծծմբի ոչ պակաս օքսիդացում (թթվածնի բացակայությամբ):
2H 2 S + O 2 = 2S + 2H 2 O
3. Wackenroder- ի արձագանքը
2H 2 S + SO 2 = 3S + 2H 2 O
Ծծմբի քիմիական հատկություններ
Ծծումբը օքսիդացնող նյութ է S 0 + 2ē→ S -2 | Ծծումբ - կրճատող գործակալ: S - 4ē→ S +4; S - 6է→ S +6 |
1. Ծծմբի փոխազդեցությունը հետբոլոր ալկալիների եւ ալկալային մետաղների, պղնձի, սնդիկի, արծաթի առանց ջեռուցման: 2 Na + S→ Na 2 Ս ՓՈՐՁ S + Hg = HgS Մերկուրին ունի բարձր փոփոխականություն: Նրա զույգերը թունավոր են: Այս ռեակցիան հիմնված է սնդիկի հեռացման եւ արտանետման վրա, օրինակ, կոտրված բժշկական ջերմաչափից: Այն վայրերը, որոնցից հնարավոր չէ հանել սնդիկի կաթիլները, ծածկված են ծծմբի փոշիով: Ծծումբը եւ սնդիկները արձագանքում են: Արդյունքում, ձեւավորվում է քիմիական աներեւույթ եւ անվնաս նյութ: Այս գործընթացը կոչվում է դեքերկուլյացիա: 2. Ծծմբի փոխազդեցությունըգ այլ մետաղներ (բացառությամբAu, Pt): 2Al + 3S t → Ալ 2 S 3 Zn + S- ը t
°
→
ԶՆՍ ՓՈՐՁ Cu + S- ը t
→
CuS փորձը 3. Ծծմբի հետ փոխազդեցության հետ որոշ ոչ մետաղներ ձեւավորելու համար երկուական միացություններ: Հ 2 + Ս→ Հ 2 Ս 2P + 3S→ P 2 S 3 C + 2S→ CS 2 | 1. Ծծմբի հետ փոխազդեցությունը թթվածինով. S + O 2 t ° → S +4 O 2 2 S + 3 O 2 t °; pt → 2 S +6 O 3 2. Ծծմբի փոխազդեցությունըգ հալոգեն (բացառությամբ յոդից) S + Cl 2→ S +2 CI 2 ** Ծծմբի հետ փոխգործակցությունը թթուներ - օքսիդացող նյութեր. S + 2H 2 SO 4 (համակ)→ 3S + 4 O 2 + 2H 2 O S + 6HNO 3 (համակ)→ H 2 S +6 O 4 + 6NO 2 + 2H 2 O ** Անհամապատասխանության արձագանքները. 4. 3 S 0 + 6 KOH→ K 2 S +4 O 3 + 2 K 2 S -2 + 3 H 2 O |
Դիմում
Ռեզինի վուլկանացում, աբոնիտի ձեռքբերում, խաղերի արտադրություն, վառոդ, գյուղատնտեսության վնասատուների դեմ պայքարում, բժշկական նպատակներով (մաշկի հիվանդությունների բուժման համար ծծմբի քսուք), ծծմբաթթու ձեռք բերելու եւ այլն:
Տնային աշխատանքպարբերություն 21; վարժություններ 1, 3, 4 էջ 99-100:
Լրացուցիչ դասարաններ
Լրացրեք ռեակցիաների հավասարումները, պար Կազմակերպեք գործակիցները էլեկտրոնային հաշվեկշռի մեթոդով, նշեք օքսիդիչը, նվազեցնող նյութը:
№2: Կատարեք վերափոխումը ըստ սխեմայի:
Սա հետաքրքիր է ...
- 70 կգ քաշով մարդու մարմնում ծծմբի պարունակությունը `140 գ:
- Մարդկանց օրվա ընթացքում պետք է 1 գ ծծումբ:
- Peas, լոբի, վարսակի ալյուր, ցորեն, միս, ձուկ, մրգեր եւ մանգո հյութեր հարուստ են ծծմբի մեջ:
- Ծծումբը հորմոնների, վիտամինների, սպիտակուցների մի մասն է, ճարպային հյուսվածքի, մազերի, եղունգների մեջ: Մարմնի մեջ ծծմբի բացակայության պատճառով կա եղունգների եւ ոսկորների փխրունություն, մազերի կորուստ:
Դիտեք ձեր առողջությունը:Գիտեք արդյոք ..
- Ծծմբի միացությունները կարող են ծառայել որպես թմրամիջոցներ:
- Ծծումբը `սաղմնային մաշկի հիվանդությունների բուժման քաղցկեղի հիմքի վրա, պայքարելու բեղերի դեմ: Նատրիումի թիոսուլֆատ Na 2 S 2 O 3 օգտագործվում է այն պայքարելու համար:
- Ծծմբաթթվի շատ աղեր պարունակում են բյուրեղացման ջուր: ZnSO 4 × 7H 2 O եւ CuSO 4 × 5H 2 Ա. Դրանք օգտագործվում են որպես հակասեպտիկներ բույսերի սերմացուի եւ գյուղատնտեսության վնասատուների դեմ պայքարում հացահատիկ հագնելու համար:
- Iron ցիկլ FeSO- ն 4 × 7H 2 O- ն օգտագործվում է անեմիայի համար:
- BaSO 4 օգտագործվում է ստամոքսի եւ աղիքների ռադիոգրաֆիական հետազոտության համար:
- Ալյումինի կալիումի կալիումի KAI (SO 4) 2 × 12H 2 O-hemostatic- ով կրճատումներով:
- Հանքային Na 2 SO 4 × 10H 2 Նա կոչվում է «Գլաուբերի աղը», գերմանացի քիմիկոս Գլաուբ ԻՌ Գլաուբերի պատվին, որը հայտնաբերել է VIII դարում եւ հանկարծ ճամփորդության ընթացքում հիվանդացել է: Նա ոչինչ չէր կարող ուտել, նրա ստամոքսը հրաժարվում էր ուտել: Տեղացիներից մեկը նրան ուղարկում է աղբյուր: Երբ նա խմեց դառը աղը, նա անմիջապես սկսեց ուտել: Գլաուբերը հետազոտել է այս ջուրը, նրանից աղը բյուրեղացած է: 2 SO 4 × 10H 2 Ա. Այժմ այն օգտագործվում է որպես դեղամիջոց դեղամիջոցներով, բամբակյա գործվածքների ներկում: Աղը նաեւ օգտագործում է ապակու արտադրության մեջ:
- Yarrow- ն ունի հողից ծծմբի արդյունահանման ունակություն եւ խթանելու այս տարրերի կլանումը հարեւան բույսերով:
- Սխտորը թողարկում է մի նյութ `albucide, caustic ծծմբի բարդ: Այս նյութը խանգարում է քաղցկեղին, դանդաղեցնում է ծերացումը, կանխում սրտի հիվանդությունը:
The chalcogen ենթախումբը ներառում է ծծումբ, սա տարրերի երկրորդն է, որը կարող է մեծ քանակությամբ հանքաքարի հանքեր ձեւավորել: Սուլֆատները, սուլֆիդները, օքսիդները եւ այլ ծծմբային միացությունները շատ տարածված են, կարեւոր են արդյունաբերության եւ բնության մեջ: Հետեւաբար, այս հոդվածում մենք համարում ենք, թե ինչ են նրանք, ինչն է ծծումբը, իր պարզ նյութը:
Ծծումբը եւ դրա բնորոշումը
Այս տարրը պարբերական համակարգում ունի հետեւյալ դիրքորոշումը:
- Վեցերորդ խումբ, հիմնական ենթախումբը:
- Երրորդ փոքր ժամանակահատվածը:
- Ատոմային զանգվածը 32.064 է:
- Հետեւյալ թիվը 16 է, պրոտոնների եւ էլեկտրոնների քանակը նույնն է, եւ կան նաեւ 16 նեյտրոններ:
- Անդրադառնում է ոչ մետաղական տարրերին:
- Բանաձեւը կարդում է «es», տարրերի ծծմբի անունը, լատինական ծծումբը:
Բնականաբար կան չորս կայուն изотоптар, զանգվածային համարներով 32,33,34 եւ 36: Այս տարրը վեցերորդ ամենաբազմազան բնույթն է: Անդրադառնում է սնուցիչները, որպես կարեւոր օրգանական մոլեկուլների մի մաս:
Ատոմի էլեկտրոնային կառուցվածքը
Ծծմբի միացությունները պարտական են իրենց բազմազանությունը ատոմի էլեկտրոնային կառուցվածքի առանձնահատկություններին: Այն արտահայտվում է հետեւյալ կազմաձեւման բանաձեւով. 1s 2 2s 2 2p 6 3s 2 3p 4.
Վերոնշյալ ընթացակարգը արտացոլում է միայն տարրային կայուն վիճակը: Այնուամենայնիվ, հայտնի է, որ եթե ատոմը տեղեկացվի լրացուցիչ էներգիայի մասին, ապա էլեկտրոնները կարող են բաժանվել 3p եւ 3s ենթաբեւեռների հետ, հետագա հերթափոխով դեպի 3d, որը մնում է անվճար: Արդյունքում ոչ միայն փոխվում է ատոմի արժեւորումը, այլեւ հնարավոր բոլոր օքսիդացման վիճակները: Նրանց թիվը զգալիորեն ավելանում է, ինչպես նաեւ տարբեր ծագում ունեցող նյութերի քանակը:
Միացությունների մեջ ծծմբի օքսիդացման աստիճաններ
Այս ցուցանիշի համար կան մի քանի հիմնական տարբերակ: Ծծմբի համար այն է `
Դրանցից S +2- ը շատ հազվադեպ է, մնացածը ցրվում են ամենուր: Խառնուրդների մեջ ծծմբի օքսիդացման աստիճանը կախված է քիմիական ակտիվությունից եւ ամբողջ նյութի օքսիդատիվ կարողությունից: Օրինակ, 2-ը `սուլֆիդներ: Նրանց մեջ մեզ համարող տարրը բնորոշ օքսիդացնող նյութ է:
Որքան բարձր է օքսիդացման աստիճանը բարդում, այնքան ավելի է արտահայտվում այդ նյութի օքսիդացման ունակությունը: Դա հեշտությամբ երեւում է, եթե հիշենք, որ ծծմբի երկու հիմնական թթուները,
- H 2 SO 3 - ծծմբային;
- H 2 SO 4 - ծծումբ:
Հայտնի է, որ վերջինս շատ ավելի կայուն, ուժեղ բարդ է, ունի բարձր կոնցենտրացիայում, շատ լուրջ օքսիդացման ունակություն:
Պարզ նյութ
Որպես պարզ նյութ, ծծմբը ներկայացնում է հերթական կանոնավոր երկարաձգված ձեւի դեղին գեղեցիկ բյուրեղներ: Թեեւ սա միայն ձեւերից մեկն է, քանի որ կան երկու հիմնական նյութեր: Առաջինը, մոնոկլինիկ կամ ռոմիկ, դեղին է, որը չի կարող լուծվել ջրի մեջ, այլ միայն օրգանական լուծույթներում: Տարբերակները պղտորությամբ եւ կառույցի գեղեցիկ ձեւով ներկայացված են թագի ձեւով: Հալման կետ - մոտ 110 0 С.
Եթե դուք չեք կարոտում նման փոփոխության ջերմության միջանկյալ ժամանակը, ապա ժամանակի ընթացքում կարող եք հայտնաբերել մեկ այլ պետություն `պլաստիկ ծծմբ: Դա շագանակագույն գույնի ռետինե, փխրուն լուծույթ է, որը հետագա ջեռուցման կամ արագ սառեցման ժամանակ կրկին դառնում է ռոմբինացված ձեւ:
Եթե խոսենք քիմիապես մաքուր ծծմբի մասին, որը ստացվում է կրկնակի զտման միջոցով, ապա դա վառ դեղին փոքրիկ բյուրեղներ է, փխրուն եւ լիովին լուծելի ջրի մեջ: Հնարավորություն է տալիս այրվել օդում խոնավության եւ թթվածնի հետ շփման վրա: Տարբերորեն բարձր քիմիական ակտիվությամբ:

Լինելով բնության մեջ
Բնության մեջ կան բնական հանքեր, որոնցից արդյունահանվում են ծծմբի միացություններ եւ ինքն իրեն որպես պարզ նյութ: Բացի այդ, այն պարունակում է.
- հանքանյութերի, հանքաքարի եւ ժայռերի մեջ;
- կենդանիների, բույսերի եւ մարդկանց մարմնում, որպես բազմաթիվ օրգանական մոլեկուլների մի մաս,
- բնական գազերում, նավթով եւ ածուխով;
- պայթուցիկ սալիկներով եւ բնական ջրերում:
Առավել ծծմբի հարուստ հանքանյութերից մի քանիսը հետեւյալն են.
- cinnabar;
- պիրիտ;
- սալաքար;
- անիմոնիտ;
- գալենա եւ այլն:
Այսօր արտադրված ծծմբի մեծ մասը գնում է սուլֆատ արտադրության: Մեկ այլ մասը օգտագործվում է բժշկական նպատակներով, գյուղատնտեսությամբ, նյութերի արտադրության արդյունաբերական գործընթացներով:
Ֆիզիկական հատկություններ
Նրանք կարող են նկարագրվել մի քանի կետերում:
- Այն անլուծելի է ջրի մեջ, ածխածնի դիսֆիդի կամ արցունքի մեջ `լավ լուծարված է:
- Երկարատեւ շփման հետ կուտակվում է բացասական լիցք:
- Հալման կետը 110 ° C է:
- Եռման կետ 190 0 C.
- Երբ հասնում է 300 ° C, այն դառնում է հեղուկ, հեշտությամբ շարժունակ:
- Մաքուր նյութը կարող է պայթել այրվող նյութերը շատ լավ:
- Հոտը ինքնին գրեթե ոչ մի ազդեցություն չի ունենում, սակայն ծծմբի ջրածնի միացումներն առաջացնում են փտած ձվերի սուր հոտ: Ճիշտ այնպես, ինչպես մի քանի գազային երկուական ներկայացուցիչներ:
Այս նյութի ֆիզիկական հատկությունները վաղուց արդեն հայտնի են մարդկանց համար: Հատկապես իր դյուրավառության համար, որ ծծումբը ստացել է նման անուն: Պատերազմներում նրանք օգտագործեցին շնչառական եւ թունավոր բորբոքումներ, որոնք ձեւավորվում են այս բարդի այրման ժամանակ որպես թշնամիների դեմ զենք: Բացի այդ, ծծմբի մեջ պարունակվող թթուները միշտ էլ կարեւոր արդյունաբերական նշանակություն ունեն:

Քիմիական հատկություններ
Թեման `« Կուլֆուրը եւ դրա միացությունները »դպրոցական քիմիայի դասընթացում ոչ մի դաս է վերցնում, բայց մի քանիսը: Ի վերջո, նրանցից շատերը: Դա պայմանավորված է նյութի քիմիական ակտիվությամբ: Այն կարող է ցուցադրել ինչպես օքսիդացման առանձնահատկությունները, այնպես էլ ուժեղ կրճատող նյութեր (մետաղներ, բոր, եւ այլն) եւ նվազեցնելով հատկությունները ոչ մետաղների հետ:
Այնուամենայնիվ, չնայած այս գործունեությանը, միայն ֆտորով, փոխազդեցությունը նորմալ պայմաններում է ընթանում: Բոլոր մյուսները ջեռուցում են պահանջում: Կան մի քանի կատեգորիա այնպիսի նյութեր, որոնց հետ կարող են համագործակցել ծծմբի:
- մետաղներ;
- ոչ մետաղներ;
- alkalis;
- ուժեղ օքսիդացող թթուներ `ծծմբային եւ ազոտային:
Ծծմբի միացություններ. Սորտեր
Նրանց բազմազանությունը բացատրվում է հիմնական տարրերի `ծծմբի օքսիդացման աստիճանի անհավասար արժեքով: Այսպիսով, այս հատկությունը կարող եք ընտրել մի քանի հիմնական տեսակի նյութեր.
- միացություններ `օքսիդացման վիճակով -2;
Եթե դասերը համարում ենք ոչ թե արժեհամակարգի ցուցանիշ, ապա այս տարրը կազմում է այնպիսի մոլեկուլներ, ինչպիսիք են.
- թթուներ;
- օքսիդներ;
- աղեր;
- երկկողմանի միացություններ ոչ մետաղների հետ (ածխածնի դդուլֆիդ, քլորիդներ);
- օրգանական նյութեր:
Այժմ հաշվի առեք հիմնականը եւ օրինակ բերեք:

Օքսիդացումով նյութեր -2
Ծծմբի միացությունները 2-ն են նրա հետ կապված մետաղների հետ, ինչպես նաեւ `
- ածխածնային
- ջրածինը;
- ֆոսֆոր;
- սիլիկոն;
- մկնդեղ.
- բոր.
Այդ դեպքերում այն գործում է որպես օքսիդացող նյութ, քանի որ նշված բոլոր տարրերը ավելի էլեկտրական են: Նկատի առնենք դրանցից ամենակարեւորը:
- Ածխածնի դիսուլֆիդ - CS 2: Մաքուր հեղուկ, որը բնորոշ է էթերի հաճելի բուրմունքով: Այն թունավոր, դյուրավառ եւ պայթուցիկ է: Օգտագործվում է որպես վճարունակ, եւ շատ տեսակի յուղերի, ճարպեր, ոչ մետաղներ, արծաթե նիտրատ, խեժեր եւ ռետիններ: Դա նաեւ կարեւոր մասն է ռեզոնանսի շրջանի արտադրության մեջ: Արդյունաբերության մեջ մեծ քանակությամբ սինթեզվում է:
- Ջրածին սուլֆիդ կամ ջրածնի սուլֆիդ `H 2 S. Գազ, որը չունի գույն եւ քաղցր համ: Հոտը սուր է, չափազանց տհաճ, հիշեցնում է փտած ձու: Թունավոր, ցնցում է շնչառական կենտրոնը, քանի որ կապում է պղնձի իոնները: Հետեւաբար, եթե նա թունավորվում է, նա շնչում եւ մեռնում է: Այն լայնորեն օգտագործվում է բժշկության մեջ, օրգանական սինթեզներով, ծծմբական թթու արտադրությամբ, ինչպես նաեւ որպես էներգաարդյունավետ հումք:
- Մետաղական սուլֆիդները լայնորեն օգտագործվում են բժշկության մեջ, սուլֆատ արտադրությունում, ներկերի արտադրության, ֆոսֆորների եւ այլ տեղերի արտադրության մեջ: Ընդհանուր բանաձեւը `Me x S y:

Օքսիդացման հետ համակցված նյութեր +4
Ծծմբի միացությունները 4 հիմնականում օքսիդ են եւ համապատասխան աղեր եւ թթու: Բոլորը բավականին տարածված միացություններ են, որոնք ունեն որոշակի արժեք արդյունաբերությունում: Նրանք կարող են հանդես գալ որպես օքսիդացող նյութեր, բայց ավելի հաճախ ցույց են տալիս նվազեցնող հատկություններ:
Աղցանների միացությունների համար ձեւակերպումները +4 են:
- օքսիդ - ծծմբի երկօքսիդ SO2;
- թթու - ծծմբային H 2 SO 3;
- աղերը ունեն ընդհանուր բանաձեւ Me x (SO 3) y:
Ամենատարածվածներից մեկը կամ անխիդրը: Դա այրված խաղի հոտով անգույն նյութ է: Հրաբխի ժայթքման ընթացքում ձեւավորված խոշոր կլաստերներում այս պահին հեշտ է որոշել հոտը:
Այն ջրի մեջ լուծարվում է հեշտությամբ տարանջատող թթու, ծծմբային թթու ձեւավորմամբ: Կատարում է որպես բնորոշ աղի ձեւեր, որոնք հանդիսանում են sulfite ion SO 3 ձեւով: Անհիդրիդը հիմնական գազն է, որը ազդում է շրջակա միջավայրի աղտոտման վրա: Սա է, որ ազդում է կրթության վրա: Արդյունաբերությունում օգտագործվում է սուլֆատ արտադրությունում:
Բաղադրիչներ, որոնցում ծծմբի օքսիդացման վիճակը ունի +6
Սրանք ընդգրկում են, առաջին հերթին, ծծմբային անհիդրիտ եւ ծծմբաթթու `իրենց աղով:
- սուլֆատներ;
- հիդրոֆիլդարները:
Քանի որ դրանցում ծծմբի ատոմը բարձր օքսիդացված է, այդ միացությունների հատկությունները շատ պարզ են: Նրանք ուժեղ օքսիդացող նյութեր են:
Ծծմբի օքսիդը (VI) -sulfuric anhydride- անկայուն, անգույն հեղուկ է: Հատկանշական առանձնահատկությունն այն է, որ ուժեղ ամուր ունակություն է: Բացօթյա ծխեր. Ջրի լուծարման ժամանակ տալիս է ամենաուժեղ հանքային թթուներից մեկը, ծծմբական: Դրա կենտրոնացված լուծումը ծանր յուղոտ, թեթեւ դեղնավուն հեղուկ է: Եթե անհիդրիդը լուծվում է ծծմբաթթվի մեջ, ապա դուք ստանում եք հատուկ օղակ, որը կոչվում է օլեում: Այն օգտագործվում է արդյունաբերության մեջ, թթվային արտադրության համար:
Աղերի շրջանում - սուլֆատներ - միացություններ, ինչպիսիք են `
- գիպս CaSO 4 · 2H 2 O;
- barite BaSO 4;
- մուլտիպլիկացիա;
- կապարի սուլֆատ եւ այլն:
Դրանք օգտագործվում են շինարարության, քիմիական սինթեզի, բժշկության, օպտիկական սարքերի եւ ակնոցների, եւ նույնիսկ սննդի արդյունաբերության մեջ:
Հիդրոուլֆատները լայնորեն կիրառվում են մետալուրգիայի մեջ, որտեղ դրանք օգտագործվում են որպես հոսք: Եվ նրանք նաեւ օգնում են թարգմանել բազմաթիվ բարդ օքսիդներ լուծվող սուլֆատային ձեւերի մեջ, որն օգտագործվում է համապատասխան ոլորտներում:
Քիմի քիմիայի դասընթացքում ծծմբի ուսումնասիրությունը
Երբ է լավագույնը ուսանողներին սովորելու, թե ինչ է ծծումբը, ինչն է նրա հատկությունները, ինչն է ծծմբի բարդույթը: 9-րդ դասարան `լավագույն ժամանակաշրջան: Սա հենց սկիզբն է, երբ ամեն ինչ նոր է եւ անհասկանալի երեխաների համար: Սա միջին կետն է քիմիական գիտության ուսումնասիրության ժամանակ, երբ ավելի վաղ դրված հիմնարկները կօգնեն ամբողջությամբ հասկանալ թեման: Հետեւաբար, դա ավագ դասի երկրորդ կեսն է, որը հատկացված է այդ հարցերի քննարկմանը: Միեւնույն ժամանակ, ամբողջ թեման բաժանված է մի քանի բլոկների, որոնց դասը «Սուլֆուրի միացություններ. 9-րդ աստիճան» առանձին կանգնած է:
Դա պայմանավորված է նրանց բազմազանությամբ: Նաեւ անդրադարձել է արդյունաբերության մեջ ծծմբաթթու արտադրության հարցին: Ընդհանուր առմամբ, այս թեմայով նվիրված է միջինը 3 ժամ:
Սակայն ծծումբը հանվում է միայն 10-րդ դասարանում սովորելու համար, երբ օրգանական հարցերը համարվում են: Նրանք նաեւ ազդում են միջնակարգ դպրոցում կենսաբանության վրա: Ի վերջո, ծծումբը նման օրգանական մոլեկուլների մի մասն է.
- thyspirits (thiols);
- սպիտակուցներ (երրորդական կառուցվածք, որի վրա դելֆֆիդ կամուրջների ձեւավորում);
- թիալդեհիդներ;
- թիֆենոլներ;
- thioesters;
- սուլոնային թթուներ;
- սուլֆոքսիդներ եւ այլն:
Նրանք առանձնանում են օրգանական ծծմբի միացությունների հատուկ խմբում: Նրանք կարեւոր են ոչ միայն կենդանի կենդանիների կենսաբանական գործընթացներում, այլ նաեւ արդյունաբերության մեջ: Օրինակ, սուլֆոնիկ թթուները շատերի հիմքն են դեղեր (ասպիրին, սուլֆոնամիդ կամ streptocid):
Բացի այդ, ծծմբը միացությունների մշտական բաղադրիչ է, ինչպես օրինակ `որոշ:
- ամինաթթուներ;
- enzymes;
- վիտամիններ;
- հորմոններ:
Սենյակային ջերմաստիճանում, ծծմբը արձագանքում է միայն սնդիկով: Բարձր ջերմաստիճանով նրա գործունեությունը զգալիորեն աճում է: Երբ ջերմացվում է, ծծումբը անմիջականորեն արձագանքում է բազմաթիվ պարզ նյութերի հետ, բացառությամբ իներտ գազերի, ազոտի, սելենիումի, տելորիի, ոսկու, պլատինիի, րիԻդիի եւ յոդի: Ազոտի եւ ոսկու սուլֆիդները ձեռք են բերվում անուղղակի:
Մետաղների հետ փոխազդեցություն
Ծծումբը օքսիդացնում է հատկությունները, փոխազդեցության արդյունքում ձեւավորվում են սուլֆիդներ.
Փոխազդեցություն ջրածնի հետ տեղի է ունենում 150-200 ° С:
H 2 + S = H 2 S.
Թթվածնի հետ փոխազդեցություն
Ծծումբը այրվում է 280 ° C- ով, օդի մեջ 360 ° C- ում եւ ձեւավորվում է օքսիդի խառնուրդ.
S + O 2 = SO 2;
2S + 3O 2 = 2SO 3:
Ֆոսֆորի եւ ածխածնի հետ փոխազդեցություն
Երբ առանց օդի ջեռուցվում է, ծծումբը արձագանքում է ֆոսֆորով, ածխածնիով, օքսիդատիվ հատկություններով:
2P + 3S = P 2 S 3;
Ֆտորային փոխազդեցություն
Ուժեղ օքսիդացող նյութերի ներկայությամբ ցուցադրվում են նվազեցնող հատկություններ.
S + 3F 2 = SF 6:
Շփում բարդ նյութերի հետ
Երբ բարդ նյութերով փոխազդեցության դեպքում ծծումբը պահպանում է որպես նվազեցնող նյութ:
S + 2HNO 3 = 2NO + H 2 SO 4:
Անհամապատասխանության ռեակցիա
Սուլֆուրը ի վիճակի է անհամաչափության ռեակցիաներ, երբ ձեւավորվում են ալկալային սուլֆիդների եւ սուլֆիտների հետ փոխազդեցություն.
3S + 6KOH = K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O.
1.7. Ծծմբի արտադրությունը
Հայրենի հանքերից
Պիրիտը ջեռուցվում է առանց օդային հասանելիության
FeS 2 = FeS + S.
Օքսիդացում ջրածնի սուլֆիդի թթվածնի բացակայությամբ
2H 2 S + O 2 = 2S + 2H 2 O.
Մետաղագործական եւ կոկաօդային ջեռոցում թափոնների գազերից, երբ տաքացվում է կատալիզատորի ներկայությամբ
H 2 S + SO 2 = 2H 2 O + 3S:
1.8. Ջրածին սուլֆիդ
Ջրածին ծծմբի բաղադրություն - ջրածնի սուլֆիդ Հ 2 Ս . Ջրածին սուլֆիդը կովալենտի բաղադրություն է: Մոլեկուլի կառուցվածքը նման է ջրային մոլեկուլի կառուցվածքին, ծծմբի ատոմը գտնվում է sp 3 հիբրիդացման վիճակում, սակայն, ի տարբերություն ջրի, ջրածնի սուլֆիդի մոլեկուլները չեն ձեւավորում ջրածնային կապեր: Ծծմբի ատոմն ավելի քիչ էլեկտրոնգեգատիկ է, քան թթվածնի ատոմը, ունի ավելի մեծ չափ, եւ, որպես հետեւանք, ավելի ցածր լարման խտություն: The HSH valence անկյունը 91.1 ° է, H - S պարտատոմսի երկարությունը `0.133 նմ:
Ֆիզիկական հատկություններ
Նորմալ պայմաններում ջրածնի սուլֆիդը անգույն գազ է, հոտի հոտի ուժեղ հոտը: Տ pl = -86 ° C Տ kip = -60 ° C, ցածր ջուր, 20 ° C, 2.58 մլ H 2 S ջերմաստիճանում 100 գ ջրի մեջ: Շատ թունավոր, հանգեցնում է ինհալացիաի կաթված, որը կարող է մահացու լինել: Բնության մեջ այն ազատվում է բուսական եւ կենդանի օրգանիզմների քայքայված ձեւով ստեղծված հրաբխային գազերի կազմի մեջ: Այն լուծելի է ջրի մեջ, երբ լուծարվում է թույլ ջրածնի սուլֆիդաթթու:
Քիմիական հատկություններ
Ջրի լուծույթում ջրածնի սուլֆիդը ունի թույլ դիբազի թթվի հատկություններ.
H 2 S = HS - + H +;
HS - = S 2- + H +.
Օդի մեջ ջրհեղեղի ծծումբը այրվում է կապույտ բոց: Օդի հասանելիության սահմանափակ քանակությամբ, ստեղծվում է ազատ ծծմբ:
2H 2 S + O 2 = 2H 2 O + 2S:
Օդի հասանելիության ավելցուկով ջրածնի սուլֆիդի այրումը հանգեցնում է ծծմբի օքսիդի (IV) ձեւավորմանը.
2H 2 S + 3O 2 = 2H 2 O + 2 SO 2:
Ջրածին սուլֆիդը նվազեցնում է հատկությունները: Կախված պայմաններից, ջրածնի սուլֆիդը կարող է օքսիդացվել ջրային լուծույթում `ծծմբի, ծծմբի երկօքսիդը եւ ծծմբաթթու:
Օրինակ, այն գունաթափվում է բրոմի ջուրը.
H 2 S + Br 2 = 2HBr + S.
համագործակցում է քլորի ջրի հետ.
H 2 S + 4Cl 2 + 4H 2 O = H 2 SO 4 + 8HCl:
Ջրածնի սուլֆիդի ճառագայթները կարող են այրվել, օգտագործելով կապի երկօքսիդը, քանի որ ռեակցիան ուղեկցվում է մեծ ջերմության շնորհիվ:
3PbO 2 + 4H 2 S = 3PbS + SO 2 + 4H 2 O.
Ջերմոցային սուլֆիդի փոխազդեցությունը ծծմբի երկօքսիդի հետ օգտագործվում է մետաղագործական եւ սուլֆատ արտադրության թափոններից ստացված ծծմբի արտադրությունը.
SO 2 + 2H 2 S = 3S + 2H 2 O.
Վուլկանային գործընթացներում հայրենի ծծմբի ձեւավորումը կապված է այս գործընթացի հետ:
Սխտորային լուծույթի միջոցով ծծմբի երկօքսիդի եւ ջրածնի սուլֆիդի միաժամանակ փոխանցմամբ, կազմված է թիոսուլֆատ `
4SO 2 + 2H 2 S + 6NaOH = 3Na 2 S 2 O 3 + 5H 2 O.
Նորմալ պայմաններում ջրածնի սուլֆիդը անգույն եւ շատ թունավոր գազ է `փտած ձվի յուրահատուկ հոտով:
Այն լաբորատորիայում ձեռք բերելու համար սովորաբար ավելացվում է հիդրոքլորիդը `սուլֆիդին.
Ջրածնի սուլֆիդի արտադրման այլ ձեւ է ալյումինե սուլֆիդին սառը ջուր ավելացնել:
Այս եղանակով ստացված ջրածնի սուլֆիդը մաքուր է:
Ջրածին սուլֆիդը կովալենտի բաղադրություն է: Դրա մոլեկուլները ունեն ջուրի մոլեկուլների կառուցվածքի նման տեսք ունեցող կառույց (տես աղանդը 2.2): Այնուամենայնիվ, ի տարբերություն ջրի, ջրածնի սուլֆիդ մոլեկուլները չեն ձեւավորում ջրածնային կապեր: Փաստն այն է, որ ծծմբի ատոմն ավելի քիչ էլեկտրոգլոնգատիկ է, քան թթվածնի ատոմը, բայց ավելի մեծ չափ ունի: Հետեւաբար, ծծմբի ատոմն ունի ավելի ցածր լարման խտություն, քան թթվածնի ատոմը: Հիդրոէներգետիկ պաշարների բացակայության պատճառով ջրածնի սուլֆիդը ցածր եռում է, քան ջուրը: Ջրածնի սուլֆիդի մեջ ջրածնային կապերի բացակայությունը բացատրում է նաեւ ջրի իր թույլ լուծելիությունը:
Ջրի լուծույթում ջրածնի սուլֆիդը ունի թույլ դիբազի թթվի հատկություններ.
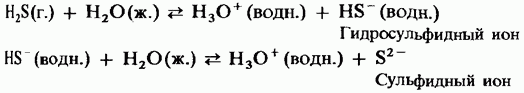
Ջրածին սուլֆիդը այրում է կապույտ բոցով օդում: Օդի հասանելիության սահմանափակման դեպքում ջրածնի սուլֆիդի այրումը ուղեկցվում է ազատ ծծմբի թողարկումով, որը խտացնում է նավթի սառը մակերեսին.
Օդի հասանելիության ավելցուկով ջրածնի սուլֆիդի այրումը հանգեցնում է ծծմբի երկօքսիդի ձեւավորմանը.
Ջրածին սուլֆիդը նվազեցնում է հատկությունները: Օրինակ, այն դանդաղեցնում է բրոմի ջուրը եւ նվազեցնում է իոնների իոնները:
Ջրածին սուլֆիդ, որպես dibasic թթու, կարող է ձեւավորել երկու շարքի աղ `սուլֆիդներ եւ հիդրոֆիլդիդներ (տես վերը): Ալկալի մետաղական սուլֆիդները լուծարվում են ջրում, ալկալային լուծումներ կազմելու համար: Սա տեղի է ունենում որպես հիդրոլիսի արդյունք:
Այլ մետաղների չլուծվող սուլֆիդները կարող են precipitated այս մետաղների աղերի ջրային լուծումներից `լուծելով ջրածնի սուլֆիդը: Օրինակ, ջրհեղեղի սուլֆիդի միջոցով ոնց պարունակող լուծույթով, ձեւավորվում է սեւ սուլֆիդի աղտոտվածություն
Այս ռեակցիան օգտագործվում է որպես վերլուծական նմուշ, ջրածնի սուլֆիդի համար:
Ծծմբի օքսիդներ
Ծծումբը մի քանի օքսիդ է կազմում, որոնցից երկուսը ամենակարեւորն են `ծծմբի երկօքսիդը եւ ծծմբի եռքոլը:
Ծծմբի երկօքսիդը խիտ, անգույն գազ է, սուր, տհաճ հոտով: Լաբորատոր պայմաններում այն կարելի է ձեռք բերել օդի մեջ կամ թթվածնի մեջ ծծմբի այրման միջոցով, ավելացնելով որոշ սուլֆիտի աղի ջերմ լուծված թթու լուծույթ կամ պղնձով խտացված ծծմբաթթվով ջեռուցման միջոցով:
Ծծմբի երկօքսիդի թթվի օքսիդ: Այն հեշտությամբ լուծարվում է ջրի մեջ, կազմելով ծծմբային թթու: Այս թթունքը մասամբ ionized է եւ, հետեւաբար, թույլ թթու:
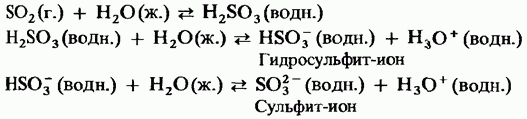
Ձեւավորելով ծծմբի երկօքսիդի գազը նատրիումի հիդրոօքսիդի լուծույթով, ձեւավորվում է նատրիումի սուլֆիտ: Նատրիումի սուլֆիտը, որն արձագանքում է ծծմբի երկօքսիդի ավելցուկին, ձեւավորում է նատրիումի հիդրոֆիլիտ: Այս ռեակցիաները նման են ածխածնի երկօքսիդի կրաքարի ջրի կրկնակի արձագանքին:
Թե գազային ծծմբի երկօքսիդը եւ նրա ջրային լուծումը նվազեցնում են նյութերը: Օրինակ, գազի ծծմբի երկօքսիդը նվազեցնում է օքսիդը սուլֆատը դարձնելու համար ծծմբաթթու վերականգնում է իոնին իոնին
Արդյունաբերական պայմաններում ծծմբի երկօքսիդը ստացվում է օդի մեջ ծծմբի ծծմբի կամ սուլֆիդ հանքաքարի խտանյութով եւ օգտագործվում է որպես միջանկյալ արտադրանք, ծծմբաթթու ստանալու գործընթացում (տես Գլուխ 7): Ծծմբի երկօքսիդը օգտագործվում է պղպեղի արդյունաբերության մեջ, սպիտակեցնող գործվածքների, ինչպես նաեւ մրգերի եւ բանջարեղենի վերամշակման համար երկարատեւ պահեստավորման ընթացքում:
Ծծմբի երկօքսիդը կարեւոր դեր է խաղում մթնոլորտային աղտոտման եւ հատկապես թթվային անձրեւի ձեւավորման գործում: Մթնոլորտում այն օքսիդացված է ծծմբի եռօքսիդին.
Նորմալ պայմաններում այս գործընթացը բավականին դանդաղ է ընթանում, բայց կատալիզատորի ներկայությամբ այն կարող է զգալիորեն արագացնել, ինչպես դա տեղի է ունենում շփման գործընթացում, ծծմբական թթու ստանալու համար: Մթնոլորտում երկաթի եւ մանգանային միացությունների փոքր քանակությունները կարծես կատալիզացնում են ծծմբի երկօքսիդի օքսիդացում: Արդյունքում ծծմբի եռօքսիդը արձագանքում է օդում խոնավության պատճառով, ուստի ամպերը հայտնվում են թթվային անձրեւով (տես նաեւ 12-րդ գլուխը):
Կիտրոնաթթու trioxide- ը պոլիմորֆիկ բարդույթ է: Դրանց երկու կարեւորագույն ձեւերը, որոնցից առաջինը ցիկլային կառուցվածք ունեցող եռաչափ է (Նկար 15.24, ա); բյուրեղները թափանցիկ են: ունի զտիչ պոլիմերային կառուցվածք (Նկար 15.24, բ); այն առկա է ասեղի տեսքով: Հալման կետ Խոնավության առկայությամբ այն աստիճանաբար վերածվում է երկու ձեւի եփուկի `45 ° C- ով: Ծծմբի եռօքսիդի գոլորշը բաղկացած է մեկուսացված սիմետրիկ հարթ մոլեկուլներից:
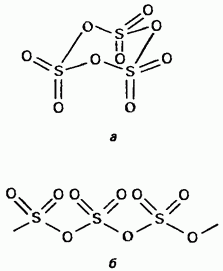
Նկար. 15.24. Ծծմբի trioxide, a - cyclic կառուցվածքը, b - acyclic կառուցվածքը:
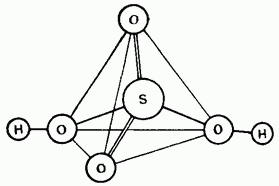
Նկար. 15.25. Ծծմբաթթվի մոլեկուլի կառուցվածքը:
Լաբորատոր պայմաններում ծծմբի եռօքսիդը ձեռք է բերվում սուլֆատի ջեռուցման միջոցով
Ծծմբի եռօքսիդը ուժեղ acidic հատկություններ ունի: Այն արձագանքում է էկզոթերտիկորեն ջրով `ծծմբաթթու ստեղծելու համար.
Ծծումբ trioxide- ն ուժեղ օքսիդող նյութ է: Օրինակ, այն օքսիդացնում է ջրածնի բրոմիդը `ազատ բրոմ:
Ծծմբաթթու
Ծծմբաթթու - անգույն յուղոտ քավական հեղուկ: Այն ամենակարեւոր արդյունաբերական քիմիական արտադրանքներից մեկն է: Շփման գործընթացի եւ կիրառման միջոցով դրա արդյունաբերական արտադրանքը նկարագրված է Ch. 7
Սխտորված ծծմբաթթունը քուվալից բաղադրություն է: Դրա մոլեկուլները ունեն մակերեսային կառուցվածք (Նկար 15.25):
Ծծմբաթթուը եռում է եւ քայքայվում է 340 ° C- ում `կազմելով ծծմբի եռքօքսիդ եւ ջուր
Բարձր եռման կետը եւ ծծմբական թթվի բարձր խտությունը, ըստ երեւույթին, պայմանավորված են ջրածնի ատոմների եւ հարեւան մոլեկուլների թթվածնի ատոմների միջեւ ջրածնի կապերի առկայությամբ:
Ծծմբաթթուն ուժեղ dibasic թթու է: Ջրի մեջ ամբողջությամբ ionized է, կազմելով hydrosulfate եւ sulfate իոնները:
Ծծմբաթթուն ներգրավված է թթուների բնորոշ բոլոր ռեակցիաների մեջ: Այն արձագանքում է մետաղների հետ, ձեւավորելով այդ մետաղների եւ ջրածնի սուլֆատները, կարբոնատներով ռեակցիաների մեջ ձեւավորում են ծծմբաթթուներ, ածխածնի երկօքսիդ եւ ջուր, իսկ հիմքերի եւ ալկալների հետ ռեակցիաներում ձեւավորում են սուլֆատ կամ հիդրոդուլֆատներ:
Խտացված ծծմբաթթունը շատ ջերմությամբ է արձագանքում ջրին: Այդ պատճառով ծծմբաթթունքը միշտ պետք է ջնջվի, այն լցնելով ջրի մեջ, եւ ոչ թե հակառակը: Այս թթու է hygroscopic, այսինքն, այն կարող է կլանել խոնավությունը օդում: Հետեւաբար, այն օգտագործվում է չոր գազեր, որոնք չեն արձագանքում դրա հետ, դրանք անցնելով ծծմբաթթվով: Ծծմբաթթվի սնուցումը այնքան մեծ է, որ ծծմբաթթունքը կարող է ծառայել որպես ջրազրկող նյութ: կենտրոնացված ծծմբաթթվի ակցիայի ներքո.
կապույտ բյուրեղները սուլֆատ պենտահիտրատով են ձեւավորում անջուր սուլֆատ
ածխաջրերը, ինչպիսիք են սաքսոզի,
թուղթը նույնպես խառնվում է խտացված ծծմբաթթվի գործողությամբ, ինչը պայմանավորված է բջջանյութի մանրաթելերի վրա թթվային գործողության հետեւանքով.
էթանոլը վերածվում է էթիլենի.
(էթանոլի ջրազրկում, ծծմբաթթվի հետ, իրականացվում է վերահսկվող
պայմանները, հանգեցնում են էթոլիոեթանի (դիետիկ էթերի) ձեւավորմանը, եւ այս ռեակցիան օգտագործվում է արդյունաբերական մասշտաբով `էթոքեթետան արտադրելու համար);
քլորոբենզոլի եւ տրիխլորիթենալի (քլորալ) խառնուրդը ջրահեռացվում է (տես աղանդը, 16.3):
Խտացված ծծմբաթթուն ուժեղ օքսիդացնող նյութ է: Այն օքսիդացնում է մետաղները եւ ոչ մետաղները: Օրինակ
Որպես այլ օրինակներ, որոնք նկարագրում են խտացված ծծմբաթթվի թթվի հատկությունները, մենք նշում ենք իոնների օքսիդացումն իոնների, ինչպես նաեւ բրոմի իոնների `հետեւյալ ռեակցիաներում ազատ բրոմը.
Վերջապես, ծծմբաթթուն օգտագործվում է որպես օրգանական քիմիայի մեջ սուլֆացող նյութ (տես գլուխ 17):
Սուլֆատներ, սուլֆիտներ եւ թիո միացություններ
Սուլֆատ իոնը ունի մակերեսային կառուցվածք, որը նման է ծծմբաթթվի մոլեկուլի կառուցվածքին:
Աղ Սուլֆատները ձեւավորվում են զտված ծծմբաթթվի ռեակցիաների մեջ մետաղների, դրանց օքսիդների, հիդրոքսիդների կամ կարբոնատների հետ: Բացառությամբ բարիումի սուլֆատի եւ մնացած սուլֆատները լուծելի են ջրի մեջ: Կալցիումի սուլֆատը ջրի ցածր լուծումը ունի: Սուլֆատները սովորաբար դիմացկուն են ջերմության: Միակ բացառությունները երկաթի սուլֆատներն են: Օրինակ, սուլֆատը տատանում է, երբ երկաթի օքսիդ է ձեւավորվում.
Որոշ լուծման մեջ հայտնաբերել սուլֆատային իոնները, այնտեղ ավելացվում է բարիում քլորիդի ջրային լուծույթ: Եթե թեստային լուծույթում առկա են սուլֆատային իոններ, արդյունքում բարիումի սուլֆատի սպիտակ աղը կազմում է.
Սուլֆատները շատ կարեւոր նշանակություն ունեն: Օրինակ, մագնեզիումի սուլֆատը (բրիտանական աղ, դառը աղ) օգտագործվում է պայթուցիկ նյութերի արտադրության մեջ, խաղերի եւ հրդեհային գործվածքների արտադրության համար: Այս աղի հագեցված լուծումը օգտագործվում է բժշկական պրակտիկայում որպես հակաբորբոքային նյութ:
Նատրիումի թիոսուլֆատը կարելի է համարել որպես նատրիումի սուլֆատի անալոգ, որտեղ մեկ թթվածնի ատոմը փոխարինվում է ծծմբի ատոմով: Նման թիոսո միացությունների շարքում եւս պետք է նշվի `կալիումի թիոսյանատ: Դա կալիումի ցիանի ծծմբի անալոգիա է: Կալիումի թիոսյանատը կարող է ձեռք բերել կալիումի ցիանիդը ծծմբի հետ միացնելով.
Կալիումի թիոսյանատը օգտագործվում է որակական վերլուծության մեջ, իոնների հայտնաբերման համար: Եթե այդ իոնները ներկա են փորձարկման լուծույթին `ավելացնելով կալիումի թիոսյանատի լուծույթը` հանգեցնելով արյան կարմիր գույնի, բարդ ionի ձեւավորման շնորհիվ:
Այսպիսով, կրկին կրկնում:
1. VI խմբի ներքեւի անցնելիս իր տարրերի հատկությունները աստիճանաբար փոխվում են ոչ մետալից մետաղից:
2. VI խմբի բաղադրիչները ունեն միաձուլելու ջրածնի եւ ռեակտիվ մետաղների հետ, կազմելով միացություններ, որոնցում նրանք ունեն օքսիդացման վիճակ -2:
3. Թթվածինն ունի բարձր էլեկտրեգեներատիվություն եւ ուժեղ օքսիդանտի հատկություններ:
4. Օզոնն ավելի թունդ օքսիդ է, քան թթվածինը:
5. Թթվածին կենսաբանական համակարգերում չափազանց կարեւոր դեր է խաղում, ներգրավված շնչառության եւ նյութափոխանակության պրոցեսների (նյութափոխանակության) գործընթացներում:
6. Թթվածին ձեւավորում է երկուական միացություններ, տարբեր տեսակի օքսիդներ `այլ միացությունների հետ.

7. Ջրածնի պերօքսիդը ուժեղ օքսիդող նյութ է:
8. Ազնվամորի ծծումբը կարող է գոյություն ունենալ մի քանի enantiotropic ձեւերով:
9. Ստորերկրյա հանքավայրերից ծծմբի արդյունահանման համար օգտագործվում է Frash պրոցեսը, որն օգտագործում է սեղմված օդի եւ գերհոգնած գոլորշի:
10. Ծծումբը կազմում է միացություններ, որոնցում այն գտնվում է այն երկրներում, ինչպիսիք են օքսիդացման վիճակները +2, +4, +6 եւ -2:
11. Ջրածին սուլֆիդ `թույլ տոքսիկաթթու եւ նվազեցնող նյութ:
12. Գազային ծծմբի երկօքսիդը եւ դրա ջրային լուծույթի նվազեցնող նյութերը:
13. Ծծումբ trioxide- ը խստորեն արտահայտում է թթվային եւ օքսիդացող հատկությունները:
14. Ծծմբաթթուն ուժեղ dibasic թթու է, desiccant, dehydrating գործակալ եւ ուժեղ oxidizing գործակալ:
15. Ծծմբաթթու մոլեկուլները եւ սուլֆատ ions ունեն մակերեւութային կառուցվածք: