Όταν συνδέετε 28 g πυριτίου με οξυγόνο. Οι ενώσεις οξυγόνου του πυριτίου
(Πυριτικά), οξείδωση και υδρόλυση, τετραχλωριούχος τετραφθοριούχος και τετραχλωριούχος πυρίτιο, υδρόλυση, εξαφθοροπυριτικά, ενώσεις οξυγόνου, οξείδιο του πυριτίου (IV), σίλικα ζελ, Kremnev πυριτικά άλατα, οξέα, πυριτικά άλατα, διαλυτότητα και υδρόλυση, φυσικά πυριτικά άλατα και αργιλοπυριτικά, ζεόλιθοι, ενώσεις οργανοπυριτίου, σιλικόνες και σιλοξάνια.
Πυριτίου (lat. Silicium), Si, χημικό στοιχείο της ομάδας IV του περιοδικού συστήματος. ατομικός αριθμός 14, ατομική μάζα 28.086. Το πυρίτιο παρουσιάζει επίσης υβριδισμό sp3 των ηλεκτρονικών
τροχιακά. Στο εξωτερικό στρώμα ηλεκτρονίων του ατόμου πυριτίου υπάρχουν σθένος 3d-
τροχιακά (Si: 3s23p23d0),
Το πυρίτιο μετά το οξυγόνο είναι το πιο κοινό στοιχείο του φλοιού. Σε αντίθεση με τον άνθρακα σε ελεύθερη κατάσταση, το πυρίτιο δεν βρίσκεται στη φύση. Οι πιο κοινές ενώσεις του είναι το οξείδιο του πυριτίου (IV) SiO2 και τα άλατα πυριτικού οξέος, πυριτικά άλατα. Αποτελούν το κέλυφος του φλοιού της γης. Οι ενώσεις πυριτίου βρίσκονται σε φυτά και ζώα. Με χημικές ιδιότητες, το πυρίτιο, όπως ο άνθρακας, είναι μη μεταλλικό, αλλά η μη μεταλλικότητά του είναι λιγότερο έντονη, καθώς έχει μεγαλύτερη ατομική ακτίνα
Πυριτίου. σχηματίζει ενώσεις με σχεδόν όλα τα μέταλλα - με αραιωτικά (δεν βρέθηκαν ενώσεις μόνο με Bi, Tl, Pb, Hg). Ελήφθησαν πάνω από 250 πυριτίδια, των οποίων η σύνθεση (MeSi, MeSi2, Me5Si3, Me3Si, Me2Si κ.λπ.) συνήθως δεν αντιστοιχεί σε κλασικά σθένη. Τα πυριτίδια διαφέρουν ως προς την ανθεκτικότητα και τη σκληρότητα. το σιδηροπυρίτιο (αναγωγικός παράγοντας στην τήξη ειδικών κραμάτων, βλέπε Ferroalloys) και το πυριτιοκτόνο MoSi2 του μολυβδαινίου (θερμαντήρες ηλεκτρικών κλιβάνων, πτερύγια αεριοστροβίλων κ.λπ.) έχουν μεγάλη πρακτική σημασία.
Σιλάνη Κάτω από τη δράση του υδροχλωρικού οξέος στα πυριτίδια, η απλούστερη ένωση υδρογόνου του πυριτίου είναι το σιλάνιο SiH4:
Το σιλάνιο είναι ένα δηλητηριώδες αέριο με δυσάρεστη οσμή που αναφλέγεται αυθόρμητα. τον αέρα
Είναι αντιδρώντα και είναι ισχυροί αναγωγικοί παράγοντες.
αντιδρά με το νερό όταν θερμοκρασία δωματίου:
SiH4 + 2H2O · Si02 + 4Η2,:
Τετραφθορίδιο Το πυρίτιο παράγεται με φθορίωση του διοξειδίου του πυριτίου με στοιχειακό φθόριο.
Η διαδικασία φθορίωσης διεξάγεται σε δύο στάδια σε αντιδραστήρα φλόγας, κατευθύνοντας την περίσσεια στοιχειακού φθορίου από το 1ο στάδιο στο 2ο στάδιο.
Το τεχνικό αποτέλεσμα είναι η παραγωγή πυριτίου σε συνεχή λειτουργία με υψηλή απόδοση και ποιότητα προϊόντος.
Τετραφθοριούχο πυρίτιο Το SiF4 σχηματίζεται από τη δράση του υδροφθορικού (υδροφθορικού) οξέος σε γυαλί:
Na2Si03 + 6HF®2NaF + SiF4 + 3Η2Ο
Οι ενώσεις οξυγόνου του πυριτίου
Η πιο σημαντική ένωση οξυγόνου πυριτίου είναι το διοξείδιο του πυριτίου SiO2 (σίλικα), το οποίο έχει αρκετές κρυσταλλικές τροποποιήσεις.
Η τροποποίηση χαμηλής θερμοκρασίας (έως 1143 K) ονομάζεται χαλαζία. Το χαλαζία έχει πιεζοηλεκτρικές ιδιότητες. Φυσικές ποικιλίες χαλαζία: κρύσταλλο βράχου, τοπάζ, αμέθυστος. Οι ποικιλίες του πυριτίου είναι χαλκηδόνιο, οπάλιο, αχάτη,. Jasper, άμμο.
Το πυρίτιο είναι χημικά ανθεκτικό. επηρεάζεται μόνο από φθόριο, υδροφθορικό οξύ και αλκαλικά διαλύματα. Πηγαίνει εύκολα σε μια υαλώδη κατάσταση (γυαλί χαλαζία). Το γυαλί χαλαζία είναι εύθραυστο, πολύ χημικά και θερμικά ανθεκτικό. Το αντίστοιχο πυριτικό οξύ SiO2 δεν έχει ειδική σύνθεση. Τυπικά, το πυριτικό οξύ καταγράφεται ως xH2O-ySi02. Τα πυριτικά οξέα επιλέχθηκαν: H2Si03 (Η2Ο-δίΟ2) - μετα-πυρίτιο (τριών οξο-πυριτίου), H4Si04 (2H20-Si02) - ορθο-πυρίτιο (τετρα-οξο-σιλικόνη), H2Si2O5 (H2O * Si02)
Τα πυριτικά οξέα είναι ελάχιστα διαλυτές ουσίες. Σύμφωνα με τη μικρότερη μεταλλοειδές φύση του πυριτίου σε σύγκριση με τον άνθρακα, το H2SiO3 ως ηλεκτρολύτης είναι ασθενέστερο από το H2CO3.
Αντίστοιχα με τα πυριτικά οξέα, τα άλατα-πυριτικά άλατα στο νερό είναι αδιάλυτα (εκτός από πυριτικά άλατα αλκαλικών μετάλλων). Τα διαλυτά πυριτικά άλατα υδρολύονται από την εξίσωση
2Si03 - + Η20 = Si2O52- + 20Η-.
Συμπυκνωμένα διαλύματα διαλυτών πυριτικών αλάτων ονομάζονται υγρά γυαλιά. Το συνηθισμένο πυριτικό γυαλί του νατρίου και του ασβεστίου έχει μια σύνθεση Να20-CaO-6Si02. Λαμβάνεται με αντίδραση
Μια ευρεία ποικιλία πυριτικών αλάτων (πιο συγκεκριμένα, οξοπυριτικά) είναι γνωστή. Μια ορισμένη κανονικότητα παρατηρείται στη δομή των οξοπυριτικών: όλα αποτελούνται από Si04 τετραέδρα, τα οποία συνδέονται μεταξύ τους μέσω ενός ατόμου οξυγόνου. Οι πιο συνηθισμένοι συνδυασμοί τετραεδρών είναι (Si2O76-), (Si3O9) 6-, (Si40l2) 8-, (Si6O1812-), οι οποίοι ως δομικές μονάδες μπορούν να συνδυαστούν σε αλυσίδες, κορδέλες, δίχτυα και σκελετούς (Εικ. 4).
Τα σημαντικότερα φυσικά πυριτικά άλατα είναι, για παράδειγμα, ο τάλκης (3MgO * H20-4Si02) και ο αμίαντος (SmgO * Η2Ο * Si02). Όπως και με το SiO2, η υαλώδης (άμορφη) κατάσταση είναι χαρακτηριστική των πυριτικών. Με την ελεγχόμενη κρυστάλλωση του γυαλιού, είναι δυνατόν να ληφθεί μια λεπτή κρυσταλλική κατάσταση (sitalls). Τα Sitalls χαρακτηρίζονται από αυξημένη αντοχή.
Εκτός από τα πυριτικά, τα αργιλιοπυριτικά είναι ευρέως διαδεδομένα στη φύση. Αργιλοπυριτικά άλατα - οξυπυριτικά πλαίσια, στα οποία ένα μέρος των ατόμων πυριτίου αντικαθίσταται από τρισθενές ΑΙ. π.χ. Na12 [(Si, ΑΙ) 04] 12.
Για το πυριτικό οξύ, μια κολλοειδής κατάσταση είναι χαρακτηριστική όταν τα άλατα του οξέος H2SiO3 δεν επηρεάζονται αμέσως. Τα κολλοειδή διαλύματα πυριτικού οξέος (διαλύματα) υπό ορισμένες συνθήκες (για παράδειγμα, όταν θερμαίνονται) μπορούν να μετατραπούν σε μια διαφανή, ομοιογενή γέλη μάζας-πηκτής πυριτικού οξέος. Τα πηκτώματα είναι υψηλού μοριακού βάρους ενώσεις με χωρική, πολύ χαλαρή δομή που σχηματίζεται από μόρια SiO2, τα κενά των οποίων είναι γεμάτα με μόρια Η2Ο. Κατά την αφυδάτωση της πηκτής οξειδίου του πυριτίου, λαμβάνεται πήγμα πυριτίας - ένα πορώδες προϊόν με υψηλή ικανότητα προσρόφησης.
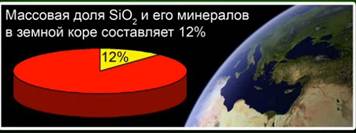
Το οξείδιο του πυριτίου (IV) (σίλικα) - η πιο κοινή ένωση στο φλοιό της γης, που αποτελεί το 12% της μάζας της, με τη μορφή διαφόρων μεταλλευμάτων. Διακρίνετε μεταξύ κρυσταλλικού και άμορφου πυριτίου. Ο απλούστερος τύπος για το οξείδιο του πυριτίου (IV) είναι SiO2. Κρυσταλλώνεται στο ατομικό πλέγμα.
1) Κρυστάλλινη σίλικα - με τη μορφή ορυκτού χαλαζία και των ποικιλιών του (κρυστάλλινα πετρώματα, χαλκηδόνια, αχάτη, ιάσιρ, φλαμουριά). ο χαλαζίας αποτελεί τη βάση των άμμων χαλαζία που χρησιμοποιούνται ευρέως στην κατασκευή και στη βιομηχανία πυριτικών.
2) Άμορφο πυρίτιο - με τη μορφή της συνθετικής ορυκτής ουσίας SiO2 nH2O. οι γήινες μορφές άμορφου πυριτίου είναι διατομίτης, Τρίπολη (γη φωτοσύνθεσης). Ένα παράδειγμα τεχνητής άμορφης άνυδρης σίλικας είναι το διοξείδιο του πυριτίου, το οποίο λαμβάνεται από μεταπυριτικό νάτριο:
Na2Si03 + 2HCl = 2NaCl + H2Si03
Το silica gel έχει μια ανεπτυγμένη επιφάνεια και γι 'αυτό απορροφά την υγρασία καλά.
Σιλικαζέλ είναι ένα ξηρό πήκτωμα που σχηματίζεται από υπερκορεσμένα διαλύματα πυριτικού οξέος (nSiO2 · mH2O) σε pH\u003e 5-6. Στερεό υδρόφιλο ροφητικό.
Να πάρει
Λαμβάνεται με οξίνιση των διαλυμάτων πυριτικού αλκαλιμετάλλου, ακολουθούμενη από έκπλυση και ξήρανση της σχηματιζόμενης γέλης:
Πυριτικό οξύ. Το Si02 είναι ο ανυδρίτης ενός αριθμού πυριτικών οξέων
Το πυριτικό οξύ κατασκευάζεται από τετραεδρικές δομικές μονάδες (σε κάθε τέτοια μονάδα, το άτομο πυριτίου βρίσκεται στο κέντρο του τετραεδρικού και υπάρχουν άτομα οξυγόνου στις κορυφές). Οι δομικές συνδέσεις, που ενώνουν τις αλυσίδες, σχηματίζουν πιο σταθερά οξέα πολυσιλικόνης:
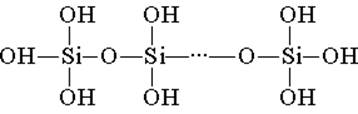
Η σύνθεση μιας τέτοιας ένωσης μπορεί να εκφραστεί από τον τύπο (H2Si03) η. Ωστόσο, το πυριτικό οξύ αντιπροσωπεύεται συνήθως από τον τύπο H2SiO3. H2SiO3 - το οξύ είναι πολύ αδύναμο, ελάχιστα διαλυτό στο νερό. Όταν θερμαίνεται, αποσυντίθεται εύκολα με τον ίδιο τρόπο όπως το ανθρακικό οξύ:
Όλα τα πυριτικά οξέα είναι πολύ αδύναμα (ασθενέστερα από τον άνθρακα).
Πυριτικά άλατα. Τα άλατα όλων των πυριτικών οξέων ονομάζονται πυριτικά άλατα, αν και, κατά κανόνα, στην εκπαιδευτική βιβλιογραφία, τα πυριτικά άλατα υποδηλώνουν άλατα μετακρυσταλλικού οξέος. Η σύνθεσή τους αντιπροσωπεύεται συνήθως από τον τύπο με τη μορφή ενώσεων των οξειδίων των στοιχείων. Για παράδειγμα, το πυριτικό ασβέστιο CaSiO3 μπορεί να εκφραστεί ως: CaO × SiO2.
Τα πυριτικά της σύνθεσης R2OxnSiO2, όπου το R2O είναι οξείδια νατρίου ή καλίου, ονομάζονται διαλυτά γυαλιά και τα συμπυκνωμένα υδατικά διαλύματα τους ονομάζονται υγρά γυαλιά. Το πιο σημαντικό είναι το διαλυτό στο νάτριο γυαλί.
Όταν στέκεται στον αέρα, τα διαλύματα των πυριτικών αλάτων αναπτύσσονται θολά, δεδομένου ότι το διοξείδιο του άνθρακα (IV) στον αέρα μετατοπίζει το πυριτικό οξύ από τα άλατά του:
Το πυριτικό οξύ είναι πρακτικά αδιάλυτο στο νερό - αυτή η ιδιότητα χρησιμοποιείται ως ποιοτική αντίδραση στο ιόν SiO32-.
Τα πυριτικά άλατα λαμβάνονται με τήξη πυριτίας με αλκάλια ή ανθρακικά άλατα:
Διαλυτότητα σε πυριτικό οξύ και ο ρυθμός διάλυσης εξαρτάται από διάφορους παράγοντες, εκ των οποίων οι σημαντικότερες είναι η τροποποίηση του διοξειδίου του πυριτίου που έχει ληφθεί, ο βαθμός διασποράς και η θερμοκρασία. Όταν ανακινείται κολλοειδές πήγμα διοξειδίου του πυριτίου με νερό, η ισορροπία διαλυτότητας καθιερώνεται σε λίγες ώρες · στην περίπτωση του χαλαζία χρειάζονται πολλοί μήνες και ακόμη και χρόνια.
ΦΥΣΙΚΑ ΠΥΡΗΝΙΚΑ (από το λατινικό σιλικόνη, το γένος, το πυριτικό οξύ, το φυσικό πυριτικό άλας, το φυσικό πυριτικό άλας, το φυσικό πυριτικό άλας και το πυριτικό νάτριο), μια κατηγορία ανόργανων αλάτων, πυριτικών, ισο - και ετεροπολυκρυσταλικών οξέων. Το μερίδιο των φυσικών πυριτικών αλάτων αντιπροσωπεύει το 75% της μάζας του φλοιού της γης και περίπου το 25% των ορυκτών ειδών. Στη φύση, είναι γνωστά περισσότερα από 700 φυσικά πυριτικά άλατα, συμπεριλαμβανομένων των σημαντικότερων ορυκτών που σχηματίζουν πετρώματα (άστριες, πυροξένη, αμφιβολίες, μίκας κ.λπ.)
Αργιλιοπυριτικά - μια ομάδα φυσικών και συνθετικών πυριτικών, τα σύνθετα ανιόντα των οποίων περιέχουν πυρίτιο και αλουμίνιο. Παραδείγματα σύνθετων ανιόντων: -, -, 2 -. Τα Na +, K +, Mg2 +, Ca2 +, και μερικές φορές τα Ba2 + και Li + δρουν ως κατιόντα.
Τα φυσικά αργιλοπυριτικά είναι τα πιο κοινά μέταλλα, αντιπροσωπεύουν μέχρι και το 50% της μάζας του φλοιού της γης. Αυτές περιλαμβάνουν τους άστρους (αλβίτη, ορθοκλάση, ανόρτη), ορυκτά αργίλου και μαρμαρυγία.
Ζεόλιθοι - Πρόκειται για υδατικά αργιλοπυριτικά άλατα ασβεστίου, νατρίου, καλίου, βάριου και ορισμένα άλλα στοιχεία. Η ομάδα ζεολίθων περιλαμβάνει περισσότερα από σαράντα ορυκτά, τα οποία διαφέρουν στη σύνθεση (ιδιαίτερα στον αριθμό των μορίων ύδατος στο κρυσταλλικό ένυδρο) και φυσικά στις φυσικές και χημικές ιδιότητες. Αλλά σχεδόν όλοι οι εκπρόσωποι αυτής της ομάδας ορυκτών έχουν κοινή ιδιοκτησία - είναι καλά προσροφητικά, διαθέτουν ιδιότητες ανταλλαγής ιόντων, μπορούν να αλλάξουν την κινητικότητα των μεμονωμένων ιόντων και να λειτουργήσουν ως μοριακά κόσκινα. Και σχετικά πρόσφατα, αυτά τα ορυκτά έχουν βρει μια εντελώς απροσδόκητη χρήση - άρχισαν να χρησιμοποιούνται στη γεωργία.
Οργανοπυριτικές ενώσεις - ενώσεις στα μόρια των οποίων υπάρχει δεσμός μεταξύ πυριτίου και ατόμων άνθρακα. Οι ενώσεις οργανοπυριτίου ονομάζονται μερικές φορές σιλικόνες, από τη λατινική ονομασία πυριτίου "πυρίτιο". Οι οργανοπυριτικές ενώσεις χρησιμοποιούνται για την παραγωγή λιπαντικών, πολυμερών, ελαστικών, καουτσούκ, υγρών σιλικόνης και γαλακτωμάτων. Οι ενώσεις οργανοπυριτίου χρησιμοποιούνται σε καλλυντικά, οικιακά χημικά, χρώματα και βερνίκια, απορρυπαντικά. Διακριτικό χαρακτηριστικό τα προϊόντα που βασίζονται σε ενώσεις οργανοπυριτίου από προϊόντα που βασίζονται σε κοινές οργανικές ενώσεις είναι, κατά κανόνα, υψηλότερες επιδόσεις και χαρακτηριστικά, καθώς και η ασφάλεια της ανθρώπινης χρήσης. Τα πολυμερή σιλικόνης μπορούν να χρησιμοποιηθούν για τη δημιουργία καλουπιών στο μαγείρεμα. Ο πολυμερισμός των ενώσεων οργανοπυριτίου και των στεγανωτικών είναι ασφαλής για τον άνθρωπο και δεν απαιτεί εξαγωγή.
Σιλοξάνες - ενώσεις που περιέχουν εναλλασσόμενα άτομα πυριτίου και οξυγόνου σε ένα μόριο. Τα υψηλότερα έχουν σιλοξάνες υψηλού μοριακού βάρους - πολυοργανοσιλοξάνια. βλέπε πολυμερή σιλικόνης.
Σιλικόνες (πολυοργανοσιλοξάνια) - οξυγονωμένες ενώσεις οργανοπυριτίου υψηλού μοριακού βάρους με χημικό τύπο η, όπου R = οργανική ομάδα (μεθύλιο, αιθύλιο ή φαινύλιο). Τώρα ο ορισμός αυτός σπάνια προσκολλάται και οι πολυοργανοσιλοξάνες (για παράδειγμα, σιλικόνες τύπου PMS, αντιδραστήρια νερού τύπου NGL ή ελαφρά κολλοειδή SKTN ελαστικά) και ακόμη μονομερή οργανοπυριτίου (διάφορα σιλάνια) συνδυάζονται επίσης σε «σιλικόνες», διαγράφοντας τη διάκριση μεταξύ «σιλικόνης» και «σιλικόνης», σιλικόνη ".
Μεταλλικό πυρίτιο  Κρυσταλλικό πυρίτιο
Κρυσταλλικό πυρίτιο
Πυριτίου (Si). Αυτό το χημικό στοιχείο είναι το 1/4 της σύνθεσης του φλοιού της γης. Χαλαζία, πετρώδες κρύσταλλο, άμμος, άργιλος, γρανίτης, μαρμαρυγία, αμίαντος - όλα αυτά χημικές ενώσεις πυριτίου
Το πυρίτιο είναι ένα ενδιάμεσο στοιχείο (αμφοτερικό) και μπορεί να παρουσιάζει τόσο μεταλλικές όσο και μη μεταλλικές ιδιότητες. Μπορεί να σχηματίζει χημικές ενώσεις, τόσο με μέταλλα όσο και με μη μέταλλα.
Καθαρό πυρίτιο - μια χημικά απλή ουσία γκρίζου χρώματος, σκληρή, ανθεκτική και εύθρυπτη. Κρυσταλλικό πυρίτιο Έχει μεταλλική λάμψη και χρησιμοποιείται ευρέως στη βιομηχανία ημιαγωγών (είναι ημιαγωγός).
Το πυρίτιο μπορεί να τεντωθεί όπως σε κρυσταλλική κατάσταση ( κρυσταλλικό πυρίτιο) και στην άμορφη κατάσταση ( άμορφο πυρίτιο). Το κρυσταλλικό πυρίτιο σχηματίζεται με ψύξη διαλύματος άμορφου πυριτίου σε τετηγμένο μέταλλο. Με τη σειρά του, το κρυσταλλικό πυρίτιο είναι ένα πολύ εύθραυστο υλικό και συνθλίβεται εύκολα σε μια άμορφη σκόνη. Έτσι, άμορφο πυρίτιο είναι ένα θραύσμα κρυστάλλων κρυσταλλικού πυριτίου.
Στην ελεύθερη κατάσταση, το πυρίτιο είναι αρκετά δύσκολο να επιτευχθεί. Η βιομηχανική παραγωγή του συνδέεται με την ανάκτηση του χαλαζία, χημικός τύπος που - SiO 2, η αντίδραση μείωσης παράγεται από θερμό κωκ (άνθρακας).
Si02 + C → C02 + Si
Στο εργαστήριο, το καθαρό πυρίτιο μειώνεται από την πυριτική άμμο με μεταλλικό μαγνήσιο χρησιμοποιώντας την ακόλουθη αντίδραση:
Si02 + 2Μg · Si + 2MgO.
Κατά τη διάρκεια αυτής της αντίδρασης, σχηματίζεται μία καφέ σκόνη από άμορφο πυρίτιο. Όταν θερμαίνεται, η σκόνη μπορεί να αντιδράσει βραδέως με συμπυκνωμένα διαλύματα αλκαλίων (για παράδειγμα, υδροξείδιο του νατρίου ΝθΟΗ)
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2, - η προκύπτουσα πολύπλοκη ουσία - επίσης αποκαλείται υγρό γυαλί.
Είναι ενδιαφέρον ότι η χημική δραστηριότητα του πυριτίου εξαρτάται από το μέγεθος των κρυστάλλων του. Το συν-κρυσταλλικό πυρίτιο είναι λιγότερο χημικά δραστικό από το άμορφο. Η τελευταία αντιδρά εύκολα με φθόριο ακόμα και σε συνηθισμένη θερμοκρασία και σε θερμοκρασία 400-600 ° C αντιδρά με οξυγόνο, χλώριο, βρώμιο, θείο για να σχηματίσει τις αντίστοιχες χημικές ενώσεις. Σε πολύ υψηλές θερμοκρασίες, το πυρίτιο αντιδρά με άζωτο και άνθρακα για να σχηματίσει, αντίστοιχα, νιτρίδιο και καρβίδιο του πυριτίου.
Αν προσπαθήσετε να διαλύσετε το πυρίτιο σε ένα μείγμα υδροφθορικού HF (υδροφθορικού) και νιτρικού HNO 3 οξέων, τότε η αντίδραση δεν θα συνεχιστεί. Αλλά αν διεξάγετε μια χημική αντίδραση με ένα αλκάλιο, για παράδειγμα, με υδροξείδιο του καλίου, τότε η αντίδραση θα λάβει χώρα με το σχηματισμό ενός άλατος του πυριτικού οξέος
Si + ΚΟΗ → Κ2SiΟ3 + Η2
Αν φρυγανισθεί στον κλίβανο πυριτίου (άμμος) με κωκ, αποδειχθεί μια πολύ στερεή κρυσταλλική ουσία. Carborundum SiC
SiO2 + 3C → SiC + 2CO
Carborundum - πολύ σκληρή και πυρίμαχη ουσία. Στη βιομηχανία, παράγεται σε μεγάλες ποσότητες λόγω αυτών των ιδιοτήτων. Είναι ενδιαφέρον ότι το κρυσταλλικό πλέγμα Carborundum είναι παρόμοιο με το πλέγμα της σκληρότερης ουσίας - διαμάντι, αλλά σε αυτό τα άτομα άνθρακα αντικαθίστανται ομοιόμορφα από άτομα πυριτίου.
Σε υψηλές θερμοκρασίες, καθώς και κατά τη διάρκεια χημικών αντιδράσεων υπό την επίδραση οξέων σε μεταλλικές ενώσεις με πυρίτιο, σιλανίου SiH 4.
Σιλάνη - είναι ένα αυτοφωτιστικό άχρωμο αέριο. Μπορεί να αναφλεγεί στον αέρα για να σχηματίσει διοξείδιο του πυριτίου και νερό.
SiH4 + 2O2\u003e → Si02 + 2H20
Εάν το οξείδιο του πυριτίου SiO2 θερμαίνεται παρουσία άνθρακα σε ρεύμα χλωρίου, λαμβάνει χώρα χημική αντίδραση με το σχηματισμό χλωριούχου πυριτίου
Si02 + 2C + 2Cl2 + SiCl4 + 2CO
Χλωριούχο πυρίτιο - είναι υγρό, η θερμοκρασία ζέσεως του οποίου είναι μόνο 54 0 C. Το χλωριούχο πυρίτιο διαλύεται εύκολα σε νερό με το σχηματισμό διαλύματος δύο οξέων: πυριτικό και υδροχλωρικό
SiCl4 + H20 - H2SiO3 + HCl
Αν αυτή η χημική αντίδραση προχωρήσει σε ατμόσφαιρα υγρού αέρα, θα εμφανιστεί πυκνός καπνός κατά τη διάρκεια του σχηματισμού δύο οξέων.
Φθοριούχο πυρίτιο SiF 4 - που σχηματίζεται ως αποτέλεσμα μιας χημικής αντίδρασης του υδροφθορικού οξέος και του οξειδίου του πυριτίου
Si02 + 4HF - SiF4 + 2Η2Ο
Το φθοριούχο πυρίτιο είναι ένα άχρωμο αέριο με "ισχυρή" οσμή. Εκτός από το χλωριούχο πυρίτιο, στο νερό αυτό το αέριο σχηματίζει δύο οξέα: πυρίτιο και υδροφθορικό. Ενδιαφέρον όμως είναι ότι το φθοριούχο πυρίτιο μπορεί να αλληλεπιδράσει με το υδροφθορικό οξύ για να σχηματιστεί εξαφθοροπυριτικό οξύ του οποίου η χημική φόρμουλα είναι H 2 SiF 6. Τα άλατά της και το ίδιο το οξύ είναι δηλητηριώδη.
Πυριτίου
Βασικά μέταλλα και μη μέταλλα
Σε αυτό το μάθημα θα μελετήσετε το θέμα του "Silicon". Εξετάστε τις πληροφορίες σχετικά με το πυρίτιο: την ηλεκτρονική του δομή, όπου το πυρίτιο είναι στη φύση, τη μελέτη της αλλοτροπίας του πυριτίου, την εξήγηση του φυσικού και του χημικές ιδιότητες. Μάθετε πού χρησιμοποιείται πυρίτιο στη βιομηχανία και σε άλλες περιοχές, πώς παράγεται. Θα γνωρίσετε την πυριτία, το πυριτικό οξύ και τα άλατά του - τα πυριτικά άλατα.
Θέμα: Βασικά μέταλλα και μη μέταλλα
Μάθημα: Σιλικόνη. Ευγενή αέρια
Το πυρίτιο είναι ένα από τα πιο κοινά χημικά στοιχεία του φλοιού της γης. Το περιεχόμενό της είναι σχεδόν 30%. Στη φύση, βρίσκεται κυρίως στη μορφή διαφόρων μορφών διοξειδίου του πυριτίου, πυριτικών και αργιλοπυριτικών.
Το πυρίτιο είναι τετρασθενές σε σχεδόν όλες τις ενώσεις του. Σε αυτή την περίπτωση, τα άτομα πυριτίου είναι στην διεγερμένη κατάσταση. Το Σχ. 1.
Για να μπει σε αυτή την κατάσταση, ένα από τα ηλεκτρόνια των 3s καταλαμβάνει μια κενή θέση στις τροχιές 3ρ. Στην περίπτωση αυτή, αντί για 2 μη συζευγμένα ηλεκτρόνια στην κατάσταση εδάφους, το άτομο πυριτίου στην διεγερμένη κατάσταση θα έχει 4 μη συζευγμένα ηλεκτρόνια. Θα είναι σε θέση να σχηματίσει 4 ομοιοπολικούς δεσμούς μέσω του μηχανισμού ανταλλαγής.


Τα άτομα πυριτίου δεν είναι επιρρεπή στον σχηματισμό πολλαπλών δεσμών, αλλά σχηματίζουν ενώσεις με απλούς δεσμούς -Si-O-. Το πυρίτιο, σε αντίθεση με τον άνθρακα, δεν είναι χαρακτηριστικό της αλλοτροπίας.
Ένα από τα αλλοτροπική τροποποίηση είναι το κρυσταλλικό πυρίτιοστην οποία κάθε άτομο πυριτίου είναι σε sp3 υβριδοποίηση. Το Σχ. 2, 3. Το κρυσταλλικό πυρίτιο είναι μια στερεή, πυρίμαχη και ανθεκτική κρυσταλλική ουσία σκούρου γκρι με μεταλλική λάμψη. Υπό κανονικές συνθήκες - ένα ημιαγωγό. Μερικές φορές, το άμορφο πυρίτιο εκπέμπεται επίσης ως άλλη αλλοτροπική τροποποίηση του πυριτίου. Είναι μια σκούρα καφέ σκόνη, πιο χημικά ενεργή από το κρυσταλλικό πυρίτιο. Είτε πρόκειται για μια αλλοτροπική τροποποίηση είναι ένα σημείο αμφισβήτησης.
Χημικές ιδιότητες του πυριτίου
1. Αλληλεπίδραση με αλογόνα
Si + 2F2 - SiF4
2. Όταν θερμαίνεται, πυρίτιο καίει σε οξυγόνο, σχηματίζεται σίλικα (IV).
Si + O2 → SiO2
3. Σε υψηλές θερμοκρασίες, το πυρίτιο αλληλεπιδρά με άζωτο ή άνθρακα.
3Si + 2N2 → Si3N4
4. Το πυρίτιο δεν αντιδρά με υδατικά διαλύματα οξέων. Αλλά διαλύεται σε αλκάλια.
Si + 2NaOH + H20 - Na2SiO3 + 2H2
5. Όταν το πυρίτιο συντήκεται με μέταλλα, σχηματίζονται πυριτίδια.
Si + 2Mg · Mg2Si
6. Το πυρίτιο δεν αλληλεπιδρά άμεσα με το υδρογόνο, αλλά οι ενώσεις υδρογόνου του πυριτίου μπορούν να ληφθούν με την αλληλεπίδραση των πυριτιδίων με το νερό.
Mg2Si + 4H2O → 2Mg (ΟΗ) 2 + SiH4 (σιλανίου)
Τα σιλάνια έχουν παρόμοια δομή με τα αλκάνια, αλλά είναι αρκετά δραστικά. Το πιο σταθερό μονοσιλάνιο είναι εύφλεκτο στον αέρα.
SiH4 + 2O2 → Si02 + 2H20
Λήψη πυριτίου
Το πυρίτιο λαμβάνεται με αναγωγή από οξείδιο του πυριτίου (IV)
Si02 + 2Μg · Si + 2MgO
Ένα από τα καθήκοντα είναι η λήψη πυριτίου υψηλής καθαρότητας. Για το σκοπό αυτό, το τεχνικό πυρίτιο μεταφέρεται σε τετραχλωριούχο πυρίτιο. Το προκύπτον τετραχλωρίδιο ανάγεται σε σιλάνιο και το σιλάνιο αποσυντίθεται σε πυρίτιο και υδρογόνο όταν θερμαίνεται.
Το πυρίτιο είναι ικανό να σχηματίσει δύο οξείδια: SiO 2 - οξείδιο του πυριτίου (IV) και SiO - οξείδιο του πυριτίου (II).
SiΟ - οξείδιο του πυριτίου (ΙΙ) - Αυτή είναι μια άμορφη σκούρα καφέ ουσία, η οποία σχηματίζεται από την αλληλεπίδραση του πυριτίου με το οξείδιο του πυριτίου (IV)
Si + Sio 2 → 2 Sio.
Παρά τη σταθερότητά του, η ουσία αυτή δεν χρησιμοποιείται σχεδόν ποτέ.
SiO 2 - οξείδιο του πυριτίου (IV)


Η ουσία αυτή αντιπροσωπεύει το 12% του φλοιού της γης. Το Σχ. 4. Εκπροσωπείται από τέτοια ορυκτά όπως κρυστάλλινα πετρώματα, χαλαζία, αμέθυστο, κιτρίν, ιασέπτης, χαλκηδόνια. Το Σχ. 5
SiO 2 - οξείδιο του πυριτίου (IV) - μια ουσία μη μοριακής δομής.
Το κρυσταλλικό του πλέγμα είναι ατομικό. Το Σχ. 6. Οι κρύσταλλοι SiO2 έχουν τη μορφή τετραεδριού, οι οποίοι αλληλοσυνδέονται με άτομα οξυγόνου. Ο τύπος του μορίου (SiO2) n θα ήταν πιο σωστός. Δεδομένου ότι το SiO 2 σχηματίζει μια ουσία ατομικής δομής και το CO 2 - μιας μοριακής δομής, η διαφορά στις ιδιότητές τους είναι προφανής. Το CO 2 είναι ένα αέριο και το SiO2 είναι μια στερεή διαφανής κρυσταλλική ουσία, αδιάλυτη στο νερό και ανθεκτική.
Χημικές ιδιότητεςSiΠερίπου 2
1. Το οξείδιο πυριτίου (IV) Si02 είναι οξείδιο οξέος. Δεν αντιδρά με το νερό. Το πυριτικό οξύ δεν μπορεί να ληφθεί με την ενυδάτωση του Si02. Τα άλατά του, πυριτικά άλατα, μπορούν να ληφθούν με αντίδραση του Si02 με διαλύματα θερμού αλκαλίου.
SiO2 + 2NaOH Na2SiO3 + Η2Ο
2. Αντιδρά με ανθρακικά αλκαλίων και αλκαλικών γαιών.
CaCO3 + Si02 CaSi03 + CO2
3. Αλληλεπίδραση με μέταλλα.
Si02 + 2Μg · Si + 2MgO
4. Αντίδραση με υδροφθορικό οξύ.
Si02 + 4HF - SiF4 + 2Η2Ο
SiF4 + 2HF → Η2
Χημικές ιδιότητες πυριτικού οξέος και πυριτικών αλάτων
Λαμβάνοντας πυριτικό οξύ
Το πυριτικό οξύ καθιζάνει ως πολυμερική ένωση. Τύποι πυριτικού οξέος -
H 2 SiO 3 (μορφή μετα) και H4SiO4 (ορθομορφή) - αντικατοπτρίζουν την αναλογία των στοιχείων, αλλά όχι την πραγματική σύνθεση. Συμβατικά, στο επίπεδο, η σύνθεση του πυριτικού οξέος απεικονίζεται ως Σχ. 7
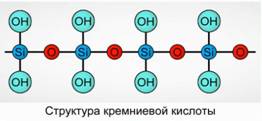
Για το πυριτικό οξύ, χρησιμοποιείται πάντα ο τύπος H2SiO3.
1. H 2 Sio 3 αποσυντίθεται όταν θερμαίνεται
Η2SiO3H2O + Si02 (πήγμα πυριτίας)
2. Αλληλεπίδραση με αλκαλικά διαλύματα
H2SiO3 + 2NaOH Na2SiO3 + 2H2O
Άλατα πυριτικού οξέος - πυριτικά άλατα - αναφέρονται σε ιονικές ενώσεις. Πρόκειται για στερεές άχρωμες ουσίες. Μόνο τα πυριτικά αλκαλιμετάλλου, εκτός από το λίθιο, είναι διαλυτά στο νερό.
1. Τα διαλυτά πυριτικά άλατα υδρολύονται με ανιόν
Na2SiO3 + H203 NaHSi03 + NaOH
2. Διαλυτά πυριτικά άλατα αλληλεπιδρούν με ισχυρά οξέα.
Na2SiO3 + 2HCl · H2SiO3 ↓ + 2NaCl
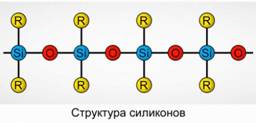
Πολυοργανοσιλοξάνια (σιλικόνες)
Τα πολυοργανοσιλοξάνια (σιλικόνες) είναι οξυγονούχες ενώσεις οργανοπυριτίου υψηλού μοριακού βάρους.
R 2 [ Sio] n
Το R είναι μία οργανική ομάδα (μεθύλιο, αιθύλιο ή φαινύλιο). Η βάση της δομής των σιλοξανών είναι μια αλυσίδα εναλλασσόμενων ατόμων πυριτίου και οξυγόνου. Εικ.8. Μεταβάλλοντας το μήκος της αλυσίδας και των οργανικών ομάδων, μπορούν να ληφθούν σιλικόνες με διαφορετικές ιδιότητες. Αλλάζοντας τις συνθήκες πολυμερισμού, μπορείτε να πάρετε μόρια διαφορετικών μηκών.


Τα πολυμερή μικρής αλυσίδας είναι υγρά, τα μακρύτερα είναι πολύτιμα λιπαντικά. Το Σχ. 9, οι οποίες διατηρούν τις ιδιότητές τους σε τεράστιο εύρος θερμοκρασιών από
100 0 C έως + 300 0 С. Μεγαλύτερα μόρια σχηματίζουν ελαστικά που δεν χάνουν την ελαστικότητά τους σε χαμηλές θερμοκρασίες. Έχουν υψηλή αντοχή στην τριβή, είναι χημικά αδρανείς. Το Σχ. 10. Προκαλεί διάφορες παραλλαγές της εφαρμογής τους. Μπορούν να χρησιμοποιηθούν για τη δημιουργία τεχνητών καρδιακών ή νεφρικών μηχανών και μπορούν να χρησιμοποιηθούν ως παπούτσια για παπούτσια. Τα πολυμερή σιλοξανίου χρησιμοποιούνται στην ιατρική για τη δημιουργία διαφόρων εμφυτευμάτων μαλακών μορίων, εφόσον αυτά τα πολυμερή είναι χημικά αδρανή και δεν απορρίπτονται από το σώμα. Δεν υγραίνονται με νερό. Χρησιμοποιείται σε κρέμες. Όταν εφαρμόζετε αυτή την κρέμα στα χέρια του, θα αντικαταστήσει τα γάντια από καουτσούκ.
Ανόργανη Κήπος
Σε ένα διαφανές ποτήρι γεμάτο με πυριτικό νάτριο, βυθίστε τους κρυστάλλους χρωματισμένων αλάτων, για παράδειγμα, θειικού χαλκού. Μετά από κάποιο χρονικό διάστημα, μπορεί να φανεί ότι οι κοίλοι σωλήνες που σχηματίζονται από τους κρυστάλλους, που αποτελούνται από αδιάλυτα πυριτικά άλατα. Το Σχ. 11

Να πάρει "ανόητο" στόκο
Ίσες ποσότητες πυριτικού νατρίου και ιατρικής αλκοόλης αναμειγνύονται. Το ίζημα διηθείται και συμπιέζεται έτσι ώστε να μην στάζει αλκοόλη. Αυτό είναι στόκος. Το Σχ. 12. Ονομάστηκε έτσι επειδή σχεδιάστηκε να το χρησιμοποιήσει ως στόκος για τα παράθυρα. Αλλά αποδείχθηκε ότι έχει τέτοιες ιδιότητες που δεν θα μπορούσαν να χρησιμοποιηθούν για τον επιδιωκόμενο σκοπό. Αν κυλάτε την μπάλα και την πετάξετε στο πάτωμα, θα αναπηδήσει σαν μπάλα από καουτσούκ. Εάν βρεθεί στο τραπέζι, θα εξαπλωθεί σαν υγρό. Εάν χτυπήσετε ένα στερεό αντικείμενο, θα σπάσει σαν ένα συμπαγές σώμα. Μετά από λίγο, όταν το αλκοόλ στεγνώνει, αυτό το στόκος θα καταρρεύσει.
![]()
Συνοψίζοντας το μάθημα
Στο μάθημα αυτό, έχετε μελετήσει το θέμα "Σιλικόνη". Εξετάσαμε πληροφορίες σχετικά με το πυρίτιο: την ηλεκτρονική του δομή, όπου βρίσκεται το πυρίτιο στη φύση, μελετούσε την αλλοτροπία του πυριτίου, εξήγησε τις φυσικές και χημικές του ιδιότητες. Έμαθαν για το πού χρησιμοποιείται πυρίτιο στη βιομηχανία και σε άλλες περιοχές, πώς παράγεται. Συναντήσατε με πυρίτιο, πυριτικό οξύ και τα άλατά του - πυριτικά άλατα.
Αναφορές
1. Rudzitis G.E. Χημεία. Βασικά στοιχεία της γενικής χημείας. Βαθμός 11: βιβλίο για τα εκπαιδευτικά ιδρύματα: βασικό επίπεδο / G.E. Rudzitis, F.G. Feldman. - 14η έκδ. - Μ.: Διαφωτισμός, 2012.
2. Popel P.P. Χημεία: 8 cl .: Εγχειρίδιο για τα σχολεία δευτεροβάθμιας εκπαίδευσης / PP. Popel, L.S. - К.: ИЦ "Ακαδημία", 2008. - 240 σελίδες: Ill.
3. Gabrielyan O.S. Χημεία. 11η τάξη. Βασικό επίπεδο. 2η έκδοση, Sr. - Μ.: Drofa, 2007. - 220 σ.
Εργασία στο σπίτι
1. №№2-4 (σελ. 138) Rudzitis G.E. Χημεία. Βασικά στοιχεία της γενικής χημείας. Βαθμός 11: βιβλίο για τα εκπαιδευτικά ιδρύματα: βασικό επίπεδο / G.E. Rudzitis, F.G. Feldman. - 14η έκδ. - Μ.: Διαφωτισμός, 2012.
2. Ποιες είναι οι εφαρμογές των πολυοργανοσιλοξανών.
3. Συγκρίνετε τις ιδιότητες των αλλοτροπικών τροποποιήσεων του πυριτίου.
