التفاعلات المكافئة ، والتي تميز قوة حمض الهيدروكلوريك المخفف. قائمة فحوصات التغذية من الانضباط
سطح Pochorninya من اللوحات القديمة ، التي رسمها olynyi farbs ، إلى المستودع ، والتي تشمل الرصاص bilil (PbCO3) ، المرتبطة ببيانات كبريتيد الرصاص الحديدي (II) من خلال ظهور الماء في الغلاف الجوي. إذا قمت بتغطية السطح ببيروكسيد الماء ، فعندئذ يتم إنشاء التفاعل مع كبريتات الرصاص (II) باللون الأبيض:
PbS + 4H2 O2 = PbSO4 + 4H2 O.
بهذه الطريقة لاستعادة الصور القديمة التي رسمها أولينيي فابس.
Zasosuvannya kisnyu و sirki
مساحة تخزين الطعام يمثلها الطفل 61.
تسمح ل vikoristovuvati yogo بالعدوى اشرب ماءتلك المياه العادمة الصناعية الأجنبية ؛ كمطهر في الطب. سينتصر الأوزون نتيجة الانصباب.
نبيذ لإنتاج الأحماض الكحوليّة ، وتحضير السرنك ، وحرائق البنغال ، والنضال مع تلاميذ المدارس في ولاية سيلسكوي ، ولمساعدة الأطفال الذين يعانون من الأمراض. سيركا لمعرفة تخزين غومي ، بارفنيك والأصباغ ، قطع الألياف ، لومينوفورز وفي.
صغير. 61- Zasosuvannya sisnyu

بالنسبة للحموضة في نصف الوقت ، فإن أكثر خطوات الأكسدة المميزة هي -2 ، وتتأكسد ذرات الكبريت والسيلينيوم والتيلورو بخطوات –2 و +2 و +4 و +6.
تتجلى أكسدة القوة والحموضة في تفاعلاتهم مع المعادن والماء والأفعال وغير المعادن.
امدادات الطاقة والامدادات
1. قم بتخزين الصيغ spoluk kisnyu s kalієm و kaltsm و alumіnієm. قدمي خطوات عنصر الجلد المؤكسد وسميه يوميًا.
2. حماية الجزء الأكبر من سيركا في كبريتيد الألومنيوم.
3. اسم "كيسين" -الأكسجين يعني "حمض scho roozhuє". أكتب الصيغ الكيميائية vіdomih لك ، إلى المستودع الذي يتم وضع العنصر فيه. أحماض الاسم.
4. ما هي التعديلات المتباينة التي تعرفها؟ ما هي الروائح الكريهة التي تأتي من نوع واحد من شيء واحد؟
5. يُفقد كيسن ، الذي يستنشقه الناس ، مع الهيموجلوبين في الدم. على ما يبدو ، تُعطى كتلة الهيموغلوبين البالغة 1 جم بالحجم (n.u.) 1.35 سم 3. بدلا من الهيموجلوبين في دم الأشخاص الأصحاء 140 جم / دسم 3. حجم دم Zagalny - 6 dm3. حماية كيمياء الحموضة ، حيث يمكنك الاعتماد على دماء الناس.
6. جزء كتلة Visnaznite من حمض الهيدروكلوريك في النطاق ، مقطوع عند توزيع الماء في الحجم (n.u.) 8.96 dm 3 في ماء مع ماسويو 500 جم.
7. أداء Razstavte في المخططات الهجوميةتفاعلات الأكسيد الأساسية:
أ) H2 S + Cl2 + H2 O → H2 SO4 + HCl ؛ ب) H2 S + Br2 → S + HBr ؛
ج) H2 S + O2 → S + H2 O.
لديك تفاعلات الجلد للأكسدة والسيطرة.
§ 39. Kisnevmіsnі spoluki sіrki
لديك مرحلة الأكسدة s'єdnannyakh sirka viyavlyaє+4 і +6.
أكسيد سيركا (IV). حمض نقي
أكسيد رمادي (IV) - SO2 (غاز نظيف) - غاز خالي من الشريان ذو رائحة نفاذة يحدث أثناء الماء الساخن:
S + O2 = t SO2.

بعض الذين وجدوا الركود تم ربطهم بالحجارة في عروق دهنية يمكن أن تحترق. ياك يكتب المؤرخ القديم بليني الأب من القرن الأول إلى الصوت. أي ، "يمكن لرائحة نار النار أن تحافظ على كل أنواع التعويذات وتطرد أي قوة نجسة". قوة المطهر والمبيد للجراثيم لأكسيد المصل (IV) سوف تصبح شريرة في وقت واحد. يتم استخدام الغازات البيضاء في عملية معالجة الخضروات والفواكه والفاكهة لمنع تعفنها.
تصريف الغاز النظيف بالقرب من الماء (ما يصل إلى 40 حجمًا من ثاني أكسيد الكبريت لكل حجم واحد من الماء) - nestiyka ، قاعدة مزدوجة حمض سيركل yaka isnu tilki in roschini:
SO2 + H2 O H2 SO3.
الحمض النقي هو حمض ضعيف ، في اختلافات الماء ، غالبًا ما يتم فصله عن عبارات الهيدروكلفيت والكبريتيت:
H + + HSO - ، | - H + + SO 2–. |
||||
الحمض النقي هو قوة كيميائية ، zagalny للأحماض: التفاعل مع الأكاسيد الأساسية ، والقواعد ، والدخول في تبادل التفاعل مع أملاح الأحماض السفلية ، zokrem ، vitisnya من الأملاح ، حمض ضعيف:
Na2CO3 + H2SO3 = Na2SO3 + H2O + CO2.
أكسيد سيركي (السادس)
يوجد أكسيد سيركا (VI) ، أكسيد مصل مؤكسد (IV) موجود في وجود محفز عند درجات حرارة قريبة من 500 درجة مئوية:
ر ، قطة.
2SO + O −−−−− ← 2SO.
2 2 ←−−−−−3
بالنسبة للعقول الباهظة ، فإن Serky Oxide (VI) SO3 هو مصدر قاحل للمياه ، والذي يتحول عند درجات حرارة أقل من 17 درجة مئوية إلى كلمة بلورية. هذا أكسيد حمضي نموذجي ، يقوم ، بالاقتران مع الماء ، بتحويل حمض حمضي قوي:
SO3 + H2 O = H2 SO4.
حمض سيرشانا
الصيغة الرسومية هي نموذج لجزيء حمض الكبريتيك وتهدف إلى 62 قليلاً.
صغير. 62. صيغة ونموذج بياني لجزيء حمض الهيدروكلوريك
لديك قضايا التربية حمض سيرشانє إلكتروليت قوي ،
і її disoсіatsіyu تدوير مثل هذا:
H2 SO4 → 2Н + + SO4 2–.
القوة الفيزيائية لحمض الهيدروكلوريك
حمض Сірчана - مهم (قوة 1.83 جم / سم 3) ، زيتي ، عديم الحظائر ، عديم الرائحة. سوف يذهب فون إلى الماء في أي نوع من اللمحات.
يتم فرض عملية تحديد H2 SO4 بكمية كيميائية مقدارها 1 مول على مقدار 92 كيلو جول من الحرارة ، والتي يمكن تعديلها وفقًا لقيم التأثيرات الحرارية في التفاعلات الكيميائية. إن تصور كمية كبيرة من الحرارة أثناء تفاعل حمض الهيدروكلوريك والماء دليل على إنشاء مجهرية بكلمتين من هيدرات من النوع H2 SO4 n H2 O.
على سبيل المثال ، H2 SO4 · H2 O؛ H2 SO4 2H2 O ؛ H2 SO4 3H2 O إلخ.
يسمح الحمض والماء الجديد باستخدامه كعامل قوي لنقل الماء ، على سبيل المثال ، لتجفيف الغازات.
يمكن الإشراف على تطوير المبالغ في حالة انتشار حمض الهيدروكلوريك في الماء على شكل قوالب. اتذكرك لا يمكنك إضافة الماء إلى الحمض
دفعة ، متبوعة بخلط غير منقطع للمحلول ، صب الحمض في الماء.
السلطات المبتهجةحمض الستريك. سلفاتي
سلفاتي. حمض السيرشان المخفف كل شيء يميز أحماض القوة: التبادل مع المعادن ، التي تقف بين منتصف النشاط والماء ؛ أكاسيد مذبذبة أساسية وقواعد وأملاح. بشكل عام يوجد سولي: وسط -كبريتات ، على سبيل المثال K 2 SO 4 і حمض -
هيدروسلفات ، على سبيل المثال KHSO4.
يتم التخلص من معظم الكبريتات والكبريتات جيدًا بواسطة الماء ، وقد تمت الموافقة على الكثير منها بلورات... تسمى بلورات Deyaki من أملاح حمض الهيدروكلوريك والزجاج: الحمضيات الزجاجية CuSO4 ∙ 5H2 O ، الزاج الأبيض FeSO4 ∙ 7H2 O و ін.
من أجل تدهور الأحماض العضوية والأملاح عند مستويات المياه ، من الممكن تطوير مجموعة متنوعة من الأملاح:
Ba (NO3) 2 + Na2 SO4 = BaSO4 ↓ + 2NaNO3 ؛
Ba2 + SO4 2– = BaSO4 ↓.
نتيجة للتفاعل ، سيكون هناك حصار كبريتات الباريوم.
التفتيش المخبري 6
وصفة السلطات الكيميائية لحمض السيرشانويك المخفف
هناك خمسة أنابيب اختبار لاستخدامها: معدن (زنك أو حتى معدن على مقياس الاهتزاز) ، أكسيد قاعدي ، هيدروكسيد الصوديوم ، كربونات الصوديوم ، كلوريد الصوديوم. أعط قطرة من الفينول فثالين لهيدروكسيد الصوديوم وأعطها قطرة من القطرات. صب 1-2 سم 3 من الشراب المخفف في أنبوب اختبار الجلد. (Uvaga! التفاعل مع الأكسيد الرئيسي يتعارض مع القاعدة ، لتسريع الحمل الزائد بمقدار نصف الكحول).
ماذا تفعل؟ ما هي العلامات التي تدل على تجاوز التفاعلات الكيميائية؟ تخزين التفاعلات الكيميائية من وجهة النظر الجزيئية والأيونية. ماذا عن التفاعلات المؤكسدة - vidnovnoy التي قمت بها؟ لتدوين ملاحظة حول القوة الكيميائية لحمض السيرشانيك المخفف.
حمض السيرشان المركزє عامل مؤكسد قوي ، غير مخفف. مع تفاعل حمض السيرشانويك المركز
لا يمكن رؤية أي معدن.
ض المعادن ، التي تقف بجانب نشاط الماء (باستثناء الذهب والبلاتين) ، التفاعل ضد أكسيد serky (IV) SO المعتمد 2 :
Cu + 2H2 SO4 (conc) = t CuSO4 + SO2 + 2H2 O.
في التفاعل مع المعادن ، والتي تكون في نطاق النشاط حتى الماء ، يمكن تركيز تركيز الحمض إلى أكسيد الماء (IV) SO2 ، أو الماء S أو الماء H2S هو الشكل السائد لنشاط المعدن وتدفق التفاعل. على سبيل المثال:
4Zn + 5H2 SO4 (زعنفة) = t 4ZnSO4 + H2 S + 4H2 O.
Nagadaєmo ، scho zalizo ، الألمنيوم و deyakі іnshi ألقوا للعقول الشريرة لترعى بحمض السيرتشان المركز.
حمض syrchana المركز مفيد للتفاعل مع الكلمات البسيطة مع غير المعادن ، على سبيل المثال ، مع syrkoy:
S + 2H2 SO4 = t 3SO2 + 2H2 O.
مؤكسد الطي باجاتو spoluks العضوية، حمض sirchan obgorta الورق ، النسيج ، الخشب ، odyag التي shkiru. يحدث هذا مع حمض السيرشان المركز في التربه.
حمض السيرشان المركز مفيد لإزالة الأحماض والأملاح المتطايرة. على سبيل المثال:
NaCl (TV) + H2 SO4 (conc) = t NaНSO4 + حمض الهيدروكلوريك.
في جمهورية سيرشان بيلوروس ، يتم توزيع الحمض بواسطة ضريبة القيمة المضافة "مصنع جوميل خيميشني" ، ضريبة القيمة المضافة "جرودنو أزوت".
مناطق شرب الحامض
تظهر الرائحة لـ 63 قليلاً.
صغير. 63. ركود حامض الستريك
حمض Сірчана H2 SO4 - مهم ، بدون ريدين زيتي عديم الرائحة.
يتم تخفيف حمض سيرشان مع المعادن ، والتي تقف بين النشاط والماء ؛ أكاسيد المعادن أساسيات؛ من الأملاح.
عند التفاعل مع الأحماض والمعادن المركزة ، لا يمكن رؤية الماء.
لتلف الأحماض العضوية والأملاح عند مستويات الماء ، من الشرير تكوين أملاح الباريوم.
امدادات الطاقة والامدادات
1. اكتب معادلات أكاسيد وأحماض الكبريت الحمضية. أظهر لهم درجة أكسدة ذرات الماء.
2. ابحث عن كتلة السركى المحترقة بالحامض ، كما ترى فى الجبل 29.69 كيلو جول من الحرارة. هل كانت كمية جبنة من أكسيد السيركا (السادس) التي حصلت عليها؟ يصبح التأثير الحراري لتفاعل مكافحة الحرائق 296.9 كيلوجول / مول.
3. الجدول أكالة من الملح والأحماض والقواعد في الماء ، إضافة 2 تفاعلات متساوية من حمض الهيدروكلوريك والأملاح المخفف. اكتب الاسم
الخامس viglyad الجزيئية والأيونية.
4. قم بحماية الكتلة بهذه الكمية الكيميائية من شريط الكبريتات ، والتي يتم إعدادها عند تخفيفها بحمض الهيدروكلوريك لمحلول النترات ، بقضيب 200 جم ، جزء الكتلة من Ba (NO 3) 2 لكل طريق 10٪.
5. يرجى الرجوع إلى نص الفقرة على أساس التفاعل ، الذي يميز القوة الكيميائية لحمض الهيدروكلوريك المركز. تبدأ مراحل أكسدة ذرات الماء في الدولة. في تفاعل الجلد ، هو عامل مؤكسد.
6. حجم الياكي لحمض الهيدروكلوريك المركز (= 1.83 جم / سم 3) مع كسر كتلي من H2 SO4 98٪ ، الحل الضروري لكتلة 6.4 ص؟
7. زيادة كفاءة المخططات لبدء التفاعلات المؤكسدة الرئيسية:
أ) HBr + H2SO4 → Br2 + SO2 + H2O ؛ ب) CaSO4 → CaO + SO2 + O2 ؛
ج) K2 S + HClO → K2SO4 + حمض الهيدروكلوريك.
في تفاعل الجلد ، هو عامل مؤكسد.
§ 40. فهم طريقة تفاعل المنتج الكيميائي
تسمح الكيمياء ، المخزنة وفقًا لقانون الحفاظ على كتلة الكلام ، بتنفيذ razrahunki و zokryuvat massu و obsyag chihichnuyu نتاج التفاعل. في الممارسة العملية ، يتم عكس الكثير من ردود الفعل ، ويشارك جزء من الخطاب في نتائج التبخير أو الحل أو الموافقة على المنتجات الثانوية. يجب التأكيد على أن منتج التفاعل هذا أقل ، فلا يوجد الكثير مما يمكن رؤيته قبل تطوير تفاعل مماثل. في مثل هذا التصنيف ، إذا قبلنا نظريًا وزن المنتج للتفاعل المتساوي ، أو إذا كانت الكمية الكيميائية للمنتج هي 100٪ ، فعندئذٍ في العملية الحقيقية للانتقال إلى المنتج ستكون أقل من 100٪.
بداية رد الفعل على ناتج التفاعل هو حرف الأبجدية اليونانية (tsya) ويظهر في أجزاء من نفس الشيء.
نوع منتج تفاعل كيميائي هو قيمة باهظة الثمن لمنتج (حجم ، كمية كيميائية) لمنتج تم قطعه بالفعل إلى منتج (لمنتج ، كمية كيميائية) ، محسوبة للتفاعل
وفي جميع الأحوال سيُعرف أن أهمها لمنتج التفاعل الكيميائي. على سبيل المثال ، عند vidomo ، لتفاعل الأكسيد المؤكسد من serky (IV) لأكسيد serka (VI)
2SO2 + O2 2SO3
vikhid ليصبح 80٪ (أو 0.8) ، مما يعني ، حول أكسيد الرمادي (IV) بوزن 64 جم (حجم 22.4 dm3 ، كمية كيميائية 1 مول) وأكسيد رمادي مقبول (VI) مع a الوزن ليس 80 جم (حجم 22.4 dm3 ، الكمية الكيميائية 1 مول) ، والكتلة 80 جم ∙ 0.8 = 64 جم (الحجم 17.9 dm3 ، الكمية الكيميائية
من حجم البضائع إلى عملية العالم الحقيقي ، هناك حاجة لإدخال عمليات وعمليات إضافية.
من السهل رؤية صورة ارتباط المسبحة من مفهوم "الذهاب إلى نتاج التفاعل".
الأسهم 1. نتيجة تمليح السائل الرمادي بكتلة 48 جم ، تتم إزالة أكسيد الكبريت (IV) بحجم 28.6 dm3. انظر إلى منتج التفاعل.
م (ق) = 48 جم | 1. بصريًا عددًا جبنيًا من البذور ، |
||||
الخامس العملي (SO2) = 28.6 ديسيمتر مكعب | دخلت في رد فعل: | ||||
تصلب متعدد) | |||||
(SO2) =؟ | ن (ق) | ||||
السيدة) | 32 جم / مول |
||||
2. تفاعل المستودع لأكسيد serka (IV): S + O2 = SO2.
3. نحن نعرف الكمية النظرية لأكسيد السيركي (الرابع):
1 جزيء جرامي S - 1 جزيء جرامي SO2 ؛
1.5 مول S-1.5 مول SO2.
فهم مدخلات ناتج تفاعل كيميائي |
4. نحن نعرف التحليل النظري لأكسيد السيركي (الرابع):
مظهر V (SO2) = n نظرية (SO2) V m = 1.5 مول 22.4 مول / ديسيمتر 3 = 33.6 ديسيمتر مكعب.
5. Rozrakhumo vikhid لمنتج التفاعل:
الجواب: الاستجابة للدواء 85٪.
الملحق 2. حدد كتلة FeS2 المطلوبة لإزالة أكسيد السيركي (IV) بحجم 8.96 dm3 ، بحيث يصبح ناتج التفاعل 90٪.
الخامس (SO2) = 8.96 ديسيمتر مكعب | 1- التبادل النظري المهم بصريًا لأكسيد السيركي (IV): |
|||||||||||
(SO2) = 90٪ | الممارسة الخامسة | الممارسة الخامسة | ||||||||||
م (FeS2) =؟ | النجوم الخامس نظرية = | |||||||||||
نظرية V | ||||||||||||
Vtheor (SO2) = | ممارسة V (SO 2) | 8.96 ديسيمتر 3 | 9.56 ديسيمتر مكعب. |
||||||||||
2. نحن نعرف الكمية الكيميائية النظرية لأكسيد الرمادي (IV): |
||||||||||||
n theor (SO 2) | في ثور (SO 2) | 9.56 ديسيمتر مكعب | ||||||||||
22.4 ديسيمتر مكعب / مول |
||||||||||||
3. تفاعل المستودع مع أكسيد السيركا (IV) والكمية الكيميائية من البيريت التي يجب إعطاؤها إلى vipal:
x مول 0.4 مول
4FeS2 + 11O2 = 8SO2 + 2Fe2 O3 ، 4 مول 8 مول
س = 0.2 مول.
3. بحكم وزن البيريت الضروري للعضو vipal: m (FeS2) = 0.2 mol · 120 g / mol = 24 g.
اقتراح: لمراعاة أكسيد السيركا (IV) ، من الضروري أن تأخذ كتلة 24 جم.

نوع منتج تفاعل كيميائي هو قيمة باهظة الثمن لمنتج (مخزن العظام ، كمية كيميائية) لمنتج مقطوع بالفعل إلى منتج (ناز ، منتج كيميائي) محسوب للتفاعل. استدر في أجزاء من Odinitsi chi vidsotkah.
امدادات الطاقة والامدادات
1. لماذا يجب تسمية استجابة عملية لمنتج رد فعل أقل ، تغطية تأمينية أقل نظريًا للحصول على استجابة متساوية؟
2. مع تفاعل الماء مع كيمياء الماء ، 1 مول ، يتم ضبط الماء بكمية كيميائية قدرها 0.85 مول. انظر إلى منتج التفاعل.
3. نتيجة تفاعل الكلوريد بوزن 200 جم من حمض الهيدروكلوريك ، ترسب الكبريتات بوزن 100 جم.
4. ابحث عن حجم (n.u.) وكمية كيميائية من أكسيد الرمادي (IV) ، والتي يتم تحديدها ببذور محترقة تبلغ 64 جم ، حيث يكون ناتج التفاعل 75٪.
5. احسب كتلة الماء المحروق ، إذا تم اقتطاع كمية أكسيد الرمادي (IV) بالحجم (n.u.) 89.6 dm 3 يجب أن يصبح 80٪ من الممكن نظريًا.
6. على ما يبدو ، أكسيد الفيكهيد من serky (VI) ، مقطوع أثناء الأكسدة المؤكسدة لـ serky (IV) ،
طريق 85٪. عن طريق الكتلة ، الحجم (n.o.) والكمية الكيميائية لأكسيد السيركي (IV) ، بعد أن دخلت في التفاعل ، عندما تمت إزالة أكسيد serky (VI) بحجم (n.u) 2.24 dm3.
7. أولاً ، ابدأ الجزء الكتلي من الملح في الروشيني ، وقطعه عند تقطيره من كتلة 3.2 جم ، في أحماض الشراب في كتلة 192 جم ، إذا أصبح ناتج التفاعل 85٪.
§ 41. النيتروجين والفوسفور
النيتروجين N والفوسفور P يتعفن في النظام الدوري للمجموعة VA. تم تقديم مجموعة كاملة من الأنظمة الدورية ، Mis'yak As و surma Sb و bismuth Bi. النيتروجين والفوسفور є مع اللافلزات ، يجلبان المشياك والسورما إلى المعادن ، ويصلان إلى المعادن.
بودوفا أتوميف تلك المرحلة من الأكسدة
تحتوي العناصر الذرية للمجموعة VA على 5 إلكترونات لكل مستوى من مستويات الطاقة الأكثر أهمية ؛
7 شمال ↓ | 15P ↓ |
زافدانيا.
- Chim viklikana مثل هذا التغيير؟ على أي قوة يجب زرع ثنائي اللون في مجموع الكروم للطبق؟
- صب 5-6 قطرات من ثنائي كرومات الكالسيوم في أنبوب اختبار و 3 قطرات من حمض الهيدروكلوريك. أضف قطرتين من اليوديد إلى kaliyu وأضف 10 قطرات من الماء بدلاً من أنابيب الاختبار. انقل جزءًا صغيرًا بقلم إلى أنبوب الاختبار بدلاً من إضافة قطرة نشاء. تشي zm_nilosya zabarvlennya النشا؟ لماذا؟ طريقة Rivnyannya OVR و vzvnyannya الإلكترونية.
- الخاصية الأولية للعنصر 15 ر. قوة التعديلات المتآصلة على الفوسفور. تبادل الفسفور بكلمات بسيطة قابلة للطي.
تحتوي الصيدلة على ركود أكسيد الزئبق (II) كمطهر أقل للطهي المراهم، كيفية الحصول على الكثير من هيدروكسيد الصوديوم المخفف على أساس أملاح الزئبق.
زافدانيا.
1. اكتب رد فعل محدد لأكسيد الزئبق (II). اشرح لماذا من الضروري إجراء عمليات في تيمريافا؟
3. القوانين الأساسية للكيمياء.
يعتمد زنك Vikoristannya spoluk في الطب على هذا التصميم اللاذع والمطهر. 0.25٪ razchin zinc sulfate vykorytutsya لتحضير قطرات العين دفعة واحدة مع 2٪ حمض البوريك.
زافدانيا.
- تحضير محلول 0.25٪ لكبريتات الزنك بحجم 100 مل (ρ = 1.02 جم / مل).
- مراجعة Zd_ysniti
Zn → ZnCl 2 → ZnSO 4 → Zn (NO 3) 2 → Zn (OH) 2 → Na 2 → NaCl
- الارتباط التساهمي ، viznennya ، انظر ، آلية الإضاءة ، القوة. التكافؤ. المرحلة مؤكسدة.
· صيدلاني لضبط جودة عقار زاليزا بطريقة قياس البرمنجنات.
زافدانيا.
1. أن يكتب استجابة متساوية والتعليم باستخدام طريقة إلكترونية.
2. احسب ، ما هو حجم 0.5٪ - للقدم (ρ = 1.004 جم / مل) حجم هيدروكسيد الصوديوم المطلوب للتفاعل مع محلول 0.1 مولار من كلوريد (III) بحجم 20 مل.
3. أن القانون الدوري النظام الدوريفي ضوء النهار حول بودوفا للذرة.
· زاليزو ، متجدد ، وهو راكد داخلياً على عكسه ، لكن يمكن رؤيته من بيوت الكبريتيدات من ميدي ، فوغيلا ، حمض السيليك ، ميسياكو.
زافدانيا.
1. اقتراح طريقة التخلص من المنزل. Obruntuvati vidpovid.
3. النوع الرئيسي من الصوت الكيميائي. الطبيعة تصدر صوتًا مبتهجًا.
· لكائن برمنجنات є مع الحبوب ، їkh zeshkozhennya لتنفيذ 3٪ محلول مائي من H 2 Pro 2 مع حمض حمضي.
زافدانيا.
1. اكتب رد فعل مشترك. مستوى الاستجابة بالطريقة الإلكترونية
- Oxydi ، viznachennya ، التصنيف ، التسمية ، القوة وطرق الهوس.
· يتم تنفيذ عدد الكلمات في التحضير بطريقة قياس البرمنجنات ، وسوف نستخدم Fe2 + للتأكسد إلى Fe3 +. يتم استخدام مجموعة مختارة من الأملاح المتجددة لاستخراج كمية برمنجنات الصوديوم أثناء التسخين وعند تبريده.
زافدانيا.
1. كتابة التفاعلات المعيارية التي هي أساس التعريف الأساسي.
2. تحضير 200 مل من 0.1 ن KMnO 4 (عامل التكافؤ في القيمة للتحضير).
3. الأحماض ، viznachennya ، التصنيف ، التسمية ، القوة ، طرق الهوس.
· يجب الاستغناء عن تحضير دستور الأدوية من نترات الوسيط بالرتبة الهجومية: محلول السبيكة المعدنية المتوسطة من تخفيف حامض النيتريك ، لتنقية إزالة النترات من المنازل ، ترسيبه بحمض الهيدروكلوريك. نتيجة لذلك ، يتم إدخال الزنك في البيئة الحمضية ، وفي الوسط ، وليس من المنازل ، مرة أخرى في حامض النيتريك.
زافدانيا.
- اكتب سطرًا من ردود الفعل الشائعة.
- تحديد التفاعلات الإيجابية لأنيون Cl- ، Br- ، J على أساس النترات المتوسطة ، وهو الأساس لتأكيد صلاحية المستحضرات في الكلوريدات ، واليود ، والبروميدات في السعرات الحرارية.
- العرض التقديمي ، viznachennya ، التصنيف ، التسمية ، القوة ، طرق الهوس.
9. نترات الركود المتوسط في حالة التآكل والانعطافات وحالة التهاب الملتحمة في viglyadas 2.5 و 10٪ حلول المياه.
زافدانيا.
- تحضير 2٪ أحجام AgNO 3 بالحجم 50 مل (ρ = 1.015 جم / مل). كم عدد العقول التي أعطيت للاختلاف؟
- مراجعة Zd_ysniti
Ag → AgNO 3 → AgCl → AgNO 3 → Ag
- Soli ، viznachennya ، التصنيف ، التسمية ، القوة ، طرق الهوس.
· يجب على الصيدلي أن يقوم بتعريف المستحضر الصيدلاني بقضيب كبريتات.
زافدانيا.
1. كيف أستخدم فايكوريست كبريتات في الطب؟ لماذا يجب خلط كبريتات الباري بكربونات الصوديوم قبل إجراء تفاعلات التعريف؟ دليل على تأكيد ردود الفعل المماثلة.
2. تحفيز تفاعلات تحديد الأملاح BaSO4، CaSO4، Na2SO4.
3. مجمع spoluks ، viznachennya ، budova لـ A. Werner ، طبيعة الصوت الكيميائي ، التصنيف ، التسمية ، التفكك. ركود الحلول المعقدة في التحليل الطبي والكيميائي.
· صيدلي بمحلول مركّز من الأمياكو ، مما يسمح بتدمير كبير لتقنية السلامة - بعد أن قام بتوجيه الروبوتات على رأس الفارس دون زيادة الجر.
زافدانيا.
- ما الميراث الذي يمكنك القيام به عند العمل مع مجموعة مركزة من الأمياكو دون لمس تقنية الأمان؟ المساعدة الطبية من Yak pershu ضرورية للدفع عند إزالة الأمياك في أزواج.
- إعادة تطوير Zdіsniti ذلك.
(NH 4) 3 PO 4 → NH 3 → NH 4 NO 2 → N 2 → NO → NO 2 → HNO 3 → Hg (NO 3) 2 → NO 2
لكتابة التفاعلات الصحيحة للعرض الجزيئي والأيوني ، ولإجمالي - مستوى طريقة التوازن الإلكتروني.
- حركية الكيمياء. سرعة التفاعلات الكيميائية. تسريب عوامل مرنة على سرعة التفاعلات الكيميائية.
· النيتروجين الموجود في الدواء راكد في كمية الأمونيا في الماء وأملاح الأمونيوم وأكسيد النيتريك ونتريت الصوديوم.
زافدانيا.
- ماذا سأفعل بتكريم النيتروجين؟ اكتب معادلات الخطب المحددة وردود الفعل المتساوية التي تميز القوة الرئيسية.
- اكتب تفاعل rіvnyannya بين نترات الصوديوم وبرمنجنات الكالسيوم في الوسط الحامض. تعرف على رد الفعل بطريقة التفاعل
- غير قابل للتفاوض وذئاب ضارية تفاعلات كيميائية... خيميشنا ريفنوفاجا. قانون ماك لأنظمة لا تقل أهمية. ثابت Rivnovagi. مبدأ لو شاتيلє.
· يجب على الصيدلي أن يقوم بالتعرف على الأملاح بكبريتات الصوديوم وكلوريد الصوديوم وهيدروكربونات الصوديوم.
زافدانيا.
- تفاعلات Viconatie مع أيون SO 4 2- ، Cl- ، HCO 3-.
- Rosrahuvati ، كمية الجرامات في بلورات الصوديوم Na 2 SO 4 · 10H 2 O ضرورية للصيدلي لإزالة كمية الماء بمقدار 500 جم ، لإزالة 5 ٪ من كمية Na 2 SO 4؟
- تفاعلات الأكسدة الرائدة. الأحكام الرئيسية للنظرية الإلكترونية للتفاعلات المؤكسدة الحيوية. Nayvazhivіshі مؤكسد الشخصيات القيادية. تفاعلات Zrivnyannya oxide-vidnovnykh بواسطة طريقة التوازن الإلكتروني وطريقة الأيونات الإلكترونية.
Kaliєva sl sіrchanoіy acid وخلع الكثير من المستحضرات الأجنبية للجسم (xenobiotics) - المخدرات lіkuvalnyيعتمد هذا التمثيل الغذائي على تصريحات بعض الكلام غير الذكي - المتقارنات ، حيث يسهل نقله إلى الجسم.
زافدانيا.
- Otrimatyvu sіl sl sіlchanoic acid بطريقة طبيعية ، vikoryuchi على طاولة الكاشف. اكتب سطرًا من ردود الفعل الشائعة.
- نطاق التفاعلات الجزيئية ، التي تدور مع مثل هذه السرعة іvnyаnnya:
S 2- + H 2 S → 2HS -
S 2- + 2H + → H 2 S.
HS - + OH - → S 2– + H 2 O
· أنظمة التشتت والتسمية والتصنيف. المعلقات ، الهباء الجوي ، المستحلبات. تشتت أنظمة Vikoristannya بخشونة في الطب والصيدلة.
يحتاج الصيدلاني إلى إزالة محلول 5٪ من حمض السيرشانويك.
زافدانيا.
- ما هي الصحة المؤكسدة لأنيون SO 4 2 في تركيز الحمض؟ اكتب التفاعلات الصحيحة لوصف قوة الحمض المخفف والمركز.
- تحضير 5٪ من قوة حمض sirchanoic ، المايوتشي 50 مل من حمض sirchanoic وجزء كتلي من H 2 SO 4 30٪.
- الاختلافات الهائلة ، التصنيف ، التسمية ، الجزيئية الحركيةتلك القوة الضوئية ، الرفض. استقرار الاختلافات الهائلة. تجلط الدم. بيبدة. بودوفا ميسيل. دياليز.
· Сірка ، scho لدخول مستودع الأحماض الأمينية ، للتأكسد في الكائن الحي. مع حمض sirchan الداخلي الكامل يعتني بمصير spoluch النخالة الأجنبية - الفينول ، كريسول ، إندول.
زافدانيا.
- وصف قوة الحمض الحمضي ونقض قواعد الروبوتات مع الأحماض.
- Rosrahuvati ، وهو حجم من حمض sirchanoic مع كسر كتلي من H 2 SO 4 25 ٪ وسميكة 1.18 جم / مل ، من الضروري تناوله لتحييد هيدروكسيد الكالسيوم ، الحجم 50 مل ، مع كسر كتلي من KOH 12 ٪ وسميك 1.1 جم / مل.
- حقيقة القرار ، القيمة ، الفهم الرئيسي ، يوم عملية اتخاذ القرار. تعريف. التنافذ. ملزمة تناضحي.
· في المناطق الصناعية حيث يوجد الكثير من المياه ، ليس من السهل الحصول على الألواح الحمضية.
زافدانيا.
- Shho بواسطة مستودع الكيمياءالمجالس الحمضية في مناطق كيخ؟ ياك فين للتظاهر؟ اكتب رد فعل بسيط.
- المستويات الجزيئية والسريعة للتحلل المائي للأملاح المبكرة:
K 2 S ، Na 2 SO 4 ، Na 2 SO 3 ، Al 2 (SO 4) 3 ، Cr 2 S 3
Sirvododen للدخول إلى الطبيعة عدد كبير من الأشياءلتطوير العمليات البيولوجية وتحدث في المياه المؤيدة للمعادن.
زافدانيا.
- قوة القوة.
- مراجعة Zd_ysniti:
H 2 S → SO 2 → H 2 SO 3 → NaHSO 3 → Na 2 SO 3
اكتب رد فعل بسيط على العارض الجزيئي والأيوني.
- تفكك الأحماض والقواعد والأملاح والماء. rivnovaga الحمضي القاعدي في الرازيني. Ionny dobutok vodi ، حلول الأس الهيدروجيني.
- دواء رسمي من sirki є sirka ، مغلف بـ (Sulfur praecipitafum).
زافدانيا.
- صِف قوة النبيذ والتعديلات المتباينة للزيت.
- مراجعة Zd_ysniti:
تفاعلات Zr_vnyati بواسطة طريقة الميزان الالكتروني.
- هيدروليز. الحساسية لعملية التحلل المائي. التحلل المائي لأنواع مختلفة من الأملاح. خطوة نحو التحلل المائي. ضخ عوامل جديدة في مراحل التحلل المائي.
سيجري الصيدلي تفاعلًا تعريفيًا بنسبة 3٪ من محلول بيروكسيد بيروكسيد: حتى 1 مل من حمض الهيدروكلوريك المخفف ، و 1 مل من حمض الهيدروكلوريك المخفف ، و 1 مل من الإيثر ، و 0.5 مل من محلول ثنائي كرومات الكالسيوم ، نتيجة تركيز حمض الهيدروكلوريك في الحمض 6
زافدانيا.
- تفاعل Viconati لتحديد بيروكسيد الماء.
- لكتابة معيار لتحديد الفرق بين بيروكسيد الماء والصحة باستخدام طريقة التوازن الإلكتروني.
- الخصائص العامة لعناصر زمرة الرأس للمجموعة السابعة والسبولوك. ميديكو- ذات مغزى بيولوجيالهالوجين
· Kisen - منتج صيدلاني موصوف بواسطة GF. Yogo zasosovyut للاستنشاق لأنواع مختلفة من الجوع الحامض.
20. زافدانيا.
- اكتب التفاعلات الصحيحة للكشف عن ثاني أكسيد الكربون ، 2 ، لا ، NO2.
- لكتابة ردود الفعل r_vnyannya ، والتي هي أساس طريقة المختبر لرفض الحموضة. مستويات تحريض التفاعلات بطريقة التوازن الإلكتروني
- الكلور ، ماء الكلور ، حمض الهيدروكلوريك ، الكلوريد. القوة الفيزيائية والكيميائية للكلور والنصف الآخر. الأهمية الطبية والبيولوجية للهالوجينات.
· مراجعة الصيدلاني للأدوية المعتمدة على كلوريد الصوديوم وبروميد الصوديوم ويوديد الصوديوم.
زافدانيا.
- لأي غرض من الممكن استخدام الملح في الصيدلة والطب.
- ردود فعل Vykonati yakіsnі على الأنيوني Cl- ، Br- ، J-.
- القوة الفيزيائية والكيميائية للكلور الحمضي. أوتريمانيا. Zasosuvannya.
· إحدى الطرق الصناعية لإزالة اليود للأدوية هي عملية رؤية اليود من مياه الحفر. يوديدي ، بالقرب من مياه الحفر ، تتأكسد حسب المخطط:
NaJ + NaNO 2 + H 2 SO 4 → J 2 + Na 2 SO 4 + NO + H 2 O
22. زافدانيا.
- مستحضرات اليود الياك وكيف تتعثر في الطب.
- لتعلم رد الفعل ، لوضع الأساس لهوس اليود بطريقة napivreaktsii.
- خاصية Zagalny للكالكوجينات. القوة الحامضة التي يوجو سبولوك. المعنى الطبي والبيولوجي
· الصيدلي viznacha عقاقير مرجعية في كلوريد الصوديوم والكالسيوم والكالسيوم.
زافدانيا.
- لأي غرض من الأغراض ، vikorist والمستحضرات الصيدلانية.
- Viconati ردود الفعل لتحديد أملاح معينة.
- أنا تعكر سبولوكي بالماء. السلطات الفيزيائية والكيميائية للمياه. ماء بيروكسيد ، طاقة ، تخزين في الأدوية. معنى الماء في حياة الكائنات الحية.
· الهالوجينات Zi spoluk مع هيبوكلوريت الأشنة الحامضة أصبحت موضع اهتمام الطب حيث يتم تطهيرها.
زافدانيا.
- هل تقوم على قوة هيبوكلوريت؟ اكتب سطرًا من ردود الفعل الشائعة.
- Rosrahuvati ، يجب أخذ بضع جرامات من الكلور vapna لإزالة 2 لتر من الكلور النشط.
- Sirka و її سبولوكي. Alotropia من vilnoy sirka. القوة الفيزيائية والكيميائية للماء ، الماء ، الماء ، الأحماض والأملاح.
· في حالة نقص حموضة عصير الملاط ، من الضروري استخدام حمض الهيدروكلوريك المخفف داخليًا.
زافدانيا.
- أعد قراءة القواعد الأساسية للروبوت باستخدام الأحماض.
- Rosrahuvati ، في زجاجة بها محلول 36.5٪ (ρ = 1.19 جم / مل) من حمض الهيدروكلوريك ، ومن الضروري تناول 100 مل لتحضيره. 8.2٪ (ρ = 1.040 جم / مل) حمض.
- القوى الفيزيائية والكيميائية لأكاسيد الماء والحمض البكر والحمض العضوي. الكبريتات. سلفاتي. القوة ، الحيازة ، الامتلاك.
يوجد في الصيدلية أحد الحلول القياسية المحاليل حيث يمكن إزالة 33٪ أسيتات الكالسيوم والتي يمكن الاستغناء عنها بمحلول 30٪ كربونات الكالسيوم - على أساس حمض عضوي.
زافدانيا.
1. اكتب رد فعل متساوٍ على العارض الجزيئي والأيوني.
- الخصائص الرئيسية لعناصر المجموعة الرئيسية للمجموعة V. قوة النيتروجين. قيمة النيتروجين في حياة الكائنات الحية.
· وصف فروق الكلام وهي القاعدة القوية والحمضية الضعيفة. لترتيب مثبت GFH yak ، يتم توفير محلول 0.1 ن من هيدروكسيد الصوديوم بحجم 4 مل لكل 1 لتر من المحلول.
زافدانيا.
- اكتب مثالاً على التفاعل مع التحلل المائي لملح CH3COONa.
- Rosrahuvati ، يجب احترام بضعة جرامات من هيدروكسيد الصوديوم ، مع قطع 500 مل من حجم 0.1n. قم بإعداد مجموعة واسعة من الحلول لتقنية السلامة.
- أمياك. ملح الأمونيا. القوة. ركود في الطب والصيدلة.
أعد صيدلاني وصفة لمرهم: 1 غرام من كربونات الكالسيوم و 0.5 غرام من رباعي بورات الصوديوم في 70 مل من الماء المقطر ، و 10 غرام من اندماج الإستيارين مع 15 غرام من أوليا الفازلين وتيار رقيق مع تقليب الورد إلى كربونات دافئة. مع الماء. ...
زافدانيا.
- كم عدد الكلمات التي تم تبنيها في الماضي؟ أكيد الرجل الأوسط أن يتظاهر لماذا؟ دليل على تأكيد ردود الفعل المماثلة.
- تحضير المبهمات التقنية الكيميائية للروبوتات. احترم 1 جرام من كربونات السعرات الحرارية على المدرجات الفنية والكيميائية.
- أكسيد النيتروجين. حمض النيتروز والأملاح. السلطات الفيزيائية والكيميائية. قيمة طبية وبيولوجية مع النيتروجين
يحتاج الصيدلي إلى تحضير 0.05٪ برمنجنات بحجم 200 مل لشطف الفم والحلق.
زافدانيا.
- على أي سلطة لبرمنجنات كالي رونتويت يوغو العمل السياسي؟ المنغنيز ياكي سبولوكسيو راكد في لأغراض الشرب?
- لإزالة كمية KMnO 4 جرام ، من الضروري استخدام 0.05٪ KMnO 4 (ρ = 0.9994 جم / مل) لإزالة 200 مل. اشرح تقنية الحصول على النطاق المحدد.
- جزيئات حمض النيتريك بودوفا. القوة الفيزيائية والكيميائية لحمض النيتريك والأملاح. Mediko - القيمة البيولوجية للنيتروجين والسبولوك.
تحتوي المستحضرات الصيدلانية على أكسيد الزئبق (II) ، وهو مادة مفرغة كمطهر ، وتوزع هيدروكسيد الصوديوم على شكل أملاح زئبق مخففة (II).
زافدانيا.
1. اكتب رد فعل محدد لأكسيد الزئبق (II). ما هي ردود الفعل التي يجب القيام بها في تيمريافا؟
3. القوانين الأساسية للكيمياء.
K 2 Cr 2 O 7 + H 2 O 2 + H 2 SO 4 = K 2 SO 4 + H 2 CrO 6 + H 2 O
حمض الندكروميك ، والذي يمكن العثور عليه في نفس الوقت ، H 2 CrO 6 هو أحد الألوان الزرقاء. تآزر إعادة تعبئة الحمض ودعم تحضير Н2О2.
زافدانيا.
- رد فعل Zrіvnyati tsyu بالطريقة الإلكترونية.
- أي نوع من الكروم يمكن أن يسبب قوة مؤكسدة وماذا عنها؟
- قوة الفسفور وأكاسيد الفوسفور وأحماض الفوسفوريك وامتلاكها. القيمة الطبية والبيولوجية للفوسفور
· سومش أكسيد المغنيسيوم (85٪) وبيروكسيد المغنيسيوم (15٪) є مع مستحضر نسميه "بيروكسيد المغنيسيوم" الذي يستخدم للركود في حالة الإفرازات المعوية السائلة.
زافدانيا.
- اشرح العقار المضاد للحموضة والجراثيم. دليل على تأكيد ردود الفعل المماثلة.
- Rosrahuvati ، بضع جرامات من MgO و MgO 2 تحتاج إلى تحضير 100 جرام من هذا المستحضر. احترم 10 جم من أكسيد المغنيسيوم على المدرات التقنية الكيميائية.
- الخصائص العامة لعناصر المجموعة الرابعة لمجموعة بيدجروب الرأس. بودوفا ، القوة البدنية alotrope في الكربون. القوة المرحة لشخص قوي في الفحم.
· شطف هيدروكربونات الصوديوم (شرب الصودا) للوقوف عند شطف viglyadi ، اغسل عند اشتعال العينين ، القشور المخاطية لنبلاء dichny العلوي.
زافدانيا.
- هل هو مطهر لقوة هيدروكربونات الصوديوم؟ دليل على تأكيد ردود الفعل المماثلة. ما الذي يمكن استخدامه كمطهر مع رباعي بورات الصوديوم Na 2 B 4 O 7 ∙ 10H 2 Pro؟
- تحضير محلول 5٪ من NaHCO 3 بالحجم 50 مل (= 1.036 جم / مل).
- بودوفا من الجزيئات ، القوة الفيزيائية والكيميائية للحمض سبولوك في الفحم. Mediko - المعنى البيولوجي في الفحم الذي سبولوك.
في المستحضرات المضادة للحموضة ، التي تنتقم من هيدروكربونات الصوديوم ، يجب أن تنتقم في حالة مرض الشباب الذي تشرف عليه الحموضة. الحماض.
زافدانيا.
- على أي قوة لسعر الملح يجب أن نستخدم الأدوية المضادة للحموضة؟ دليل على تأكيد ردود الفعل المماثلة. ما نوع الكلام الذي يمكنك شراؤه لتحقيق أهدافك؟
- مراجعة Zd_ysniti:
NaOH → NaHCO 3 → Na 2 CO 3 → NaCl → NaNO 3
اكتب رد فعل بسيط على العارض الجزيئي والأيوني.
تفاعل Viconati Na 2 CO 3 → NaCl → NaNO 3.
- السيليكون أن yogo spoluky ، على دراية بالطبيعة ، والرفض ، والقوة الفيزيائية والكيميائية. Mediko - بيولوجي يعني السيليكون.
· يستخدم محلول كلوريد الصوديوم بنسبة 2.5٪ داخليًا لغسل الملاط عند إزالة AgNO 3.
زافدانيا.
1. لماذا يجب علي استخدام محلول كلوريد الصوديوم؟ دليل على تأكيد ردود الفعل المماثلة.
3. الخصائص العامة لعناصر المجموعة الرئيسية للمجموعة الثالثة. القوة مملة أن yogo spoluk. الأهمية الطبية والبيولوجية في الطب.
· لتربية أشكال lykarsky النادرة ، علامات لـ ін'єкцій ، ін'кцій ، vikoristovyut іzotonіchny rozchin.
زافدانيا.
1. ما هو أيضًا فرق مقوِّي التوتر؟ لماذا سمي izotonic؟
3. Alumіnіy أن yogo spoluky ، والسلطة ، والرفض. الأهمية الطبية والبيولوجية للألمنيوم.
3٪ محلول ماء بيروكسيد ماء zasosovyat yak zovn_shn_y zasib مبيد للجراثيم.
زافدانيا.
1. على أي أساس هو مبيد للجراثيم والدم الشوكي لبيروكسيد الماء على أساس. ما نوع الزيارات الأجنبية التي تحتاج إلى الاعتناء بها أثناء السفر؟
2. Rosrahuvati، الابن. يجب تناول بيرهيدرول (30٪ محلول مائي من Н 2 برو 2 ، ρ = 1.1 جم / مل) لإزالة 500 مل من محلول 3٪ (ρ = 1.005 جم / مل). قم بإعداد مجموعة واسعة من الحلول لتلبية تكنولوجيا السلامة.
3. معادن مجموعة pidgroup الرأس. خاصية الزغلني ، الرفض ، القوة الفيزيائية والكيميائية. ملح الكالسيوم والمغنيسيوم. عسر الماء. Usunennya zhorstkosti vodi. الأهمية الطبية والبيولوجية لعناصر المجموعة الرئيسية الثانية.
· الصناعة الصيدلانية الحالية لإنتاج الأدوية بواسطة مطحنة الركام ، ونوع الأنظمة المشتتة ، وطريقة الإدخال إلى الكائن الحي.
زافدانيا.
1. ما تسمى الأنظمة المشتتة؟
كيف تصنف الأنظمة المشتتة؟
هل أنظمة viglyadi المشتتة تحتوي على أدوية؟ إحضار مؤخرات محددة.
- Otrimati الكلاب المائية باستخدام طريقة استبدال razchinnik.
- الخصائص الهامة للمعادن الأجنبية وحيازتها وقوتها الفيزيائية والكيميائية. Naivazhlivіshі poluchny metalіv. القيمة الطبية والبيولوجية للمعادن
في خطابات viglyadі المائية razchinіv іznіh ، تبدأ في الركود rіdki lykarski فورمي، scho يمكنني تغيير الاختلاف مرة أخرى.
زافدانيا.
- Spravzhn_ razchini ، razchinn_st ، التحريض ، عدم التدمير ، الاكتظاظ السكاني لـ razchini. أي بيروقراطيين لديهم؟
- تحضير 5 ٪ razines CuSO 4 بالحجم 100 مل (ρ = 1.051 جم / مل) مع الحمضيات الزجاجية CuSO 4 ∙ 5H 2 O
- السمة الأولية هي د - العناصر. مجموعة pidgroup المعدنية أحاديًا و їkh spoluk. الأهمية الطبية والبيولوجية.
· روسيا لديها معالجة كهربائية للعصير وعصير أخضر طازج وسيروفين إبداعي منخفض العصير: التوت والفواكه والمحاصيل الجذرية للخضروات والكائنات الحية الصغيرة للخضروات ، وذلك بمساعدة ظهور العصائر (الطبيعية الداخلية). vmist الداخلي هو اختلاف هائل في الطوب ، احماض نووية، في الكربوهيدرات والعفص
زافدانيا.
1. هل يطلق عليك اسم "الهائل"؟ ياك نتن تصنيف؟ أعد قراءة قوة الاختلافات الهائلة. ما هي العملية التي تكمن في أساس رؤية العصائر من syruvina المتنامية؟
2. قم بتحريك المحلول المائي مع هيدروكسيد المحلول الملحي (III) بطريقة التحلل المائي لـ FeCl 3. اكتب مخططًا للبراعم.
- المعادن هي أحادي المعامل من المجموعة الثانية ، التوصيف ، القوة الفيزيائية والفيزيائية والقوة الكيميائية. الأهمية الطبية والبيولوجية.
عند تحضير أقراص على أساس مستخلص جذر حشيشة الهر ، لا ينصح باستخدام كربونات المغنيسيوم كأساس نابوفنوفاش ، لأنه من الممكن أن يتسبب في معادلة حمض الإيزوفاليريك واستخراج الفالتات حتى يصبح حامضيًا.
زافدانيا.
1. شرح مظهر من مظاهر قوة كربونات المغنيسيوم. اكتب رد فعل بسيط على العارض الجزيئي والأيوني. كيف أفوز بتحضير أقراص بخلاصة حشيشة الهر؟
2. مراجعة Zd_ysniti:
MgO → MgCl 2 → MgSO 4 → Mg (OH) 2 → MgOHCl
اكتب رد فعل بسيط على العارض الجزيئي والأيوني.
3. الخصائص العامة لعناصر مجموعات السادس والسابع لمجموعات pidgroups الثانوية. القوة المؤكسدة للكروم والمنغنيز والسبولك. الأهمية الطبية والبيولوجية.
· Zrіdzheny في غاز حمض الكربونيك vikoristovyuyut في virobniztvі الصيدلانية للخطاب النشط بيولوجيًا viluchennya من lіkarskoy roslinnoy sirovini.
زافدانيا.
- على أي نوع من الطاقة في ثاني أكسيد الكربون يتحلل الغاز في أغراض التسيخ؟
- مراجعة Zd_ysniti:
C → CH 4 → CO → CO 2 → BaCO 3 → Ba (HCO 3) 2 → BaCO 3 → CO 2
ردود الفعل على تبادل المعلومات مع العارض الجزيئي والأيوني.
- الخصائص العامة لعناصر المجموعة VIII هي مجموعة pidgroup ثنائية البت. قوة الروح هي أن yogo spoluk. الأهمية الطبية والبيولوجية.
قائمة فحوصات التغذية من الانضباط
الفهم الرئيسي لقوانين الكيمياء. عيد ميلاد سعيد للذرة.
القانون الدوري والنظام الدوري D.I. منديليف على ضوء الذرة.
Viznachennya ، انظر ، فكر في طبيعة الصوت الكيميائي.
القيمة ، آلية الإضاءة ، قوة الارتباط التساهمي. التكافؤ. المرحلة مؤكسدة.
Oxydis: التعيين والتصنيف والتسمية والقوة وطرق الهوس.
الأحماض: viznachennya ، التصنيف ، التسمية ، القوة وطرق الحيازة.
التقديمات: التأشيرات ، التصنيف ، التسمية ، القوة وطرق الاستحواذ.
Soli: التعيين والتصنيف والتسمية والسلطة وطرق الهوس.
spoluks المعقدة: viznachennya ، budova for Werner ، tipi ، التسمية.
سرعة التفاعلات الكيميائية. المسؤولين ، scho تحقن إحساسًا بالتفاعل الكيميائي.
تفاعلات كيميائية غير قابلة للعكس وعكسها. خيميشنا ريفنوفاجا. مبدأ M. Chatelє. ثابت Rivnovagi.
التفاعلات الرائدة للأكسدة: القيمة ، والفهم الأساسي ، والأكسدة والتجديد اليومي ، والأكسدة الجديدة وتفاعلات الرصاص.
أنظمة التشتت: التسمية والتصنيف. أنظمة مشتتة بشكل خشن: معلقات ، رذاذ ، مستحلبات.
اختلافات هائلة: القيمة ، القوة ، الهوس ، بودوفا micel.
القرارات الصحيحة: القيمة ، والفهم الأساسي ، اليومية لعملية الحل. تعريف. التنافذ. ملزمة تناضحي.
أهم أحكام نظرية التفكك الكهربائي. آلية التفكك الكهربائي. الخطوة هي ثابت التفكك.
تفكك الأحماض والقواعد والأملاح. تفكك الماء ومحاليل الأس الهيدروجيني.
نقص التحلل المائي. التحلل المائي لأنواع مختلفة من الأملاح. خطوة نحو التحلل المائي.
الخصائص الأساسية لعناصر المجموعة الرئيسية للمجموعة السابعة. الأهمية الطبية والبيولوجية للهالوجينات
الكلور والماء الكلور وحمض الهيدروكلوريك. الرفض ، القوة. كلوريدي.
كيسنيفي سبولوكيالكلور.
خاصية Zagalny للكالكوجينات. كيسن أن يوجو سبولوكي. المعنى الطبي والبيولوجي
فلاستيفوستي سبولوك الماء الحامض (الماء ، بيروكسيد الماء). Zastosuvannya N 2 Pro 2 من medi. قيمة محرك الأقراص.
سيركا. Alotropia من vilnoy sirka. مرح سلطات العالم. سيرفودين. حمض الهيدروهيدريك والأملاح.
القوة الفيزيائية والكيميائية لأكاسيد الماء والأحماض النقية والنقية وأملاح الأحماض النقية والنقية وغيرها.
الخصائص الرئيسية لعناصر المجموعة الرئيسية للمجموعة V. نيتروجين بنفس القوة.
قوة أملاح الأمونيا والأمونيا. ركود في الطب والصيدلة.
أكسيد النيتروجين. حمض النيتروز والأملاح. القدرة الفيزيائية والكيميائية والتخزين.
القوة الفيزيائية والكيميائية لحمض النيتريك. نتراتي. Mediko - القيمة البيولوجية للنيتروجين والسبولوك.
خصائص العنصر 15 R. فيلني الفوسفور: alotropia ، القوة الفيزيائية والكيميائية ، الحيازة.
فوسفين. أكسيد الفوسفور وحمض الفوسفوريك: القوة ، الامتلاك. القيمة الطبية والبيولوجية للفوسفور
الخصائص العامة لعناصر المجموعة الرابعة لمجموعة بيدجروب الرأس. في الفحم: القوة الفيزيائية للألوتروب في الفحم ، القوة الكيميائية.
كيسنفي سبولوكي في الفحم: جزيئات بودوفا ، القوى الفيزيائية والكيميائية. Mediko-biologic المعنى في الفحم الذي سبولوك.
السيليكون الذي يتسم بالملل: معرفة الطبيعة ، والرفض ، والقوة الفيزيائية والكيميائية. Mediko - بيولوجي يعني السيليكون.
المجموعة الرئيسية للمجموعة الثالثة: الخصائص الرئيسية للعناصر. حدود هذا yogo spoluky: الرفض ، القوة الفيزيائية والكيميائية ، التخزين في الطب.
الألمنيوم واليوغو سبولوكي: الهوس والقوة الفيزيائية والكيميائية. الأهمية الطبية والبيولوجية للألمنيوم.
معادن مجموعة pidgroup للمجموعة الثانية: التوصيف ، الهوس ، القوة الفيزيائية والكيميائية. ملح الكالسيوم والمغنيسيوم. عسر الماء. Usunennya zhorstkosti vodi. الأهمية الطبية والبيولوجية لعناصر المجموعة الرئيسية الثانية.
تم إلقاء البرك: التوصيف ، الامتلاك ، القوة ، spoluks navazhliv. الأهمية الطبية والبيولوجية.
توصيف عناصر د أولي. مجموعة pidgroup المعدنية أحاديًا المجموعة الأولى. بودنانيا مودو ، سبلا. الأهمية الطبية والبيولوجية.
معادن المجموعة الثانية: توصيف بودوفيا ، القوة الفيزيائية والكيميائية. الأهمية الطبية والبيولوجية.
المجموعات الثانوية للمجموعات السادسة والسابعة: الخصائص المميزة لعناصر المجموعة ، قوة الكروم والمنغنيز وسبولوكهم. الأهمية الطبية والبيولوجية.
مشيراً إلى المجموعة الثامنة المجموعة: الخصائص العامة لعناصر المجموعة ، قوة هذه المجموعة. الأهمية الطبية والبيولوجية.
Ustatkuvannya.على طاولة الجلد أمام العلماء ، هناك خطة درس ، رسم تخطيطي لتفاعل حمض النيتريك مع المعادن ، مجموعة من الكواشف ، اختبار للمادة المرفقة.
أكسيد النيتروجين
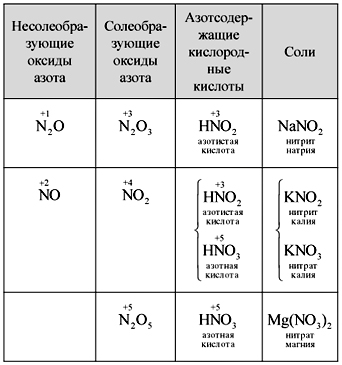
Vchitel.خمن أن تكتب صيغة أكاسيد النيتروجين. هل الأكاسيد تسمى مكونة للملح أم غير مالحة؟ لماذا؟
يكتب العلماء بشكل مستقل صيغ خمسة أكاسيد نيتروجين ، ويسمونها ، ويخمنون الأحماض الحامضة المختلطة بالنيتروجين ، ويصوغون الشكل بين الأكاسيد والأحماض. يكتب أحد العلماء على الجرعة (جدول).
طاولة
استبدال أكاسيد النيتروجين والأحماض والأملاح
إظهار المعلومات:
تفاعل أكسيد النيتروجين (IV) مع الماء
Vchitel. لديك سفينة sلا 2 هناك مد من الماء والمد والجزر من الماء ، بدلا من اختبار vip من عباد الشمس.
من sposterіgaєmo؟ Rosechin chervonin من خلال حمضين ، لا بأس.
2NO 2 + H 2 O = HNO 2 + HNO 3.
أكسدة النيتروجين خطوة فيلا 2 باب +4 ، توبتو. فاز mіzh الصناعية +3 і +5 ، كما هو الحال على مستوى الصلابة ، يتم إحضار أكسيد النيتروجين (IV) إلى شكل حمضين - النيتروجين والنيتروجين.
مستودع جزيئات بودوفا
Vchitel.لكتابة الصيغة الجزيئية لحمض النيتريك ، احسب الوزن الجزيئي ويعني مرحلة العناصر المؤكسدة. تخزين الصيغ الهيكلية والإلكترونية.
يقوم العلماء بصياغة مثل هذه الصيغ (الشكل 1).
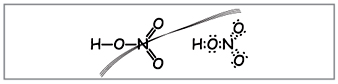
Vchitel.وفقًا لعدد الصيغ ، يمكن لف عشرة إلكترونات حول النيتروجين ، والذي لا يمكن أن يكون أحمر بسبب تم العثور على النيتروجين في الفترة الأخرى وبقدر الإمكان على الكرة الأخيرة في الأحدث قد لا تحتوي على المزيد من الإلكترونيات. يتم استيعاب التردد الفائق ، كما لو أنه يترك ، ولكن بين ذرة النيتروجين وإحدى الذرات الموجودة في الحمض ، يتم إنشاء رابط تساهمي وراء آلية متلقي المتبرع(الصورة 2).
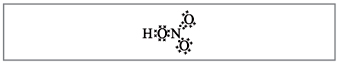
صغير. 2. الصيغة الإلكترونية لحمض النيتريك.
ذرة الإلكترون والنيتروجين يرمز إليها بالنقاط السوداء
يمكن استنتاج الصيغة الهيكلية لحمض النيتريك على النحو التالي(تين. 3) :
صغير. 3. الصيغة التركيبية لحمض النيتريك
(مجموعة من المؤشرات المانح والمتقبل مع مهاجم)
ومع ذلك ، فقد تم إحضارها من خلال المسار السابق أن الرابط الفرعي مقسم بالتساوي بين ذرتين من kisny. تكون مرحلة النيتروجين المؤكسد في حمض النيتريك باهظة الثمن +5 ، والتكافؤ (الاحترام الوحشي) باهظ الثمن ، أكثر من مجرد اختيار الرهانات الإلكترونية.
القوة الفيزيائية لحمض النيتريك
Vchitel.هنا زجاجة من حمض النيتريك المركز المخفف. صِف القوى الجسدية الموجودة.
وصف العلماء أن حمض النيتريك ياك ريدنا مهم للمياه ، ولون مطاطي ، وله رائحة نفاذة. حامض النيتريك راشين بدون لون وعديم الرائحة.
Vchitel. Dodam ، درجة حرارة غليان حامض النيتريك +83 درجة مئوية ، درجة حرارة التجمد -41 درجة مئوية ، يجب أن تصل. لعقول بارعة من tse ridin. رائحة نفاذة وتلك التي عند خلعها توضح أن الحمض يتركز قليلاً قبل أن ينطفئ الضوء ، أو عندما يسخن ، ينهار غالبًا.
كيمياء القوة الحمضية
Vchitel. خمن أي نوع من العبارات تتبادل الأحماض؟(الاسم العلمي.)
قبل الكواشف ، تنبأ بقائمة التفاعلات واكتب تحذيراتك (ردود أفعال تدوين الطلب في ضوء TED).
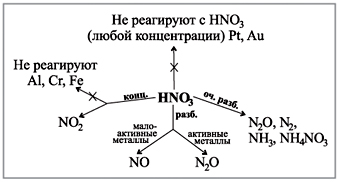
ونحن الآن نطعم أنفسنا بالقوى المحددة لحمض النيتريك.
لقد تم صقلنا ، لكن الحمض في حالة zbergannі zhovtіє ، نقوم الآن بإجراء تفاعل كيميائي:
4HNO 3 = 2H 2 O + 4NO 2 + O 2.
(علميًا لتسجيل التوازن الإلكتروني للتفاعل بشكل مستقل.)
"غاز بوري"(رقم 2) حمض فربو.
خاصة حمض يتم تقليله إلى معادن. أنت تعلم أنهم ألقوا الماء من الأحماض ، وإلا فلن يضيع أثناء التفاعل مع حمض النيتريك.
تعجب من الرسم التخطيطي الذي لديك في الحفلة ، حيث يظهر كيف تظهر الغازات أثناء تفاعل الحمض والتركيز مع المعادن.(روبوت مع رسم بياني.)
إظهار المعلومات:
تفاعل حامض النيتريك المركز مع الوسط
والأكثر فاعلية هو إظهار تفاعل حمض النيتريك (conc.) بمسحوق الوسط ، أو بدلاً من ذلك ، مع إضافة سهم بقطع صغيرة من العسل:
علميًا لتسجيل التوازن الإلكتروني للتفاعل بشكل مستقل:
الهوس بالحمض
Vchitel. سيكون الدرس غير مفهوم ، لأن تغذية حمض النيتريك غير مرئية.
طريقة المختبر: ضياء حمض الهيدروكلوريك المركز على النترات (الشكل 5).
NaNO3 + H2SO4 = NaHSO4 + HNO3.
في بروميسلوفوستو حمض في الحيازة الأساسية بطريقة ودية.
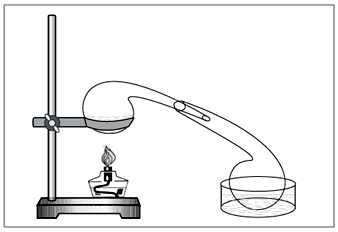
صغير. 5. لإزالة حامض النيتريك في المختبر
مختار يدويًا vikoristovuvati أطباق كيميائية قديمة - معوجة
لا يتم توسيع طريقة الحفاظ على الحمض مع النيتروجين والحمض عند درجات حرارة تصل إلى 2000 درجة مئوية (القوس الكهربائي) بشكل خاص.
في روسيا ، ارتبط تاريخ إزالة حمض النيتريك بأسماء الكيميائي والتقني إيفان إيفانوفيتش أندرييف (1880-1919).
فين في عام 1915 ص. بعد أن افتتح أول منشأة للتحمض بالأمونيا وأدركت طرق التفكك على نطاق المصنع عام 1917 ص. أول مصنع بناء بالقرب من دونيتسك.
تتضمن الطريقة بأكملها بضع خطوات.
1) التحضير للمناسبات التربوية والاجتماعية.
2) أكسدة amiaku kisnem povitrya على البلاتين cittsi:
4NH 3 + 5O 2 = 4NO + 6H 2 O.
3) يتأكسد إلى أكسيد النيتروجين (II) إلى أكسيد النيتروجين (IV):
2NO + O2 = 2NO2.
4) تقدير نسبة أكسيد النيتروجين (IV) من الماء ومحتوى الحمض:
3NO2 + H2O = 2HNO3 + لا.
من السهل إجراء العملية في وجود الحمض ، حيث يتم تحويل كل أكسيد النيتروجين (IV) إلى حمض النيتريك.
5) استنتاجات مرحلة إزالة حامض النيتريك - تنقية الغازات مثل الغلاف الجوي من الأكسيد إلى النيتروجين. مستودعات غازات السيش: تصل إلى 98٪ نيتروجين ، 2-5٪ حمض و 0.02-0.15٪ أكاسيد نيتروجين. (يؤخذ النيتروجين من مصدر الأمونيا ، المأخوذ من أجل أكسدة الأمونيا.) إذا كانت أكاسيد النيتروجين في هذه الغازات أكثر من 0.02٪ ، يتم إجراء ذلك خصيصًا لتحديثها بشكل حفزي إلى نيتروجين ، لذلك هناك القليل من المشاكل الكبيرة .
كتبه كل ما يقال عن صيام التغذية: ولماذا نحتاج إلى حامض؟
حامض المص
Vchitel.حمض النيتريك نيابة عن virobrytvu: النيتروجين جيد ، وفي المقام الأول ملح حمض الأميك (كيف її الوسواس؟) ؛ خطابات vibukhovy (لماذا؟) ؛ بارفنيكيف. nіtratіv ، حول كيفية أن تكون في المستوى الهجومي.
مادة الإغلاق
تجربة أمامية للفصل
- لماذا مستوى النيتروجين المؤكسد في حامض النيتريك +5 ، وتكافؤ الشوتيري؟
- لا يدخل حمض النيتريك في التفاعل مع الفلزات اللامعة؟
- تحتاج إلى الحصول على بعض حمض الهيدروكلوريك وحمض النيتريك ، فهناك ثلاثة معادن على الطاولة - العسل والألمنيوم والزنك. ماذا تقصد بذلك؟
اختبار
الخيار 1
1. ما عدد الأرقام المرتبطة بتوزيع الإلكترونات لمستويات الطاقة في ذرة النيتروجين؟
1) 2, 8, 1; 2) 2, 8, 2; 3) 2, 4; 4) 2, 5.
2. إنهاء التطبيق العملي لردود الفعل العملية:
1) HNO 3 (وردي) + نحاس ... ؛
2) Zn + HNO 3 (conc.) ... ؛
3) HNO 3 + MgCO 3 ... ؛
4) CuO + KNO 3 ....
3. قدم ، كقاعدة عامة ، إحدى مراحل العملية وعودحمض النيتريك.
1) 4NH 3 + 5O 2 = 4NO + 6H 2 O ؛
2) 5HNO 3 + 3P + 2H 2 O = 3H 3 PO 4 + 5NO ؛
3) N 2 + O 2 = 2NO.
4. يتجلى النيتروجين في الأسفل خطوات الأكسدة السلبية:
1) N 2 O ؛ 2) لا ؛ 3) لا 2 ؛ 4) نا 3 ن.
5. تفاعل نشارة العسل مع حامض النيتريك المركز لينتج لحين الموافقة:
1) لا 2 ؛ 2) لا ؛ 3) ن 2 ؛ 4) NH 3.
الخيار 2
1. قيمة التكافؤ للنيتروجين واحدة:
1) 1; 2) 2; 3) 5; 4) 4.
2. اكتب التفاعل المحتمل بين حامض النيتريك المركز والمعادن المتقدمة: الصوديوم والألمنيوم والزنك والزاليزو والكروم.
3. تهتز الكلام ، مثل є syruvinoy لحمض النيتريك:
1) النيتروجين والماء ؛
2) أمواك ، وأحيانًا تلك المياه ؛
3) النترات.
4. لا يتفاعل حمض النيتريك المركز مع:
1) غاز ثاني أكسيد الكربون.
2) حمض الهيدروكلوريك.
3) في الفحم.
4) شريط هيدروكسيد.
5. مع تفاعل الحمض والمغنيسيوم المخفف ، يجب على المرء أن يتظاهر:
1) لا 2 ؛ 2) لا ؛ 3) N 2 O ؛ 4) NH 4 NO 3.
الشهادات - التوصيات الخيار 1. 1 – 4;
3 – 1; 4 – 4; 5 – 1. الخيار 2. 1 – 4;
3 – 2; 4 – 1; 5 – 4. |
تريفنيفي زاليك سبينر 11 فئة
سمة: " المعادن "
شكل الدرس:زاليك
تسيل: لإعادة النظر في معرفة المنح الدراسية حول موضوع: "اللافلزات" ؛ معلومات عامة عن قوى ساحقةاللافلزات والسبولوك. لتعزيز صياغة المعرفة بالحالات غير المعيارية والمعيشة ، من المؤسسات التابعة والمتميزة.
زافدانيا:
1. مراجعة المجال العام وإغلاق المعرفة بالدراسات حول اللافلزات و їkh spoluks ؛ أخذ التطور من وجهة نظر المنطق المضلل وكيمياء فولوديا ؛ الانتقال من القبول الرسمي المنطقي للمواد من قبل هؤلاء إلى رسالة منطقية مجازية بمساعدة المباني المتقدمة والمجدية وغير القياسية.
2. Razvinuvichki بحذر ، واكتشاف العفو ، وإحياء المصنع ، ورؤية البذاءة ، والتقاط الحقائق ، والإبهار ، فمن المنطقي للأفكار الشريرة والروبوتات ؛ vchiti rozmіrkovuvati ، robiti pripuschennya ، التوقعات.
3. قبول صياغة الأفكار المرئية الرئيسية من خلال النشاط المعرفي والاستقلالية الإبداعية للعلماء.
4. Vihovuvati vmіnnya pratsyuvati ضبط النفس من ضبط النفس. إظهار الروابط لأولئك الذين يعيشون في الحياة. فيهوففاتي svitoglyad العلمي على أساس الترابط بين القوى التي budovi.
التعامل مع تلك الكواشف:أنابيب الاختبار ومصابيح الكحول وأنابيب الاختبار والسيرنيك والرشيني: ; ;
; ;
;
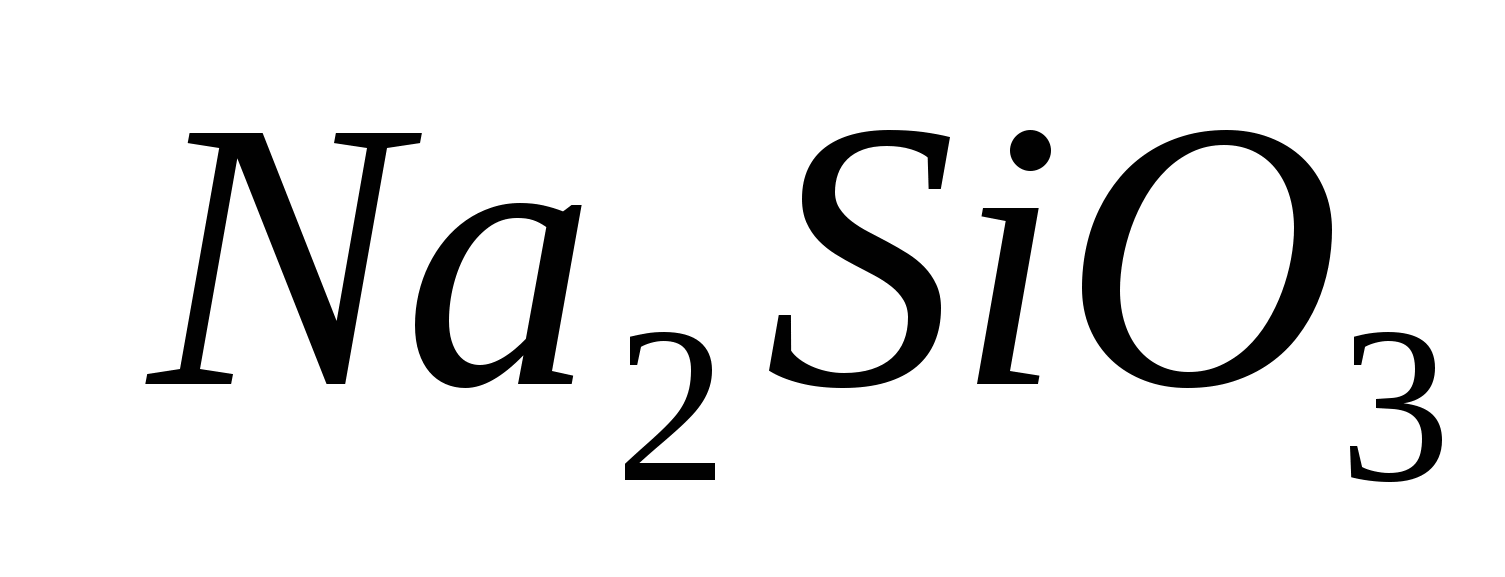 .
.
التحضير قبل المدخل.
أعد المعلم ثلاثة مستويات من قابلية الطي لأنواع البداية: الاختبار ، والتغذية النظرية ، وفهم الكلمات وتطويرها.
المعلم جاهز لتعليمك ، لأنك ستقوم بمراجعة الفريق.
لمدة يوم إلى يومين ، يتم إرسال ورقة المعلومات إلى المكتب.
ورقة الطريق مرئية للجلد. يشار إلى مخطط الروبوتات على الخطوات على أوراق الطريق.
ورقة الطريق.
F.І. مختص بمجال علمي
اسم الخطوة
جدول المراحل
رقم التسجيل
توقيع الانعكاس
مشكلة Rozrakhunkov
Rosp_znavannya
إعادة التجسد
اذهب إلى الدرس.
يدخل العلماء الفصل بأوراق مسار ، 5 أوراق فارغة ، بقلم ويذهبوا إلى الخطوة ، قيم الرقم 1. يلتقط العلماء معرفة قابلية الطي ويعودون إلى الحرف الجديد ، إذا كنت نائمًا ، على المسرح من "تسمية الكلمات".
على الروبوت ، يتم إدخال مرحلة الجلد من 7 إلى 8 ريشات ، مما يحول vistavlya إلى مسار ورقة rivn ، لا.
يتم عرض التقدير كمتوسط حسابي لجميع المراحل.
المضاف
"الاعتراف بالخطب"
1 روفين
1. تأكد من أن أيون واضح 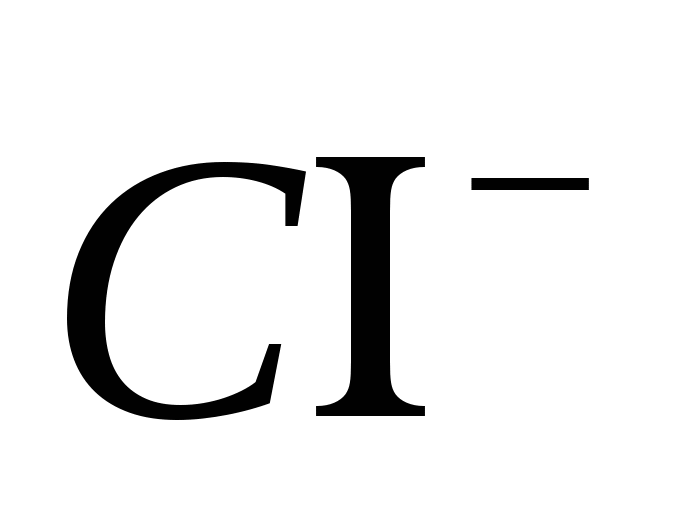
2. تأكد من أن أيون واضح 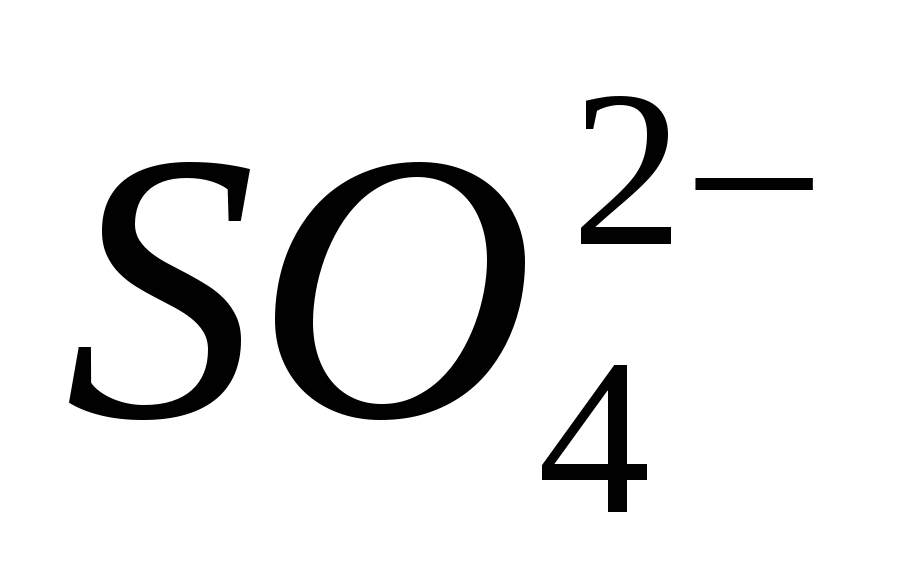
3. تأكد من أن أيون واضح 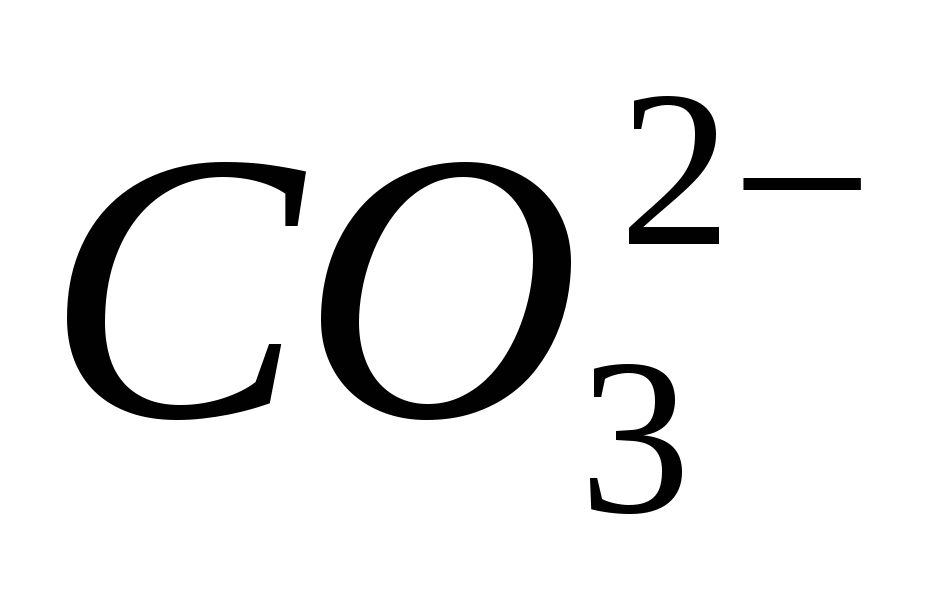
4. وضح الأمر 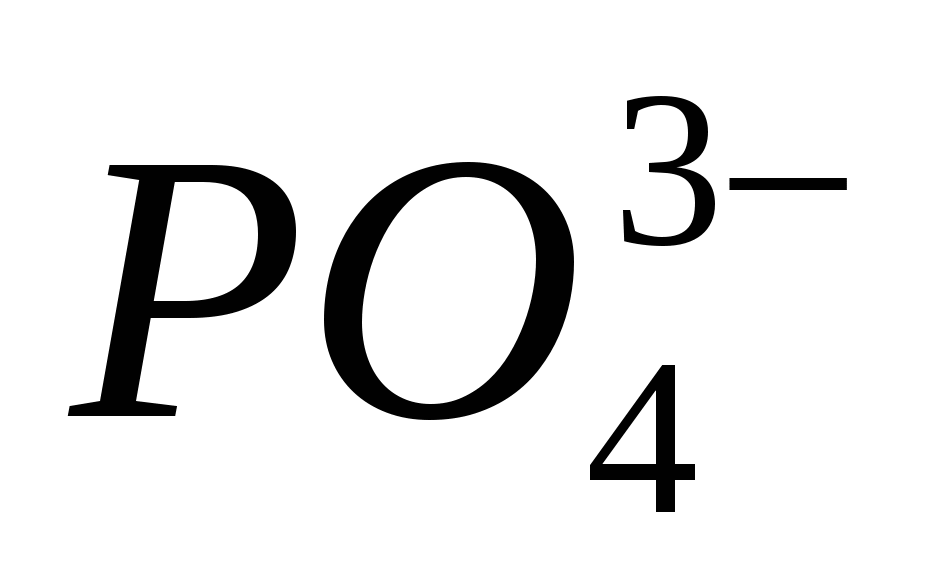
5. تأكد من أن أيون واضح 
2 روفين
1. تحديد الاختلافات وراء كاشف واحد:
2. تحديد الاختلافات وراء كاشف واحد:
3. تحديد الاختلافات الكامنة وراء كاشف واحد:
4. تحديد الاختلافات وراء كاشف واحد: 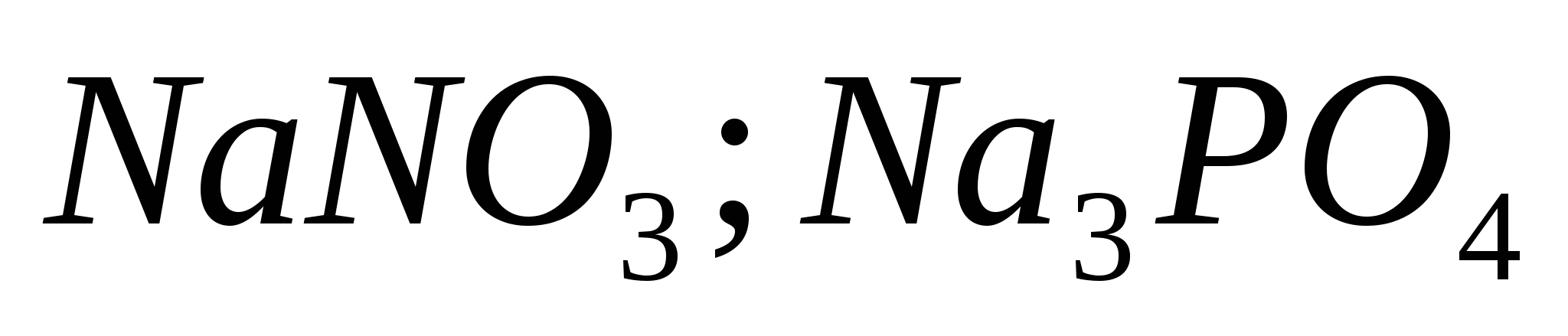 ;
;
5. تحديد الاختلافات وراء كاشف واحد:
3 روفين
1. تصميم بدون كواشف إضافية للموافقة:
2. تصميم بدون كواشف إضافية للموافقة:
3. التصميم بدون كواشف إضافية للموافقة:
4. تصميم بدون كواشف إضافية للموافقة:
5. تصميم بدون كواشف إضافية للموافقة:
ايتاب "مراجعة الكلام"
1 روفين
1. قم بإنهاء التفاعلات القياسية
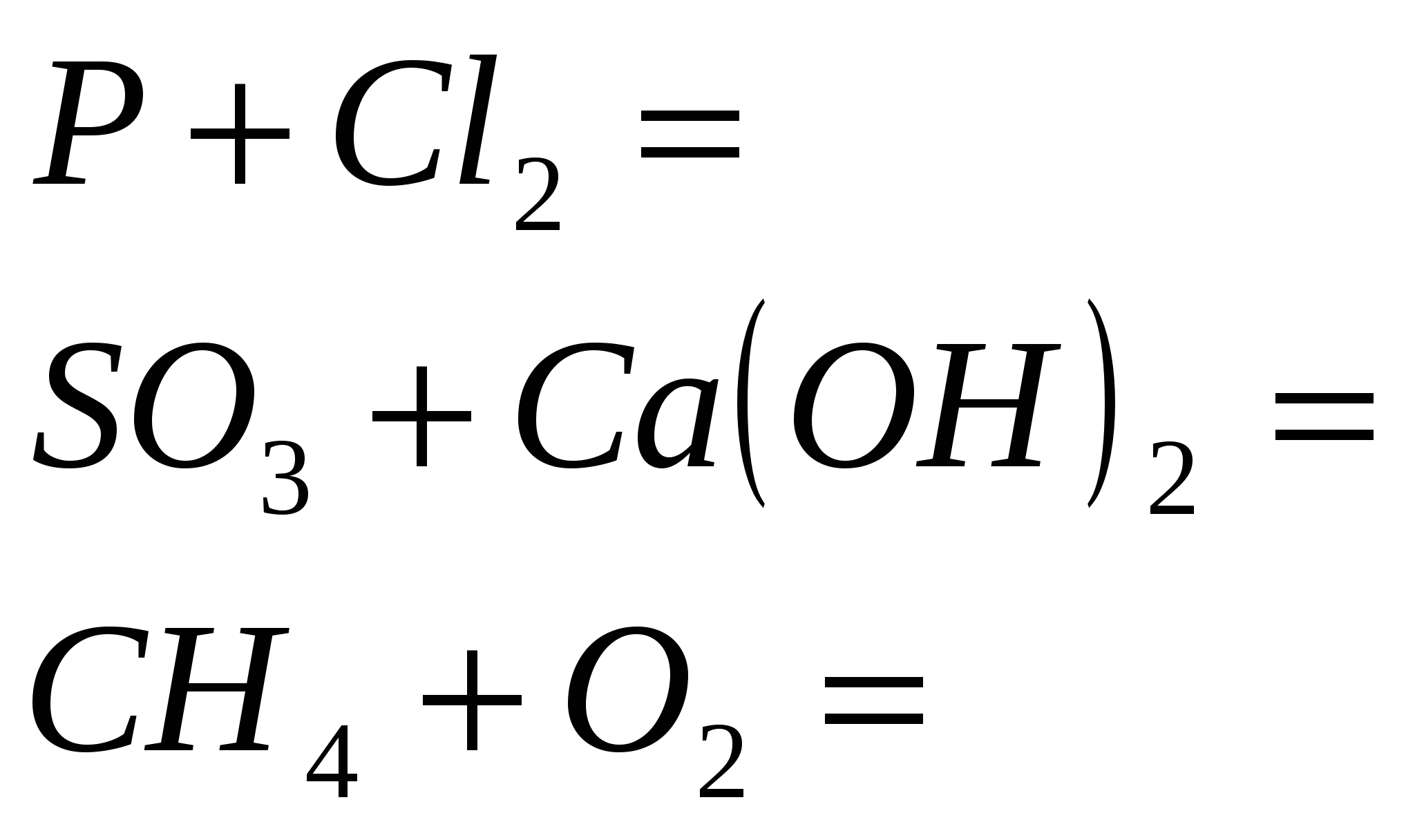
2. لإنهاء ردود الفعل الروتينية
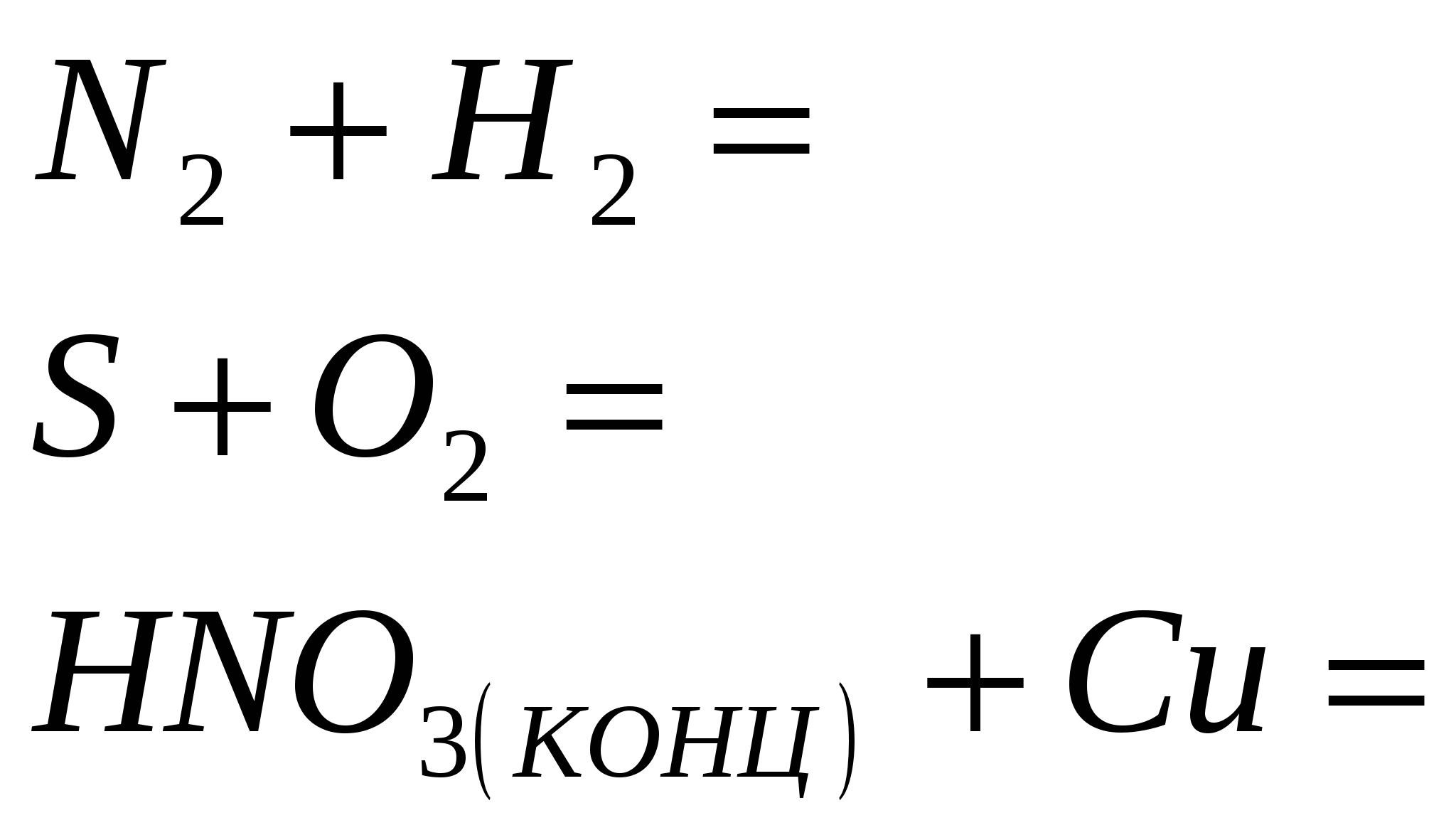
3. قم بإنهاء التفاعلات القياسية
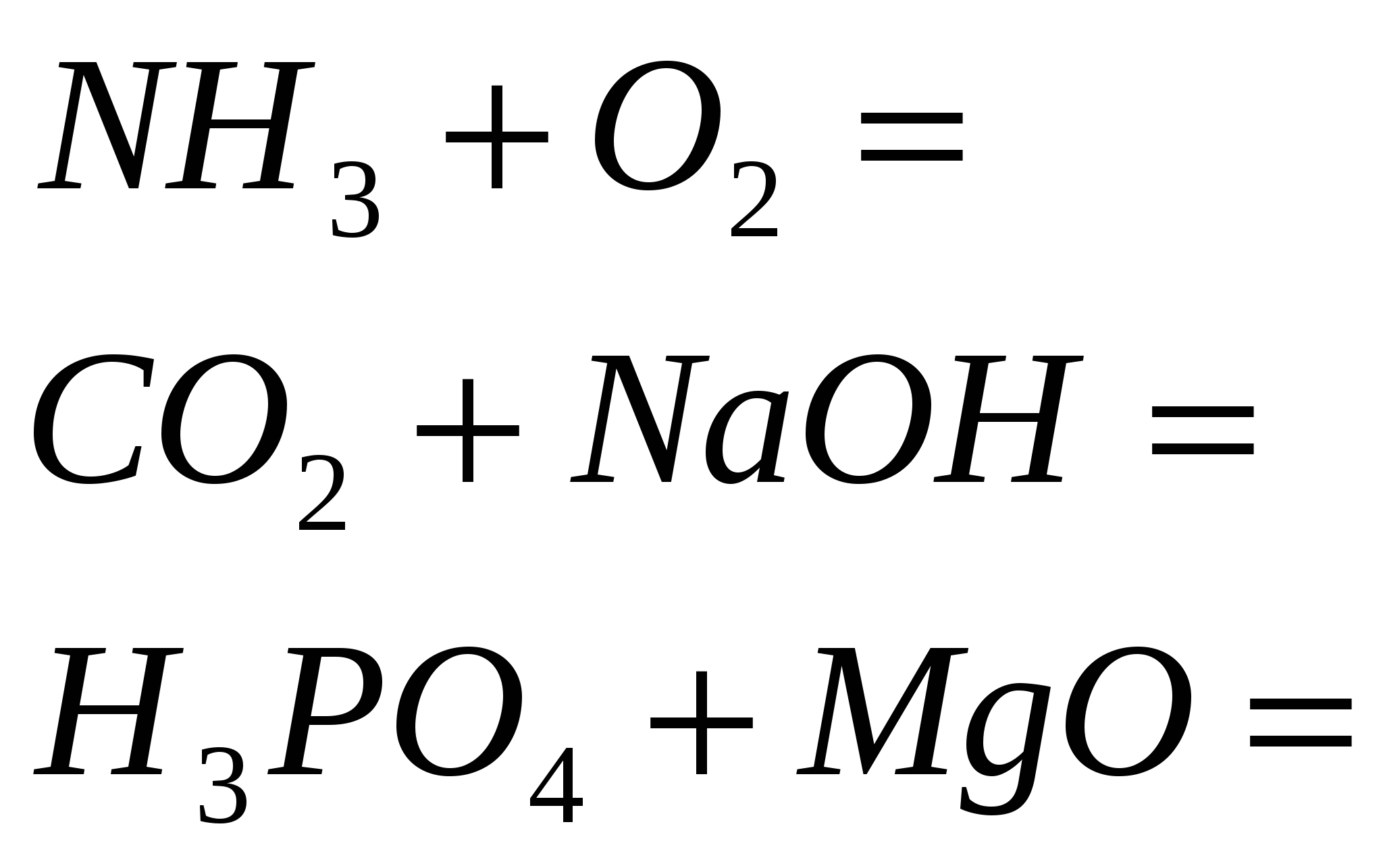
4. قم بإنهاء التفاعلات القياسية
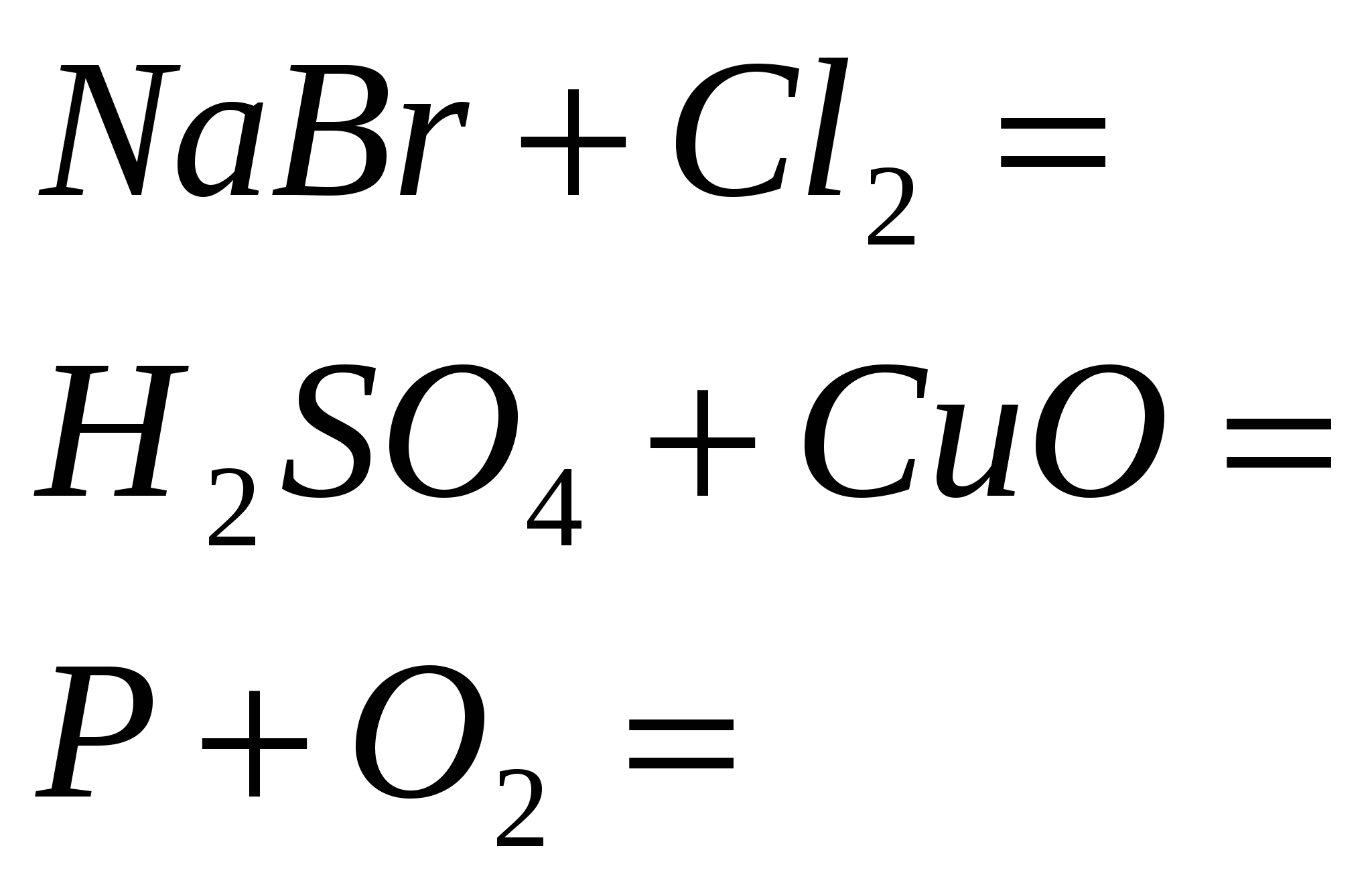
5. قم بإنهاء التفاعلات القياسية
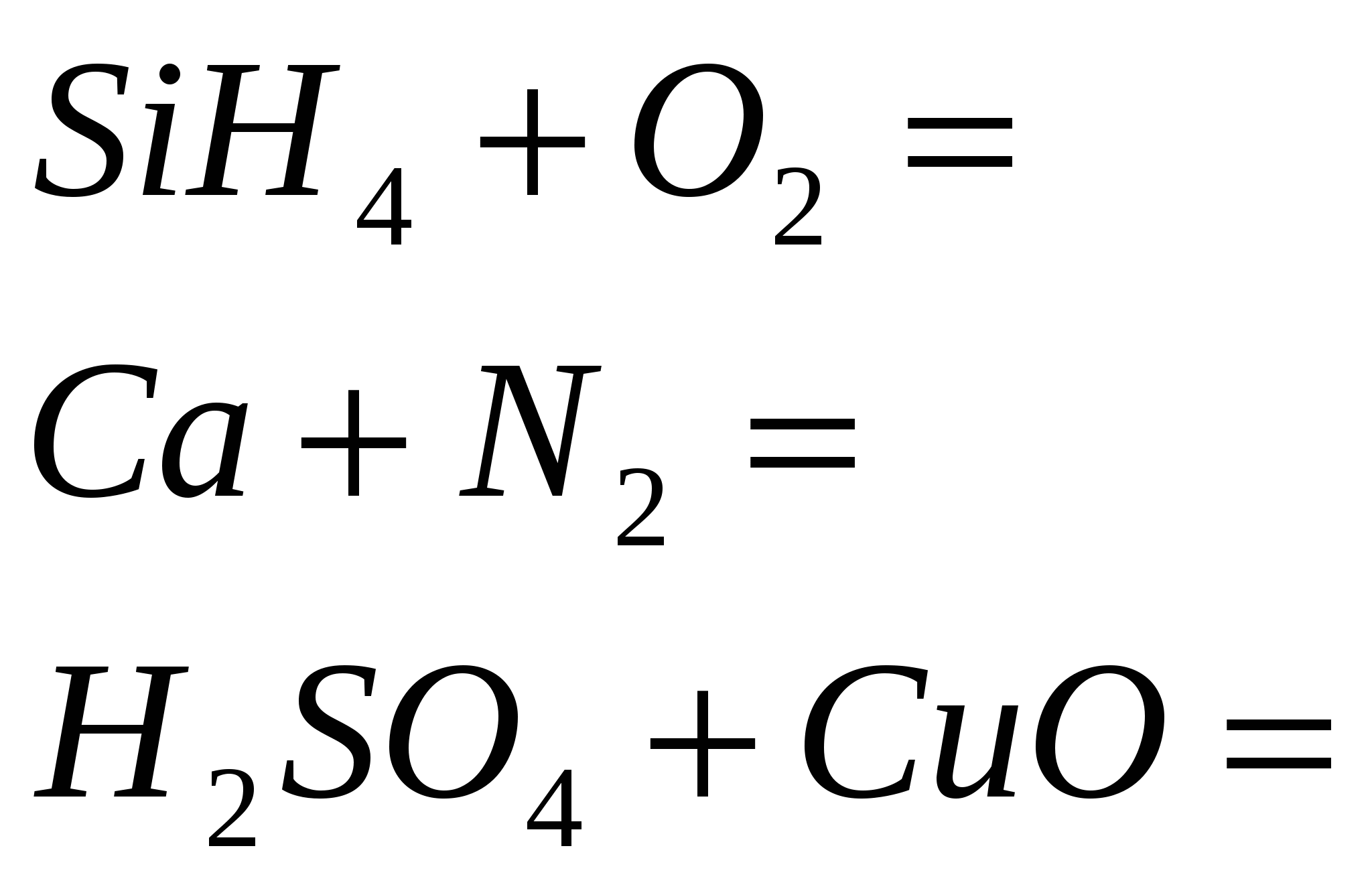
2 روفين
مراجعة Zdіysnіt:
3روفين
مراجعة Zdіysnіt:
3.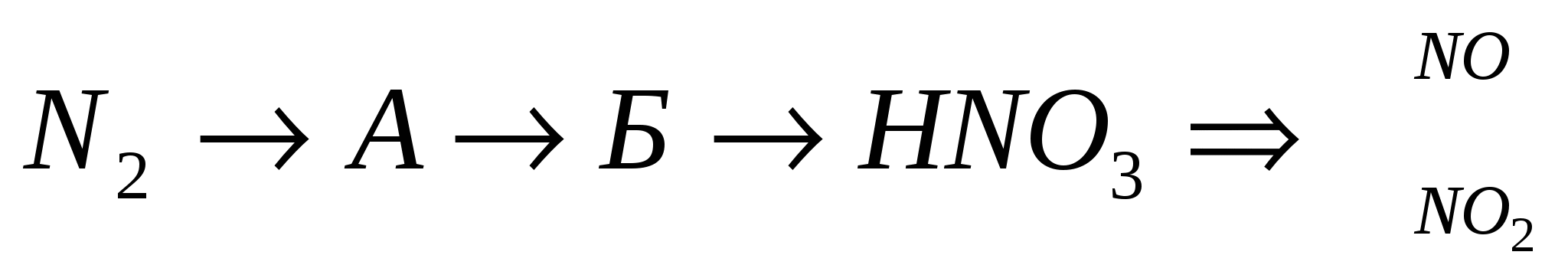
خطوة "اختبار"
الخيار 1
أ) O ، ب) S ، ج) Cl ، د) C ، هـ) Si.
أ) 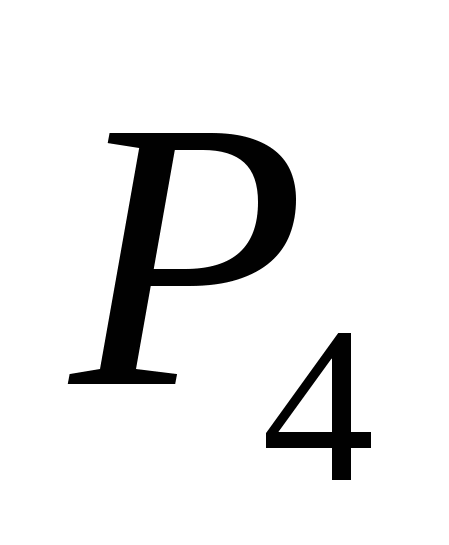 ، ب) ج ، ج)
، ب) ج ، ج) 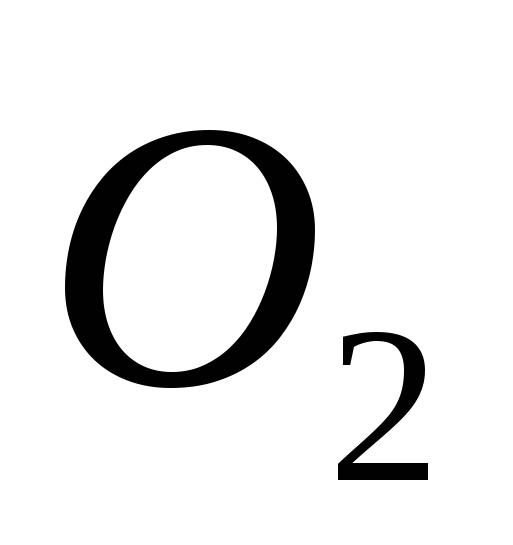 ، ز)
، ز) 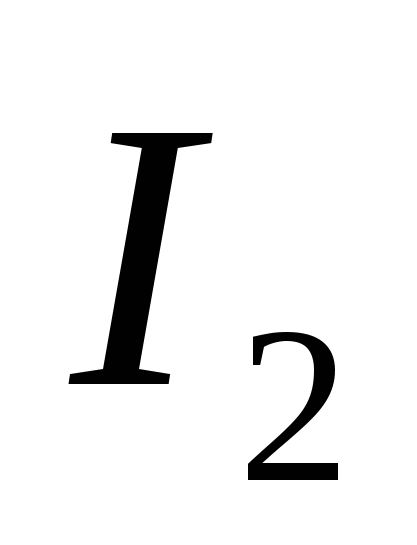 ه)
ه) 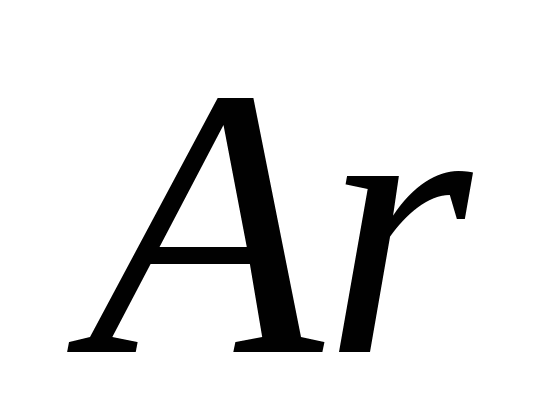 .
.
أ)  ، ب)
، ب)  ، الخامس)
، الخامس)  ، ز)
، ز)  ه)
ه)  .
.
4. الصيغة الإلكترونية للعنصر. يوغو تحلق فودنيفا سبولوك:
أ)  ، ب)
، ب)  ، الخامس)
، الخامس)  ، ز)
، ز)  .
.
5. قوة نمو الأحماض المائية في السلسلة:
أ) ![]()
ب) 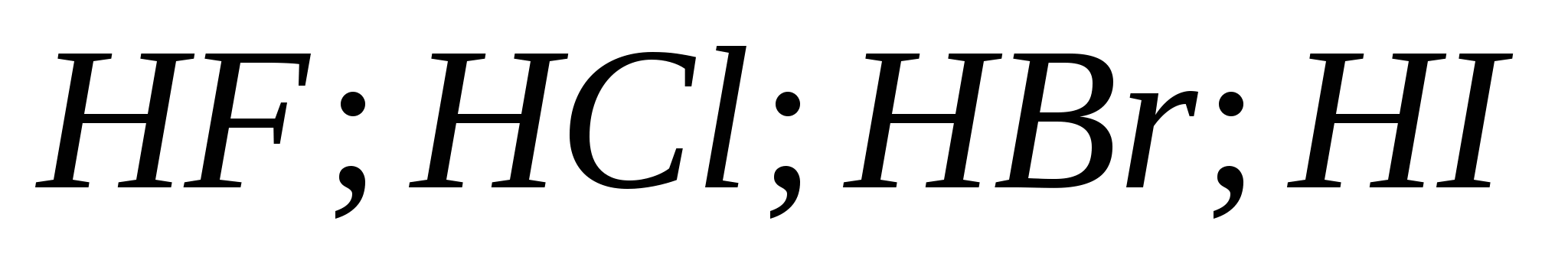
الخامس) 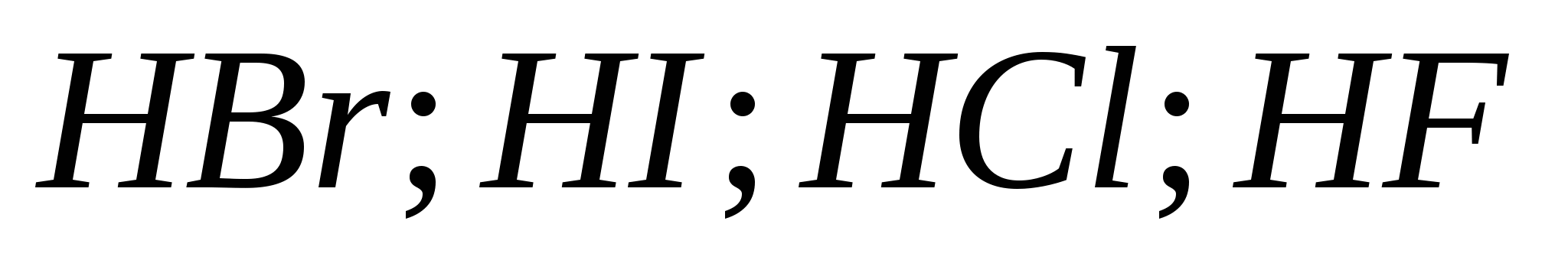
ز) 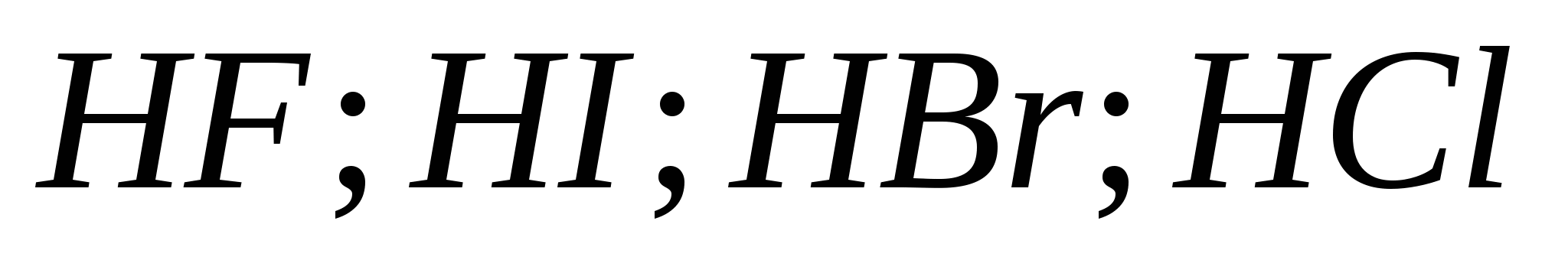
6. من الهالوجينات أمام بويوفيه دياخ الخطاب عالق:
أ) الفلور. ب) الكلور. ج) اليود. د) البروم.
7. حمض السيرتشان المخفف لقوة الأكسدة لتطوير الذرات:
أ)  ، ب)
، ب)  ، الخامس)
، الخامس)  .
.
8- يمكن دمج أكسيد النيتروجين V:
أ)  ، ب)
، ب)  ، الخامس)
، الخامس)  ، ز)
، ز) 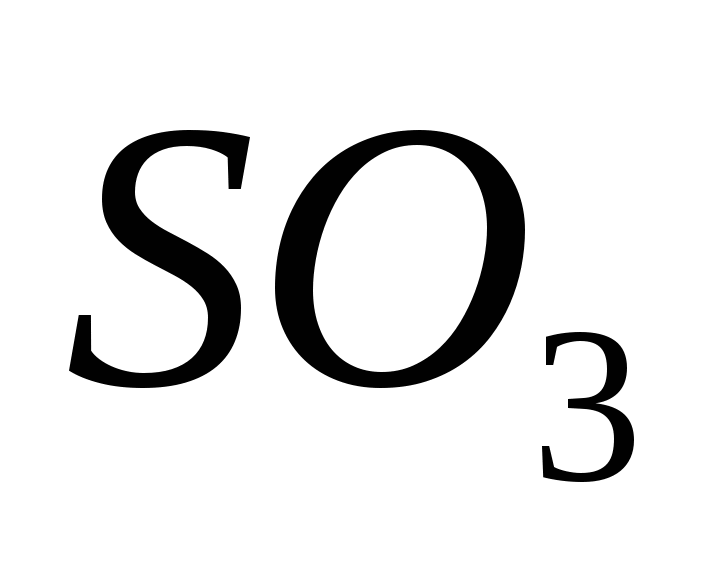 ه)
ه)  .
.
9. رد الفعل: لجلب مثل هذه السلطات إلى أمريكا:
أ) مؤكسد ، ب) مفرد ، ج) حامض ، د) قاعدي.
10. قوة الأحماض على التوالي
أ) التغيير ، ب) النمو ، ج) التغيير كثيرًا ، ثم التغيير ؛ د) رش السقوط والنمو ، هـ) لا يتغير.
الخيار 2
قد تكون النعم الكريستالية الذرية عبارة عن خطابات بسيطة ، تمت الموافقة عليها:
أ)  ، ب)
، ب)  ، الخامس)
، الخامس) 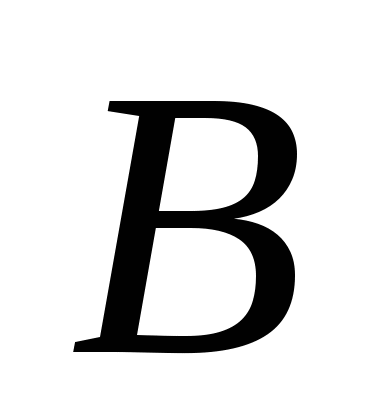 ، ز)
، ز) 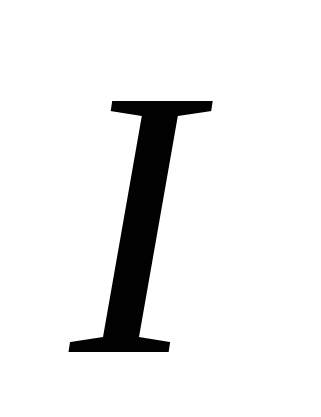 ه)
ه)  .
.
2. الغاز للعقول العادية є:
أ)  ، ب)
، ب) 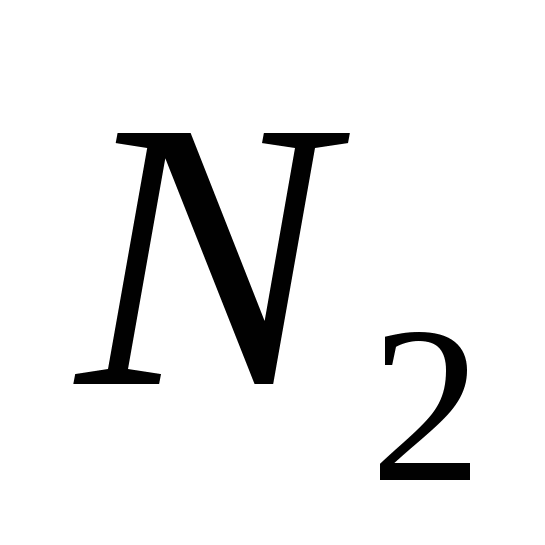 ، الخامس)
، الخامس) 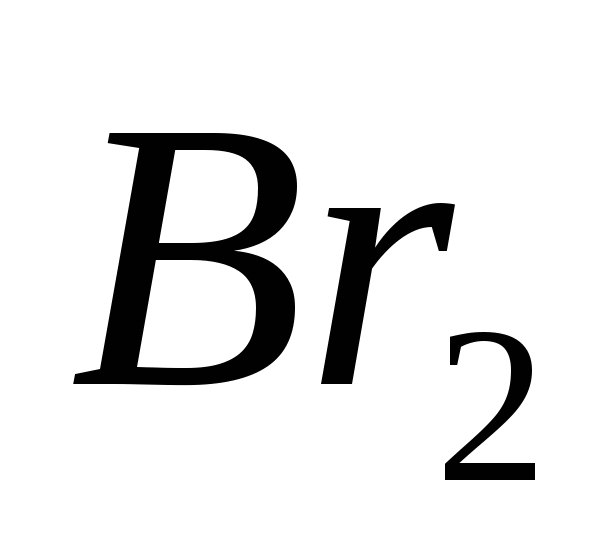 ، ز)
، ز)  ه)
ه) 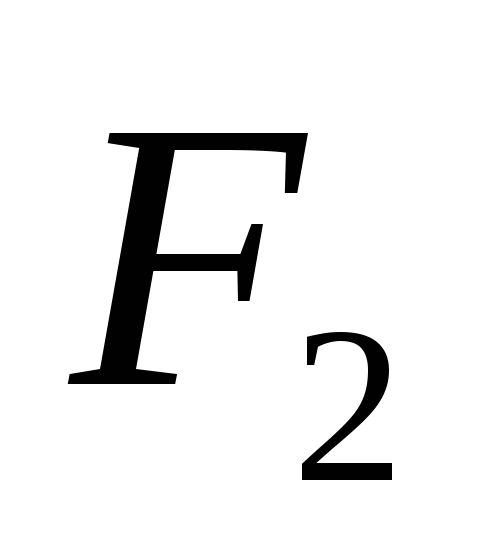 .
.
3. تنص التعديلات المتآصلة على العناصر التالية:
أ)  ، ب)
، ب)  ، الخامس)
، الخامس)  ، ز)
، ز)  ه)
ه)  ,
,
4. الصيغة الإلكترونية للعنصر. يوغو تحلق فودنيفا سبولوك:
أ)  ، ب)
، ب)  ، الخامس)
، الخامس)  ، ز)
، ز)  ه)
ه)  .
.
5. تتغير القوة الرئيسية للممرات المائية الصيفية بالترتيب التالي:
أ) 
ب) 
الخامس) 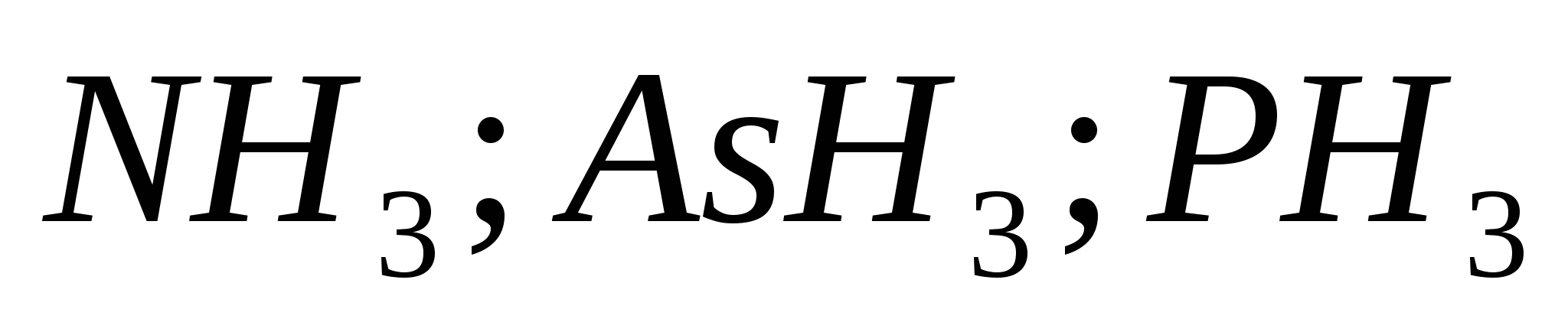
ز) 
6. للتشبث بالكلور ، يمكنك استخدام المحاليل المركزة:
أ)  ، ب)
، ب) 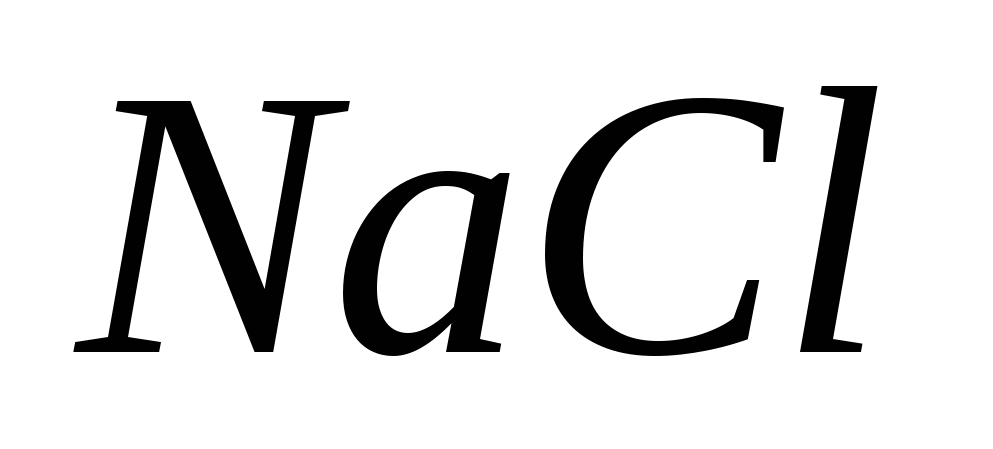 ، الخامس)
، الخامس)  ، ز)
، ز)  .
.
7. حمض السيرتشان المركز هو قوة مؤكسدة لراخونوك الذرات:
أ)  ، ب)
، ب)  ، الخامس)
، الخامس)  .
.
ملاحظة: 9-10 طرق عرض صحيحة - "5" ؛ 7-8- "4" ؛ 5-6- "3" ؛ أقل من 5-2
ETAP "نظرية"
أنا ryven (إلى "3")
اكتب التفاعلات النموذجية لوصف قوة حمض الهيدروكلوريك المخفف.
اكتب ردود فعل محددة لتوصيف قوة أكسيد السيركي (السادس).
اكتب التفاعلات النموذجية لوصف قوة حمض الصوديوم.
اكتب التفاعلات ذات الصلة لتوصيف قوة أكسيد الفوسفور (V).
اكتب ردود الفعل الرجعية التي تميز قوة أمريكا.
II ryven (على "4")
اكتب معادلات ينابيع المياه الصيفية غير المعدنية في الفترة الثانية. اشرح كيف ولماذا يحدث تغيير في القوة الحمضية.
اكتب معادلات الأكاسيد اللافلزية الأخرى في الفترة الثالثة. اشرح كيف ولماذا يحدث تغيير في القوة الحمضية.
اكتب معادلات العناصر الأكثر حمضية في الفترة الثالثة. اشرح كيف ولماذا يحدث تغيير في القوة الحمضية.
اكتب معادلات مجموعة السادس pidgroup المائية غير الفلزية المتطايرة. اشرح كيف ولماذا يحدث تغيير في القوة الحمضية.
اكتب صيغ الأحماض الأكثر حمضية لعناصر مجموعة Pidgroup VA. اشرح كيف ولماذا يحدث تغيير في القوة الحمضية.
المستوى الثالث (على "5")
تحديد الخواص الحمضية والحمضية لحمض النيتريك والهيدروكلوريك. يرجى تأكيد ردود الفعل البسيطة.
حدد القوة المؤكسدة والحمضية للأكسيد الرمادي (IV) والأكسيد في الكربون (IV). يرجى تأكيد ردود الفعل البسيطة.
تغيير القوة المؤكسدة والحمضية للماء وماء الفلوريد. يرجى تأكيد ردود الفعل البسيطة.
تحديد حموضة حامض النيتريك المركز والمخفف. يرجى تأكيد ردود الفعل البسيطة.
تحديد حموضة الأكسيد في الكربون (II) والأكسيد في الكربون (IV). يرجى تأكيد ردود الفعل البسيطة.
ETAP "مشكلة Rozrakhunkova"
أنا ryven (إلى "3")
II ryven (على "4")
مع تفاعل 37 جم من هيدروكسيد الكالسيوم مع كبريتات الأمونيوم ، تتم إزالة 15 جم من الأمونيا. احسب الجزء الكتلي من المدخلات amiak٪.
عندما يكون spalyuvanny في حامض 62 جم من الفوسفور ، يتم إزالة 130 جم من أكسيد الفوسفور (V). احسب الكسر الكتلي لمدخلات أكسيد الفوسفور (V)٪.
كم جرام من 10٪ تحتاج هيدروكسيد الصوديوم لمعادلة 8.96 لتر من ماء الكلور؟
يمكن قطع فلاتر اللترات الموجودة في ثاني أكسيد الكربون في عبوات سعة 10 كجم من فابنياك ، ويمكن إزالة 20٪ من المنازل.
كم جرام من الحصار يجب إعداده لتمرير 11.2 لترًا من ثاني أكسيد الكربون عبر 900 جرام من شريط هيدروكسيد 10٪؟
المستوى الثالث (على "5")
ما هو حجم 80٪ حمض النيتريك (pl. 1.46 جم / مل) الضروري لعسل "razchinennya" 32 جم؟
سيكون Yaka masa مطلوبًا للتفاعل مع حمض النيتريك شديد التركيز لإزالة 4 لترات (n.u.) أكسيد النيتروجين (IV) ؛
عندما "ينكسر" في تركيز حمض الهيدروكلوريك ، 20 جم من سبائك الذهب مع 4.2 لتر (n.u.) أكسيد الرمادي (IV). Visnite الكسر الكتلي في٪ من السبيكة.
تم تمرير كمية غاز في الكلور وحجم 1 لتر عبر محلول يوديد الكالسيوم. رأيت 5.08 ص من اليود في تسومو. ابحث عن جزء (٪) من غاز الكلور في المجموع الشرير.
تم سكب كمية السيليكون والفوجيلا بكتلة 10 جم على نطاق شديد التركيز من هيدروكسيد الصوديوم. نتيجة للتفاعل ، شوهد 5.6 لتر من الماء (n.o.). Visnite الكسر الكتلي للسيليكون (٪) عند tsіy sumіshі.
