عند توصيل 28 غرام من السيليكون بالأكسجين. مركبات الأكسجين السيليكون
السيلكون.الخاصية العامة: الفرق الرئيسي من الكربون: عدم وجود رابطة n في المركبات.السيليكيدات.المركبات التي تحتوي على الهيدروجين (السيلان) والأكسدة والتحلل المائي.تيترافلورايد ورابع كلوريد السيليكون ، التحلل المائي.السيليكات الفلورية السيليكا (IV). الحمض ، السيليكات ، الذوبان والتحلل ، السيليكات الطبيعية والألومينوسيليكات ، الزيوليت ، مركبات السيليكون العضوي ، السيلكونات والسيلوكسان ، استخدام مركبات السيليكون في الطب.
السيليكون (Latin Silicium) ، Si ، العنصر الكيميائي للمجموعة IV من الجدول الدوري ؛ العدد الذري 14 ، الكتلة الذرية 28.086. يحتوي السيليكون أيضًا على تهجين SP3
المدارات. على طبقة الإلكترون الخارجي لذرة السيليكون يوجد التكافؤ ثلاثي الأبعاد
المدارات (Si: 3s23p23d0) ،
السيليكون بعد الأكسجين هو العنصر الأكثر شيوعا في القشرة. على عكس الكربون في الحالة الحرة ، لا يوجد السيليكون في الطبيعة. مركباته الأكثر شيوعًا هي أكسيد السيليكون (IV) SiO2 وأملاح حمض السيليك ، السيليكات. إنها تشكل قشرة الأرض. تم العثور على مركبات السيليكون في النباتات والحيوانات. وفقًا للخصائص الكيميائية ، يعتبر السيليكون ، مثل الكربون ، غير معدني ، ولكن درجة اللامعدنية فيه أقل وضوحًا ، حيث يبلغ قطر نصف قطرها الذري أكبر
السيليكون. أشكال المركبات مع جميع المعادن تقريبا - مع ilitsidy (لم يتم العثور على مركبات فقط مع Bi، Tl، Pb، Hg). تم الحصول على أكثر من 250 مبيد للسيل ، عادةً لا يتوافق تركيبها (MeSi ، MeSi2 ، Me5Si3 ، Me3Si ، Me2Si ، إلخ.) المبيدات الحشرية تختلف في الحراريات والصلابة. إن السبائك الحديدية (عامل الاختزال في صهر السبائك الخاصة ، انظر السبائك الحديدية) و MoSi2 الموليبدينوم السيليسيد (سخانات الأفران الكهربائية ، ريش التوربينات الغازية ، إلخ) هي ذات أهمية عملية كبيرة.
سيلاني. تحت تأثير حمض الهيدروكلوريك على المبيدات الحشرية ، فإن أبسط مركب هيدروجين من السيليكون هو silane SiH4:
Silane هو غاز سام مع رائحة كريهة ، فإنه يشعل من تلقاء نفسه. الهواء
هم رد الفعل وقوية وكلاء الحد.
تتفاعل مع الماء عندما درجة حرارة الغرفة:
SiH4 + 2H2O → SiO2 + 4H2 ،:
رابع فلوريد ينتج السيليكون عن طريق فلورة ثاني أكسيد السيليكون بالفلور الأولي.
تتم عملية الفلورة على مرحلتين في مفاعل اللهب ، وتوجيه الفائض من الفلور الأولي من المرحلة الأولى إلى الثانية.
والنتيجة التقنية هي إنتاج السيليكون في وضع مستمر مع إنتاجية عالية وجودة المنتج.
رباعي فلوريد السيليكون يتكون SiF4 بواسطة عمل حمض الهيدروفلوريك (الهيدروفلوريك) على الزجاج:
Na2SiO3 + 6HF ® 2NaF + SiF4 + 3H2O
مركبات الأكسجين السيليكون
مركب الأكسجين الأكثر أهمية في السيليكون هو ثاني أكسيد السيليكون SiO2 (السيليكا) ، والذي يحتوي على العديد من التعديلات البلورية.
يُسمى تعديل درجة الحرارة المنخفضة (حتى 1143 كلفن) الكوارتز. الكوارتز له خصائص كهرضغطية. أصناف طبيعية من الكوارتز: حجر الراين ، التوباز ، الجمشت. أنواع السيليكا هي العقيق ، العقيق ، العقيق ،. يشب والرمل.
السيليكا مقاومة كيميائيا. يتأثر فقط بالفلور وحمض الهيدروفلوريك والقلويات. يذهب بسهولة إلى حالة زجاجية (زجاج الكوارتز). زجاج الكوارتز هش ومقاوم كيميائيا وحراريا. لا يحتوي حمض السيليك SiO2 المقابل على تركيبة محددة. عادة ، يتم تسجيل حمض السليكيك على أنه xH2O-ySiO2. تم اختيار أحماض السيليك: H2SiO3 (H2O-SiO2) - السيليكون الفوقية (ثلاثي أكسيد السيليكون) ، H4Si04 (2H20-Si02) - السيليكون العظمي (رباعي أوكسو السيليكون) ، H2Si2O5 (H2O * SiO2).
أحماض السيليك هي مواد ضعيفة الذوبان. وفقًا لطبيعة السيليكون الأقل ميتاليد مقارنة بالكربون ، فإن H2SiO3 ككهارل أضعف من H2CO3.
المقابلة أملاح حمض السيليك - سيليكات في الماء غير قابلة للذوبان (باستثناء السيليكات المعدنية القلوية). تتحلل السيليكات الذائبة بالمعادلة
2SiO3 - + H20 = Si2O52- + 20H-.
المحاليل المركزة للسيليكات الذائبة تسمى الزجاج السائل. يحتوي زجاج النوافذ المعتاد من سيليكات الصوديوم والكالسيوم على تكوين Na20-CaO-6Si02. يتم الحصول عليها عن طريق رد الفعل
مجموعة واسعة من السيليكات (بتعبير أدق ، أكاسيليكات) معروفة. ويلاحظ وجود انتظام معين في بنية الأكسوسيليكات: كلها تتكون من Si04 رباعي الاسطح ، والتي ترتبط مع بعضها البعض من خلال ذرة الأكسجين. المجموعات الأكثر شيوعا من رباعي الاسطح هي (Si2O76-) ، (Si3O9) 6- ، (Si40l2) 8- ، (Si6O1812-) ، والتي ، كوحدات هيكلية ، يمكن دمجها في سلاسل وأشرطة وشبكات وهياكل عظمية (الشكل 4).
السيليكات الطبيعية الأكثر أهمية ، على سبيل المثال ، التلك (3MgO * H20-4Si02) والأسبستوس (SmgO * H2O * SiO2). كما هو الحال مع SiO2 ، فإن الحالة الزجاجية (غير المتبلورة) هي خاصية السيليكات. مع تبلور الزجاج المتحكم فيه ، من الممكن الحصول على حالة بلورية (مراحيض). تتميز Sitalls بزيادة القوة.
بالإضافة إلى السيليكات ، تنتشر الألومينات سيليكات في الطبيعة. ألومينوسيليكات - أكاسيليكات إطار ، حيث يتم استبدال جزء من ذرات السيليكون بعقار ثلاثي التكافؤ ؛ على سبيل المثال Na12 [(Si، Al) 04] 12.
بالنسبة للحمض السيليك ، تكون الحالة الغروية مميزة عندما لا تتأثر أملاح الحمض H2SiO3 على الفور. يمكن تحويل المحاليل الغروية لحمض السيليك (sols) في ظروف معينة (على سبيل المثال ، عند تسخينها) إلى هلام كتلة شفاف متجانس يشبه الهلام من حمض السيليك. المواد الهلامية عبارة عن مركبات ذات جزيئات عالية ذات بنية مكانية وفضفاضة للغاية تتشكل من جزيئات SiO2 ، وتملأ الفراغات منها بجزيئات H2O. عند تجفيف المواد الهلامية حمض السيليك ، يتم الحصول على هلام السيليكا - منتج مسامي مع قدرة امتصاص عالية.
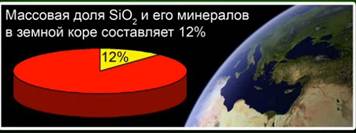
أكسيد السيليكون (الرابع) (السيليكا) هو المركب الأكثر شيوعًا في قشرة الأرض ، ويشتمل على 12٪ من كتلته في شكل معادن مختلفة. التمييز بين السيليكا البلورية وغير المتبلورة. أبسط صيغة لأكسيد السيليكون (IV) هي SiO2. تتبلور في الشبكة الذرية.
1) السيليكا البلورية - في شكل معدن من الكوارتز وأصنافه (البلور الصخري ، العقيق الأبيض ، العقيق ، اليشب ، الصوان) ؛ يشكل الكوارتز أساس رمال الكوارتز المستخدمة على نطاق واسع في البناء وفي صناعة السيليكات.
2) غير متبلور السيليكا - في شكل تكوين العقيق المعدنية SiO2 nH2O. الأشكال الترابية للسيليكا غير المتبلورة هي دياتوميت ، ترايبولي (تربة infusorial) ؛ من أمثلة السيليكا اللامائية غير المتبلرة الاصطناعية هلام السيليكا ، والذي يتم الحصول عليه من ميتاسيليكات الصوديوم:
Na2SiO3 + 2HCl = 2NaCl + H2SiO3
يحتوي هلام السيليكا على سطح متطور ولهذا تمتص الرطوبة جيدًا.
هلام السيليكا هو عبارة عن هلام مجفف يتكون من المحاليل المفرطة لحمض السيليك (nSiO2 · mH2O) عند درجة الحموضة\u003e 5-6. مادة ماصة للماء الصلبة.
استقبال
يتم الحصول عليها عن طريق تحمض المحاليل السيليكات المعدنية القلوية ، تليها غسل وتجفيف هلام تشكيل:
حمض السيليك. SiO2 هو أنهيدريد لعدد من الأحماض السيليكية
يتكون حمض السليكيك من الوحدات الهيكلية رباعية السطوح (في كل وحدة من هذه الوحدات ، توجد ذرة السيليكون في وسط رباعي السطوح ، وتوجد ذرات أكسجين في القمم). الروابط الهيكلية ، متحدة في سلاسل ، تشكل أحماض سيليكون أكثر استقرارًا:
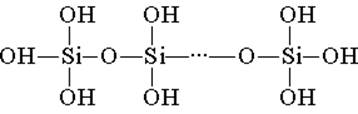
يمكن التعبير عن تكوين مثل هذا المركب بالصيغة (H2SiO3) n. ومع ذلك ، عادة ما يمثل حمض السيليك بواسطة الصيغة H2SiO3. H2SiO3 - الحمض ضعيف جدًا ، قليل الذوبان في الماء. عند تسخينها ، تتحلل بسهولة مثل حمض الكربونيك:
جميع الأحماض السيليكية ضعيفة للغاية (أضعف من الفحم).
السيليكات. تسمى أملاح جميع الأحماض السيليكية السيليكات ، على الرغم من أن السيليكات في الأدب التربوي ، كقاعدة عامة ، تتضمن أملاح حمض الميثاسيليك. وعادة ما يتم تمثيلها من خلال الصيغة في شكل مركبات أكاسيد العناصر. على سبيل المثال ، يمكن التعبير عن سيليكات الكالسيوم CaSiO3 كـ: CaO × SiO2.
يطلق على السيليكات المكونة للتكوين R2O × nSiO2 ، حيث يكون R2O أكاسيد الصوديوم أو البوتاسيوم ، الزجاج الذائب ، وتسمى المحاليل المائية المركزة بالزجاج السائل. الأكثر أهمية هو الزجاج القابل للذوبان الصوديوم.
عند الوقوف في الهواء ، تزداد محاليل السيليكات تعكرًا ، حيث إن ثاني أكسيد الكربون (IV) في الهواء يحل محل حمض السيليك من أملاحه:
حمض السليكيك غير قابل للذوبان عمليا في الماء - تستخدم هذه الخاصية كرد فعل نوعي على أيون SiO32-.
يتم الحصول على السيليكات عن طريق دمج السيليكا مع القلويات أو الكربونات:
ذوبان حمض السيليك ويعتمد معدل انحلاله على عدة عوامل ، أهمها تعديل ثاني أكسيد السيليكون المتخذ ودرجة تشتيته ودرجة حرارته. عند هز هلام السيليكا بالماء ، يتم إنشاء توازن الذوبان في غضون ساعات قليلة ؛ في حالة الكوارتز ، هناك حاجة لعدة أشهر وحتى سنوات.
سيليكات طبيعية (من اللاتينية. silex ، جنس. حالة من السيليكات - فلينت * أ. السيليكات الطبيعية ؛ N. naturliche Silikate ؛ F. سيليكات المواد الطبيعية ؛ و silicticos naturales) - فئة من المعادن ، أملاح السيليكات ، أحماض إيزية غير متجانسة. تمثل حصة السيليكات الطبيعية ما يصل إلى 75 ٪ من كتلة قشرة الأرض وحوالي 25 ٪ من الأنواع المعدنية. في الطبيعة ، هناك أكثر من 700 من السيليكات الطبيعية معروفة ، بما في ذلك أهم المعادن المكونة للصخور (الفلسبار ، البيروكسينات ، البرمائيات ، الميكا ، إلخ)
الألمنيوم - مجموعة من السيليكات الطبيعية والاصطناعية ، تحتوي الأنيونات المعقدة على السيليكون والألومنيوم. أمثلة على الأنيونات المعقدة: - ، - ، 2–. تعمل كل من Na + و K + و Mg2 + و Ca2 + وأحيانًا Ba2 + و Li + ككاتيونات.
تعتبر الألومينات سيليكات الطبيعية أكثر المعادن شيوعًا ، فهي تمثل ما يصل إلى 50٪ من كتلة القشرة الأرضية. وتشمل هذه الفلسبار (ألبيتي ، أورثوكلاز ، أنورتيتي) ، ومعادن الطين والميكا.
الزيوليت - هذه عبارة عن ألومينوسيليك مائي من الكالسيوم والصوديوم والبوتاسيوم والباريوم وبعض العناصر الأخرى. تضم مجموعة الزيوليت أكثر من أربعين معادن ، والتي تختلف في تكوينها (خاصة في عدد جزيئات الماء في هيدرات البلورية) ، وبالطبع في الخواص الفيزيائية والكيميائية. ولكن تقريبا جميع ممثلي هذه المجموعة من المعادن لديها الملكية المشتركة - إنها مواد ماصة جيدة ، وتمتلك خصائص التبادل الأيوني ، وقادرة على تغيير تنقل الأيونات الفردية والعمل كمناخل جزيئية. ومؤخرًا نسبيًا ، وجدت هذه المعادن استخدامًا غير متوقع تمامًا - بدأ استخدامها في الزراعة.
مركبات السيليكون العضوي - المركبات التي توجد بها جزيئات رابطة بين ذرات السيليكون وكربون. تسمى مركبات السيليكون العضوي في بعض الأحيان بالسليكون ، من اسم السيليكون اللاتيني "السيليكون". تستخدم مركبات السيليكون العضوي لإنتاج مواد التشحيم والبوليمرات والمطاط والمطاط وسوائل السيليكون والمستحلبات. تستخدم مركبات السيليكون العضوي في مستحضرات التجميل والمواد الكيميائية المنزلية والدهانات والورنيش والمنظفات. ميزة مميزة المنتجات القائمة على مركبات السيليكون العضوي من المنتجات القائمة على المركبات العضوية الشائعة هي ، كقاعدة عامة ، أداء وخصائص أعلى ، وكذلك سلامة الاستخدام البشري. يمكن استخدام بوليمرات السيليكون لصنع قوالب في الطهي. بلمرة مركبات السيليكون العضوي ومانعات التسرب آمنة للبشر ولا تتطلب الاستخراج.
siloxane - مركبات تحتوي على ذرات السيليكون والأكسجين بالتناوب في جزيء. أعلى لديها السيلوكسان عالية الوزن الجزيئي - polyorganosiloxanes. رؤية البوليمرات سيليكون.
السيليكون (polyorganosiloxanes) - مركبات السليكون العضوي عالية الوزن المؤكسج مع الصيغة الكيميائية n ، حيث R = مجموعة عضوية (ميثيل ، إيثيل أو فينيل). الآن نادراً ما يتم الالتزام بهذا التعريف ، ويتم دمج polyorganosiloxanes (على سبيل المثال ، زيوت السيليكون من نوع PMS ، طارد NGL للماء أو المطاط SKTN ذو الوزن الجزيئي المنخفض) وحتى monomers سيلكون عضوي (مختلف silanes) يتم دمجها في "silicones". سيليكون. "
السيليكون المعدني  كريستال السيليكون
كريستال السيليكون
السيليكون (سي). هذا العنصر الكيميائي هو 1/4 من تكوين قشرة الأرض. الكوارتز ، الكريستال الصخور ، الرمل ، الطين ، الجرانيت ، الميكا ، الأسبستوس - كل هذا مركبات كيميائية من السيليكون
السيليكون هو عنصر وسيط (مذبذب) ويمكن أن يحمل كلاً من الخصائص المعدنية وغير المعدنية. يمكن أن تشكل مركبات كيميائية ، سواء مع المعادن أو غير المعادن.
السيليكون النقي - مادة كيميائية بسيطة من اللون الرمادي ، من الصعب ، الحرارية وهشة. كريستال السيليكون له بريق معدني ويستخدم على نطاق واسع في صناعة أشباه الموصلات (وهو أشباه الموصلات).
سيكون السيليكون قادراً على التدفق كما هو الحال في حالة البلورية ( السيليكون البلوري) ، وفي حالة غير متبلور ( السيليكون غير المتبلور). يتكون السليكون البلوري عن طريق تبريد محلول من السيليكون غير المتبلور في المعدن المنصهر. بدوره ، يعد السيليكون البلوري مادة هشة للغاية ويتم سحقه بسهولة إلى مسحوق غير متبلور. وهكذا، السيليكون غير المتبلور هو جزء من بلورات السيليكون البلوري.
في الحالة الحرة ، يصعب الحصول على السيليكون. يرتبط إنتاجها الصناعي باسترداد الكوارتز ، الصيغة الكيميائية الذي - SiO 2 ، يتم إنتاج تفاعل الاختزال بواسطة فحم الكوك الساخن (الكربون).
SiO 2 + C → CO 2 + Si
في المختبر ، يتم تقليل السيليكون النقي من رمل السيليكا مع المغنيسيوم المعدني باستخدام التفاعل التالي:
SiO 2 + 2Mg → Si + 2MgO.
خلال هذا التفاعل ، يتم تشكيل مسحوق بني من السيليكون غير المتبلور. عند تسخينه ، يمكن للمسحوق أن يتفاعل ببطء مع المحاليل المركزة للقلويات (على سبيل المثال ، هيدروكسيد الصوديوم NaOH)
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2 ، - المادة المعقدة الناتجة - تسمى أيضًا الزجاج السائل.
ومن المثير للاهتمام أن النشاط الكيميائي للسيليكون يعتمد على حجم بلوراته. السيليكون البلوري المشترك أقل نشاطًا كيميائيًا من غير المتبلور. هذا الأخير يتفاعل بسهولة مع الفلور حتى في درجة الحرارة العادية ، وعند درجة حرارة من 400 إلى 600 درجة مئوية ، فإنه يتفاعل مع الأكسجين والكلور والبروم والكبريت لتشكيل المركبات الكيميائية المقابلة. في درجات الحرارة المرتفعة للغاية ، يتفاعل السيليكون مع النيتروجين والكربون لتشكيل نتريد وكربونات السيليكون ، على التوالي.
إذا حاولت إذابة السيليكون في مزيج من أحماض الهيدروفلوريك الهيدروفلوريك (الهيدروفلوريك) وأحماض النيتريك HNO 3 ، فلن يستمر التفاعل. ولكن إذا قمت بإجراء تفاعل كيميائي مع قلوي ، على سبيل المثال ، مع هيدروكسيد البوتاسيوم ، فسيحدث التفاعل بتكوين ملح من حمض السليكيك
Si + KOH → K 2 SiO 3 + H 2
إذا كان المكلس في أكسيد السيليكون (فرن) مع فحم الكوك ، فإنه يتحول إلى مادة بلورية صلبة للغاية الورق المفحم كربيد
SiO 2 + 3C → SiC + 2CO
الورق المفحم - مادة صلبة للغاية ومقاومة للحرارة. في الصناعة ، يتم إنتاجها بكميات كبيرة بسبب هذه الخصائص. ومن المثير للاهتمام أن الشبكة البلورية المصنوعة من الكربوروند تشبه الشبكة البلورية لأصعب المواد - الماس ، ولكن في ذلك يتم استبدال ذرات الكربون الفردية بشكل موحد بذرات السيليكون.
في درجات الحرارة العالية ، وكذلك خلال التفاعلات الكيميائية تحت تأثير الأحماض على المركبات المعدنية مع السيليكون ، سيلاني سيه 4.
Cilan - إنه غاز عديم اللون يشعل نفسه بنفسه. يمكن أن تشتعل في الهواء لتشكيل السيليكا والماء.
SiH 4 + 2O 2\u003e → SiO 2 + 2H 2 O
إذا تم تسخين أكسيد السيليكون SiO 2 في وجود الكربون في تيار الكلور ، يحدث تفاعل كيميائي مع تكوين كلوريد السيليكون
SiO 2 + 2C + 2 Cl 2 → SiCl 4 + 2CO
كلوريد السيليكون - سائل ، درجة حرارة غليانه لا تزيد عن 54 درجة مئوية. يذوب كلوريد السيليكون بسهولة في الماء بتكوين محلول من اثنين من الأحماض: سيليك وهيدروكلوريك
SiCl 4 + H 2 O → H 2 SiO 3 + HCl
إذا استمر هذا التفاعل الكيميائي في جو من الهواء الرطب ، سيظهر دخان كثيف أثناء تكوين اثنين من الأحماض.
فلوريد السيليكون SiF 4 - تشكلت نتيجة للتفاعل الكيميائي لحمض الهيدروفلوريك وأكسيد السيليكون
SiO 2 + 4HF → SiF 4 + 2H 2 O
فلوريد السيليكون هو غاز عديم اللون ذو رائحة "قوية". بالإضافة إلى كلوريد السيليكون ، يشكل هذا الغاز في الماء اثنين من الأحماض: السيليكون والهيدروفلوريك. ولكن المثير للاهتمام ، يمكن أن تتفاعل فلوريد السيليكون مع حمض الهيدروفلوريك لتشكيل حمض سداسي فلورو سليك الذي الصيغة الكيميائية H 2 SiF 6. أملاحها والحامض نفسها سامة.
السيليكون
المعادن الأساسية وغير المعدنية
في هذا الدرس سوف تدرس موضوع "السيليكون". النظر في معلومات حول السيليكون: هيكلها الإلكتروني ، حيث السيليكون في الطبيعة ، ودراسة خواص السيليكون ، وشرح المادية وال الخواص الكيميائية. تعلم أين يتم استخدام السيليكون في الصناعة وغيرها من المناطق ، وكيف يتم إنتاجه. سوف تتعرف على السيليكا وحمض السيليك وأملاحه - السيليكات.
الموضوع: المعادن الأساسية وغير المعدنية
الدرس: السيليكون. الغازات النبيلة
يعتبر السيليكون أحد العناصر الكيميائية الأكثر شيوعًا في قشرة الأرض. محتواه هو ما يقرب من 30 ٪. في الطبيعة ، يوجد بشكل أساسي في أشكال مختلفة من السيليكا ، السيليكات والألمنيوم.
السيليكون رباعي التكافؤ في جميع مركباته تقريبًا. في هذه الحالة ، تكون ذرات السيليكون في حالة الإثارة. التين. 1.
للدخول إلى هذه الحالة ، يحتل أحد إلكترونات 3s مكانًا شاغرًا في المدارات 3p. في هذه الحالة ، ستحتوي ذرة السيليكون في الحالة المثارة على 4 إلكترونات غير زوجية ، بدلاً من إلكترونين غير زوجي في الحالة الأرضية. سيكون قادرًا على تكوين 4 سندات تساهمية بواسطة آلية التبادل.


ذرات السيليكون ليست عرضة لتشكيل روابط متعددة ، ولكنها تشكل مركبات ذات روابط مفردة- Si-O-. السيليكون ، على عكس الكربون ، ليس نموذجيًا للتجانس.
واحد من التعديلات allotropic هي السيليكون البلوريفيها كل ذرة من السيليكون في sp 3 تهجين. التين. 2 ، 3. السيليكون البلوري هو مادة بلورية صلبة ، مقاومة للحرارة ودائم من الرمادي الداكن مع بريق معدني. في ظل الظروف العادية - أشباه الموصلات. في بعض الأحيان ، ينبعث السليكون غير المتبلور أيضًا كتعديل آخر متآثر للسيليكون. إنه مسحوق بني داكن ، أكثر نشاطًا كيميائيًا من السيليكون البلوري. سواء كان تعديل allotropic هو نقطة خلافية.
الخواص الكيميائية للسيليكون
1. التفاعل مع الهالوجينات
Si + 2F 2 → SiF 4
2. عند تسخينه ، يحترق السيليكون في الأكسجين ، يتشكل السيليكا (IV).
Si + O 2 → SiO 2
3. في درجات الحرارة العالية ، يتفاعل السيليكون مع النيتروجين أو الكربون.
3Si + 2N 2 → Si 3 N 4
4. لا يتفاعل السيليكون مع المحاليل المائية للأحماض. لكنه يذوب في القلويات.
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2
5. عندما يتم دمج السيليكون مع المعادن ، تتشكل المبيدات الحشرية.
Si + 2Mg → Mg 2 Si
6. لا يتفاعل السيليكون مباشرة مع الهيدروجين ، لكن يمكن الحصول على مركبات الهيدروجين من السيليكون عن طريق تفاعل المبيدات الحشرية مع الماء.
Mg 2 Si + 4H 2 O → 2Mg (OH) 2 + SiH 4 (silane)
تتشابه السيلانات في تركيبها مع الألكانات ، ولكنها تتفاعل بشكل كبير. الأكثر استقرارا monosilane قابلة للاشتعال في الهواء.
SiH 4 + 2 O 2 → SiO 2 + 2H 2 O
الحصول على السيليكون
يتم الحصول على السيليكون عن طريق الحد من أكسيد السيليكون (IV)
SiO 2 + 2Mg → Si + 2MgO
واحدة من المهام هي الحصول على السيليكون عالية النقاء. لهذا يتم نقل السيليكون التقني لرابع كلوريد السيليكون. يتم تقليل رباعي كلوريد الناتج إلى سيلان ، ويتحلل سيلان عن طريق التسخين إلى السيليكون والهيدروجين.
السيليكون قادر على تكوين أكاسيد اثنين: SiO 2 - أكسيد السيليكون (IV) و SiO - أكسيد السيليكون (II).
سيO - أكسيد السيليكون (II) - هذه مادة بنية داكنة غير متبلورة ، تتشكل بتفاعل السيليكون مع أكسيد السيليكون (IV)
سي + شافي 2 → 2 شافي.
على الرغم من ثباتها ، فإن هذه المادة لا تُستخدم أبدًا.
سيO 2 - أكسيد السيليكون (IV)


هذه المادة تمثل 12 ٪ من قشرة الأرض. التين. 4. ويمثلها المعادن مثل الكريستال الصخري ، الكوارتز ، الجمشت ، السترين ، يشب ، العقيق. التين. 5.
SiO 2 - أكسيد السيليكون (IV) - مادة التركيب غير الجزيئي.
شعرية الكريستال لها ذرية. التين. 6. بلورات SiO 2 لها شكل رباعي الاسطح ، والتي ترتبط ببعضها بواسطة ذرات الأكسجين. تكون صيغة جزيء (SiO 2) n أكثر صحة. نظرًا لأن SiO 2 يشكل مادة التركيب الذري ، ويشكل ثاني أكسيد الكربون بنية جزيئية ، فإن الاختلاف في خصائصه واضح. ثاني أكسيد الكربون هو غاز ، و SiO 2 عبارة عن مادة بلورية شفافة صلبة وغير قابلة للذوبان في الماء والحراريات.
الخواص الكيميائيةسيحوالي 2
1. أكسيد السيليكون (IV) SiO 2 هو أكسيد حمض. لا يتفاعل مع الماء. لا يمكن الحصول على حمض السيليك بواسطة ترطيب SiO2 ، ويمكن الحصول على أملاحه ، السيليكات ، من خلال تفاعل SiO2 بمحلول قلوي ساخن.
SiO 2 + 2NaOH Na 2 SiO 3 + H 2 O
2. يتفاعل مع كربونات المعادن القلوية والأرضية القلوية.
CaCO 3 + SiO 2 CaSiO 3 + CO 2
3. يتفاعل مع المعادن.
SiO 2 + 2Mg → Si + 2MgO
4. رد فعل مع حمض الهيدروفلوريك.
SiO 2 + 4HF → SiF 4 + 2H 2 O
SiF 4 + 2HF → H 2
الخواص الكيميائية للحمض السيليكى والسيليكات
الحصول على حمض السيليك
حمض السيليك يترسب كمركب بوليمري. حمض السيليك الصيغ -
H 2 SiO 3 (شكل ميتا) و H 4 SiO 4 (شكل أورثو) - تعكس نسبة العناصر ، ولكن ليس التكوين الحقيقي. تقليديا ، على متن الطائرة ، يتم وصف تكوين حمض السيليك كما في الشكل. 7.
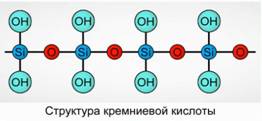
بالنسبة لحمض السيليك ، تستخدم الصيغة H 2 SiO 3 دائمًا.
1. H 2 شافي 3 تتحلل عند تسخينها
H 2 SiO 3 H 2 O + SiO 2 (هلام السيليكا)
2. يتفاعل مع المحاليل القلوية
H 2 SiO 3 + 2NaOH Na 2 SiO 3 + 2H 2 O
أملاح حمض السيليك - السيليكات - تشير إلى المركبات الأيونية. هذه هي المواد عديم اللون الصلبة. السيليكات المعدنية القلوية فقط ، باستثناء الليثيوم ، قابلة للذوبان في الماء.
1. يتم تحلل السيليكات الذائبة بواسطة الأنيون
Na 2 SiO 3 + H 2 O ⇆ NaHSio 3 + NaOH
2. تتفاعل السيليكات الذائبة مع الأحماض القوية.
Na 2 SiO 3 + 2HCl → H 2 SiO 3 ↓ + 2NaCl
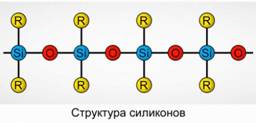
Polyorganosiloxanes (السيليكات)
Polyorganosiloxanes (سيليكونات) هي مركبات عضوي سيلكون عضوي ذات وزن جزيئي مرتفع.
R 2 [ شافي] ن
R عبارة عن مجموعة عضوية (ميثيل أو إيثيل أو فينيل). أساس بنية السيلوكسان هو سلسلة من ذرات السيليكون والأكسجين بالتناوب. الرقم 8. عن طريق تغيير طول السلسلة والمجموعات العضوية ، يمكن الحصول على السيليكونات ذات الخصائص المختلفة. عن طريق تغيير شروط البلمرة ، يمكنك الحصول على جزيئات بأطوال مختلفة.


البوليمرات ذات السلسلة القصيرة عبارة عن سوائل ، والأطول منها هي مواد تشحيم قيمة. التين. 9 ، والتي تحتفظ بخصائصها في درجة حرارة ضخمة تتراوح من
من 100 درجة مئوية إلى + 300 درجة مئوية ، تشكل الجزيئات الأطول من المطاط لا تفقد مرونتها في درجات الحرارة المنخفضة. فهي شديدة المقاومة للتآكل ، خاملة كيميائيا. التين. 10. أنه يسبب المتغيرات المختلفة لتطبيقها. يمكن استخدامها لإنشاء آلات اصطناعية للقلب أو الكلى ، ويمكن استخدامها كحذاء للأحذية. تستخدم بوليمرات السيلوكسان في الطب لإنشاء العديد من غرسات الأنسجة الرخوة ، لأن هذه البوليمرات خاملة كيميائيا ولا يرفضها الجسم. لا يتم ترطيبها بالماء. يتم استخدامه في الكريمات. عند وضع هذا الكريم على يديه ، سوف يحل محل القفازات المطاطية.
حديقة غير عضوية
في دورق شفاف مليء بسيليكات الصوديوم ، قم بغمس بلورات الأملاح الملونة ، على سبيل المثال كبريتات النحاس. بعد مرور بعض الوقت ، يمكن ملاحظة أن أنابيب مجوفة رقيقة تتشكل من البلورات ، والتي تتكون من سيليكات غير قابلة للذوبان. التين. 11.

الحصول على المعجون "غبي"
يتم خلط كميات متساوية من سيليكات الصوديوم والكحول الطبي. ترشح المادة المترسبة وتُسحب للخارج حتى لا تُقطر الكحول. هذا هو المعجون. التين. 12. تم تسمية ذلك لأنه تم التخطيط لاستخدامه كمعجون للنوافذ. لكن اتضح أن لديها خصائص لا يمكن استخدامها للغرض المقصود منها. إذا قمت بتمرير الكرة ورميها على الأرض ، فسوف ترتد مثل كرة مطاطية. إذا وضعت على الطاولة ، فسوف ينتشر مثل السائل. إذا ضربت جسمًا صلبًا ، فسوف تتحطم كجسم صلب. بعد فترة من الوقت ، عندما يجف الكحول ، سوف تنهار هذه المعجون.
![]()
تلخيص الدرس
في هذا الدرس ، درست موضوع "السيليكون". نظرنا في معلومات حول السيليكون: هيكلها الإلكتروني ، حيث يوجد السيليكون في الطبيعة ، درسنا خواص السيليكون ، وشرح خواصه الفيزيائية والكيميائية. لقد تعلموا أين يستخدم السيليكون في الصناعة وغيرها من المجالات ، وكيف يتم إنتاجه. لقد قابلت السيليكا وحمض السيليك وأملاحه - السيليكات.
مراجع
1. رودزيت جي الكيمياء. أساسيات الكيمياء العامة. الصف 11: كتاب مدرسي للمؤسسات التعليمية: المستوى الأساسي / هـ. رودزيتيس ، ف. فيلدمان. - الطبعة 14 - م: التنوير ، 2012.
2. Popel P.P. الكيمياء: 8 ق .: كتاب مدرسي للمدارس الثانوية / PP. بوبيل ، الولايات المتحدة الأمريكية - К.: ИЦ "أكاديمية" ، 2008. - 240 صفحة: Ill.
3. غابرييليان أوس. الكيمياء. الصف 11th. المستوى الأساسي. 2nd ed.، Sr. - م: دروفا ، 2007. - 220 صفحة.
الواجب المنزلي
1. -42-4 (ص 138) Rudzitis G.E. الكيمياء. أساسيات الكيمياء العامة. الصف 11: كتاب مدرسي للمؤسسات التعليمية: المستوى الأساسي / هـ. رودزيتيس ، ف. فيلدمان. - الطبعة 14 - م: التنوير ، 2012.
2. ما هي تطبيقات polyorganosiloxanes.
3. قارن خصائص التعديلات متآثر من السيليكون.
